一种基于催化酶激活的靶向交联剂在蛋白分析中的应用
1.本发明涉及一种可在靶向区域内进行可控的化学交联反应,从而实现细胞原位下,快速高效地引发交联反应,进而对目标区域实现高时空分辨的蛋白质相互作用分析。
背景技术:
2.蛋白质通过相互作用形成复合物发挥其功能,调控着各项生命过程。精准地表征蛋白质复合物在细胞原位的时空动态变化对于阐释其功能,理解生命现象本质以及揭示重大疾病的发生发展机制具有重要意义1。
3.然而,传统的的x射线晶体衍射、冷冻电镜、核磁共振、免疫沉淀-质谱等技术,主要分析体外纯化的蛋白质复合物结构,或细胞裂解液水平的蛋白质相互作用,无法实现蛋白质复合物的细胞内原位解析2。脱离了细胞的原位环境,不仅蛋白质之间真实的相互作用难以表征,并且弱/瞬间的相互作用极易被破环,蛋白质复合物在空间维度上的定位信息也完全丧失。
4.化学交联质谱解析技术以能够提供蛋白质相互作用的界面和位点信息、分析通量高、灵敏度高等优点,近年来已成功用于纯化体系及细胞裂解液中蛋白质复合物的规模化解析,并在细胞原位的复合物动态分析中表现出极大的先进性3。然而,蛋白质在细胞中普遍存在多个亚细胞器共定位的特点,并且在不同的亚细胞器中通过调控特定的相互作用网络发挥着不同的功能。但是,由于化学交联反应缺乏空间靶向性,且反应可控性差,无法仅在特定亚细胞器中发生原位交联,故无法表征蛋白质复合物在空间维度上的动态组装。
5.本发明通过对催化酶激活的新型靶向交联剂的研发和应用,实现交联剂仅在特定亚细胞器中发生化学交联反应,建立基于亚细胞器靶向交联的蛋白质复合物原位分析方法,实现亚细胞器中时空分辨的蛋白质相互作用动态变化精准解析。
6.参考文献:
7.1.thul,p.j.;akesson,l.;wiking,m.;mahdessian,d.;geladaki,a.;ait blal,h.;alm,t.;asplund,a.;bjork,l.;breckels,l.m.;backstrom,a.;danielsson,f.;fagerberg,l.;fall,j.;gatto,l.;gnann,c.;hober,s.;hjelmare,m.;johansson,f.;lee,s.;lindskog,c.;mulder,j.;mulvey,c.m.;nilsson,p.;oksvold,p.;rockberg,j.;schutten,r.;schwenk,j.m.;sivertsson,a.;sjostedt,e.;skogs,m.;stadler,c.;sullivan,d.p.;tegel,h.;winsnes,c.;zhang,c.;zwahlen,m.;mardinoglu,a.;ponten,f.;vonfeilitzen,k.;lilley,k.s.;uhlen,m.;lundberg,e.,a subcellular map of the human proteome.science 2017,356,3321-3332.
8.2.yang,t.-j.;chang,y.-c.;ko,t.-p.;draczkowski,p.;chien,y.-c.;chang,y.-c.;wu,k.-p.;khoo,k.-h.;chang,h.-w.;hsu,s.-t.d.,cryo-em analysis of a feline coronavirus spike protein reveals a uniquestructure and camouflaging glycans.proc.natl.acad.sci.2020,117,1438-1446.
9.3.d.;m.;z.;chmel
í
k,j.;man,p.;nov
á
k,p.,
impact of chemical cross-linking on protein structure and function.anal.chem.2018,90,1104-1113.
技术实现要素:
10.为了克服常规化学交联方法反应可控性差,反应速率低,无法进行特定区域原位交联等问题,本发明提供一种使用靶向化学交联剂,在区域内酶催化条件下,实现空间区域的原位交联反应,随后采用点击化学反应将交联蛋白接枝上富集基团,选择性富集交联肽段并高效释放从而对该靶向区域的蛋白质相互作用提供信息。该方法具有细胞原位,快速,反应可控的优点,可应用于区域或目标蛋白质复合体的分析。
11.为实现上述目的,本发明采用的技术方案为:
12.(1)靶向交联剂的合成:合成一端为过氧化物酶可催化的苯酚集团,一端为光反应基团的靶向交联试剂,作为连接臂的烷基链上含有可富集基团;
13.(2)细胞培养:选择线粒体表达或高尔基体表达等亚细胞器区域或目标蛋白质融合表达辣根过氧化物酶的细胞、真菌或细菌培养至80%-90%密度;
14.(3)交联剂溶液的配制:使用水、缓冲液或乙腈、有机醇类、有机酸类、dmf或dmso中的一种或二种以上的有机溶剂配制成浓度为1μm-1m的交联剂溶液
15.(4)标记溶液的配制:将交联剂母液用细胞培养液dmem或mem或r1640等中的一种稀释,加入细胞中,孵育30min;
16.(5)加入终浓度为1mm的过氧化氢溶液,混匀,静置1min;
17.(6)配制含10mm抗坏血酸钠,5mm trolox,10mm叠氮化钠的缓冲盐溶液为淬灭溶液,加入细胞中,静置2min;重复一次;
18.(7)使用ph为7.1-10的碳酸氢铵缓冲盐溶液、磷酸缓冲盐溶液、4-羟乙基哌嗪乙磺酸缓冲盐溶液或三羟甲基氨基甲烷缓冲盐溶液中的一种或二种以上,且不含与所用交联剂上反应基团反应的基团的缓冲液冲洗去除淬灭溶液;
19.(8)加入缓冲盐溶液,将细胞置于紫外光下照射30s-10min;
20.(9)刮下或用胰酶消化下细胞,用超声辅助或液氮冻融破碎细胞;所述的反应条件为15-40℃反应10min-2h或0-10℃反应10min-10h;
21.(10)向蛋白样品中加入分体式富集试剂,摩尔量为2-10倍于交联剂摩尔量,催化剂为cuso4与thpta或bttaa孵育5min以上与抗环血酸钠孵育2min以上的混合溶液,25-60℃反应10min-2h;
22.(11)多余小分子试剂的去除:向样品中加入四倍体积的预冷丙酮或八倍体积的预冷甲醇混匀,负二十度沉淀蛋白4-24h;离心,加入预冷的丙酮或甲醇清洗沉淀1-3次,挥干;
23.(12)蛋白质样品的溶解、变性及还原:采用ph为1-6.5的甲酸、三氟乙酸、三氯乙酸或醋酸等酸性缓冲溶液或ph为7.5-14的碱性缓冲溶液配制的溶有表面活性剂或有机溶剂的溶解液来溶解蛋白质样品,加入dtt、tcep或β-巯基乙醇等还原剂中的一种或二种以上,在40-100℃水浴下孵育1min-10h,同时进行蛋白质样品的变性及还原;
24.(13)蛋白质样品的烷基化及酶解:加入碘代乙酸或碘乙酰胺中的一种或二种对蛋白质样品进行烷基化反应后,向蛋白质样品中加入胰蛋白酶、蛋白酶k、胃蛋白酶、弹性蛋白酶、羧肽酶、胰凝乳蛋白酶、胞内蛋白酶lys-c/n、蛋白内切酶glu-c/n、asp-c/n中的一种或
二种以上,使用二种以上时,同时使用或顺序使用;
25.(14)向步骤(12)的产物中加入带有单体为链霉亲和素、亲和素等中的一种或二种以上的琼脂糖凝胶球、硅球、聚合物球等有机/无机材料制备的富集材料,并与样品反应;
26.(15)使用高浓度盐溶液如1m氯化钾溶液或表面活性剂如wt 2%sds等清稀溶液洗去富集材料上非特异性吸附的肽段;
27.(16)使用具有切割连接臂上断裂基团能力的如连二亚硫酸钠溶液还原重氮键将富集材料上键合的肽段释放出来,除盐,冻干并重溶进行质谱分析和数据检索;
28.(17)将上述样品预处理方法用于细菌、真菌或人源细胞样品中线粒体等亚细胞区域或目标蛋白质区域的蛋白质相互作用网络的鉴定;
29.本发明具有以下优点:
30.1、反应快速;两端反应时间均在2min以内,相较于传统交联反应时间大大缩短,对于弱相互作用及易解离的相互作用具有重要意义
31.2、反应可控;通过选择靶向区域或目标蛋白质过氧化物酶融合的细胞,应用靶向交联剂,实现对于目标区域的选择性标记后引发另一端的光反应
32.3、反应原位;交联反应均在细胞原位进行,区别于传统将蛋白提取为裂解液,保持了蛋白在生理状态下的状态及相互作用情况。
附图说明
33.图1为靶向交联剂adp的结构。
34.图2为荧光图谱。
具体实施方式
35.可靶向交联剂alkyne-diazirine-phenol(adp)的合成:
36.将4-戊炔酸(9.8g,100mmol)溶于四氢呋喃(200ml)中,然后向反应体系加入丙二酸单甲酯钾盐(17.2g,110mmol),加入完毕,在室温搅拌2小时;然后依次加入mgc12(9.5g,100mmol)and cdi(17.0g,105mmol)。最终的反应液升温至60℃反应3小时。待体系冷却至室温,过滤上述反应体系,滤液经过减压蒸馏,上述所得的粗品经过柱层析分离得到目标产物8.6g,性状为黄色油状物,收率:56%。
[0037][0038]
将化合物1(8.5g,55.1mmol)溶于甲苯(200ml)中,然后向反应体系加入乙二醇(17.1g,275.5mmol)和对甲苯磺酸(1.0g,5.5mmol),加入完毕,在带有分水器的反应器上升温至120℃,反应6小时。待体系冷却至室温,向反应体系加入水,用乙酸乙酯(200ml)萃取,然后用饱和食盐水洗涤有机相(100mlx2),再用无水硫酸钠干燥。过滤无水硫酸钠,滤液经过减压蒸馏得到目标产物8.2g,性状为黄色油状物,收率:75%。
[0039][0040]
将化合物2(8.0g,40.4mmol)溶于四氢呋喃(100ml)中,控温0℃,在搅拌状态下,一次性加入四氢铝锂(1.5g,40.4mmol),加入完毕,上述反应体系在室温反应2小时。待反应完毕,依次向反应体系加入水(1.5ml),15%氢氧化钠(4.5g)and水(1.5ml)淬灭反应。过滤淬灭过程产生的固体。滤液经过减压蒸馏得到目标产物6.9g,收率:100%。
[0041][0042]
将化合物3(6.5g,38.2mmol)溶于丙酮(100ml)中,然后加入对甲苯磺酸(1.5g,7.6mmol),加入完毕,上述反应体系在室温反应4小时。待反应完毕,滤液经过减压蒸馏,上述所得的粗品经过柱层析分离得到目标产物4.3g,性状为透明油状物,收率:90%。lcms[m+h]+=127.2.
[0043][0044]
将液氨(30ml)置于干冰-丙酮浴中降温,然后向反应体系加入化合物4(3.8g,30mmol),加入完毕,上述反应体系在干冰-丙酮浴中反应5小时。保持上述温度,向反应体系慢慢滴加羟胺磺酸/甲醇溶液(羟胺磺酸(3.4g,35mmol)溶于10ml无水甲醇中),滴加时间不少于30分钟。滴加完毕,撤出干冰-丙酮浴,反应在35℃继续反应1小时。将上述反应体系放置过夜,待反应体系残留氨气挥发出去。
[0045]
过滤上述反应体系析出的固体,滤饼用甲醇淋洗。合并所有滤液,通过减压蒸馏浓缩干,浓缩干的粗品溶于二氯甲烷(20ml)中,然后加入三乙胺(5.3ml)。在搅拌状态下,向上述体系慢慢滴加碘/二氯甲烷溶液(碘单质(5.5g,43.2mmol)溶于二氯甲烷(15ml)中)直到反应体系呈棕黄色为止。反应液经过减压蒸馏,上述所得的粗品经过柱层析分离得到目标产物2.3g,收率:55%。lcms[m+h]+=139.2.
[0046][0047]
将咪唑(3.1g,45.6mmol)和三苯基磷(4.4g,16.7mmol)溶于二氯甲烷(100ml)中,控温0℃,在搅拌状态下,加入i2(4.6g,18.24mmol),加入完毕,上述反应体系继续搅拌10分钟。然后将化合物5的二氯甲烷溶液(化合物5(2.1g,15.2mmol)溶于dcm(20ml))慢慢滴加到反应体系中,滴加完毕,上述反应体系继续反应4小时。然后向上述反应体系加入饱和na2s2o3溶液(50ml)淬灭反应。分离上述反应体系有机相,水相用乙酸乙酯萃取(2
×
50ml)。合并有机相,有机相用无水硫酸钠干燥,有机相经过减压蒸馏,上述所得的粗品经过柱层析分离得到目标产物3.2g,性状为透明油状物,收率:85%。lcms[m+h]+=249.1.
[0048][0049]
将3-(3-炔-1-丁基)-3-(2-碘乙基)-3h-双吖丙啶(化合物6)(3.0g,12mmol)溶于n,n-二甲基甲酰胺(30ml)中,然后加入氰化钠(1.2g,24mmol),加入完毕,上述反应体系升温至70℃搅拌过夜。待反应体系冷却至室温,将上述反应液倒入水中,用乙酸乙酯(100ml)萃取,有机相用饱和食盐水洗涤(50mlx3),有机相用无水硫酸钠干燥,有机相经过减压蒸馏,上述所得的粗品经过柱层析分离得到目标产物1.4g,性状为透明油状物,收率:82%。lcms[m+h]+=148.2.
[0050][0051]
将化合物7(1.3g,8.8mmol)溶于10%的氢氧化钠溶液(20ml)中,加入完毕,上述反应体系在回流状态下反应8小时。待反应体系冷却至室温,控温0℃用2m的盐酸溶液调节ph至5左右。然后用乙酸乙酯(20mlx3)萃取,合并有机相,有机相用无水硫酸钠干燥,有机相经过减压蒸馏得到目标产物1.1g,性状为透明油状物,收率:75%。lcms[m+h]+=167.2.
[0052][0053]
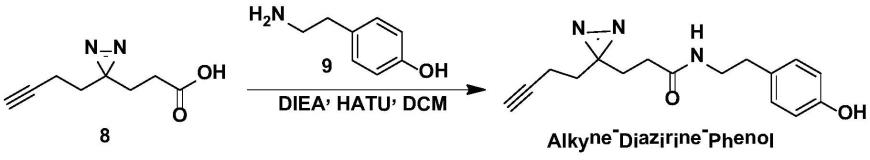
将化合物8(600mg,3.6mmol)和化合物9(590mg,4.3mmol)溶于二氯甲烷(20ml)中,在室温下向反应体系依次加入diea(697mg,5.4mmol)和hatu(1.52g,4.0mmol)。加入完毕,上述反应体系在常温下反应2小时。反应完毕,浓缩有机相,上述所得的粗品经过柱层析分离得到目标产物680mg,性状为白色固体,收率:66%。lcms[m+h]+=148.2.
[0054][0055]
实施例1
[0056]
1.交联反应
[0057]
选择以c10烷基链为骨架,一端为苯酚集团,一端为双吖基团,烷基链中间为炔基富集基团的交联剂,命名为alkyne-diazirine-phenol(adp);选择线粒体表达辣根过氧化物酶的人源细胞系293t细胞培养至80%-90%密度;用dmso配制adp(母液浓度为2m;用dmem培养液将adp稀释为2mm,6ml加入至10cm培养皿的细胞中,孵育30min。
[0058]
按与细胞培养液体积比100:1加入100mm的过氧化氢溶液,混匀,静置1min;
[0059]
配制含10mm抗坏血酸钠,5mm trolox,10mm叠氮化钠的磷酸盐缓冲盐溶液为淬灭溶液,6ml加入至10cm培养皿细胞中,静置2min;重复一次;
[0060]
弃去淬灭溶液,加入6ml磷酸缓冲盐溶液,将细胞置于紫外光下照射30s-10min;
[0061]
3.蛋白提取
[0062]
加入1ml wt 1%sds的pbs溶液,超声提取蛋白
[0063]
4.点击化学反应
[0064]
向样品中加入20mm cuso4、160mm三(3-羟丙基三氮基甲基)胺以及500mm vc使其终浓度分别为100μm、800μm和2.5mm,加入20mm、至终浓度为200μm的diazo biotin-azide(sigma-aldrich,900891),60℃反应2h。
[0065]
5.蛋白沉淀
[0066]
向样品中加入反应体系四倍体积预冷的丙酮,-20℃沉淀过夜;离心用预冷丙酮清洗沉淀2次,挥干丙酮。
[0067]
6.向挥干后的交联样品加入尿素及1,4-二硫苏糖醇(dtt),使溶液中尿素终浓度为8m,dtt终浓度为10mm,37℃水浴反应30min。
[0068]
7.蛋白溶液的烷基化及酶解
[0069]
向步骤6中的溶液中加入碘代乙酸(iaa),并使其终浓度为20mm,避光反应30min。烷基化反应结束后,将样品溶液用50mm碳酸氢铵溶液稀释至原样品溶液体积8倍,并加入1μg丝氨酸蛋白酶lys-c,37℃水浴反应4h。反应结束后,向样品溶液中加入2μg胰蛋白酶,37℃水浴反应过夜。
[0070]
8.交联肽段的富集
[0071]
使用50mm碳酸氢铵溶液将200ul键合有链霉亲和素的琼脂糖凝胶球(ge healthcare,17-5113-01)清洗三遍,加入肽段样品中,直至上清完全无色,即修饰上diazo biotin-azide的肽段全部结合在琼脂糖球上。
[0072]
9.非特异性吸附肽段的去除
[0073]
使用h2o、1m kcl溶液、10%乙腈溶液以及h2o各清洗三次洗去琼脂糖凝胶球上的非特异性吸附的肽段。
[0074]
10.肽段的释放
[0075]
加入200ul洗脱液300mm na2s2o4(内含6m尿素,2m硫脲,20mm4-羟乙基哌嗪乙磺酸),37℃反应30min。
[0076]
11.交联肽段的鉴定
[0077]
将释放得到的交联肽段进行除盐冻干后,重溶于体积浓度0.1%甲酸溶液,进入质谱分析。
[0078]
鉴定结果如图2所示;
[0079]
在细胞靶向原位交联后,进行荧光表征表征交联剂信号,红色为细胞线粒体信号,绿色为靶向交联剂信号,两个信号完全重合,证明交联剂完全靶向至线粒体。
[0080]
在交联肽段的鉴定结果中,鉴定到了50对交联肽段,涉及到258个蛋白的交联位点,均为线粒体蛋白的相互作用。
[0081]
实施例2
[0082]
1.交联反应
[0083]
选择内质网表达辣根过氧化物酶的人源293t细胞系培养至80%-90%密度;用dmso配制adp母液浓度为2m;用dmem培养液将adp稀释为2mm,6ml加入至10cm培养皿的细胞中,孵育30min。
[0084]
按与细胞培养液体积比100:1加入100mm的过氧化氢溶液,混匀,静置1min;
[0085]
配制含10mm抗坏血酸钠,5mm trolox,10mm叠氮化钠的缓冲盐溶液为淬灭溶液,6ml加入至10cm培养皿细胞中,静置2min;重复一次;
[0086]
弃去淬灭溶液,加入6ml磷酸缓冲盐溶液,将细胞置于紫外光下照射30s-10min;
[0087]
2.蛋白提取
[0088]
加入1ml wt 1%sds的pbs溶液,超声提取蛋白
[0089]
3.点击化学反应
[0090]
向样品中加入20mm cuso4、160mm三(3-羟丙基三氮基甲基)胺以及500mm vc使其终浓度分别为100μm、800μm和2.5mm,加入20mm,终浓度为200μm的uv-cleavable biotin azide(kerafast,uv102),60℃反应2h。
[0091]
4.蛋白沉淀
[0092]
向样品中加入反应体系四倍体积预冷的丙酮,-20℃沉淀过夜;离心用预冷丙酮清洗沉淀2次,挥干丙酮。
[0093]
5.向挥干后的交联样品加入尿素及1,4-二硫苏糖醇(dtt),使溶液中尿素终浓度为8m,dtt终浓度为10mm,37℃水浴反应30min。
[0094]
6.蛋白溶液的烷基化及酶解
[0095]
向步骤6中的溶液中加入碘代乙酸(iaa),并使其终浓度为20mm,避光反应30min。烷基化反应结束后,将样品溶液用50mm碳酸氢铵溶液稀释8倍,并加入1μg丝氨酸蛋白酶lys-c,37℃水浴反应4h。反应结束后,向样品溶液中加入2μg胰蛋白酶,37℃水浴反应过夜。
[0096]
7.交联肽段的富集
[0097]
使用50mm碳酸氢铵溶液将200ul键合有链霉亲和素的琼脂糖凝胶球(ge healthcare,17-5113-01)清洗三遍,加入肽段样品中,即修饰上uv-cleavable biotin azide的肽段全部结合在琼脂糖球上。
[0098]
8.非特异性吸附肽段的去除
[0099]
使用h2o、1m kcl溶液、10%乙腈溶液以及h2o各清洗三次洗去琼脂糖凝胶球上的非特异性吸附的肽段。
[0100]
9.肽段的释放
[0101]
加入600ul50mm碳酸氢铵溶液,置于磁力搅拌器上,365nm紫外照射2h。
[0102]
10.交联肽段的鉴定
[0103]
将释放得到的交联肽段进行除盐冻干后,重溶于0.1%甲酸溶液,进入质谱分析。
[0104]
鉴定结果
[0105]
在交联肽段的鉴定结果中,鉴定到了112对交联肽段,涉及到535个蛋白的交联位点,均为内质网蛋白的相互作用。
[0106]
实施例3:
[0107]
1.交联反应
[0108]
选择egfr为目标蛋白表达辣根过氧化物酶的人源细胞系293t细胞培养至80%-90%密度后进行adp交联剂靶向标记及紫外光照交联反应的引发
[0109]
2.蛋白提取
[0110]
加入1ml ripa裂解液,超声提取蛋白
[0111]
4.点击化学反应
[0112]
向样品中加入20mm cuso4、160mm thpta以及500mm vc使其终浓度分别为100μm、800μm和2.5mm,加入20mm,终浓度为200μm的uv-cleavable biotin azide(kerafast,uv102),60℃反应2h。
[0113]
5.蛋白沉淀
[0114]
向样品中加入四倍反应体积体积预冷的丙酮,-20℃沉淀过夜;离心用预冷丙酮清洗沉淀2次,挥干丙酮。
[0115]
6.向挥干后的交联样品加入尿素及dtt,使溶液中尿素终浓度为8m,dtt终浓度为10mm,37℃水浴反应30min。
[0116]
7.蛋白溶液的烷基化及酶解
[0117]
向步骤6中的蛋白溶液溶液中加入tcep,并使其终浓度为10mm,避光反应30min。烷基化反应结束后,将样品溶液用50mm碳酸氢铵溶液稀释8倍,并加入1μg丝氨酸蛋白酶lys-c,37℃水浴反应4h。反应结束后,向样品溶液中加入2μg胰蛋白酶,37℃水浴反应过夜。
[0118]
8.交联肽段的富集
[0119]
使用50mm碳酸氢铵溶液将200ul键合有链霉亲和素的琼脂糖凝胶球清洗三遍,加入肽段样品中,即修饰上uv-cleavable biotin azide的肽段全部结合在琼脂糖球上。
[0120]
9.非特异性吸附肽段的去除
[0121]
使用h2o、1m kcl溶液、10%乙腈溶液以及h2o各清洗三次洗去琼脂糖凝胶球上的非特异性吸附的肽段。
[0122]
10.肽段的释放
[0123]
加入600ul 50mm碳酸氢铵溶液,置于磁力搅拌器上,365nm紫外照射2h。
[0124]
11.交联肽段的鉴定
[0125]
将释放得到的交联肽段进行除盐冻干后,重溶于0.1%甲酸溶液,进入质谱分析。
[0126]
鉴定结果
[0127]
在交联肽段的鉴定结果中,鉴定到了56对交联肽段,涉及到egfr蛋白与三类蛋白的结合,涉及两种egfr已知的相关信号通路。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1