本发明属于生物物理和生物化学技术领域,尤其涉及一种检测膜融合蛋白在脂质体中定位的核磁共振方法。
背景技术:
细胞膜融合是生物体常见的生理现象,广泛存在于各种生命系统中。通过细胞膜融合,两套独立的双层脂分子合二为一,完成一定的生物功能。例如:成肌细胞的融合产生骨骼肌、破骨细胞的融合产生骨以及滋养细胞的融合产生胎盘;在先天免疫应答中,巨噬细胞融合形成多核巨细胞,吞噬并摧毁病原体。异常的细胞膜融合则与人类的疾病密切相关。膜融合通常不会自发发生,需要在膜融合蛋白的诱导下实现细胞膜的融合,有些膜融合过程通过同一蛋白完成,如:病毒侵染时的融合1,而某些膜融合过程则需要多个蛋白形成复合物驱动,如:snare复合物驱动的膜融合2,3等。因此,探索不同膜融合蛋白的机理和融合反应的分子机制,有助于对生命现象本质的深入了解。膜融合的机理非常复杂,为了描述这一过程,需要对膜融合蛋白的结构、蛋白与膜间的相互作用、以及膜融合蛋白在细胞膜上的拓扑结构进行详细的表征。研究蛋白结构的技术主要包含x-ray晶体衍射技术、冷冻电镜技术、液体核磁共振技术和固体核磁共振技术四种。在膜融合蛋白-脂质体复合物中,由于脂质体的存在,限制了x-ray晶体衍射技术和冷冻电镜技术的应用;由于脂质体体积较大,液体核磁共振技术则受到了分辨率的限制。
固体核磁共振技术可以研究多种形态的样品,广泛地应用于膜蛋白的结构解析,因此适用于融合反应后膜融合蛋白-脂质体复合物中的蛋白的结构研究。然而在膜融合蛋白的拓扑结构鉴定方面,即分析膜融合蛋白在细胞膜中的定位方面,依然存在着技术挑战。首先,由于膜融合体系的不均匀性,对样品体系有序性要求很高的orientsamplenmr(os-nmr)技术不适用;其次,基于固体nmr的h/d交换实验可以获取膜蛋白与顺磁性分子或水分子的相互作用,间接获取拓扑结构,但不适合鉴定细胞膜与蛋白的相互作用。因此,需要发展一种新方法用于膜融合体系中膜融合蛋白的定位。
技术实现要素:
有鉴于此,本发明的目的在于提供一种检测膜融合蛋白在脂质体中定位的核磁共振方法,采用本发明提供的核磁共振方法能够检测膜融合蛋白在脂质体中的定位。
为了实现上述发明目的,本发明提供了以下技术方案:
本发明提供了一种检测膜融合蛋白在脂质体中定位的核磁共振方法,包括以下步骤:
1)对膜融合蛋白进行15n标记,得到标记蛋白,将所述标记蛋白与不同类型脂质体反应,得到蛋白-脂质体复合物;
2)对所述步骤1)得到的蛋白-脂质体复合物进行固体核磁共振,采集一维1h-15n固体核磁图谱。其中包括与一定比例的络合镧系金属离子的顺磁磷脂分子的顺磁脂质体,和不含有顺磁磷脂分子的非顺磁脂质体。根据一维1h-15n固体核磁图谱在不同类型脂质体中的对比,分析膜融合蛋白在脂质体中的定位;
所述固体核磁共振的条件包括:1h的π/2脉冲时间设为2.6μs,1h-15n极化接触时间为0.5ms,15n的连续锁场功率为70khz,1h的锁场功率为80khz,采样数为2048,记录15n化学位移,采用spinal序列对1h去耦,去耦功率为100khz,循环等待时间为2s。
优选的,利用600mhzbrukeravanceiii固体核磁共振仪进行固体核磁共振,魔角转速设置为10khz。
优选的,所述膜融合蛋白包括psi蛋白。
优选的,所述步骤1)脂质体中含有磷脂和顺磁磷脂。
优选的,所述脂质体中磷脂的质量百分含量为50-100%。
优选的,所述脂质体中顺磁磷脂的质量百分含量为0.5-10%。
优选的,所述顺磁磷脂包括结合gd3+,cu2+,tm3+,tb3+,dy3+,mn2+,fe3+,co2+等金属离子的磷脂,本案例中用的为gd3+-dmpe-dtpa。
优选的,所述步骤1)标记蛋白与脂质体的摩尔质量比为1:5~35。
优选的,所述步骤1)反应的条件包括:所述反应的时间为8~60min,所述反应的温度为4~37℃。
优选的,所述步骤1)膜融合蛋白的纯度在90%以上。
本发明提供了一种检测膜融合蛋白在脂质体中定位的核磁共振方法,包括以下步骤:1)对膜融合蛋白进行15n标记,得到标记蛋白,将所述标记蛋白与脂质体反应,得到蛋白-脂质体复合物;2)对所述步骤1)得到的蛋白-脂质体复合物进行固体核磁共振,采集一维1h-15n固体核磁图谱,根据一维1h-15n固体核磁图谱,分析膜融合蛋白在脂质体中的定位;所述固体核磁共振的条件包括:1h的π/2脉冲时间设为2.6μs,1h-15n极化接触时间为0.5ms,15n的连续锁场功率为70khz,1h的锁场功率为80khz,采样数为2048,记录15n化学位移,采用spinal序列对1h去耦,去耦功率为100khz,循环等待时间为2s。
本发明解决了在膜融合体系中,膜融合蛋白在脂质体中的拓扑定位的问题。利用顺磁磷脂在脂质体的表面修饰了顺磁离子,如果膜融合蛋白位于脂质体表面,则距离顺磁中心较近,受到的弛豫增强效应导致谱线变宽信号减弱,因此可以通过对比顺磁和非顺磁脂质体上蛋白质信号的变化,判断膜融合蛋白的膜表面定位。如果蛋白位于脂质体内部,核磁共振信号顺磁和非顺磁脂质体上信号强度差异较小,可以用于判断插入细胞膜模式的定位。
附图说明
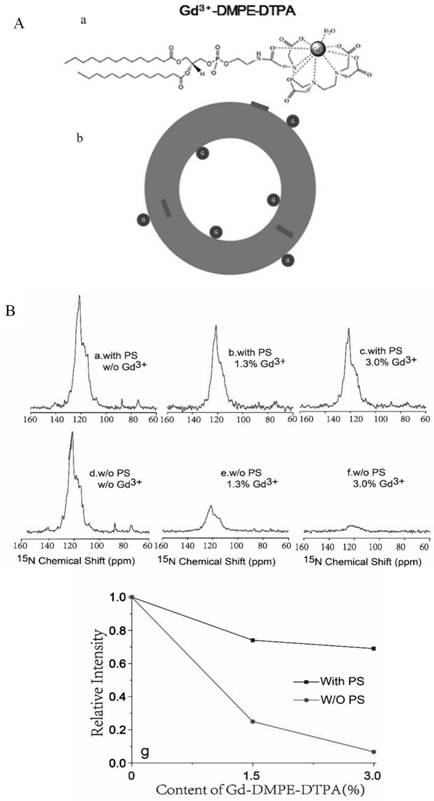
图1未利用顺磁磷脂检测蛋白定位结果,其中a,原理图示意图,a,顺磁磷脂gd3+-dmpe-dtpa的分子结构;b,加入顺磁磷脂后形成的脂质体示意图,g表示顺磁中心,红色表示蛋白;b,通过顺磁磷脂鉴定psi在不同脂质体中的拓扑结构;(a-c)为ps-free脂质体中顺磁磷脂含量分别为0,1.5%和3%时psi的一维15nnmr谱图;(d-f)为ps-contained脂质体中顺磁磷脂含量分别为0,1.5%和3%时psi的一维15nnmr谱图;g为ps-free脂质体(红)和ps-contained脂质体(黑)中psi信号的相对强度随顺磁磷脂含量的变化曲线。
具体实施方式
本发明提供了一种检测膜融合蛋白在脂质体中定位的核磁共振方法,包括以下步骤:
1)对膜融合蛋白进行15n标记,得到标记蛋白,将所述标记蛋白与脂质体反应,得到蛋白-脂质体复合物;
2)对所述步骤1)得到的蛋白-脂质体复合物进行固体核磁共振,采集一维1h-15n固体核磁图谱,根据一维1h-15n固体核磁图谱的对比,分析膜融合蛋白在脂质体中的定位;
所述固体核磁共振的条件包括:1h的π/2脉冲时间设为2.65μs,1h-15n极化接触时间为0.5ms,15n的连续锁场功率为70khz,1h的锁场功率为80khz,采样数为2048,记录15n化学位移,采用tppm序列对1h去耦,去耦功率为10khz,循环等待时间为2s。
本发明对膜融合蛋白进行15n标记,得到标记蛋白,将所述标记蛋白与脂质体反应,得到蛋白-脂质体复合物。
在本发明中,所述膜融合蛋白包括psi蛋白。在本发明中,所述psi蛋白是位于植物天冬氨酸蛋白酶上的植物特有插入序列(plant-specificinsert,psi)。本发明对膜融合蛋白进行15n标记的方法没有特殊限定,本领域技术人员依据常规操作即可,所述15n标记至少对膜融合蛋白的一个氨基酸进行标记。在本发明中,当所述膜融合蛋白优选包括psi蛋白时,本发明对所述psi蛋白的来源没有特殊限定,采用市售产品或者采用常规方法制备得到即可。在本发明中,所述psi蛋白的纯度优选在90%以上,当所述psi蛋白用于固体核磁共振时,psi蛋白的用量优选在2mg以上。在本发明中,所述psi蛋白的氨基酸序列具体如下(seqidno.1):
amaivsmecktivsqygemiwdllvsgvrpdqvcsqaglcfvdgaqhvssniktvveretegssvgeaplctacemavvwmqnqlkqegtkekvleyvnqlcekip。
在本发明中,所述脂质体中优选含有非顺磁修饰磷脂和顺磁修饰磷脂。在本发明中,所述脂质体的组成会影响到膜融合蛋白在脂质体中的定位。在本发明中,所述顺磁磷脂优选包括gd3+-dmpe-dtpa。在本发明中,所述脂质体中磷脂的质量百分含量优选为50%-90%。在本发明中,所述脂质体中顺磁磷脂的质量百分含量优选为0.5%-10%。在本发明中,所述顺磁磷脂辅助膜融合蛋白在脂质体中定位。本发明对所述脂质体的制备方法没有特殊限定,根据脂质体中含有的磷脂和顺磁磷脂的含量采用常规制备方法制备即可。
在本发明中,所述标记蛋白与脂质体的摩尔质量比优选为1:5~1:35,更优选为1:30。在本发明中,所述标记蛋白与脂质体反应的条件优选包括:所述反应的时间优选为8~60min,更优选为10min;所述反应的温度优选为4~37℃,更优选为10~25℃。在本发明中,所述标记蛋白与脂质体反应,得到反应物,将所述反应物在70000g下离心3h,得到蛋白-脂质体复合物。
本发明对得到的蛋白-脂质体复合物进行固体核磁共振,采集一维1h-15n固体核磁图谱,根据一维1h-15n固体核磁图谱,分析膜融合蛋白在脂质体中的定位;所述固体核磁共振的条件包括:1h的π/2脉冲时间设为2.65μs,1h-15n极化接触时间为0.5ms,15n的连续锁场功率为70khz,1h的锁场功率为80khz,采样数为2048,记录15n化学位移,采用spinal序列对1h去耦,去耦功率为100khz,循环等待时间为2s。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
1.psi蛋白的制备:
本实施例以植物天冬氨酸蛋白酶的植物特有插入序列(psi蛋白序列)为模型验证了该方法的可行性。该蛋白由108个氨基酸构成,结构如图1所示。为了便于表达纯化,选择的载体质粒为pet-32a(+),整合的序列结构为氧化硫蛋白-凝血酶切位点-目标蛋白,his标签接在氧化硫蛋白上,通过ni柱纯化和一次酶切反应,可得到目标蛋白,将构建的载体导入到大肠杆菌rosetta-gamib(de3)plyss中进行蛋白的表达。
(1)载体质粒的构建
pet-32a(+)上的氧化硫蛋白片段可直接利用,因此选择的上游酶切位点为msci,后面接入质粒中原带的histag和凝血酶切位点,之后接入目标蛋白的dna序列和终止子,下游酶切位点为xhoi。
(2)构建的载体导入到大肠杆菌rosetta-gamib(de3)plyss中表达
利用氯化钙法制备大肠杆菌的感受态后,将质粒热激导入大肠杆菌中,在固体培养基中培养后,挑取单克隆进行表达。
培养基加入四种抗生素(分别是15mg/l的卡那霉素,50mg/l的氨苄青霉素,12.5mg/l的四环素,34mg/l的氯霉素)后,加入导入目标质粒的大肠杆菌rosetta-gamib(de3)plyss(已筛选到表达量较高的单克隆),37℃,230rpm培养过夜。过夜的培养液,接入1l的lb培养基(若表达标记的蛋白,可换为相应标记的m9培养基)中(加入上述浓度的四种抗生素),37℃,230rpm条件下培养。od600长到0.6-0.8之间时,加入iptg(终浓度为1mm),30℃,230rpm条件下诱导表达过夜。收集表达蛋白的细菌(10,000×g,离心5分钟),保存在-20℃。
(3)蛋白的纯化
①用20mm的tris缓冲溶液(ph7.5)溶解菌,之后用高压均质仪裂菌(1000bar,2分钟)。裂解后的菌溶液在4℃,14,000×g离心30分钟。
②亲和色谱分离。平衡缓冲溶液(20mmtris,300mmnaclph7.4)平衡ni柱后,将高速离心的溶液取上清与ni柱结合。收集流出液,缓冲溶液1(30mm咪唑,20mmtris,300mmnacl,ph7.4)的洗出液,缓冲溶液2(300mm咪唑,20mmtris,300mmnacl,ph7.4)的洗出液。
③对缓冲溶液2的洗出液进行透析(透析外液:20mmtris,100mmnacl,ph8.0)后,按照每毫克蛋白1u的量加入thrombin酶,37℃酶切过夜。
④利用ni柱对酶切后的蛋白溶液进行纯化,psi蛋白在流出液中。
2.固体nmr样品(蛋白-脂质体复合物)的制备
①脂质体的制备
制备两种不同的脂质体,顺磁性脂质体和非磁性脂质体。非磁性脂质体的组成为质量比为1:1的eggpc,eggpe以及含量不等(0或33.3%)的brainps,顺磁性脂质体在上述非磁性脂质体的基础上再加入一定量(0,1.5%或3%)的顺磁磷脂gd3+-dmpe-dtpa。将溶解在氯仿中的磷脂(按实验需求加入不同含量的brainps磷脂和顺磁磷脂)搅拌混合均匀后,用氮气吹干,并真空干燥3小时。之后用缓冲溶液超声洗脱形成球形脂质体,经过液氮和37℃反复冻融十次后,形成尺寸均一的脂质体。
②将纯化得到的蛋白与制备好的脂质体按照1:30的摩尔质量比混合,搅拌反应10min后,700,000g超高速离心3小时,收集沉淀,得到蛋白-脂质体复合物的固体nmr的样品。
3.固体核磁谱图的采集
将15n标记的psi蛋白与脂质体反应后形成的蛋白-脂质体复合物置于3.2mm样品管中,依次采集一维1h-15n固体核磁谱图。结果见图1中b。
谱图收集与结果分析
首先分析脂质体中不含ps时,psi蛋白的拓扑定位。制备三份等量的脂质体,其中含有质量比为1:1的eggpc,eggpe,并分别掺入了含量为0,1.5%和3%的顺磁磷脂,与等量的psi蛋白反应后收集一维15n谱。结果显示化学位移主要在100-140ppm之间,并且随着顺磁磷脂含量的增加,蛋白的信号强度逐步降低(图1中b(a-c))。以不含顺磁磷脂含量时的蛋白信号峰强度作为参考,定义为100%,当顺磁磷脂含量为1.5%时,蛋白信号强度为25%,当顺磁磷脂含量为3%时,蛋白信号强度进一步降低为6.7%。
当研究脂质体中ps含量为33.3%的情况时,则制备三份等量的脂质体,其中含有质量比为1:1:的eggpc,eggpe,brainps,并分别掺入了含量为0,1.5%和3%的顺磁磷脂,同样地收集了顺磁磷脂含量不同的脂质体与蛋白反应后复合物的一维15n谱。随着顺磁磷脂含量的增加,蛋白的峰强度也在逐步下降,但降低幅度明显比不含ps时小(图1中b(d-f))。在顺磁磷脂含量为1.5%时,蛋白信号强度为76%,而顺磁磷脂含量为3%时,蛋白信号强度为69%。
由以上实施例可以得出,脂质体中不含ps时,psi蛋白更靠近膜表面;当脂质体中存在ps时,psi则更多地嵌入到脂质体内部。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
参考文献
1podbilewicz,b.virusandcellfusionmechanisms.annurevcelldevbiol30,111-139(2014).
2reinhard,j.&scheller,r.h.snares--enginesformembranefusion.natrevmolcellbiol7,631-643(2006).
3liang,b.&tamm,l.k.solutionnmrofsnares,complexinandα-synucleininassociationwithmembrane-mimetics.progressinnuclearmagneticresonancespectroscopy105,41-53(2018).
序列表
<110>北京大学
中国医学科学院病原生物学研究所
<120>一种检测膜融合蛋白在脂质体中定位的核磁共振方法
<160>1
<170>siposequencelisting1.0
<210>1
<211>106
<212>prt
<213>人工序列(artificialsequence)
<400>1
alametalailevalsermetglucyslysthrilevalserglntyr
151015
glyglumetiletrpaspleuleuvalserglyvalargproaspgln
202530
valcysserglnalaglyleucysphevalaspglyalaglnhisval
354045
serserasnilelysthrvalvalgluarggluthrgluglyserser
505560
valglyglualaproleucysthralacysglumetalavalvaltrp
65707580
metglnasnglnleulysglngluglythrlysglulysvalleuglu
859095
tyrvalasnglnleucysglulysilepro
100105