一种快速检测杂交瘤细胞是否分泌抗体的试剂盒的制作方法
1.本发明属于细胞生物学领域,具体涉及一种快速检测杂交瘤细胞是否分泌抗体的试剂盒。
背景技术:
2.抗体是一种能特异性结合抗原的免疫球蛋白(ig),其可被蛋白水解酶水解。如被木瓜蛋白酶水解成2个f(ab)段和一个fc段。抗体f(ab)段能够结合抗原,而fc段功能则是和fc受体结合,介导调理作用(opsonization)或抗体依赖的细胞介导的细胞毒性作用(adcc,antibody-dependent cell-mediated cytotoxicity)。由于fc段可直接结合酶或荧光染料来标记抗体,因此其既是elisa实验中抗体铆钉在固定板上的部位,也是免疫沉淀、免疫印迹和免疫组化中识别并结合二抗的部位。
3.杂交瘤细胞是将具有抗体分泌能力的b细胞和无限增生能力的骨髓瘤细胞体外融合后,在限定培养基中筛选出来的杂合细胞,其兼具抗体分泌能力和无限体外增生能力。筛选时,可直接检测杂交瘤细胞培养上清,完成初步筛选。一般通过小鼠杂交瘤,即可直接制备小鼠腹水纯化单抗,但产量较低。此外,通过其他动物,如大鼠、仓鼠和家兔等制备杂交瘤时则无法制备腹水。因此,体外培养杂交瘤细胞株,将其扩繁后转入发酵罐发酵,对发酵液进行纯化收集成了获取大量纯抗的突破点。而稳定分泌抗体的杂交瘤细胞株是此过程中重要节点。
4.然而,每个杂交瘤细胞都是b细胞和骨髓瘤细胞融合的产物,在细胞分裂过程中传代不稳定,易于失去生成抗体的能力。而抗体fc段的缺少,即导致f(ab)段较小且缺乏交联功能,使其不能与抗原结合发生沉淀反应,也不会在活体研究中被免疫细胞捕获。因此,及时检测杂交瘤细胞抗体fc段的完整,是确保杂交瘤细胞稳定分泌抗体的重要前提。
技术实现要素:
5.本发明目的在于提供一种快速检测杂交瘤细胞是否分泌抗体的试剂盒,通过阻断杂交瘤细胞的高尔基体,使杂交瘤细胞产生的抗体滞留在细胞内部而不能分泌到细胞外。通过细胞破膜剂的作用使杂交瘤细胞内抗体释放出来,与带有荧光的二抗特异性结合,用流式技术对其进行荧光信号检测,即可定性分析该杂交瘤细胞株是否生产抗体,以及定量分析具有抗体生产能力的细胞占待检测杂交瘤细胞的比例,即该细胞株分泌抗体能力的强弱。
6.一方面,本发明提供了一种快速检测杂交瘤细胞分泌抗体的方法。
7.所述的方法中包括:展现杂交瘤细胞中的抗体fc段于细胞质中,对胞质中fc段进行分析,判断抗体特异性及细胞产生抗体的能力。
8.所述的方法中包括以下步骤:
9.s1、待检细胞中加入蛋白转运抑制剂使细胞分泌的抗体滞留于细胞内;
10.s2、对步骤s1中的细胞进行破膜和抗体固定;
11.s3、步骤s2中的抗体与二抗进行反应;
12.s4、向步骤s3反应后的体系中加入缓冲液,流式细胞仪进行检测。
13.优选地,所述的步骤s1中蛋白转运抑制剂包括布雷非得菌素a、莫能菌素中的一种或多种。
14.优选地,所述的步骤s1中蛋白转运抑制剂包括布雷非得菌素a;进一步优选地,所述蛋白转运抑制剂购自bd biosciense,货号及厂家为555029。
15.所述的蛋白酶抑制剂溶于rpmi-10%完全培养液。
16.所述的蛋白酶抑制剂与rpmi-10%完全培养液的比例为1:10-1:1000;优选为1:10。
17.具体地,所述的步骤s1中的抗体可以是杂交瘤细胞表达的任意抗体,所述的步骤s3中的二抗为任意可以与前述抗体结合的二抗。
18.优选地,所述的步骤s2中破膜的方法为加入cytofix/cytoperm。
19.具体地,所述的步骤s3中,所述的二抗为大鼠抗小鼠抗体、山羊抗小鼠抗体、兔抗鼠抗体中的一种或多种。
20.优选地,所述的步骤s3中二抗为山羊抗小鼠抗体、兔抗鼠抗体。
21.具体地,所述的步骤s3中,所述的二抗带有荧光为pe、fitc、apc或其他荧光。
22.可选择地,所述的步骤s3中,所述的二抗带有荧光为pe或fitc。
23.可选择地,所述的步骤s1中的待检细胞为cd22[10f.4.4.1]、cd22[5e8.1.8]、cd3[sk7]中的一种或多种,所述的步骤s3中的二抗为大鼠抗小鼠,山羊抗小鼠和兔抗鼠;优选地,所述的二抗的浓度为0.5mg/ml。优选地,所述的二抗为山羊抗小鼠igg-pe和兔抗鼠igg-pe。
[0024]
优选地,所述的步骤s4中的缓冲液为perm/wash缓冲液。
[0025]
优选地,所述的步骤s4中的perm/wash缓冲液首先用于清洗,其次用于重悬。
[0026]
另一方面,本发明提供了一种快速检测杂交瘤细胞分泌抗体的试剂盒。
[0027]
所述的试剂盒中包括:蛋白转运抑制剂、细胞破膜剂、抗体固定剂、与待检细胞分泌抗体反应的二抗、缓冲液。
[0028]
优选地,所述的蛋白转运抑制剂为包括布雷非得菌素a、莫能菌素中的一种或多种;进一步优选为布雷非得菌素a。
[0029]
优选地,所述蛋白转运抑制剂购自bd biosciense,货号及厂家为555029。
[0030]
进一步优选地,所述的蛋白酶抑制剂溶于rpmi-10%完全培养液。
[0031]
所述的蛋白酶抑制剂与rpmi-10%完全培养液的比例为1:10-1:1000;优选为1:10。
[0032]
优选地,所述的细胞破膜剂为cytofix/cytoperm。
[0033]
优选地,所述的缓冲液为perm/wash缓冲液。
[0034]
所述的试剂盒的使用方法可以参照前述的快速检测杂交瘤细胞分泌抗体的方法进行。
[0035]
可选择地,所述的待检细胞为cd22[10f.4.4.1]、cd22[5e8.1.8]或cd3[sk7],所述的步骤s3中的二抗为大鼠抗小鼠抗体,山羊抗小鼠抗体和兔抗鼠抗体;优选地,所述的二抗的浓度为0.5mg/ml。优选地,所述的二抗为山羊抗小鼠igg-pe和兔抗鼠igg-pe。
[0036]
本发明的有益效果:
[0037]
通过对细胞膜的打孔,可以直接检测细胞分泌抗体的强弱,使一些在细胞内表达的抗体和杂交瘤细胞中分泌抗体细胞占总细胞数的阳性率占比可以直观的检测出来。可以检测每一个单克隆细胞分泌抗体能力的高低。杂交瘤细胞表面的非特异性成分的高低。
附图说明
[0038]
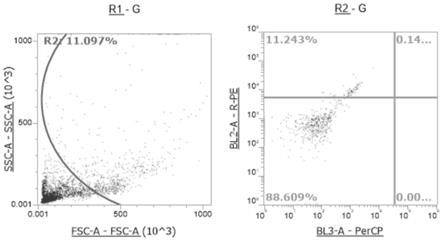
图1为在空白对照中染色的细胞占总细胞的比例;其中左图为细胞悬液中所有细胞的分布图,在左图中选取需要的细胞设为r2门,右图为r2门中的带有pe荧光信号细胞的散点图。
[0039]
图2为细胞cd22[10f4.4.1]染色的细胞占总细胞的比例;其中左图为细胞悬液中所有细胞的分布图,右图为r2门中的带有pe荧光信号细胞的散点图。
[0040]
图3为细胞cd22[5e8.1.8]染色的细胞占总细胞的比例;其中左图为细胞悬液中所有细胞的分布图,右图为r2门中的带有pe荧光信号细胞的散点图。
[0041]
图4为细胞cd3[sk7]占总细胞的比例;其中左图为细胞悬液中所有细胞的分布图,右图为r2门中的带有pe荧光信号细胞的散点图。
具体实施方式
[0042]
下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0043]
以下实施例中,杂交瘤细胞均购自上海杰枭生物科技股份有限公司。
[0044]
实施例1一种快速检测杂交瘤细胞分泌抗体的方法
[0045]
需要检测的细胞为cd22[10f.4.4.1],表达抗体类型:mouse igg。
[0046]
复苏细胞,复壮培养后计数,取4
×
106个待测细胞,1500rpm/min条件离心5min,再加入10ml pbs缓冲液清洗,1500rpm/min离心5分钟。离心结束后加入200μl含蛋白转运抑制剂rpmi-10%完全培养液。
[0047]
rpmi-10%完全培养液(500ml)配方见下表:
[0048][0049]
蛋白转运抑制剂为含布雷非得菌素a的蛋白转运抑制剂(555029/bd biosciences),配方为6ml rpmi-10%完全培养液加入600μl含布雷非得菌素a蛋白转运抑
制剂,吹打重悬细胞,吸取至圆底96孔板中于二氧化碳培养箱内,37℃、5%co2浓度下恒温培养3小时,保证杂交瘤细胞持续分泌的抗体滞留在胞内。
[0050]
2、将待检测细胞从二氧化碳培养箱中取出,将圆底96孔板放入离心机,2000rpm/min离心2分钟,离心结束,轻轻倒掉上清,留下底部待检测细胞,在每个细胞孔中加入100μl cytofix/cytoperm(51-2090kz/bd biosciences)轻轻吹打,在冰上反应30min,目的是对杂交瘤细胞进行破膜固定,方便后续滞留在细胞内的抗体与二抗反应。
[0051]
3、取破膜固定结束后的96孔板,2000rpm/min离心2min,离心结束后,再加入perm/wash缓冲液2000rpm/min,离心2min,离心结束后,轻轻倒掉上清,留下圆底96孔板底部细胞,每孔加入50μl带有pe荧光的大鼠抗小鼠(二抗稀释比例为1:50-1:2000,1:100为最佳范围,二抗亚型:igg,克隆号:4053,浓度为:0.5mg/ml,购买来源信息:405307,biolgend),于冰上反应15min。
[0052]
4、反应结束,每个孔中加入200μl perm/wash缓冲液(51-2091kz/bd biosciences,具体配制方法:9ml无菌水中加入1ml perm/wash),2000rpm/min离心2分钟,重复2次后,轻轻倒掉上清,留下圆底96孔板底部细胞,每孔加入500μl perm/wash缓冲液,重悬后移取至1.5ml离心管,以待用流式细胞仪进行信号检测。
[0053]
实验结果:
[0054]
在空白对照中染色的细胞占总细胞的11.243%(图1),细胞cd22[10f4.4.1]染色的细胞占总细胞的44.552%(图2)。
[0055]
实施例2
[0056]
参照实施例1的实验方法,对cd22[5e8.1.8]进行检测,cd22[5e8.1.8]表达mouse igg。
[0057]
细胞cd22[5e8.1.8]染色的细胞占总细胞的93.976%(图3)。
[0058]
实施例3
[0059]
参照实施例1的实验方法,对cd3[sk7]进行检测,cd3[sk7]表达mouse igg1,kappa。
[0060]
细胞cd3[sk7]占总细胞的0.352%(图4)。
[0061]
由以上实施例可判断,cd22[5e8.1.8]的细胞中分泌抗体的细胞阳性率最高,其次为cd22[10f4.4.1],细胞cd3[sk7]则无阳性细胞分泌抗体。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1