一种锂离子电池过充电热失控建模方法与流程
本发明属于电池领域,具体涉及一种锂离子电池过充电热失控建模方法。
背景技术:
锂离子电池具有能量密度/功率密度高、使用寿命长等特点,是目前应用最为广泛的车用化学动力源。然而,近年来,电动汽车的电池系统的热失控事故层出不穷,危害了人们的生命财产安全,同时打击了公众对电动汽车的信心。
过充电是最常见的电池滥用情况之一,指的是电池在到达充电截止电压后仍然被继续充入电流,通常由电池管理系统失效引起。过充电过程中,电池内部会发生一系列化学反应,这些反应产生大量的热量,使得电池温度升高,最终导致电池发生热失控,造成起火、爆炸等事故。为了更好地防止电池发生过充电,需要建立电池的过充电热失控模型,模拟过充电过程中电池电压和温度的变化,根据电压和温度的变化规律评估电池安全状态的变化,实现对过充电热失控隐患的早期检测。另外,电池过充电热失控模型还可以模拟过充电引起的电池系统热失控扩散,仿真模拟结果可以用于指导电池系统热失控扩展防范设计,更好地保障电池系统的安全。然而,目前为止,尚没有能够模拟真实电池过充电热失控过程电压和温度变化的模型。
技术实现要素:
本发明的目的是为克服已有技术的空白之处,提供一种锂离子电池过充电热失控建模方法。该方法能够同时模拟过充电热失控过程中电压和温度的变化规律,准确地模拟锂离子电池的过充电热失控行为,更好地保障电池系统的安全。
本发明提出了一种锂离子电池过充电热失控建模方法,其特征在于,该方法首先对第一锂离子电池进行绝热过充电热失控实验,并记录第一锂离子电池在不同时刻的温度、电压及内阻;然后将与第一锂离子相同的第二锂离子电池拆解,制作分别包含所述第二锂离子电池正负极的两个纽扣电池,并对两个纽扣电池进行过充电测试,分别获取包含第二锂离子电池正负极电压与锂离子化学计量数的关系曲线;然后,对第一锂离子电池绝热过充电热失控过程进行阶段划分,确定不同阶段对应的电池内部化学反应;最后建立所述第一锂离子电池在绝热过充电热失控实验过程中的数学模型。该方法包括以下步骤:
1)提供一第一锂离子电池,对所述第一锂离子电池进行绝热过充电热失控实验,并记录该第一锂离子电池在不同时刻的温度T’(t)、电压V’(t)以及内阻R’(t);
2)提供一第二锂离子电池,所述第二锂离子电池型号与第一锂离子电池相同,将所述第二锂离子电池拆解,制作分别包含所述第二锂离子电池的正负极的两个纽扣电池,对两个纽扣电池进行过充电测试,分别获取包含所述第二锂离子电池正负极电压与锂离子化学计量数的关系曲线;
3)根据步骤1)所记录的温度T’(t)、电压V’(t)以及内阻R’(t),对所述第一锂离子电池绝热过充电热失控过程进行阶段划分,确定不同阶段对应的电池内部化学反应;
4)根据步骤3)得到的不同阶段对应的化学反应,建立所述第一锂离子电池在绝热过充电热失控实验过程中的数学模型{T(t),V(t)},并利用所述T’(t)及V’(t)标定该数学模型{T(t),V(t)}。
本发明提供的锂离子电池过充电热失控建模方法,通过将锂离子电池绝热过充电热失控过程划分为不同的阶段,总结不同阶段的化学反应,并根据不同阶段的化学反应,建立所述锂离子电池绝热过充电热失控过程的数学模型{T(t),V(t)},并利用该数学模型进行仿真计算,可以定量分析锂离子电池过充电热失控过程中化学反应情况,同时预测锂离子电池在过充电热失控过程中的温度和电压变化,为电池过充电过程中的安全状态监控和热失控扩散防范设计提供重要依据。
附图说明
图1为本发明的锂离子电池过充电热失控建模方法的流程图。
图2为本发明实施例中第一锂离子电池的绝热过充电热失控实验结果及阶段划分结果示意图。
图3为本发明实施例中第二锂离子电池正极电压Vca与锂离子化学计量数y的关系曲线图。
图4为本发明实施例中第二锂离子电池负极电压Van与锂离子化学计量数x的关系曲线图。
图5为本发明实施例中过充电热失控模型的仿真结果与第一锂离子电池实验结果对比图。
图6为本发明实施例中过充电热失控模型的仿真结果与第三锂离子电池实验结果对比图。
图7为本发明实施例中过充电热失控模型的仿真结果与第四锂离子电池实验结果对比图。
具体实施方式
本发明提出一种锂离子电池过充电热失控建模方法,下面结合附图及具体实施例对本发明作进一步的详细说明。
本发明提出一种锂离子电池过充电热失控建模方法,首先对第一锂离子电池进行绝热过充电热失控实验,并记录第一锂离子电池在不同时刻的温度、电压及内阻;然后将与第一锂离子相同的第二锂离子电池拆解,制作分别包含所述第二锂离子电池正负极的两个纽扣电池,并对两个纽扣电池进行过充电测试,分别获取包含第二锂离子电池正负极电压与锂离子化学计量数的关系曲线;然后,对第一锂离子电池绝热过充电热失控过程进行阶段划分,确定不同阶段对应的电池内部化学反应;最后建立所述第一锂离子电池在绝热过充电热失控实验过程中的数学模型。本发明流程如图1所示,包括以下步骤:
S1:提供一第一锂离子电池,对所述第一锂离子电池进行常规绝热过充电热失控测试(即在绝热环境下进行过充电测试,直至发生热失控),并记录该第一锂离子电池在不同时刻的温度T’(t)、电压V’(t)以及内阻R’(t);
S2:提供一第二锂离子电池,所述第二锂离子电池型号与第一锂离子电池一致,将所述第二锂离子电池拆解,制作分别包含所述第二锂离子电池的正负极的两个纽扣电池,对两个纽扣电池进行过充电测试,分别获取包含所述第二锂离子电池正负极电压与锂离子化学计量数的关系曲线;
S3:根据步骤S1中记录的温度T’(t)、电压V’(t)以及内阻R’(t),对所述第一锂离子电池绝热过充电热失控过程进行阶段划分,确定不同阶段对应的电池内部化学反应;
S4:根据步骤S3不同阶段对应的化学反应,建立所述第一锂离子电池在绝热过充电热失控实验过程中的数学模型{T(t),V(t)},并利用所述T’(t)及V’(t)标定该数学模型{T(t),V(t)}。
步骤S1中,所述锂离子电池的正、负极材料以及隔膜可以为常用的锂离子电池的正、负极材料以及隔膜。在本实施例中,所述锂离子电池的正极材料为镍钴锰三元材料与锰酸锂材料混合组成,负极材料为石墨,隔膜为具有陶瓷涂层的聚乙烯。
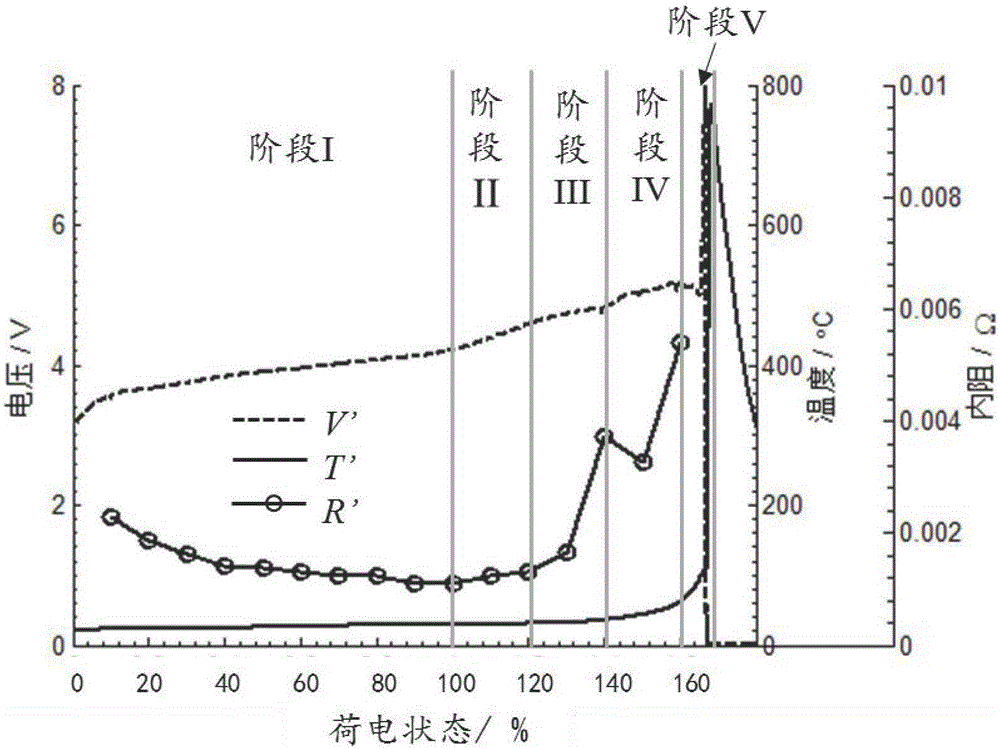
在绝热环境下对所述第一锂离子电池进行过充电热失控实验,有利于准确获得所述锂离子电池在过充电热失控过程中释放的全部能量。本实施例中,采用常规大型绝热加速量热仪中进行所述第一锂离子电池的过充电热失控实验,并记录了该第一锂离子电池在不同时刻的温度T’(t)、电压V’(t)以及内阻R’(t),如图2所示。其中,图2的横坐标为电池的荷电状态,即充电容量与电池标称容量的比值;虚线为第一锂离子电池过充电热失控实验过程中电压的变化曲线,对应的纵坐标轴为左边的电压坐标轴,可以看到,过充电热失控过程中,电池电压逐渐上升,在充电容量达到电池标称容量的160%时,达到极大值5.23V,然后开始下降,在热失控发生时急剧下降至0V;实线为第一锂离子电池过充电热失控实验过程中温度的变化曲线,对应的纵坐标轴为右边第一个坐标轴——温度纵坐标轴,可以看到,过充电热失控过程中,电池温度也逐渐上升,在充电容量达到电池标称容量的140%后,电池升温速率加快,热失控发生时,电池温度急剧升高至最大值800℃;实线与圆圈标志组成的曲线为第一锂离子电池过充电热失控实验过程中内阻的变化曲线,对应的纵坐标轴为右边第二个坐标轴——内阻纵坐标轴,可以看到在过充电热失控实验过程中,电池内阻先是慢慢下降,在充电容量达到电池标称容量的120%后,电池内阻开始快速上升,在充电容量达到电池标称容量的140%时,电池内阻出现极大值,随后,电池内阻经历了轻微的下降后又开始上升,直至电池发生热失控。
步骤S2中,所述的第二锂离子电池型号与第一锂离子电池一致;分别获取包含所述第二锂离子电池正负极电压与锂离子化学计量数的关系曲线,具体包括以下步骤:
S21:将所述第二锂离子电池放电至放电截止电压,将第二锂离子电池拆解,获取该电池的正负极极片;
S22:利用S21中获得的电池正负极极片,在常规的手套箱中分别制作两个纽扣电池;其中,第一纽扣电池的正极为所述第二锂离子电池的正极材料,负极为金属锂;第二纽扣电池的正极为所述第二锂离子电池的负极材料,负极为金属锂;
S23:对S22得到的分别包含所述第二锂离子电池的正、负极的两个纽扣电池进行过充电测试,获取过充电过程中正极电压Vca与锂离子化学计量数y以及负极电压Van与锂离子化学计量数x的关系曲线,如图3和图4所示。图3中的横坐标为正极锂离子化学计量数y,纵坐标为正极电压Vca,可以看到正极锂离子化学计量数y从0变化到0.1时,电池电压逐渐上升,正极锂离子化学计量数y等于0.1时,正极电压达到极大值5.24V,随后,随着正极锂离子化学计量数y从0.1增加至1,正极电压逐渐下降。图4中的横坐标为负极锂离子化学计量数x,纵坐标为正极电压Van,可以看到负极锂离子化学计量数x从0逐渐增加到1.2的过程中,负极电压从1.1V逐渐下降至-0.0058V,负极锂离子化学计量数x大于1.2时,负极电压基本保持不变,为-0.0058V。
步骤S3中,根据步骤S1中记录的温度T’(t)、电压V’(t)以及内阻R’(t),对所述锂离子电池绝热过充电热失控过程进行阶段划分,确定不同阶段对应的电池内部化学反应,具体包括:参照图2,根据步骤S1中记录的温度T’(t)、电压V’(t)以及内阻R’(t),不考虑降温阶段,将所述第一锂离子电池过充电热失控过程划分为阶段I、阶段II、阶段III、阶段IV以及阶段V。
阶段I:从所述第一锂离子电池开始充电开始,到电池充电电压到达充电截止电压时结束。此阶段内,电池在进行正常的充电,过充电尚未发生。此时,电池内部的热量主要来自于自身内阻产生的焦耳热,以及正负极材料可逆的脱锂/嵌锂反应产生的可逆热;
阶段II:从所述第一锂离子电池的充电电压超过其充电截止电压时开始,到充电容量达到电池标称容量的120%结束。从充电电压超过充电截止电压开始,电池开始发生过充电,但由于锂离子电池正负极均留有一定的余量,此时正负极材料发生的仍然是可逆的脱锂/嵌锂反应,即锂离子从正极材料中脱出,通过电解液,到达负极材料表面,并嵌入负极材料内部。此时电池内的热量主要来自于自身内阻产生的焦耳热以及脱锂/嵌锂反应产生的可逆热;
阶段III:从所述第一锂离子电池的充电容量超过电池标称容量的120%开始,到充电容量达到电池标称容量的140%结束。当充电容量超过电池标称容量的120%后,负极材料已经完全嵌满锂,多余的锂离子将很难继续嵌入负极中,开始在负极表面以锂金属的形式析出。析出的金属锂非常活泼,容易与电解液发生反应,消耗电解液,同时生成新的SEI膜,将导致电池内阻增加。对于正极,正极电压将达到锰酸锂材料中的3价锰离子的溶解电压,导致3价锰离子发生溶解;
阶段IV:从所述第一锂离子电池的充电容量超过电池标称容量的140%开始,到充电容量达到电池标称容量的160%结束。随着过充电的进行,正极电压持续升高,达到电解液的分解电压,氧化性强的正极材料开始与电解液发生反应,将电解液氧化分解,产生大量的气体和热量。同时,负极的SEI膜在高温下也开始发生分解,导致还原性强的负极材料直接与电解液接触,在负极表面与电解液发生还原反应,消耗负极材料和电解液,同时产生气体和热量。在本阶段后期,正极材料发生结构坍塌,无法继续维持高电压,电池电压在到达极大值点后开始下降。
阶段V:从所述第一锂离子电池的充电容量超过电池标称容量的160%开始,到电池发生热失控并且达到热失控的最高温度结束。从此阶段开始,电池内部的电解液消耗完毕,电池内阻急剧增加,电池电压也开始快速增加,直接到达充放电机的最高电压(20V)。同时,电池的温度也开始快速上升,体积明显膨胀。电池隔膜在快速升温的过程中发生收缩,引起电池内部的大规模内短路,释放大量的热量,热失控发生,电池电压急剧下降至0V,温度急剧升高至最大值。
步骤S4中,建立所述第一锂离子电池在绝热过充电热失控实验过程中的数学模型{T(t),V(t)},具体包括以下步骤:
S41:建立所述第一锂离子电池在过充电热失控过程中的正极电压Vca(t)、负极电压Van(t)以及全电池电压V(t)的计算公式;
S42:建立所述第一锂离子电池在过充电热失控过程中产热速率Q(t)的计算公式;
S43:建立所述第一锂离子电池在过充电热失控过程中的能量守恒方程,得到不同时刻电池升温速率dT(t)/dt的计算公式,进而得出不同时刻的电池温度T(t)的计算公式。
步骤S41中,锂离子电池在过充电热失控过程中的正极电压Vca与正极的锂离子化学计量数y一一对应,对应关系由步骤2)得到,如图3所示。同样,负极电压Van与负极的锂离子化学计量数x一一对应,对应关系对应关系由步骤2)得到,如图4所示。而在所述第一锂离子电池过充电热失控过程中,正极材料发生脱锂反应,负极材料发生嵌锂反应,即正极锂离子化学计量数y不断减少,而负极锂离子化学计量数x不断增加。因此,在所述第一锂离子电池过充电热失控过程中,正极锂离子化学计量数y的计算公式如式(1)所示:
其中,y0为充电开始时刻正极锂离子化学计量数,本实施例中设为0.996;I为充电电流,Qca为正极材料的容量。如前面所述,随着过充电的进行,正极材料会发生分解,正极容量也随之会发生衰减,需要根据正极材料的分解情况计算正极材料容量Qca。由于图3中正极纽扣电池测试得到的正极电压Vca(t)与正极内部的锂离子化学计量数y对应关系也已经纳入正极容量衰减的影响(因为正极纽扣电池过充电测试中正极材料也会有衰减)。在进行建模时,仅需要根据正极材料的分解情况修正正极材料容量Qca,如式(2)所示:
Qca=Qca,0·(1-kQ,ca·(cca,0-cca)) (2)
式(2)中,Qca,0为正极材料的初始容量,kQ,ca为修正系数,取值范围为0~1,cca为正极材料的归一化浓度,取值范围为0~1,cca,0=1为正极材料的初始归一化浓度。在本实施例所述第一锂离子电池的数学模型中,Qca,0设为78.503Ah,kQ,ca设为0.1,cca根据正极材料的分解反应计算得到。
在所述第一锂离子电池过充电热失控过程中,负极锂离子化学计量数x的计算公式如式(3)所示:
其中,x0为充电开始时刻负极锂离子化学计量数,本实施例中设为0.0167;I为充电电流,Qan为负极材料的容量,取值范围为40~90Ah。本实施例所述第一锂离子电池的数学模型,Qan=52.52Ah。需要注意的是,实际中负极锂离子化学计量数x的值应当在0和1之间,x大于1意味着负极材料已经嵌满锂,多余的锂离子将析出。另外,在进行负极锂离子化学计量数x的计算时,原则上也需要考虑负极容量Qan衰减的影响,但从图4中可以看出,负极发生析锂后,负极电压基本稳定在-0.0058V左右。此时,尽管负极容量Qan衰减对负极锂离子化学计量数x的取值有影响,但对负极电压并没有影响,方便起见,便不再考虑负极容量Qan衰减的影响。
负极电压Van(t)的计算公式如式(4)所示:
其中,Van(x(t))的意思是在充电过程中,负极电压Van(t)与负极锂离子化学计量数x(t)存在一一对应关系,对应关系由步骤2)得到,如图4所示。在计算过程中,先由公式(3)计算得到负极锂离子化学计量数x(t),然后根据步骤2)中得到的对应关系,线性插值获得负极电压Van(t),故表示为Van(x(t))。
在充电过程中,全电池的电压为正极电压Vca(t)和负极电压Van(t)之差,加上电池自身内阻通过电流带来的电压,如式(5)所示,其中Rohm为电池内阻,在步骤S1中可以测得。
V(t)=Vca(y(t))-Van(t)+I·Rohm(t) (5)
其中,Vca(y(t))的意思是在充电过程中,正极电压Vca(t)与正极锂离子化学计量数y(t)存在一一对应关系,对应关系由步骤2)得到,如图3所示。在计算过程中,先由公式(1)计算得到正极锂离子化学计量数y(t),然后根据步骤2)中得到的对应关系,线性插值获得正极电压Vca(t),故表示为Vca(y(t))。
步骤S42中,电池过充电过程中,电池的内部产热速率包括以下几部分:
(1)电池正负极材料发生可逆脱锂/嵌锂反应产生的可逆产热速率Qrev(t);
(2)电池自身内阻通过电流时产生的焦耳产热速率Qohm(t);
(3)过充电过程中电池内部化学反应产热速率Qr(t);
(4)电池大规模内短路产热速率Qshort(t);
在过充电热失控过程中,电池产热速率Q(t)即为上述四种产热速率之和。
所述可逆产热速率Qrev(t)由电池正负极材料脱锂/嵌锂的可逆反应产生,当充电容量超过电池标称容量的120%,即充电荷电状态(SOC)大于120%,电池内部开始发生副反应,Qrev(t)可以忽略不计。因此可逆产热速率Qrev(t)的计算公式如式(6)所示。
其中dU/dT为反应熵变,可以通过实验标定,本实施例所述的第一锂离子电池在不同SOC下的反应熵变如表1所示。
表1第一锂离子电池在不同SOC下的反应熵变取值表
所述焦耳产热速率Qohm(t)的计算公式如式(7)所示:
Qohm(t)=I2Rohm(t) (7)
所述化学反应产热速率Qr(t)的表达式如式(8)所示:
Qr(t)=QLi+Qca,d+Qe+QSEI+Qan+Qca (8)
其中,QLi为负极表面析出的锂金属与电解液反应的产热速率,Qca,d为正极材料中锰离子溶解导致的产热速率,Qe为电解液氧化分解的产热速率,QSEI为SEI膜分解反应的产热速率,Qan为负极材料分解反应的产热速率,Qca为正极材料分解反应的产热速率。
所述QLi的计算公式如式(9)所示,其中HLi为单位摩尔锂金属与电解液反应释放的能量,单位为J/mol,RLi为锂金属与电解液反应的速率,单位为mol/s。
QLi=HLi·RLi (9)
RLi符合阿伦尼乌斯公式,如式(10)所示,其中ALi表示金属锂与电解液反应的频率因子,单位是s-1,EaLi为反应的活化能,单位是J/mol,R是理想气体常量,R=8.314J/(mol·K),T为所述第一锂离子电池的温度,cLi为析出的锂的物质的量,单位为mol,ce为代表电解液的归一化浓度,kLi为人为设置的常数,使得cLi为0时,反应速率为0,而cLi为趋向于无穷大时,反应速率不再受锂金属的量影响。
在过充电过程中,析出的锂金属的量遵循式(11)、(12)所示的质量守恒方程,其中cLi,0为初始锂金属的量,本实施例中设为0,F为法拉第常数,表示1mol电子所带的电量,F=96487C/mol。
iLi为析锂电流,遵循BV方程,如式(13)所示,其中i0为反应交换电流,单位为A,αc和αa为传递常数,rSEI为SEI膜内阻,Van,ref为析锂反应的平衡电势。析锂反应只有在负极表面电势低于平衡电势Van,ref,即Van-I·rSEI-Van,ref<0时,才会发生。
在本实施例中,上述锂金属与电解液反应的公式中相关参数的取值如表2所示:
表2锂金属与电解液反应的公式中相关参数的取值表
所述Qca,d来自于正极材料中的3价锰离子溶解,计算公式如式(15)所示,其中Hca,d为单位质量的正极材料中的3价锰离子全部溶解释放的能量,单位为J/g,Rca,d为3价锰离子溶解的速率,mca为所述第一锂离子电池中正极材料的质量,单位为g。
Qca,d=Hca,d·Rca,d·mca (15)
Rca,d符合阿伦尼乌斯公式,如式(16)所示,其中Aca,d表示锰离子溶解反应的频率因子,单位是s-1,Eaca,d为反应的活化能,单位是J/mol,cMn为代表3价锰离子的归一化浓度,αd为传递常数,Vca,d,ref为溶解反应的平衡电势。锰离子溶解反应只有在正极电压大于平衡电势Vca,d,ref时,即Vca-Vca,d,ref>0时才会发生。
在过充电过程中,正极材料中3价锰离子的含量遵循式(17)、(18)所示的质量守恒方程,其中cMn,0为锰离子归一化浓度的初始值,本实施例中设为1。随着充电的进行,3价锰离子逐渐被氧化,因此充电电流也对锰离子的量有影响,如式(18)所示,kd为相关系数。
在本实施例中,上述锰离子溶解相关反应的公式中相关参数的取值如表3所示:
表3锰离子溶解相关反应的公式中相关参数的取值表
所述Qe由高电压下,电解液被正极材料氧化分解产生,计算公式如式(19)所示,其中He为单位质量的电解液氧化分解释放的能量,单位为J/g,Re为电解液氧化分解速率,me为所述第一锂离子电池中电解液的质量,单位为g。
Qe=He·Re·me (19)
Re符合阿伦尼乌斯公式,如(20)式所示,其中Ae表示电解液氧化分解反应的频率因子,单位是s-1,Eae为反应的活化能,单位是J/mol,ce为代表电解液的归一化浓度,αe为传递常数,Ve,ref为电解液分解反应的平衡电势。电解液氧化分解只有在正极表面电压大于平衡电势Ve,ref时,即Vca+I·re-Ve,ref>0时才会发生。re为正极表面阻抗,受到电解液氧化分解的影响,如式(21)所示,re,0为阻抗初始值,kr,e为影响系数。
re=re,0+kr,e∫Redt (21)
在过充电过程中,电池中电解液的含量遵循式(22)、(23)所示的质量守恒方程,其中ce,0为电解液归一化浓度的初始值,本实施例中设为1。电解液的消耗速率受三个方面的影响:(1)自身的氧化分解速率Re;(2)金属锂与电解液的反应速率ke,1·RLi,ke,1为影响系数;(3)负极材料与电解液的反应速率ke,2·Ran,ke,2为影响系数。
在本实施例中,上述电解液分解反应相关公式中相关参数的取值如表4所示:
表4电解液分解反应相关公式中相关参数的取值表
所述QSEI由SEI膜分解反应产生,该反应在电池温度T(t)大于40℃时才会进行。QSEI计算公式如式(24)所示,其中HSEI为单位质量的负极中的SEI膜全部分解释放的能量,单位为J/g,RSEI为SEI膜分解速率,man为所述第一锂离子电池中负极材料的质量,单位为g。
QSEI=HSEI·RSEI·man (24)
RSEI符合阿伦尼乌斯公式,如式(25)所示,其中ASEI表示SEI膜分解反应的频率因子,单位是s-1,EaSEI为反应的活化能,单位是J/mol,cSEI为代表SEI膜的归一化浓度。
SEI膜的含量遵循式(26)、(27)所示的质量守恒方程,其中cSEI,0为SEI膜归一化浓度的初始值,取值范围为0~1,本实施例中设为0.15。锂金属与电解液的反应将生成新的SEI膜,对SEI膜的含量有影响,kSEI为影响系数,取值范围为0~1,本实施例中设为0.1。SEI膜分解会影响SEI膜阻抗,如式(14)所示,rSEI,0为阻抗的初始值,kr,SEI为影响系数,取值范围为0~0.1,本实施例中设为0.05。
在本实施例中,上述SEI膜分解反应公式中相关参数的取值如表5所示:
表5SEI膜分解反应公式中相关参数取值表
所述Qan由负极材料分解反应产生,该反应在电池温度T(t)大于65℃时才会进行。Qan计算公式如式(28)所示,其中Han为单位质量的负极材料全部分解释放的能量,单位为J/g,Ran为负极材料分解速率,man为所述第一锂离子电池中负极材料的质量,单位为g。
Qan=Han·Ran·man (28)
Ran符合阿伦尼乌斯公式,如(29)式所示,其中Aan表示负极材料分解反应的频率因子,单位是s-1,Eaan为反应的活化能,单位是J/mol,can为代表SEI膜的归一化浓度。表征SEI膜厚度对负极材料分解反应的影响。
负极材料的含量遵循式(30)、(31)所示的质量守恒方程,其中can,0为负极材料归一化浓度的初始值,本实施例中设为0.85。
在本实施例中,上述负极材料分解反应相关公式中相关参数的取值如表6所示:
表6负极分解反应相关公式中相关参数取值表
所述Qca由正极材料分解产生,本实施例中采用的锂离子电池的正极材料为三元材料与锰酸锂材料组成的混合材料,具有两个不同的化学反应,分别在电池温度T(t)大于180℃和220℃时才会进行。因此Qca计算公式如式(32)所示,其中Hca,1和Hca,2分别为单位质量的正极材料发生两个不同的化学反应释放的能量,单位为J/g,Rca,1和Rca,2分别为两个化学反应的反应速率,mca为所述第一锂离子电池中正极材料的质量,单位为g。
Qca=Hca,1·Rca,1·mca+Hca,2·Rca,2·mca (32)
Rca,1和Rca,2符合阿伦尼乌斯公式,如式(33)、(34)所示,其中Aca,1、Aca,2为反应的频率因子,单位是s-1,Eaca,1、Eaca,2为反应的活化能,单位是J/mol,cca为代表正极材料的归一化浓度。
在电池温度T(t)大于180℃下进行:
在电池温度T(t)大于220℃下进行:
正极材料的含量遵循式(35)、(36)所示的质量守恒方程,其中cca,0为正极材料归一化浓度的初始值,本实施例中设为1。锰离子溶解以及电解液的分解反应也会消耗部分的正极材料,kca,1和kca,2分别为影响系数。
在本实施例中,上述公式中相关参数的取值如下表7所示:
表7正极材料分解反应相关公式中相关参数取值表
所述大规模内短路产热速率Qshort(t)的表达式如下:
ΔHshort代表释放的总能量,Δt代表平均反应时间,决定反应速度,∫Qshort(t)dt代表已经发生短路的能量。大规模内短路在电池温度T(t)大于为大规模内短路温度Tshort时才会发生。本实施例中,Tshort=110℃。上述各参数的取值如表8所示:
表8大规模内短路反应相关参数取值表
步骤S43中,根据能量守恒,建立所述第一锂离子电池在过充电热失控过程中的能量守恒方程,如下式所示:
其中,M为电池质量,本实施例中M=1kg;Cp为电池的比热容,在本实施例中,Cp=1100J/(kg·K);hA(T(t)-Ta(t))表示过充电热失控过程中的散热量,在本实施例中,所述第一锂离子电池的过充电热失控实验在绝热环境下进行,因此散热量为零。得到不同时刻电池升温速率的计算公式如式(39)所示:
进一步地,得到不同时刻电池温度T(t)的计算公式如式(40)所示,其中T0为所述第一锂离子电池在过充电热失控实验前的温度,为已知量,本实施例中,T0=19℃;
所述利用T’(t)以及V’(t)标定所述数学模型{T(t),V(t)}的步骤包括:
对于Qr(t),根据现有的文献选定相关参数的值,利用所述数学模型{T(t),V(t)}进行仿真计算,得到所述第一锂离子电池在不同时刻的电压和温度的仿真结果,如果仿真结果与步骤1中得到的实验结果T’(t)和V’(t)相差较大,则在一定范围内调整相关参数,每调整一次参数进行一次仿真计算,直至仿真计算结果与实验结果相近为止。上述表1-表8的各个参数取值表中给出的即为使得仿真计算结果与实验结果相近的优选参数取值结果。
利用所建立的数学模型{T(t),V(t)}对第一锂离子电池进行仿真计算的结果与实验结果的对比如图5所示。图5(a)中,横坐标为时间,纵坐标为电压,实线表示实验得到的电压变化曲线,而虚线表示使用本发明的建模方法建立的数学模型进行仿真计算得到的电压变化曲线,可以看到,实线与虚线基本重合,表明本发明的建模方法可以准确模拟电池过充电热失控过程中电池电压的变化;图5(b)中,横坐标为时间,纵坐标为温度,实线表示实验得到的温度变化曲线,而虚线表示使用本发明的建模方法建立的数学模型进行仿真计算得到的温度变化曲线,可以看到,实线与虚线基本重合,表明本发明的建模方法建立的数学模型可以准确模拟过充电热失控过程中电池温度的变化。图5(a)和(b)的结果说明通过本发明的建模方法建立的数学模型{T(t),V(t)}具有较好的精度。
本发明所述锂离子电池过充电热失控建模方法在步骤S4之后可进一步包括以下步骤:
S5:提供一第三、第四锂离子电池,与所述第一锂离子电池相同,对所述第三、第四锂离子电池进行与第一锂离子电池不同充电倍率的绝热过充电热失控实验,分别记录第三、第四锂离子电池在不同时刻的温度和电压;
S6:利用第三、第四锂离子电池的实验结果,验证S4所建立的数学模型{T(t),V(t)}。
在本实施例中,第一锂离子电池实验过程中采用的充电电流为20A,而第三、第四锂离子电池实验过程中采用的充电电流分别为13.33A和40A。图6和图7是模型仿真计算结果与第三、第四锂离子电池的实验结果的对比图。图6(a)中,横坐标为时间,纵坐标为电压,实线表示实验得到的电压变化曲线,而虚线表示使用本发明的建模方法建立的数学模型进行仿真计算得到的电压变化曲线,可以看到,实线与虚线基本重合,表明本发明的建模方法可以准确模拟充电电流为13.33A的电池过充电热失控过程中电池电压的变化;图6(b)中,横坐标为时间,纵坐标为温度,实线表示实验得到的温度变化曲线,而虚线表示使用本发明的建模方法建立的数学模型进行仿真计算得到的温度变化曲线,可以看到,实线与虚线基本重合,表明本发明的建模方法建立的数学模型可以准确模拟充电电流为13.33A的过充电热失控过程中电池温度的变化。图7(a)中,横坐标为时间,纵坐标为电压,实线表示实验得到的电压变化曲线,而虚线表示使用本发明的建模方法建立的数学模型进行仿真计算得到的电压变化曲线,可以看到,实线与虚线基本重合,表明本发明的建模方法建立的数学模型可以准确模拟充电电流为40A的电池过充电热失控过程中电池电压的变化;图7(b)中,横坐标为时间,纵坐标为温度,实线表示实验得到的温度变化曲线,而虚线表示使用本发明的建模方法建立的数学模型进行仿真计算得到的温度变化曲线,可以看到,实线与虚线基本重合,表明本发明的建模方法建立的数学模型可以准确模拟充电电流为40A的过充电热失控过程中电池温度的变化。从图5、图6和图的对比结果,可以看出通过本发明的建模方法建立的数学模型能够准确模拟仿真不同倍率下的过充电热失控过程中电池电压和温度的变化,具有较好的精度。
另外,本领域技术人员还可以在本发明精神内做其他变化,这些依据本发明精神所作的变化,都应包含在本发明所要求保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!