一种体细胞胚胎途径的槲蕨种苗组培快繁方法与流程
本发明属于植物组织培养技术领域,具体涉及一种基于体细胞胚胎途径的槲蕨组培快繁方法。
背景技术:
槲蕨(drynariaroosii),又名石岩姜、岩连姜、猴姜,属于槲蕨科(drynariaceae)槲蕨属的中型附生蕨类。在我国主要分布于浙江、福建、台湾、广东、广西、江西、湖北、四川、贵州、云南等地。槲蕨为中型附生蕨类,其根状茎以骨碎补入药,作为骨碎补正品被收载于《中国药典》(周铜水和周荣汉,1998)。研究发现,槲蕨根状茎中的柚皮甙和总黄酮含量均高于其它同类植物,是骨碎补中具有活血去瘀、接骨疗伤和增强心肌细胞机能作用的主要活性成分(周铜水等,1997;周荣汉和段金廒,2005)。目前市售的骨碎补药材70%来源于槲蕨根状茎(周铜水和周荣汉,1998),然而,人工繁殖和栽培槲蕨的工作刚刚起步,传统的槲蕨药材完全来源于野生槲蕨的采挖。由于市场需求量大,导致野生槲蕨资源被过度开采,也严重破坏了槲蕨生存的生态环境。2002年,槲蕨已被建议列入国家濒危保护植物名录(张宪春,2002)。开展对槲蕨的人工繁育技术研究有助于促进槲蕨产业发展、保护槲蕨野生资源、缓解生态环境恶化。
近年来槲蕨的人工繁殖技术已有一些报道,专利《槲蕨的一种繁殖方法》(cn1788549a)首次建立了槲蕨的离体培养体系,随后,专利《一种槲蕨的快速繁殖方法》(cn103430853a)和专利《一种槲蕨的离体保存方法》(cn105660415a)分别报道了基于组培技术对槲蕨进行愈伤诱导离体快繁和离体保存的方法。另外,专利《一种槲蕨种苗周年繁育方法》(cn106613809a)、《一种槲蕨人工繁殖方法》(cn109691372a)、《一种提高槲蕨根茎繁殖率的方法》(cn110337926a)均对槲蕨人工栽培技术进行了研究报道。
槲蕨孢子播种生长缓慢,且存在萌发率低、生长周期长等问题。组织培养因具有不受环境、时间等外界因素的影响和高效等特点,被广泛的运用于植物的规模化生产和科学研究中。目前报道的槲蕨组织培养体系所用外植体为成熟孢子,从孢子采集、灭菌培养到得到种苗依然需要较长时间。受孢子量和生活力的影响,若想周年生产,需要一个专门培养成年植株收获孢子的苗圃,不然孢子量不能保证,野外采集还可能出现不同种孢子混杂的风险,不是很适合槲蕨种苗的规模化生产。
专利《一种槲蕨的快速繁殖方法》(cn103430853a)的组培体系报道了愈伤组织的获得和四倍体的诱导,但由于愈伤组织易发生变异,若采用愈伤增殖分化的方法,对于槲蕨的大规模人工繁殖存在一定的风险。
技术实现要素:
为解决上述问题,本发明提供一种基于体细胞胚胎途径的槲蕨种苗离体快繁方法,该发明可以快速得到槲蕨的体细胞胚胎,促进种苗的形成,提高繁殖效率,将对槲蕨野生资源的保护和开发利用发挥重要的促进作用。
本发明的方法包括如下步骤:外植体的获得;外植体预培养;外植体继代培养;体细胞胚胎分离和接种培养。
外植体的获得:将槲蕨孢子无菌播种于孢子萌发培养基中,置于培养室,待孢子萌发并发育至配子体时期,在培养容器中添加无菌水,促进幼孢子体的形成。
外植体预培养:以1/2ms为基本培养基,添加一定浓度的6-ba、7g/l琼脂、3%蔗糖,在高温高压灭菌前将ph调至5.8,得到诱导体细胞胚的培养基,将幼孢子体叶片剪下接种至该培养基中,置于培养室预培养7天。
其中,所述的诱导体细胞胚的培养基为添加0-3mg/l6-ba、3%蔗糖的1/2ms培养基,优选的,所述的诱导体细胞胚的培养基为添加0.5-2mg/l6-ba、3%蔗糖的1/2ms培养基,更优选的,所述的诱导体细胞胚的培养基为添加1mg/l6-ba、3%蔗糖的1/2ms培养基。
外植体继代培养:将预培养7天的叶片外植体转接于含有不同浓度的蔗糖的1/2ms培养基中,置于培养室,培养条件同上;优选的,蔗糖浓度为3-5%,更优选3%。
体细胞胚胎分离和成苗培养:将产生的体细胞胚从外植体上剥离,接种至1/2ms+3%蔗糖+0.3%ac培养基,置于培养室,培养条件同上。
其中,培养条件:培养室温度为25±1℃,光照强度为50~60μmol/(m2·s),光周期为16/8h,湿度为30%。
本发明从槲蕨孢子萌发开始,产生幼孢子体外植体约100天,诱导产生体细胞胚胎约70天,体细胞胚胎培养成可出瓶移栽的种苗约150天,即,从孢子萌发开始至种苗形成共需320天。并且,体细胞胚胎形成的幼苗,其叶片可直接作为外植体,用于诱导体细胞胚胎,剪下叶片对幼嫩根状茎生长发育的影响很小,如此操作,可使槲蕨种苗的繁殖周期进一步缩短。由此可见,本发明可以快速获得槲蕨孢子体种苗,诱导效率高,成苗周期短,由于是通过体细胞胚胎发生途径产生的孢子体种苗,还大大降低了变异的风险。
附图说明
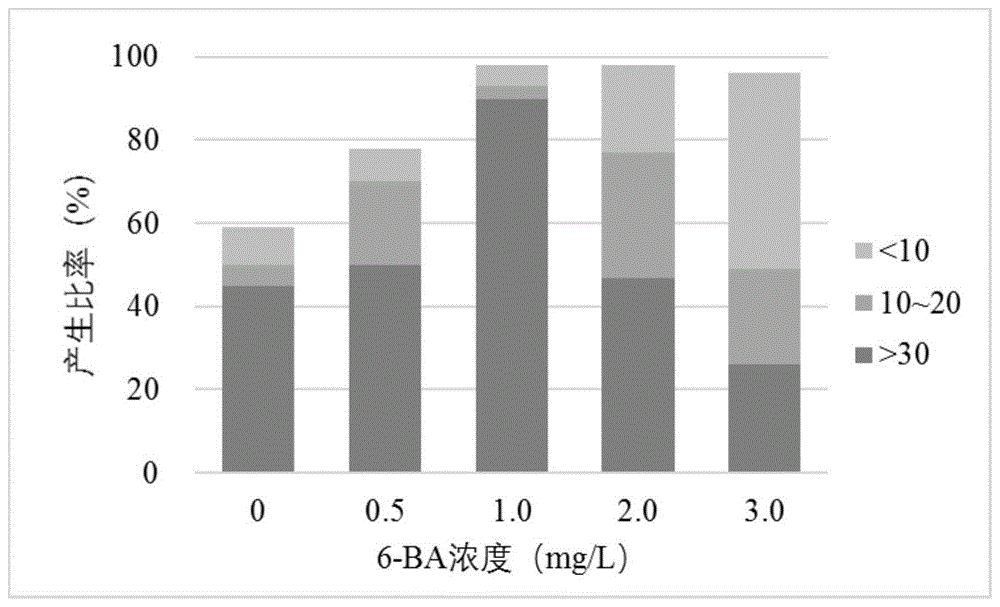
图1所示为6-ba对槲蕨体细胞胚胎发生的影响。
图2所示为蔗糖浓度对槲蕨体细胞胚胎发生的影响。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
试剂:ms粉、6-ba、蔗糖、琼脂、无菌水等。
仪器设备:超净工作台、高压灭菌锅、体式显微镜、离心机、振荡器等;
基本培养基:以1/2ms为基本培养基,添加7g/l琼脂,高压灭菌前调ph值为5.8~5.9;
孢子灭菌:称取20mg成熟孢子置于1.5ml无菌离心管中,加入无菌水冲洗1遍,然后滴入1ml5%naclo溶液,振荡混匀,灭菌5分钟,无菌水冲洗3-5次,最后加入1ml无菌水,获得无菌的孢子悬浮液;
孢子的无菌播种:在充分冷却凝固的萌发培养基中加入少量无菌水使培养基表面润滑,吸取孢子悬浮液100μl均匀接种于培养基上;先在黑暗处放置24h,再放回正常光照条件下使孢子能够同步萌发;
培养室条件:温度25±1℃,光照强度50~60μmol/(m2·s),光周期16/8h,湿度30%;
外植体的获得:待孢子萌发并发育至配子体时期,在培养容器中添加无菌水,促进幼孢子体的形成;
外植体预培养:在基本培养基中添加一定浓度的6-ba(0、0.5、1.0、2.0、3.0mg/l),得到诱导体细胞胚的培养基,将幼孢子体产生的叶片剪下接种至该培养基中,置于培养室预培养7天;
继代培养:将预培养7天的叶片外植体转接于基本培养基中,置于培养室继续培养60天;另外,将预先在1/2ms+6-ba2.0mg/l培养基中培养7天的叶片外植体,分别接种于含有不同浓度的蔗糖(1%、2%、3%、4%、5%)的1/2ms培养基中,观察蔗糖浓度对外植体的产生体细胞胚的效率的影响;
体细胞胚胎分离和成苗培养:将产生的体细胞胚从外植体上剥离,接种至1/2ms+3%蔗糖+0.3%ac培养基,置于培养室,每隔30天继代一次,直至幼孢子体根状茎长约0.5~0.7cm。
实施例1ba预处理对槲蕨体细胞胚胎发生的影响
将槲蕨孢子离体萌发产生的幼孢子叶片接种在含不同浓度6-ba(0、0.5、1.0、2.0、3.0mg/l)的预处理培养基中,预培养7天后,转接至无激素的基本培养基中,继续培养60天后,在体式显微镜下观察统计外植体产生体细胞胚胎的状况。
外植体产生体细胞胚效率的统计:外植体在1/2ms培养基中培养60天后,在体式显微镜下观察并统计每个外植体上产生体细胞胚的数量,计算产生比率,产生比率=(产生n个体细胞胚胎的外植体个数/产生体细胞胚的外植体个数)×100%,n为>30、10~20、<10。
统计显示,各处理均可使外植体产生体细胞胚胎,其中,1.0mg/l及以上浓度可使诱导效率几乎接近100%,但每个外植体产生体细胞胚胎的数量存在一定差异,6-ba浓度为0.5-1.5mg/l时,单个外植体产生30个以上体细胞胚胎的效率可达50%(图1)。将产生的体细胞胚从外植体上剥离,接种至1/2ms+3%蔗糖+0.3%ac培养基,150天后幼孢子体根状茎长约0.5~0.7cm。
实施例2蔗糖浓度对槲蕨体细胞胚胎发生的影响
将槲蕨孢子离体萌发产生的幼孢子叶片接种在含6-ba2.0mg/l的预处理培养基中,预培养7天后,转接至含有不同浓度的蔗糖(1%、2%、3%、4%、5%)的基本培养基中,继续培养60天后,在体式显微镜下观察统计外植体产生体细胞胚胎的状况。
外植体产生体细胞胚效率的统计:外植体在1/2ms培养基中培养60天后,在体式显微镜下观察并统计每个外植体上产生体细胞胚的数量,计算产生比率,产生比率=(产生n个体细胞胚胎的外植体个数/产生体细胞胚的外植体个数)×100%,n为>30、10~20、<10。
统计显示,预培养基中蔗糖浓度对体细胞胚胎的产生有一定的促进作用,3~5%的蔗糖处理,获得30个以上体细胞胚胎的外植体数量显著高于低浓度蔗糖处理,可达55%以上(图2)。将产生的体细胞胚从外植体上剥离,接种至1/2ms+3%蔗糖+0.3%ac培养基,150天后幼孢子体根状茎长约0.5~0.7cm。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!