一种植物组织培养的培养基及其应用
1.本发明涉及农业生产技术领域,特别是涉及一种植物组织培养的培养基及其应用。
背景技术:
2.植物的组织培养又叫离体培养,是指从植物体分离出符合需要的组织、器官或细胞,原生质体等,通过无菌操作,在无菌条件下接种在含有各种营养物质及植物生长调节剂的培养基上进行培养以获得再生的完整植株或生产具有经济价值的其他产品的技术。培养基是植物组织培养过程必不可少的物质,而通常,琼脂(或卡拉胶等)被广泛作为植物组织培养的培养基中的培养基支持体使用。但是,带琼脂(或卡拉胶等)的培养基是一种固体凝胶,可能导致培养组织所产生的废物和有害物质扩散比较缓慢,以致对某些植物产生毒害。同时,组培苗移栽时,由于琼脂(或卡拉胶等)支持物的亲水特性,造成植物根系表面附着大量培养基,若彻底洗净根系琼脂,耗时费力还容易损伤植株根系。如果琼脂(或卡拉胶等)没有清洗干净,容易造成组培苗发霉或腐烂,进而导致植株移栽后的成活率低等问题存在,因此,需要提供一种新的培养基或者新的植物组织培养方法,以解决现有技术中由于琼脂作为培养基支持体所带来的问题。
技术实现要素:
3.针对现有技术的不足,本发明提供了一种植物组织培养的培养基及其应用方法,以解决上述现有技术存在的问题,用聚丙烯纤维作为培养基支持体构建植物组织培养的培养基,利用此培养基进行朱顶红等植物组织培养,可以省时省工,还可显著提高朱顶红组培繁殖效率。朱顶红植株再生率最高可达100%,平均每个外植体最多可产生40.5棵小植株。
4.本发明提供一种植物组织培养的培养基,其为在植物组织培养的基础培养基的基础上,按照每升所述基础培养基添加2.5~20.0g聚丙烯纤维构成;所述基础培养基包括外植体诱导体细胞胚阶段所用的诱导培养基、植株再生阶段所用的再生培养基。
5.本发明还提供一种植物组织培养的培养基,其为在植物组织培养的基础培养基的基础上,按照每升所述基础培养基添加2.5~20.0g聚丙烯纤维构成;
6.所述基础培养基包括外植体诱导体细胞胚阶段所用的诱导培养基、植株再生阶段所用的再生培养基。
7.本发明还提供一种植物组织培养快繁的方法,包括以下步骤:
8.步骤1,体细胞胚诱导:将植物外植体接种到所述的培养基中的聚丙烯纤维上,并使所述外植体基部接触到诱导培养基,诱导培养成体细胞胚;其中,所述诱导培养基包括以下组分:ms培养基+0~6.0mg/l 6
‑
苄基氨基腺嘌呤+2.5~20.0g/l聚丙烯纤维+20~40g/l蔗糖,ph6.2~6.4;在24~26℃,黑暗条件下培养,叶片的外表面产生体细胞胚;
9.步骤2,植株再生:待外植体产生体细胞胚后,吸出诱导培养基,并添加等量的再生培养基,并使所述体细胞胚接触到再生培养基,在24~26℃,每日12~14h光照环境下培养,
体细胞胚萌发形成完整植株;所述再生培养基包括以下组分:ms培养基+0~3.0mg/l 6
‑
糠基氨基嘌呤+2.5~20.0g/l聚丙烯纤维+20~40g/l蔗糖,ph6.2~6.4;
10.步骤3,移栽:将所得植株连同聚丙烯纤维或者去除根部的聚丙烯纤维后,移栽至温室中,进行正常管理培养。
11.优选的是,取朱顶红试管苗新叶,垂直于叶片纵轴进行横切,将叶片切成适宜长度片段作为外植体。
12.优选的是,选取长出新叶的长度为0.5~5.0cm;叶片切成适宜长度片段为0.5~1.0cm。
13.优选的是,步骤1和步骤2中所述聚丙烯纤维与相应培养基按照7.5~12.5g:1l的比例添加。
14.优选的是,步骤1中,所述诱导培养基包括以下组分:ms培养基+0~5.0mg/l6
‑
苄基氨基腺嘌呤+2.5~20.0g/l聚丙烯纤维+20~40g/l蔗糖,ph6.2~6.4。
15.优选的是,步骤2中,所述再生培养基包括以下组分:ms培养基+0~2.0mg/l6
‑
糠基氨基嘌呤+2.5~20.0g/l聚丙烯纤维+20~40g/l蔗糖,ph6.2~6.4。
16.优选的是,步骤2中,光照强度均为1600~2000lux。
17.优选的是,步骤1和步骤2中,培养时间均为4~8周。
18.本发明还提供所述的培养基在植物组织培养中的应用,应用于如下(1)或(2)中:
19.(1)提高诱导培养阶段体细胞胚的诱导率;
20.(2)提高再生培养阶段植株再生率。
21.与现有技术相比,本发明的有益效果在于:
22.(1)可有效减轻褐化。由于采用液体培养,增加了培养基流动性,外植体伤口等产生的酚类物质易于迅速扩散,可有效降低外植体褐化。
23.(2)简化再生培养流程。植株再生培养时,可沿用原有培养容器,直接在超净台中更换新鲜液体培养基,简化了操作流程。
24.(3)简化移栽流程,降低组培苗损伤。移栽温室时,由于聚丙烯纤维具有疏水性,聚丙烯纤维及植物根系上不容易附着液体培养基,可以将植株连同聚丙烯纤维一起直接移栽;或者将植株与支持物分离后,植株直接移栽。可以免去组培苗清洗根部琼脂的繁琐流程,还能有效降低因清洗根部对组培苗带来的损伤,可以节省大量时间和人力。
25.(4)组培苗移栽时,可将聚丙烯纤维与植株分离,进行重复使用,有效降低生产成本。
26.(5)综合各项改进,本发明优化并建立了朱顶红高效的体细胞胚发生途径的植株再生体系,其体细胞胚诱导率最高达100%,植株再生率最高达100%,平均每个外植体最多可产生40.5棵小植株。与现有技术相比,植株的再生效率明显提高。
具体实施方式
27.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
28.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每
个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
29.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
30.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本技术说明书和实施例仅是示例性的。
31.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
32.以下实施例以朱顶红的组织培养为例对本发明的技术方案进一步说明。
33.实施例1一种朱顶红组织培养快繁的方法
34.(1)外植体诱导体细胞胚
35.诱导培养基配制:以ms培养基为基本培养基,并添加20g/l蔗糖,ph6.2。将培养基分装于组织培养容器中,然后添加聚丙烯纤维,以每升液体培养基添加2.5g的量添加。密封后进行121℃高温高压灭菌20分钟。
36.接种培养:待朱顶红试管苗新叶长成长度0.5cm时,在超净台中,垂直于叶片纵轴进行横切,将叶片切成长度为0.5cm片段作为外植体。
37.将外植体接种于聚丙烯纤维上,并使外植体基部接触到上述诱导培养基,在24℃,黑暗条件下培养4周,叶片的外表面诱导培养成体细胞胚。
38.(2)植株再生
39.待外植体产生体细胞胚后,在超净台中打开培养容器,吸出诱导培养基,并添加等量的再生培养基,并使所述体细胞胚接触到再生培养基,在24℃,每日12h光照环境(光照强度1600lux)下培养4周,体细胞胚萌发形成完整植株;所述再生培养基包括以下组分:ms培养基+2.5g/l聚丙烯纤维+20g/l蔗糖,ph6.2。
40.(3)植株移栽
41.将植株连同聚丙烯纤维一起从培养容器中取出,然后直接移栽至温室中,以泥炭等为基质,栽植后浇水,然后进行正常管理。移栽时,亦可从根部取下聚丙烯纤维后,将植株直接移栽,聚丙烯纤维可重复使用。
42.实施例2一种朱顶红组织培养快繁的方法
43.(1)外植体诱导体细胞胚
44.诱导培养基配制:以ms培养基为基本培养基,并添加25g/l蔗糖,1.0mg/l 6
‑
苄基氨基腺嘌呤,ph6.2。将培养基分装于组织培养容器中,然后添加聚丙烯纤维,以每升液体培养基添加5.0g的量添加。密封后进行121℃高温高压灭菌20分钟。
45.接种培养:待朱顶红试管苗新叶长成长度1.5cm时,在超净台中,垂直于叶片纵轴进行横切,将叶片切成长度为0.8cm片段作为外植体。
46.将外植体接种于聚丙烯纤维上,并使外植体基部接触到上述诱导培养基,在24℃,黑暗条件下培养5周,叶片的外表面诱导培养成体细胞胚。
47.(2)植株再生
48.待外植体产生体细胞胚后,在超净台中打开培养容器,吸出诱导培养基,并添加等量的再生培养基,并使所述体细胞胚接触到再生培养基,在24℃,每日13h光照环境(光照强度1700lux)下培养5周,体细胞胚萌发形成完整植株;所述再生培养基包括以下组分:ms培养基+1.0mg/l6
‑
糠基氨基嘌呤+5g/l聚丙烯纤维+25g/l蔗糖,ph6.2。
49.(3)植株移栽
50.将植株连同聚丙烯纤维一起从培养容器中取出,然后直接移栽至温室中,以泥炭等为基质,栽植后浇水,然后进行正常管理。移栽时,亦可从根部取下聚丙烯纤维后,将植株直接移栽,聚丙烯纤维可重复使用。
51.实施例3一种朱顶红组织培养快繁的方法
52.(1)外植体诱导体细胞胚
53.诱导培养基配制:以ms培养基为基本培养基,并添加30g/l蔗糖,2.0mg/l 6
‑
苄基氨基腺嘌呤,ph6.3。将培养基分装于组织培养容器中,然后添加聚丙烯纤维,以每升液体培养基添加7.5g的量添加。密封后进行121℃高温高压灭菌20分钟。
54.接种培养:待朱顶红试管苗新叶长成长度2.5cm时,在超净台中,垂直于叶片纵轴进行横切,将叶片切成长度为0.8cm片段作为外植体。
55.将外植体接种于聚丙烯纤维上,并使外植体基部接触到上述诱导培养基,在25℃,黑暗条件下培养5周,叶片的外表面诱导培养成体细胞胚。
56.(2)植株再生
57.待外植体产生体细胞胚后,在超净台中打开培养容器,吸出诱导培养基,并添加等量的再生培养基,并使所述体细胞胚接触到再生培养基,在25℃,每日13h光照环境(光照强度1800lux)下培养5周,体细胞胚萌发形成完整植株;所述再生培养基包括以下组分:ms培养基+1.5mg/l6
‑
糠基氨基嘌呤+7.5g/l聚丙烯纤维+30g/l蔗糖,ph6.3。
58.(3)植株移栽
59.将植株连同聚丙烯纤维一起从培养容器中取出,然后直接移栽至温室中,以泥炭等为基质,栽植后浇水,然后进行正常管理。移栽时,亦可从根部取下聚丙烯纤维后,将植株直接移栽,聚丙烯纤维可重复使用。
60.实施例4一种朱顶红组织培养快繁的方法
61.(1)外植体诱导体细胞胚
62.诱导培养基配制:以ms培养基为基本培养基,并添加30g/l蔗糖,3.0mg/l 6
‑
苄基氨基腺嘌呤,ph6.4。将培养基分装于组织培养容器中,然后添加聚丙烯纤维,以每升液体培养基添加10.0g的量添加。密封后进行121℃高温高压灭菌20分钟。
63.接种培养:待朱顶红试管苗新叶长成长度3.5cm时,在超净台中,垂直于叶片纵轴进行横切,将叶片切成长度为1.0cm片段作为外植体。
64.将外植体接种于聚丙烯纤维上,并使外植体基部接触到上述诱导培养基,在25℃,黑暗条件下培养6周,叶片的外表面诱导培养成体细胞胚。
65.(2)植株再生
66.待外植体产生体细胞胚后,在超净台中打开培养容器,吸出诱导培养基,并添加等量的再生培养基,并使所述体细胞胚接触到再生培养基,在25℃,每日13h光照环境(光照强度1900lux)下培养6周,体细胞胚萌发形成完整植株;所述再生培养基包括以下组分:ms培养基+1.0mg/l6
‑
糠基氨基嘌呤+10.0g/l聚丙烯纤维+30g/l蔗糖,ph6.3。
67.(3)植株移栽
68.将植株连同聚丙烯纤维一起从培养容器中取出,然后直接移栽至温室中,以泥炭等为基质,栽植后浇水,然后进行正常管理。移栽时,亦可从根部取下聚丙烯纤维后,将植株直接移栽,聚丙烯纤维可重复使用。
69.实施例5一种朱顶红组织培养快繁的方法
70.(1)外植体诱导体细胞胚
71.诱导培养基配制:以ms培养基为基本培养基,并添加35g/l蔗糖,4.0mg/l 6
‑
苄基氨基腺嘌呤,ph6.4。将培养基分装于组织培养容器中,然后添加聚丙烯纤维,以每升液体培养基添加10.0g的量添加。密封后进行121℃高温高压灭菌20分钟。
72.接种培养:待朱顶红试管苗新叶长成长度4.5cm时,在超净台中,垂直于叶片纵轴进行横切,将叶片切成长度为1.0cm片段作为外植体。
73.将外植体接种于聚丙烯纤维上,并使外植体基部接触到上述诱导培养基,在25℃,黑暗条件下培养7周,叶片的外表面诱导培养成体细胞胚。
74.(2)植株再生
75.待外植体产生体细胞胚后,在超净台中打开培养容器,吸出诱导培养基,并添加等量的再生培养基,并使所述体细胞胚接触到再生培养基,在25℃,每日13h光照环境(光照强度2000lux)下培养7周,体细胞胚萌发形成完整植株;所述再生培养基包括以下组分:ms培养基+2.5mg/l6
‑
糠基氨基嘌呤+10.0g/l聚丙烯纤维+30g/l蔗糖,ph6.3。
76.(3)植株移栽
77.将植株连同聚丙烯纤维一起从培养容器中取出,然后直接移栽至温室中,以泥炭等为基质,栽植后浇水,然后进行正常管理。移栽时,亦可从根部取下聚丙烯纤维后,将植株直接移栽,聚丙烯纤维可重复使用。
78.实施例6一种朱顶红组织培养快繁的方法
79.(1)外植体诱导体细胞胚
80.诱导培养基配制:以ms培养基为基本培养基,并添加40g/l蔗糖,6.0mg/l 6
‑
苄基氨基腺嘌呤,ph6.4。将培养基分装于组织培养容器中,然后添加聚丙烯纤维,以每升液体培养基添加20.0g的量添加。密封后进行121℃高温高压灭菌20分钟。
81.接种培养:待朱顶红试管苗新叶长成长度5.0cm时,在超净台中,垂直于叶片纵轴进行横切,将叶片切成长度为1.0cm片段作为外植体。
82.将外植体接种于聚丙烯纤维上,并使外植体基部接触到上述诱导培养基,在25℃,黑暗条件下培养8周,叶片的外表面诱导培养成体细胞胚。
83.(2)植株再生
84.待外植体产生体细胞胚后,在超净台中打开培养容器,吸出诱导培养基,并添加等量的再生培养基,并使所述体细胞胚接触到再生培养基,在26℃,每日14h光照环境(光照强度2000lux)下培养8周,体细胞胚萌发形成完整植株;所述再生培养基包括以下组分:ms培
养基+3.0mg/l6
‑
糠基氨基嘌呤+20.0g/l聚丙烯纤维+40g/l蔗糖,ph6.4。
85.(3)植株移栽
86.将植株连同聚丙烯纤维一起从培养容器中取出,然后直接移栽至温室中,以泥炭等为基质,栽植后浇水,然后进行正常管理。移栽时,亦可从根部取下聚丙烯纤维后,将植株直接移栽,聚丙烯纤维可重复使用。
87.为了证明在植物组织培养的培养基中添加不同量的聚丙烯纤维以及植物生长调节剂对体细胞胚诱导率、植株再生率具有显著的影响,本发明在实施例4的基础上通过调节培养基不同成分,统计了体细胞胚诱导率和植株再生率。
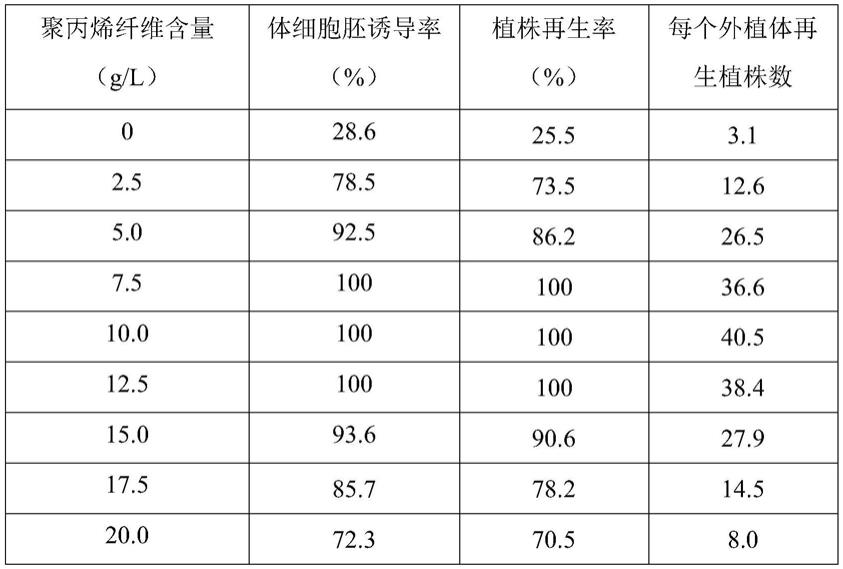
88.在实施例4基础上,只改变步骤1和步骤2中聚丙烯纤维的添加量,其他不变。统计体细胞诱导率和植物再生率的结果如表1所示。
89.表1培养基聚丙烯纤维含量对朱顶红体细胞胚诱导和植株再生的影响
[0090][0091]
在实施例4基础上,只改变步骤1中诱导培养基中6
‑
苄基氨基腺嘌呤(6
‑
ba)添加量,其他不变。统计体细胞诱导率的结果如表2所示。
[0092]
表2培养基6
‑
苄基氨基腺嘌呤(6
‑
ba)含量对朱顶红体细胞胚诱导的影响
[0093]
[0094][0095]
在实施例4基础上,只改变步骤2中再生培养基中6
‑
糠基氨基嘌呤(kt)添加量,其他不变。统计植株再生率和每个外植体再生植株数的结果如表3所示。
[0096]
表3培养基6
‑
糠基氨基嘌呤(kt)含量对朱顶红植株再生的影响
[0097]
kt含量(mg/l)植株再生率(%)每个外植体再生植株数055.610.50.584.830.61.010040.51.510032.42.088.525.62.574.316.83.061.211.3
[0098]
上述表1
‑
表3中,体细胞胚诱导率(%)=形成体细胞胚的外植体数
÷
外植体总数
×
100%;植株再生率(%)=再生植株的外植体数
÷
外植体总数
×
100%;每个外植体再生植株数=再生植株总数
÷
外植体总数。
[0099]
从表1
‑
3中可以看出,培养基中聚丙烯纤维、6
‑
ba以及6
‑
kt的添加对体细胞胚形成以及再生植株的产生有直接影响。通过分析发现,诱导培养基和再生培养培养基中聚丙烯纤维添加量为7.5~12.5g/l时,体细胞胚诱导率和植株再生率均可达到100%,每个外植体再生植株数最高可达40.5个;同时,在聚丙烯纤维添加量为10g/l的基础上,诱导培养基中添加3.0mg/l 6
‑
ba可以使体细胞胚诱导率达到100%,再生培养基中添加1.0mg/l 6
‑
kt可以使植株再生率达到100%,每个外植体再生植株数达40.5个。可见,相比对照,在培养基中添加聚丙烯纤维和植物生长调节剂能够显著提高体细胞胚诱导率、植株再生率以及每个外植体再生植株数。
[0100]
根据上述实施例以及所得的试验结果分析,效果显著的原因之一可能由于聚丙烯纤维添加到植物组织培养基中存在如下优势:
[0101]
1、该支持体物理性质稳定,能够耐受121℃的高温高压灭菌。
[0102]
2、该支持体化学性质稳定,长期置于液体培养基中不变质,不会释放有毒有害物质,不改变培养基组成和ph,不影响植物生长。
[0103]
3、该支持体蓬松,孔隙大,植物培养过程中,培养组织所产生的有害物质可以迅速扩散,减轻有害物质对植物的伤害。
[0104]
4、该支持体具有疏水性,优点表现在:(1)培养过程中,可以及时更换新鲜液体培养基。由于具有疏水性,更换培养基时,可直接吸出旧液体培养基,旧培养基不会残留在支
持体表面。(2)由于疏水性,液体培养基不会附着在支持体表面,植物培养结束后,若无须分离该支持体,试管苗可沥干液体培养基直接移栽,省时省力。(3)植物培养结束后,若需分离该支持体,试管苗由于疏水性,试管苗根系极容易与其分离,省时省力,同时,便于支持体回收重复利用,节省成本。
[0105]
5、该支持体不易变形,可作为无土栽培介质,植物培养结束后,试管苗可连同支持物一起取出,直接转入营养液无土栽培模式,移栽过程省时、省力、省成本。
[0106]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1