利用体外反搏技术评价自主神经调节功能的方法和系统与流程
本申请大体上涉及医疗领域。更具体而言,本申请提供了利用体外反搏技术评价自主神经调节功能的方法和系统。
发明背景
体外反搏(External counterpulsation,ECP)是一种无创的用以增加器官血流灌注的方法,其在治疗方面的效果已得到循证医学研究的证实。目前,中国、美国以及一些欧洲国家都已将体外反搏纳入治疗缺血性心脏病的治疗指南。本申请的发明人已经开展了体外反搏治疗缺血性脑卒中的测试,并证实其可以改善急性脑卒中患者的临床预后。
自主神经系统是外周传出神经系统的一部分,由交感神经系统和副交感神经系统两部分组成,能够支配和调节机体器官、血管、平滑肌的活动以及腺体的分泌,对调节机体心率和血压以及维持内环境稳定起重要作用。目前,评价自主神经调节功能方法主要包括心率变异性和血压变异性衡量,例如瓦耳萨耳瓦氏(Valsalva)试验、深呼吸试验、持续握持手柄试验和直立体位试验。瓦耳萨耳瓦氏试验是令病人强行闭呼动作,即,深吸气后紧闭声门,再用力做呼气动作,通过增加胸内压来影响血液循环和自主神经功能状态,进而达到测试目的的一种临床生理试验。深呼吸试验是训练患者维持进行每分钟6次深呼吸动作。持续握持手柄试验测量患者最大握持手柄力量,然后以最大力的30%握持手柄并维持5分钟,观察舒张压的改变。直立体位试验中患者从平躺到直立,观察收缩压的改变。以上评估方法需要患者的配合并且要求患者的一般状况良好。但是,对于例如患有脑部疾病(例如,脑卒中或脑外伤)的患者或对于具有某些身体残疾或神志不清而无法配合测试的患者,以上评估方法的应用就会受到限制。
在医学领域中开发体外反搏除治疗功能之外的新用途是有前景的, 同时本领域中也需要新的评价自主神经调节功能的方法和系统。
发明概述
第一方面,本申请提供了评价个体自主神经调节功能的方法,包括以下步骤:
a)对所述个体施加体外反搏操作;
b)在体外反搏操作前、体外反搏操作期间以及体外反搏操作后,对所述个体进行连续性血压和心率监测;以及
c)记录所述个体响应于体外反搏操作的血压变异性和心率变异性,并基于此评价所述个体的自主神经调节功能。
在一些实施方案中,个体为脑部疾病患者。
在一些实施方案中,个体为脑外伤患者或脑卒中患者。
在一些实施方案中,个体为急性脑卒中患者。
在一些实施方案中,个体为无清醒意识的患者。
在一些实施方案中,体外反搏操作包括:在心脏舒张初期向个体的肢体部加正压,并且在心脏舒张末期解除加压。
在一些实施方案中,肢体为下肢。
在一些实施方案中,加压部位为小腿、大腿和/或臀部。
在一些实施方案中,通过心电图监测使加正压与R波同步触发。
在一些实施方案中,所施加的正压为0.02-0.04Mpa。
在一些实施方案中,加正压步骤为按照小腿、大腿、臀部的顺序连续依次加压。
在一些实施方案中,连续性血压监测是基于容积补偿法。
在一些实施方案中,步骤c)包括将受试个体响应于体外反搏操作的血压变异性和心率变异性与健康对照者响应于体外反搏操作的血压变异性和心率变异性相比较,如果受试个体的血压变异性和心率变异性显著增高,则提示受试个体的自主神经调节功能受损。
在一些实施方案中,健康对照者响应于体外反搏操作的血压变异性和心率变异性为事先已建立的数据。
第二方面,本申请提供了用于评价个体自主神经调节功能的系统, 其包括:
体外反搏装置,其被配置为能够用于向个体施加体外反搏操作;和
监测装置,其被配置为能够用于对个体进行连续性血压和心率监测。
在一些实施方案中,系统还包括分析装置,其被配置为能够基于从所述监测装置获得的数据分析个体响应于体外反搏操作的血压变异性和心率变异性。
在一些实施方案中,系统还包括评价装置,其被配置为能够基于从所述分析装置获得的血压变异性和心率变异性评价个体的自主神经调节功能。
在一些实施方案中,评价装置被配置为将受试个体响应于体外反搏操作的血压变异性和心率变异性与健康对照者响应于体外反搏操作的血压变异性和心率变异性相比较,如果受试个体的血压变异性和心率变异性显著增高,则提示受试个体的自主神经调节功能受损。在一些实施方案中,健康对照者响应于体外反搏操作的血压变异性和心率变异性为事先已建立的数据,任选地,可以储存于评价装置中。
在一些实施方案中,分析装置和/或评价装置作为功能模块整合于监测装置中。
在一些实施方案中,体外反搏装置包括能够施加于个体肢体外部的囊以及配置为能够使所述囊膨胀或排空的压力控制装置。
在一些实施方案中,体外反搏装置还包括心电监测装置。
在一些实施方案中,监测装置是基于容积补偿法对个体进行连续性血压监测。
附图说明
本申请的一些具体实施方案体现于附图中,其中:
图1展示了体外反搏技术的示例性工作原理和设备;
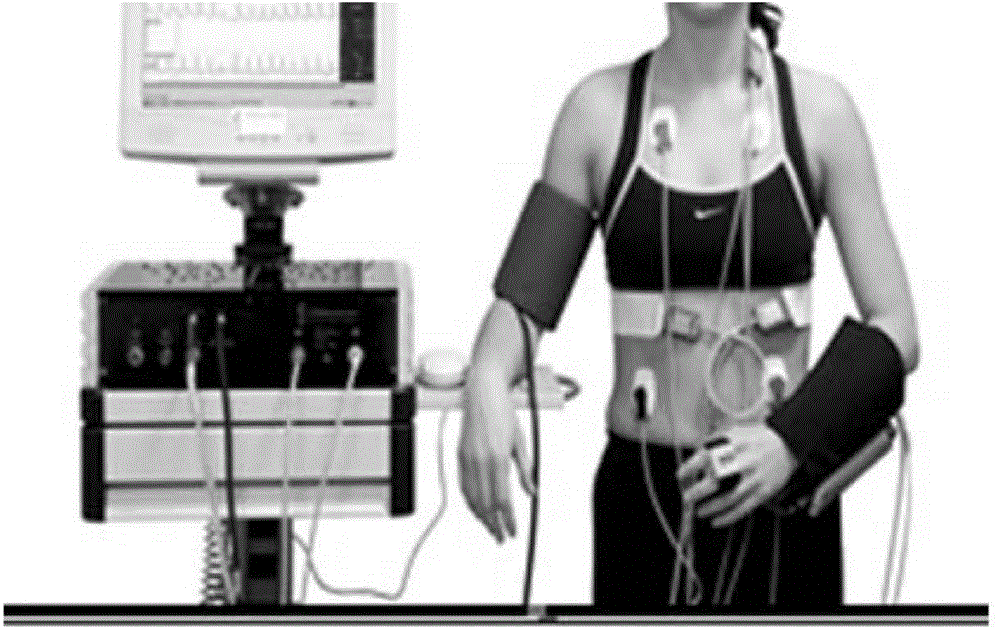
图2展示了用于连续性血压和心率监测的示例性设备;
图3展示了本申请的方法和系统的示例性工作状态;
图4A-4D展示了在示例性实施方案中,在体外反搏过程中,在不同的加压下,对照个体以及脑卒中患者的心率(4A)和血压(包括收缩压(4A)、 舒张压(4B)和平均血压(4C))的变化。
图5展示了示例性实施方案中的心率变异性分析图,其中时间轴1-3分钟代表体外反搏处理前的基线值,3-6分钟代表0.02Mpa压力下的体外反搏处理的数值,6-9分钟代表0.025Mpa压力下数值,9-12分钟代表0.03Mpa压力下数值,12-15分钟代表0.035Mpa压力下数值,15-18分钟代表终止体外反搏处理后第一个3分钟数值,18-21分钟代表终止体外反搏处理后第二个3分钟数值。
图6展示了示例性实施方案中的血压变异性分析图,其中时间轴1-3分钟代表体外反搏处理前的基线值,3-6分钟代表0.02Mpa压力下的体外反搏处理的数值,6-9分钟代表0.025Mpa压力下数值,9-12分钟代表0.03Mpa压力下数值,12-15分钟代表0.035Mpa压力下数值,15-18分钟代表终止体外反搏处理后第一个3分钟数值,18-21分钟代表终止体外反搏处理后第二个3分钟数值。
具体实施方式
为了进一步地展示本申请的特征和优势,以下对一些具体实施方案进行描述。应当理解,以下描述仅出于说明的目的,而并不是以任何方式加以限制。还应当理解,结合某一实施方案描述的技术特征也适用于其他实施方案,并且可以与结合其他实施方案描述的技术特征组合在一起,除非另作说明或者从上下文能够作出其他判断。
如“发明背景”部分所述,目前已有的评价自主神经调节功能方法主要包括心率变异性和血压变异性衡量,例如瓦耳萨耳瓦氏(Valsalva)试验、深呼吸试验、持续握持手柄试验和直立体位试验等。但是,以上方法在一些条件下的应用会受到限制。例如,一些方法可能会降低血压或减少脑部血液灌注,那么对于例如脑卒中或脑外伤等脑部疾患的人群,实施这样的测试会产生较大风险。再例如,上述方法均需要患者的主动配合,从而对于一些神志不清而无法配合测试的患者来说,就无法顺利地实施这些测试。
针对这样的技术问题,本申请的发明人创新地将体外反搏技术引入自主神经调节功能的评价中,从而完成了本申请的各项发明,其优势包 括以下中的一项或多项:
(1)无创式操作,安全性和顺应性好;
(2)不降低血压和脑血流灌注,提供脑部保护;
(3)对受试个体要求低,不需要进行过多的主动配合。
第一方面,本申请提供了评价个体自主神经调节功能的方法,包括以下步骤:
a)对所述个体施加体外反搏操作;
b)在体外反搏操作前、体外反搏操作期间以及体外反搏操作后,对所述个体进行连续性血压和心率监测;以及
c)记录所述个体响应于体外反搏操作的血压变异性和心率变异性,并基于此评价所述个体的自主神经调节功能。
在一些实施方案中,个体为脑部疾病患者。在一些实施方案中,个体为脑外伤患者或脑卒中患者。在一些实施方案中,个体为急性脑卒中患者。在一些实施方案中,个体为无清醒意识的患者。但是应当理解,虽然本申请的方法适合于上述类型的个体,但是在其他个体(例如健康个体)上依然可以实施本申请的方法。
在一些实施方案中,体外反搏操作包括:在心脏舒张初期向个体的肢体部加正压,并且在心脏舒张末期解除加压。在一些实施方案中,肢体为下肢。在一些实施方案中,加压部位为小腿、大腿和/或臀部。在一些实施方案中,通过心电图监测使加正压与R波同步触发。在一些实施方案中,所施加的正压为0.02-0.04Mpa。在一些实施方案中,加正压步骤为按照小腿、大腿、臀部的顺序连续依次加压。
图1展示了体外反搏技术的示例性工作原理和设备。图1中的照片显示了体外反搏技术的设备,主要包括供个体躺卧的平台和心电监测仪,平台上设置了能够施加于个体的大腿、小腿和臀部的气囊,气囊与电磁阀和气箱相通,以机械方法对气囊进行充气和排气。图1中左上的两张图描述了气囊的工作方式,其中在心脏舒张初期,按照小腿至大腿至臀部的顺序,依次对气囊进行加压,然后在心脏舒张末期同时将气囊排空减压。图1中的心电图下方的波形是指脉监测体外反搏治疗波形,箭头 代表在心脏舒张期开始启动体外反搏治疗。
作为非限制性的实例,利用图1中的设备的体外反搏技术可以如下实施:
使受试者平躺在平台上,在其大腿、小腿和臀部缚以气囊,当心脏舒张时,通过心电R波同步触发,使围绕在腿部及臀部的气囊充气,对肢体加正压0.02~0.04MPa,在心脏舒张初期依次地加压于小腿、大腿和臀部,产生舒张期增压波(diastolic augmentation,DA),在舒张末期解除所有压力,以驱动血液向主动脉返流,同时留下空的下肢血管床接受心脏输出量,由此卸载后收缩压(systolic unloading,SU)和心脏后负荷(cardiac afterload)得以降低。在体外反搏过程中,双脉动血流是独特的血流动力学特征,既能提高平均动脉压,增加组织器官的血液灌流,同时也提高了血流切应力。
在一些实施方案中,连续性血压监测是基于容积补偿法。此类型设备利用容积补偿法实现无创性连续血压测量,其技术上是基于当动脉血管由于外力作用而处于去负荷状态时外加压力等于动脉压力,血管直径不会随血压波动而变化,血管处于恒定容积状态。在利用容积补偿法连续测量血压时,在一定的范围内改变动脉血压,可同时测量脉搏的振幅随血压的变化。示例性的连续心率和血压监测设备如图2所示。
根据体外反搏操作前、体外反搏操作期间以及体外反搏操作后,对所述个体进行连续性血压和心率监测所得到的数据,可以分析得出个体响应于体外反搏操作的血压变异性和心率变异性,根据这些数据则可以对个体的自主神经调节功能作出评价。
本文所用的术语“血压变异性”的含义是本领域技术人员公知的,是指在一定时间段内血压波动的程度。通常,可以使用动态血压标准差与变异系数(CV,动态血压标准差与平均值的比值)来表示血压随时间的变异性,也可以按照一段时间内血压整体发生变化的程度表示血压变异性。本文所用的术语“心率变异性”的含义也是本领域技术人员公知的,是指心率节奏或心动周期随时间的变化情况,评价指标包括但不限于SDNN、SDANN、RMSSD、PNN50等。
在一些实施方案中,使用时域分析(time domain analysis)和频域分析 (frequency domain analysis)方法进行变异性分析。
在一些实施方案中,步骤c)包括将受试个体响应于体外反搏操作的血压变异性和心率变异性与健康对照者响应于体外反搏操作的血压变异性和心率变异性相比较,如果受试个体的血压变异性和心率变异性显著增高,则提示受试个体的自主神经调节功能受损。在一些实施方案中,包括对健康个体和受试个体实施本申请的方法,并将获得的血压变异性和心率变异性结果相比较。在一些实施方案中,健康对照者响应于体外反搏操作的血压变异性和心率变异性为事先已建立的数据。
此外,本申请的发明人发现,体外反搏对个体的血压和心率的改变能够良好地将健康个体与自主神经调节功能受损的个体的血压变异性和心率变异性区分开,从而适合于评价自主神经调节功能,这也是本申请的优势之一。
图3展示了本申请的方法的示例性实施状态。
第二方面,本申请提供了用于评价个体自主神经调节功能的系统,其包括:
体外反搏装置,其被配置为能够用于向个体施加体外反搏操作;和
监测装置,其被配置为能够用于对个体进行连续性血压和心率监测。
在一些实施方案中,系统还包括分析装置,其被配置为能够基于从所述监测装置获得的数据分析个体响应于体外反搏操作的血压变异性和心率变异性。
在一些实施方案中,系统还包括评价装置,其被配置为能够基于从所述分析装置获得的血压变异性和心率变异性评价个体的自主神经调节功能。
在一些实施方案中,评价装置被配置为将受试个体响应于体外反搏操作的血压变异性和心率变异性与健康对照者响应于体外反搏操作的血压变异性和心率变异性相比较,如果受试个体的血压变异性和心率变异性显著增高,则提示受试个体的自主神经调节功能受损。在一些实施方案中,健康对照者响应于体外反搏操作的血压变异性和心率变异性为事先已建立的数据,任选地,可以储存于评价装置中。
应当理解,上述分析装置和/或评价装置并不是本申请的系统所必需 的。例如,分析过程可以借助于单独的计算机来完成,而评价过程也可以由医师根据分析结果进行人为判断。在一些实施方案中,出于系统的整合性和使用方便性的目的,将分析装置和/或评价装置作为功能模块整合于监测装置中。
在一些实施方案中,体外反搏装置包括能够施加于个体肢体外部的囊以及配置为能够使所述囊膨胀或排空的压力控制装置。
在一些实施方案中,体外反搏装置还包括心电监测装置。
在一些实施方案中,监测装置是基于容积补偿法对个体进行连续性血压监测。
上文所述的体外反搏装置和监测装置的工作原理是本领域技术人员公知的,并且目前在市场上均有商业化产品销售。通过阅读本申请的公开内容,本领域技术人员能够理解,本申请的各项发明的实施并不依赖于特定类型的体外反搏装置和监测装置,而关键在于将体外反搏技术与连续性血压和心率监测结合起来用于评价个体自主神经调节功能。因此,各种类型的体外反搏装置和监测装置都能够良好地应用于本申请。
实施例
实施例1–可行性确认
研究个体
招募标准:在发病7天内的急性缺血性脑卒中患者。
排除标准:痴呆;心率不齐,如房颤;并存的全身性疾病的证据,如肾衰竭(肌酐>300mmol/L);恶性肿瘤;发烧或者任何原因导致的神智不清。
同时招募年龄大于45岁的无心脑血管疾病和任何危险因素的健康志愿者做对照组。
本研究获得了伦理道德委员会的批准,并且参与本研究的患者和健康对照个体均签署了书面知情同意书。
实验设备和方法
体外反搏设备:体外反搏MC3型号(中国佛山市华文医疗仪器有限 公司),处理压力范围150mm Hg-262.5mm Hg。
连续性血压和心率监测设备:Task Force Monitor 3040i仪器(CNSystems Medizintechnik AG,Graz,Austria)。
使受试者(包括脑卒中患者和对照个体)躺在体外反搏治疗床上,在其大腿、小腿和臀部缚以反搏设备气囊,并将连续性血压和心率监测设备连接在受试者上。
当心脏舒张时,通过心电R波同步触发,使围绕在腿部及臀部的气囊充气,对肢体加150mmHg(~0.02MPa)正压,在心脏舒张初期依次地加压于小腿、大腿和臀部,产生舒张期增压波(diastolic augmentation,DA),在舒张末期解除所有压力,以驱动血液向主动脉返流,同时留下空的下肢血管床接受心脏输出量,由此卸载后收缩压(systolic unloading,SU)和心脏后负荷(cardiac afterload)得以降低。
结果和讨论
图4记录了在不同体外反搏加压(150mmHg(0.02Mpa)、187.5mmHg(0.025Mpa)、225mmHg(0.03Mpa)、262.5mmHg(0.035Mpa))下,对照个体和卒中患者的心率改变和血压改变百分比(从反搏前的基线)。如图4所示,体外反搏可以提高对照个体和卒中患者的血压和心率,两者的曲线趋势并无统计学显著差异,体外反搏对于提高对照个体和卒中患者的血压和心率的大体效果是相同的。
实施例2–自主神经调节功能的评价
研究个体
招募标准和排除标准如实施例1所述。
测试卒中患者:男性,72岁,左侧前循环脑梗塞,发病3天后。
健康对照组标准如实施例1所述。
实验设备和方法
如实施例1所述。
结果和讨论
图5和图6是由Task Force Monitor 3040i仪器自带软件绘制的心率变异性和血压变异性3D谱,其中图5反映的是心率变异性(HRV),图6显示的是血压变异性(BPV)。通过图5和6的波谱可以直观地看出,对照个体的波动幅度小且波形平稳,卒中患者的波动幅度明显地大于对照个体,提示该卒中患者的自主神经功能受损。
通过上述实验证实,本申请所提供的利用体外反搏技术评价自主神经功能的方法和系统是成功的。
本领域技术人员能够理解,在不脱离本申请的实质和范围的情况下,可以对本文所述的实施方案进行改变和变化,或者与其它相关文献中的技术方案或技术特征进行组合,从而得到其它技术方案,而这些方案也包括在本申请的范围之内。在权利要求书中,所使用的术语不应被解释为将权利要求限制于本说明书和权利要求书所公开的具体实施方式,而应被解释为包括所有可能的实施方式连同权利要求所要求的等同物的全部范围。因此,权利要求并不受本公开的限制。
- 还没有人留言评论。精彩留言会获得点赞!