用于治疗肥大细胞相关的或嗜碱性粒细胞介导的炎性疾病的含大麻素复杂混合物的制作方法
1.相关申请的交叉引用
本申请要求享有2017年2月1日提交的美国临时申请no.62/453,161的权益,该临时申请通过引用整体并入本文。
2.
背景技术:
炎症反应可以在生理学和病理生理学上是有益的,因为炎症反应是伤口愈合、病毒或细菌感染的消退和恢复所必需的。然而,过度炎症反应是有害的,因为它们涉及过敏反应或类过敏反应、过敏性或特发性炎症。肥大细胞是起始和维持炎症的核心。
肥大细胞策略性地位于体内:它们靠近与外部环境(例如气道、胃肠道、子宫、皮肤)接触的组织中的血管、神经和淋巴管。响应于各种刺激(包括对先天性免疫和获得性免疫、cns衍生物和物理应激源的挑战),肥大细胞通过三组偶联事件引发炎症部位形成:(1)释放预先形成的含有诸如组胺的促炎性介质的细胞质颗粒(“脱粒”),(2)从头生物合成生物活性脂质介质(例如白三烯和前列腺素),以及(3)从头转录激活一系列细胞因子、趋化因子和生长因子的基因。肥大细胞活化导致炎症部位的形成,典型特征为红肿(由于血管扩张引起的变红)、肿瘤(由于水肿引起的肿胀)、发热(由浸润的白细胞的强烈代谢活动和血流量增加导致的热量)、疼痛(由介质对局部感觉神经末梢的影响引起的疼痛)以及组织重塑/修复事件,包括血管生成,纤维组织增生和上皮增殖,这些事件由脱粒过程中分泌的基质活性蛋白酶引发。
嗜碱性粒细胞是另一种类型的粒细胞,具有与肥大细胞相似的功能和特征。嗜碱性粒细胞也是免疫反应中的炎症反应的原因。当被活化时,它们脱粒以释放组胺、蛋白多糖如肝素和软骨素、蛋白酶如弹性蛋白酶和溶血磷脂酶。它们还分泌脂质介质,如白三烯和各种细胞因子。肥大细胞和嗜碱性粒细胞共享许多共同的活化途径,信号传导机制和功能输出。
肥大细胞和嗜碱性粒细胞在炎症中所起的关键作用、与这些细胞相关的大量炎性疾病以及已经被证明引发肥大细胞或嗜碱性粒细胞反应的广泛刺激物,使得已经将这些免疫细胞确立为开发新的抗炎疗法过程中的优先战略靶标。特别是,同时抑制肥大细胞(或嗜碱性粒细胞)反应的多项手段(arms)(上面列举为(1),(2),(3))或抑制起始该反应的所有手段所共用的信号传导通路的策略可能优于目前可用的抗组胺剂(其使生物活性脂质和细胞因子合成途径保持完整)、nsaid(其靶向白三烯和前列腺素的合成酶)或仅靶向细胞因子途径的单克隆抗体疗法/受体阻断剂。这种对多个途径的平行靶向可能需要专业设计的化合物的组合混合物,所述组合混合物目前是没有的或没有经实验证明在对照试验中是有效的。
来自许多文化的传统医学表明植物是可用于治疗多种人类病症(包括炎症)的复杂化学混合物的可能来源。例如,已经提出在大麻(cannabissatival.)中发现的化合物参与调节免疫应答。由神经、上皮和免疫组织分泌的一系列内源性大麻素(内源性-大麻素)调节包括免疫的广泛的生理过程,并且在各种免疫系统细胞(包括肥大细胞)上存在这些内源性大麻素的代谢型和离子型受体。类似地,已经提出一些萜烯具有抗炎潜力,并且它们靶向的信号传导途径存在于诸如肥大细胞的免疫细胞中。
然而,植物衍生药的安全性、功效和一致性尚未接近大范围治疗应用的传统药物标准。因此,为了开发有效的抗炎治疗剂,需要明确定义的大麻素和萜烯的组合物,其选择性地发挥抗炎作用,尤其是对肥大细胞和嗜碱性粒细胞。
3.
技术实现要素:
本发明提供了适合用作活性药物成分的新型的含大麻素的复杂混合物,制备该复杂混合物的方法,以及包含该复杂混合物的药物组合物。本发明还涉及它们用于治疗和预防哺乳动物中的慢性和急性炎性疾病的方法,所述慢性和急性炎性疾病包括肥大细胞或嗜碱性粒细胞介导的炎性疾病。
本发明的含大麻素的复杂混合物是包含从大麻属(cannabisspp.)中鉴定出来的多种化合物的混合物,所述化合物大致分为三类:(a)主要大麻素,其在植物中高度丰富,(b)次要大麻素,和(c)萜烯。在不同大麻品种、培育品种、时间、栽培方法和环境条件下,植物中这些化合物的浓度差异很大。
虽然已经广泛研究了主要大麻素,但是对次要大麻素和萜烯的研究较少,并且尚未充分研究跨越这些类别的定制混合物的医学潜力。此外,植物来源的混合物的复杂性包括可能对给定的靶信号传导途径加和、协同或相反地起作用的化合物。后者意味着从植物转化至临床并不简单,并强调需要解构、优化和重构具有治疗上所需的组成的混合物。本发明提供了通过解构、优化和重构过程鉴定治疗上所需的组合物的方法,以及由所述方法鉴定的组合物。
本文公开的含大麻素的复杂混合物提供了通过抑制肥大细胞脱粒和生物活性脂质释放治疗和预防涉及过度炎症反应的各种疾病的新方法(图1)。这些方法可有效治疗和预防涉及肥大细胞的各种炎性疾病。此类炎性病症包括但不限于过敏和特应症(过敏性哮喘、湿疹、鼻炎),肥大细胞活化综合征(mcas),物理性和化学性荨麻疹,特发性荨麻疹,克罗恩病,炎性肠病,皮炎和接触性皮炎,关节炎和类风湿性关节炎,对刺痛(sting)或其他过敏性或类过敏性刺激的皮肤、组织或全身反应,犬肥大细胞增多症,牛、猪中的过敏和炎症等。
预期本发明的新型组合物和方法替代或补充如下所述仍不完美的本领域可用的其他抗炎方法:
首先,共靶向肥大细胞活化过程的至少两项手段相较于如上所述的现有方法有所改善。
其次,现有的使用皮质类固醇的慢性抗炎方法有副作用和脱敏现象,靶向tnfα等的单克隆抗体疗法具有相当大的副作用属性并且是昂贵的。相比之下,轶事证据和来自人群中大量大麻当前使用者(药物和娱乐使用)的患者报告结果表明(1)低副作用特征和(2)长期疗效而没有显著的脱敏现象。
再次,在阻断脱粒的过程中,本文描述的混合物的作用对包含在肥大细胞颗粒内的除组胺之外的介质具有辅助作用。这些介质包括但不限于血清素、组织活性肽、颗粒蛋白和肥大细胞蛋白酶(“mcpt”)大家族,例如在血管舒张和组织重塑中高度活跃的糜酶和类胰蛋白酶。
预期本发明的新型组合物和方法替代或补充如下所述仍不完美的本领域可用的基于大麻的药物的当前使用方式:
首先,该方法“针对(homein)”用于抗炎治疗的大麻素/萜烯的理想组合物,其随后可以在定制合成组合物或在判断/评定某些天然存在的大麻品种/培养品种在治疗应用中的优点时出现,这是相对于当前处方或主要基于轶事证据的品种选择方法的改进。
其次,该方法提供了合成组合物的设计,该合成组合物可以一致地且以无污染的方式制造,这是对医用大麻生产过程的当前状态的改进,在所述当前状态中,因为生长条件的差异、植物间遗传/表观遗传和代谢差异以及提取方法差异而不能够确保批次间的一致性,并且微生物和化学污染一直是个问题。
再次,本文提出的定制混合物不含或基本上不含主要的精神活性大麻素,δ-9四氢大麻酚(thc)。因此,与通常可用的医用大麻相比,这些混合物具有降低的监管负担和伦理负担。
因此,本发明对于治疗和预防各种炎性疾病具有重要价值。
本发明的一个方面涉及药物活性成分,其包含大麻二酚(cbd),作为第一次要大麻素的大麻萜酚(cbg),至少一种第一选定萜烯,和任选的第二次要大麻素。
在一些实施方案中,所述药物活性成分还包含第二次要大麻素。在一些实施方案中,所述第二次要大麻素是大麻环萜酚(cbc)。在一些实施方案中,第二次要大麻素是次大麻二酚(cbv)。
在一些实施方案中,所述药物活性成分还包含第三次要大麻素。在一些实施方案中,第二次要大麻素和第三次要大麻素分别是大麻环萜酚(cbc)和次大麻二酚(cbv)。
在一些实施方案中,第一选定萜烯是柠檬烯。在一些实施方案中,第一选定萜烯是芳樟醇。
在一些实施方案中,所述药物活性成分还包含第二选定萜烯。在一些实施方案中,第二选定萜烯是柠檬烯。在一些实施方案中,第二选定萜烯是芳樟醇。在一些实施方案中,第一选定萜烯和第二选定萜烯是柠檬烯和芳樟醇。
在一些实施方案中,所述药物活性成分包含柠檬烯、芳樟醇、橙花叔醇、蒎烯和植醇。
在一些实施方案中,所述药物活性成分基本上不含δ-9,thc。
在一些实施方案中,大麻二酚(cbd),次要大麻素和选定萜烯共同构成所述药物活性成分的至少75重量%。在一些实施方案中,大麻二酚(cbd),次要大麻素和所选萜烯共同构成所述药物活性成分重量的至少80重量%、85重量%、90重量%或95重量%。
在一些实施方案中,所述药物活性成分中除大麻二酚(cbd),次要大麻素和所选萜烯之外的所有化合物均可从大麻(cannabissativa)中提取。
在一些实施方案中,以所述药物活性成分的重量计,大麻二酚(cbd)构成7-25%,次要大麻素共同构成15-65%,选定萜烯共同构成13-65%。
在一些实施方案中,以所述药物活性成分的重量计,大麻二酚(cbd)构成15-25%,次要大麻素共同构成15-65%,选定萜烯共同构成18-65%。
在另一个方面,提供了制备药物活性成分的方法,所述方法包括以任何顺序混合以下的步骤:大麻二酚(cbd);作为第一次要大麻素的大麻萜酚(cbg);至少一种第一选定萜烯;以及任选的,第二次要大麻素。
在一些实施方案中,将大麻二酚,第一次要大麻素,第一选定萜烯和任选的第二次要大麻素中的至少一种加入到大麻提取物中。
在一些实施方案中,该方法还包括以下在先步骤:测量大麻提取物中大麻二醇,第一次要大麻素和第一选定萜烯的浓度。
在一些实施方案中,加入大麻二酚,第一次要大麻素和第一选定萜烯中的至少一种以在药物活性成分中达到预定浓度。
在一些实施方案中,该方法还包括制备大麻提取物的在先步骤。在一些实施方案中,大麻提取物由被选择为最接近活性成分的预定组成的大麻品种制备。
本发明的一些实施方案涉及通过本文提供的方法产生的药物活性成分。
本发明的一些实施方案涉及药物组合物,所述药物组合物包含本文提供的药物活性成分和药学上可接受的载体或稀释剂。
在一些实施方案中,所述药物组合物是油、乳液、凝胶或气溶胶。
在一些实施方案中,药物组合物被配制用于通过吸入、通过蒸发器、通过喷雾器或通过气雾器施用。在一些实施方案中,药物组合物被配制用于口服施用、口腔施用或舌下施用。在一些实施方案中,药物组合物被配制用于静脉内、肌内或皮下施用。在一些实施方案中,药物组合物被配制用于鞘内或脑室内施用。在一些实施方案中,药物组合物被配制用于局部给药。
在一些实施方案中,所述药物活性成分以至少0.01、0.1、0.5或1mg/ml的浓度存在于药物组合物中。
在另一个方面,提供了治疗免疫系统疾病的方法,该方法包括给予有效量的本文公开的药物组合物。
在一些实施方案中,免疫系统疾病是过敏或特应症。在一些实施方案中,免疫系统疾病是肥大细胞活化综合征(“mcas”)、物理性和化学性荨麻疹、特发性荨麻疹、克罗恩病、炎性肠病、皮炎和接触性皮炎、关节炎、犬肥大细胞增多症、或非人动物中的过敏或炎症。在一些实施方案中,所述疾病是针对刺痛或其他过敏性或类过敏性刺激的皮肤、组织或全身反应。
在一些实施方案中,免疫疾病是涉及cb1或cb2受体失调或肥大细胞的camp失调的疾病。在一些实施方案中,免疫疾病是涉及cb1或cb2受体的过度活化或肥大细胞的camp抑制的疾病。
在一些实施方案中,免疫系统疾病是涉及一种或多种肥大细胞介质失调的疾病。在一些实施方案中,肥大细胞介质是预先形成的介质或新合成的介质。在一些实施方案中,肥大细胞介质是预先形成的介体,其选自组胺、肥大细胞蛋白酶(包括但不限于糜酶和类胰蛋白酶)、血清素和肝素。在一些实施方案中,肥大细胞介质是新合成的介质,其选自生物活性脂质(包括但不限于前列腺素和白三烯)、paf、细胞因子、生长因子、趋化因子、自由基和p物质。
在一些实施方案中,免疫系统疾病是涉及一种或多种嗜碱性粒细胞介质失调的疾病。
在一些实施方案中,免疫系统疾病是涉及肥大细胞的过度活化的疾病。在一些实施方案中,肥大细胞的过度活化是由选自下组的受体结合激动剂造成的:ige+抗原、igg、ige、ig轻链、补体、神经肽、微生物产物、细胞因子和趋化因子。在一些实施方案中,肥大细胞的过度活化是由机械扰动、温度或压力造成的。在一些实施方案中,肥大细胞的过度活化是由选自促分泌素(包括但不限于源自昆虫的毒液肽)或花生四烯酸代谢物的小分子造成的。
在一些实施方案中,免疫系统疾病是涉及嗜碱性粒细胞的过度活化的疾病。
在一些实施方案中,免疫系统疾病是涉及肥大细胞异常脱粒的疾病。在一些实施方案中,免疫系统疾病是涉及生物活性脂质介质的异常合成的疾病。
在一些实施方案中,免疫系统疾病是涉及嗜碱性粒细胞异常脱粒的疾病。
在一些实施方案中,药物组合物通过吸入施用。在一些实施方案中,药物组合物经口服施用。在一些实施方案中,药物组合物通过口腔给药施用。在一些实施方案中,通过舌下给药递送药物组合物。在一些实施方案中,药物组合物通过注射施用。在一些实施方案中,药物组合物通过局部施用来施用。
在一些实施方案中,药物组合物以足以抑制通过分泌颗粒从肥大细胞脱粒进行的组胺分泌的量施用。在一些实施方案中,药物组合物以足以抑制肥大细胞的生物活性脂质释放或促炎细胞因子、趋化因子或生长因子的产生的量施用。
在一些实施方案中,大麻二酚以每剂小于1g的量施用。在一些实施方案中,大麻二酚以每剂小于500mg的量施用。在一些实施方案中,大麻二酚以每剂小于100mg的量施用。在一些实施方案中,大麻二酚以每剂量小10mg的量施用。
在一些实施方案中,必要时施用药物组合物。在一些实施方案中,药物组合物每天施用一次。在一些实施方案中,药物组合物每天施用2-4次。在一些实施方案中,药物组合物每周施用2-4次。在一些实施方案中,药物组合物每周施用一次。在一些实施方案中,药物组合物每两周施用一次。
以下进一步详细描述本发明的这些和其他方面。
4.附图说明
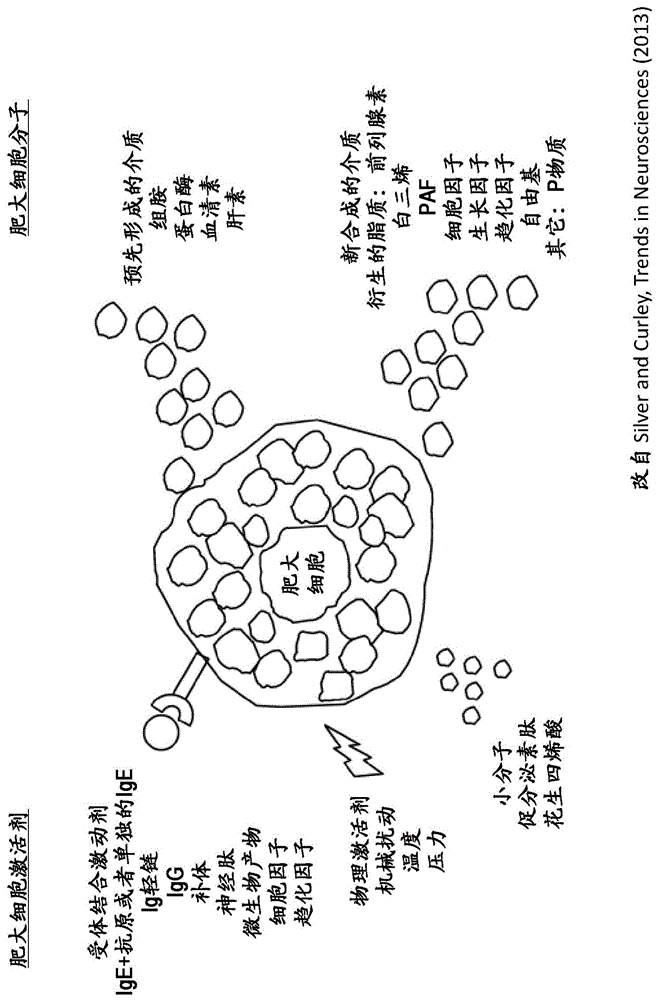
图1示出了各种肥大细胞激活剂(左),包括受体结合激动剂,物理激活剂和小分子,以及各种肥大细胞分子(右),包括预先形成的介质和新合成的介质。该图改自silverandcurley,trendsinneurosciences36:9,513-521(2013),可从
http://www.cell.com/trends/neurosciences/fulltext/s0166-2236(13)00112-4获得。
图2提供来自实施例2的数据,其示出了在含有大麻二酚和十二种亚混合物(ent1-ent12)之一的各种含大麻素复杂混合物的存在下,通过组胺释放测量的fcεri诱导的肥大细胞脱粒。y轴显示与pma/离子霉素存在下的脱粒(最大脱粒,100%)相比的脱粒%。对脱粒有显著抑制作用的含大麻素复杂混合物(p<0.05)用实心条形物表示,对脱粒没有显著抑制作用的复杂混合物用以交叉线做出阴影的条形物表示。
图3a列表示出了图2中示出的脱粒%(分泌%)(第2列)、脱粒%(分泌%)的等级顺序(第3列),通过从100%减去脱粒抑制%计算得到的脱粒抑制%(第4列),以及脱粒抑制%的等级顺序(第5列)。图3b提供了箱线图,其总结了图3a中示出的含大麻素复杂混合物对fcεri诱导的肥大细胞脱粒的抑制%的分布。
图4提供了条形图,其示出了在各种含大麻素复杂混合物存在下或在δ-9四氢大麻酚(thc)模拟物cp55940(以交叉线做出阴影的条形物)存在下的肥大细胞脱粒%。在条形图上绘制水平线以比较cp55930对脱粒的抑制作用与各种含大麻素复杂混合物的抑制作用。
图5是显示来自实施例3的数据的条形图,其示出了大麻二酚(cbd)、大麻酚(cbn)、大麻环萜酚(cbc),大麻萜酚(cbg)或次大麻二酚(cbv)各自对fcεri诱导的肥大细胞脱粒的抑制%。
图6比较了含有大麻二酚和ent3的含大麻素复杂混合物(左)对fcεri诱导的脱粒的预测的抑制%和该复杂混合物的实际抑制%。通过将复杂混合物的各个组分对fcεri诱导的脱粒的抑制百分比求和来预测抑制作用。
图7a提供了来自实施例3的数据,其示出次大麻二酚的促炎作用。该图显示了在对照肥大细胞(实线)和用次大麻二酚预处理10分钟的肥大细胞(虚线)中fcεri诱导的组胺释放的时间过程。x轴表示施用fcεri交联激动剂后的分钟数,y轴表示组胺释放量(pg/1000万个细胞)。图7b比较暴露于fcεri交联激动剂(左)后10分钟测量的组胺释放(pg/1000万个细胞)或在没有fcεri交联激动剂的情况下暴露于次大麻二酚(右)后10分钟测量的组胺释放(pg/1000万个细胞)
图8示出了来自实施例3的数据的条形图,其显示了5种萜烯(柠檬烯、芳樟醇、橙花叔醇、蒎烯和植醇)中的每一种对fcεri诱导的肥大细胞脱粒的抑制%。
图9比较了含有大麻二酚(cbd)和ent2的含大麻素复杂混合物对fcεri诱导的脱粒的预测抑制%(左)与用该复杂混合物观察到的实际抑制%。通过将该复杂混合物的各个组分对fcεri诱导的脱粒的抑制%求和来预测抑制作用。
图10提供了含大麻素复杂混合物对fcεri诱导的脱粒的预测的抑制%,所述复杂混合物包含大麻二酚和十二种亚混合物(ent1-ent12)之一(标记为“预测加和”的行)和该复杂混合物的实际抑制%(标记为“实际的”行)。标记为“实际表现相对于预测值的倍数增加”的行显示预测值与实际值之间的比率。通过将复杂混合物的各个组分对fcεri诱导的脱粒的抑制%求和来获得预测值(在标记有各个组分的名称的行中提供单个组分的作用)。
图11突显了含有大麻二酚和ent6、8或9之一的含大麻素复杂混合物对fcεri诱导的脱粒的预测抑制%(标记为“预测加和”的行)和该复杂混合物的实际抑制%(标记为“实际的”的行)。标记为“实际表现相对于预测值的倍数增加”的行显示预测效果与实际效果之间的比率。
图12显示了不同浓度的柠檬烯(具有菱形的线),不同浓度的大麻萜酚(具有矩形的线),不同浓度的柠檬烯与10μm大麻萜酚的组合(具有三角形的线),不同浓度的大麻二酚(具有x的线)和不同浓度的大麻二酚与10μm大麻萜酚的组合(具有圆圈的线)对fcεri诱导的脱粒的抑制%。
图13比较了单独的柠檬烯(左)或柠檬烯与10μm大麻萜酚的组合(右)对fcεri诱导的脱粒的抑制效力,该抑制效力基于图12中所示的对fcεri诱导的脱粒的抑制%的ic50(nm)计算。
图14示出了响应于各种浓度(范围为1-500ng/ml)的fcεri交联激动剂dnp-bsa的白三烯c4(ltc4)释放量(y轴,pg/3000万个细胞)。
图15提供了来自实施例5的数据,其示出在不存在(阴性对照)或存在含有大麻二酚和五种亚混合物(ent1a、2、3a、8a和9a)之一的各种含大麻素复杂混合物的情况下,通过ltc4释放量测量的fcεri连接诱导的肥大细胞活化。该表提供了ltc4释放量(pg/3000万个细胞),相较于对照(即,在没有任何含大麻素复杂混合物的情况下的ltc4释放)的释放%,以及抑制%(从100%中减去的释放%)。
图16提供了来自实施例6的数据,其示出了在存在外部钙(1mm)时,在不存在(对照载体)或存在1、10或50μmcbg的情况下刺激的rbl2h3细胞中的细胞内游离钙测量结果。使用离子霉素作为阳性对照。在20秒时加入刺激物。
附图仅出于说明的目的描绘了本发明的各种实施方案。本领域技术人员将从以下讨论中容易地认识到,可以采用本文所示的结构和方法的替代实施方案而不脱离本文所述的本发明的原理。
5.具体实施方式
5.1.定义
除非另外定义,否则本文使用的所有技术和科学术语具有本发明所属领域的技术人员通常理解的含义。本文所用的以下术语具有下文所赋予的含义。
“主要大麻素”是指大麻二酚(cbd)或大麻酚(cbn)。主要大麻素可以通过化学合成、化学改性获得,或者从源自一种或多种大麻属植物的植物材料获得。
“次要大麻素”是指大麻环萜酚(cbc)、大麻萜酚(cbg)或次大麻二酚(cbv)。次要大麻素可以通过化学合成、化学改性获得,或者从源自一种或多种大麻属植物的植物材料获得。
“选定萜烯”是指柠檬烯,芳樟醇,橙花叔醇,蒎烯或植醇。选定萜烯可以通过化学合成、化学改性、市售分子获得,或者从源自一种或多种大麻属植物的植物材料获得。
“亚混合物”或“ent”是包含多种化合物的混合物,所述化合物选自如本文所定义的次要大麻素和/或选定萜烯。表1提供了在本文示出的实施例中测试的亚混合物ent1-ent12a的具体组成。
“含大麻素复杂混合物”是包含主要大麻素和亚混合物(ent)的组合物。
如果药物活性成分含有少于0.3%(w/v)的δ-9四氢大麻酚,则该药物活性成分(同义词,活性药物成分或活性成分)“基本上不含thc”。如果包含药物活性成分的药物组合物含有少于0.3%(w/v)的δ-9四氢大麻酚,则该药物组合物“基本上不含thc”。
“大麻提取物”是通过流体和/或气体提取从大麻植物材料获得的组合物,例如通过使用co2的超临界流体提取(sfe)。大麻提取物通常含有主要大麻素,次要大麻素,选定萜烯和其他萜烯,植物大麻素和次级代谢产物。例如,大麻提取物可以包括以下中的一种或多种:没药醇、葎草烯、萜品烯、石竹烯、莰烯、香叶醇,愈创木醇、异蒲勒醇、罗勒烯、伞花烃、桉叶油素、异松油烯和月桂烯。
5.2.其他解释性惯例
本文所述的范围应理解为是该范围内的所有值的简写,包括所列举的端点。例如,1至50的范围应理解为包括选自以下的任意数字,数字组合或子范围:1、2、3、4、5、6、7、8、9、10、11,12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36,37、38、39、40、41、42、43、44、45、46、47、48、49和50。
除非另有说明,否则提及具有一个或多个立体中心的化合物意指该化合物的每种立体异构体及立体异构体的所有组合。
5.3.实验结果概述
如在实施例部分中更全面地描述的,我们制备了各种含大麻素复杂混合物并测试了它们抑制肥大细胞脱粒的能力。
通过将主要大麻素,大麻二酚(cbd)与表1中鉴定的二十一种亚混合物之一组合,产生每种复杂混合物。
使用已广泛用于鉴定抗炎剂的体外测定法测试这些复杂混合物抑制肥大细胞脱粒的能力。
fcεri是免疫球蛋白e(ige)fc区的高亲和力受体,其是参与过敏性疾病和对寄生虫产生免疫的抗体同种型。fcεri分子在肥大细胞表面上的连接诱导脱粒和炎症介质如白三烯(ltc4)的合成和释放。在该测定中,通过在细胞表面上人工连接fcεri分子来活化肥大细胞;在不存在和存在潜在抑制剂的情况下,基于组胺、β-己糖胺酶和ltc4的释放来确定活化。
我们发现几种含大麻素复杂混合物对fcεri诱导的肥大细胞脱粒具有显著的抑制作用。
特别地,包含大麻二酚和ent1、5、9或10的复杂混合物对通过组胺释放测量的肥大细胞脱粒显示出显著的抑制作用(分别为抑制82%,62%,61%和63%),如图2和3所示。许多含大麻素复杂混合物-包含ent1、2、3、5、7、9或10的混合物-显示出其抑制作用显著大于纳摩尔浓度的cp55940(图4中的阴影条形物和水平线)的抑制作用,cp55940是一种有效的cb1受体激动剂,其作用于与天然存在的δ-9thc的作用相似)。结果表明,不含thc的含大麻素复杂混合物可具有强烈的抗炎作用,其作用超过thc或cp55940的作用,但没有thc的精神活性作用。
含大麻素复杂混合物的强抗炎作用大于根据单独使用主要大麻素,次要大麻素或萜烯所观察到的单独抗炎作用所预测到的抗炎作用。如图5所示,当以10μm的浓度单独使用时,主要大麻素和次要大麻素对通过组胺释放测量的fcεri诱导的肥大细胞脱粒仅显示出微弱的作用。具体地,大麻二酚(cbd),大麻酚(cbn),大麻环萜酚(cbc)和大麻萜酚(cbg)对fcεri诱导的脱粒的抑制大约或小于20%。次大麻二酚(cbv)增强fcεri诱导的组胺分泌超过20%。因此,基于三种次要大麻素和大麻二酚(cbd)各自作用的总和,预测包含三种次要大麻素(ent3)和大麻二酚(cbd)的混合物的抗炎作用约为0;然而,包含ent3和大麻二酚的混合物的实际抑制作用为43%(图6)。
我们进一步证明了,包含ent1a的复杂混合物对通过ltc4释放测量的肥大细胞的生物活性脂质介质的从头生物合成显示出显著的抑制作用(73%),如图15所示。含大麻素复杂混合物对ltc4释放也具有类似的协同作用。当将各自的抑制作用相加时(即,具有ent2的混合物的作用与具有ent3a的混合物的作用),包含大麻二酚(cbd),两种次要大麻素和五种选定萜烯(ent1a)的复杂混合物对ltc4释放的预测抑制作用为57%。然而,该复杂混合物的实际作用约为73%。因此,所述数据表明某些含大麻素复杂混合物具有协同作用,这是根据测试每种单独组分或复杂混合物子集的作用的其他实验所无法预期的。
考虑到次大麻二酚(cbv)的强烈促炎作用,含有次大麻二酚(cbv)的含大麻素复杂混合物的强烈抗炎作用是非常令人惊讶的。在图7a中提供的时程实验中进一步证明了用作单一药剂的次大麻二酚(cbv)的促炎作用。如图7a-7b所示,用10μm次大麻二酚(cbv)预处理肥大细胞10分钟显著增强fcεri连接的促炎作用。不希望囿于任何理论,次大麻二酚(cbv)和fcεri连接之间的加和相互作用表明,次大麻二酚(cbv)和fcεri在独立的途径中起作用。
还使用包含萜烯的含大麻素复杂混合物证明了协同作用。如图8所示,当单独测试时,每种萜烯对fcεri诱导的脱粒的抑制仅为约20%或远小于20%。因此,当将各个组分的抗炎作用相加时,包含五种萜烯和大麻二酚(cbd)的复杂混合物的预测抗炎作用为约20%。然而,包含五种萜烯(ent2)和大麻二酚(cbd)的复杂混合物的实际抗炎作用大于50%(图9)。
如图10中进一步示出的,在许多但不是所有的含大麻素复杂混合物中发现了协同作用。标记为“预测的加和”的行提供了预测的抗炎作用(即,各个组分的抗炎作用的总和),标记为“实际的”的行提供了各种含大麻素复杂混合物的实际抗炎作用。
我们进一步发现大麻萜酚(cbg)尤其提供强烈的协同作用。如图11所示,与不含大麻萜酚的类似含大麻素复杂混合物(例如,包含大麻二酚(cbd)和ent6或8的混合物)相比,在包含大麻二酚(cbd)和ent9的混合物中发现的含大麻萜酚(cbg)的含大麻素复杂混合物具有高得多的抗炎作用。例如,ent6和ent9之间的唯一区别是大麻萜酚(cbg)的存在与否。然而,包含ent6或9的两种复杂混合物之间的抗-抑制作用的差异非常显著。具有ent6的复杂混合物将fcεri诱导的脱粒抑制3%,而具有ent9的复杂混合物抑制61%。
图12示出了在1nm-50μm的不同浓度下,柠檬烯,大麻萜酚(cbg)或大麻二酚(cbd)对fcεri诱导的脱粒的抑制%,并将效果与在10μm大麻萜酚(cbg)存在下由柠檬烯或大麻二酚(cbd)诱导的效果进行比较。数据显示,大麻萜酚(cbg)使大麻二酚(cbd)和柠檬烯的剂量-反应曲线左移,从而证明了大麻萜酚(cbg)增强了大麻二酚(cbd)和柠檬烯的抗炎作用。具体而言,如图13所示,单独的柠檬烯对fcεri诱导的脱粒的抑制作用的ic50为约480nm(左侧条形物),但与10μm大麻萜酚(cbg)组合的柠檬烯的抑制作用的ic50为约100nm(右条形物)。
根据这些实验,我们已经证明了某些新的含大麻素复杂混合物对肥大细胞脱粒和从头合成生物活性脂质介质如ltc4具有强烈的抑制作用。含大麻素复杂混合物不含δ-9thc,但已被证明具有超过δ-9thc或thc模拟物cp55940的作用的抗炎作用。这些数据预测这些含大麻素复杂混合物在预防肥大细胞相关炎症反应方面有效力,并因此预测在治疗肥大细胞相关炎性疾病的症状方面有效力,且不会诱导δ-9thc的不希望的精神活性作用。
5.4.药物活性成分
5.4.1.主要大麻素,次要大麻素,选定萜烯
因此,在第一方面,提供了药物活性成分(在本文中也同义地称为“活性成分”和“活性药物成分”),其包括主要大麻素,大麻二酚(cbd);至少一种第一次要大麻素;至少一种第一选定萜烯;和任选的,至少一种第二次要大麻素。在一些实施方案中,第一次要大麻素是大麻萜酚(cbg)。
在一些实施方案中,活性成分包括第二次要大麻素。在一些实施方案中,第二次要大麻素是大麻环萜酚(cbc)。在一些实施方案中,第二次要大麻素是次大麻二酚(cbv)。
在一些实施方案中,活性成分还包含第三次要大麻素。在一些实施方案中,第二次要大麻素和第三次要大麻素是大麻环萜酚(cbc)和次大麻二酚(cbv)。
在一些实施方案中,第一选定萜烯是柠檬烯。在一些实施方案中,第一选定萜烯是芳樟醇。
在一些实施方案中,活性成分还包含第二选定萜烯。在一些实施方案中,第二选定萜烯是柠檬烯。在一些实施方案中,第二选定萜烯是芳樟醇。在一些实施方案中,第一选定萜烯和第二选定萜烯分别是柠檬烯和芳樟醇。
在一些实施方案中,活性成分包括柠檬烯,芳樟醇,橙花叔醇,蒎烯和植醇。
5.4.1.1.相对含量
在典型的实施方案中,大麻二酚(cbd)占活性成分的7-25重量%(wt%)。
在某些实施方案中,大麻二酚(cbd)占活性成分的7-10重量%、活性成分的10-15重量%、活性成分的15-20重量%、活性成分的15-25重量%、或活性成分的20-25重量%。在某些实施方案中,主要大麻素共同占活性成分的至少5重量%、至少10重量%、至少15重量%、或至少20重量%,但在每种情况均不超过25重量%。
在典型的实施方案中,次要大麻素共同构成活性成分重量的15-65%。
在某些实施方案中,次要大麻素共同构成活性成分的15-20重量%、活性成分的20-25重量%、活性成分的25-30重量%、活性成分的30-35重量%、活性成分的35-40重量%。在某些实施方案中,次要大麻素共同构成活性成分的40-45重量%、45-50重量%、50-55重量%、55-60重量%或60-65重量%。在某些实施方案中,次要大麻素共同构成活性成分的至少15重量%、20重量%、25重量%、30重量%、35重量%、40重量%、45重量%、50重量%、55重量%、60重量%,但在每种情况下,均不超过65重量%。
在典型的实施方案中,选定萜烯共同构成活性成分重量的13-65%。
在某些实施方案中,选定萜烯共同构成活性成分的至少13重量%、至少15重量%、至少20重量%、至少25重量%、至少30重量%、至少35重量%、至少40重量%、至少45重量%、至少50重量%、至少55重量%或至少60重量%,但在每种情况下,均小于65重量%。在某些实施方案中,选定萜烯共同构成活性成分的13-65重量%、活性成分的18-65重量%、活性成分的18-25重量%、活性成分的25-55重量%、活性成分的30-50重量%、活性成分的25-30重量%、活性成分的30-35重量%、活性成分的35-40重量%、活性成分的40-45重量%、活性成分的45-50重量%、活性成分的50-55重量%、活性成分的55-60重量%、活性成分的60-65重量%。
在典型的实施方案中,大麻二酚(cbd)构成活性成分的7-25%(w/v)。
在某些实施方案中,大麻二酚(cbd)构成活性成分的7-10%(w/v)、活性成分的10-15%(w/v)、活性成分的15-20%(w/v)、活性成分的15-25%(w/v),或活性成分的20-25%(w/v)。在某些实施方案中,主要大麻素共同构成活性成分的至少5%(w/v),至少10%(w/v),至少15%(w/v)或至少20%(w/v),但在每种情况下,均不超过活性成分的25%(w/v)。
在典型的实施方案中,次要大麻素共同构成活性成分的15-65%(w/v)。
在某些实施方案中,次要大麻素共同构成活性成分的15-20%(w/v)、活性成分的20-25%(w/v)、活性成分的25-30%(w/v)、活性成分的30-35%(w/v)、活性成分的35-40%(w/v)。在某些实施方案中,次要大麻素共同构成活性成分的40-45%(w/v)、45-50%(w/v)、50-55%(w/v)、55-60%(w/v)、或60-65%(w/v)。在某些实施方案中,次要大麻素共同构成活性成分的至少15%(w/v)、20%(w/v)、25%(w/v)、30%(w/v)、35%(w/v)、40%(w/v)、45%(w/v)、50%(w/v)、55%(w/v)、60%(w/v),但在每种情况下,均不超过活性成分的65%(w/v)。
在典型的实施方案中,选定萜烯共同构成活性成分的13-65%(w/v)。
在某些实施方案中,选定萜烯共同构成活性成分的至少13%(w/v)、至少15%(w/v)、至少20%(w/v)、至少25%(w/v)、至少30%(w/v)、至少35%(w/v)、至少40%(w/v)、至少45%(w/v)、至少50%(w/v)、至少55%(w/v)或至少60%(w/v),但在每种情况下,均小于活性成分的65%(w/v)。在某些实施方案中、选定萜烯共同构成活性成分的13-65%(w/v)、活性成分的18-65%(w/v)、活性成分的18-25%(w/v)、活性成分的25-55%(w/v)、活性成分的30-50%(w/v)、活性成分的25-30%(w/v)、活性成分的30-35%(w/v)、活性成分的35-40%(w/v)、活性成分的40-45%(w/v)、活性成分的45-50%(w/v)、活性成分的50-55%(w/v)、活性成分的55-60%(w/v)、活性成分的60-65%(w/v)。
在一些目前优选的实施方案中,大麻二酚(cbd)构成活性成分的7-25%(w/v);次要大麻素共同构成活性成分的15-65%(w/v);选定萜烯共同构成活性成分的13-65%(w/v)。
5.4.1.2.绝对含量
在一些实施方案中,药物活性成分由大麻二酚(cbd),次要大麻素和选定萜烯组成。在这些实施方案中,大麻二酚(cbd),次要大麻素和选定萜烯共同构成药物活性成分的100重量%。
在一些实施方案中,活性成分基本上由大麻二酚(cbd),次要大麻素和选定萜烯组成。
在其他实施方案中,大麻二酚(cbd),次要大麻素和选定萜烯共同构成小于100重量%(wt%)的药物活性成分。
在一些实施方案中,药物活性成分由大麻二酚(cbd),次要大麻素和选定萜烯组成。在这些实施方案中,大麻二酚(cbd),次要大麻素和选定萜烯共同构成药物活性成分的100%(w/v)。
在一些实施方案中,活性成分基本上由大麻二酚(cbd),次要大麻素和选定萜烯组成。
在其他实施方案中,大麻二酚(cbd),次要大麻素和选定萜烯共同构成小于100%(w/v)的药物活性成分。
5.4.2.其他组分
在一些实施方案中,主要大麻素,次要大麻素和选定萜烯共同构成小于100重量%(wt%)的药物活性成分。
在各种这样的实施方案中,大麻二酚(cbd),次要大麻素和选定萜烯共同构成药物活性成分的至少75重量%但小于100重量%。在具体的实施方案中,大麻二酚(cbd),次要大麻素和选定萜烯共同构成活性成分的至少80重量%、至少85重量%、至少90重量%、至少91重量%、至少92重量%、至少93重量%、至少94重量%或至少95重量%,但小于100重量%。在特定的实施方案中,大麻二酚(cbd),次要大麻素和选定萜烯共同构成活性成分的至少96重量%、至少97重量%、至少98重量%或至少99重量%,但小于100重量%。
在大麻二酚(cbd),次要大麻素和选定萜烯共同构成小于100重量%(wt%)的药物活性成分的实施方案中,活性成分还包含除主要大麻素,次要大麻素和选定萜烯以外的化合物。在典型的此类实施方案中,活性成分中的所有其他化合物均可从大麻中提取。在具体的实施方案中,活性成分中的所有其他化合物存在于由大麻制成的提取物中。
在一些实施方案中,大麻二酚(cbd),次要大麻素和选定萜烯共同构成小于100%(w/v)的药物活性成分。
在各种这样的实施方案中,大麻二酚(cbd),次要大麻素和选定萜烯共同构成药物活性成分的至少75%(w/v),但小于100%(w/v)。在具体的实施方案中,主要大麻素,次要大麻素和任选的选定萜烯共同构成活性成分的至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、或至少95%(w/v)、但小于100%(w/v)。在特定的实施方案中,主要大麻素,次要大麻素和任选的选定萜烯共同构成活性成分的至少96%、至少97%、至少98%或至少99%(w/v),但小于100%(w/v)。
在大麻二酚,次要大麻素和选定萜烯共同构成小于100%(w/v)的药物活性成分的实施方案中,活性成分还包含除大麻二酚,次要大麻素和选定萜烯以外的化合物。在典型的此类实施方案中,活性成分中的所有其他化合物均可从大麻中提取。在具体的实施方案中,活性成分中的所有其他化合物存在于由大麻制成的提取物中。
5.4.2.1.δ-9四氢大麻酚(thc)含量
在各种实施方案中,活性成分基本上不含δ-9四氢大麻酚(thc)。这些实施方案保留了活性药物成分在治疗免疫疾病中的治疗特性,并且不具有精神活性作用,这提供了某些监管益处和其他生理学益处。
在某些实施方案中,活性成分基本上不含δ-9thc。在某些此类实施方案中,活性成分包含1-10重量%(wt%)的thc。在具体的实施方案中,活性成分包含2-9重量%的thc、3-8重量%的thc、4-7重量%的thc。在某些实施方案中,活性成分包含1、2、3、4、5、6、7、8、9或10重量%的thc。
在某些实施方案中,活性成分基本上不含δ-9thc。在某些此类实施方案中,活性成分包含1-10%(w/v)的thc。在具体的实施方案中,活性成分包含2-9%(w/v)的thc,3-8%(w/v)的thc,4-7%(w/v)的thc。在某些实施方案中,活性成分包含1、2、3、4、5、6、7、8、9或10%的(w/v)thc。
5.4.3.制备活性成分的方法
在一些实施方案中,通过将化学纯的大麻二酚(cbd),次要大麻素和选定萜烯混合至所需的最终浓度来制备药物活性成分。大麻酚(cbd),次要大麻素和选定萜烯中的每一种可以单独地化学合成,或者通过全合成或者通过中间体的合成改性、纯化自组合混合物如大麻提取物,或者如下文实施例中那样商购获得。
在其他实施方案中,通过将大麻二酚(cbd),次要大麻素和选定萜烯中的任一种或多种调节至预定的所需最终浓度,从起始组合混合物制备药物活性成分。在典型的实施方案中,起始组合混合物是大麻提取物。在目前优选的实施方案中,起始组合混合物是大麻提取物,并且大麻二酚(cbd),次要大麻素和任选的选定萜烯中的一种或多种被加入该混合物中以达到预定的所需最终浓度。
通常在这样的实施方案中,该方法还包括确定起始组合混合物中所需的大麻二酚(cbd),次要大麻素和任选的选定萜烯各自的浓度的在先步骤。
在某些此类实施方案中,该方法还包括更早的步骤,即制备大麻提取物。制备大麻提取物的方法描述于美国专利no.6,403,126、8,895,078和9,066,910;doorenbosetal.,cultivation,extraction,andanalysisofcannabissatival.,annalsofthenewyorkacademyofsciences,191,3-14(1971);fairbairnandliebmann,theextractionandestimationofthecannabinoidsincannabissatival.anditsproducts,journalofpharmacyandpharmacology,25,150-155(1973);oroszlanandverzar-petri,separation,quantitationandisolationofcannabinoidsfromcannabissatival.byoverpressuredlayerchromatography,journalofchromatographya,388,217-224(1987)中,它们的公开内容通过引用整体并入本文。在特定的实施方案中,选择提取方法以提供大麻二酚,次要大麻素和选定萜烯的含量最接近活性成分的预定组成的提取物。
在一些实施方案中,该方法还包括选择大麻品种以用于后续开发成治疗剂或用于治疗的提取化合物的来源的步骤。
在某些实施方案中,所选择的品种在植物整体或在植物可提取部分中具有典型含量的大麻二酚,次要大麻素和选定萜烯,该典型含量最接近活性成分的预定组成。在具体的实施方案中,所选择的品种在植物、其可提取部分或其提取物中具有最接近所需主要大麻素,次要大麻素和任选的选定萜烯的预定重量比的典型含量。在具体的实施方案中,所选择的品种在植物、其可提取部分或其提取物中具有典型含量,该典型含量要求以最少的次数调整所需大麻二酚(cbd),次要大麻素和选定萜烯的浓度以实现活性成分的预定组成。在具体的实施方案中,所选择的品种在植物、其可提取部分或其提取物中具有典型含量,该典型含量要求以最低的成本调整所需大麻二酚(cbd),次要大麻素和任选选定萜烯的浓度以实现活性成分的预定组成。
大麻素,萜类化合物和其他化学成分可以通过本领域已知的任何合适的分析化学方法测量。这些方法包括但不限于气相色谱(gc)与二级检测方法相结合,如质谱(gc-ms),串联质谱(gc-ms/ms),火焰离子化检测器(gc-fid)或红外线光谱学(gc-ir)。液相色谱(lc)可以与二级检测方法相结合。
5.4.4.方法制备的产品
在典型的实施方案中,药物活性成分通过上文5.4.3节中描述的方法之一制备。
在药物活性成分由起始组合混合物通过调节至预定的所需最终浓度制备的实施方案中,大麻二酚(cbd),次要大麻素和选定萜烯中的任一种或多种,活性成分中除大麻二酚(cbd),次要大麻素和选定萜烯以外的所有化合物存在于起始组合混合物中。在起始组合混合物是大麻提取物的实施方案中,活性成分中除大麻二酚(cbd),次要大麻素和任选的选定萜烯之外的所有化合物都存在于大麻提取物中。
5.5.药物组合物
在另一方面,提供了药物组合物。药物组合物包含本文公开的药物活性成分和药学上可接受的载体或稀释剂。
5.5.1.药物活性成分的含量
在典型的实施方案中,活性成分以至少0.01μg/ml、至少0.1μg/ml、至少0.5μg/ml或至少1μg/ml的浓度存在于药物组合物中。在某些实施方案中,活性成分以至少1μg/ml、2μg/ml、3μg/ml、4μg/ml、5μg/ml、10μg/ml、15μg/ml、20μg/ml或25μg/ml的浓度存在于药物组合物中。在某些实施方案中,活性成分以至少30μg/ml、35μg/ml、40μg/ml、45μg/ml或50μg/ml的浓度存在于药物组合物中。
5.5.2.一般的配制
药物组合物可以是适合于人用或兽医用的任何形式,包括液体、油、乳液、凝胶、胶体、气溶胶或固体。
可以配制药物组合物用于通过适合于人或兽医用的任何给药途径施用,包括肠内和肠胃外施用途径。
在各种实施方案中,配制药物组合物用于通过吸入施用。在某些此类实施方案中,配制药物组合物用于通过蒸发器施用。在某些此类实施方案中,配制药物组合物用于通过喷雾器施用。在某些此类实施方案中,配制药物组合物用于通过气雾器施用。
在各种实施方案中,配制药物组合物用于口服施用,口腔施用或舌下施用。
在一些实施方案中,配制药物组合物用于静脉内、肌内或皮下施用。
在一些实施方案中,配制药物组合物用于鞘内或脑室内施用。
在一些实施方案中,配制药物组合物用于局部施用。
5.5.3.适于通过吸入施用的药物组合物
在一些实施方案中,提供了本文所述的药物组合物的单位剂型,其适于通过蒸发器,雾化器或气雾器施用该药物组合物。在一些实施方案中,剂型是小瓶、安瓿,任选地带有刻痕以允许使用者打开。在特定实施方案中,喷雾器是喷射雾化器或超声雾化器。
可吸入组合物通常以水性溶液的形式施用,例如作为鼻或肺喷雾剂。用于将液体以鼻用喷雾形式分配的优选系统公开在美国专利no.4,511,069中。通过将根据本发明的组合物溶解在水中以产生水性溶液并使溶液无菌,可以方便地制备这样的制剂。制剂可以存在于多剂量容器中,例如美国专利no.4,511,069中公开的密封分配系统。其他合适的鼻喷雾递送系统已经记载于transdermalsystemicmedication,y.w.chiened.,elsevierpublishers,newyork,1985;m.naefetal.developmentandpharmacokineticcharacterizationofpulmonalandintravenousdelta-9-tetrahydrocannabinol(thc)inhumans,j.pharm.sci.93,1176-84(2004);和美国专利no.4,778,810;6,080,762;7,052,678;和8,277,781(各自通过引用并入本文)。另外的气溶胶递送形式可包括例如压缩空气喷雾器,喷射喷雾器,超声喷雾器和压电喷雾器,它们递送溶解或悬浮在药用溶剂(例如水,乙醇或它们的混合物)中的生物活性剂。
粘膜制剂以干粉制剂形式施用,例如,包含生物活性剂,其为具有适当粒径或在适当粒径范围内的干燥形式,通常为冻干形式,用于鼻内递送。适于在鼻或肺通道内沉积的最小粒径通常为约0.5微米质量中值等效空气动力学直径(mmead),通常约1微米mmead,更通常约2微米mmead。适于在鼻腔内沉积的最大粒径通常约10微米mmead,通常约8微米mmead,更通常约4微米mmead。在这些尺寸范围内的鼻内可吸入粉末可通过各种常规技术生产,例如喷射研磨,喷雾干燥,溶剂沉淀,超临界流体冷凝等。这些合适的mmead干粉可以通过常规干粉吸入器(dpi)施用至患者,所述干粉吸入器依靠患者的呼吸,在肺或鼻吸入后,将粉末分散成雾化量。或者,干粉可以通过空气辅助装置施用,该装置使用外部电源将粉末分散成雾化量,例如活塞泵。
5.5.4.适用于口服/口腔/舌下施用的药物组合物
用于口服,口腔或舌下施用的制剂可以是胶囊剂、扁囊剂、丸剂、片剂、糖锭(使用调味基质,通常是蔗糖和阿拉伯胶或黄蓍胶)、粉剂、颗粒剂、或作为在水性或非水性液体中的溶液或悬浮液、或作为水包油或油包水液体乳液、或作为酏剂或糖浆、或作为锭剂(使用惰性基质,如明胶和甘油,或蔗糖和阿拉伯胶)、和/或作为漱口剂等,各自含有预定量的主题多肽治疗剂作为活性成分。除活性化合物外,悬浮液还包含助悬剂,例如乙氧基化异硬脂醇、聚氧乙烯山梨糖醇和脱水山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂和黄蓍胶以及它们的混合物。
在用于口服、口腔或舌下施用的固体剂型(胶囊剂,片剂,丸剂,糖衣丸,粉末剂,颗粒剂等)中,可以将一种或多种治疗剂与一种或多种药学上可接受的载体混合,例如柠檬酸钠或磷酸二钙,和/或以下中任何一种:(1)填充剂或增量剂,例如淀粉、乳糖、蔗糖、葡萄糖、甘露糖醇和/或硅酸;(2)粘合剂,例如羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖和/或阿拉伯胶;(3)保湿剂,如甘油;(4)崩解剂,如琼脂、碳酸钙、马铃薯淀粉或木薯淀粉、海藻酸,某些硅酸盐和碳酸钠;(5)溶液缓凝剂,如石蜡;(6)吸收促进剂,如季铵化合物;(7)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;(8)吸收剂,如高岭土和膨润土;(9)润滑剂,例如滑石,硬脂酸钙,硬脂酸镁,固体聚乙二醇,十二烷基硫酸钠及它们的混合物;(10)着色剂。在胶囊剂、片剂和丸剂的情况下,药物组合物还可包含缓冲剂。类似类型的固体组合物也可用作软填充和硬填充明胶胶囊中的填充剂,其使用诸如乳糖或乳糖的赋形剂,以及高分子量聚乙二醇等。用于口服施用的液体剂型包括药学上可接受的乳液,微乳液,溶液,悬浮液,糖浆和酏剂。除活性成分外,液体剂型还可含有本领域常用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1、3-丁二醇、油(特别是棉籽油,花生油,玉米油,胚芽油,橄榄油,蓖麻油和芝麻油)、甘油、四氢呋喃醇、聚乙二醇以及脱水山梨糖醇的脂肪酸酯,以及它们的混合物。除惰性稀释剂外,口服组合物还可包含助剂,如润湿剂、乳化剂和悬浮剂、甜味剂、调味剂、着色剂、芳香剂和防腐剂。
5.5.5.适于注射的药物组合物
对于静脉内,肌内或皮下注射,或患处注射,活性成分将是肠胃外可接受的水性溶液的形式,其是无热原的并且具有合适的ph、等渗性和稳定性。本领域相关技术人员能够使用诸如等渗媒介物(如氯化钠注射液,林格氏注射液,乳酸林格氏注射液)制备合适的溶液。根据需要,可以将防腐剂、稳定剂、缓冲剂、抗氧化剂和/或其他添加剂包含在内。
在各种实施方案中,单位剂型是小瓶、安瓿、瓶或预填充注射器。在一些实施方案中,单位剂型含有0.01mg、0.1mg、0.5mg、1mg、2.5mg、5mg、10mg、12.5mg、25mg、50mg、75mg或100mg的大麻素组合物。在一些实施方案中,单位剂型含有125mg、150mg、175mg或200mg的大麻素组合物。在一些实施方案中,单位剂型含有250mg大麻素组合物。
在典型的实施方案中,单位剂型中的药物组合物是液体形式。在各种实施方案中,单位剂型含有0.1ml至50ml的药物组合物。在一些实施方案中,单位剂型含有1ml、2.5ml、5ml、7.5ml、10ml、25ml或50ml的药物组合物。
在特定的实施方案中,单位剂型是含有1ml浓度为0.01mg/ml、0.1mg/ml、0.5mg/ml或1mg/ml的大麻素组合物的小瓶。在一些实施方案中,单位剂型是含有2ml浓度为0.01mg/ml、0.1mg/ml、0.5mg/ml或1mg/ml的大麻素组合物的小瓶。
在一些实施方案中,单位剂型中的药物组合物是适于溶解的固体形式,例如冻干物。
适用于皮下,皮内或肌内施用的单位剂型实施方案包括预装注射器,自动注射器和自动注射笔,各自包含预定量的上文所述的药物组合物。
在各种实施方案中,单位剂型是预装注射器,其包含注射器和预定量的药物组合物。在某些预装注射器实施方案中,注射器适于皮下施用。在某些实施方案中,注射器适于自身施用。在特定的实施方案中,预装注射器是一次性注射器。
在各种实施方案中,预装注射器含有约0.1ml至约0.5ml的药物组合物。在某些实施方案中,注射器含有约0.5ml的药物组合物。在具体的实施方案中,注射器含有约1.0ml的药物组合物。在特定的实施方案中,注射器含有约2.0ml的药物组合物。
在某些实施方案中,单位剂型是自动注射笔。自动注射笔包括含有如本文所述的药物组合物的自动注射笔。在一些实施方案中,自动注射笔递送预定体积的药物组合物。在其他实施方案中,自动注射笔被构造成递送由用户设定的一定体积的药物组合物。
在各种实施方案中,自动注射笔含有约0.1ml至约5.0ml的药物组合物。在具体的实施方案中,自动注射笔含有约0.5ml的药物组合物。在特定的实施方案中,自动注射笔含有约1.0ml的药物组合物。在其他实施方案中,自动注射笔含有约5.0ml的药物组合物。
5.5.6.适于局部施用的药物组合物
用于局部施用的药物组合物和制剂可包括透皮贴剂、软膏剂、洗剂、乳膏剂、凝胶剂、滴剂、栓剂、喷雾剂、液体剂和粉剂。常规的药物载体,水性、粉状或油性基质,增稠剂等可能是必需的或期望的。涂覆的避孕套,手套等也可能是有用的。合适的局部制剂包括其中本发明重点介绍的含大麻素复杂混合物与局部递送剂如脂质、脂质体、脂肪酸、脂肪酸酯、类固醇、螯合剂和表面活性剂的混合的那些。合适的脂质和脂质体包括中性(例如二油酰磷脂酰dope乙醇胺,二肉豆蔻酰磷脂酰胆碱dmpc,二硬脂酰磷脂酰胆碱)阴离子型(例如二肉豆蔻酰磷脂酰甘油dmpg)和阳离子型(例如二油酰四甲基氨基丙基dotap和二油酰磷脂酰乙醇胺dotma)。本发明重点介绍的含大麻素复杂混合物可以被包封在脂质体内或可以与其形成复合物,特别是阳离子脂质体。或者,含大麻素复杂混合物可与脂质形成复合物,特别是与阳离子脂质形成复合物。合适的脂肪酸和酯包括但不限于花生四烯酸、油酸、二十烷酸、月桂酸、辛酸、癸酸、肉豆蔻酸、棕榈酸、硬脂酸、亚油酸、亚麻酸、二癸酸酯、三癸酸酯、单油酸酯、二月桂酸、甘油基1-单癸酸酯、1-十二烷基氮杂环庚烷-2-酮、酰基肉碱、酰基胆碱或c1-10烷基酯(例如肉豆蔻酸异丙酯ipm)、甘油单酯、甘油二酯或它们的药学上可接受的盐。
5.6.一般剂量范围
可任选地采用体内和/或体外测定来帮助确定使用的最佳剂量范围。制剂中使用的精确剂量还取决于施用途径和病症的严重程度,并应根据医师的判断和每个个体的情况来决定。可根据源自体外或动物模型测试系统的剂量-反应曲线外推有效剂量。
5.7.单位剂型
药物组合物可以方便地以单位剂型存在。
单位剂型通常适合于药物组合物的一种或多种特定施用途径。
在各种实施方案中,单位剂型适于通过吸入施用。在某些此类实施方案中,单位剂型适于通过蒸发器施用。在某些此类实施方案中,单位剂型适于通过喷雾器施用。在某些此类实施方案中,单位剂型适于通过气雾器施用。
在各种实施方案中,单位剂型适于口服施用、口腔施用或舌下施用。
在一些实施方案中,单位剂型适于静脉内,肌内或皮下施用。
在一些实施方案中,单位剂型适于鞘内或脑室内施用。
在一些实施方案中,配制药物组合物用于局部施用。
可以与载体材料组合以产生单一剂型的活性成分的量通常是化合物产生治疗效果的量。
5.8.使用方法
5.8.1.治疗肥大细胞相关的或嗜碱性粒细胞介导的炎性疾病的方法
在另一个方面,提供了用于治疗患有免疫系统疾病的个体的方法。在典型的实施方案中,免疫系统疾病是肥大细胞相关的炎性疾病。在一些实施方案中,免疫系统疾病是嗜碱性粒细胞介导的炎性疾病。在一些实施方案中,免疫系统疾病是人类个体中的免疫系统疾病。在一些实施方案中,免疫系统疾病是非人动物个体中的免疫系统疾病。
可用本文所述的含大麻素复杂混合物治疗的疾病包括但不限于:
(1)过敏或特应症(例如,过敏性哮喘,过敏性鼻炎,湿疹,过敏性荨麻疹),(2)肥大细胞活化综合征(“mcas”),(3)物理性和化学性荨麻疹,(4)特发性荨麻疹,(5)克罗恩病,(6)炎性肠病,(7)关节炎,包括类风湿性关节炎,(8)皮炎或接触性皮炎,和(9)针对刺痛、其他过敏性或类过敏性刺激的中毒的皮肤、组织或全身反应。这些疾病还包括犬肥大细胞增多症,以及牛,猪等中的过敏和炎症。
可用本文所述的含大麻素复杂混合物治疗的疾病包括但不限于涉及一种或多种肥大细胞或嗜碱性粒细胞介质的失调的疾病或受一种或多种肥大细胞或嗜碱性粒细胞介质影响的疾病,所述介质为预先形成的选自以下的介质:组胺,肥大细胞或嗜碱性蛋白酶(包括但不限于糜蛋白酶和类胰蛋白酶),血清素和肝素。在一些实施方案中,肥大细胞或嗜碱性粒细胞介质是新合成的介质,其选自生物活性脂质(包括但不限于前列腺素和白三烯)、paf、细胞因子、生长因子、趋化因子、自由基和p物质。
可用本文所述的含大麻素复杂混合物治疗的疾病还包括但不限于涉及各种激活剂过度活化肥大细胞的疾病,例如受体结合激动剂(例如ige+抗原或单独的ige,igg,ig轻链,补体,神经肽,微生物产物,细胞因子,趋化因子),物理激活剂(例如,机械扰动,温度,压力)和小分子(例如促分泌素肽,花生四烯酸代谢物)。
可以用含大麻素复杂混合物治疗的疾病还包括但不限于涉及各种活化剂过度活化嗜碱性粒细胞的疾病。
可用本文所述的含大麻素复杂混合物治疗的疾病还包括与肥大细胞或嗜碱性粒细胞的异常脱粒有关的疾病。
可用本文所述的含大麻素复杂混合物治疗的疾病还包括与生物活性脂质介质的异常合成有关的疾病。在典型的实施方案中,含大麻素复杂混合物以如上所述的药物组合物的形式施用。这些方法特别旨在哺乳动物,更特别是人类的治疗性和预防性治疗。
本文使用的术语“治疗”等通常意指获得所需的药理学和/或生理学作用。就完全或部分预防疾病、病症或其症状而言,该效果可以是预防性的,和/或就部分或完全治愈疾病或病症和/或可归因于所述疾病或病症的不良反应(例如症状)而言,该效果可以是治疗性的。本文所用的“治疗”包括对哺乳动物,特别是人的疾病或病症的任何治疗,并且包括:(a)在易患所述疾病或病症但尚未被诊断患上所述疾病或病症的个体中预防所述疾病或病症的发生;(b)抑制所述疾病或病症(例如,阻止其进展);或(c)缓解所述疾病或病症(例如,引起所述疾病或病症的消退,提供一种或多种症状的改善)。可以根据本领域已知的标准方法和技术容易地评估任何病症的改善。通过该方法治疗的个体群包括患有不期望的病症或疾病的个体,以及具有患上病症或疾病的风险的个体。
术语“治疗有效剂量”或“有效量”是指产生所需效果所施用的剂量或量。确切的剂量或量将取决于治疗的目的,并且本领域技术人员可以使用已知技术确定(参见,例如,lloyd(2012)theart,scienceandtechnologyofpharmaceuticalcompounding,第四版)。
术语“足够的量”是指足以产生所需效果的量。
术语“治疗有效量”是有效缓解疾病症状的量。治疗有效量可以是“预防有效量”,因为疾病预防可以被认为是治疗。
术语“缓解”是指治疗疾病状态(例如免疫疾病)过程中任何治疗上有益的结果,包括预防疾病状态,减轻疾病状态的严重性或进展,缓解或治愈疾病状态。
实际施用量,施用速率和时间过程将取决于所治疗疾病的性质和严重程度。治疗处方,例如决定剂量等,由全科医生和其他医疗专业人员负责,并且通常考虑待治疗的疾病,个体患者的状况,递送部位,施用方法和医生已知的其他因素。上述技术和方案的实例可以在remington'spharmaceuticalsciences,16thedition,osol,a.(ed),1980中找到。
在一些实施方案中,药物组合物通过吸入、口服给药,通过口腔给药,通过舌下给药,通过注射或通过局部应用来施用。
在一些实施方案中,药物组合物以足以调节肥大细胞或嗜碱性粒细胞的脱粒的量施用。
在一些实施方案中,药物组合物以足以调节肥大细胞或嗜碱性粒细胞释放组胺的量施用。在一些实施方案中,药物组合物以足以调节肥大细胞或嗜碱性粒细胞释放其他介质的量施用,例如预先形成的介质(例如,组胺、肥大细胞蛋白酶(包括但不限于糜酶和类胰蛋白酶)、血清素、和肝素),或新合成的介质的释放(例如,生物活性脂质(包括但不限于前列腺素和白三烯)、paf、细胞因子、生长因子、趋化因子、自由基和p物质。
在一些实施方案中,大麻二酚以每剂小于1g、小于500mg、小于100mg、小于10mg的量施用。
在一些实施方案中,药物组合物每天施用一次,每天施用2-4次,每周施用2-4次,每周施用一次或每两周施用一次。
取决于待治疗的病症,组合物可以单独施用或与其他治疗同时或依次组合施用。
本发明提供了包含大麻二酚和亚混合物的新型组合物。我们已经证明该组合物具有显著的抗炎作用,因此,它们可以对免疫病症具有治疗作用,所述免疫病症涉及过度炎症反应,例如从肥大细胞释放异常增加的组胺。此外,我们已经鉴定了发挥显著协同作用的主要大麻素和亚混合物的特定组合。本发明还提供了使用本文鉴定的药物组合物治疗免疫疾病的方法。
5.9.实施例
提供以下实施例是为了说明而非限制。
5.9.1.实施例1:包含次要大麻素和/或萜烯的亚混合物(ent1-ent12a)
通过混合表1中指定的各个组分产生包含次要大麻素和/或萜烯的21种不同的亚混合物(ent1-ent12a)。各组分获自各供应商-来自tokyochemicalindustry的橙花叔醇(#n0454),来自tokyochemicalindustry的芳樟醇(#l0048),来自sigmaaldrich的a-蒎烯(#p45680),来自mpbiomedicals的柠檬烯(#155234),来自ultrscientific的植醇(#flms-035),来自sigmaaldrich的次大麻二酚(#c-140),来自sigmaaldrich的大麻环萜酚(#c-143),来自sigmaaldrich的大麻二酚(#c-045),来自sigmaaldrich的大麻萜酚(#c-141)和来自sigmaaldrich的大麻酚(#c-046)。每种组分的加入量使每种亚混合物包含相同摩尔浓度的每种单独组分。
类似地,通过混合主要大麻素(例如大麻二酚)与二十一种不同亚混合物(ent1-12a)中的每种组分产生含大麻素复杂混合物。每种组分(大麻二酚和亚混合物的每种组分)的加入量足以使含大麻素复杂混合物包含相同摩尔浓度的每种单独组分。
5.9.2.实施例2:基于组胺释放的抑制测量的含大麻素复杂混合物的抗炎作用
通过基于fcεri连接的体外测定法测试包含大麻二酚和十二种亚混合物之一(ent1-12)的各种含大麻素复杂混合物的抗炎作用。
fcεri是免疫球蛋白e(ige)的fc区的高亲和力受体,ige是参与过敏症和寄生虫免疫的抗体同种型。fcεri是多聚体并且是相关抗原/fc受体家族的成员,所述相关抗原/fc受体在启动细胞内信号传导级联中具有保守的结构特征和类似的作用。在人类中,fcεri控制肥大细胞和嗜碱性粒细胞的活化,并参与ige介导的抗原呈递。多价抗原通过fcεri结合并交联保持在细胞表面上的ige分子。受体聚集诱导多种控制不同效应子反应的信号传导途径。这些包括过敏介质的分泌和细胞因子基因转录的诱导,导致分子如白细胞介素-4、白细胞介素-6、肿瘤坏死因子-α和粒细胞-巨噬细胞集落刺激因子的分泌。因此,fcεri对诱导和维持过敏反应至关重要,并且在寄生虫感染中提供生理学上的保护。因此,fcεri通常用于鉴定抗炎剂的测定中。
对于fcεri测定,将肥大细胞(来自肥大细胞细胞系,rbl2h3)以5×104个细胞/孔接种在群集板中。洗涤单层细胞并在200μltyrode缓冲液中温育。然后将肥大细胞用1μg/mlige-抗dnp抗体引发16小时。然后将细胞洗涤三次,并施加如上所述制备的含大麻素复杂混合物。以经计算使肥大细胞暴露于10μm的大麻二酚和10μm的每种次要大麻素或萜烯组分的量施加所测试的复杂混合物。fcεri连接诱导的最大脱粒的对照不包括含大麻素复杂混合物。
10分钟后,施加250ng/ml的dnp-bsa以连接肥大细胞表面上的fcεri分子。
在存在或不存在所测试的含大麻素复杂混合物的情况下暴露于dnp-bsa后60分钟收集肥大细胞培养基。通过使用市售elisa试剂盒(例如,获自enzolifesciences,inc.,rockymountaindiagnostics,inc等的组胺elisa试剂盒)测量组胺释放来测试肥大细胞的脱粒。
图2示出了暴露于含有大麻二酚(cbd)和十二种亚混合物之一(ent1-12)的含大麻素复杂混合物后的肥大细胞脱粒。基于组胺释放量测量每种所测试的复杂混合物的肥大细胞脱粒,并以相较于响应pma/离子霉素的组胺释放(100%)的组胺释放%表示。在二十四(8×3)个独立实验中测试每种复杂混合物,并对来自二十四个独立实验的数据取平均值。平均值表示为图2中每种复杂混合物的条形物。该图中还提供了标准偏差。
如图2所示,某些含大麻素复杂混合物非常显著地抑制了肥大细胞脱粒。对肥大细胞脱粒具有显著抑制作用(p<0.05)的含大麻素复杂混合物的数据用实心条形物表示,没有显著作用的数据用阴影条形物表示。
响应于每种含大麻素复杂混合物的脱粒%用于通过从100%减去该脱粒%来计算脱粒抑制%。每种含大麻素复杂混合物的脱粒抑制%提供于图3a的表中(第四行)。
然后,我们基于它们对肥大细胞脱粒的作用对测试的复杂混合物进行排序(图3a的第二和第三行)。如图3a所示,包含大麻二酚和ent1的混合物在抑制肥大细胞脱粒方面最有效,包含大麻二酚和ent10的混合物排第二,包含大麻二酚和ent5的混合物排第三。包含大麻二酚和ent6的混合物效果最差。图3b进一步提供了表示各含大麻素复杂混合物的抗炎作用的数据的线框图。箱线图右侧的箭头表示分布中的不同四分位数和对应于每个四分位数的复杂混合物。包含ent1或ent10的复杂混合物在第三四分位数内具有最显著的抑制作用,包含ent2、3、5、7、9、11或12的复杂混合物在具有中等抑制作用的中值组内,包含ent4、6或8的复杂混合物在具有最小抑制作用的第一四分位数内。
cp55940(一种具有与天然存在的thc的作用相似的作用的cb1受体激动剂)的抗炎作用也用类似的体外试验测试,所述体外试验使用fcεri连接来驱动肥大细胞脱粒。如图4所示,与pma/离子霉素(100%)相比,cp55940抑制肥大细胞的组胺释放约30%。该效果低于本文提供的许多含大麻素复杂混合物所显示的效果。例如,包含大麻二酚和ent1、2、3、5、7、9或10的复杂混合物具有比cp55940更强的抑制作用(图4)。
根据这一系列实验,我们已经证明了,几种含大麻素复杂混合物强烈抑制肥大细胞的脱粒,这预测了这些复杂混合物作为抗炎剂治疗各种免疫疾病的功效。此外,在没有thc的情况下观察到它们的功效,它们的抗炎作用大于cp55940的作用(图4)。这表明不含thc的含大麻素复杂混合物可有效预防炎症反应,从而有效治疗炎性疾病的症状。
5.9.3.实施例3:每种主要大麻素或次要大麻素或选定萜烯的抗炎作用
通过如上所述测量组胺释放,基于它们对fcεri诱导的肥大细胞脱粒的抑制来评估(i)每种主要大麻素,(ii)每种次要大麻素和(iii)每种选定萜烯的抗炎作用。
图5示出了在10μm浓度下,每种主要大麻素(大麻二酚和大麻酚)和每种次要大麻素(大麻环萜酚,大麻萜酚和次大麻二酚)的抗炎作用。图8示出了在10μm浓度下,每种选定萜烯(柠檬烯,芳樟醇,橙花叔醇,蒎烯和植醇)的抗炎作用。它们的抗炎作用表示为与在pma/离子霉素存在下的组胺释放(0%)相比,在测试化合物存在下组胺释放的减少%。该图中还提供了实验数据的标准偏差。
一些主要大麻素和次要大麻素和选定萜烯抑制组胺释放,表现出抗炎作用。例如,大麻二酚(cbd)和柠檬烯分别使fcεri连接诱导的组胺分泌减少了23%和24%。然而,大多数次要大麻素(例如,大麻环萜酚,大麻萜酚)和选定萜烯(例如芳樟醇,橙花叔醇,蒎烯,植醇)显示几乎没有抗炎作用。
此外,次大麻二酚显示出促炎作用。如图5所示,次大麻二酚使fcεri连接诱导的组胺分泌增加26%。在延时实验中进一步证明了次大麻二酚的促炎作用,该延时实验的数据在图7中提供。图7a示出在用(虚线)或没用(实线)10μm次大麻二酚预处理10分钟的情况下,响应于fcεri连接的组胺释放的时间过程。x轴表示施加bsa-dnp后的分钟数,y轴表示组胺释放量(pg/1000万个细胞)。次大麻二酚的促炎作用甚至大于fcεri连接的作用;在暴露10分钟后,响应于fcεri连接的组胺释放约为220pg/1000万个细胞,而响应于次大麻二酚(不同时进行fcεri连接)的组胺释放为约340pg/1000万个细胞。用次大麻二酚预处理后连接fcεri进一步增强了促炎作用,这表明次大麻二酚和fcεri连接通过独立的途径起作用。
因此,本发明鉴定的含大麻素复杂混合物的极强的抗炎作用不能根据单独的主要大麻素,单独的次要大麻素和单独的选定萜烯的抗炎作用预期到。特别地,本文鉴定的含次大麻二酚复杂混合物的极强的抗炎作用不能根据次大麻二酚的抗炎作用预期到,当单独使用次大麻二酚时,其引发显著的肥大细胞脱粒。
例如,当基于复杂混合物的各个组分的抗炎作用的总和预测含大麻素复杂混合物的抗炎作用时,预测值远小于含大麻素复杂混合物的实际抗炎作用。例如,包含大麻二酚和三种次要大麻素(ent3)的复杂混合物对肥大细胞脱粒的预测抑制作用仅为约1%,但该复杂混合物实际观察到的效果为约43%(图6和10)。类似地,包含大麻二酚和五种选定萜烯(ent2)的复杂混合物对肥大细胞脱粒的预测抑制作用为约23%,但作为复杂混合物它们的实际观察效果为约55%(图9和10)。图10提供了每种测试的含大麻素复杂混合物的实际抗炎作用(在标记为“实际的”的行中)和预测效果(在标记为“预测的加和”的行中)的完整列表。实际效果和预测值之间的比率也在图10中标记为“实际表现相对于预测加和的倍数增加”的行中提供。该列表表明许多含大麻素复杂混合物的预测值与实际值之间存在很大差异。
特别地,预期包含次大麻二酚的复杂混合物不具有或具有最小的抗炎作用,因为当单独使用时次大麻二酚具有显著的促炎作用。然而,与预期相反,包含次大麻二酚的几种含大麻素复杂混合物-例如包含大麻二酚和ent1的混合物,包含大麻二酚和ent10的混合物和包含大麻二酚和ent9的混合物-具有强烈的抗炎作用。
这表明组分之间未知的协同相互作用在许多含大麻素复杂混合物的抗炎作用中起重要作用。根据对复杂混合物的各个组分进行的研究不会预期产生协同作用。
5.9.4.实施例4:大麻萜酚与其他大麻素和/或选定萜烯的组合的协同作用
我们进一步证明了,次要大麻素(大麻萜酚(cbg))与其他大麻素和/或萜烯组合时对肥大细胞脱粒的强烈协同作用。大麻萜酚(cbg)本身对肥大细胞脱粒没有显著影响,如图5所示。然而,当大麻萜酚(cbg)与其他大麻素和/或萜烯组合时,其增强对肥大细胞脱粒的抑制作用。例如,如图11中突出显示的那样,ent6和ent9之间的唯一区别是大麻萜酚(cbg)的存在与否。包含大麻二酚(cbd)和ent6的复杂混合物几乎没有抑制作用,而包含大麻二酚(cbd)和ent9的复杂混合物具有显著的抑制作用。包含大麻二酚(cbd)和ent9的复杂混合物抑制fcεri连接诱导的肥大细胞脱粒61%。
与各种浓度的柠檬烯或大麻二酚(cbd)的组合进一步证明了大麻萜酚(cbg)的协同作用。如图12所示,在存在(分别为具有三角形的线和具有圆圈的线)或不存在10μm大麻萜酚(cbg-分别是具有菱形和具有x的线)的情况下,在11种不同浓度(x轴:0、1、5、10、50、100、500、1000、5000、10000、50000nm)下,评估了柠檬烯和大麻二酚(cbd)的抗炎作用。在该实验中,混合物的抗炎作用基于使用β-己糖胺酶测定法测量的对肥大细胞脱粒的作用。
β-己糖胺酶测定法:用抗-dnpaige引发肥大细胞,然后如实施例2所述在存在或不存在测试组合物的情况下用dnp-bsa刺激肥大细胞。在暴露于fcεri后60分钟收集肥大细胞培养基并在37℃下温育45分钟。移出培养基的25μl上清液,通过微量离心澄清,并转移至每孔含有100μl1mmp-n-乙酰基葡糖胺(sigma)的0.05m柠檬酸盐缓冲液(ph4.5)的96孔板中。将混合物在37℃温育1小时后,通过加入100μl/孔的0.2m甘氨酸(ph9.0)淬灭反应。β-己糖胺酶水平解读为在405nm处的od。
当大麻萜酚单独施用时,大麻萜酚的抗炎作用不显著-即使在最高测试浓度(50μm)下,大麻萜酚抑制fcεri连接诱导的脱粒小于10%。然而,当与柠檬烯或大麻二酚组合时,大麻萜酚显示出显著的协同作用。当大麻萜酚加入不同浓度的柠檬烯或大麻二酚时,通过如图所示使柠檬烯或大麻二酚的剂量响应曲线向左移动,显著增强了它们的抗炎作用。例如,单独的柠檬烯的抗炎反应的ic50为约480nm,但当与10μm大麻萜酚组合时柠檬烯的ic50为约100nm(图13)。
5.9.5.实施例5:含大麻素复杂混合物的基于白三烯c4释放抑制的抗炎作用
还通过测量含大麻素复杂混合物对fcεri连接诱导的白三烯c4(ltc4)释放的影响来测试它们对肥大细胞活化的影响。如图14所示,向用抗-dnpige引发的肥大细胞施加dnp-bsa,以浓度依赖性的方式诱导肥大细胞释放ltc4。图14示出了响应于各种浓度的dnp-bsa(范围为1至500ng/ml)的ltc4释放(y轴,pg/3000万个细胞)。如下所述测量ltc4。
白三烯c4elisa:在存在或不存在如实施例1中所述的测试组合物的情况下,在用抗-dnpige引发后通过添加dnp-bsa刺激fcεri的肥大细胞连接。1小时后,使用eia试剂盒(caymanchemicals,annarbor,mi)参照标准曲线测定来自肥大细胞培养物的上清液的ltc4。显色进行45分钟,读取在430nm处的吸光度。结果以一式三份实验的平均值(±sd)报告。
在存在或不存在各种含大麻素复杂混合物的情况下,在用dnp-bsa刺激后,测量培养基中的ltc4。具体地,测试了包含大麻二酚和亚混合物ent1a,ent2,ent3a,ent8a或ent9a中的一种的复杂混合物。如图15所示,含大麻素复杂混合物显著抑制fcεri连接诱导的肥大细胞ltc4释放。第二列示出了在存在或不存在各种复杂混合物的情况下fcεri连接诱导的ltc4释放,第三列示出了与不存在含大麻素复杂混合物时的ltc4释放(100%)相比的ltc4释放%,第四列提供了通过从100%中减去ltc4释放%得到的抑制%。含有大麻二酚和ent1a的含大麻素复杂混合物对ltc4释放具有最显著的抑制作用-与对照相比抑制fcεri连接诱导的ltc4释放73%。
在该数据集中还观察到含大麻素混合物的协同作用。换句话说,当基于含大麻素复杂混合物的组分的抗炎作用的总和来预测该混合物的抗炎作用时,预测值小于含大麻素复杂混合物的实际观察到的抗炎作用。例如,包含大麻二酚,两种次要大麻素和五种选定萜烯(ent1a)的复杂混合物对肥大细胞脱粒的预测抑制作用为57%(大麻二酚和ent2的抑制作用(8%)+大麻二酚和ent3a的抑制作用(49%)),而其实际观察到的抑制作用约为73%。
5.9.6.实施例6:含大麻素复杂混合物的抗炎作用的细胞和分子机制
大麻萜酚(cbg)可以通过(1)抑制促分泌途径或(2)刺激抗分泌途径或两者来具有抗炎作用,即抑制脱粒。gi-偶联受体cb1和cb2的活化可诱导gi介导的腺苷酸环化酶抑制和随后细胞内camp浓度的降低。由于cbg是针对均在rbl肥大细胞上表达的cb1和cb2的拮抗剂,因此cbg对cb1和cb2的抑制可以增加细胞内camp并抑制肥大细胞脱粒。已知增加camp可抑制肥大细胞的脱粒。
cb1和cb2受体可以通过其内源配体如anandamide(花生四烯酰乙醇胺或aea)组成型活化。aea由脂肪酸酰胺水解酶(faah)代谢,因此,通过抑制faah可以增加内源性aea水平,从而降低细胞内camp。另一方面,磷酸二酯酶抑制剂如pdei可直接提高camp水平。
进行实验以检验如下假设:cbg介导的抗炎作用,即抑制脱粒,是通过细胞内camp的增加实现的,细胞内camp的增加是由cbg对aea和cb1/2受体之间的相互作用的拮抗作用导致的。为了测试该假设,评估了cbg降低fcεri诱导的脱粒的能力。在加入fcεri之前,将肥大细胞与或不与cbg一起温育。使用faah抑制剂作为对照以增加aea的水平并因此使cb1/2受体饱和,导致camp降低。pdei用作对照以直接增加细胞内camp的水平。还将细胞与单独的cbd或与cbg和cbd一起温育以评估cbd和cbg的协同作用。
将rbl2h3细胞在37℃下与(i)10μmfaah抑制剂ly2183240/pf750混合物,(ii)10μmpdei3-异丁基-1-甲基黄嘌呤(ibmx)或(iii)载体在37℃下预温育3小时(表3)。将载体或300nmcbg(先前确定的最大增强cbd抑制作用的cbg剂量的30%)应用于d-f和j-i组,第一-在fcεri诱导前1小时-和第二-在fcεri诱导前两小时(t0,抗原),并在整个实验过程中保持不变。载体是dmso、甲醇或pbs。在fcri-诱导脱粒前20分钟,将10μmcbd另外加入到组d-i中。在诱导后1小时(t60)使用β-己糖胺酶测定法测量细胞脱粒。重复实验以一式三份进行并取平均值。将每组的脱粒以行l作归一化。在表3的“结果”列中示出的结果数据是每组平均值的归一化细胞脱粒反应。相对于lmn组,abc组p<0.005。相对于lmn组,组ghip<0.005。行f相对于行d没有显著差异。相对于行d,行ep<0.05。
更高的“结果”数字表明在fcεri诱导后细胞脱粒增加。单独的ibmx导致fcεri诱导的脱粒减少3倍(行n,0.34),这证实通过ibmx增加camp可以抑制脱粒。单独添加cbg不会减少脱粒(行j,0.98,与行l的1.0相比;和行k,0.92,与行m的1.02相比)。然而,单独的cbd确实抑制了脱粒(行g,0.54,与行l的1.0相比;和行h,0.56,与行m的1.02相比)。有趣的是,cbg和cbd的添加对细胞脱粒的抑制具有协同作用,因为该组合导致比单独的cbd更低的脱粒(行d,0.31,与行g的0.54相比)。这表明尽管单独的cbg可能不足以直接抑制细胞脱粒,但cbd和cbg的组合具有协同作用并且导致的脱粒抑制比单独的cbd更强。
此外,cbd和cbg的组合导致与pdei混合物相同的脱粒抑制(行d,0.31,与行f的0.33和行n的0.34相比),并且当应用于用pdei混合物处理的细胞时,cbd和cbg的组合没有进一步抑制脱粒(行n,0.34,与行f的0.33相比)。这些结果表明cbd和cbg的组合以及pdei可以通过调节相同的靶标即camp来抑制脱粒。
接下来,评估了cbg直接调节钙内流的能力。还已知cbg是trpm8拮抗剂。trpm8是一种离子通道,其在活化后允许na+和ca+离子进入细胞,因此可能在钙进入肥大细胞和活化促分泌途径中起作用。cbg介导的细胞钙进入抑制可能在cbg抑制细胞脱粒反应中起作用。
洗涤rbl2h3细胞并与0.2μmfluo-4在37℃下在标准改良林格氏溶液(145mmnacl,2.8mmkcl,10mmcscl,+/-1-10mmcacl2,2mmmgcl2,10mm葡萄糖,10mmhepes,ph7.4,330mosm)中温育30分钟。将细胞以50000个细胞/孔转移至96孔板,并用1、10或50μmcbg刺激。使用500nm离子霉素作为阳性对照以诱导钙反应。使用flexstation3(moleculardevices,sunnydale,usa)获得钙信号,持续3分钟。使用
图16示出了细胞内钙测定的结果。在最高测试剂量(50μm)下,cbg处理导致细胞内钙的适度增加,但在较低剂量(1和10μm)下没有显著改变细胞内钙。因此,抑制钙内流可能不是cbg抑制细胞脱粒的机制。
6.通过引用并入
本申请中引用的所有出版物、专利、专利申请和其他文献出于所有目的通过引用整体并入本文,其程度如同每个单独的出版物、专利、专利申请或其他文献被单独指出,出于所有目的通过引用并入本文。
7.等同物
本发明尤其提供了能够抑制肥大细胞脱粒的含大麻素复杂混合物的组合物。本发明还提供了通过施用含大麻素复杂混合物来治疗免疫疾病的方法。虽然已经说明和描述了各种具体实施方案,但是上述说明并不是限制性的。应当理解,在不脱离本发明的精神和范围的情况下,可以进行各种改变。在阅读本说明书后,许多变化形式对于本领域技术人员而言将变得显而易见。
- 还没有人留言评论。精彩留言会获得点赞!