雷西纳德控释药物组合物的制作方法
本发明涉及一种雷西纳德控释药物组合物。
背景技术:
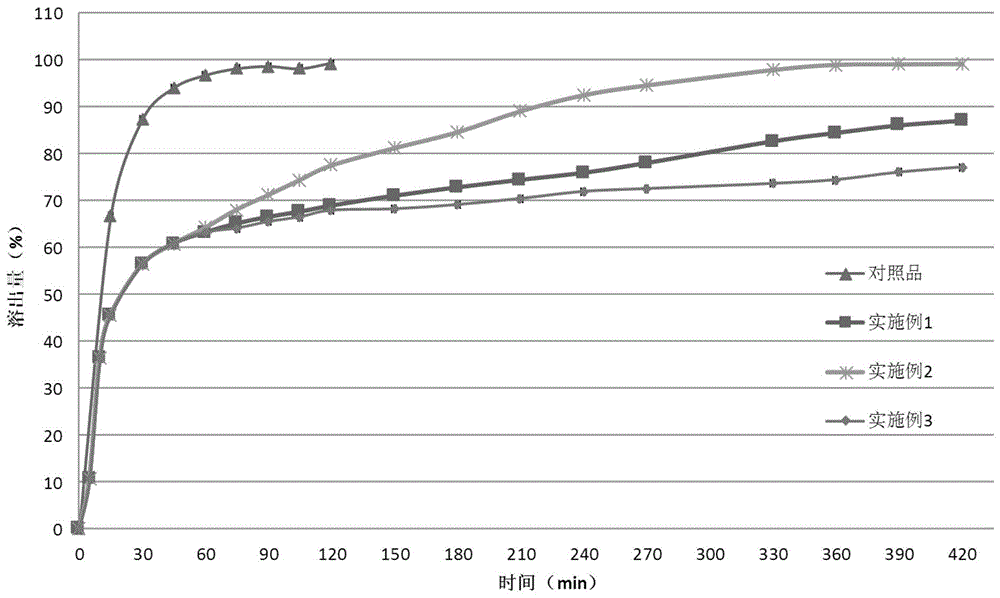
:雷西纳德(lesinurad)是一种尿酸盐转运蛋白1(urat1)抑制剂,其结构如式i所示,化学名:2-(5-溴-4-(4-环丙基萘-1-基)-4h-1,2,4-三唑-3-基硫基)乙酸、或者2-[[5-溴-4-(4-环丙基-1-萘)-4h-1,2,4-三唑-3-基]硫代]乙酸,cas:878672-00-5。原研公司的专利cn102643241b中公开了雷西纳德用于治疗或预防组织尿酸水平异常的病状的药物中的用途,如痛风、高尿酸血症等,同时还提及了各种形式的雷西纳德医药组合物。在临床3期实验中,雷西纳德400mg组虽然显示附加疗效,但有较严重的不良反应及肾毒性,因而2015年获得fda批准上市的zurampic的规格仅为200mg。zurampic是雷西纳德普通片剂,适应症为与黄嘌呤氧化酶抑制剂(xoi)联合用于治疗单独使用xoi未达到目标血清尿酸水平的患者的痛风相关的高尿酸血症。zurampic说明书中的黑框警告zurampic应与xoi一起使用,单独使用时更易发急性肾功能衰竭,此外说明书中还指出zurampic应当在早晨随餐服用。cn103565804a公开了一种含非布司他和雷西纳德的药物组合物,组合物在体外介质中在15分钟内溶出大于85%,其为速释制剂。cn107281108a公开了一种雷西纳德固体分散体,为了增加雷西纳德的溶出度和稳定性,其中的雷西纳德为无定型态。cn108324695a公开了一种雷西纳德包衣片剂,从1000g/1.5万片来看,其包衣片中的雷西纳德含量为67mg/片。技术实现要素:本发明所解决的技术问题在于克服现有的雷西纳德在高剂量使用时具有严重的毒副作用,且雷西纳德药物服用条件较严苛等的缺陷,提供一种雷西纳德控释药物组合物。本发明的雷西纳德控释药物组合物具有改进的释放和溶出速度,在相同剂量情况下较普通速释片剂毒副作用低,提高药效,能够显著降低雷西纳德的用药风险,同时提高药物服用的顺应性。本发明通过以下技术方案解决上述技术问题。本发明提供一种雷西纳德控释药物组合物,其具有下列特征:(i)所述药物组合物在口服给药后的12小时的时间内,雷西纳德的血浆浓度保持在6μg/ml以上;和(ii)所述药物组合物在口服给药后,雷西纳德的最大血浆浓度(cmax)是单独口服给予等剂量雷西纳德的45%~70%。其中,“单独口服给予等剂量雷西纳德”可以是单独口服给予等剂量的雷西纳德化合物,或是等剂量的普通释放的(非缓控释的)雷西纳德制剂,例如zurampic片剂。较佳地,所述药物组合物在口服给药后的12小时时,雷西纳德的血浆浓度在6~9μg/ml。较佳地,所述药物组合物在口服给药后的6小时的时间内,雷西纳德的血浆浓度保持在18μg/ml以上;更佳地,所述药物组合物在口服给药后的6小时时,雷西纳德的血浆浓度在18~22μg/ml。在本发明的一些实施方案中,本发明的雷西纳德控释药物组合物,其具有至少两个以上的下列特征:(1)所述药物组合物的单元制剂中包含200mg~400mg的雷西纳德;(2)在ph5.5的溶出介质中,60min内雷西纳德的溶出度为60%~70%;(3)在ph5.5的溶出介质中,1小时~6小时之间,雷西纳德的每小时溶出度为1.0%~8.0%。其中,所述ph5.5的溶出介质为本领常规使用的溶出介质,通常为ph5.5的磷酸盐缓冲液。在进一步的实施方案中,本发明的雷西纳德控释药物组合物包含立即释放组分和缓释组分,立即释放组分和缓释组分中雷西纳德的质量比为3:1~3:2。按本领常识,所述立即释放组分在摄入后立即释放雷西纳德;所述缓释组分在与立即释放组分相比延长的时间段内释放雷西纳德。立即释放组分和缓释组分可以包含能够呈现多种释放特性的一个或多个颗粒、微丸或片层,例如各种不同释放特性的颗粒包括涂有雷西纳德的惰性核心和一个或多个药学上可接受的辅料层(如聚合物层)。在本发明的一些优选实施方式中,所述雷西纳德控释药物组合物为双层片形式;所述立即释放组分包括:雷西纳德25%-70%(如66.67%)、粘合剂2%-10%(如7%)、崩解剂0%-20%、稀释剂10%-72%(如25.34%)和润滑剂0.01%-3%(如1%);所述百分比为相对于立即释放组分总质量的质量百分比;所述缓释组分包括:雷西纳德30%-75%(如36.36%)、缓释材料10-50%(如25%)、稀释剂10%-50%(如37.64%)和润滑剂0.1%-1%(如1%);所述百分比为相对于缓释组分总质量的质量百分比。其中,所述粘合剂、崩解剂、稀释剂、缓释材料和润滑剂的物质种类均可为本领域此类辅料的常规物质种类。所述粘合剂较佳地为聚维酮(pvp)、交联聚维酮(pvpp)、羟丙甲纤维素(hpmc)、淀粉、羧甲基淀粉钠(cms-na)、乙基纤维素(ec)和聚丙烯酸树脂中的一种或多种,更佳地为羟丙甲纤维素(如hpmce5)和/或交联聚维酮。所述稀释剂较佳地为微晶纤维素(mcc)、甘露醇、淀粉、乳糖、预胶化淀粉、低取代羟丙基纤维素和聚乙二醇中的一种或多种,更佳地为微晶纤维素和/或乳糖。所述缓释材料较佳地为羟丙甲纤维素、羟丙基纤维素、海藻酸钠、羧甲基纤维素钠、聚维酮、共聚维酮、聚丙烯醇、乙基纤维素、羟乙基纤维素和聚丙烯酸树脂中的一种或多种,更佳地为羟丙甲纤维素(如hpmce50lv)。所述润滑剂较佳地为硬脂酸镁和/或硬脂酸。在本发明的另一些优选实施方式中,所述雷西纳德控释药物组合物中,立即释放组分和缓释组分为颗粒或微丸形式,所述药物组合物为丸剂、片剂或胶囊剂;所述立即释放组分包括:①惰性核心5-25%;和②包封惰性核心的立即释放层,其包含雷西纳德45%-80%和粘合剂1%-30%;所述百分比为相对于立即释放组分总质量的质量百分比;所述缓释组分包括:①惰性核心5-35%;②包封惰性核心的释放层,其包含雷西纳德35%-75%;和③包封释放层的聚合物层,其包含聚合物材料1%-30%;所述百分比为相对于缓释组分总质量的质量百分比。其中,所述惰性核心、粘合剂和聚合物材料可为本领域此类辅料的常规物质种类。所述惰性核心一般为糖球。所述粘合剂较佳地为聚维酮(pvp)、交联聚维酮(pvpp)、羟丙甲纤维素(hpmc)、淀粉、羧甲基淀粉钠(cms-na)、乙基纤维素(ec)和聚丙烯酸树脂中的一种或多种,更佳地为羟丙甲纤维素(如hpmce5)和/或交联聚维酮。所述聚合物材料较佳地为羟丙甲纤维素。进一步地,在本发明的一些优选实施方式中,所述雷西纳德控释药物组合物中的唯一药物活性成分为雷西纳德。在本发明的另一些优选实施方式中,所述雷西纳德控释药物组合物中,药物活性成分是雷西纳德和黄嘌呤氧化酶抑制剂。所述黄嘌呤氧化酶抑制剂可以是别嘌呤醇和/或非布司他。本发明的雷西纳德控释药物组合物中,所述雷西纳德包括所有顺式、反式以及对应混合物,即包括雷西纳德轴手性化合物及其对映异构体。一些实施方式中,所述雷西纳德的轴手性化合物可以通过制备单个立体异构体形式来制备,或者也可以通过拆分消旋体混合物以得到光学纯对映异构体。本发明的雷西纳德控释药物组合物可以通过本领域常规的制备方法进行制备。在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。本发明的积极进步效果在于:本发明的雷西纳德控释药物组合物具有改进的释放和溶出速度,较普通速释片剂毒副作用低,提高药效,能够显著降低雷西纳德的用药风险,同时提高药物服用的顺应性。附图说明图1为实施例1-3样品和对照品的溶出释放曲线。图2为实施例1样品和对照品的血浆雷西纳德浓度-时间曲线。图3为实施例2样品和对照品的血浆雷西纳德浓度-时间曲线。图4为实施例3样品和对照品的血浆雷西纳德浓度-时间曲线。具体实施方式下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。实施例1表1缓释组分配方(100片)表2立即释放组分配方(100片)原辅料每片含量(mg)比例(%)处方用量(g)雷西纳德150.0066.6715.000hpmce54.502.000.450乳糖33.2514.783.325mcc10223.7510.562.375交联聚维酮11.255.001.125硬脂酸镁(外加)2.251.000.225总计225.00100.0022.500(1)根据表1的配方制备缓释组分:1)混合:将称量好的雷西纳德、hpmce50lv、乳糖、mcc102混合3min,过24目筛,再混合3min;2)制粒:加入润湿剂(50%乙醇),湿法制粒,过24目筛网;3)干燥:烘箱60℃干燥,水份<3%;4)整粒:干颗粒过24目筛网;5)总混:加入硬脂酸镁,混合3min;(2)根据表2的配方制备立即释放组分:1)混合:将称量好的雷西纳德、乳糖、mcc102、交联聚维酮混合3min,过24目筛,再混合3min;2)制粒:加入hpmce5(5%水溶液),手工湿法制粒,过24目筛网;3)干燥:烘箱60℃干燥,水份<3%;4)整粒:干颗粒过24目筛网;5)总混:加入ms,混合3min;(3)进行双层片压制,压制压力6-7kg,即得。实施例2表3缓释组分配方(100片)原辅料每片含量(mg)比例(%)处方用量(g)雷西纳德100.0036.3610.000hpmce50lv55.0020.005.500乳糖78.1828.437.818mcc10239.0714.213.907硬脂酸镁(外加)2.751.000.275总计275.00100.0027.500表4立即释放组分配方(100片)原辅料每片含量(mg)比例(%)处方用量(g)雷西纳德150.0066.6715.000hpmce54.502.000.450乳糖33.2514.783.325mcc10223.7510.562.375交联聚维酮11.255.001.125硬脂酸镁(外加)2.251.000.225总计225.00100.0022.500根据实施例1中的方法,制备缓释组分和立即释放组分,再进行双层片压制,即得。实施例3表5立即释放组分配方(1000粒)原辅料每片含量(mg)比例(%)处方用量(g)雷西纳德150.0066.67150.00丸芯56.6628.3356.66羟丙甲基纤维素10.005.0010.00总计200.00100.00200.00表6缓释组分配方(1000粒)原辅料每片含量(mg)比例(%)处方用量(g)雷西纳德100.0036.36100.000丸芯110.0033.64110.00羟丙甲基纤维素15.005.0015.00苏丽丝(surelease)75.0025.0075.00总计300.00100300.00(1)根据表5的配方制备立即释放组分:1)上药液的制备:将粘合剂加入适量的水中,搅拌至完全溶解,加入雷西纳德,继续搅拌,混悬均匀。2)含药丸芯的制备:将蔗糖空白丸芯置于流化床中,采用底喷上药的方式,将上药液包在空白丸芯表面,制得雷西纳德的上药丸芯即速释微丸;(2)根据表6的配方制备缓释组分:1)缓释包衣液的制备:将包衣材料溶于适量水溶液中,同时将致孔剂加入适量水中,搅拌;2)缓释微丸的制备:依照(1)的步骤制备上药丸芯,再采用流化床底喷方式,在搅拌条件下将缓释包衣液喷至所述上药丸芯上,制得雷西纳德缓释微丸;(3)将立即释放组分和缓释组分装填入胶囊,即可。效果实施例1)体外溶出试验按照《中国药典》2015年版第四部通则0931溶出度与释放度测定法中第二法(桨法),对实施例1~3制得的雷西纳德控释药物组合物与已上市的雷西纳德片(对照品,商品名:zurampic,200mg片剂)进行体外溶出释放试验,溶出介质选择ph5.5的磷酸盐缓冲盐溶液。具体结果如图1所示。60min时,实施例1-3的产品的溶出度分别为63.2%、64.2%和63.2%,对照品的溶出度为96.7%。1~6小时间,实施例1~3的产品的溶出速率在1.2%/小时~7.9%/小时,而对照组在2小时时基本已完全溶出(99.3%)。2)在犬中的改进释放药代动力学试验对实施例1-3制得的雷西纳德控释药物组合物与已上市的雷西纳德片(对照品)进行了犬体内药代特征研究。分别按单片/只或单粒/只的剂量对6只beagle犬交叉口服给予受试制剂。给药前禁食12h,并在给药后的10min、20min、0.5h、1h、2h、3h、4h、6h、9h、12h、24h和36h测量狗的血浆浓度(ng/ml),以确定随时间变化的血浆浓度特性。前肢静脉采血约400μl,血液用1%肝素抗凝,离心后取血浆于聚丙烯管中,置于-70℃冰箱,待测。各样品的血浆浓度-时间曲线显示在图2-4中,具体地,实施例1-3的试验组对应的cmax分别是对照品的48.7%、58.1%和49.3%,6小时的雷西纳德血浆浓度分别为18.2μg/ml、21.9μg/ml和20.1μg/ml,12小时的雷西纳德血浆浓度分别为8.1μg/ml、6.9μg/ml和8.3μg/ml。而对照组的6小时和12小时的雷西纳德血浆浓度分别为13μg/ml和2.2μg/ml。fda公布的zurampic片剂临床试验数据显示,100mg剂量的雷西纳德空腹组与200mg剂量的雷西纳德空腹组的起效时间(约6小时)和药效(降血尿酸水平)基本一致,而效果维持时间过短;400mg组虽然显示附加疗效,但有较严重的不良反应及肾毒性。本发明实施例1-3的雷西纳德控释药物组合物,不仅能确保与zurampic片剂具有相当的起效时间和药效,同时具有较长的维持时间,并且在起效初期血药浓度保持在相对较低的水平,具有相对于zurampic片剂更低的毒副作用。从上述试验结果可以看出,本发明的雷西纳德控释药物组合物具有改进的释放和溶出速度,较普通速释片剂毒副作用低,提高药效,能够显著降低雷西纳德的用药风险,同时提高药物服用的顺应性。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1