锌铝复合佐剂的制备及作为疫苗佐剂的用途的制作方法
本发明属于医药技术领域。具体地,本发明涉及制备锌铝复合佐剂的方法。本发明还涉及制得的锌铝复合佐剂以及其用于制备疫苗佐剂的用途,尤其是可作为蛋白质疫苗的佐剂。
技术背景
铝佐剂自1926年被发现,1932年第一次被用于人用疫苗,自今已有80多年的使用历史。目前仍是公认的,应用最为广泛、安全、有效的佐剂。但其仍然存在诸多缺陷。比如其主要在体液免疫过程中发挥诱导和刺激的作用,而在细胞免疫中效果甚微;并且需要多针次免疫,才能达到提升并延长有效期限的效果。这促使我们在新型佐剂的研发中,需要有新的思路。除铝佐剂外,现有一些新型复合佐剂也被应用于临床,比如:由诺华公司(novartis)研发的mf59,以及葛兰素史克公司(glaxosmithkline,gsk)研发的佐剂系统as01b、as03、as04等。as04是基于铝佐剂基础上添加有mpl(3-o-desacyl-4’-单磷酰脂质a)的复合型佐剂,相较于单独使用铝佐剂而言,可以明显提高中和抗体滴度和延长免疫有效保护期,目前该佐剂已在gsk的预防宫颈癌疫苗(hpv16/18双价苗)中得以应用。
锌是一种重要的化学元素,具有特殊的生物学功能。例如,痕量级的锌存在于大约300种参与细胞代谢的酶中,并且其在细胞呼吸、细胞分裂、蛋白质合成、dna合成、损伤修复以及免疫功能激活等中扮演重要角色。因此,锌的缺乏或紊乱与众多疾病相关,尤其是免疫系统方面的疾病(autoimmunityreviews,2015,14(04)277–285)。在免疫细胞内,二价阳离子包括锌,对于细胞内信号通路的调节具有重要的作用。锌的缺乏对先天性免疫及适应性免疫中淋巴细胞的存活、增殖及成熟都会产生影响。有研究报道称,锌缺乏会对免疫细胞细胞因子的产生和功能、外周及胸腺t细胞的数量、其增殖和分化产生不利影响。有研究调查发现微量锌的缺乏将导致老年人免疫衰老(immunity&ageing,2009,6(9):1-17)。简而言之,锌对于t细胞生成、发育及其功能发挥具有重要作用。
dieterberndardt等发明了一种氢氧化锌胶体或氢氧化铁胶体的制备过程及其作为疫苗佐剂的应用(美国专利,专利号us5252327,授权日期:1993年10月12号)。氢氧化锌胶体或氢氧化铁胶体对病毒或蛋白具有良好的吸附作用并具有良好的佐剂效应;氢氧化锌胶体可同时激发机体的体液和细胞免疫,而氢氧化铁胶体主要增强体液免疫反应,并且二者具有良好的局部及全身耐受性;二者与卵磷脂联合使用具有更好的免疫刺激作用。
胡云章等发明了一种疫苗佐剂(中国专利,公开号cn101444623a,公开日2009年6月3日),该疫苗佐剂化学式为zn(oh)2,化学式量为99.4046道尔顿的化合物氢氧化锌在制备疫苗的佐剂方面的应用,以及在制备甲肝疫苗的佐剂方面的应用。该氢氧化锌作为佐剂与疫苗联合应用能有效增强疫苗的体液免疫应答,其免疫增强效果优于铝佐剂,并且动物试验结果显示,氢氧化锌作为新型的疫苗佐剂其致敏性和安全性均优于铝佐剂。
王海漩等(中国生物制品学杂志,2011,24(10):1174-1176)研究硫酸乙酰肝素(heparansulfate,hs)与氢氧化锌复合佐剂对丙型肝炎病毒(hepatitiscvirus,hcv)重组抗原表位多肽疫苗诱导小鼠体液免疫的增强作用,结果发现hs与氢氧化锌的复合佐剂能有效增强hcv重组抗原表位多肽疫苗诱导的小鼠体液免疫应答,且能够在一定程度上节省抗原的使用量。
胡云章等发明磷酸锌疫苗佐剂(中国专利,公开号cn101972477b,公开日2012年9月26日),该发明涉及一种磷酸锌疫苗佐剂,尤其涉及磷酸锌作为疫苗佐剂的应用,以及磷酸锌疫苗佐剂在制备疫苗中的应用。所述磷酸锌作为疫苗佐剂与抗原联合应用,能够有效增强疫苗的体液免疫应答,其免疫增强效果优于铝佐剂和氢氧化锌佐剂,并且经动物试验结果显示:磷酸锌作为疫苗佐剂其致敏性和安全性均优于铝佐剂和氢氧化锌佐剂。
胡云章等发明一种复合疫苗佐剂(中国专利,公开号cn102085366b,公开日2012年12月26日),该发明提供一种复合疫苗佐剂,其特征在于由下列组分组成:阿魏酸钠与氢氧化锌的质量比为10:1~50:1。所述复合疫苗佐剂与疫苗联合应用能有效增强疫苗的体液免疫应答,增强效果与铝佐剂相似,并优于单一的阿魏酸钠佐剂和单一的氢氧化锌佐剂,而且无毒副作用,在免疫剂量范围内使用是安全可靠的。该发明的复合疫苗佐剂原料易得,均为市售产品,制备工艺简单,成本低,性能稳定,可用作乙肝疫苗、基因工程疫苗、病毒疫苗等的佐剂。
蔡泓志等(中国生物制品学杂志,2013,26(05):608-610)研究氢氧化锌与硫酸乙酰肝素(heparansulfate,hs)复合佐剂对狂犬病疫苗诱导的小鼠体液免疫应答的影响,结果发现氢氧化锌和hs复合佐剂能增强狂犬病疫苗诱导的小鼠体液免疫应答。
陈振普等发明甘氨酸锌佐剂及含甘氨酸锌佐剂的疫苗(中国专利,公开号cn104096229a,公开日2014年10月15日),该发明提供一种甘氨酸锌佐剂及含有甘氨酸锌佐剂的疫苗,即每单份疫苗剂中含有用ph=6~8的pbs溶解的0.1~1mg的甘氨酸锌佐剂。该发明提供的甘氨酸锌佐剂是药用辅料,是锌营养强化剂,毒副作用小,在免疫剂量范围内使用是安全可靠的,能够有效诱导抗原特异性的体液免疫应答,且所诱导的体液免疫应答效果优于无佐剂组,甘氨酸锌佐剂原料易得,为市售产品,制备工艺简单,成本低,性能稳定,生物学效价较高、无毒害作用,可添加于多种传统疫苗和基因工程疫苗中作为疫苗佐剂。
mahsaafshari等(cytokine,2016,81:71-76)采用利什曼虫感染的balb/c小鼠模型中,口服喂养小鼠硫酸锌,发现其可显著降低寄生虫载量,并且可提升th1细胞因子mrna的表达量。这说明,硫酸锌可诱导利什曼虫感染的balb/c小鼠的强th1免疫反应。
技术实现要素:
本发明人经过创造性的劳动和深入的研究,发明了一种锌铝复合佐剂,提供了其制备方法、理化性质检测及其在预防性疫苗中的用途。发明人惊奇地发现,所述的锌铝复合佐剂能够很好的作为预防性疫苗佐剂。
在第一方面,本发明涉及制备锌铝复合佐剂的方法,其包括:
使锌离子和铝离子在可溶性盐溶液中与阴离子反应以沉淀所述锌离子和铝离子,从而制备锌铝复合佐剂。
在具体的实施方案中,所述沉淀为序列沉淀、分别沉淀后混合或共同沉淀。
在具体的实施方案中,所述序列沉淀包括首先使锌离子和铝离子中的一种与阴离子混合并反应以产生沉淀,随后添加锌离子和铝离子中的另一种并使其与阴离子反应以产生沉淀。
在具体的实施方案中,所述分别沉淀后混合包括使锌离子和铝离子分别与阴离子混合并反应以产生沉淀,然后将两种相混合。
在具体的实施方案中,所述共同沉淀包括首先将锌离子和铝离子混合,然后添加阴离子,使得锌离子和铝离子与阴离子反应以产生沉淀。
在具体的实施方案中,所述阴离子选自磷酸根、碳酸根、硫酸根和氢氧根。
在具体的实施方案中,该方法包括如下步骤:
a.提供包含锌离子和铝离子的可溶性盐溶液,
b.将步骤a的可溶性盐溶液与碱性溶液均匀混合以使锌离子和铝离子与碱性溶液中的阴离子(诸如选自磷酸根、碳酸根、硫酸根和氢氧根)产生沉淀,从而获得锌铝复合佐剂。
在本发明的实施方案中,所述碱性溶液包括氢氧化物溶液、磷酸盐溶液或氢氧化物和磷酸盐的混合溶液。
在本发明一个实施方案中,氢氧化物包括氢氧化钠。
在本发明一个实施方案中,磷酸盐包括na2hpo4、na3po4。
在本发明的实施方案中,所述可溶性盐溶液通常不受限制,例如可以选自氯化盐溶液。
在优选的实施方案中,所述方法还包括将步骤b获得的锌铝复合佐剂灭菌,并于2-8℃(例如4℃)储存备用;
优选地,所述灭菌包括采用高温高压灭菌技术的灭菌,例如在121℃下灭菌30-60分钟,优选60分钟。
在一个实施方案中,锌:铝摩尔浓度比可以是0.02-0.8。在优选的实施方案中,锌:铝摩尔浓度比选自0.023、0.047、0.1、0.375、0.5、0.6、0.7、0.8。
如本文所用的锌离子和铝离子的可溶性盐溶液可以是锌离子和铝离子的任何可溶性盐溶液,优选为锌离子和铝离子的氯化盐溶液。
在一个实施方案中,在使用磷酸盐的情况下,磷:铝摩尔浓度比为0.1-2。在优选的实施方案中,磷:铝摩尔浓度比选自0.15、0.3、0.7、1.1、1.3、1.5、1.7、1.9。
如本文所用的碱性溶液是可以与锌离子和铝离子的可溶性盐溶液发生反应以使锌离子和铝离子沉淀的任何碱性溶液。这样的碱性溶液包括但不限于氢氧化物溶液、磷酸盐溶液或氢氧化物和磷酸盐的混合溶液。氢氧化物溶液可以选自但不限于naoh、koh及其混合物的溶液。磷酸盐溶液可以选自但不限于磷酸钠、磷酸氢二钠(无结晶水,二水,七水,十二水)、磷酸二氢钠(无结晶水,二水)、磷酸钾、磷酸氢二钾、磷酸二氢钾、焦磷酸、多聚磷酸及其任意混合物的溶液。在优选的实施方案中,如本文所用的碱性溶液是氢氧化物和磷酸盐的混合溶液,例如是na2hpo4+naoh溶液、na3po4+naoh溶液。
如本文所用的锌铝沉淀方式可以是使锌离子和铝离子的可溶性盐溶液与碱性溶液充分混合以发生沉淀反应的任何方式。优选地可以通过序列沉淀、分别沉淀后混合或共同沉淀等多种方式制备成锌铝复合型佐剂。
如本文所用的灭菌可以是适合于对锌铝复合佐剂进行灭菌的任何方式。例如,可以采用高温高压灭菌技术来灭菌,例如在121℃下灭菌30-60分钟,优选60分钟。
在一个具体的实施方案中,如本文所述的锌铝复合佐剂可通过以下步骤制备:按照一定的zn/al摩尔浓度比,配制一定浓度的alcl3溶液(内含一定浓度的zncl2),定义为a溶液;按照一定的p/al摩尔浓度比,配制一定浓度的na2hpo4或na3po4(内含一定浓度的naoh)溶液,定义为b液,0.22μm滤膜过滤备用;优选地,zn/al摩尔浓度比为0.375,p/al摩尔浓度比为0.15;更优选地,选择以zn/al摩尔浓度比为0.375,以al浓度不变,添加zn与al共沉淀形成复合佐剂的方式;将a和b溶液按照一定的体积配比,通过序列沉淀、分别沉淀后混合或共同沉淀等方式形成锌铝悬浊液;于121℃灭菌60分钟,于2-8℃储存备用。
在一个实施方案中,所述方法包括如下(1)至(6)中的一项或多项:
(1)步骤a中,可溶性盐溶液中锌离子的摩尔浓度为1-50mm,例如1.5mm、1.7mm、2mm、2.5mm、3mm、3.5mm、10mm、15mm、20mm、25mm、30mm、36mm、39mm、42mm、45mm、46mm、48mm;
(2)步骤b中,阴离子为磷酸根和氢氧根;
优选地,磷酸根和氢氧根的摩尔浓度比为1:(1.8-27),例如1:2、1:3、1:5、1:10、1:14、1:18、1:20、1:22、1:26、1:27;
(3)步骤b中,混合之前,还包括对碱性溶液过滤;
优选地,采用0.1-0.5μm(例如0.3μm、0.4μm)滤膜过滤;
(4)步骤b中,通过将碱性溶液加入可溶性盐溶液中进行混合,
优选地,加入的方式为滴加;
(5)步骤b中,可溶性盐溶液与碱性溶液体积比为1:1;
(6)还包括调整锌铝复合佐剂的ph值至5-8,例如6、7;
优选地,采用盐酸溶液或氢氧化物(例如氢氧化钠)溶液调整ph值。
在第二方面,本发明涉及一种锌铝复合佐剂,其由本发明第一方面的方法制得。
在本发明的实施方案中,锌铝复合佐剂中的锌:铝摩尔浓度比通常不受限制。在优选的实施方案中,锌铝复合佐剂中的锌:铝摩尔浓度比可以是0.02~0.8。优选地,锌:铝摩尔浓度比选自0.023、0.047、0.1、0.375、0.5、0.6和0.7。
在锌铝复合佐剂的又一个实施方案中,锌铝复合佐剂中还可包含磷酸盐,例如,可以使用磷酸盐通过不同的混合方式(诸如序列沉淀、分别沉淀后混合或共同沉淀等多种方式)使得锌离子和/或铝离子与磷酸根产生沉淀而制备成锌铝复合型佐剂。在这样的锌铝复合佐剂中,磷:铝摩尔浓度比通常不受限制。在优选的实施方案中,磷:铝摩尔浓度比可以是0.1~2,优选地,磷:铝摩尔浓度比选自0.15、0.3、0.7、1.1、1.3、1.5、1.7、1.9。
在本发明的锌铝复合佐剂的实施方案中,具体的锌和铝化合物类型不受限制,例如可以是氢氧化锌、磷酸锌、硫酸锌、碳酸锌、氢氧化铝、磷酸铝、硫酸铝或其它本领域已知的锌和铝佐剂类型,只要该锌铝复合佐剂是通过使得锌离子和铝离子与不同的阴离子(例如,磷酸根、碳酸根、硫酸根、氢氧根)产生沉淀制备而成的。
在一个实施方案中,本发明还涉及对获得的锌铝复合佐剂进行理化性质的测定。在一个实施方案中,测定了锌铝复合佐剂的形态、ph值、粒径、zeta电位(zetapotential)、颗粒零电荷点(pzc,potentialofzerocharg)、蛋白吸附率以及沉降体积比等。佐剂的理化性质可以采用常规技术来测定,例如可参见us9573811;艾绪露等人,3种氢氧化铝佐剂的理化性质分析,《中国生物制品学杂志》,2015,28(1):44-47;以及如本文实施例所述。
在一个实施方案中,如本文所述的锌铝复合佐剂具有以下的一个或多个性质:
在灭菌前ph为8.0-9.0,
在灭菌后ph为6.0-8.0,例如7.0
颗粒粒径为1-20μm,例如2μm、3μm、5μm、7μm、9μm、11μm、13μm、15μm、17μm、19μm,
颗粒零电荷点为4.0-11.4,例如5.0、7.0、8.0、10.0、11.0,
蛋白吸附率>94%(例如>95%),优选地,所述蛋白包括牛血清白蛋白(bsa),优选地,蛋白吸附率为对0.1mg/ml-2mg/ml(例如0.2、0.4、0.5、0.7、1、1.2、1.4、1.6、1.8mg/ml)浓度蛋白的吸附率,
沉降体积比v24h大于15%,优选为15%~20%,例如17%、18%、19%,
沉降体积比v2h大于20%,优选为20%~30%,例如22%、25%、27%、28%,
沉降时间t50为18~33min,例如20min、22min、23min、25min、27min、29min、31min、32min
沉降时间t25为100~130min,例如102min、105min、108min、110min、112min、115min、117min、120min、123min、126min、128min。
在一个实施方案中,沉降实验是将锌铝复合佐剂与0.1%-1.2%nacl溶液混合后进行,优选锌铝复合佐剂和nacl溶液的体积比为1:(1~6),例如1:2、1:3、1:5。
在一个方面,本发明涉及包含如本文所述的锌铝复合佐剂的组合物,特别是药物制剂或药物组合物。
制备药物制剂或药物组合物的方法包括使锌铝复合佐剂与载体和/或任选的一种或多种辅助成分结合在一起的步骤。
一般而言按照如下步骤制备制剂:将锌铝复合佐剂与液体载体或粉碎的固体载体或两者均匀地和紧密地结合在一起,然后有必要的话将产品成形。
用于口服施用锌铝复合佐剂的液体剂型包括药学上可接受的乳剂、微乳剂、溶液剂、混悬剂、糖浆剂和酏剂。除了锌铝复合佐剂之外,液体剂型还可含有本领域常用的惰性稀释剂,例如水或其他溶剂、增溶剂和乳化剂,如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苄醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、油(具体而言为棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢糠醇、聚乙二醇、脱水山梨糖醇的脂肪酸酯,以及它们的混合物。
除了惰性稀释剂之外,口服组合物还可包含佐剂如湿润剂、乳化剂和悬浮剂、甜味剂、矫味剂、着色剂、香味剂和防腐剂。
混悬剂制剂除了含有锌铝复合佐剂之外还可含有悬浮剂,例如乙氧基化异十八醇、聚氧乙烯山梨醇和脱水山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂和黄蓍胶以及它们的混合物。
供直肠或阴道施用的本发明药物组合物的制剂可作为栓剂提供,其可通过将锌铝复合佐剂与一种或多种合适的非刺激性赋形剂或载体(包括例如可可脂、聚乙二醇、栓剂用蜡或水杨酸盐)混合来制备,且在室温下为固体而在体温下为液体,从而在直肠或阴道中会熔化而释放出锌铝复合佐剂。本发明的适合于阴道施用的制剂还包括含有本领域已知适用的载体的阴道栓剂、棉塞、乳膏剂、凝胶剂、糊剂、泡沫剂或喷雾剂。
适合于胃肠外施用的本发明药物组合物包含锌铝复合佐剂和与其相组合的一种或多种药学上可接受的无菌等渗含水或非水载体,包括溶液剂、分散剂、混悬剂或乳剂或者可在临用前重构成无菌可注射溶液剂或分散剂的无菌散剂,其可含有抗氧化剂、缓冲剂、使制剂与预定接受者的血液等渗的溶质或者悬浮剂或增稠剂。
可应用于本发明药物组合物的合适的含水和非水载体的例子包括水、乙醇、多元醇(如甘油、丙二醇、聚乙二醇等)和它们的合适混合物、植物油如橄榄油、以及可注射的有机酯如油酸乙酯。可例如通过使用包衣材料如卵磷脂,通过维持所需的颗粒大小(在分散剂的情况中),和通过使用表面活性剂,来维持适当的流动性。
这些组合物还可含有辅剂如湿润剂、乳化剂和分散剂。还可能需要在组合物中包含等渗剂,如糖类、氯化钠等。另外,可通过掺入能延迟吸收的物质如单硬脂酸铝和明胶,实现可注射药物形式的延长吸收。
可通过形成锌铝复合佐剂于生物可降解聚合物(如聚丙交酯-聚乙醇酸交酯)中的微囊基质,制备出可注射的长效制剂形式。根据锌铝复合佐剂与聚合物的比例和具体采用的聚合物的性质,可控制锌铝复合佐剂的释放速度。其他生物可降解聚合物的例子包括聚(原酸酯)和聚(酸酐)。长效可注射制剂也可通过将锌铝复合佐剂包埋在与身体组织相容的脂质体或微乳中来制备。可注射材料可例如通过用细菌保留滤器过滤来进行除菌。
制剂或组合物可以单剂量提供,或者以多剂量密封容器(例如安瓿和小瓶)提供,且可在冻干条件下保存,在临用前仅需要加入无菌液体载体如注射用水。可从上述类型的无菌粉末、颗粒和片剂即时制备注射溶液和混悬剂。
在一个方面,本发明还涉及包含如本文所述的锌铝复合佐剂以及一种或多种抗原的免疫原性组合物。
如本文所用的免疫原性组合物在被施用至受试者或动物时,能引起针对其中所包含的所述一种或多种抗原的保护性免疫应答的组合物。
在一个方面,本发明还涉及包含如本文所述的锌铝复合佐剂以及一种或多种抗原的疫苗组合物。
如本文所用的疫苗组合物在被施用至受试者或动物时,能引起针对例如微生物的保护性免疫应答,或者能有效地保护受试者或动物免受感染。
疫苗组合物可用于防止或改善会对免疫应答调节作出有利响应的病理状况。这样的疫苗组合物可以是预防性疫苗或治疗性疫苗。优选地,疫苗组合物包括基因工程疫苗,例如蛋白质疫苗,例如水痘带状疱疹病毒重组蛋白疫苗。
在一个方面,本发明还涉及包含如本文所述的锌铝复合佐剂的疫苗佐剂。例如,这样的疫苗佐剂还可以包含如下文所述的次要佐剂。
如本文所用的术语“佐剂”或“疫苗佐剂”意在指能够非特异性地加速、延长或增强对抗原的免疫应答的物质。
有利地,佐剂还可减少进行保护性免疫所需的免疫次数或抗原数量。
众所周知,佐剂本身不会或几乎不会诱发免疫应答,但是佐剂会提高对抗原的免疫应答。因此,可将本发明的锌铝复合佐剂与一种或多种抗原进行组合,以产生可用于在个体中引起免疫应答的免疫原性组合物或疫苗。有多种物质可用作免疫原性类型的或疫苗类型的化合物或制剂中的抗原,例如,减毒的和灭活的病毒和细菌病原体、纯化的大分子、蛋白质、多糖、类毒素、重组抗原、含有来自病原体的外来基因的生物体、合成的肽、聚核酸、抗体和肿瘤细胞等。抗原在预防性和治疗性疫苗中都可使用。抗原包括蛋白质抗原,例如水痘带状疱疹病毒ge糖蛋白抗原(vzvge)。
多种免疫调节分子也可与本发明的锌铝复合佐剂组合使用,以改变个体中的免疫应答。本文所述的免疫调节剂,是指能调节、平衡及恢复机体免疫功能的一类制剂,常用的免疫调节剂有免疫促进剂、免疫抑制剂及免疫双向调剂三大类。
抗原和锌铝复合佐剂在本发明疫苗组合物中的量及所施用的剂量,通过制药领域技术人员公知的技术来确定,其中要考虑到诸如以下的因素:具体的抗原,具体的动物或患者的年龄、性别、体重、物种和状况,以及施用途径。
在一个优选的实施方案中,本发明的疫苗组合物还包含一种或多种选自以下的组分:表面活性剂、吸收促进剂、吸水聚合物、抑制酶促降解的物质、醇、有机溶剂、油、ph控制剂、防腐剂、渗透压控制剂、抛射剂、水以及它们的任意混合物。
本发明的疫苗组合物还可包含药学上可接受的载体。载体的量将取决于其他成分所选定的量、抗原的所需浓度、施用途径的选择(口服还是胃肠外途径)等。载体可在任何方便的时间加到疫苗。在冻干的疫苗的情况中,可例如在临施用前加入载体。或者,最终产品可制造成带有载体。
适当的载体的例子包括但不限于无菌水、盐水、缓冲液、磷酸缓冲盐水、缓冲氯化钠、植物油、最小必需培养基(mem)、具有hepes的mem,等等。
任选地,本发明的疫苗组合物可含有不同数量的常规次要佐剂,数量取决于该佐剂和所需的结果。
合适的次要佐剂的例子包括但不限于稳定剂;乳化剂;ph调节剂,如氢氧化钠、盐酸等;表面活性剂,如tween.rtm.80(聚山梨醇酯80,可从sigmachemicalco.(st.louis,mo.)市售获得);脂质体;iscom佐剂;合成的糖肽,如胞壁酰二肽;增量剂,如右旋糖苷;聚羧乙烯;细菌细胞壁,如分枝杆菌细胞壁提取物;它们的衍生物,如短小棒状杆菌(corynebacteriumparvum);痤疮丙酸杆菌(propionibacteriumacne);牛分支杆菌(mycobacteriumbovis),例如卡介菌(bovinecalmetteguerin,bcg);牛痘或动物痘病毒蛋白;亚病毒颗粒佐剂,如环状病毒;霍乱毒素;n,n-双十八烷基-n',n'-双(2-羟乙基)-丙二胺(吡啶);单磷酰脂质a;二甲基双十八烷基溴化铵(dda,可从kodak公司(rochester,n.y.))市售获得;它们的合成物和混合物。
合适的稳定剂的例子包括但不限于蔗糖、明胶、蛋白胨、消化的蛋白质提取物如nz-胺或nz-胺as。乳化剂的例子包括但不限于矿物油、植物油、花生油和其他可用于注射剂或鼻内疫苗组合物的标准、可代谢、无毒的油。
出于本发明的目的,这些佐剂在本文指称为“次要”仅仅是为了与上述的锌铝复合佐剂形成对比,因为锌铝复合佐剂与抗原物质相组合可显著提高针对该抗原物质的免疫应答从而其作为疫苗组合物中的必要成分。次要佐剂主要是作为加工助剂包括在疫苗制剂中,尽管某些佐剂的确具有一定程度的免疫增强性质从而具有双重目的。
常规的防腐剂可以以约0.0001%(重量)至约0.1%(重量)的有效量加到疫苗组合物。取决于制剂中所采用的防腐剂,这个范围以下或以上的数量也可使用。典型的防腐剂包括例如山梨酸钾、焦亚硫酸钠、苯酚、羟苯甲酯、羟苯丙酯、硫柳汞等。
失活的、修饰的或其他类型的疫苗组合物的选择以及本发明的改进的疫苗组合物制剂的制备方法,是本领域普通技术人员知道的或者容易确定的。
一般而言,本发明的疫苗组合物便利地通过口服、胃肠外(皮下、肌肉内、静脉内、真皮内、腹腔或腹膜内)、口腔内、鼻内或透皮途径施用。本发明所设想的施用途径将取决于抗原物质和辅助剂。例如,如果疫苗组合物含有皂苷类,虽然它们口服或鼻内施用时是无毒的,但必须小心不要将皂苷元糖苷注射到血流中,因为它们起到强溶血剂的作用。还有,许多抗原如果口服的话将不会有效。优选地,疫苗组合物通过肌肉或腹腔途径施用。
疫苗组合物的剂量将显著取决于所选择的抗原、施用途径、物种和其他标准因素。设想到,本领域普通技术人员可很容易地滴定出用于针对每种抗原的免疫应答的适当剂量,以获知有效的免疫量和施用方法。
作为疫苗佐剂,本发明的锌铝复合佐剂可通过增强较弱的抗原(如高度纯化的或重组的抗原)的免疫原性、减少免疫应答所需的抗原的量、减少提供保护性免疫所需的免疫频率来提高疫苗的有效性,可改进疫苗在免疫应答减低或弱化的个体(如新生儿、老年人和免疫受损的个体)中的功效,和可增强在靶标组织中的免疫性,或者通过引发特定的细胞因子谱来促进细胞介导的免疫和/或体液免疫。
抗原和/或免疫调节分子与本发明的锌铝复合佐剂的组合,可在本领域公知的多种临床前毒理学和安全性研究中进行试验。
例如,可在这样的动物模型中评价这种组合:该抗原已被发现在该动物模型中具有免疫原性,且该动物模型可通过与提议用于人临床试验的途径相同的途径可再现地进行免疫。
抗原和/或免疫调节分子与本发明的锌铝复合佐剂的组合,可例如通过由美国食品与药物管理局生物制品评价与研究中心与美国国家过敏症与传染病研究所(goldenthal,kl等人.aidreshumretroviruses,9:s45-9(1993))提出的方案进行试验。
本领域技术人员会知道如何为抗原和/或免疫调节分子与本发明的锌铝复合佐剂的具体组合确定适当的抗原负荷、免疫途径、剂量、抗原纯度和可用于在特定动物物种中治疗特定病理状况的接种方案。
用于诱导免疫应答的本发明免疫原性组合物或疫苗,可与药学上可接受的介质一起作为溶液或悬浮液施用。
这种药学上可接受的介质可为例如水、磷酸缓冲盐水、生理盐水或其他生理缓冲盐水、或者其他溶剂或介质,如二元醇、甘油和油(如橄榄油)或可注射有机酯。药学上可接受的介质还可含有脂质体或胶束,且可含有通过将多肽或肽抗原与去污剂和糖苷(如quila)混合在一起制备的免疫刺激复合物。
本发明的免疫原性组合物或疫苗可通过多种途径施用以刺激免疫应答。例如,免疫原性组合物或疫苗可通过皮下、真皮内、淋巴内、肌肉内、肿瘤内、膀胱内、腹腔、腹膜内和脑内途径递送。
本领域技术人员会知道如何选择用于本发明锌铝复合佐剂的具体制剂的适当递送途径。
在本发明的一个优选实施方案中,用于在哺乳动物中治疗或预防感染的接种方法包括使用本发明的疫苗,该疫苗具体而言将通过肌肉或腹腔施用。疫苗可作为单独剂量施用,或者优选地根据初次免疫/加强免疫模式每周或每月施用数次,例如两次、三次或四次。适当的剂量根据各种参数而定。
在一个方面,本发明还涉及如本文所述的锌铝复合佐剂用于制备疫苗佐剂、药物组合物、免疫原性组合物或疫苗组合物的用途,优选地,所述疫苗包括蛋白质疫苗,例如水痘带状疱疹病毒蛋白重组疫苗。
附图说明
图1a为本发明制备例1中序列沉淀的工艺示意图;
图1b为本发明制备例1中分别沉淀后混合的工艺示意图;
图1c为本发明制备例1中共沉淀的工艺示意图;
图2a为本发明实施例1中锌铝复合佐剂al-002-zn(zn/al=0.023)的透射电镜照片;
图2b为本发明实施例1中锌铝复合佐剂al-002-zn(zn/al=0.047)的透射电镜照片;
图2c为本发明实施例1中锌铝复合佐剂al-002-zn(zn/al=0.1)的透射电镜照片;
图2d为本发明实施例1中锌铝复合佐剂al-002-zn(zn/al=0.375)的透射电镜照片;
图3为本发明实施例2中石墨炉法测定锌铝复合佐剂中的铝含量的标准曲线;
图4为本发明实施例3中火焰法测定锌铝复合佐剂中锌含量的标准曲线;
图5为本发明实施例4中不同实验组对小鼠血清特异性抗体滴度影响的示意图,平均值±sd:n=5;
图6为本发明实施例4中不同实验组第一次免疫小鼠的血清特异性抗体水平比较示意图,平均值±sd:n=5;
图7为本发明实施例4中不同实验组第二次免疫小鼠的血清特异性抗体水平比较示意图,平均值±sd:n=5;
图8为本发明实施例5中不同zn/al摩尔比的锌铝复合佐剂配伍vzvge第一次免疫小鼠的血清特异性抗体滴度示意图,平均值±sd:n=5;
图9为本发明实施例5中不同zn/al摩尔比的锌铝复合佐剂配伍vzvge第二次免疫小鼠的血清特异性抗体滴度示意图,平均值±sd:n=5;
图10为本发明实施例7中不同的锌添加方式制备的锌铝复合佐剂配伍vzvge对小鼠血清抗体滴度影响的示意图,平均值±sd:n=5;
图11为本发明实施例8中不同试剂组的肌肉免疫对小鼠血清抗体滴度影响的示意图,平均值±sd:n=5;
图12为本发明实施例8中不同试剂组的腹腔免疫对小鼠血清抗体滴度影响的示意图,平均值±sd:n=5。
图13为本发明实施例9中不同ph值的锌铝复合佐剂配伍vzvge对小鼠血清抗体滴度影响的示意图,平均值±sd:n=5;
图14为本发明实施例6中不同佐剂配伍vzvge对小鼠外周血单核细胞γ-ifn表达影响的示意图;
图15为本发明实施例10中金属锌、钙、铁修饰的铝佐剂配伍vzvge对小鼠特异性血清抗体滴度影响的示意图,平均值±sd:n=5;
图16为本发明实施例10中金属铜、钴、锰修饰的铝佐剂配伍vzvge对小鼠特异性血清抗体滴度影响的示意图,平均值±sd:n=5;
图17为本发明实施例10中金属镁修饰的铝佐剂配伍vzvge对小鼠特异性血清抗体滴度影响的示意图,平均值±sd:n=5。
具体实施方式
下面结合实施例对本发明实施方案进行详细描述,但是本领域技术人员将会理解,下面实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中的未注明具体条件者,按照常规条件或制作商建议的条件进行。所用试剂或仪器未注明生产商者,均为可以通过市购获得的常规产品。
下述制备例、实施例所使用的材料如下::
六水氯化铝(alcl3·6h2o):购自sigma-aldrich;
无水氯化锌(zncl2):购自sigma-aldrich;
二水合磷酸氢二钠(na2hpo4·2h2o):购自honeywell;
氢氧化钠(naoh):购自四川金山制药有限公司。
制备例1:锌铝复合佐剂fh-001的lot161001-2批次产品的制备
(1)溶液的配制:
采用六水氯化铝和无水氯化锌加水配制成含124.44mm氯化铝和46.68mm氯化锌的溶液0.25l,定义为a溶液;采用二水合磷酸氢二钠和氢氧化钠加水配制成含18.68mm磷酸盐和0.425m氢氧化钠的溶液0.25l,定义为b溶液,采用0.22μm滤膜过滤备用;
(2)锌铝复合佐剂的制备:
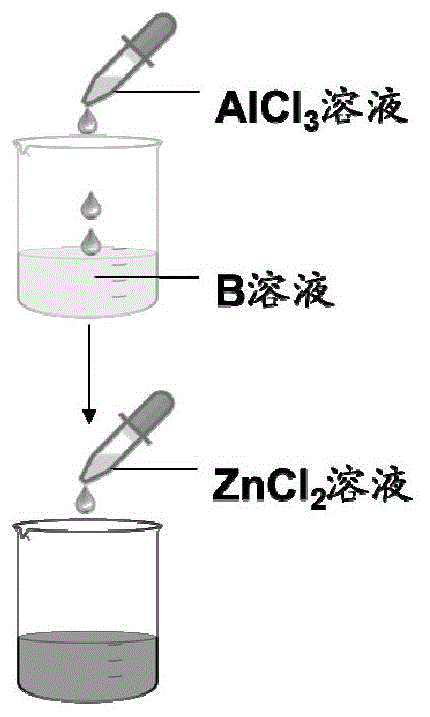
图1a-图1c提供了由b溶液或者a溶液及b溶液生成复合佐剂的三种方式,分别为序列沉淀(图1a)、分别沉淀后混合(图1b)、共同沉淀(图1c)。
按照图1c所示,将0.25lb溶液往0.25la溶液里逐滴滴加,直至完全加完,获得锌铝复合佐剂fh-001的lot161001-2批次产品(zn/al摩尔比为0.375、p/al摩尔比为0.15);对获得的锌铝复合佐剂进行一次121℃、60min的高压蒸汽灭菌,测定灭菌之后的ph值、粒径及颗粒形态等理化性质。
制备例2:锌铝复合佐剂fh-001的lot161001-3批次、lot161001-4批次产品的制备
按照制备例1方法制备得到锌铝复合佐剂fh-001的lot161001-3批次产品、lot161001-4批次产品。
制备例3:实验例4中锌铝复合佐剂al-001-zn(zn/al=0.375)的制备
参照制备例1,但a溶液浓度、b溶液浓度均为制备例1中的1/2,得到锌铝复合佐剂al-001-zn(zn/al=0.375)。
制备例4:锌铝复合佐剂al-002-zn(zn/al=0.023)的制备
(1)溶液的配制:
采用六水氯化铝和无水氯化锌加水配制成含66.93mm氯化铝和1.55mm氯化锌的溶液0.5l,定义为a溶液;采用二水合磷酸氢二钠和氢氧化钠加水配制成含18.68mm磷酸盐和0.05m氢氧化钠的溶液0.5l,定义为b溶液,采用0.22μm滤膜过滤备用;
(2)锌铝复合佐剂的制备:
按照图1c所示,将0.5lb溶液向0.5la溶液里逐滴滴入直至完全滴完,获得锌铝复合佐剂al-002-zn(zn/al摩尔比为0.023,p/al摩尔比为0.30);对获得的锌铝复合佐剂进行一次121℃、60min的高压蒸汽灭菌,测定灭菌之后的ph值、粒径及颗粒形态等理化性质。
制备例5:锌铝复合佐剂al-002-zn(zn/al=0.047)的制备
(1)溶液的配制:
采用六水氯化铝和无水氯化锌加水配制成含65.37mm氯化铝和3.11mm氯化锌的溶液0.5l,定义为a溶液;采用二水合磷酸氢二钠和氢氧化钠加水配制成含18.68mm磷酸盐和0.05m氢氧化钠的溶液0.5l,定义为b液,0.22μm滤膜过滤备用;
(2)锌铝复合佐剂的制备:
制备工艺与制备例4中的(2)相同,得到锌铝复合佐剂al-002-zn(zn/al摩尔比为0.047,p/al摩尔比为0.30)。
制备例6:锌铝复合佐剂al-002-zn(zn/al=0.1)的制备
(1)溶液的配制:
采用六水氯化铝和无水氯化锌加水配制成含62.26mm氯化铝和6.22mm氯化锌的溶液0.5l,定义为a溶液;采用二水合磷酸氢二钠和氢氧化钠加水配制成含18.68mm磷酸盐和0.05m氢氧化钠的溶液0.5l,定义为b液,0.22μm滤膜过滤备用;
(2)锌铝复合佐剂的制备:
制备工艺与制备例4中的(2)相同,得到锌铝复合佐剂al-002-zn(zn/al摩尔比为0.1,p/al摩尔比为0.30)。
制备例7:锌铝复合佐剂al-002-zn(zn/al=0.375)的制备
(1)溶液的配制:
采用六水氯化铝和无水氯化锌加水配制成含49.80mm氯化铝和18.68mm氯化锌的溶液0.5l,定义为a溶液;采用二水合磷酸氢二钠和氢氧化钠加水配制成含18.68mm磷酸盐和0.05m氢氧化钠的溶液0.5l,定义为b液,0.22μm滤膜过滤备用;
(2)锌铝复合佐剂的制备:
制备工艺与制备例4中的(2)相同,得到锌铝复合佐剂al-002-zn(zn/al摩尔比为0.375,p/al摩尔比为0.3)。
制备例8:锌铝复合佐剂al-002-zn(zn/al=0.5)的制备
(1)溶液的配制:
采用六水氯化铝和无水氯化锌加水配制成含62.26mm氯化铝和34.24mm氯化锌的溶液0.5l,定义为a溶液;采用二水合磷酸氢二钠和氢氧化钠加水配制成含18.68mm的磷酸盐和0.05m氢氧化钠的溶液0.5l,定义为b液,0.22μm滤膜过滤备用;
(2)锌铝复合佐剂的制备:
制备工艺与制备例4中的(2)相同,得到锌铝复合佐剂al-002-zn(zn/al摩尔比为0.5,p/al摩尔比为0.30)。
制备例9:锌铝复合佐剂al-002-zn(zn/al=0.375,ph值=5.6)的制备
将制备例7制备的锌铝复合佐剂al-002-zn(zn/al=0.375)利用12m盐酸或10m氢氧化钠溶液进行ph调节,使佐剂最终ph值为5.6。
制备例10:锌铝复合佐剂al-002-zn(zn/al=0.375,ph值=6.6)的制备
将制备例7制备的锌铝复合佐剂al-002-zn(zn/al=0.375)利用12m盐酸或10m氢氧化钠溶液进行ph调节,使佐剂最终ph值为6.6。
制备例11:锌铝复合佐剂al-002-zn(zn/al=0.375,ph值=7.6)的制备
将制备例7制备的锌铝复合佐剂al-002-zn(zn/al=0.375)利用12m盐酸或10m氢氧化钠溶液进行ph调节,使佐剂最终ph值为7.6。
制备例12:铝佐剂al-001的制备
(1)溶液的配制:
采用六水氯化铝加水配制成0.5l62.22mm氯化铝溶液,定义为a溶液;采用二水合磷酸氢二钠和氢氧化钠加水配制成含9.33mm磷酸盐和0.15m氢氧化钠的溶液0.5l,定义为b液,0.22μm滤膜过滤备用;
(2)铝佐剂的制备:
按照图1c所示,将0.5lb溶液向0.5la溶液里逐滴滴入直至完全滴完,得到铝佐剂al-001(p/al摩尔比为0.15)。
对获得的铝佐剂进行一次121℃、60min的高压蒸汽灭菌,冷却至室温后置于2-8℃中储存。
制备例13:铝佐剂al-002的制备
(1)溶液的配制:
采用六水氯化铝加水配制成62.22mm的氯化铝溶液0.5l,定义为a溶液;采用二水合磷酸氢二钠和氢氧化钠加水配制成含18.68mm磷酸盐和0.12m氢氧化钠溶液0.5l,定义为b液,0.22μm滤膜过滤备用;
(2)铝佐剂的制备:
制备工艺与制备例12中的(2)相同,得到铝佐剂al-002(p/al摩尔比为0.3)。
对获得的铝佐剂进行一次121℃、60min的高压蒸汽灭菌,冷却至室温后置于2-8℃中储存。
实验例1:锌铝复合佐剂的理化性质测定
以下检测方法适用于任何一种zn/al摩尔配比及p/al摩尔配比的锌铝复合佐剂理化性质测定;
(1)佐剂颗粒形态观察:
将锌铝复合佐剂al-002-zn用去离子水稀释50至100倍后,利用日本electronics的jem-2100透射电子显微镜(transmissionelectronmicroscopy,tem)进行观察。具体的步骤如下:将佐剂样品滴于渡炭的铜网上,令其吸附10min,用滤纸擦去残液,送入透射电镜的样品室里,观察样品形态,拍照以备进一步分析。
实验结果:图2a-2d中的不同zn/al摩尔配比的佐剂具有明显区别,当zn/al摩尔配比为0.1时可以清晰看到球形纳米核心颗粒,zn/al摩尔配比为0.023及0.047时,佐剂类似紫菜团,zn/al摩尔配比为0.375时,呈现丝状的细微结构,并聚集成团。
(2)ph测定:
取供试品,放置室温平衡至少30分钟,利用sartoriusph玻璃电极进行测量。
选择标准缓冲液(ph7.00)、标准缓冲液(ph4.01)、标准缓冲液(ph10.01)按照使用说明书要求校正仪器。
按“mode”(转换)键可以在ph和mv模式之间进行切换。通常测定溶液ph值将模式至于ph状态。
按“setup”键,显示屏显示clearbuffer,按“enter”键确认,清除以前的校准数据。
按“setup”键直至显示屏显示缓冲溶液组“4.01,7.00,10.01”,按“enter”键确认。
将电极小心从电极储存液中取出,用去离子水充分冲洗电极,冲洗干净后用滤纸吸干表面水(注意不要擦拭电极)。
将电极浸入第一种缓冲溶液(ph7.00),等到数值稳定并出现“s”时,按“standardize”键,等待仪器自动校准。校准成功后,将显示“7.00”和电极斜率。
将电极从第一种缓冲溶液中取出,用去离子水充分淋洗电极,将电极依次浸入第二种缓冲溶液(ph4.01),等到数值稳定并出现“s”时,按“standardize”键,等待仪器自动校准。校准成功后,将显示“4.017.00”和信息“%slope××”。××显示测量的电极斜率值,该测量值在90-105%范围内可以接受。
如果与理论值有很大偏差,将显示错误信息(err),电极应清洗,并重复上述步骤校准。
重复以上操作完成第三点(ph10.01)校准。
校准完成后,用去离子水充分淋洗电极,然后滤纸轻轻吸干。摇匀供试品溶液,将玻璃电极浸入供试品溶液中,至ph值的读数在1分钟内改变不超过±0.05时进行读数。
摇匀供试品溶液,重新测量,两次ph值的度数相差应不超过0.1。取两次读数的平均值作为供试品ph值。
实验结果见表1。
锌铝复合佐剂灭菌前ph的范围为8.0-9.0,灭菌后为6.5-8.0;
(3)粒径大小的测定:
打开beckmanls13320激光粒径测试仪,预热15min。
打开仪器控制软件和样品池封闭舱,将样品池从样品槽中取出并加入12ml纯化水。
将样品池置于样品槽上,关闭舱门。
点击“startcycle”,依次选择“measureoffsets”、“align”、“measurebackground”,最后点击“start”,在弹出的对话框中点击“ok”开始校正空白背景。
取出样品池,加入一定质量的标准样品(仪器自带),点击“startcycle”,依次选择“measureloading”、“entersampleinfo”、“enterrunsetting”、“startruns”,最后点击“start”,在弹出的对话框中输入标准样品名称,待软件中“obscuration”参数为8%-12%时点击“ok”,进行标准样品的测试。
为保证实验数据的准确性和可靠性,每次开机测量之前均需校正空白背景和测试标准样品的大小。
打开样品池封闭舱,取出样品池。
将样品池内含有标准样品的水溶液倒弃,倒入去离子水清洗样品池3遍。
清洗完毕后加入12ml纯化水,将样品池置于样品槽上,关闭舱门。
点击“startcycle”,依次选择“measureoffsets”、“align”、“measurebackground”,最后点击“start”,在弹出的对话框中点击“ok”开始校正空白背景。
取出样品池,加入一定体积的检测样品,打开样品测试舱门,将样品池置于样品槽上,关闭舱门。
点击“startcycle”,选择“entersampleinfo”、“enterrunsetting”、“startruns”,最后点击“start”,在弹出的对话框中输入样品名称,待软件中“obscuration”参数为8%-12%时点击“ok”,记录样品测得的粒径大小;
实验结果见表1,锌铝复合佐剂的颗粒形态如图2a-2d所示。
锌铝复合佐剂颗粒大小1-20μm。
(4)沉降性质测定:
配制一定体积0.9%nacl溶液,取70ml佐剂和210ml0.9%nacl溶液进行混合,混匀后倒入250ml量筒中至250ml,同时用秒表开始计时,依次记录下t50、t25、v2h(%)、v24h(%)。其中:
沉降时间t50:沉降体积比为0.5时所需要的时间;
沉降时间t25:沉降体积比为0.25时所需要的时间;
沉降体积比v2h:沉降2h时的vh与总体积的比;
沉降体积比v24h:沉降24h时的vh与总体积的比;
沉降体积比:vh/vh0;h0佐剂总体积,h为沉淀体积。
实验结果见表1。
沉降时间t50:20-30min;t25:100-130min;v2h:20-30%;v24h:15-20%。
表1:锌铝复合佐剂的ph、粒径大小、沉降性质
注:“-”,未进行检测。
(5)吸附率检测:
bsa标准品绘制标准曲线:5mmhis-hcl(ph6.5)/150mmnacl为稀释缓冲液,将bsa标准品(2mg/ml)进行系列稀释,用uv2100pro检测其在280nm处的吸光值,od280在0.2-0.8(放宽至0.2-1.5)之间准确度高。
bsa梯度稀释(ep):5mmhis-hcl(ph6.5)/150mmnacl为稀释缓冲液,称取一定量bsa样品,稀释至ep中规定的浓度梯度:0.5mg/ml、1mg/ml、2mg/ml、3mg/ml、5mg/ml、10mg/ml,待用。
bsa与佐剂混合:bsa:佐剂=3:1(体积比)做为吸附率检测实验条件;将佐剂摇匀后,按照前述实验条件与不同浓度bsa分别进行混合,室温吸附1h,期间摇晃5次;用13000rpm/min离心3min后取上清,待用。
蛋白浓度测定:ep中蛋白浓度测定采用lowry法,结合实际情况,本实验中采用uv2100pro直接测定上清在280nm处的吸光值,使读值在0.2-0.8之间,否则需进行稀释。
吸附率计算:吸附率=(1-(上清中od280(稀释倍数x))/稀释x倍后的理论od280)*100
实验结果如下表:
表2:锌铝复合佐剂的蛋白吸附能力
实验例2:锌铝复合佐剂中(al-001-zn(zn/al=0.375))铝含量的测定(石墨炉法)
采用石墨炉法(d2灯背景校正)测定锌铝复合佐剂中铝含量并规范测定操作流程;检测仪器为原子吸收分光光度计:岛津aa6300c(p/n206-52430);
标准品溶液及待测样品的配制:标准曲线的配制:铝标准品原始浓度100μg/ml,利用0.1m盐酸溶液将其稀释成20ng/ml、50ng/ml、100ng/ml和150ng/ml的标准品;
供试品溶液的准备:用0.1m盐酸溶液将样品稀释1000倍,需用涡旋混和仪震动混匀;
aa-6300c操作方法及wizaard软件使用方法:
打开电源:计算机开机、aa-6300c电源开关、自动进样器asc-6100f电源开关、gfa-ex7i电源开关、冷却水循环电源开关、通风系统开关。(注意:gfa-ex7i的电源开关扳手(heat)此时处于关闭状态。);
打开氩气:次级压力不得低于0.5mpa;
wizaard软件基本操作:选择元素→“校准曲线设置”和“编辑参数”→打开gfa-ex7i的电源开关扳手(heat),“连接主机/发送参数”→“光学参数”标签页中,设定波长[396.2nm],狭缝宽[0.7nm]→在“石墨炉程序”页面中,“最大阶段号”选择[7],“采样阶段号”选择[6]→石墨炉原子化器原点位置调节→检查asc管口位置→在菜单栏中选择[参数]→[编辑参数]→将点灯方式改为<bgc-d2>→清洁→在mrt工作单上依次设置空白组(blk)、标准品(std)、待测样品(unk)的位置及上样量(10μl),输入标准品的理论浓度以及待测样品的样品名称,选择<开始>进行检测→导出并保存数据,断开仪器与计算机的连接→关机:检测结束后,关闭所有电源,包括计算机、aa-6300c电源开关、自动进样器asc-6100f电源开关、gfa-ex7i电源开关、冷却水循环电源开关、通风系统开关,关闭氩气;
实验结果:
标准曲线测定:
表3:标准曲线的测定(图3)
表4:锌铝佐剂al-001-zn(zn/al=0.375)中铝的含量检测结果
实验例3:锌铝复合佐剂al-001-zn(zn/al=0.375)锌含量的测定(火焰法)
采用火焰法(d2灯背景校正)测定锌铝复合佐剂中锌含量并规范测定操作流程。检测仪器为原子吸收分光光度计:岛津aa6300c(p/n206-52430;
标准品溶液及待测样品的配制:标准曲线的配制:锌标准品原始浓度500μg/ml,利用0.1m盐酸溶液将其稀释成500ng/ml、1000ng/ml、1500ng/ml、2000ng/ml和2500ng/ml的标准品。
供试品溶液的准备:用0.1m盐酸溶液将样品稀释400倍,需用涡旋混和仪震动混匀。
aa-6300c操作方法及wizaard软件使用方法:
打开电源:计算机开机、aa-6300c电源开关、空气压缩机开关(保证压力为0.35mpa)、通风系统开关;
打开乙炔:缓慢打开乙炔气阀,保证初级压力为0.5mpa,次级压力为0.1mpa;
wizaard软件基本操作:登录wizaard→选择元素→“未连接仪器/发送参数”页面,点击<连接/发送参数>→在“仪器初始化”页面中进行设置→在“火焰分析的仪器检查目录”中逐项检查并打钩,点击<ok>→在“光学参数”页面中设定波长[213.86],狭缝宽[0.7],点灯方式[发射],[灯位设置]保证zn空心阴极灯的实际位置与设定位置相同,选择[点灯]→谱线搜索→燃烧器原点位置调节→在菜单栏中选择[参数]→[编辑参数]→将点灯方式改为<bgc-d2>→谱线搜索→点火:确保c2h2打开且压力达到要求后,同时按下主机上的purge和ignite键,直至点火→自动调零→在mrt工作单上设置空白组(blk)、标准品(std)、待测样品(unk),输入标准品的理论浓度以及样品名称,通过雾化器延伸出来的上样管进行手动上样,每次上样量最少1ml,选择[开始]进行检测→熄火→保存数据并断开仪器与计算机的连接→关机;
实验结果:
表5:标准曲线的绘制(图4)
实验例4:锌铝复合佐剂在vzvge疫苗上的佐剂活性测定
将制备好的锌铝复合佐剂al-001-zn(an/al=0.375)作为佐剂,其中zn/al的摩尔浓度比0.375,p/al的摩尔浓度比为0.15,将其作为佐剂与vzvge抗原二者联用肌肉注射小鼠,测定产生的特异性抗体滴度。具体方法如下:
实验动物:balb/c小鼠,6-8周,5只/组,雌性。
给药剂量:5μg/鼠;铝佐剂:50μl/鼠;锌铝复合佐剂:50μl/鼠;
实验组:(1)ph6.5的组氨酸盐缓冲液(10mm组氨酸与70mmnacl氯化钠溶液混合,ph调至6.5);(2)50μg/ml的抗原vzvge;(3)alcl3溶液(利用ph6.5组氨酸盐缓冲液,配制31.11mm氯化铝溶液)+抗原vzvge;(4)zncl2溶液(利用ph6.5的组氨酸盐缓冲液,配制31.11mm氯化锌溶液)+抗原vzvge;(5)alcl3+zncl2溶液(利用ph6.5的组氨酸盐缓冲液配制含31.11mmalcl3和11.67mmzncl2的溶液)+抗原vzvge;(6)铝佐剂al-001+抗原vzvge;(7)锌铝复合佐剂al-001-zn(an/al=0.375)+抗原vzvge;
免疫方案:用(1)、(2)组药物免疫小鼠,其余各组将药物与抗原等体积混合后免疫小鼠,小鼠按照免疫分组首次免疫后第2周,眼眶采血,测定血清中抗体滴度。第2周加强免疫,二次免疫后2周,眼眶取血,测定血清中抗体滴度,测定后2周进行第3次免疫。elisa测定血清中的抗体滴度。
酶联免疫吸附法(elisa)检测抗体结合滴度:
1.抗原包被液:1xpb7.4缓冲液(4.343gna2hpo4·7h2o;0.456gnah2po4)。
2.洗涤液:pbst,北京万泰公司elisa试剂盒
3.封闭液2xed(enzymedilution):1xpbs+0.5%酪蛋白+2%明胶+0.1%防腐剂(proclin-300),用超纯水或蒸馏水稀释至1x后用于封闭及样品稀释。
4.显色液a:北京万泰公司elisa试剂盒。
5.显色液b:北京万泰公司elisa试剂盒。
6.终止液:北京万泰公司elisa试剂盒。
实验过程:
(1)包板:用pb7.4包被缓冲液将vzvge抗原稀释至1μg/ml。100μl/孔加至聚苯乙烯96孔板中,4℃包被过夜。
(2)封闭:弃去孔内包被液,pbst洗液洗板1次,甩干,加封闭液200μl/孔,室温封闭4h。
(3)加一定稀释度的血清:弃去孔内封闭液,pbst洗板1次,甩干,首孔加待检的稀释血清150μl/孔,血清和ed稀释液按1:300稀释(v:v)(酶稀液2×ed:称量143.20g十二水合磷酸氢二钠、9.60g磷酸二氢钾、8.04g氯化钾、320.0g氯化钠、200.0g酪蛋白钠盐,吸取800ml明胶、40mlproclin防腐剂,将上述物质用超纯水定容到20l),后面的每孔加入100μled稀释液,3倍梯度稀释,25℃孵育反应1h。
(4)加酶标抗体(gam-hrp):弃去孔内血清稀释液,pbst洗板5次,甩干,加酶标抗体(gam-hrp,v:v=1:5000)100μl/孔,25℃孵育反应1h。
(5)显色:弃去孔内二抗,pbst洗板5次,甩干,以100μl/孔加入a、b等体积混匀的显色液,25℃反应10min。
(6)终止:50μl/孔加2m硫酸终止液,终止反应。
(7)读板:在酶标仪上设置检测双波长为450nm和630nm,测各反应孔的od值。
实验结果如图5-7所示:
锌铝复合佐剂组,小鼠免疫一针后,其具有起效快的特点,免疫2针后,其体液免疫增强优势依然明显;
铝佐剂免疫增强效果在起效快慢上不如锌铝复合佐剂;
alcl3溶液、zncl2溶液及alcl3溶液+zncl2溶液的免疫增强效果不如共沉淀的铝佐剂及锌铝复合佐剂。
实验例5:锌铝复合佐剂的免疫增强效果量效关系验证
将不同zn/al的摩尔比的锌铝复合佐剂分别与vzvge抗原二者联用肌肉注射小鼠,测定产生的特异性抗体滴度。具体方法如下:
实验动物:balb/c小鼠,6-8周,5只/组,雌性。
抗原浓度:50μg/ml;
对照组:铝佐剂al-002。
给药剂量:抗原:5μg/鼠;锌铝复合佐剂:50μl/鼠;铝佐剂:50μl/鼠。
实验组:(1)铝佐剂al-002;(2)al-002-zn(zn/al=0.023);(3)al-002-zn(zn/al=0.047);(4)al-002-zn(zn/al=0.1);(5)al-002-zn(zn/al=0.375)。
免疫方案:上述各药物分别与抗原等体积混合,免疫小鼠,小鼠按照免疫分组首次免疫后2周,眼眶采血,测定血清中抗体滴度。首次免疫注射后第二周检测抗体滴度,第2周加强免疫,二次免疫后2周,眼眶取血,测定血清中抗体滴度,测定后2周进行第3次免疫。elisa测定血清中的抗体滴度。
酶联免疫吸附法(elisa)检测抗体结合滴度:(参考是实验例4)。
实验结果如图8-9所示:
不同zn/al摩尔比浓度比的锌铝复合佐剂组,小鼠免疫一针后,不仅起效快,且具有明显的正相关的量效关系;免疫2针后,量效关系依然明显;说明锌铝复合佐剂在vzvge疫苗的体液免疫增强方面具有明显的效果。
实验例6:锌铝复合佐剂配伍vzvge对小鼠外周血单核细胞γ-ifn表达的影响
γ-ifn检测试剂:小鼠外周血单核细胞γ-ifn流式细胞仪检测试剂盒(bd)。
实验动物:balb/c小鼠,6-8周,5只/组,雌性。
实验组:(1)铝佐剂al-002;(2)锌铝复合佐剂(al-002-zn(zn/al=0.1));(3)完全弗氏佐剂(购自sigma)。
实验过程:
上述各佐剂分别与vzvge抗原等体积混合,进行0,2,4周免疫,三针免疫小鼠后2周:
取20μl、1ku/ml肝素钠,加至无菌ep管,并轻弹使其在管壁分布均匀。
收集小鼠眼眶血0.5ml,注意采集时使血液自然流出,切勿挤压,轻摇,使之与肝素混匀。
向0.5ml血液里加入0.5ml无菌pbs,此时总体积为1ml,取等体积的分离介质于流式管中,做好标记,将pbs稀释后的血液缓慢加入流式管中,勿将分离介质冲破,使血液均匀分布在分离介质上。
于400×g(约1800rpm)平稳离心30min,中间白色条带为目标细胞,用枪头顺着液面吸出至新的ep管中,并做好标记,用1mlpbs悬浮收集的pbmc,300×g离心10min,去上清,轻弹管壁使细胞完全分散。
固定:每管加入1ml固定液(bdcytofixtmfixationbuffer),避光,固定15min,300×g离心10min去除固定液,轻弹,使细胞完全分散。
通透:每管加入1ml穿透液(bdperm/washtmfixationbuffer,按说明书,需先用超纯水稀释成1×后再使用),通透15min,300×g离心10min去除固定液,轻弹,使细胞完全分散。
抗体染色:每管加入50μl穿透液,再加入10μl鸡尾酒抗体(mouseth1/th2/th17phenotypingkit)避光反应30min,而后加入200-300μlpbs,待用。
依次打开电脑、bd流式细胞分析仪以及配套软件,点击cytometerstartup,打开液流,仪器需预热15-20分钟至稳定。
安装合适的喷嘴,外周血检测通常使用85μm或70μm。
打开激光:percp-cy5.5(cd4+)—488nm
pe(il-17a)—488nm
fitc(γ-ifn)—488nm
apc(il-4)—633nm
调节flowjow中的参数,使得drop与gap选项显示的数值一致。
调节amp1,使其在第三至第四液滴之间。
将已用pbs稀释好的细胞样品装至流式管中,放在上样口处。
建立文件夹,添加实验程序,lode管子,修改各激光对应的电压值,使得fsc&ssc图示中所示的细胞位于整个图像的对角线上,开始计数,圈出需要分析的细胞区域,技术完毕后,点击unlode,完成对该样品的分析。
点击nexttube,重复前述步骤进行其他样品的分析。
导出实验数据,用仪器自带的数据分析软件flowjo7.6对数据进行处理。
实验结果如图14所示:
锌铝复合佐剂促进γ-ifn分泌量大于铝佐剂,铝佐剂组cd4+γ-ifn+为阳性的pbmc比例为0.015%,锌铝复合佐剂组为14.3%,弗氏佐剂组为18.1%,说明锌铝复合佐剂在刺激细胞免疫反应中有一定的效果。
实验例7:锌铝复合佐剂不同锌添加方式配伍vzvge对小鼠血清抗体滴度的影响
al-002-zn(zn/al=0.1)-共沉淀、al-002-zn(zn/al=0.375)-共沉淀由制备例6和7制备,将al-002-zn(zn/al=0.1)-共沉淀、al-002-zn(zn/al=0.375)-共沉淀与等体积重组蛋白vzvge抗原配伍进行实施例4的实验。
al-002-zn(zn/al=0.1)-简单混合及al-002-zn(zn/al=0.375)-简单混合:在铝佐剂al-002基础上添加与共沉淀组等量的氯化锌,然后分别与等体积重组蛋白vzvge抗原配伍,进行实施例4所述的实验。
结果如图10所示:本发明共沉淀法制备的锌铝复合佐剂能更快且更好地增强免疫应答。
实验例8:锌铝复合佐剂配伍vzvge的不同施用途径对小鼠血清抗体滴度的影响
按照实验例4,将组氨酸盐缓冲液、vzvge、铝佐剂配伍vzvge组、锌铝复合佐剂配伍vzvge分别通过肌肉和腹腔注射来免疫小鼠,检测血清抗体滴度,结果分别如图11-12所示,不同施用途径注射的锌铝复合佐剂均能更快且更好地增强免疫应答。
实验例9:不同ph的锌铝复合佐剂配伍vzvge对小鼠血清抗体滴度的影响
采用实验例4所述的实验流程,将不同ph值的锌铝复合佐剂配伍vzvge免疫小鼠,检测血清抗体滴度。如图13所示的结果显示,不同ph值的锌铝复合佐剂均能够更快且更好地增强免疫应答。
实施例10:其它金属修饰的铝佐剂配伍vzvge对小鼠特异性血清抗体滴度的影响
按照制备例7工艺,将其中的氯化锌替换为等摩尔的氯化钙、氯化铁、氯化铜、氯化钴、氯化锰、氯化镁,分别制备得到钙、铁、铜、钴、锰、镁与铝的复合佐剂,将它们分别配伍vzvge免疫小鼠,并与铝佐剂、锌铝复合佐剂进行比较,检测血清抗体滴度。
如图15-17所示的结果显示,与铝佐剂相比,锌铝复合佐剂表现出起效快和更好的免疫应答;钙、铁与铝的复合佐剂也表现出比铝佐剂更快起效的作用,但效果不如锌铝复合佐剂;铜、钴、锰、镁与铝的复合佐剂免疫应答增强效果较差。
- 还没有人留言评论。精彩留言会获得点赞!