用于递送具有特异性剪切HBV基因功能的核酸类药物的系统及其应用的制作方法
本发明属于基因工程及药物制剂领域,涉及靶向递送可以剪辑(特异性修饰)人乙肝病毒(hbv)基因(s/x)的sgrna表达载体及crispr/cas9核酸酶表达载体的脂质类非病毒载体-核酸类药物复合物。
背景技术:
乙型病毒性肝炎是由乙肝病毒(hbv)引起的、以肝脏炎性病变为主,并可引起多器官损害的一种疾病。乙肝广泛流行于世界各国,主要侵犯儿童及青壮年,少数患者可转化为肝硬化或肝癌,已成为严重威胁人类健康的世界性疾病。全球慢性乙肝病毒感染者超过两亿,每年因其引起的肝硬化、终末期肝病和肝癌等并发症死亡人数约60万。目前临床上使用干扰素-α,及核苷类似物如拉米夫定、恩替卡韦、阿德福韦酯等药物治疗乙肝,不仅用药时间长,还不能获得抑制hbv复制的良好疗效,因此,对于乙型肝炎病毒(hbv)感染的治疗方法仍有待创新技术与新药带来的突破。
核酸类药物是各种具有不同功能的核糖核苷酸(rna)或脱氧核糖核苷酸(dna),主要在基因水平上发挥作用。一般认为,核酸药物包括aptamer、抗基因(antigene)、核酶(ribozyme)、反义核酸(antisencenucleicacid)、rna干扰剂。核酸类药物特异性针对致病基因,也就是说具有特定的靶点和作用机制,因此核酸类药物具有广泛的应用前景。
以crispr/cas9系统为代表的核酸类药物表现出越来越大的临床应用潜力,部分crispr/cas9药物已经处于临床前和临床试验。crispr/cas9系统的工作原理是crrna(crispr-derivedrna)通过碱基配对与tracrrna(trans-activatingrna)结合形成tracrrna/crrna复合物,此复合物引导核酸酶cas9蛋白在与crrna配对的序列靶位点剪切双链dna。通过人工设计这两种rna,可以形成具有引导作用的sgrna(singleguiderna),以引导cas9对dna的定点切割。
为达到治疗效果,核酸类药物必须进入靶细胞内部才能发挥作用,而核酸分子进入机体后很快会被机体降解。因此,确保核酸分子高效、完整的进入靶细胞是核酸类药物面临的主要难题。脂质类非病毒载体主要包括阳离子脂质体、脂质类胶束、纳米粒等,非病毒载体相对于病毒载体具有免疫原性低,药物装载量大、易于工业化生产等优势,其在临床应用上具有很大的潜力。例如,利用crispr/cas9基因药物编辑hbv基因,体内、外实验表明可明显降低hbv-s、hbv-x的表达,清除hbv病毒的感染,预防hbv引起的肝炎,具有效率高、可以同时敲除修饰多个靶点基因的突出特点。但现有的脂质类非病毒载体(例如,阳离子脂质体)在核酸类药物递送效率上仍有待提高。而导致递送效率低的主要因素包括载体与药物复合后稳定性差、药物包封率低及药物靶向释放效率低,这也直接影响了基于核酸类药物递送系统的抗hbv核酸类药物制剂的治疗效果。
目前利用基因编辑载体仅能够对乙肝病毒达到清除作用(例如,中国专利201610133993.9),但临床所面临的问题在于:对于大部分的乙肝病人(例如,慢性hbv携带者),尚缺乏有效的治疗手段阻止其发展到hbv阳性肝细胞癌阶段(主要原因包括不能在基因敲除后抑制体内乙肝病毒的复制,从而基本或彻底清除体内的乙肝病毒)。同时,尽管实验表明通过敲低hbv基因的表达可以影响乙肝病毒的复制,但临床治疗肝癌的手段主要还是放疗和化疗。目前尚未见到通过清除体内的乙肝病毒达到预防和治疗肝癌(例如,hbv阳性肝细胞癌)目的的报道。
技术实现要素:
本发明的目的在于提供一种用于递送具有特异性剪切hbv基因功能的核酸类药物的系统及其应用。
为达到上述目的,本发明采用了以下技术方案:
一种靶向hbv阳性细胞的核酸类药物递送系统,该药物递送系统包括脂质类载体(粒径100~150nm)以及由所述脂质类载体包裹或装载的一种或多种用于抑制hbv复制的核酸分子,所述脂质类载体的载体材料包括阳离子脂质以及辅助脂质,辅助脂质包括ph敏感脂质成分及促免疫逃逸脂质成分。
优选的,所述脂质类载体选自ph敏感的阳离子脂质体。
优选的,所述阳离子脂质选自dotap((2,3-二油酰基-丙基)三甲基氯化铵,即n-[1-(2,3-dioleyloxy)propyl]-n,n,n-trimethylammonium)、dospa(三氟乙酸二甲基-2,3-二油烯氧基丙基-2-(2-精胺甲酰氨基)乙基铵)、dotma(n-[1-(2,3-dioleyloxy)propyl]-n,n,n-trimethylammoniumchloride)、dogs或dc-chol(3β-(n-(n’,n’-二甲基胺乙基)胺基甲酰基)-胆固醇)中的一种或多种;所述ph敏感脂质成分选自dope(二油酰基磷脂酰乙醇胺),促免疫逃逸脂质成分为dspe(二硬脂酰基磷脂酰乙醇胺)和/或dspe-peg2000。
优选的,所述脂质类载体在制备中采用的阳离子脂质:ph敏感脂质成分的摩尔比为1:(0.1~6),促免疫逃逸脂质成分的用量不超过载体材料总脂质质量的10%。
优选的,所述辅助脂质还包括膜流动性调节脂质成分,膜流动性调节脂质成分为dspc和/或胆固醇,阳离子脂质:膜流动性调节脂质成分的摩尔比为1:(0.1~5)。
优选的,所述脂质类载体选自阳离子脂质体,该阳离子脂质体的载体材料包括阳离子脂质以及辅助脂质,其中,阳离子脂质为dotap,辅助脂质为dope、dspe-peg2000以及胆固醇,所述阳离子脂质体在制备中采用的dotap:dope:胆固醇的摩尔比为1:(0.1~6):(0.1~5)(针对载体材料为dotap、胆固醇、dspe-peg2000和dope的ph敏感阳离子脂质体,摩尔比为1:(1~3):(0.5~1)时更佳,下同),dspe-peg2000用量为载体材料总脂质质量的1%~5%。
优选的,所述药物递送系统还包括用于提高该系统稳定性的辅助分子,辅助分子选自枸橼酸钠、磷酸氢二钠、磷酸二氢钠或氯化钠中的一种或多种。
优选的,所述核酸分子选自dna、sirna或microrna等类的核酸类药物。
优选的,以dna为例,所述核酸分子选自基因编辑载体。
优选的,所述基因编辑的靶向定位序列选自在crispr-cas9特异性修饰人hbv基因中可特异性靶向人hbvcccdna的sgrna。
优选的,所述基因编辑载体包括sgrna的表达载体和核酸酶cas9的表达载体,核酸酶cas9的表达载体可采用中国专利“联合免疫基因抑制hbv复制的特异性sgrna、表达载体及其应用”(申请号为201610133993.9)中的pst1374-nls-flag-cas9-zf质粒。
优选的,所述sgrna为seq.id.no.3、seq.id.no.4等可特异性靶向人hbvcccdna的sgrna。
优选的,所述sgrna的表达载体具体为pgl3-u6-hbv-ssg质粒和/或pgl3-u6-hbv-xsg质粒。pgl3-u6-hbv-ssg由序列如seq.id.no.4所示的sgrna的寡聚核苷酸双链与线性化pgl3-u6-sgrna质粒连接获得,pgl3-u6-hbv-xsg由序列如seq.id.no.3所示的sgrna的寡聚核苷酸双链与线性化pgl3-u6-sgrna质粒连接获得,通过连接seq.id.no.4或seq.id.no.3所示序列插入至pgl3-u6-sgrna质粒(质粒完整名称为pgl3-u6-sgrna-pgk-puromycin)的多克隆位点内(可参考中国专利“联合免疫基因抑制hbv复制的特异性sgrna、表达载体及其应用”,申请号为201610133993.9)。
优选的,所述pgl3-u6-hbv-ssg质粒与pgl3-u6-hbv-xsg质粒的质量比为(1~2):(1~2)。
优选的,所述核酸酶cas9的表达载体:sgrna的表达载体的质量比为(1~4):(1~3)。
上述核酸类药物递送系统的制备方法,包括以下步骤:
1)将阳离子脂质及辅助脂质溶解于同一溶剂,得到载体材料溶液;
2)将载体材料溶液的溶剂蒸除,得到脂质薄膜;
3)将脂质薄膜干燥后与水或非离子缓冲液进行水合(40~60℃),然后依次经超声分散、搅拌、微孔滤膜过滤,得到脂质类载体溶液;
4)将核酸分子与脂质类载体溶液混合后于10~30℃下进行孵育(20~60min),使脂质类载体对所述核酸分子进行包裹或装载。
优选的,所述溶剂选自氯仿或三氯甲烷等有机溶剂。
优选的,所述步骤3)中,非离子缓冲液选自浓度为10~40mmol/l的hepes溶液(浓度为20~25mmol/l时更佳);超声分散的条件为于40~60℃水浴下超声处理1~20min(5~10min更佳),搅拌的条件为于40~60℃水浴下磁力搅拌,微孔滤膜的孔径为≤0.22μm。
优选的,所述核酸分子的氮元素与脂质类载体的磷元素的摩尔比为1~10:1(摩尔比为3~6:1时更佳)。
优选的,向经过所述孵育之后的体系中加入终浓度为1~150mmol/l的上述辅助分子(浓度为50~100mmol/l时更佳),然后于10~30℃下继续进行孵育。
上述靶向hbv阳性细胞的核酸类药物递送系统在制备用于抗乙肝病毒药物或者用于预防、治疗人hbv阳性肝细胞癌的药物中的应用。
本发明的有益效果体现在:
本发明利用脂质类非病毒纳米载体包裹或装载抑制hbv复制的基因编辑载体等核酸类药物分子,构建了一种针对hbv病毒感染的细胞具有高度特异性的核酸类药物递送系统,其中的脂质类载体是利用阳离子脂质与辅助脂质成分构成的阳离子脂质体,通过免疫逃逸、ph响应机制可以使核酸类药物高效的递送至靶细胞(hbv感染细胞),并将核酸类药物释放于靶细胞内,从而保证其药物活性在递送中不遭到破坏,其所递送的核酸类药物通过靶向编辑(例如,剪切)hbv,不仅抑制hbv的基因表达,而且可以通过抑制体内乙肝病毒的复制实现对体内乙肝病毒的有效清除,本发明不仅可以显著提高乙肝治疗(抗病毒)的效果,而且发现通过抑制体内乙肝病毒的复制,可以有效预防、治疗hbv阳性肝细胞癌等肝癌。
进一步的,本发明根据适合crispr-cas9靶向剪辑的人hbv基因(hbv-s、hbv-x),构建抑制hbv基因的sgrna表达载体。将其与核酸酶cas9的表达载体组合为crispr-cas9系统并借助上述药物递送系统,使相应核酸类药物高效的递送至hbv阳性细胞,为基因药物治疗肝癌的临床应用创造条件。
进一步的,本发明将阳离子脂质、dope、dspe-peg2000和胆固醇按照一定比例混合,可以利用薄膜分散法构建得到一种ph敏感阳离子脂质体,与核酸类药物通过混合孵育,即可得到稳定的阳离子脂质体-核酸复合物,该复合物作为基于脂质类非病毒载体的核酸类药物递送系统,具有高效、稳定的药物递送效率,并显著提高核酸类药物的疗效,可以广泛应用于将sirna、dna、microrna等核酸类药物高效递送至hbv阳性细胞,从而发挥抑制病毒复制等作用。
进一步的,本发明制备的阳离子脂质体粒径均匀、体系稳定,可以包裹或负载crispr/cas9基因药物,且药物包封率高。
进一步的,本发明通过引入辅助分子,提高核酸类药物递送系统的稳定性,防止出现聚沉。
进一步的,本发明针对hbv阳性细胞具有较高的药物递送效率,可以明显降低hbv基因的表达,更为重要的是结合特定的基因敲除目标基因(例如s+x),可以抑制体内乙型肝炎病毒复制,从而显著提高乙肝和hbv阳性肝细胞癌的治疗效果。
附图说明
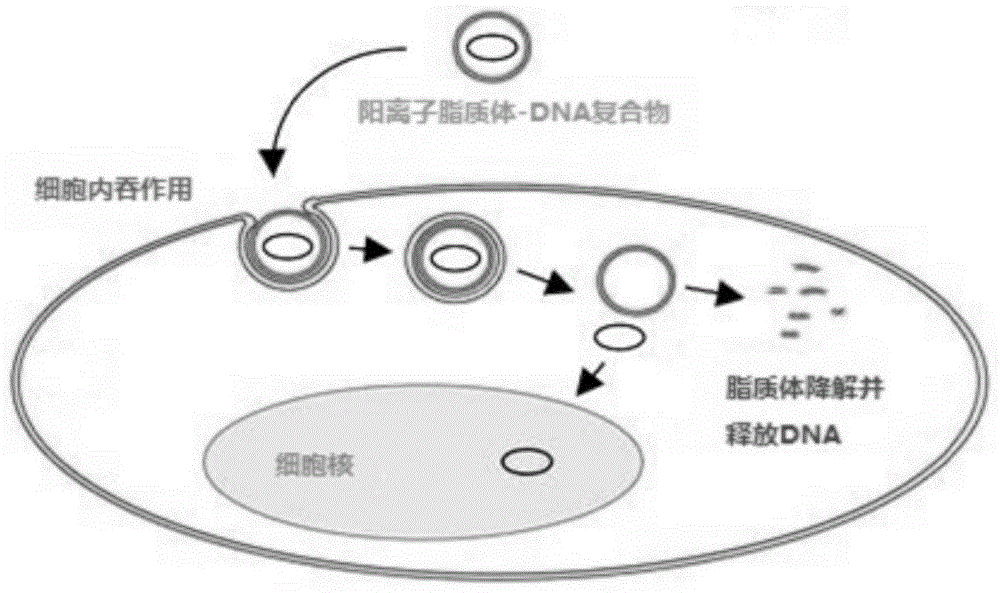
图1为阳离子脂质体递送核酸类药物作用原理图。
图2为本发明制备的复合物的粒径。
图3为本发明制备的复合物的zeta电位。
图4为本发明制备的阳离子脂质体的外观,其中:(a)三个月前,(b)三个月后。
图5为cas9实现定点切割导致dna及双链断裂过程的示意图。
图6为基因药物包封率分析的琼脂糖凝胶电泳图。
图7为包裹sgrna/cas9质粒组合物的脂质体介导的hbv特异性剪切造成hbsag表达变化的结果。
图8为转基因小鼠注射复合物后肝脏免疫组化的情况。
图9为荷瘤小鼠肿瘤抑制结果。
具体实施方式
下面结合附图和实施例对本发明做进一步详细说明。所述实施例仅用于解释本发明,而非对本发明保护范围的限制。
本发明中制备的核酸类药物递送系统,其作用原理如图1所示。所述核酸类药物递送系统是ph敏感阳离子脂质体-核酸类药物(例如,dna)复合物,ph敏感阳离子脂质体的作用是将核酸类药物有效的输送至靶细胞内并于靶细胞特定ph内环境下释放,使核酸类药物发挥作用。
本发明依据稳定性和ph敏感等特性对阳离子脂质体的载体材料、比例进行了筛选,旨在发现提高基于阳离子脂质体的抗病毒基因药物的递送效率的可行的途径。
通过实验,本发明选择了dspe-peg2000和dope作为辅助磷脂,设计出一种长循环、ph敏感的阳离子脂质体。其中,dspe-peg2000利用其空间构型可以增加脂质体-dna复合物的稳定性,同时可以实现复合物的体内免疫逃逸。dope作为脂质体的ph敏感元件,其在生理环境(ph7.4)下稳定,而在酸性条件(ph5.0~6.8)下发生结构改变,利用此特性,dope可以帮助脂质体在溶酶体的酸性条件下实现溶酶体逃逸,防止dna被降解。利用这一阳离子脂质体可以构建一种药用级别的药物递送系统,实现了基因药物递送的多重靶向及长循环作用。
(一)空白阳离子脂质体的制备
将药用合成磷脂dotap、dope、dspe-peg2000及药用合成胆固醇(共4个成分)溶解于5ml三氯甲烷并移入25ml圆底烧瓶中,其中dotap:dope:胆固醇的摩尔比为1:1:0.6,dspe-peg200占总脂质质量(即4个成分质量之和)的1%;在0.08mpa(表压)、30℃的条件下缓慢旋蒸除去有机溶剂(三氯甲烷),从而在圆底烧瓶底部形成一层厚度均匀的脂质薄膜,-0.1mpa(表压)、室温条件下真空干燥2h(将有机溶剂和蒸汽彻底去除);向圆底烧瓶中加入10ml预热至50℃的hepes溶液(20mmol/l),将脂质薄膜从圆底烧瓶底部洗掉(洗膜),然后将圆底烧瓶置于超声波清洗仪上50℃水浴超声处理5min,脂质薄膜消失(脂质薄膜溶解于hepes溶液),将圆底烧瓶移至磁力搅拌器上,50℃水浴、900rpm继续搅拌水化;搅拌30min后溶液出现淡蓝色乳光且无颗粒状杂质(蓝色乳光代表阳离子脂质体形成,且脂质体形态完整、质量高),然后依次过0.22μm和0.1μm的微孔滤膜(使阳离子脂质体粒径均一,同时也可以除菌)各5次后充氮气并于4℃保存。
1)粒度测定
激光粒度测定仪测定不同批次微孔滤膜过滤后的溶液样品,发现其中溶解的阳离子脂质体平均粒径在100~150nm,采用zeta电位仪测定zeta电位平均值在55~60mv。图2和图3为其中一批样品的测定结果。
2)空白阳离子脂质体的稳定性
空白脂质体无菌过滤分装至灭菌管中,于4℃冰箱存储28天,再室温下静置3个月,仍然稳定,脂质体颜色偏白,均一性较好,未见沉淀(图4)。
3)空白阳离子脂质体的ph敏感特性
将脂质体和不同ph的pb溶液在37℃条件下共孵育30min,采用zeta电位仪测定混合物的电位值变化。通过测定脂质体在不同ph条件下的表面电位,结果表明,脂质体的表面电荷随ph值的下降(细胞内涵体为酸性条件,其ph值约为5.0)而急剧升高。
(二)靶向编辑hbv基因的crispr/cas9系统
参见图5,crispr/cas9系统对基因的定向识别和剪切是由sgrna和核酸酶cas9实现的,sgrna决定了cas9的靶向性,也决定了cas9的剪切活性。
2.1、靶向hbv的sgrna寡核苷酸的设计和选择
1.在hbv基因上选择5’-ggn(19)gg的序列,如果没有5’-ggn(19)gg的序列,5’-gn(20)gg或者5’-n(21)gg也可以。
2.sgrna在hbv的靶向位点分别位于hbv的s和x基因区域。
3.在ucsc数据库、blat、ncbi数据库中,确定sgrna靶序列唯一性,减少潜在的脱靶位点。
4.如果用针对hbv不同区域的sgrna来实现靶向联合编辑hbv基因,可更有效的敲除hbv基因。
5.如果用靶向hbv不同区域的两个sgrna来敲除目的基因,能更有效的抑制hbv病毒的复制。
2.2、构建sgrna的寡聚核苷酸双链
根据选择的sgrna,在其5’加上ccgg得到正向寡核苷酸(forwardoligo),如果序列本身在5’端已经有1或者2个g,那么就对应的省略1或者2个g;根据选择的sgrna,获得其对应dna的互补链,并且在其5’加上aaac得到反向寡核苷酸(reverseoligo);分别合成上述正向寡核苷酸和反向寡核苷酸,将合成的sgrna寡聚核苷酸的forwardoligo和reverseoligo成对退火。
退火反应体系如下:
在pcr仪中按照以下touchdown程序运行:95℃,5min;95-85℃at-2℃/s;85-25℃at-0.1℃/s;4℃保存备用。
退火之后形成可以连入u6真核表达载体的sgrna寡聚核苷酸双链。
2.3、sgrna寡聚核苷酸质粒(表达载体)的构建
1.线性化pgl3-u6-sgrna质粒(商品名:pgl3-u6-sgrna-pgk-puromycin,addgene),酶切体系和条件如下:2μgpgl3-u6-sgrna(400ng/μl)、1μlcutsmartbuffer,及1μlbsai(neb),ddh2o补至50μl,37℃孵育3~4小时;酶切完成后将线性化的pgl3-u6-sgrna质粒用axypreppcrcleanupkit(ap-pcr-250)纯化回收至20~40μl灭菌水中。
2.将退火的sgrna寡聚核苷酸双链与线性化的pgl3-u6-sgrna质粒连接,获得pgl3-u6-hbvsg质粒(依据sgrna针对的hbv不同基因区域,具体分为pgl3-u6-hbv-ssg、pgl3-u6-hbv-xsg等)。
3.转化大肠杆菌感受态细胞,并涂amp+平板(50μg/ml)。
4.用u6通用引物(参见seq.id.no.1)测序的方法鉴定阳性克隆。
5.37℃摇床摇菌,过夜培养阳性克隆并用axyprepplasmidminiprepkit(ap-mn-p-250)抽提pgl3-u6-hbvsg质粒。
(三)ph敏感阳离子脂质体-dna复合物的制备
将用于转染细胞的crispr/cas9系统(dna)与(一)中制备的空白阳离子脂质体溶液按氮磷摩尔比6:1制成混合溶液(是将质粒加入滤膜过滤后的溶液)后,室温孵育20min,向该混合溶液中加入一定量的枸橼酸钠,使体系中枸橼酸钠的浓度为60mmol/l,室温孵育20min,形成无颗粒状杂质的均匀溶液,该溶液即为ph敏感阳离子脂质体-dna复合物溶液。
用凝胶电泳实验来检测脂质体-dna复合物的包封率,方法如下:
1)按凝胶电泳实验制胶,胶浓度为1~2%,含eb;
2)制备上述阳离子脂质体-dna复合物溶液后,取定量样品加上样缓冲液,上样于加样孔,电泳;
3)于紫外光下比较样品中游离dna与marker条带的荧光强度,判断游离dna的量,而包封于脂质体中dna被阻滞在加样孔。
根据灰度分析,与maker(20ng/μl,5μl)相比较,通过琼脂糖凝胶电泳法初步推测样品(213.5ng/μl,20μl)dna的包封率在95%以上(图6方框处为游离的质粒dna)。
将阳离子脂质体-dna复合物重悬在含10%胎牛血清的培养基中,通过激光粒度/zeta电位仪测定复合物的粒径变化。现有阳离子脂质体复合物和血液中的蛋白质容易产生非特异性吸附,严重影响了其作为crispr/cas9药物递送体系的应用。而本发明通过测定阳离子脂质体-dna复合物在含有10%胎牛血清的培养基中粒径的变化,发现复合物在血清中稳定。
(四)针对hbv感染细胞具有高度特异性的核酸类药物递送系统的功效实验
本发明中的核酸类药物递送系统是通过将脂质体包裹crispr/cas9系统而构建的阳离子脂质体-核酸复合物,以hbv感染的人乙肝细胞和乙肝转基因小鼠、荷瘤小鼠模型为研究对象,采取特异性靶向“单一基因”或“协同作战”的方法,针对疾病的主要分子靶点同时进行递送和干预,实现hbv病毒靶致病基因的有效敲除,可以明显抑制hbv基因表达、复制,达到彻底清除病毒目的,从而为人体内hbv基因清除和乙肝、肝癌的预防、治疗提供有效途径。
1、转染人乙肝hepg2.2.15细胞
1.1细胞培养
首先,将处于对数生长期的hepg2.2.15细胞用胰酶彻底消化,然后用含10%新生牛血清的细胞培养液以达到终止消化的目的,用无刻度弯头移液管轻轻吹打培养瓶中细胞并将其移入离心管,114g下离心5min。离心完毕后,倒掉上清,用细胞培养液重悬细胞制成单细胞悬液,用台盼蓝室温染色2min,在倒置显微镜下用血球计数板对细胞进行计数。然后,用细胞培养液润洗培养板1次,将细胞密度调整为次日汇合度达70%~90%接种到12孔板中,培养液补足体积至1ml,置于37℃、5%co2细胞培养箱中进行培养。
1.2无脂质体共转染hepg2.2.15细胞操作
在靶向hbvcccdna的sgrna寡核苷酸设计、选择和合成之后,将靶向hbvcccdna的sgrna寡聚核苷酸(即靶向hbv的s基因和x基因的sgrna)分别与线性化pgl3-u6-sgrna质粒连接,分别获得含靶向hbvs基因和x基因的sgrna寡聚核苷酸的载体pgl3-u6-hbvsg(pgl3-u6-hbv-ssg和pgl3-u6-hbv-xsg),按如下操作转染hepg2.2.15细胞:按照lipofectamine2000transfectionreagent(invitrogen,11668-019)的操作手册,将含靶向hbvs基因sgrna寡聚核苷酸的载体pgl3-u6-hbv-ssg、含靶向hbvx基因sgrna寡聚核苷酸的载体pgl3-u6-hbv-xsg单独或联合与pst1374-nls-flag-cas9-zf质粒质粒混匀,共转染细胞。
1.3利用脂质体共转染hepg2.2.15细胞操作
将带有对应hbv基因的sgrna寡聚核苷酸的pgl3-u6-hbvsg质粒(靶向hbv-s和/或hbv-x)与pst1374-nls-flag-cas9-zf质粒(addgene)及阳离子脂质体溶液按照(三)混合孵育,25℃静置15~20min。然后,将混合液缓慢均匀地加入到12孔板中,然后置于细胞培养箱中培养4~6h。
2、分组
基因药物处理组是转入了针对hbv-s、hbv-x具有剪切活性的sgrna载体(lipo+grna-hbv-s组:pgl3-u6-hbv-ssg,即pgl3-u6-hbvsg含有靶向hbv-s的sgrna寡聚核苷酸,sgrna参见seq.id.no.4;lipo+grna-hbv-x组:pgl3-u6-hbv-xsg,即pgl3-u6-hbvsg含有靶向hbv-x的sgrna寡聚核苷酸,sgrna参见seq.id.no.3;lipo+grna-hbv-(s+x)组:联合使用针对hbv-s和hbv-x的pgl3-u6-hbvsg)及pst1374-nls-flag-cas9-zf质粒。
对照组(grnaemptyvector组)是转入了没有剪切活性的sgrna载体(pgl3-u6-hbvsg中sgrna替换为seq.id.no.2)及pst1374-nls-flag-cas9-zf质粒。
空白组(blank组):不转染任何质粒的hepg2.2.15细胞。
对照组及处理组中,每组内的全部pgl3-u6-hbvsg质粒与pst1374-nls-flag-cas9-zf质粒混合比例为1:1(质量比),通过阳离子脂质体共转染hepg2.2.15细胞。
质粒验证组:与处理组比较,不同在于直接转染含有相应sgrna的质粒及pst1374-nls-flag-cas9-zf质粒,无脂质体包裹(分别记为grna-hbv-s组、grna-hbv-x组、grna-hbv-(s+x)组)。
(五)酶联免疫法检测乙型肝炎病毒表面抗原的变化
1、按照(四)的方法和分组,分别将带有对应hbv剪切活性的sgrna寡聚核苷酸的pgl3-u6-hbvsg质粒(靶向hbv的s基因和/或x基因的sgrna)与pst1374-nls-flag-cas9-zf质粒混匀,以两种方式(四;1.2\1.3)共转染hepg2.2.15细胞。
2、在转染后的第二天,收取上清液,按照diagnostickitforhepatitisbvirussurfaceantigen(elisa)使用说明书测量乙型肝炎病毒表面抗原。
对照组(grnaemptyvector)是转入了没有切割活性的sgrna载体pgl3-u6-hbvsg(对应的sgrna为seq.id.no.2),处理组(s+x)是同时加入针对hbvcccdna的s基因和x基因的sgrna载体pgl3-u6-hbv-ssg和pgl3-u6-hbv-xsg(对应的sgrna为seq.id.no.4和seq.id.no.3)。用elisa检测hbsag表达,与对照组比较,crispr/cas9处理组表面抗原明显减少;脂质体(lipo)+crispr/cas9相比较crispr/cas9单独处理组(质粒验证组)效果更加明显。脂质体+crispr/cas9处理组乙肝病毒表面抗原的表达显减著少。
(六)体内抑制hbv病毒复制实验
选取hbv转基因小鼠作为动物模型,将其分为3组,即对照组、crispr/cas9敲除hbv组(对应质粒验证组)及脂质体包裹crispr/cas9敲除hbv组(对应处理组)。采用尾静脉注射的方法,每组给药剂量举例说明如下:
对照组:40μgpst1374-nls-flag-cas9-zf+40μgpgl3-u6-hbvsg(对应的sgrna为seq.id.no.2);
crispr/cas9敲低hbv组(grna-hbv(x+s)组):40μgpst1374-nls-flag-cas9-zf+20μgpgl3-u6-hbv-ssg+20μgpgl3-u6-hbv-xsg;
脂质体包裹crispr/cas9敲低hbv组(lipo+grna-hbv(x+s)组):40μgpst1374-nls-flag-cas9-zf+20μgpgl3-u6-hbv-ssg+20μgpgl3-u6-hbv-xsg,加入200μl空白阳离子脂质体溶液中(符合氮磷摩尔比例6:1)。
注射质粒后,于第一天、第三天抽取小鼠尾静脉静脉血,分离血清,用elisa的方法检测hbsag的变化情况,结果如图7所示,相比于对照组及未采用脂质体递送的crispr/cas9基因药物,通过脂质体递送crispr/cas9基因药物可以更有效的降低乙肝表面抗原的表达水平。
3周后处死小鼠,用免疫组化法检测小鼠肝脏细胞hbsag的表达情况。参见图8,可以看出,相比于对照组及未采用脂质体递送的crispr/cas9基因药物,通过脂质体递送crispr/cas9基因药物可以更有效的降低乙肝表面抗原的表达水平。
(七)hbv阳性肝细胞癌荷瘤小鼠实验
培养小鼠hepg2.2.15细胞,按每个注射点2×106个细胞的数量接种balb/c小鼠背部皮下。
待移植瘤长至2mm3大小,按照(四)分组:即对照组、grna-hbv-s组、grna-hbv-x组、grna-hbv-(s+x)组、lipo+grna-hbv-s组、lipo+grna-hbv-x组、以及lipo+grna-hbv-(s+x)组。采用尾静脉注射靶向基因质粒的方法,每组给药剂量分别为:
1.对照组:40μgpst1374-nls-flag-cas9-zf+20μg空grna;
2.grna-hbv-s组:40μgpst1374-nls-flag-cas9-zf+40μgpgl3-u6-hbv-ssg;
3.grna-hbv-x组:40μgpst1374-nls-flag-cas9-zf+40μgpgl3-u6-hbv-xsg;
4.grna-hbv-(s+x)组:40μgpst1374-nls-flag-cas9-zf+20μgpgl3-u6-hbv-ssg+20μgpgl3-u6-hbv-xsg;
5.lipo+grna-hbv-s组:40μgpst1374-nls-flag-cas9-zf+40μgpgl3-u6-hbv-ssg,加入200μl空白阳离子脂质体溶液中(符合氮磷摩尔比例6:1);
6.lipo+grna-hbv-x组:40μgpst1374-nls-flag-cas9-zf+40μgpgl3-u6-hbv-xsg,加入200μl空白阳离子脂质体溶液中(符合氮磷摩尔比例6:1);
7.lipo+grna-hbv-(s+x)组:40μgpst1374-nls-flag-cas9-zf+20μgpgl3-u6-hbv-ssg+20μgpgl3-u6-hbv-xsg,加入200μl空白阳离子脂质体溶液中(符合氮磷摩尔比例6:1);
在给药后于3、6、9、12、15、18、21d脱臼处死小鼠,取瘤拍照片,参见图9,相比较于对照组,通过脂质体递送的grna-hbv-s组或grna-hbv-x组的抑瘤效果优于未通过脂质体递送的grna-hbv-s组或grna-hbv-x组;通过脂质体联合递送的lipo+grna-hbv-(s+x)组有更好的抑制肿瘤生长的作用。
由于既往研究多关注乙肝病毒的清除(病毒基因敲低),但由于无法有效抑制体内病毒复制,故尚未能够发现基于病毒清除而抑制hbv阳性肝细胞癌的预防和治疗途径。
总之,本发明制备的阳离子脂质体粒径均匀、体系稳定、药物包封率高,其作为核酸类药物递送系统具有高效的药物递送效率,其优势具体体现在:
1、药物递送系统适用范围广,能用于将dna、sirna、microrna等核酸类药物递送至细胞中。
2、通过筛选脂质体成分及其之间的比例,解决了许多阳离子脂质体针对向细胞递送核酸类药物时效率不稳定的困境,能将核酸类药物高效递送至靶细胞并发挥作用。
3、本发明的基因表达载体制备方法简单、sgrna靶向性好,crispr/cas9系统的敲除效率高。
4、本发明所述的药物递送系统为特异性剪接hbvs和/或x基因功能的阳离子脂质体,能够精确靶向剪切hbv基因,高效降低hbv的基因表达,明显降低乙肝表面抗原的表达水平,即显示出抗乙肝病毒感染的优效性,将为靶向治疗乙肝病毒感染提供有效的药物治疗途径。
5、本发明所述的药物递送系统可以发挥crispr/cas9快速、简便、高效、特异性剪切hbv基因的优势,并结合本发明中所述的阳离子脂质体进行递送,可以有效抑制病毒复制,从而发挥清除人正常肝脏持续存在的hbv病毒的作用,并解决目前人乙肝病毒感染治疗(特别是hbv阳性肝细胞癌)中缺乏有效防治药物的问题。
<110>西北妇女儿童医院
<120>用于递送具有特异性剪切hbv基因功能的核酸类药物的系统及其应用
<160>4
<210>1
<211>24
<212>dna
<213>人工合成
<400>1
atggactatcatatgcttaccgta24
<210>2
<211>20
<212>dna
<213>人工合成
<400>2
ctctgcaagatcccagagtgaga20
<210>3
<211>20
<212>dna
<213>人工合成
<400>3
caacttgtcctggttatcgc20
<210>4
<211>20
<212>dna
<213>人工合成
<400>4
ggtctccatgcgacgtgcag20
- 还没有人留言评论。精彩留言会获得点赞!