一种负载富血小板血浆和抗菌肽的水凝胶及其制备方法和应用与流程
本发明涉及生物医用材料
技术领域:
,具体涉及一种负载富血小板血浆和抗菌肽的水凝胶及其制备方法和应用。
背景技术:
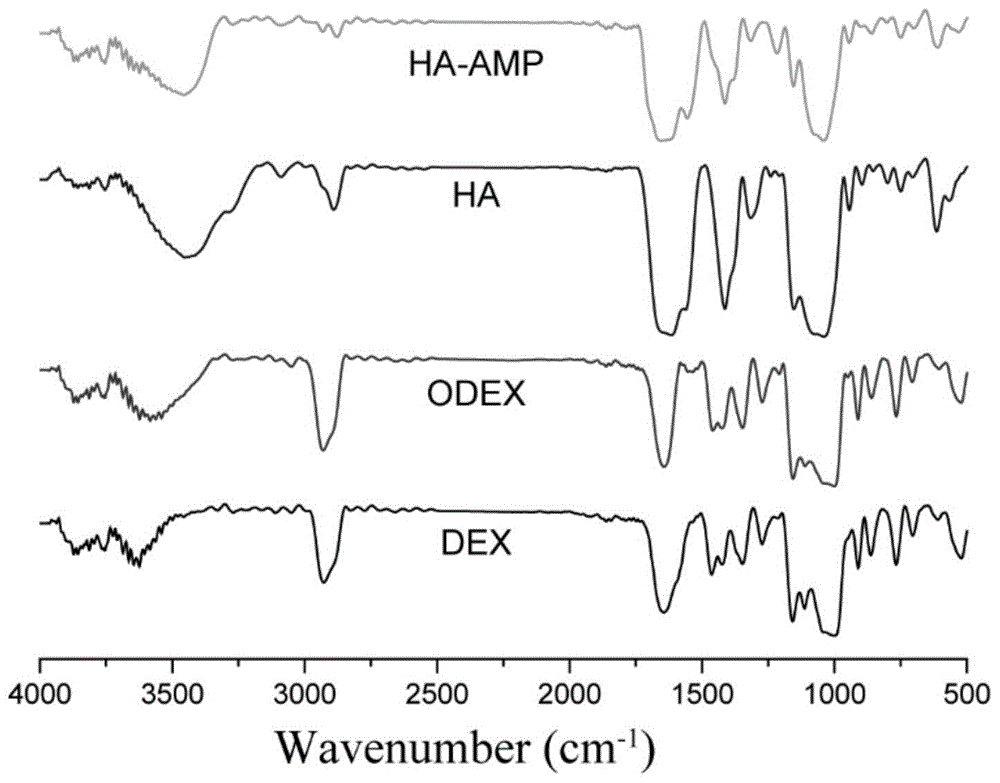
:伤口治疗是最重要和最具挑战性的健康问题之一。在美国,650万病人患有慢性创伤,每年花费250亿美元用于治疗。如果没有适当的治疗,皮肤伤口往往会受到细菌感染,从而延长炎症时间,扰乱再上皮化,抑制胶原的产生,延迟伤口愈合。受损的皮肤由于失去其自我保护机制,因而积累组织液导致伤口处病原体和微生物的大量入侵和繁殖,从而导致严重的伤口感染,延缓伤口愈合过程,引发伤口溃烂不愈。此外,一旦细菌附着在伤口表面,它们就会形成生物膜,生物膜是附着在细胞外聚合物中的细菌群落。这些生物膜保护细菌不受免疫系统和抗生素的影响,并释放导致脓毒症的内毒素,严重时会导致死亡。细菌感染被认为是影响伤口愈合的主要局部因素。细菌毒素能刺激炎症细胞在伤口部位分泌白介素-1和肿瘤坏死因子-α等促炎细胞因子,进而导致伤口愈合速度减慢。微生物研究表明,金黄色葡萄球菌在延缓近25~30%的慢性创面愈合中起着重要作用,许多由金黄色葡萄球菌引起的慢性溃疡不能愈合。金黄色葡萄球菌还表达多种毒力因子(如蛋白酶、核酸酶、脂肪酶、胶原酶和透明质酸酶)、表面蛋白(如蛋白a、纤维连接蛋白和胶原结合蛋白,以及聚集因子)和毒素(例如,毒性休克综合征毒素和肠毒素),它们促进其与伤口组织的粘附,降低宿主的多形核中性粒细胞(pmn)功能和免疫应答。因此,预防细菌感染和生物膜的形成在伤口治疗中具有十分重要的意义。为了防止细菌感染和生物膜的形成,皮肤伤口和敷料都使用了青霉素和甲氧西林等抗生素。传统疗法,如敷料,外科清创术、植皮术和全身抗生素并不总能使慢性伤口获得满意的愈合。由于抗生素耐药细菌的出现,传统抗生素的使用减少了。目前,其他类型的抗菌材料,例如季铵盐化合物、银离子或纳米粒子或抗菌聚合物等,已用于伤口护理,特别是含银材料具有优异的抗菌效果。然而,这些替代材料要么具有相当大的不良影响(如细胞毒性、细菌耐药性问题),要么效果不佳。近年来,抗菌肽(amps)作为一种新型抗菌材料受到了广泛的关注。一般来说,amps存在于哺乳动物、昆虫、鱼类、两栖动物甚至某些细菌中,与其他免疫应答一起在保护宿主免受入侵细菌、真菌或病毒侵害方面起着至关重要的作用。虽然amps具有不同的结构,但它们具有共同的结构特征,如具有a-螺旋构象的阳离子结构域和两亲结构域。据认为,这种结构通过破坏细菌细胞膜,在抗菌活性中起着关键作用。amps不仅具有快速杀灭细菌的作用,而且具有广谱的抗菌活性,具有较高的抗菌效果。此外,它们不会引起细菌耐药性,因此在长期使用中是相对安全的。例如,抗菌肽nisin被食品和药物管理局(fda)批准为食品防腐剂。此外,许多制药公司一直在尝试开发用于治疗的amps,其中一些已应用于临床试验。amp(swlsktakklfkkipkkipkkrfprprpwprpnmi)是具有23个氨基酸合成的短肽,是天蚕素抗菌肽的一种,具有很强的广谱抗菌活性和抑癌作用。通过在细菌的细胞膜积累并发生构象的变化进而破坏膜结构的完整性,导致细胞内容物外流,细菌细胞破裂,抗菌过程迅速,在接触微生物数秒里就能发生。amp除了具有抗菌活性外,还具有多种生物活性,如脂多糖(lps)的中和,炎症反应的调节和促进再上皮化(即迁移、增殖和上皮细胞的分化),导致伤口愈合过程加速。在尽管这种多功能,amp的使用是有限的因为潜在的细胞毒性和对蛋白水解的敏感性。为了减少其细胞毒性,增加其抗菌性稳定性,amps经常被固定在材料表面在各种生物医学应用中,如导尿管、骨或牙科植入物和人工角膜。然而,目前使用amps作为伤口敷料应用的研究较少。最近的研究报告表明,富血小板血浆(prp)治疗可提高创面愈合率。prr是多种生长因子的天然蓄积物,例如血小板衍生生长因子(pdgf)、转化生长因子-β(tgf-β)、表皮生长因子(egf)、血管内皮生长因子(vegf)、胰岛素生长因子(igf)、骨钙素、骨连接蛋白、纤维蛋白原、维甲酸、纤维蛋白原和血小板反应素。这些生长因子在调节间充质细胞的合成、增殖和愈合过程中的细胞外基质合成方面起着重要的作用。prp还抑制细胞因子的释放,抑制炎症,从而促进伤口愈合和组织再生,促进新生毛细血管生成,加速慢性创伤的上皮化。在伤口治疗中,通常采用性能优良的包扎材料来促进伤口愈合,其中水凝胶具有高含水量、灵活的力学性能和良好的生物相容性,被认为是有前途的临床应用材料。首先,通过提供多孔结构和合适的溶胀比,水凝胶基质可以允许氧的存在,去除伤口渗出液,维持潮湿的伤口床以促进伤口愈合。其次,具有固有抗菌性能的水凝胶受到了生物材料研究人员的广泛关注。最后,与传统的伤口敷料(纱布和棉毛)不同,生物降解的水凝胶敷料易于剥离和自发降解,避免了换药过程中的疼痛和二次损伤。考虑到上述标准,同时具有组织再生的成分和防止细菌生长的抗菌药物的水凝胶是治疗慢性伤口的理想材料。技术实现要素:本发明的目的在于克服现有技术的不足之处而提供一种负载富血小板血浆和抗菌肽的水凝胶及其制备方法和应用,该水凝胶兼具有长效抗菌性能与创面修复性能。为实现上述目的,本发明采取的技术方案如下:一种负载富血小板血浆和抗菌肽的水凝胶的制备方法,包括以下步骤:(1)将抗菌肽加入到透明质酸溶液中,搅拌均匀后获得反应液;取1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和1-羟基苯并三唑溶于二甲基亚砜和水的混合液中,调节ph,得到混合溶液;将混合溶液加入到反应液中,反应完成后,经透析、冷冻干燥,得到透明质酸钠和抗菌肽的复合物;(2)配制透明质酸钠和抗菌肽的复合物溶液,并在透明质酸钠和抗菌肽的复合物溶液中加入富血小板血浆,混合均匀后加入氧化葡聚糖溶液,搅拌均匀,凝胶化后得到负载富血小板血浆和抗菌肽的水凝胶。本发明首先将抗菌肽通过酰胺键接枝到透明质酸钠中,有利于提高抗菌肽的缓释效果,使抗菌肽能够实现长期缓慢的释放,进而将透明质酸钠和抗菌肽的复合物溶液与富血小板血浆混合均匀后,再与氧化葡聚糖溶液混合,形成负载富血小板血浆和抗菌肽的水凝胶,该水凝胶兼具有良好的力学性能,以及长效抗菌性能与创面修复性能。优选地,所述抗菌肽包括类天蚕素抗菌肽、人源抗菌肽ll-37中的至少一种。优选地,透明质酸钠和抗菌肽的复合物溶液中透明质酸钠和抗菌肽的复合物的浓度为1w/v%~10w/v%,优选为2-3w/v%;氧化葡聚糖溶液中氧化葡聚糖的浓度5w/v%~30w/v%,优选为10-14w/v%,透明质酸钠和抗菌肽的复合物溶液与氧化葡聚糖溶液的体积比为(1-10):(1-10),优选为1:1,制备得到的水凝胶具有较好的生物相容性和力学性能。富血小板血浆添加有助于提高水凝胶的创面修复性能,但富血小板血浆含量太高会导致成胶效果不好,含量太低则有效成分太少,促进伤口愈合效果不明显,优选地,所述步骤(2)中,透明质酸钠和抗菌肽的复合物溶液与富血小板血浆的体积比为(5-15):(0.5-2),优选为10:1,制备得到的水凝胶兼具较好的力学性能、成胶效果和创面修复效果。优选地,其特征在于,所述步骤(1)中,透明质酸溶液中透明质酸的浓度为1-10mg/ml。优选地,其特征在于,所述步骤(1)中,抗菌肽和透明质酸的质量比为(50-500):(100-1000),优选为250:500,制备的水凝胶具有优异的生物相容性。优选地,所述步骤(1)中,1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、1-羟基苯并三唑和透明质酸的质量比为1~5:1~5:1,优选为1.5:1.2:1。优选地,所述步骤(1)中,将混合溶液加入到反应液中,反应时间为2~12h,优选为4h;透析选用的透析袋的截留分子量为8~15kda。优选地,所述氧化葡聚糖的制备方法为:在葡聚糖水溶液中加入高碘酸钠溶液,在室温避光条件下进行氧化反应,加入乙二醇中和多余的高碘酸钠后停止氧化反应,反应液经去离子水透析后,冷冻干燥,得到氧化葡聚糖。优选地,所述葡聚糖水溶液中葡聚糖的浓度为5w/v%~20w/v%,优选为10w/v%,所述高碘酸钠溶液中高碘酸钠溶液的浓度为20~200mg/ml,优选为100mg/ml。优选地,所述氧化反应的时间为10~50h,优选为20h;乙醇与高碘酸钠溶液的体积比(1~10):(1~10),优选为1:1。所述氧化葡聚糖的制备方法中,透析选用的透析袋的截留分子量为8~15kda。本发明还提供了根据上述方法制备得到的负载富血小板血浆和抗菌肽的水凝胶。本发明还提供了上述负载富血小板血浆和抗菌肽的水凝胶在制备促进慢性皮肤缺损创面愈合的敷料中的应用。本发明制备得到的水凝胶可生物降解,促进伤口愈合和组织再生,且具有长效无耐药性抗菌作用,可应用于慢性皮肤缺损创面修复。与现有技术相比,本发明的有益效果为:本发明将抗菌肽通过酰胺键接枝到透明质酸钠中,形成透明质酸钠和抗菌肽的复合物,进而将透明质酸钠和抗菌肽的复合物溶液与富血小板血浆混合均匀后,再与氧化葡聚糖溶液混合,形成负载富血小板血浆和抗菌肽的水凝胶。本发明制备得到的水凝胶可生物降解,具有良好的力学性能和生物相容性,能够促进伤口愈合和组织再生,且具有长效无耐药性抗菌作用,可应用于慢性皮肤缺损创面修复。附图说明图1为dex、实施例2的odex、ha、实施例4的ha-amp的红外光谱图。图2为实施例7的odex/ha、odex/ha/amp、odex/ha/amp/prp水凝胶支架的扫描电镜图。图3为实施例8的odex/ha/amp/prp的水凝胶体外amp药物释放动力学曲线。图4为实施例7制备的odex/ha、odex/ha/amp、odex/ha/amp/prp水凝胶的抗菌试验图。图5为实施例7制备的odex/ha、odex/ha/amp、odex/ha/amp/prp水凝胶与细胞共培养后第1、2、3天的细胞存活率图。具体实施方式为更好地说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明进一步说明。本领域技术人员应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。实施例中,所使用的实验方法如无特殊说明,均为常规方法,所用的材料、试剂等,如无特殊说明,均可从商业途径得到。dex:葡聚糖odex:氧化葡聚糖ha:透明质酸adh:己二酰肼amp:类天蚕素抗菌肽ha-amp:透明质酸钠和类天蚕素抗菌肽的复合物prp:富血小板血浆edc:1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐hobt:1-羟基苯并三唑dmso:二甲基亚砜实施例1odex的制备将1gdex溶于10ml纯水中配制成浓度为10w/v%的葡聚糖水溶液,然后加入2ml的浓度为100mg/ml的高碘酸钠溶液放置于室温黑暗条件下进行氧化反应20h;随后将2ml乙二醇加入到反应溶液中,中和多余的高碘酸钠后停止氧化反应;将反应液用截留分子量8-15kda的纤维素透析袋置于去离子水中透析3天后冷冻干燥处理,得到odex。实施例2odex的制备与红外光谱分析将5gdex溶于25ml纯水中配制成浓度为20w/v%的dex水溶液,然后加入10ml的浓度为20mg/ml的高碘酸钠溶液放置于室温黑暗条件下进行氧化反应10h;随后,将10ml乙二醇加入到反应溶液中,中和多余的高碘酸钠后停止氧化反应;将反应液用截留分子量8-15kda的纤维素透析袋置于去离子水中透析3天后冷冻干燥处理,得到odex。通过傅立叶红外光谱表征dex以及本实施例的odex特征峰变化。分别取1-2mg的dex和odex的样品置于玛瑙研钵研碎后,再依次加入100-200mg干燥24h后的溴化钾粉末(待测试样在溴化钾中的比例大约是0.5%-1%)继续研磨至粒度细致,混合均匀后,将混合物在真空度10mmhg下2-5min压成透明薄片进行测试,扫描范围为4000-400cm-1,得到结果如图1所示。从图1中可以看出峰的范围从3002cm-1到3400cm-1代表-oh键的伸缩振动。对比dex,odex产生代表醛基的特征吸收峰1722cm-1,说明高碘酸钠成功氧化了dex。实施例3氨基化透明质酸钠的制备本实施例的氨基化透明质酸钠的制备方法,包括以下步骤:(1)将500mgha溶解在125ml纯水中形成4mg/ml的ha水溶液,然后将8gadh加入到ha水溶液中,磁力搅拌约4小时以获得反应液;(2)将750mgedc和600mghobt溶解于10ml的dmso/h2o溶液中,dmso/h2o溶液中dmso和h2o的体积比为1:1,然后使用naoh和hcl溶液将上述溶液的ph调节至4.75,得到混合溶液;(3)将混合溶液加入到反应液中,反应保持约4小时,然后将ph调节至7.0完成反应;(4)将上述完成反应后的混和溶液置于100mmnacl、25%乙醇、去离子水中分别透析一天,每天至少更换三次透析液,用截留分子量为8-15kda纤维素透析袋进行透析,经-50℃冷冻干燥后得到冻干的氨基化透明质酸钠粉末。实施例4ha-amp的制备本实施例的透明质酸钠和类天蚕素抗菌肽的复合物的制备方法,包括以下步骤:(1)将500mgha溶解在125ml纯水中形成4mg/ml的ha水溶液,将250mgamp加入到ha水溶液中,磁力搅拌约4h以获得反应液;(2)将750mgedc和660mghobt溶解于10ml的dmso/h2o溶液中,dmso/h2o溶液中dmso和h2o的体积比为1:1,然后使用naoh和hcl溶液将上述溶液的ph调节至4.75,得到混合溶液;(3)将混合溶液加入到反应液中,反应保持约4h,然后将ph调节至7.0完成反应;(4)将上述完成反应后的混合溶液置于100mmnacl、25%乙醇、去离子水中分别透析一天,每天至少更换三次透析液,用截留分子量为8-15kda纤维素透析袋进行透析,经-50℃冷冻干燥后得到冻干的ha-amp粉末。实施例5ha-amp的制备与红外光谱分析本实施例的氨基化透明质酸钠和类天蚕素抗菌肽的复合物的制备方法,包括以下步骤:(1)将100mgha溶解在10ml纯水中形成10mg/ml的ha水溶液,然后将40mgamp和8gadh加入到ha水溶液中,磁力搅拌12h以获得反应液;(2)将750mgedc和600mghobt溶解于10ml的dmso/h2o溶液中,dmso/h2o溶液中dmso和h2o的体积比为1:1,然后使用naoh和hcl溶液将上述溶液的ph调节至4.75,得到混合溶液;(3)将混合溶液加入到反应液中,反应保持约12h,然后将ph调节至7.0完成反应;(4)将上述完成反应后的混合溶液置于100mmnacl、25%乙醇、去离子水中分别透析一天,每天至少更换三次透析液,用截留分子量为8-15kda纤维素透析袋进行透析,经-50℃冷冻干燥后得到冻干的ha-amp粉末。通过傅立叶红外光谱表征ha和ha-amp特征峰变化。分别取1-2mg的ha和ha-adh的样品置于玛瑙研钵研碎后,再依次加入100-200mg干燥24h后的溴化钾粉末(待测试样在溴化钾中的比例大约是0.5%-1%)继续研磨至粒度细致,混合均匀后,将混合物在真空度10mmhg下2-5min压成透明薄片进行测试,扫描范围为4000-400cm-1,得到结果如图1所示。对比ha,1548cm-1代表ha-amp氨基的特征峰,说明amp成功接枝在ha上。实施例6odex/ha/amp/prp的水凝胶的制备与压缩模量测试选用实施例5制备的ha-amp粉末分别配制浓度为1、2、2.5、3w/v%ha-amp溶液;选用实施例2制备的odex分别配制浓度为6、10、14w/v%的odex溶液;按表1的比例,在10mlha-amp溶液中加入1mlprp,混合均匀后,加入10mlodex溶液,混合均匀,然后轻轻搅拌混合物,凝胶化过程约1min,得到odex/ha/amp/prp水凝胶。对本实施例制备的水凝胶进行压缩模量测试,具体方法为:使用游标卡尺测量水凝胶的直径和长度,在40%形变内,以1mm/min的形变速率,采用电子万能试验机测试样品的压缩弹性模量。表1材料比例压缩强度(kpa)odex:ha-amp6w/v%:2w/v%2.98odex:ha-amp10w/v%:2w/v%%4.43odex:ha-amp14w/v%:2w/v%4.51odex:ha-amp10w/v%:1w/v%2.21odex:ha-amp10w/v%:2.5w/v%4.46odex:ha-amp10w/v%:3w/v%4.49理想的水凝胶应具有良好的力学性能,以保持其使用时的完整性。本实施例制备的水凝胶的压缩模量如表1所示。结果表明,odex溶液与ha-amp溶液浓度在10-14w/v%:2-3w/v%水凝胶具有良好的力学性能,其压缩弹性模量约~4kpa。因此,本发明ha-amp溶液的浓度优选为2-3w/v%;odex溶液的浓度10-14w/v%,ha-amp溶液与odex溶液的体积比优选为1:1。实施例7odex/ha、odex/ha/amp、odex/ha/amp/prp水凝胶的扫描电镜的分析选用实施例5制备的ha-amp粉末配制浓度为5w/v%ha-amp溶液;选用实施例2制备的odex配制浓度为10w/v%的odex溶液;向10ml浓度为5w/v%的ha-amp溶液中加入1mlprp,混合均匀后,加入2ml浓度为10w/v%的odex溶液,混合均匀,然后轻轻搅拌混合物,凝胶化过程约1min,得到odex/ha/amp/prp水凝胶。odex/ha水凝胶的制备方法与上述odex/ha/amp/prp水凝胶的制备方法基本相同,不同之处在于,odex/ha水凝胶的制备方法中将ha-amp粉末替换为实施例3制备的氨基化透明质酸钠,且本实施例不添加prp。odex/ha/amp水凝胶的制备方法与上述odex/ha/amp/prp水凝胶的制备方法基本相同,不同之处在于,odex/ha/amp水凝胶的制备方法不添加prp。采用hitachis4800扫描电子显微镜进行微观形貌表征,取本实施例制备的odex/ha、odex/ha/amp、odex/ha/amp/prp水凝胶冻干样品,在1.2kv电压,20ma电流,0.1torr真空环境下进行喷金30s处理,然后固定在电镜样品台上,在加速电压为10kv,工作距离8.8mm的环境下观察并拍摄干水凝胶样品的表面形貌。如图2所示,本实施例所制备的水凝胶具有多孔结构,且孔径约为60μm。实施例8负载prp与抗菌肽水凝胶的抗菌肽释放的研究选用实施例5制备的ha-amp粉末配制浓度为10w/v%ha-amp溶液;选用实施例2制备的odex配制浓度为5w/v%的odex溶液;向10ml浓度为10w/v%的ha-amp溶液中加入1mlprp,混合均匀后,加入10ml浓度为5w/v%的odex溶液,混合均匀,然后轻轻搅拌混合物,凝胶化过程约1min,得到odex/ha/amp/prp水凝胶。将1g水凝胶加入40mlpbs溶液放置在37℃,恒温水浴中在特定的时间点取出100μl水溶液并加入100μl新的pbs以保持40mlpbs溶液体积不变,测定取出溶液中amp浓度使用紫外分光光度计对水凝胶的释放行为进行了连续14天测定,结果如图3所示。由图3结果可以看出,抗菌肽amp从dex/ha/amp/prp水凝胶中可以持续释放14天,几乎呈线性释放。实施例9负载prp与抗菌肽水凝胶的抑菌实验的研究取实施例7制备的odex/ha、odex/ha/amp、odex/ha/amp/prp水凝胶(直径为10mm),在超净工作台紫外照射30min灭菌。在固体lb培养基上滴取100μl革兰氏阳性菌(s.aureus)和革兰氏阴性菌(e.coli)、铜绿假单孢菌(p.auruginosa)悬液(1×108cfu/ml),用涂布棒均匀涂布,贴上待测样品,正置15min后将培养皿放置于37℃生化培养箱中倒置培养,培养24h后取出观察培养基上的细菌生长情况并记录抑菌圈直径,每组三个平行样品,结果如图4所示。通过图4的抑菌圈大小可以看出,所制备的odex/ha/amp和odex/ha/amp/prp水凝胶支架对大肠杆菌、金黄色葡萄球菌均具有一定的抑菌性;而无抗菌肽负载的dex/ha水凝胶支架对所有的细菌没有明显的抑菌圈,odex/ha/amp水凝胶对e.coli、s.aureus、p.auruginosa的抑菌圈直径分别为22.1±0.8mm、28.4±1.5mm、22.3±1.2mm;odex/ha/amp/prp水凝胶对e.coli、s.aureus、p.auruginosa的抑菌圈直径分别为(21.7±0.6mm、29.7±1.0mm、21.4±1.1mm。实施例10负载prp与抗菌肽的水凝胶的生物活性检测根据国标gb/t16886.12标准,利用0.1g:1ml的比例,将无菌制备的实施例7odex/ha、odex/ha/amp、odex/ha/amp/prp水凝胶浸泡在完全培养基中,制成三组水凝胶浸提液。将培养的l929细胞用0.25%胰酶消化悬浮后,以每孔密度为2×104个/ml的细胞悬液接种在48孔板上。培养12h后取出原培养液,并分别在每孔皿中加入500μl实验材料浸提液,以只添加500μl完全培养基为空白对照组。每组至少设5孔。每隔24h换液一次,实验设置24h、48h两个时间点。在指定的时间间隔取出相应的孔板,每孔加100μl的cck8工作液,在37℃恒温二氧化碳培养箱(含5%的co2)中孵育1~2h后,用酶标仪在450nm波长处测定吸光度(od),按照公式计算细胞存活率,结果如图5所示。从图5中可以看出,三组水凝胶的第1天细胞存活率与空白对照组相当,且从第1天到第3天细胞存活率显著提高。值得注意的是odex/ha和odex/ha/amp/prp水凝胶组在第3天的细胞存活率高于对照组,其主要原因是凝胶中的葡聚糖和透明质酸具有良好的生物相容性,且多孔结构可促进细胞增殖。尽管由于amp与对细胞有略微的影响,odex/ha/amp水凝胶组的细胞存活率低于其他组,但仍与对照组相当。上述结果证实,本发明制备的odex/ha/amp/prp水凝胶具有良好的生物相容性,有利于3t3细胞的生长和增殖。最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1