用于尿路上皮癌的免疫治疗方法与流程
用于尿路上皮癌的免疫治疗方法
相关申请的交叉引用
[0001]
本申请请求2018年2月9日申请的美国临时申请号us 62/628,648,2018年2月10日申请的国际申请pct/cn 2018/076100的优先权,并将其全文援引并入本申请中。电子提交文本文件说明
[0002]
本申请电子递交文本文件的全部援引并入本申请:计算机可读形式的序列表(文件名称:beig_034_01wo_seqlist.txt,数据记录于2019年2月8日,文件大小126千字节)。
技术领域
[0003]
本文公开了一种用于尿路上皮癌(urothelial carcinoma,uc)患者的治疗方法,该方法包括向患者施用抗pd-1抗体,该抗体被特异性地工程化以降低fcγr与巨噬细胞的结合从而消除抗体依赖性吞噬作用。
背景技术:
[0004]
尿路上皮癌又称为尿路上皮(移行细胞)癌(uc)或尿路上皮癌(移行细胞肿瘤、或尿路上皮的移行细胞肿瘤),以及膀胱癌。超过90%的尿路上皮肿瘤源自膀胱,8%源自肾盂,以及剩余2%起源自输尿管和尿道。
[0005]
基于铂的联合化疗已被用于作为一线疗法用于患有晚期尿路上皮癌的患者数十年。例如,膀胱癌一线治疗的标准疗法包括甲氨蝶呤(methotrexate)、长春新碱(vinblastine)、多柔比星(doxorubicin)和顺铂(cisplatin)(mvac)的联合化疗,其已被证明具有相当大的毒性。另一种联合化疗是顺铂-吉西他滨联合化疗,其已替代mvac作为转移性膀胱癌的一线标准治疗,并且据报道90%的患者已复发并且预后极差。转移性uc的治疗进展在过去的三十年里停滞不前。
[0006]
wo 2016064649 a1公开了抗-vegf受体2抗体雷姆赛卢单抗(ramucirumab)与多西他赛(docetaxel)同时、单独或顺序联合治疗uc患者的组合疗法。其表明抗体疗法可作为治疗尿路上皮癌的有效药物。
[0007]
已经证明针对免疫检查点抑制性受体(如程序性细胞死亡-1(pd-1))的单克隆抗体(monoclonal antibody,mab)在多种恶性肿瘤中的有前景的抗肿瘤活性(topalian sl,等人n engl j med.[新英格兰医学杂志]2012;366:2443-2454.),该恶性肿瘤包括uc(plimack er,等人j clin oncol.[临床肿瘤学杂志]2015;33(增刊;摘要4502);bellmunt j,等人摘要470.在第31届癌症免疫治疗学会年会上发表,2016年11月9-13日,美国马里兰州国家海港;balar a,等人ann oncol.[肿瘤学年鉴]2016;第27卷,增刊_6,2016年10月1日,lba32 pr.;sharma p,等人j clin oncol.[临床肿瘤学杂志]2016;34(增刊摘要4501);galsky md,等人j clin oncol.[临床肿瘤学杂志]2016;lb:a31;以及sharma p,等人lancet oncol.[柳叶刀
·
肿瘤学]2016;17:1590-1598)。
[0008]
pd-1在cd8
+
效应子、肿瘤浸润的t淋巴细胞(til)上相对过表达;并且抗pd-1抗体诱导肿瘤微环境中cd8
+
t细胞百分比的增加(ahmadzadeh m,等人blood.[血液]2009;114:
2015/035606 a1中所公开的。在进一步的实施方案中,该igg4 fc区包含在位置228、233、234、235和265处的氨基酸突变,如在wo 2015/035606 a1中所公开的。在又进一步的实施方案中,该igg4fc区包含在位置228、233、234、235、265、309和409处的氨基酸突变,如在wo 2015/035606 a1中所公开的。在另一个实施方案中,该igg4 fc区包含s228p、e233p、f234v和l235a的氨基酸突变,如在wo 2015/035606 a1中所公开的。在一个实施方案中,上述抗体可以进一步包含含有seq id no:83-88中任一项的igg4重链恒定结构域。
[0018]
本文申请的抗体,即mab-1,先前已经表明其在如肝细胞癌的晚期实体瘤患者中是可耐受的,并且其毒性特征表明,不良事件(adverse events,aes)通常为低至中度严重程度、可控的和可逆的;desai j,等.j immunother cancer.[癌症免疫治疗杂志]2016;4(增刊1):p154;2019年1月3日公开的wo 2019/001417)。
[0019]
本申请公开的治疗方法已被证明能够降低、延迟进展、并减轻人类患者的尿路上皮癌。本发明的发明人已经发现,抗pd-1抗体,如mab-1,可作为有效的免疫治疗方案用于治疗尿路上皮癌,尤其是pd-l1
+
尿路上皮癌,因为与pd-l1-uc相比,观察到pd-l1
+
uc的客观响应的速率更高。发明人还发现,mab-1治疗在uc的预治疗患者中总体上是耐受良好,并且uc患者中报道的不良事件与研究中观察到的总体安全特征一致,并且一般为低或中度严重程度、可控的和可逆的。
附图说明
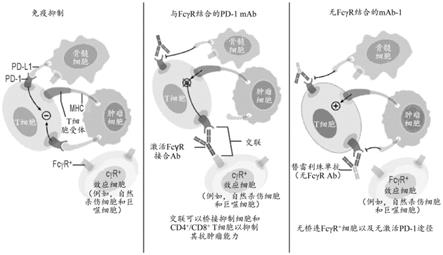
[0020]
图1显示了本申请中所用的抗pd-1抗体的t细胞清除的潜在机制,即降低fcγr结合阻止了巨噬细胞介导的t细胞清除。
[0021]
图2显示了本临床研究的设计方案。
[0022]
图3显示了使用本发明的抗体治疗的uc患者的治疗的持续时间和响应。
[0023]
图4显示了使用本发明的抗体治疗的uc患者的最大肿瘤减少。
[0024]
图5显示了使用本发明的抗体治疗的uc患者的靶病变随时间的变化。
[0025]
图6a-6h为74岁男性pd-l1阳性uc患者的射线照射图像,所述患者先前三种抗癌治疗方案失败且未包括任何免疫治疗。所述图像显示了从0天(基线)到46天治疗周期的uc肿瘤消退。
具体实施方式
缩写
[0025]
贯穿发明的详细说明书和实施例,将使用以下缩写:ab
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
抗体ae
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
不良事件cd
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
分化簇cdr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
互补决定区cr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
完全响应dpbs
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
杜尔贝科磷酸盐缓冲盐水fcγr
ꢀꢀꢀꢀꢀꢀꢀꢀ
fc-γ受体
i.p.
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
腹膜内或腹膜内地i.v.
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
静脉内或静脉内地ifn-γ
ꢀꢀꢀꢀꢀꢀꢀ
干扰素-γigg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
免疫球蛋白gmab
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
单克隆抗体max
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
最大值mhc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
主要组织相容性复合体min
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
最小值nk
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
自然杀伤细胞p.o.
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ“
口服”或“经口”pd
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
进行性疾病pd-1
ꢀꢀꢀꢀꢀꢀꢀꢀ
程序性死亡1蛋白,pdcd-1,或cd279pd-l1
ꢀꢀꢀꢀꢀꢀꢀ
程序性细胞死亡配体-1pdx
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
患者来源的异种移植物pr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
部分响应q2w
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
每2周一次q3w
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
每3周一次q4w
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
每4周一次qw
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
每周一次rp2d
ꢀꢀꢀꢀꢀꢀꢀꢀ
2期推荐剂量sd
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
稳定疾病tils
ꢀꢀꢀꢀꢀꢀꢀꢀ
肿瘤浸润性淋巴细胞uc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
尿路上皮癌v
h
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
重链可变区v
l
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
轻链可变区定义
[0026]
除非在本文件的其他地方具体定义,否则本发明中使用的所有其他技术和科学术语具有本发明所属领域的普通技术人员通常理解的含义。
[0027]
如本文使用的,包括所附权利要求,例如“一个”、“一种”和“该”的单数形式包括它们相应的复数指代,除非上下文另外明确说明。
[0028]
本文术语“抗体”以最广义使用并且具体地涵盖抗体(包括全长单克隆抗体)和抗体片段只要它们识别pd-1。抗体分子通常是单特异性的,但是还可以描述为不同特异性的,异特异性的,或多特异性的。抗体分子通过特异性结合位点与抗原上的特定性抗原决定簇或表位结合。
[0029]
本文中的术语“单克隆抗体”或“mab”是指基本上同质的抗体的群体,即,除了可能少量存在的可能天然发生的突变外,该群体中包含的抗体分子在氨基酸序列上是相同的。相比之下,常规(多克隆)抗体制剂典型地包括在其可变结构域中具有不同氨基酸序列的多种不同抗体,特别地其cdr,它们通常对不同的表位具有特异性。修饰语“单克隆”指示获得自基本上均质的抗体群体的抗体的特征,并且不应理解为要求通过任何具体方法产生抗
res.[核酸研究],1月1日;29(1):207-09(2001);maccallum等,antibody-antigen interaction:contact analysis and binding site topography[抗体-抗原相互作用:结合分析及结合位点分布],j mol.biol.[分子生物学杂志],262(5),732-745(1996);和martin等,proc.natl acad.sci.usa[美国国家科学院院刊],86,9268-9272(1989);martin,等,methods enzymol.[酶学方法],203,121-153,(1991);pedersen等,immunomethods[免疫方法],1,126,(1992);和rees等,在sternberg m.j.e.(编辑),protein structure prediction[蛋白结构预测].牛津大学出版社,牛津,141-172 1996中)。
[0034]
除非另外说明,“抗体片段”或“抗原结合片段”是指抗体的抗原结合片段,即保留与全长抗体结合的抗原特异性结合的能力的抗体片段,例如保留一个或多个cdr区的片段。抗体结合片段的实例包括但不限于fab、fab'、f(ab')2和fv片段;双抗体;线性抗体;单链抗体分子,例如,sc-fv;纳米抗体以及从抗体片段形成的多特异性抗体。
[0035]“特异性地结合”特定靶蛋白的抗体是表现出与其他蛋白质相比优先结合该靶标的抗体,但该特异性不需要绝对结合特异性。如果抗体的结合决定了样品中靶蛋白的存在,例如,没有产生不希望的结果,诸如假阳性,则抗体被认为是对其预期靶标为“特异性的”。可用于本发明的抗体或其结合片段会以比非靶蛋白的亲和力高至少2倍,优选高至少10倍,更优选高至少20倍,和最优选高至少100倍的亲和力结合至靶蛋白。将本文的抗体称作与包含给定氨基酸序列(例如成熟人pd-1分子的氨基酸序列)的多肽特异性结合,如果其与包含该序列的多肽结合但不与缺乏该序列的蛋白质结合。
[0036]
本文中的术语“人抗体”是指仅包含人免疫球蛋白蛋白质序列的抗体。如果在小鼠、小鼠细胞或源自小鼠细胞的杂交瘤中产生,人抗体可以含有鼠碳水化合物链。类似地,“小鼠抗体”或“大鼠抗体”是指分别仅包含小鼠或大鼠免疫球蛋白序列的抗体。
[0037]
术语“人源化抗体”是指含有来自非人(例如鼠)抗体以及人抗体的序列的抗体形式。此类抗体含有源自非人免疫球蛋白的最小序列。通常,人源化抗体将包含基本上至少一个、并且典型地两个可变结构域的全部,其高变环的全部或基本上全部对应于非人类免疫球蛋白的那些,并且fr的全部或基本上全部是人类免疫球蛋白序列的那些。人源化抗体还将任选地包含免疫球蛋白恒定区(fc)的至少一部分,典型地是人免疫球蛋白的至少一部分。当有必要区分人源化抗体与亲本啮齿动物抗体时,将前缀“hum”,“hu”或“h”添加到抗体克隆名称中。人源化形式的啮齿动物抗体可包含亲本啮齿动物抗体的相同cdr序列,但是可包括某些氨基酸取代以增加亲和力,增加人源化抗体的稳定性,或出于其他原因。
[0038]
术语“治疗(treatment)”或“治疗(treating)”是获得有益或所希望的临床结果的方法,包括但不限于以下一种或多种:减轻由疾病引起的一种或多种症状,减小疾病程度,稳定疾病(例如,预防或延迟疾病的恶化),预防或延迟疾病的传播(例如,转移),预防或延迟疾病的复发,延迟或减缓疾病的进展,缓和疾病状态,提供疾病的缓解(部分或全部),降低治疗疾病所需的一种或多种其他药物的剂量,延迟疾病的进展,提高生活质量,和/或延长生存期。因此,术语“治疗”也包括尿路上皮癌病理结果的减少。本文公开的方法涵盖了这些治疗方面中的任何一个或多个。抗-pd-1抗体
[0039]
如本文所公开的,抗pd-1抗体是抗体或其抗原结合片段,其特异性地结合人pd-1。
[0040]
如本文所公开的,抗pd-1抗体是包含重链可变区(v
h
)和轻链可变区(v
l
)的抗体,该重链可变区(v
h
)和轻链可变区(v
l
)含有使用卡巴特(kabat)编号系统定义的并且如下所列出的互补决定区(cdr):
[0041]
如本文所公开的,抗pd-1抗体是包含重链可变区(v
h
)和轻链可变区(v
l
)的抗体,该重链可变区(v
h
)和轻链可变区(v
l
)含有如下所列出的cdr的任意组合:
[0042]
如本文所公开的,抗pd-1抗体是包含重链可变区(v
h
)和轻链可变区(v
l
)的抗体,该重链可变区(v
h
)和轻链可变区(v
l
)包含:
[0043]
在一些实施方案中,该抗体包含在位置228(eu编号系统)处具有丝氨酸至脯氨酸突变的igg4 fc区。在一些实施方案中,该突变被称为s228p突变。在一些实施方案中,该抗体包含在位置233、234、235、265、309和409(eu编号系统)中的一个或多个处具有突变的igg4 fc区。例如,在一些实施方案中,该抗体包含在228和至少一个其他位置处具有突变的igg4区,其中该至少一个其他突变导致与一种或多种fcγr的结合减少。在进一步的实施方案中,该抗体包含在位置228和至少2个、至少3个、至少4个、至少5个、或至少6个另外的位置处具有突变的igg4区,其中该一个或多个另外的突变导致与一种或多种fcγr的结合减少。在一些实施方案中,该抗体包含在位置234和235处具有突变的igg4区。在一些实施方案中,该抗体包含在位置233、235和235处具有突变的igg4区。在一些实施方案中,该抗体包含在位置234、235和265处具有突变的igg4区。在一些实施方案中,该抗体包含在位置233、234、235和265处具有突变的igg4区。在一些实施方案中,该抗体包含在位置234、235、265和409处具有突变的igg4区。在一些实施方案中,该抗体包含在位置233、234、235、265和409处具有突变的igg4区。在一些实施方案中,该抗体包含在位置234、235、265、309和409处具有突变的igg4区。在一些实施方案中,该抗体包含在位置233、234、235、265、309和409处具有突变的igg4区。在位置234处的突变可以是苯丙氨酸取代缬氨酸或苯丙氨酸取代丙氨酸。在位置235处的突变可以是亮氨酸取代丙氨酸。在位置233处的突变可以是谷氨酸取代脯氨酸。在位置265处的突变可以是天冬氨酸取代缬氨酸或天冬氨酸取代苏氨酸。在位置309处的突变可以是亮氨酸取代缬氨酸。在位置409处的突变可以是精氨酸取代赖氨酸、苏氨酸或甲硫氨酸。
[0044]
如本文所公开的,抗pd-1抗体包含含有seq id no:83-88或91-106中任一项的igg4重链恒定结构域。
[0045]
如本文所公开的,抗pd-1抗体是含有f(ab)或f(ab’)2的抗体,该f(ab)或f(ab’)2包含上述结构域(包括重链可变区(v
h
)、轻链可变区(v
l
)以及igg4重链恒定结构域)。
[0046]
如本文所公开的,抗pd-1抗体包含重链可变区(v
h
)和轻链可变区(v
l
)以及含有seq id no:87或88的igg4重链恒定结构域,其中重链可变区(v
h
)和轻链可变区(v
l
)包含:
[0047]
如本文所公开的,抗pd-1抗体包含重链可变区(v
h
)和轻链可变区(v
l
)以及含有seq id no:88的igg4重链效应子或恒定结构域,其中重链可变区(v
h
)和轻链可变区(v
l
)分别包含seq id no:24和seq id no:26。
[0048]
如本文所公开的,抗pd-1抗体包含独特工程化人源化igg4 fc结构域,该结构域可降低fcγr从而减少抗体依赖性吞噬作用,这是t细胞清除的潜在机制,从而提高了有效性。
[0049]
抗pd1抗体及其抗原结合片段可以如wo 2015/035606 a1所述制备,将其通过援引并入本申请。治疗方法
[0050]
在本文公开的治疗方法中,以一定剂量向uc患者施用mab-1抗体。在一个实施方案中,uc患者先前未通过免疫治疗方法分子治疗。在另一个实施方案中,uc患者接受了抗癌全身疗法(例如mvac)治疗。在另一个实施方案中,患者先前进行了铂佐剂及新辅助疗法。
[0051]
在针对uc的治疗方法中,抗pd-1抗体以0.5-10mg/kg qw或q2w或q3w或q4w的剂量施用。在本文中的一些实施方案中,以0.5-10mg/kg qw或q2w或q3w的剂量施用mab-1。在另一个治疗方案中,以2-10mg/kg q2w或q3w的剂量施用mab-1或以200mg mab-1的固定剂量施用mab-1,还可以2.0mg/kg q2w、5mg/kg q2w、2mg/kg q3w或5mg/kg q3w的剂量或以mab-1的200mg的固定剂量静脉内施用mab-1。
[0052]
在另一个实施方案中,将mab-1与另一种或多种药剂联合来治疗uc。在一个实施方案中,将mab-1与uc的标准疗法(甲氨蝶呤、长春新碱、多柔比星和顺铂(mvac))联合来治疗uc。在又另一个实施方案中,用mab-1和顺铂或顺铂和吉西他滨治疗uc。该治疗的一种变化
是在顺铂和吉西他滨之前施用紫杉醇,在紫杉醇治疗之前或期间以及在顺铂和吉西他滨治疗之前或期间施用mab-1。实施例研究设计-患者鉴别和招募
[0053]
此研究设计的目的是招募uc患者以进行剂量确定和患者初步鉴别,分别在1a和1b期进行。本研究设计详述于图2中。在图2中,*显示剂量扩展方案;而表示不超过最大耐受剂量的暴露量的固定剂量,并且表示与1b期平行进行。
[0054]
1a期用于确定mab-1的安全性、rp2d和初步有效性。在1a期中,10mg/kg每两周一次(once every 2weeks,q2w)是mab-1最大施用剂量,并且未达到最大耐受剂量(maximum tolerated dose,mtd)。在1a期第1部分中,进行了从0.5mg/kg q2w开始到10mg/kg q2w的剂量递增研究。在1a期第2部分,用2mg/kg或5mg/kg的mab-1 q2w或q3w进行了方案扩展研究。在1a期第3部分,用200mg的mab-1 q3w(在选择的肿瘤中的固定剂量不超过最大耐受剂量的暴露量)进行固定剂量扩展研究,并且该研究与1b期平行进行。所有1b期患者均接受mab-1,5mg/kg静脉注射q3w。根据实体肿瘤指南1.1版(recist v1.1)中的响应评估标准,每8周或9周进行一次放射照相评估,并且在图6a-6g中示出了它的一个实例。uc亚群的关键资格标准
[0055]
招募用组织学或细胞学证实uc的成年患者(年龄≥18岁),其至少有一个可测量的病变(按照recist v1.1的定义);其接受过标准治疗,但之前没有抗pd-1或程序性死亡配体1(pd-l1)治疗;并且东部肿瘤协作组(eastern cooperative oncology group,ecog)行为状态≤1。
[0056]
如果患者对其他抗体有严重超敏反应史,则将其排除。除uc外,过去2年内有既往恶性肿瘤活动的患者,以及明显治愈的局部可治愈癌症,如基底细胞或鳞状细胞皮肤癌、表浅性膀胱癌、或子宫颈或乳腺原位癌,也被排除在外。
[0057]
在自动化平台上,通过进行免疫组织化学方法对预处理肿瘤标本进行pd-l1膜表达的回顾性评估。通过对肿瘤细胞(tc)或肿瘤相关免疫细胞(ic)进行任何强度的pd-l1膜染色,测定pd-l1的表达状态。如果≥25%tc或≥25%ic表达膜pd-l1,pd-l1被定义为高表达;并且如果tc和ic都有<25%pd-l1膜染色,则pd-l1被定义为低/阴性。在临床试验中有十八(18)名uc患者(n=18)被招募。患者分布
[0058]
在18名招募uc患者中,14名患者先前进行过至少一次化疗,并且6名患者先前进行过放射疗法,这表明在治疗uc方面存在困难。如图3和图5所示,总共有6名患者(33.3%)继续接受延长治疗,其中至少3名患者接受治疗超过36周。这些患者中的一位显示出完全缓解,而其他两位显示出良好的部分缓解(图5)。表1显示了uc患者的人口统计和疾病特征。表1
抗肿瘤活性
[0059]
在招募的18名uc患者中,有17名患者可评估。可评估的uc患者定义为具有可测量的基线肿瘤评估和至少一个可评估的基线后肿瘤响应评估,或者在初始肿瘤评估之前继续进展或死亡。
[0060]
在下文的临床试验和结果中,所有患者均接受mab-1,剂量为2.0、5.0或10.0mg/kg或固定剂量为200mg,静脉注射q2w或q3w。
[0061]
在可评估的17名uc患者中,1名患者达到了确认的完全响应(cr),4名达到了确认的部分响应(pr),3名达到了稳定疾病(sd)。发现疾病控制率(dcr=cr+pr+sd)为47.1%(n=8/17)。中位治疗持续时间为3.0个月,最长持续时间为18.3个月,最短持续时间为0.7个月。mab-1的抗肿瘤活性呈现在图3至5中。pd-l1状态响应
[0062]
还评估了用剂量为2.0、5.0或10.0mg/kg或固定剂量为200mg静脉注射q2w或q3w的mab-1治疗的uc患者的pd-l1状态和临床响应。
[0063]
共有10名患者具有可评估的pd-l1状态和临床响应。在pd-l1高表达和pd-l1低表达的患者中观察到临床响应(表2和图4)。表2显示了通过pd-l1状态确认的每个可评估患者的最佳总体响应。表2:通过pd-l1状态确认的每个可评估患者的最佳总体响应
*由于肿瘤组织不足,pd-l1状态无法评估。pd-l1高定义为≥25%的肿瘤细胞(tc)或≥25%的肿瘤相关免疫细胞(ic);如果tc和ic两者均具有<25%pd-l1染色,pd-l1低/阴性。
[0064]
研究发现,与pd-l1-疾病相比,观察到pd-l1
+
疾病中的客观响应率的速率更高,这表明mab-1对于pd-l1
+
uc患者可以是有效的。安全性和耐受性
[0065]
本临床研究还发现,在uc患者中mab-1的治疗通常耐受性良好。18名uc患者中有15名出现治疗相关的不良事件(traes)(表3),其中疲劳(n=1)、高血糖(n=1)和1型糖尿病(n=1)是唯一与严重程度≥3级的治疗相关的不良事件(无论归因)。
[0066]
一名患者由于与mab-1相关的输液相关反应而停止治疗,并且另一名患者具有治疗中出现的致命结果的紧急不良事件(肌肉无力),这与mab-1治疗无关。该数据示于表3中。表3:≥2名uc患者发生的治疗相关不良事件
[0067]
这些结果确认,本申请的抗体(mab-1)是可耐受的,并且其毒性特征证明不良事件(aes)通常是低严重程度、可控的和可逆的。
[0068]
前述实例和某些实施方案的描述应被视为是说明性的,而非限制由权利要求书所限定的本发明。如将容易理解的,在不脱离如权利要求书中所阐述的本发明的情况下,可以使用上述特征的许多变化和组合。所有这些变化都意图包括在本发明的范围之内。引用的所有参考文献都通过引用以其全文并入本文。
[0069]
应当理解,即使本文提到了现有技术出版物,但所述提及并不构成承认出版物形成任何国家的本领域公知常识的一部分。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1