用于药物递送的脂质前药的制作方法
用于药物递送的脂质前药
交叉引用
[0001]
本申请要求于2018年4月11日提交的美国临时申请第62/656,035号的权益,其全部内容通过引用并入于此。政府权利
[0002]
本发明是在美国政府的支持下,由美国国立卫生研究院(national institutes of health)授予的批准号p20 gm103451和p20 rr016480下完成的。
背景技术:
[0003]
由于水溶性差、不稳定性、位点特异性不足、一般毒性或制剂问题,天然和合成化学治疗剂通常无法进行实验室和临床试验。脂质体是具有至少一个脂质双层的球形囊泡。脂质体可用作施用营养物和药物的媒介物。药物的生物利用度和位点特异性可以通过脂质体介导的药物递送来改善。援引并入
[0004]
本申请中引用的每篇专利、出版物和非专利文献均通过引用而全文并入本文,如同各自通过引用单独并入。
技术实现要素:
[0005]
在一些实施方案中,本公开提供了基于脂质的载体,其包含:a)表面层,其中该表面层包含前药,其中该前药包含与磷脂共价缀合的治疗剂;和b)核,其中表面层围绕该核。
[0006]
在一些实施方案中,本公开提供了一种治疗病症的方法,该方法包括向有需要的受试者施用治疗有效量的基于脂质的载体,该基于脂质的载体包含:a)表面层,其中该表面层包含前药,其中该前药包含与磷脂共价缀合的治疗剂;和b)核,其中表面层围绕该核。
附图说明
[0007]
图1示出了阿糖胞苷可以与磷脂缀合的方案。
[0008]
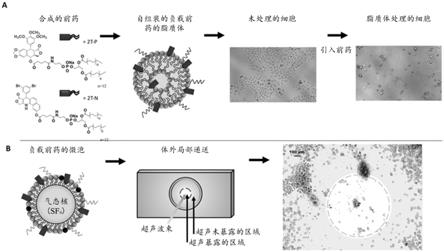
图2子图a示出了前药的合成、负载前药的脂质体的自组装以及脂质体用于体外处理细胞的用途。子图b显示了负载前药的微泡和超声暴露用于体外靶向药物递送的用途。
[0009]
图3显示了利用超声作为体外触发物的微泡治疗的示意图。
[0010]
图4示出了用于将阿糖胞苷和拓扑替康偶联至磷脂的合成途径。
[0011]
图5显示了浓度增加的负载2t-p的脂质体的差示扫描量热曲线。
[0012]
图6显示了浓度增加的负载p的脂质体的差示扫描量热曲线。
[0013]
图7子图a显示了对于2t-p,挤出前和挤出后的脂质体中的药物掺入。子图b显示了对于2t-n,挤出前和挤出后的脂质体中的药物掺入。
[0014]
图8子图a显示了负载2t-p的脂质体在整个3周的时间内保持稳定。子图b显示了负载p的脂质体在整个3周的时间内是稳定的。子图c显示了负载2t-n的脂质体在整个3周的时间内保持稳定。子图d显示了负载n的脂质体在整个3周的时间内保持稳定。
[0015]
图9显示了在2t-t挤出前和挤出后的脂质体中的药物掺入。
[0016]
图10显示了挤出前(pre-ex)和挤出后(post-ex)的具有变化量的2t-t的脂质体的尺寸分布曲线。
[0017]
图11显示了挤出前和挤出后的具有变化量的2t-t的脂质体群体(参见图10)的平均直径。
[0018]
图12显示了挤出前(_pre)和挤出后(_post)的具有变化量的2t-c的脂质体的尺寸分布曲线。
[0019]
图13显示了挤出前和挤出后的具有变化量的2t-c的脂质体群体(参见图12)的平均直径。
[0020]
图14显示了负载2t-t的脂质体的细胞毒性与游离t(拓扑替康)的毒性。
[0021]
图15显示了负载2t-c的脂质体的细胞毒性与游离c(阿糖胞苷)的毒性。
[0022]
图16显示了负载前药的微泡的体外超声触发递送。
[0023]
图17显示了在有和没有用猪肝酯酶处理的情况下,负载2t-n的脂质体在不同时间点的荧光光谱。
[0024]
图18显示了在有和没有用猪肝酯酶处理的情况下,空脂质体在不同时间点的荧光光谱。
[0025]
图19显示了在有和没有用猪肝酯酶处理的情况下,pbs溶液在不同时间点的荧光光谱。
具体实施方式
[0026]
由于水溶性差、不稳定性、位点特异性不足、一般毒性或制剂问题,许多有前景的天然和合成化学治疗剂通常无法进行实验室和临床试验。基于脂质的载体,例如脂质体、纳米液滴或微泡,可以用作用于施用营养物和药物的媒介物,并且可以显着提高治疗剂的生物利用度和位点特异性。
[0027]
脂质体是具有至少一个脂质双层的球形囊泡。脂质体具有被脂质双层形式的疏水膜围绕的核(例如,水溶液核)。脂质体的主要类型是具有若干个层状相脂质双层的多层囊泡(mlv),具有一个脂质双层的小的单层脂质体囊泡(suv),大的单层囊泡(luv)和螺旋形囊泡。为了将分子(例如,治疗剂)递送至作用部位,脂质体的脂质双层可以与其他双层例如细胞膜融合。脂质体可用作饮食或营养补充剂的载体,或用于靶向药物递送。
[0028]
微泡是小的充气气泡,直径通常在0.5μm至10μm之间。微泡的核是气态的,其被壳包围,该壳由例如聚合物、脂质、脂质聚合物、蛋白质、表面活性剂或其组合组成。微泡在医学成像中用作造影剂,并用作靶向药物递送的载体。微泡在超声扫描中使用时会高频剧烈共振,并且比身体组织更有效地反射强超声波。微泡的大小与红细胞大致相同,在血管中表现出相似的流变性,并且可用于测量器官或肿瘤中的血流量。
[0029]
纳米液滴是小的,液体填充的气泡,小于微泡。在一些实施方案中,纳米液滴的壳包含例如,脂质或磷脂。纳米液滴可以填充容易蒸发的液体。在纳米液滴的液体核蒸发时,纳米液滴转变为微泡。纳米液滴中使用的液体核的非限制性实例包括全氟化碳和全氟丁烷。
[0030]
本公开描述了一组脂质前药的开发和使用,基于脂质的载体内的脂质前药的分子
相互作用以及使用超声的脂质前药在体内和体外的功效。基于脂质的载体的非限制性实例包括脂质体和微泡。本文所述的合成策略允许将有效的脂质前药负载到基于脂质的载体(例如脂质体和微泡)中,以形成负载前药的基于脂质的载体(pllbc)。在一些实施方案中,pllbc可以用作超声造影剂,并且与超声结合用于定点治疗,该定点治疗允许靶标(例如,恶性肿瘤)的实时可视化以及造影剂到达靶位点。
[0031]
脂质前药可以利用基于脂质的药物载体、靶向递送策略和超声介导的技术来通过以下方式获得更好的性能:1)增加药物有效负载;2)通过媒介物自组装使纯化和溶解性问题最小化;3)防止药物从媒介物过早释放;4)通过使药物接近靶细胞的超声成像和治疗技术保持激活;和5)在细胞内迅速裂解后,保持药物效力。脂质和药物经由可裂解酯键以无空间位阻的方式缀合使药物能够以高浓度自组装成通过超声激活的载体;并在细胞内摄取后,释放有效且快速作用的药物。
[0032]
本文所述的脂质前药和方法可用于靶向肿瘤,例如不可切除的胰腺、肝和脑肿瘤。在一些实施方案中,本文所述的前药和方法可通过靶向受试者的间质基质而用于治疗胰腺癌。在一些实施方案中,本文描述的方法可以用于具有毒性或溶解性问题的药物。在一些实施方案中,可以将靶向配体添加到本文所述的微泡壳。脂质前药
[0033]
在一些实施方案中,本公开描述了脂质前药,其可以首先自组装成基于脂质的载体(例如,脂质体、纳米液滴或微泡),然后保持失活,直到在通过外部刺激沉积后在细胞内激活。在一些实施方案中,本文所述的合成方法将激活的磷脂附接到具有无空间位阻的羟基附接位点的治疗剂。这种结构允许通过酯化的简单缀合。在一些实施方案中,本文所述的合成方法将激活的磷脂附接到具有无空间位阻的胺基附接位点的治疗剂。这种结构允许通过酰胺化的简单缀合。在治疗剂与激活的磷脂缀合之后,酶促反应裂解可在生物环境中引起裂解。
[0034]
本公开还描述了将药物插入基于脂质的载体中的方法。基于脂质的载体的非限制性实例包括脂质体、纳米液滴和微泡。在一些实施方案中,本公开利用了fda认可的药物或特性良好但由于溶解性问题或极强的效力而在临床应用中受到限制的药物。为了促进负载到基于脂质的载体中,可以将药物附接到激活的磷脂以形成前药。然后可以通过例如自组装将前药掺入基于脂质的载体中以形成pllbc。本公开的pllbc(例如,脂质体、纳米液滴或微泡)可包含治疗剂,例如抗病毒剂、抗菌剂、抗癌剂、神经递质、蛋白质、皮肤病学剂、美容剂、螯合剂或生物制剂。在一些实施方案中,本公开的pllbc包括前药的组合。在一些实施方案中,本公开的pllbc包含染料分子。
[0035]
本公开的pllbc,例如脂质体、纳米液滴或微泡可以围绕核材料。核材料的非限制性实例包括气体,例如六氟化硫(sf6)或全氟丙烷;固体,例如氮化钛、超顺磁性氧化铁、金、银、铁、铜、锌、钛、铂、钆和钯;半导体,例如二氧化硅;无机材料;有机材料;水溶液;以及诸如全氟化碳和全氟丁烷的液体。
[0036]
本公开的pllbc可以包含抗病毒剂。抗病毒药可以最大程度地减少症状和传染性,并缩短病程。本公开的pllbc可以包含抗病毒剂,其抑制病毒向宿主细胞的附接和渗透,核酸的释放,病毒基因组的复制,病毒mrna的翻译,病毒组分的组装或新病毒从宿主细胞的释放。在一些实施方案中,本公开的pllbc可以包含抗病毒剂,例如金刚烷胺、核苷类似物(例
如,阿昔洛韦、更昔洛韦、膦甲酸)、核苷逆转录酶抑制剂(nrti;例如,拉米夫定)、非核苷逆转录酶抑制剂(例如,奈韦拉平、依法韦伦)、干扰素α、蛋白酶抑制剂(例如,博赛泼维)或神经氨酸酶抑制剂(例如,奥司他韦)。
[0037]
在一些实施方案中,本公开的pllbc可包含针对流感病毒的抗病毒剂,例如离子通道阻断剂(例如,金刚烷胺、金刚乙胺)或神经氨酸酶抑制剂(例如,奥司他韦或扎那米韦)。在一些实施方案中,本公开的pllbc可包含针对疱疹病毒的抗病毒剂,例如鸟苷类似物(例如,阿昔洛韦、喷昔洛韦、伐昔洛韦、泛昔洛韦、更昔洛韦、缬更昔洛韦)或直接病毒dna聚合酶抑制剂(例如,膦甲酸、西多福韦)。在一些实施方案中,本公开的pllbc可包含针对乙型和丙型肝炎的抗病毒剂,例如核苷酸类似物(例如,替诺福韦、阿德福韦、拉米夫定、恩替卡韦、替比夫定)、经由细胞间和细胞内机制的抗病毒和免疫调节剂(例如,peg-干扰素-α)、鸟苷类似物(例如,利巴韦林)、蛋白酶抑制剂(例如,西咪匹韦)、非核苷聚合酶(ns5a)抑制剂(例如,雷迪帕韦、维帕他韦)或非核苷聚合酶(ns5b)抑制剂(例如,索非布韦)。
[0038]
本公开的pllbc可包含抗菌剂,例如酰苯胺类、喹诺酮类、磺酰胺类、青霉素类、蛋白质合成抑制剂(例如,大环内酯类、林可酰胺类、四环素类)、双胍类、双酚类、卤代酚类、酚类、甲酚类或季铵化合物。在一些实施方案中,本公开的pllbc可包含三氯卡班、氯己定、阿来西定、聚合双胍类、六氯酚、对氯-间二甲苯酚(pcmx)、苯酚、甲酚、西曲溴铵、苯扎氯铵、诺氟沙星、多粘菌素b、苯唑西林、双氯西林、四环素、万古霉素、青霉素、利福霉素、闰年霉素(lipiarmycind)、链霉素、两性霉素b、头孢菌素或氯化十六烷基吡啶。
[0039]
本公开的pllbc可以包含抗癌剂。抗癌剂的非限制性实例包括多官能烷基化剂、烷基化剂、嘌呤拮抗剂、嘧啶拮抗剂、植物生物碱、抗生素、激素剂或其他抗癌药。在一些实施方案中,本公开的pllbc可包含抗癌剂,例如鬼臼毒素(p)、7-(3,5-二溴苯基)-2-羟基-7,11-二氢苯并[h]-呋喃并[3,4-b]喹啉-8(10h)-酮(n)、环磷酰胺、异环磷酰胺、氮芥(mechloroethamine)、美法仑苯丁酸氮芥(leukeran
tm
)、噻替派(thiopeta)白消安卡莫司汀、洛莫司汀、司莫司汀、丙卡巴肼达卡巴嗪(dtic)、六甲蜜胺顺铂氨甲蝶呤、巯嘌呤(6-mp)、硫鸟嘌呤(6-tg)、磷酸氟达拉滨、克拉屈滨喷司他丁氟脲嘧啶(5-fu)、阿糖胞苷(ara-c)、阿扎胞苷、长春碱长春新碱依托泊苷(vp-16、)、替尼泊苷拓扑替康伊立替康紫杉醇多西他赛蒽环类药物(例如,阿霉素、柔红霉素)、放线菌素伊达比星普卡霉素丝裂霉素博来霉素他莫昔芬氟他胺促性腺激素释放激素激动剂(例如,亮丙瑞林、戈舍瑞林)、芳香酶抑制剂(例如,氨鲁米特、阿那曲唑安吖啶、吉西他滨、melphelan、氨甲蝶呤、羟基脲天冬酰胺酶米托蒽醌米托坦、视黄酸衍生物、骨髓生长因子或氨
磷汀(aminfostine)。
[0040]
本公开的pllbc可以包含神经递质。神经递质的非限制性实例包括氨基酸、气体递质、单胺、痕量胺、肽、嘌呤或其他神经递质。在一些实施方案中,本公开的脂质体、纳米液滴或微泡可包含神经递质,例如谷氨酸、天冬氨酸、d-丝氨酸、γ-氨基丁酸(gaba)、甘氨酸、多巴胺、去甲肾上腺素、肾上腺素、组胺、5-羟色胺、苯乙胺、n-甲基苯乙胺、酪胺、3-碘类甲腺质、章鱼胺、色胺、催产素、生长抑素、p物质、可卡因和苯丙胺调节的转录物、阿片肽、三磷酸腺苷(atp)、腺苷、乙酰胆碱(ach)和花生四烯酸乙醇胺。
[0041]
本公开的pllbc可以包含蛋白质或生物制剂。蛋白质或生物制剂的非限制性实例包括肽;肽片段;抗体如二价抗体、一价抗体、多克隆抗体和单克隆抗体;抗体片段;和纳米抗体。合成方法
[0042]
本公开描述了合成诸如脂质体、纳米液滴或微泡的pllbc的方法。负载前药的脂质体或微泡可在各自的脂质层中包含治疗剂。本公开的负载前药的脂质体可以在脂质体的脂质双层中包含治疗剂,并且本公开的负载前药的微泡可以在微泡的脂质单层中包含治疗剂。
[0043]
在一些实施方案中,可以通过将脂质前药掺入基于脂质的载体的脂质壳中来产生pllbc。在一些实施方案中,将脂质前药掺入基于脂质的载体的脂质壳中可以消除渗漏,使药物与基于脂质的载体共价结合,并在一剂中递送双重靶向策略。在一些实施方案中,将脂质前药掺入基于脂质的载体的脂质壳中可以影响药物的药代动力学(pk)或药效学(pd)。
[0044]
在一些实施方案中,使用自组装将前药掺入基于脂质的载体的脂质壳中。在一些实施方案中,将前药掺入基于脂质的载体的脂质壳中可以最小化或消除在将前药施用于受试者之前的纯化步骤。在一些实施方案中,可以在施用之前,使用离心将负载前药的微泡与负载前药的脂质体分离。在一些实施方案中,将前药掺入基于脂质的载体的脂质壳中可以增加递送至受试者内的目标部位的药物的量,同时使对受试者的全身剂量最小化。
[0045]
可以使用通过药物分子或治疗剂与磷脂缀合而产生的溶液前药来组装本公开的pllbc(例如,脂质体、纳米液滴或微泡)。药物分子或治疗剂可以与激活的磷脂缀合,例如,马来酰亚胺(mal)磷脂、激活的羧酸(nhs)-磷脂、戊二酰基(glu)-磷脂、7-硝基苯-2-氧杂-1,3-二唑-4-基(nbd)-磷脂或二硫代吡啶(pdp)-磷脂。在一些实施方案中,药物分子与mal磷脂缀合,例如二硬脂酰基n-(3-马来酰亚胺-1-氧丙基)-l-α-磷脂酰乙醇胺(dspe-mal);二肉豆蔻酰基n-(3-马来酰亚胺-1-氧丙基)-l-α-磷脂酰乙醇胺(dmpe-mal);1-棕榈酰基-2-油酰基n-(3-马来酰亚胺-1-氧丙基)-l-α-磷脂酰乙醇胺(pope-mal);或二棕榈酰基n-(3-马来酰亚胺-1-氧丙基)-l-α-磷脂酰乙醇胺(dppe-mal)。在一些实施方案中,药物分子与nhs-磷脂缀合,例如二硬脂酰基n-(琥珀酰亚胺基氧基-戊二酰基)-l-α-磷脂酰乙醇胺(dspe-nhs);二油酰基n-(琥珀酰亚胺基氧基-戊二酰基)-l-α-磷脂酰乙醇胺(dope-nhs);1-棕榈酰基-2-油酰基n-(琥珀酰亚胺基氧基-戊二酰基)-l-α-磷脂酰乙醇胺(pope-nhs);二棕榈酰基n-(琥珀酰亚胺基氧基-戊二酰基)-l-α-磷脂酰乙醇胺(dppe-nhs);或二肉豆蔻酰基n-(琥珀酰亚胺基氧基-戊二酰基)-l-α-磷脂酰乙醇胺(dmpe-nhs)。
[0046]
在一些实施方案中,药物分子与glu-磷脂缀合,例如二硬脂酰基n-戊二酰基-l-α-磷脂酰乙醇胺(dspe-glu);二棕榈酰基n-戊二酰基-l-α-磷脂酰乙醇胺(dppe-glu);二肉豆
二棕榈酰基-sn-甘油-3-磷酸乙醇胺-n-(甲氧基(聚乙二醇)铵盐)、dmpe-peg(n-(甲基聚氧乙烯氧基羰基)-1,2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺-n-(甲氧基(聚乙二醇)铵盐),或其任何组合。在一些实施方案中,用于组装负载药物的脂质载体(例如,负载药物的脂质体或负载药物的微泡)的聚乙二醇化的磷脂溶液包括例如,dspe-peg2000(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-(甲氧基(聚乙二醇2000)铵盐)、dspe-peg5000(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-(甲氧基(聚乙二醇)5000)铵盐)、dspe-peg2000羧酸(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[羧基(聚乙二醇)-2000](钠盐))、dspe-peg5000 dbco(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[二苯并环辛基(聚乙二醇)-5000](铵盐))、dspe-peg5000胺(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[氨基(聚乙二醇)-5000](铵盐))、dspe-peg5000马来酰亚胺(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[马来酰亚胺(聚乙二醇)-5000](铵盐))、dspe-peg2000-tms(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[10-(三甲氧基甲硅烷基)十一碳烷酰胺(聚乙二醇)-2000](三乙铵盐))、dspe-peg5000叠氮化物(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[叠氮基(聚乙二醇)-5000](铵盐))、dspe-peg2000-square(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[square(聚乙二醇)-2000](钠盐))、dspe-peg2000-dbco(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[二苯并环辛基(聚乙二醇)-2000](铵盐))、dspe-peg2000叠氮化物(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[叠氮基(聚乙二醇)-2000](铵盐))、dspe-peg2000生物素(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[生物素基(聚乙二醇)-2000](铵盐))、dspe-peg2000胺(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[氨基(聚乙二醇)-2000](铵盐))、dspe-peg2000pdp(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[pdp(聚乙二醇)-2000](铵盐))、dspe-peg2000马来酰亚胺(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[马来酰亚胺(聚乙二醇)-2000](铵盐))、dspe-peg2000叶酸(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[叶酸(聚乙二醇)-2000](铵盐))、dspe-peg5000叶酸(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[叶酸(聚乙二醇)-5000](铵盐))、dspe-peg2000氰尿酸(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[氰尿酸(聚乙二醇)-2000](铵盐))、dspe-peg2000琥珀酰基(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[琥珀酰基(聚乙二醇)-2000](铵盐))、dspe-peg2000-n-花菁5、dspe-peg2000-n-花菁7、双-dspe-peg2000(1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺-n-[叠氮基(聚乙二醇)-2000(铵盐)、dmpe-peg2000(n-(甲基聚氧乙烯氧基羰基)-1,2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺-n-(甲氧基(聚乙二醇)2000)铵盐))、dmpe-peg5000(n-(甲基聚氧乙烯氧基羰基)-1,2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺-n-(甲氧基(聚乙二醇)5,000)铵盐))、dppe-peg2000(n-(甲基聚氧乙烯氧基羰基)-1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺-n-(甲氧基(聚乙二醇)2000)铵盐))、dppe-peg5000(n-(甲基聚氧乙烯氧基羰基)-1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺-n-(甲氧基(聚乙二醇)5000)铵盐))、甲氧基-peg脂质如1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)](铵盐)、1,2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)](铵盐)、1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)](铵盐)、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)](铵盐),其中甲氧基-peg重量为350、550、750、1000、2000、3000或5000道尔顿;或其任何组合。
[0053]
在一些实施方案中,可用于组装负载药物的基于脂质的载体(例如,脂质体、纳米
液滴或微泡)的本公开的磷脂溶液包含天然的磷脂衍生物,例如卵磷脂酰胆碱(pc)、卵磷脂酰甘油(pg)、大豆pc、氢化大豆pc或鞘磷脂。在一些实施方案中,用于组装本公开的负载药物的基于脂质的载体(例如,脂质体、纳米液滴或微泡)的磷脂溶液是合成的磷脂衍生物,例如磷脂酸(例如,1,2-二肉豆蔻酰基-sn-甘油-3-磷酸酯(dmpa)、1,2-二棕榈酰基-sn-甘油-3-磷酸酯(dppa)、1,2-二硬脂酰基-sn-甘油-3-磷酸酯(dspa))、磷脂酰胆碱(例如1,2-二癸酰基-sn-甘油-3-磷酸胆碱(ddpc)、1,2-二月桂酰基-sn-甘油-3-磷酸胆碱(dlpc)、1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱(dmpc)、1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(dppc)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)、1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸胆碱(popc)、1,2-二芥酰基-sn-甘油-3-磷酸胆碱(depc))、磷脂酰甘油(例如,1,2-二肉豆蔻酰基-sn-甘油-3-磷酸-rac-(1-甘油)(dmpg)、1,2-二棕榈酰基-sn-甘油-3-磷酸-rac-(1-甘油)(dppg)、1,2-二硬脂酰基-sn-甘油-3-磷酸-rac-(1-甘油)(dspg)、2-油酰基-1-棕榈酰基-sn-甘油-3-磷酸-rac-(1-甘油)(popg))、磷脂酰乙醇胺(例如,1,2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺(dmpe)、1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺(dppe)、1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺(dspe)、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope))、磷脂酰丝氨酸(例如,1,2-二油酰基-sn-甘油-3-磷酸丝氨酸(dops))、1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸乙醇胺(pope)、二棕榈酰基磷脂酰胆碱(dpptdcho)、1-硬脂酰基-2-[(e)-4-(4-((4-丁基苯基)二氮烯基)苯基)丁酰基]-sn-甘油-3-磷酸胆碱、1-硬脂酰基-2-[(e)-4-(4-((4-丁基苯基)二氮烯基)苯基)丁酰基]-sn-甘油、1-硬脂酰基-2-[(e)-4-(4-((4-丁基苯基)二氮烯基)苯基)丁酰基]-sn-甘油-3-磷酸胆碱、n-[(e)-4-(4-((4-丁基苯基)二氮烯基)苯基]丁酰基]-d-赤型-鞘氨醇磷酰胆碱、(e)-4-(4-((4-丁基苯基)二氮烯基)苯基)-n-(3-羟基-4-甲氧基苄基)丁酰胺、4-丁基-偶氮-4:0-酸-1,1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺-n-二乙烯三胺五乙酸(钆盐)、1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-二乙烯三胺五乙酸(钆盐)、双(1,2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺)-n-n'-二乙烯三胺五乙酸(钆盐)、双(1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺)-n-n'-二乙烯三胺五乙酸(钆盐)、双(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺)-n-n'-二乙烯三胺五乙酸(钆盐)、聚甘油-磷脂、官能化磷脂或末端激活的磷脂或其药学上可接受的盐。在一些实施方案中,可用于组装负载药物的基于脂质的载体(例如,脂质体、纳米液滴或微泡)的本公开的磷脂溶液包含任何以上磷脂的组合。基于脂质的载体制剂的特征
[0054]
尺寸:在一些实施方案中,本公开的基于脂质的载体(例如,脂质体、纳米液滴或微泡)可具有约70nm至约10μm的直径。在一些实施方案中,本公开的基于脂质的载体可具有约70nm至约100nm、约70nm至约150nm、约70nm至约200nm、约70nm至约250nm、约70nm至约300nm、约70nm至约350nm、约70nm至约400nm、约70nm至约450nm、约70nm至约500nm、约70nm至约550nm、约70nm至约600nm、约70nm至约900nm、约70nm至约1μm、约70nm至约5μm、约70nm至约10μm、约100nm至约150nm、约100nm至约200nm、约100nm至约250nm、约100nm至约300nm、约100nm至约350nm、约100nm至约400nm、约100nm至约450nm、约100nm至约500nm、约100nm至约550nm、约100nm至约600nm、约100nm至约900nm、约100nm至约1μm、约100nm至约5μm、约100nm至约10μm、约150nm至约200nm、约150nm至约250nm、约150nm至约300nm、约150nm至约
350nm、约150nm至约400nm、约150nm至约450nm、约150nm至约500nm、约150nm至约550nm、约150nm至约600nm、约150nm至约900nm、约150nm至约1μm、约150nm至约5μm、约150nm至约10μm、约200nm至约250nm、约200nm至约300nm、约200nm至约350nm、约200nm至约400nm、约200nm至约450nm、约200nm至约500nm、约200nm至约550nm、约200nm至约600nm、约200nm至约900nm、约200nm至约1μm、约200nm至约5μm、约200至约10μm、约250nm至约300nm、约250nm至约350nm、约250nm至约400nm、约250nm至约450nm、约250nm至约500nm、约250nm至约550nm、约250nm至约600nm、约250nm至约900nm、约250nm至约1μm、约250nm至约5μm、约250nm至约10μm、约300nm至约350nm、约300nm至约400nm、约300nm至约450nm、约300nm至约500nm、约300nm至约550nm、约300nm至约600nm、约300nm至约900nm、约300nm至约1μm、约300nm至约5μm、约300nm至约10μm、约350nm至约400nm、约350nm至约450nm、约350nm至约500nm、约350nm至约550nm、约350nm至约600nm、约350nm至约900nm、约350nm至约1μm、约350nm至约5μm、约350nm至约10μm、约400nm至约450nm、约400nm至约500nm、约400nm至约550nm、约400nm至约600nm、约400nm至约900nm、约400nm至约1μm、约400nm至约5μm、约400nm至约10μm、约450nm至约500nm、约450nm至约550nm、约450nm至约600nm、约450nm至约900nm、约450nm至约1μm、约450nm至约5μm、约450nm至约10μm、约500nm至约550nm、约500nm至约600nm、约500nm至约900nm、约500nm至约1μm、约500nm至约5μm、约500nm至约10μm、约550nm至约600nm、约550nm至约900nm、约550nm至约1μm、约550nm至约5μm、约550nm至约10μm、约600nm至约900nm、约600nm至约1μm、约600nm至约5μm、约600nm至约10μm、约900nm至约1μm、约900nm至约5μm、约900nm至约10μm、约1μm至约5μm、约1μm至约10μm或约5μm至约10μm的直径。在一些实施方案中,本公开的基于脂质的载体可以具有约70nm、约100nm、约150nm、约200nm、约250nm、约300nm、约350nm、约400nm、约450nm、约500nm、约550nm、约600nm、约900nm、约1μm、约5μm或约10μm的直径。在一些实施方案中,本公开的基于脂质的载体可具有至少约70nm、约100nm、约150nm、约200nm、约250nm、约300nm、约350nm、约400nm、约450nm、约500nm、约550nm、约600nm、约900nm、约1μm或约5μm的直径。在一些实施方案中,本公开的基于脂质的载体可以具有至多约100nm、约150nm、约200nm、约250nm、约300nm、约350nm、约400nm、约450nm、约500nm、约550nm、约600nm、约900nm、约1μm、约5μm或约10μm的直径。
[0055]
本公开的基于脂质的载体(例如,脂质体、纳米液滴或微泡)可以是制剂的一部分。在一些实施方案中,本公开的制剂可包含平均粒径为约70nm至约10μm的基于脂质的载体。在一些实施方案中,本公开的制剂可包含基于脂质的载体,其平均粒径为约70nm至约100nm、约70nm至约150nm、约70nm至约200nm、约70nm至约250nm、约70nm至约300nm、约70nm至约350nm、约70nm至约400nm、约70nm至约450nm、约70nm至约500nm、约70nm至约550nm、约70nm至约600nm、约70nm至约900nm、约70nm至约1μm、约70nm至约5μm、约70nm至约10μm、约100nm至约150nm、约100nm至约200nm、约100nm至约250nm、约100nm至约300nm、约100nm至约350nm、约100nm至约400nm、约100nm至约450nm、约100nm至约500nm、约100nm至约550nm、约100nm至约600nm、约100nm至约900nm、约100nm至约1μm、约100nm至约5μm、约100nm至约10μm、约150nm至约200nm、约150nm至约250nm、约150nm至约300nm、约150nm至约350nm、约150nm至约400nm、约150nm至约450nm、约150nm至约500nm、约150nm至约550nm、约150nm至约600nm、约150nm至约900nm、约150nm至约1μm、约150nm至约5μm、约150nm至约10μm、约200nm至约250nm、约200nm至约300nm、约200nm至约350nm、约200nm至约400nm、约200nm至约
450nm、约200nm至约500nm、约200nm至约550nm、约200nm至约600nm、约200nm至约900nm、约200nm至约1μm、约200nm至约5μm、约200至约10μm、约250nm至约300nm、约250nm至约350nm、约250nm至约400nm、约250nm至约450nm、约250nm至约500nm、约250nm至约550nm、约250nm至约600nm、约250nm至约900nm、约250nm至约1μm、约250nm至约5μm、约250nm至约10μm、约300nm至约350nm、约300nm至约400nm、约300nm至约450nm、约300nm至约500nm、约300nm至约550nm、约300nm至约600nm、约300nm至约900nm、约300nm至约1μm、约300nm至约5μm、约300nm至约10μm、约350nm至约400nm、约350nm至约450nm、约350nm至约500nm、约350nm至约550nm、约350nm至约600nm、约350nm至约900nm、约350nm至约1μmm、约350nm至约5μm、约350nm至约10μm、约400nm至约450nm、约400nm至约500nm、约400nm至约550nm、约400nm至约600nm、约400nm至约900nm、约400nm至约1μm、约400nm至约5μm、约400nm至约10μm、约450nm至约500nm、约450nm至约550nm、约450nm至约600nm、约450nm至约900nm、约450nm至约1μm、约450nm至约5μm、约450nm至约10μm、约500nm至约550nm、约500nm至约600nm、约500nm至约900nm、约500nm至约1μm、约500nm至约5μm、约500nm至约10μm、约550nm至约600nm、约550nm至约900nm、约550nm至约1μm、约550nm至约5μm、约550nm至约10μm、约600nm至约900nm、约600nm至约1μm、约600nm至约5μm、约600nm至约10μm、约900nm至约1μm、约900nm至约5μm、约900nm至约10μm、约1μm至约5μm、约1μm至约10μm或约5μm至约10μm。在一些实施方案中,本公开的制剂可包含基于脂质的载体,其平均粒径为约70nm、约100nm、约150nm、约200nm、约250nm、约300nm、约350nm、约400nm、约450nm、约500nm、约550nm、约600nm、约900nm、约1μm、约5μm或约10μm。在一些实施方案中,本公开的制剂可包含基于脂质的载体,其平均粒径为至少约70nm、约100nm、约150nm、约200nm、约250nm、约300nm、约350nm、约400nm、约450nm、约500nm、约550nm、约600nm、约900nm、约1μm或约5μm。在一些实施方案中,本公开的制剂可包含基于脂质的载体,其平均粒径为至多约100nm、约150nm、约200nm、约250nm、约300nm、约350nm、约400nm、约450nm、约500nm、约550nm、约600nm、约900nm、约1μm、约5μm或约10μm。
[0056]
负载容量:基于脂质的载体(例如,脂质体、纳米液滴或微泡)的负载容量是每单位重量的基于脂质的载体所负载的治疗剂(例如,前药)的量。在一些实施方案中,本公开的pllbc具有约0%至约99%的负载容量。在一些实施方案中,本公开的pllbc具有约0%至约5%、约0%至约10%、约0%至约15%、约0%至约20%、约0%至约30%、约0%至约40%、约0%至约50%、约0%至约75%、约0%至约90%、约0%至约95%、约0%至约99%、约5%至约10%、约5%至约15%、约5%至约20%、约5%至约30%、约5%至约40%、约5%至约50%、约5%至约75%、约5%至约90%、约5%至约95%、约5%至约99%、约10%至约15%、约10%至约20%、约10%至约30%、约10%至约40%、约10%至约50%、约10%至约75%、约10%至约90%、约10%至约95%、约10%至约99%、约15%至约20%、约15%至约30%、约15%至约40%、约15%至约50%、约15%至约75%、约15%至约90%、约15%至约95%、约15%至约99%、约20%至约30%、约20%至约40%、约20%至约50%、约20%至约75%、约20%至约90%、约20%至约95%、约20%至约99%、约30%至约40%、约30%至约50%、约30%至约75%、约30%至约90%、约30%至约95%、约30%至约99%、约40%至约50%、约40%至约75%、约40%至约90%、约40%至约95%、约40%至约99%、约50%至约75%、约50%至约90%、约50%至约95%、约50%至约99%、约75%至约90%、约75%至约95%、约75%至约99%、约90%至约95%、约90%至约99%、或约95%至约99%的负载容量。在一些实施方案
中,本公开的pllbc具有约0%、约5%、约10%、约15%、约20%、约30%、约40%、约50%、约75%、约90%、约95%或约99%的负载容量。在一些实施方案中,本公开的pllbc具有至少约0%、约5%、约10%、约15%、约20%、约30%、约40%、约50%、约75%、约90%或约95%的负载容量。在一些实施方案中,本公开的pllbc具有至多约5%、约10%、约15%、约20%、约30%、约40%、约50%、约75%、约90%、约95%或约99%的负载容量。
[0057]
基于脂质的载体(例如,脂质体、纳米液滴或微泡)的制剂的负载容量是制剂中负载到制剂的基于脂质的载体中的每单位重量的基于脂质的载体的治疗剂(例如,前药)的量。在一些实施方案中,本公开的pllbc的制剂具有约0%至约99%的负载容量。在一些实施方案中,本公开的pllbc的制剂具有约0%至约5%、约0%至约10%、约0%至约15%、约0%至约20%、约0%至约30%、约0%至约40%、约0%至约50%、约0%至约75%、约0%至约90%、约0%至约95%、约0%至约99%、约5%至约10%、约5%至约15%、约5%至约20%、约5%至约30%、约5%至约40%、约5%至约50%、约5%至约75%、约5%至约90%、约5%至约95%、约5%至约99%、约10%至约15%、约10%至约20%、约10%至约30%、约10%至约40%、约10%至约50%、约10%至约75%、约10%至约90%、约10%至约95%、约10%至约99%、约15%至约20%、约15%至约30%、约15%至约40%、约15%至约50%、约15%至约75%、约15%至约90%、约15%至约95%、约15%至约99%、约20%至约30%、约20%至约40%、约20%至约50%、约20%至约75%、约20%至约90%、约20%至约95%、约20%至约99%、约30%至约40%、约30%至约50%、约30%至约75%、约30%至约90%、约30%至约95%、约30%至约99%、约40%至约50%、约40%至约75%、约40%至约90%、约40%至约95%、约40%至约99%、约50%至约75%、约50%至约90%、约50%至约95%、约50%至约99%、约75%至约90%、约75%至约95%、约75%至约99%、约90%至约95%、约90%至约99%、或约95%至约99%的负载容量。在一些实施方案中,本公开的pllbc的制剂具有约0%、约5%、约10%、约15%、约20%、约30%、约40%、约50%、约75%、约90%、约95%或约99%的负载容量。在一些实施方案中,本公开的pllbc的制剂具有至少约0%、约5%、约10%、约15%、约20%、约30%、约40%、约50%、约75%、约90%或约95%的负载容量。在一些实施方案中,本公开的pllbc的制剂具有至多约5%、约10%、约15%、约20%、约30%、约40%、约50%、约75%、约90%、约95%或约99%的负载容量。
[0058]
前药掺入:可以根据前药摩尔数比总磷脂摩尔数(mol%)来测量掺入到本公开的pllbc(例如脂质体、纳米液滴或微泡)中的前药。在一些实施方案中,掺入到本公开的pllbc中的前药可为约1mol%至约100mol%。在一些实施方案中,掺入到本公开的pllbc中的前药可为约1mol%至约10mol%、约1mol%至约20mol%、约1mol%至约30mol%、约1mol%至约40mol%、约1mol%至约50mol%、约1mol%至约60mol%、约1mol%至约70mol%、约1mol%至约80mol%、约1mol%至约90mol%、约1mol%至约100mol%、约10mol%至约20mol%、约10mol%至约30mol%、约10mol%至约40mol%、约10mol%至约50mol%、约10mol%至约60mol%、约10mol%至约70mol%、约10mol%至约80mol%、约10mol%至约90mol%、约10mol%至约100mol%、约20mol%至约30mol%、约20mol%至约40mol%、约20mol%至约50mol%、约20mol%至约60mol%、约20mol%至约70mol%、约20mol%至约80mol%、约20mol%至约90mol%、约20mol%至约100mol%、约30mol%至约40mol%、约30mol%至约50mol%、约30mol%至约60mol%、约30mol%至约70mol%、约30mol%至约80mol%、约
30mol%至约90mol%、约30mol%至约100mol%、约40mol%至约50mol%、约40mol%至约60mol%、约40mol%至约70mol%、约40mol%至约80mol%、约40mol%至约90mol%、约40mol%至约100mol%、约50mol%至约60mol%、约50mol%至约70mol%、约50mol%至约80mol%、约50mol%至约90mol%、约50mol%至约100mol%、约60mol%至约70mol%、约60mol%至约80mol%、约60mol%至约90mol%、约60mol%至约100mol%、约70mol%至约80mol%、约70mol%至约90mol%、约70mol%至约100mol%、约80mol%至约90mol%、约80mol%至约100mol%,或约90mol%至约100mol%。在一些实施方案中,掺入到本公开的pllbc中的前药可为约1mol%、约10mol%、约20mol%、约30mol%、约40mol%、约50mol%、约60mol%、约70mol%、约80mol%、约90mol%或约100mol%。在一些实施方案中,掺入到本公开的pllbc中的前药可为至少约1mol%、约10mol%、约20mol%、约30mol%、约40mol%、约50mol%、约60mol%、约70mol%、约80mol%或约90mol%。在一些实施方案中,掺入到本公开的pllbc中的前药可为至多约10mol%、约20mol%、约30mol%、约40mol%、约50mol%、约60mol%、约70mol%、约80mol%、约90mol%或约100mol%。
[0059]
稳定性:pllbc(例如,脂质体、纳米液滴或微泡)保持恒定尺寸的能力是稳定性的量度。在一些实施方案中,本公开的pllbc(例如,脂质体、纳米液滴或微泡)稳定约1天、约2天、约3天、约4天、约5天、约6天、约7天、约8天、约9天、约10天、约11天、约12天、约13天、约14天、约15天、约16天、约17天、约18天、约19天、约20天、约21天、约22天、约23天、约24天、约25天、约26天、约27天、约28天、约29天、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约7个月、约8个月、约9个月、约10个月、约11个月、约1年或约5年。合成与自组装
[0060]
图2呈现了pllbc的非限制性实例。图2子图a示出了前药的合成,负载前药的脂质体的自组装以及脂质体用于体外处理细胞的用途。图2子图b显示了负载前药的微泡和超声暴露用于体外的靶向药物递送的用途。施用方式
[0061]
本公开的pllbc,例如脂质体和微泡,可以单剂量或多剂量施用以治疗病症。本公开的pllbc的施用可以通过各种形式和途径进行,包括例如,静脉内、动脉内、皮下、肌内、口服、肠胃外、眼、皮下、经皮、鼻、阴道和局部施用。在一些实施方案中,本公开的pllbc可以局部施用,例如通过直接注射到器官中。施用量和频率
[0062]
本公开的pllbc的制剂,例如脂质体和微泡,可以以适合单次施用精确剂量的单位剂型制备。在单位剂型中,本公开的pllbc的制剂被分为含有适当量的前药的单位剂量。该单位剂量可为含有离散量的制剂的包装形式。非限制性实例为小瓶或安瓿中的液体。水性悬浮液组合物可包装在不可重新封闭的单剂量容器中。可重新封闭的多剂量容器可与例如防腐剂组合使用。用于肠胃外注射的制剂可以以单位剂型提供在例如安瓿中或具有防腐剂的多剂量容器中。
[0063]
本公开的pllbc可以以约0mg/ml至约400mg/ml的单位剂型存在于制剂中。本公开的pllbc可以以约0mg/ml至约5mg/ml、约0mg/ml至约10mg/ml、约0mg/ml至约15mg/ml、约0mg/ml至约20mg/ml、约0mg/ml至约25mg/ml、约0mg/ml至约50mg/ml、约0mg/ml至约75mg/ml、约0mg/ml至约100mg/ml、约0mg/ml至约200mg/ml、约0mg/ml至约300mg/ml、约0mg/ml至
约400mg/ml、约5mg/ml至约10mg/ml、约5mg/ml至约15mg/ml、约5mg/ml至约20mg/ml、约5mg/ml至约25mg/ml、约5mg/ml至约50mg/ml、约5mg/ml至约75mg/ml、约5mg/ml至约100mg/ml、约5mg/ml至约200mg/ml、约5mg/ml至约300mg/ml、约5mg/ml至约400mg/ml、约10mg/ml至约15mg/ml、约10mg/ml至约20mg/ml、约10mg/ml至约25mg/ml、约10mg/ml至约50mg/ml、约10mg/ml至约75mg/ml、约10mg/ml至约100mg/ml、约10mg/ml至约200mg/ml、约10mg/ml至约300mg/ml、约10mg/ml至约400mg/ml、约15mg/ml至约20mg/ml、约15mg/ml至约25mg/ml、约15mg/ml至约50mg/ml、约15mg/ml至约75mg/ml、约15mg/ml至约100mg/ml、约15mg/ml至约200mg/ml、约15mg/ml至约300mg/ml、约15mg/ml至约400mg/ml、约20mg/ml至约25mg/ml、约20mg/ml至约50mg/ml、约20mg/ml至约75mg/ml、约20mg/ml至约100mg/ml、约20mg/ml至约200mg/ml、约20mg/ml至约300mg/ml、约20mg/ml至约400mg/ml、约25mg/ml至约50mg/ml、约25mg/ml至约75mg/ml、约25mg/ml至约100mg/ml、约25mg/ml至约200mg/ml、约25mg/ml至约300mg/ml、约25mg/ml至约400mg/ml、约50mg/ml至约75mg/ml、约50mg/ml至约100mg/ml、约50mg/ml至约200mg/ml、约50mg/ml至约300mg/ml、约50mg/ml至约400mg/ml、约75mg/ml至约100mg/ml、约75mg/ml至约200mg/ml、约75mg/ml至约300mg/ml、约75mg/ml至约400mg/ml、约100mg/ml至约200mg/ml、约100mg/ml至约300mg/ml、约100mg/ml至约400mg/ml、约200mg/ml至约300mg/ml、约200mg/ml至约400mg/ml,或约300mg/ml至约400mg/ml的单位剂型存在于制剂中。本公开的pllbc可以以约0mg/ml、约5mg/ml、约10mg/ml、约15mg/ml、约20mg/ml、约25mg/ml、约50mg/ml、约75mg/ml、约100mg/ml、约200mg/ml、约300mg/ml或约400mg/ml的单位剂型存在于制剂中。本公开的pllbc可以以至少约0mg/ml、约5mg/ml、约10mg/ml、约15mg/ml、约20mg/ml、约25mg/ml、约50mg/ml、约75mg/ml、约100mg/ml、约200mg/ml或约300mg/ml的单位剂型存在于制剂中。本公开的pllbc可以以至多约5mg/ml、约10mg/ml、约15mg/ml、约20mg/ml、约25mg/ml、约50mg/ml、约75mg/ml、约100mg/ml、约200mg/ml、约300mg/ml或约400mg/ml的单位剂型存在于制剂中。
[0064]
本公开的pllbc(例如脂质体、纳米液滴或微泡)的剂量水平可以取决于多种因素,包括例如,所用pllbc的活性、施用途径、施用时间、排泄速率、前药的代谢、治疗的持续时间、与pllbc结合使用的前药化合物、化合物和/或材料、年龄、性别、体重、状况、总体健康状况以及所治疗受试者的既往病史。剂量值也可以随着待治疗病症的严重性而变化。对于任何特定的受试者,可以根据个体需要和施用或监督组合物施用的人员的专业判断随时间调整特定的剂量方案。
[0065]
在一些实施方案中,剂量可以用前药的量除以受试者的质量来表示,例如毫克前药每千克受试者体重。在一些实施方案中,以约5mg/kg至约50mg/kg、250mg/kg至约2000mg/kg、约10mg/kg至约800mg/kg、约50mg/kg至约400mg/kg、约100mg/kg至约300mg/kg或约150mg/kg至约200mg/kg的量施用剂量。
[0066]
在一些实施方案中,剂量可以用每千克受试者体重的pllbc(例如,脂质体、纳米液滴或微泡)的量表示。在一些实施方案中,以约5mg/kg至约50mg/kg、250mg/kg至约2000mg/kg、约10mg/kg至约800mg/kg、约50mg/kg至约400mg/kg、约100mg/kg至约300mg/kg或约150mg/kg至约200mg/kg的量施用剂量。联合治疗
[0067]
在一些实施方案中,本公开的pllbc包括多种前药。包含前药组合的pllbc的施用
可能具有协同作用。协同作用可以是指观察到,包括多种前药的pllbc的施用所产生的总体效果可能大于施用包含一种前药的pllbc的单个效果之和。协同作用还可以是指观察到,具有一种前药的pllbc产生很小作用或没有作用,但具有多种前药的pllbc产生的作用大于仅具有第二种前药的pllbc产生的作用。协同作用还可以是指观察到,与施用具有一种前药的pllbc相比,向受试者施用具有多种前药的pllbc给药降低了受试者的副作用
[0068]
在一些实施方案中,可以将负载不同前药的基于脂质的载体组合地施用给受试者。组合施用pllbc(例如脂质体、纳米液滴或微泡)可具有协同作用。协同作用可以是指观察到,两种负载前药的基于脂质的载体的组合所产生的总体效果可能大于两种单独效果之和。协同作用还可以是指观察到,单个pllbc产生很小作用或没有作用,但是当与第二pllbc一起施用时,产生的效果大于由单独的第二pllbc产生的效果。协同作用还可以是指观察到,与施用单独的pllbc相比,将两个pllbc组合地施用给受试者减少了受试者中的副作用。可以通过相同或不同的施用途径同时或依次进行不同pllbc的施用。在靶位点处触发前药活性
[0069]
在一些实施方案中,本公开的pllbc(例如脂质体、纳米液滴或微泡)可以将前药递送至受试者的靶位点。靶位点可以是例如,局部感染、癌性病变、非癌性病变、转移性病变、癌前病变、肿瘤、器官的位点,或特定细胞类型,例如红细胞、白细胞、嗜中性粒细胞、巨噬细胞或神经元。向靶位点递送前药可例如,减少有效治疗病症所需的剂量,增加前药的有效性或减少由前药在受试者中引起的副作用。在一些实施方案中,在不存在体外触发物的情况下,作为pllbc的一部分存在于靶位点的前药可以保持无活性。一旦存在体外触发物,就可以触发pllbc,导致前药被释放和激活。体外触发物的非限制性实例包括超声、磁场、电场、光波和辐射。在图3中显示了利用超声作为体外触发物的微泡治疗的示意图。
[0070]
超声是频率高于人类听觉最高可听上限的声波。在一些实施方案中,可以使用约1mhz至约20mhz的超声频率来触发本公开的pllbc(例如,脂质体、微泡或纳米液滴)。在一些实施方案中,可以使用约1mhz至约2mhz、约1mhz至约3mhz、约1mhz至约4mhz、约1mhz至约5mhz、约1mhz至约6mhz、约1mhz至约7mhz、约1mhz至约8mhz、约1mhz至约9mhz、约1mhz至约10mhz、约1mhz至约15mhz、约1mhz至约20mhz、约2mhz至约3mhz、约2mhz至约4mhz、约2mhz至约5mhz、约2mhz至约6mhz、约2mhz至约7mhz、约2mhz至约8mhz、约2mhz至约9mhz、约2mhz至约10mhz、约2mhz至约15mhz、约2mhz至约20mhz、约3mhz至约4mhz、约3mhz至约5mhz、约3mhz至约6mhz、约3mhz至约7mhz、约3mhz至约8mhz、约3mhz至约9mhz、约3mhz至约10mhz、约3mhz至约15mhz、约3mhz至约20mhz、约4mhz至约5mhz、约4mhz至约6mhz约4mhz至约7mhz、约4mhz至约8mhz、约4mhz至约9mhz、约4mhz至约10mhz、约4mhz至约15mhz、约4mhz至约20mhz、约5mhz至约6mhz、约5mhz至约7mhz、约5mhz至约8mhz、约5mhz至约9mhz、约5mhz至约10mhz、约5mhz至约15mhz、约5mhz至约20mhz、约6mhz至约7mhz、约6mhz至约8mhz、约6mhz至约9mhz、约6mhz至约10mhz、约6mhz至约15mhz、约6mhz至约20mhz、约7mhz至约8mhz、约7mhz至约9mhz、约7mhz至约10mhz、约7mhz至约15mhz、约7mhz至约20mhz、约8mhz至约9mhz、约8mhz至约10mhz、约8mhz至约15mhz、约8mhz至约20mhz、约9mhz至约10mhz、约9mhz至约15mhz、约9mhz至约20mhz、约10mhz至约15mhz、约10mhz至约20mhz或约15mhz至约20mhz的超声频率来触发本公开的pllbc。在一些实施方案中,可以使用约1mhz、约2mhz、约3mhz、约4mhz、约5mhz、约6mhz、约7mhz、约8mhz、约9mhz、约10mhz、约15mhz或约20mhz的超声频率来触发本公开的pllbc。在
一些实施方案中,可以使用至少约1mhz、约2mhz、约3mhz、约4mhz、约5mhz、约6mhz、约7mhz、约8mhz、约9mhz、约10mhz或约15mhz的超声频率来触发本公开的pllbc。在一些实施方案中,可以使用至多约2mhz、约3mhz、约4mhz、约5mhz、约6mhz、约7mhz、约8mhz、约9mhz、约10mhz、约15mhz或约20mhz的超声频率来触发本公开的pllbc。
[0071]
在一些实施方案中,超声波可以产生作用在pllbc上的压力。在一些实施方案中,该压力为约25kpa至约2.5mpa的压力。在一些实施方案中,压力为约25kpa至约300kpa的压力。在一些实施方案中,压力为约1mpa至约2.5mpa的压力。
[0072]
在一些实施方案中,光可以用于触发pllbc,例如脂质体、纳米液滴或微泡。在一些实施方案中,光是激光脉冲的形式。在一些实施方案中,光的波长可为约400nm至约1,400nm。在一些实施方案中,光的波长可为约400nm至约450nm、约400nm至约500nm、约400nm至约550nm、约400nm至约600nm、约400nm至约650nm、约400nm至约700nm、约400nm至约750nm、约400nm至约800nm、约400nm至约900nm、约400nm至约1,000nm、约400nm至约1,400nm、约450nm至约500nm、约450nm至约550nm、约450nm至约600nm、约450nm至约650nm、约450nm至约700nm、约450nm至约750nm、约450nm至约800nm、约450nm至约900nm、约450nm至约1,000nm、约450nm至约1,400nm、约500nm至约550nm、约500nm至约600nm、约500nm至约650nm、约500nm至约700nm、约500nm至约750nm、约500nm至约800nm、约500nm至约900nm、约500nm至约1,000nm、约500nm至约1,400nm、约550nm至约600nm、约550nm至约650nm、约550nm至约700nm、约550nm至约750nm、约550nm至约800nm、约550nm至约900nm、约550nm至约1,000nm、约550nm至约1,400nm、约600nm至约650nm、约600nm至约700nm、约600nm至约750nm、约600nm至约800nm、约600nm至约900nm、约600nm至约1,000nm、约600nm至约1,400nm、约650nm至约700nm、约650nm至约750nm、约650nm至约800nm、约650nm至约900nm、约650nm至约1,000nm、约650nm至约1,400nm、约700nm至约750nm、约700nm至约800nm、约700nm至约900nm、约700nm至约1,000nm、约700nm至约1,400nm、约750nm至约800nm、约750nm至约900nm、约750nm至约1,000nm、约750nm至约1,400nm、约800nm至约900nm、约800nm至约1,000nm、约800nm至约1,400nm、约900nm至约1,000nm、约900nm至约1,400nm或约1,000nm至约1,400nm。在一些实施方案中,光的波长可为约400nm、约450nm、约500nm、约550nm、约600nm、约650nm、约700nm、约750nm、约800nm、约900nm、约1,000nm或约1,400nm。在一些实施方案中,光的波长可为至少约400nm、约450nm、约500nm、约550nm、约600nm、约650nm、约700nm、约750nm、约800nm、约900nm、或约1,000nm。在一些实施方案中,光的波长可为至多约450nm、约500nm、约550nm、约600nm、约650nm、约700nm、约750nm、约800nm、约900nm、约1,000nm、或约1,400nm。
[0073]
在一些实施方案中,磁场可用于触发pllbc,例如脂质体、纳米液滴或微泡。在一些实施方案中,磁场强度为0.2t至约7t。在一些实施方案中,磁场强度为约0.2t至约0.5t、约0.2t至约1t、约0.2t至约1.5t、约0.2t至约2t、约0.2t至约3t、约0.2t至约4t、约0.2t至约5t、约0.2t至约6t、约0.2t至约7t、约0.5t至约1t、约0.5t至约1.5t、约0.5t至约2t、约0.5t至约3t、约0.5t至约4t、约0.5t至约5t、约0.5t至约6t、约0.5t至约7t、约1t至约1.5t、约1t至约2t、约1t至约3t、约1t至约4t、约1t至约5t、约1t至约6t、约1t至约7t、约1.5t至约2t、约1.5t至约3t、约1.5t至约4t、约1.5t至约5t、约1.5t至约6t、约1.5t至约7t、约2t至约3t、约2t至约4t、约2t至约5t、约2t至约6t、约2t至约7t、约3t至约4t、约3t至约5t、约3t至约6t、约
3t至约7t、约4t至约5t、约4t至约6t、约4t至约7t、约5t至约6t、约5t至约7t、或约6t至约7t。在一些实施方案中,磁场强度为约0.2t、约0.5t、约1t、约1.5t、约2t、约3t、约4t、约5t、约6t或约7t。在一些实施方案中,磁场强度为至少约0.2t、约0.5t、约1t、约1.5t、约2t、约3t、约4t、约5t或约6t。在一些实施方案中,磁场强度为至多约0.5t、约1t、约1.5t、约2t、约3t、约4t、约5t、约6t或约7t。
[0074]
将体外触发物施加到受试者的时间量可以变化。在一些实施方案中,将体外触发物施加约1秒、约2秒、约3秒、约4秒、约5秒、约10秒、约30秒、约1分钟、约5分钟、约15分钟、约30分钟、约1小时、约2小时、约3小时、约4小时、约5小时、约6小时或约12小时。在一些实施方案中,将体外触发物施加约1秒至约30秒、约1分钟至约30分钟、或约1小时至约6小时、或约6小时至约12小时。
[0075]
在一些实施方案中,将体外触发物以脉冲的形式施加到受试者。在一些实施方案中,以2-100个脉冲施加体外触发物。在一些实施方案中,可以以2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100个脉冲施加体外触发物。在一些实施方案中,以超过100个脉冲施加体外触发物。在一些实施方案中,将体外触发物的每个脉冲施加约1秒、约2秒、约3秒、约4秒、约5秒、约10秒、约30秒、约1分钟、约5分钟、约15分钟、约30分钟、约1小时、约2小时、约3小时、约4小时、约5小时、约6小时或约12小时。在一些实施方案中,将体外触发物的脉冲施加约1秒至约30秒、约1分钟至约30分钟、或约1小时至约6小时、或约6小时至约12小时。造影剂
[0076]
在一些实施方案中,本公开的pllbc,例如脂质体、纳米液滴或微泡,可以充当造影剂。造影剂可以改善成像技术,例如超声成像。超声成像是便携式的,可提供实时成像反馈,并且没有电离辐射风险。超声造影剂(例如,微泡)对超声产生非线性响应,并为心脏病学成像提供高信噪比。超声波用微泡将靶组织区域实时可视化的能力可以允许测量例如,肿瘤尺寸、脉管系统和血流。病症治疗
[0077]
本公开的pllbc,例如脂质体、纳米液滴或微泡,可以用于治疗、预防或诊断病症。在一些实施方案中,本公开的pllbc可用于治疗、预防或诊断病症,例如癌症、病毒感染、细菌感染、炎性病症或神经病症。
[0078]
本公开的pllbc(例如,脂质体、纳米液滴或微泡)可用于治疗、预防或诊断癌症。在一些实施方案中、本公开的pllbc可用于治疗癌症,例如,急性成淋巴细胞白血病(all)、急性髓性白血病(aml)、肾上腺皮质癌、卡波西肉瘤(软组织肉瘤)、aids相关淋巴瘤、原发性中枢神经系统淋巴瘤、肛门癌、胃肠道类癌瘤、星形细胞瘤、非典型畸胎样/横纹肌样肿瘤、基底细胞癌、胆管癌、膀胱癌、骨癌、脑瘤、乳腺癌、支气管肿瘤、伯基特淋巴瘤、非霍奇金淋巴瘤、类癌瘤、心脏肿瘤、胚胎肿瘤、生殖细胞瘤、宫颈癌、胆管癌、脊索瘤、慢性淋巴细胞性白血病(cll)、慢性髓细胞性白血病(cml)、慢性骨髓增殖性肿瘤、结直肠癌、颅咽管瘤、皮肤t细胞淋巴瘤、导管原位癌(dcis)、子宫内膜癌(子宫癌)、室管膜瘤、食管癌、嗅神经母细胞瘤
(头颈癌)、尤文氏肉瘤、颅外生殖细胞瘤、眼内黑色素瘤、视网膜母细胞瘤、输卵管癌、骨纤维组织细胞瘤、骨肉瘤、胆囊癌、胃肠道类癌瘤、胃肠道间质瘤(gist)、性腺外生殖细胞瘤、卵巢生殖细胞瘤、睾丸癌、妊娠滋养细胞疾病、毛细胞白血病、头颈癌、肝细胞(肝)癌、组织细胞增生症、下咽癌、眼内黑色素瘤、胰岛细胞瘤、胰腺神经内分泌肿瘤、肾(肾细胞)癌、朗格汉斯细胞组织细胞增生症、喉癌、唇癌和口腔癌、肝癌、非小细胞肺癌、小细胞肺癌、淋巴瘤、骨恶性纤维组织细胞瘤、骨肉瘤、黑色素瘤、merkel细胞癌、间皮瘤、转移性癌症、转移性鳞状颈癌、中线癌、口腔癌、多发性内分泌肿瘤综合征、多发性骨髓瘤、蕈样真菌病(淋巴瘤)、鼻腔和鼻窦癌、神经母细胞瘤、非霍奇金淋巴瘤、胰腺癌、胰腺神经内分泌肿瘤、乳头状瘤、副神经节瘤、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、垂体瘤、胸膜肺母细胞瘤、原发性腹膜癌、前列腺癌、直肠癌、横纹肌肉瘤、唾液腺癌、血管肿瘤、sezary综合征(淋巴瘤)、小肠癌、软组织肉瘤、t细胞淋巴瘤、睾丸癌、咽喉癌、鼻咽癌、口咽癌、下咽癌、胸腺瘤和胸腺癌、甲状腺癌、尿道癌、子宫肉瘤、阴道癌、血管肿瘤、外阴癌或威尔姆斯肿瘤。
[0079]
本公开的pllbc(例如,脂质体、纳米液滴或微泡)可用于治疗、预防或诊断病毒感染。在一些实施方案中,本公开的pllbc可用于治疗呼吸道病毒感染,例如流感、呼吸道合胞病毒感染、腺病毒感染、副流感病毒感染或严重急性呼吸综合征(sars)。在一些实施方案中,本公开的pllbc可用于治疗胃肠道病毒感染,例如诺如病毒感染、轮状病毒感染、腺病毒感染或星状病毒感染。在一些实施方案中,本公开的pllbc可用于治疗发疹性病毒感染,例如麻疹、风疹、水痘、带状疱疹、红疹、天花、第五病或基孔肯雅病毒感染。在一些实施方案中,本公开的脂质体、纳米液滴或微泡可用于治疗肝病毒感染,例如甲型肝炎、乙型肝炎、丙型肝炎、丁型肝炎或戊型肝炎。在一些实施方案中,本公开的pllbc可用于治疗皮肤病毒感染,例如疣(例如,生殖器疣)、口腔疱疹、生殖器疱疹或传染性软疣。在一些实施方案中,本公开的pllbc可用于治疗出血性病毒疾病,例如埃博拉、拉沙热、登革热、黄热病、马尔堡出血热或克里米亚-刚果出血热。在一些实施方案中,本公开的pllbc可用于治疗神经性病毒感染,例如脊髓灰质炎、病毒性脑膜炎、病毒性脑炎或狂犬病。
[0080]
本公开的pllbc(例如,脂质体、纳米液滴或微泡)可用于治疗、预防或诊断细菌感染。在一些实施方案中,本公开的pllbc可用于治疗或预防细菌感染,例如,金黄色葡萄球菌(staphylococcus aureus)、表皮葡萄球菌(staphylococcus epidermis)、腐生葡萄球菌(staphylococcus saprophyticus)、酿脓链球菌(streptococcus pyogenous)、无乳链球菌(streptococcus agalactiae)、牛链球菌(streptococcus bovis)、肺炎链球菌(streptococcus pneumoniae)、草绿色链球菌(viridians streptococci)、炭疽芽胞杆菌(bacillus anthracis)、蜡样芽胞杆菌(bacillus cereus)、破伤风梭菌(clostridium tetani)、肉毒梭菌(clostridium botulinum)、产气荚膜梭菌(clostridium perfringens)、艰难梭菌(clostridium difficile)、白喉棒状杆菌(corynebacterium diphtheriae)、单核细胞增生李斯特菌(listeria monocytogenes)、脑膜炎奈瑟氏球菌(neisseria menigitidis)、淋病奈瑟氏球菌(neisseria gonorrhoeae)、大肠杆菌(escherichia coli)、伤寒沙门氏菌(salmonella typhi)、志贺氏菌(shigella)(细菌性痢疾)、霍乱弧菌(vibrio cholerae)、空肠弯曲杆菌(campylobacter jejuni)或幽门螺旋杆菌(helicobacter pylori)。实施例
实施例1:合成方法
[0081]
方案1描述了用于将两个化学治疗化合物(表示为p和n)偶联至包含两个磷脂链的接头的合成途径。方案1
[0082]
将母体化合物(0.24mmol,1当量)、dcc(0.73mmol,3当量)、dppe-glu(0.24mmol,1当量)和dmap(0.048mmol,0.4当量)的混合物加入到10ml的烧瓶中。在氮气气氛下,将5.5ml的干燥thf加入到烧瓶中。将反应混合物在室温下搅拌24小时。薄层色谱(tlc)板用于监测反应并指导所有快速柱色谱法(kiesel凝胶60,230-400目)。高分辨率质谱法用于验证前药的化学结构。每种前药的疏水性脂肪酸充当锚定剂以掺入到亲脂性药物递送媒介物的脂质层中。
[0083]
2,3-双(棕榈酰氧基)丙基(2-(5-氧代-5-((((5s,5as,8as,9s)-8-氧代-9-(3,4,5-三甲氧基苯基)-5,5a,6,8,8a,9-六氢呋喃并[3',4':6,7]萘并[2,3-d][1,3]二氧杂环戊烯-5-基)氧基)戊酰胺基)乙基)磷酸钠(2t-p)。产率28.6%,白色固体,mp=60℃(ch2cl2/meoh=7/1)。1h nmr(cdcl3–
d6)6.83(s,1h),6.53(s,1h),6.39(s,2h),5.98(s,2h),5.91(d,j=7.04hz,1h),5.26(s,1h),4.58(d,j=3.32,1h),4.37(s,2h),4.23-4.15(m,2h),3.94(s,4h),3.79(d,j=19.2hz,9h),3.50(s,2h),2.89-2.82(m,2h),2.56-2.50(m,2h),2.35-2.19(m,6h),2.12-2.01(m,7h),1.31(s,48h),0.91-0.88(m,6h);
13
c nmr(cdcl3–
d6)173.8,152.6,148.1,147.5,134.9,132.4,108.2,101.7,60.7,56.2,38.7,34.5,34.3,33.5,31.9,29.8,29.7,29.4,25,24.9,22.7,14.1。
[0084]
2,3-双(棕榈酰基氧基)丙基(2-(5-((7-(3,5-二溴苯基)-8-氧代-7,8,10,11-四氢苯并[h]呋喃并[3,4-b]喹啉-2-基)氧基)-5-氧代戊酰胺基)乙基)磷酸钠(2t-n)。产率25.6%,油状物,(ch2cl2/meoh=7/1)。1h nmr(cdcl3–
d6)10.56(s,1h),8.06(s,1h),7.89(d,j=6.88hz,1h);7.72(d,j=8.96hz,1h),7.59(s,1h),7.44(s,1h),7.37-7.29(m,3h),7.19(d,j=8.8hz,1h),6.96(d,j=8.36,1h),6.38(d,j=7.08hz,1h),5.25(s,1h),5.13-4.99(m,3h),4.34(d,j=,1h),4.02-4.01(m,5h),3.51(d,j=14.08hz,2h),3.05(s,3h),2.69(s,2h),2.41(s,2h),2.23(d,j=6hz,4h),2.09(s,2h),1.31-1.21(m,46h)0.91-0.89(m,6h);
13
c nmr(cdcl3–
d6)173.6,173.4,173.2,173.2,172.4 158.9,156.6,149.8,148.8,139.7,132.4,131.9,131.2,130.2,129.6,128.0,123.7,123.1,121.6,118.6,106.4,96.1,
66.5,64.5,62.5,40.9,39.8,34.9,34.2,34.0,32.7,31.9,29.7,29.7,29.6,29.6,29.4,29.4,29.2,29.1,24.9,24.8,22.7,20.9,14.1。
[0085]
图1和图4示出了用于将拓扑替康和阿糖胞苷偶联至磷脂的合成途径。通过氨基附接(阿糖胞苷)或羟基附接(阿糖胞苷、托泊替康)进行磷脂缀合,以产生双尾的托泊替康(2t-t)或双尾的阿糖胞苷(2t-c)。使用薄层色谱法检查反应进程,并通过使用3:1ch2cl2:meoh(2t-c,nh2)、1:1ch2cl2:meoh(2t-c,oh)和4:1chcl3:meoh(2t-t)的色谱分离来纯化前药。通过1h和c
13
核磁共振波谱法(nmr)验证前药的结构,发现2t-c(氨基)的产率为23%,2t-c(oh)的产率为7%,且2t-t的产率为19%。实施例2:脂质体悬浮液
[0086]
以所需的mol%使用1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(dppc);1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-(甲氧基(聚乙二醇)2000)铵盐(dspe-peg2000)的氯仿溶液;和前药在氯仿中的溶液制备负载脂质体前药的脂质膜。然后,将脂质混合物在氮气下干燥,并进一步在真空下于50℃干燥2小时。在50℃下使用超声浴30分钟,将富含前药的脂质膜重悬于1x磷酸盐缓冲盐水(pbs)溶液的0.5ml等分试样中,以提供每1ml的pbs脂质体悬浮液为1mg的脂质。实施例3:微泡悬浮液
[0087]
为了产生负载2t-n的微泡,以所需的mol%使用1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(dppc);1,2-二棕榈酰基-sn-甘油-3-磷酸盐(单钠盐)(dppa);1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-(叶酸(聚乙二醇)-5000)(铵盐)(dspe-peg5000)的氯仿溶液;和前药在氯仿中的溶液制备负载2t-n前药的脂质膜。然后,将脂质混合物在氮气下干燥,并在真空下于50℃下进一步干燥2小时。在50℃下使用超声浴30分钟,将富含前药的脂质膜重悬于(80vol%0.1m tris,10vol%甘油,10vol%丙二醇)tris缓冲液的1.5ml等分试样中,得到每1.5ml的tris缓冲脂质体悬浮液为1.5mg的脂质。密封后,用10ml的六氟化硫(sf6)吹扫每
个小瓶。使用机械振荡器将小瓶振荡45秒,以从脂质体悬浮液形成微泡。实施例4:纳米液滴悬浮液
[0088]
形成了dspc:dspe-peg2000,并用于与全氟丁烷生成纳米液滴(nd)。将含有微泡的小瓶浸没在5℃co2/异丙醇浴中,并用27g针排气,然后用约30ml的空气(来自室内)加压。通过观察小瓶内容物和浴温来防止脂质的冻结。实施例5:差示扫描量热法
[0089]
在不挤出的情况下,对于每一种化合物,使用每1ml的pbs为20mg的脂质来制备前药浓度不断增加的负载前药的脂质体(pll)样品。去离子水用作校准用标准。将每种脂质体悬液中的10μl转移并密封在铝制dsc锅中。dsc测量在室温下进行,然后将样品以5℃/min从15℃加热到55℃。
[0090]
图5显示了浓度增加的负载2t-p的脂质体的差示扫描量热曲线。图6显示了浓度增加的负载p的脂质体的差示扫描量热曲线。
[0091]
dsc是一种热分析技术,可用于通过确定混合分子和组合物与脂质体双层的相容性来设计脂质药物递送系统(如脂质体)。测量脂质体在不同的前药浓度下的热致行为,以确定分子的插入是否改变了相变温度。peg-2000掩盖了相前转变。与空脂质体相比,pll(2t-p和2t-n;0至37mol%)的热谱图显示,随着前药成分的增加,相变温度逐渐降低。负载p和负载n的脂质体(0至31mol%)的热谱图保持相变温度,吸热峰几乎没有减少。负载2t-p-和2t-n的脂质体的吸热峰的减少表明由于双层中前药的存在导致脂质-脂质相互作用的变化。13mol%的p导致相变略有变化,与药物掺入相对应(图7子图a和图7子图b)。随着浓度增加,相变返回到空脂质体的相变。较高浓度的p导致形成胶束,而不是将p包埋在脂质体的双层中。n没有降低相变温度。用于dsc分析的所有脂质体悬浮液均在去离子水中而不是钠缓冲液中制备,以防止不期望的相互作用。样品未挤出。实施例6:脂质体粒径分布和稳定性测定
[0092]
通过动态光散射(dls)来表征脂质体尺寸分布。用含有脂质体悬浮液的一次性聚苯乙烯大小比色皿进行测量。报告的dls测量值是3个单独制备的脂质体样品的平均值。实施例7:2t-p和2t-n掺入效率测量
[0093]
用紫外可见分光光度法测定脂质体中的母体化合物和前药浓度;(2t-p:292nm;2t-n:285nm)。以0mol%至50mol%的不同浓度制备pll。对于在50mol%以下的样品,脂质的量保持相等。每个样品通过200nm孔膜挤出共11次。挤出前和挤出后的脂质体通过溶解在dmso中而破裂(脂质体悬浮液/dmso,1:9,v/v)。在石英比色皿中分析样品。使用了以下参数:扫描速度:120nm/min;带宽:2nm;积分时间:0.15sec;数据间隔:0.30nm;起始波长:500nm;结束波长:190nm。
[0094]
n和p(方案1)是疏水性化合物,已更改为包含两亲性尾(2t-p和2t-n),从而改变它们在脂质体中的掺入,可以使用紫外-可见对其进行表征。该技术测量通过样品表面而降低的透射率。脂质体在不同浓度下的吸收(去除未掺入的物质后)可用于计算有多少药物已掺入脂质体中。
[0095]
图7子图a显示了对于2t-p,挤出前和挤出后的脂质体中的药物掺入。图7子图b显示对于2t-n,在挤出前和挤出后的脂质体中的药物掺入。对于母体化合物,脂质体药物掺入极限被计算为<10mol%,而对于前药则为约40mol%。母体化合物的最大测得负载量很低
(例如,p为约11mol%,n为约1.1mol%)。
[0096]
使脂质体溶液通过膜以除去未结合的分子。在挤出前和挤出后分析样品。两种前药均获得了高负载容量,其中2t-n保持96%的负载容量(图6)。在超过50mol%时,由于不能进一步挤出而无法达到掺入。高标准偏差表明脂质体的不稳定性,这是由于脂质体内未掺入的药物分子引起。
[0097]
使用动态光散射(dls),随时间监测负载母体化合物和前药的脂质体的尺寸分布。图8子图a显示了负载2t-p的脂质体在整个3周的时间内保持稳定。图8子图b显示了负载p的脂质体在整个3周的时间内是稳定的。图8子图c显示了负载2t-n的脂质体在整个3周的时间内保持稳定。图8子图d显示了负载n的脂质体在整个3周的时间内保持稳定。将有效药物与磷脂尾缀合导致脂质体的高负载效率、稳定性、保留率和靶向递送。
[0098]
负载p的脂质体和负载n的脂质体的浓度反映了初始药物量,而不是挤出后的最终药物保留,最终药物保留不超过15mol%(图7子图a和图7子图b)。
[0099]
负载前药的脂质体的尺寸分布表明,前药保留在脂质体内,渗漏最少。当由于存在过量的未掺入药物颗粒而使挤出变得不可能完成时,观察到完全饱和。增加负载效率和封装稳定性都可以最大程度地减少化学降解,并允许在亲脂性媒介物中使用可行的前药。通过添加亲水性尾并将疏水性药物转化为亲脂性前药来增加溶解度。转化导致高包埋率、低渗漏和化学稳定性。实施例8:脂质体中的2t-t掺入
[0100]
产生了具有增加浓度的2t-t的2t-t脂质体,并使其通过挤出器以从脂质体溶液中除去任何未结合的2t-t。使用紫外-可见光谱法在挤出前和挤出后对脂质体溶液进行分析,扫描范围为200nm-500nm,2nm带宽,30秒积分时间,0.5nm数据间隔和100nm/min扫描速度。如在图9和表1中可见,挤出后存在的2t-t的量与挤出前药物浓度相似,表明前药损失最小。分析了掺入极限,高达70mol%(147um)。
[0101]
通过在挤出前和挤出后的dls测量来表征2t-t脂质体的尺寸分布。脂质体直径的标准偏差在挤出后较低。该结果表明脂质体的单分散群体增加。在表2和图10-11中可以看到负载各种浓度的2t-t的2t-t脂质体的尺寸分布。表1
表22t-t mol%前pdi后pdi0148
±
790.3
±
0.1122
±
70.3
±
010102
±
190.3
±
0130
±
70.3
±
020121
±
160.3
±
0.1129
±
90.3
±
03098
±
280.3
±
0118
±
250.3
±
040114
±
240.3
±
0123
±
100.3
±
050*122.40.3122.40.360*182.90.588.760.370*172.10.475.430.3pdi=多分散指数实施例9:2t-c脂质体尺寸分布
[0102]
产生了具有增加浓度的2t-c的2t-c脂质体,并使其通过挤出器以从脂质体溶液中除去任何未结合的2t-c。通过在挤出前和挤出后的dls测量来表征2t-c脂质体的尺寸分布。脂质体直径的标准偏差在挤出后较低。该结果表明脂质体的单分散群体增加。在表3和图12-13中可以看到负载各种浓度的2t-c的2t-c脂质体的尺寸分布。表32t-c mol%前pdi后pdi0117
±
70.3
±
077
±
130.3
±
010124
±
110.3
±
0121
±
80.3
±
020115
±
140.3
±
0116
±
10.3
±
030105
±
40.3
±
0120
±
120.3
±
040109
±
150.3
±
0115
±
70.3
±
05076.6
±
130.4
±
0.191
±
20.3
±
0pdi=多分散指数实施例10:细胞培养
[0103]
在补充有10%fbs、100mg/l青霉素g和100mg/l链霉素的dmem中培养人宫颈癌(atcc s3)(hela)细胞。在补充有1.0mm丙酮酸钠、1%glutamax-1、100μg/ml青霉素、100μg/ml链霉素和10%fbs的dmem中培养人乳腺癌(mcf-7)细胞。将细胞在含5%co2的潮湿气氛中于37℃下孵育。将mcf10a细胞在补充有5%fbs、表皮生长因子(20ng/ml)、氢化可的松(0.5ug/ml)、霍乱毒素(100ng/ml)、胰岛素(10ug/ml)和penstrep的rpmi中培养。实施例11:负载2t-p和2t-n前药的脂质体的体外细胞毒性
[0104]
将细胞以4,000个细胞/孔(hela,mcf7,mcf10a)接种到96孔板中,并在37℃和5%co2下孵育24小时。孵育后,更换培养基,并将细胞平行分成pll处理组和母体化合物处理组。用从2vol%的pll悬浮液(前药/脂质,0.2mol%)开始两倍稀释的pll系列或1μm的母体化合物处理细胞。pll组阳性对照如下:未处理,空脂质体(无药物,2vol%)和氧化苯胂(pao)。母体化合物组阳性对照如下:未处理、dmso和pao。孵育48小时后,向每个孔中添加20μl的3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(mtt,5mg/ml),并将孔孵育2小时。用100μl的dmso替换培养基以溶解甲瓒晶体。使用酶标仪测量595nm处的吸光度。一式四份地进行实验,并重复两次。
[0105]
使用用于hela、mcf-7和mcf10a细胞系的标准mtt测定检查了负载前药的脂质体(20mol%)和母体化合物的细胞毒性。负载2t-n的脂质体保持效力,而负载2t-p的脂质体损失活性。活性降低是由于2t-p脂质体结构内的空间位阻。作为对照,研究正常的乳腺癌细胞系以验证当细胞暴露于负载前药的脂质体和负载母体化合物的脂质体时的癌细胞分化。与母体化合物p相比,在所有测试的细胞系中,负载2t-p的脂质体的毒性显着降低。负载2t-n的脂质体在hela细胞(0.020μm)中保持效力,但在mcf7(0.038μm)细胞中显示出降低的效力。负载2t-n的脂质体在mcf10a细胞中的效力显着降低(1.105μm)。表4显示了用游离的母体化合物或掺有前药的脂质体处理48小时后,hela、mcf-7和mcf10a细胞系的细胞生存力数据。表4实施例12:负载2t-t和2t-c前药的脂质体的体外细胞毒性
[0106]
为了评估负载2t-t前药的脂质体的细胞毒性,将hela细胞暴露于不同浓度的拓扑替康或负载2t-t的脂质体中72小时。在72小时孵育期后,通过mtt测定评估细胞活力。如在图14中可见,发现游离拓扑替康的ic
50
为51
±
1nm,而2t-t脂质体的ic
50
为263
±
430nm。
[0107]
为了评估负载2t-c前药的脂质体的细胞毒性,将hela细胞暴露于不同浓度的阿糖胞苷或负载2t-c(nh2附接)的脂质体中48小时。在48小时孵育期后,通过mtt测定评估细胞活力。如在图15中可见,发现游离阿糖胞苷的ic
50
为4.45
±
6.29μm,而2t-c脂质体的ic
50
为48.54
±
17.89μm。实施例13:体外超声
[0108]
通过以0.3rcf离心10分钟来纯化以0mol%和20mol%前药浓度产生微泡。分离上清液(微泡)和脂质体。将上清液在含有血清的培养基中孵育12小时,然后再次离心旋转。将hela细胞以120,000个细胞/孔接种到6孔板的盖玻片上。观察到融合细胞后,将盖玻片安装到与2μl微泡:3ml培养基接触的细胞板室中。用另一个盖玻片密封该室,将其置于超声室内,并暴露于18个超声脉冲中。然后,立即用培养基将盖玻片洗涤3次,以去除多余的微泡。孵育20小时后,使用显微镜在明视场中对细胞板成像。未处理用作对照,将倒置的细胞板用于在没有超声暴露的情况下促进与负载0mol%和20mol%前药的微泡的接触。
[0109]
将前药掺入微泡中以使用超声进行集中药物释放。图16显示了负载前药的微泡的体外超声发递送。将微泡纯化,在血清中孵育,然后在测试前再次纯化。微泡未与血清解离。使用超声的局部微泡递送的体外细胞毒性验证了注入2t-n的微泡的局部和超声触发递送。将空微泡和负载前药的微泡与hela细胞接触用于无超声控制,以确认使用超声的局部化(图16,左栏)。空的和负载2t-p的微泡与超声处理的细胞在超声暴露和超声未暴露的区域保持融合。负载2t-n的微泡与超声处理的细胞在超声暴露的区域减少,但在超声未暴露的区域保持融合。实施例14:酶法测定
[0110]
使用分光荧光光度计定性地测量酶促裂解。将猪肝酯酶在1x pbs中从浓缩的原液中稀释至1.2x10-7
m,并在-20℃下储存。在时间零点,将100μl的空脂质体或pll置于100μl的比色皿中,并加入5μl的酯酶。立即在荧光分光光度计中测量溶液。在60分钟时再次测量样品。使用以下参数:介质扫描速度,2秒响应时间,1nm采样间隔,3nm激发狭缝宽度,20nm发射狭缝宽度,高灵敏度,250nm的激发波长和280nm-600nm的发射范围。
[0111]
图17显示了在有和没有用猪肝酯酶处理的情况下,负载2t-n的脂质体在不同时间点的荧光光谱。表5显示了酯酶处理后空脂质体和2t-n脂质体的尺寸变化。图18显示了在有和没有用猪肝酯酶处理的情况下,空脂质体在不同时间点的荧光光谱。图19显示了在有和没有用猪肝酯酶处理的情况下,pbs溶液在不同时间点的荧光光谱。表5表5实施方案
[0112]
以下非限制性实施方案提供了本发明的说明性实例,但不限制本发明的范围。
[0113]
实施方案1.一种基于脂质的载体,其包含:a)表面层,其中所述表面层包含前药,其中所述前药包含与磷脂共价缀合的治疗剂;和b)核,其中所述表面层围绕所述核。
[0114]
实施方案2.根据实施方案1所述的基于脂质的载体,其中所述基于脂质的载体是微泡。
[0115]
实施方案3.根据实施方案1或2所述的基于脂质的载体,其中所述表面层是脂质单
层。
[0116]
实施方案4.根据实施方案1-3中任一项所述的基于脂质的载体,其中所述核是气体。
[0117]
实施方案5.根据实施方案4所述的基于脂质的载体,其中所述气体是六氟化硫(sf6)。
[0118]
实施方案6.根据实施方案1或3所述的基于脂质的载体,其中所述核是固体。
[0119]
实施方案7.根据实施方案6所述的基于脂质的载体,其中所述固体是金属。
[0120]
实施方案8.根据实施方案6所述的基于脂质的载体,其中所述固体是半导体。
[0121]
实施方案9.根据实施方案1或3所述的基于脂质的载体,其中所述核是液体。
[0122]
实施方案10.根据实施方案1-3中任一项所述的基于脂质的载体,其中所述核是有机材料。
[0123]
实施方案11.根据实施方案1-3中任一项所述的基于脂质的载体,其中所述核是无机材料。
[0124]
实施方案12.根据实施方案1或3所述的基于脂质的载体,其中所述核是水溶液。
[0125]
实施方案13.根据实施方案1或4-12中任一项所述的基于脂质的载体,其中所述基于脂质的载体是脂质体。
[0126]
实施方案14.根据实施方案1、2或4-13中任一项所述的基于脂质的载体,其中所述表面层是脂质双层。
[0127]
实施方案15.根据实施方案1-14中任一项所述的基于脂质的载体,其中所述基于脂质的载体具有约70nm至约900nm的直径。
[0128]
实施方案16.根据实施方案1-15中任一项所述的基于脂质的载体,其中所述前药以约1mol%至约100mol%的量存在。
[0129]
实施方案17.根据实施方案1-16中任一项所述的基于脂质的载体,其中所述磷脂是双尾磷脂。
[0130]
实施方案18.根据实施方案1-17中任一项所述的基于脂质的载体,其中所述磷脂包含疏水尾,所述疏水尾包含约10个碳原子至约24个碳原子。
[0131]
实施方案19.根据实施方案1-18中任一项所述的基于脂质的载体,其中所述磷脂包含疏水尾,所述疏水尾包含约16个碳原子。
[0132]
实施方案20.根据实施方案1-19中任一项所述的基于脂质的载体,其中所述治疗剂是抗癌剂。
[0133]
实施方案21.根据实施方案20所述的基于脂质的载体,其中所述抗癌剂是拓扑替康。
[0134]
实施方案22.根据实施方案20所述的基于脂质的载体,其中所述抗癌剂是阿糖胞苷。
[0135]
实施方案23.根据实施方案1-19中任一项所述的基于脂质的载体,其中所述治疗
剂是下式的化合物:
[0136]
实施方案24.根据实施方案1-19中任一项所述的基于脂质的载体,其中所述治疗剂是下式的化合物:
[0137]
实施方案25.根据实施方案1-19中任一项所述的基于脂质的载体,其中所述治疗剂是抗病毒剂。
[0138]
实施方案26.根据实施方案1-19中任一项所述的基于脂质的载体,其中所述治疗剂是抗菌剂。
[0139]
实施方案27.根据实施方案1-19中任一项所述的基于脂质的载体,其中所述治疗剂是神经递质。
[0140]
实施方案28.根据实施方案1-19中任一项所述的基于脂质的载体,其中所述治疗剂是蛋白质。
[0141]
实施方案29.根据实施方案1-19中任一项所述的基于脂质的载体,其中所述治疗剂是生物制剂。
[0142]
实施方案30.根据实施方案1-19中任一项所述的基于脂质的载体,其中所述治疗剂是吉西他滨。
[0143]
实施方案31.根据实施方案1-19中任一项所述的基于脂质的载体,其中所述治疗剂是螯合剂。
[0144]
实施方案32.根据实施方案1-31中任一项所述的基于脂质的载体,其中所述表面层还包含dppc。
[0145]
实施方案33.根据实施方案1-32中任一项所述的基于脂质的载体,其中所述表面层还包含dppa。
[0146]
实施方案34.根据实施方案1-33中任一项所述的基于脂质的载体,其中所述表面层还包含dspe-peg2000。
[0147]
实施方案35.根据实施方案1-34中任一项所述的基于脂质的载体,其中所述表面层还包含dspe-peg5000。
[0148]
实施方案36.根据实施方案1-35中任一项所述的基于脂质的载体,其中所述磷脂是激活的磷脂。
[0149]
实施方案37.根据实施方案36所述的基于脂质的载体,其中所述激活的磷脂是glu-磷脂。
[0150]
实施方案38.根据实施方案36所述的基于脂质的载体,其中所述激活的磷脂是nhs-磷脂。
[0151]
实施方案39.根据实施方案36所述的基于脂质的载体,其中所述激活的磷脂是
pdp-磷脂。
[0152]
实施方案40.根据实施方案36所述的基于脂质的载体,其中所述激活的磷脂是mal-磷脂。
[0153]
实施方案41.根据实施方案36所述的基于脂质的载体,其中所述激活的磷脂是nbd-磷脂。
[0154]
实施方案42.根据实施方案37所述的基于脂质的载体,其中所述glu-磷脂是dppe-glu。
[0155]
实施方案43.根据实施方案1-42中任一项所述的基于脂质的载体,其中所述治疗剂通过酯键共价缀合至所述磷脂。
[0156]
实施方案44.根据实施方案1-42中任一项所述的基于脂质的载体,其中所述治疗剂通过酰胺键共价缀合至所述磷脂。
[0157]
实施方案45.一种治疗病症的方法,所述方法包括向有需要的受试者施用治疗有效量的所述基于脂质的载体,所述基于脂质的载体包含:a)表面层,其中所述表面层包含前药,其中所述前药包含与磷脂共价缀合的治疗剂;和b)核,其中所述表面层围绕所述核。
[0158]
实施方案46.根据实施方案45所述的方法,其中所述基于脂质的载体是微泡。
[0159]
实施方案47.根据实施方案45或46所述的方法,其中所述表面层是脂质单层。
[0160]
实施方案48.根据实施方案45-47中任一项所述的方法,其中所述核是气体。
[0161]
实施方案49.根据实施方案48所述的方法,其中所述气体是六氟化硫(sf6)。
[0162]
实施方案50.根据实施方案45或47所述的方法,其中所述核是固体。
[0163]
实施方案51.根据实施方案50所述的方法,其中所述固体是金属。
[0164]
实施方案52.根据实施方案50所述的方法,其中所述固体是半导体。
[0165]
实施方案53.根据实施方案45或47所述的方法,其中所述核是液体。
[0166]
实施方案54.根据实施方案45-47中任一项所述的方法,其中所述核是有机材料。
[0167]
实施方案55.根据实施方案45-47中任一项所述的方法,其中所述核是无机材料。
[0168]
实施方案56.根据实施方案45或47所述的方法,其中所述核是水溶液。
[0169]
实施方案57.根据实施方案45或48-56中任一项所述的方法,其中所述基于脂质的载体是脂质体。
[0170]
实施方案58.根据实施方案45、46或48-57中任一项所述的方法,其中所述表面层是脂质双层。
[0171]
实施方案59.根据实施方案45-58中任一项所述的方法,其中所述基于脂质的载体具有约70nm至约900nm的直径。
[0172]
实施方案60.根据实施方案45-59中任一项所述的方法,其中所述前药以约1mol%至约100mol%的量存在。
[0173]
实施方案61.根据实施方案45-60中任一项所述的方法,其中所述磷脂是双尾磷脂。
[0174]
实施方案62.根据实施方案45-61中任一项所述的方法,其中所述磷脂包含疏水尾,所述疏水尾包含约10个碳原子至约24个碳原子。
[0175]
实施方案63.根据实施方案45-62中任一项所述的方法,其中所述磷脂包含疏水尾,所述疏水尾包含约16个碳原子。
[0176]
实施方案64.根据实施方案45-63中任一项所述的方法,其中所述治疗剂是抗癌剂。
[0177]
实施方案65.根据实施方案64所述的方法,其中所述抗癌剂是拓扑替康。
[0178]
实施方案66.根据实施方案64所述的方法,其中所述抗癌剂是阿糖胞苷。
[0179]
实施方案67.根据实施方案45-63中任一项所述的方法,其中所述治疗剂是下式的化合物:
[0180]
实施方案68.根据实施方案45-63中任一项所述的方法,其中所述治疗剂是下式的化合物:
[0181]
实施方案69.根据实施方案45-63中任一项所述的方法,其中所述治疗剂是抗病毒剂。
[0182]
实施方案70.根据实施方案45-63中任一项所述的方法,其中所述治疗剂是抗菌剂。
[0183]
实施方案71.根据实施方案45-63中任一项所述的方法,其中所述治疗剂是神经递质。
[0184]
实施方案72.根据实施方案45-63中任一项所述的方法,其中所述治疗剂是蛋白质。
[0185]
实施方案73.根据实施方案45-63中任一项所述的方法,其中所述治疗剂是生物制剂。
[0186]
实施方案74.根据实施方案45-63中任一项所述的方法,其中所述治疗剂是吉西他滨。
[0187]
实施方案75.根据实施方案45-63中任一项所述的方法,其中所述治疗剂是螯合剂。
[0188]
实施方案76.根据实施方案45-75中任一项所述的方法,其中所述表面层还包含dppc。
[0189]
实施方案77.根据实施方案45-76中任一项所述的方法,其中所述表面层还包含dppa。
[0190]
实施方案78.根据实施方案45-77中任一项所述的方法,其中所述表面层还包含dspe-peg2000。
[0191]
实施方案79.根据实施方案45-78中任一项所述的方法,其中所述表面层还包含dspe-peg5000。
[0192]
实施方案80.根据实施方案45-79中任一项所述的方法,其中所述磷脂是激活的磷脂。
[0193]
实施方案81.根据实施方案80所述的方法,其中所述激活的磷脂是glu-磷脂。
[0194]
实施方案82.根据实施方案80所述的方法,其中所述激活的磷脂是nhs-磷脂。
[0195]
实施方案83.根据实施方案80所述的方法,其中所述激活的磷脂是pdp-磷脂。
[0196]
实施方案84.根据实施方案80所述的方法,其中所述激活的磷脂是mal-磷脂。
[0197]
实施方案85.根据实施方案80所述的方法,其中所述激活的磷脂是nbd-磷脂。
[0198]
实施方案86.根据实施方案81所述的方法,其中所述glu-磷脂是dppe-glu。
[0199]
实施方案87.根据实施方案45-86中任一项所述的方法,其中所述治疗剂通过酯键共价缀合至所述磷脂。
[0200]
实施方案88.根据实施方案45-86中任一项所述的方法,其中所述治疗剂通过酰胺键共价缀合至所述磷脂。
[0201]
实施方案89.根据实施方案45-89中任一项所述的方法,其还包括将体外触发物施加至所述受试者。
[0202]
实施方案90.根据实施方案89所述的方法,其中所述体外触发物是超声频率。
[0203]
实施方案91.根据实施方案90所述的方法,其中所述超声频率为约1mhz至约20mhz。
[0204]
实施方案92.根据实施方案89所述的方法,其中所述体外触发物是光。
[0205]
实施方案93.根据实施方案92所述的方法,其中所述光具有约400nm至约1400nm的波长。
[0206]
实施方案94.根据实施方案89所述的方法,其中所述体外触发物是电场。
[0207]
实施方案95.根据实施方案89所述的方法,其中所述体外触发物是磁场。
[0208]
实施方案96.根据实施方案95所述的方法,其中所述磁场具有约0.2t至约7t的强度。
[0209]
实施方案97.根据实施方案89-96中任一项所述的方法,其中所述体外触发物以脉冲施加。
[0210]
实施方案98.根据实施方案45-97中任一项所述的方法,其中所述施用是静脉内的。
[0211]
实施方案99.根据实施方案45-97中任一项所述的方法,其中所述施用是瘤内的。
[0212]
实施方案100.根据实施方案45-97中任一项所述的方法,其中所述施用是皮下的。
[0213]
实施方案101.根据实施方案45-97中任一项所述的方法,其中所述施用是动脉内的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1