一种能保护芦荟活性成分且可作为药物载体的芦荟外泌体样囊泡的制作方法
本发明涉及植物外泌体样囊泡分离提取及药物传递载体研究技术领域,更具体地,涉及含有活性药物成分的芦荟皮层及芦荟凝胶层外泌体样囊泡的提取,及该外泌体样囊泡作为药物载体的可行性研究。
背景技术:
1.外泌体,是一种细胞主动分泌的纳米级囊泡,携带许多来源于亲代细胞的遗传信息,如核酸、蛋白质等,作为细胞间长距离通讯的重要介质,参与多种生物过程。同时,其磷脂双分子层结构对内部有效成分具有一定的保护作用,且易于修饰,在药物传递载体研究领域广受关注。
2.在植物中亦然,近来,逐渐有研究者从生姜,葡萄柚、铁皮石斛等植物中分离获得了外泌体样囊泡,研究表明,从植物中分离获得的植物外泌体样囊泡与哺乳动物外泌体一样富含脂质、蛋白、核酸等成分。同时,植物外泌体样囊泡含有植物本身的药理活性成分,如生姜外泌体样囊泡含有姜烯酚、姜辣素等活性成分,因此基于其有效成分在各种疾病治疗中的作用研究逐渐成为临床研究者的关注热点。
3.芦荟是一种传统的中药,具有悠久的药用历史,其药用价值在《本草汇言》、《本草经疏》等典籍中均有记载,芦荟中富含丰富的药理活性成分,如芦荟大黄素、芦荟苦素等,具有抗炎、抗菌等药理作用。目前,已有诸多研究从芦荟中分离获得芦荟大黄素等活性成分,然而,此蒽醌类成分由于含有酚羟基,往往易受温度等环境因素影响而发生结构变化,从而影响其药理活性。芦荟外泌体样囊泡具有与外泌体类似的双分子层结构,是一种天然的保护罩,能减少外界环境对其内在成分的影响。此外,芦荟中存在一种常见的植物甾醇——β-谷甾醇,其广泛存在于多种植物的细胞膜中,对磷脂脂肪酰基侧链的流动有明显抑制作用,可增强磷脂分子间的排序作用,具有显著的脂质抗氧化和稳定膜结构的性能。芦荟外泌体样囊泡由芦荟中各部分细胞分泌,可携带芦荟细胞膜中的β-谷甾醇,使其磷脂双分子层结构更加稳定,更有利于维持其内部有效成分的生物和药理活性。
4.尽管外泌体在药物传递载体研究中潜力巨大,但哺乳外泌体的分离始终存在成本高、耗时、产量低等问题,大大限制了其在药物传递载体研究领域的应用。芦荟外泌体样囊泡具有与外泌体相近的生物学特性,同时具有制备简易,成本低,产量可观等优势,可能成为一种良好的外泌体的替代物,在药物载体研究领域中发挥作用。
技术实现要素:
本发明的目的是提供一种能保护芦荟活性成分且可作为药物载体的芦荟外泌体样囊泡。
1)本发明涉及从芦荟皮层及凝胶中分离获得外泌体样囊泡,所得的外泌体样囊泡同时含有芦荟大黄素、芦荟苦素等有效芦荟活性成分,且含有能增强脂质抗氧化性及稳定性的β-谷甾醇,对内部有效成分具有显著的保护作用,可在较长时间内维持药理活性成分的稳定性;
2)本发明从芦荟皮层及芦荟凝胶两种部位分离获得的外泌体样囊泡在活性成分,蛋白分布等性质上具有一定差异;
3)本发明所得的芦荟外泌体样囊泡装载抗癌药物后,与游离的药物相比,对乳腺癌细胞具有更为显著的杀伤作用。
4)本发明所得的芦荟外泌体样囊泡能穿透皮肤角质层,与游离染料相比,包载染料的芦荟外泌体样囊泡对皮肤具有更好的渗透效果。
解决技术方案
为实现上述发明目的,本发明提供了以下技术方案:
步骤a.芦荟皮及芦荟凝胶汁液:
分别称取新鲜芦荟皮及芦荟凝胶100g,洗净,切成小片,加入50g制备好的pbs冰块,以及400ml预冷的pbs,放入榨汁机中搅碎,每30s暂停一次,间隔10s,共计240s。获得新鲜的芦荟皮及芦荟凝胶汁液,经纱布过滤后,置于4℃,备用;
步骤b.制备芦荟皮及芦荟凝胶外泌体样囊泡:
将新鲜的芦荟皮和芦荟凝胶汁液,以300×g离心10min,弃去沉淀,获得上清液a1、a2;接着将上清液a1、a2以1000×g离心10min,获得上清液b1、b2;上清液b1、b2以3000×g离心20min,获得上清液c1、c2;再将上清液c1、c2以11000×g离心40min,获得上清液d1、d2,最后上清液d1、d2经0.22μm滤膜过滤后,以50000×g离心90min,获得沉淀e1、e2,以适量pbs重悬沉淀e1、e2获得混悬液f1、f2,混悬液f1、f2以50000×g离心90min,获得沉淀g1、g2,以pbs重悬,分别获得芦荟皮层及芦荟凝胶外泌体样囊泡。
作为优选,最终获得的芦荟外泌体样囊泡沉淀,以1xpbs缓冲溶液(含25mm海藻糖、1.5μg/ml蛋白酶抑制剂)重悬,获得分散性良好的芦荟外泌体样囊泡,同时保护外泌体样囊泡的膜表面蛋白,减少低温冷冻条件对外泌体样囊泡的影响。
进一步地,制备得的芦荟皮层及芦荟凝胶外泌体样囊泡用适量甲醇重悬,超声溶解后,离心留取上清液,经过滤后,4℃保存,以待进行内部芦荟活性成分的分析。
作为优选,为准确检测芦荟外泌体样囊泡内各活性成分的含量,以外泌体样囊泡总蛋白量为定量标准,固定各成分鉴定时的蛋白总量。取相应量的芦荟外泌体样囊泡溶液经4℃,50000×g离心获得沉淀,以1ml色谱级甲醇溶液重悬沉淀,而后超声20min,使有效成分充分溶解于甲醇中,再以11000×g离心10min,留取上清,经0.22μm有机相滤膜过滤后,用封口膜封住瓶口,置于4℃保存待用。
作为优选,芦荟大黄素、芦荟苦素及β-谷甾醇在高效液相色谱分析时,流动相条件分别为乙腈-水(50:50)、乙腈-水(14:76)以及甲醇-水(85:15),柱温为30℃,检测波长分别为254nm、254nm、205nm。
进一步地,通过高效液相色谱法分析不同时间段分离获得的芦荟外泌体样囊泡中的芦荟大黄素含量,验证芦荟大黄素在芦荟外泌体样囊泡中的稳定性。
作为优选,所用的芦荟外泌体样囊泡,分别为提取后置于-80℃保存0、30、60、90、120、180天后的外泌体样囊泡。
进一步地,所获得的的芦荟皮层及芦荟凝胶外泌体样囊泡经sds-page凝胶电泳分析表征,观察二者的蛋白分布情况。
作为优选,所配置的sds-page凝胶浓度为10%,30μl不同浓度的芦荟皮层及芦荟凝胶外泌体样囊泡中加入6μl5x蛋白上样缓冲液,充分涡旋后,于金属浴中95℃反应10min,同时通过调整两种外泌体样囊泡的上样体积,使得不同蛋白浓度的外泌体样囊泡的最终上样保持一致。
进一步地,通过荧光染料染色法,分别采用蓝色细胞核荧光染料(dapi)、绿色细胞膜荧光染料(dio)、红色细胞膜荧光染料(dii),对鼠乳腺癌4t1细胞的细胞核、细胞膜以及芦荟外泌体样囊泡进行染色,通过激光共聚焦显微镜成像,验证细胞对芦荟外泌体样囊泡的摄取情况。
作为优选,所采用的dapi、dio、dii染料浓度分别为10μg/ml、10μmol/ml、10μmol/ml,所有染液均配置于1xpbs中。芦荟外泌体样囊泡与dii染料充分混匀后,与室温下摇床振摇反应20min后,经50000×g,4℃离心90min,所得沉淀用1xpbs重悬后,于50000×g,4℃离心90min,再重复用pbs清洗一次,而后用完全细胞培养基重悬,4℃保存。
作为优选,细胞荧光染色步骤为:①从培养箱中取出预先培养于激光共聚焦培养皿中的细胞,吸弃培养液,用pbs清洗2次,加入400μldii/adns溶液,于37℃培养箱中孵育12h;②从培养箱中取出①中孵育结束的细胞培养皿,吸弃dii/adnss溶液,pbs清洗2次,加入400μl4%多聚甲醛溶液,继续培养20min后,吸弃多聚甲醛,pbs清洗2次后,加入400μldapi染液,放入细胞培养箱中孵育15min;③取出孵育后的细胞培养皿,吸弃dapi染液,pbs清洗2次后,加入400μldio染液,放入细胞培养箱中孵育15min后取出,吸弃dio染液,pbs清洗2次后,置于激光共聚焦显微镜下观察。
进一步地,经mtt法验证芦荟外泌体样囊泡对肿瘤细胞的细胞毒性,同时采用孵育法将阿霉素(dox)载入芦荟外泌体样囊泡中,与相应浓度的游离阿霉素溶液分别作用于肿瘤细胞,观察其对细胞的杀伤作用。
作为优选,阿霉素的装载入芦荟外泌体样囊泡的步骤如下:取0.5mg芦荟外泌体样囊泡溶于1ml,200μg/ml阿霉素-pbs溶液中,充分混匀,400rpm,37℃孵育30min,而后经50000×g,4℃离心90min,所得沉淀用1xpbs重悬后,于50000×g,4℃离心90min,再重复用pbs清洗至上清呈无色,而后用1mlpbs缓冲溶液重悬,即为装载阿霉素的芦荟外泌体样囊泡(dox/adns)溶液置于4℃保存。
作为优选,选用鼠乳腺癌4t1细胞为研究对象,细胞经胰蛋白酶消化后,于4℃,1000rpm离心10min弃去上清,沉淀重悬于rpmi-1640完全细胞培养基中,经计数后,配制成5万个/ml的细胞悬液,在96孔板中加入200μl/孔的细胞悬液,置于37℃,5%co2的细胞培养箱中培养,待细胞贴壁后,将dox/and溶液的给药浓度设置为0、0.5、0.8、1、3、5、8、10μg/ml(此处浓度为包载入and中的dox浓度),各浓度设置5个副孔,200μl/孔,置于细胞培养箱中培养24h。选用1xpbs配制5mg/ml的mtt溶液,经0.22μm微孔滤膜过滤后,从培养箱中取出96孔板,吸弃药物溶液,pbs清洗2次后,加入mtt溶液,20μl/孔,置于细胞培养箱中反应4h后,吸弃mtt溶液,加入150μl的二甲基亚砜(dmso),置于摇床上,以800rpm,震摇10min后,用酶标仪测定其在490nm处的吸光度。
本发明的有益效果
与现有技术相比,本发明优点在于:1)本发明从芦荟皮及芦荟凝胶中分离出外泌体样囊泡的制备方法操作简便,材料价格低廉易得,且选用含1.5μg/ml蛋白酶抑制剂、25mm海藻糖的1xpbs缓冲溶液重悬的外泌体样囊泡具有良好的分散性;2)本发明所制备的芦荟皮层及凝胶层外泌体样囊泡均含有芦荟大黄素、芦荟苦素等药理活性成分,以及具有稳定脂质结构和抗氧化性β-谷甾醇,使得芦荟大黄素等有效成分能在较长时间内维持稳定;3)该芦荟外泌体样囊泡能作为药物载体,可用于装载抗癌药物实现对肿瘤细胞的有效杀伤;4)本发明所得的芦荟外泌体样囊泡能穿透皮肤角质层,对护肤品、皮肤病甚至皮肤癌的治疗研究领域具有重要意义。
附图说明
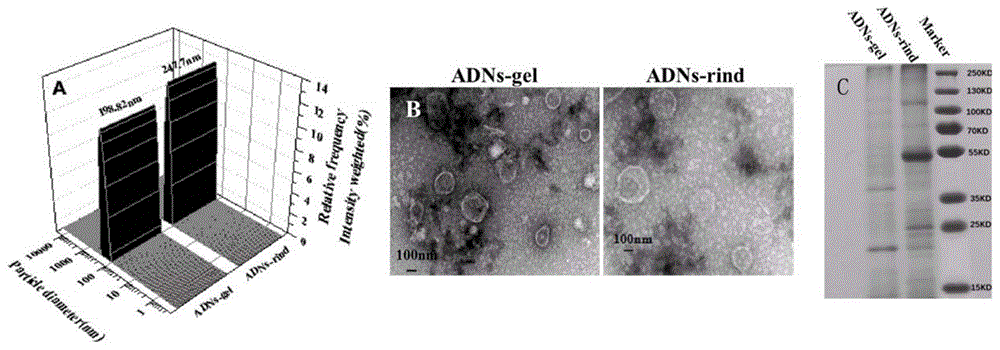
图1为实施例1分离获得的两种芦荟外泌体样囊泡的表征结果图。图中:a.动态光散射表征外泌体样囊泡的粒径分布;b.透射电子显微镜下外泌体样囊泡的形貌;c.sds-page凝胶电泳下芦荟皮层及凝胶层外泌体样囊泡的蛋白分布情况;
图2为实施例2中芦荟外泌体样囊泡中药理活性成分的高效液相色谱分析图。图中:a.芦荟外泌体样囊泡内的芦荟大黄素高效液相分析图;b.芦荟外泌体样囊泡内的芦荟苦素高效液相分析图;c.芦荟外泌体样囊泡内β-谷甾醇的高效液相分析图;d.不同时间段芦荟外泌体样囊泡内芦荟大黄素的含量分析图。
图3为实施例3提供的芦荟外泌体样囊泡进入细胞的荧光染色激光共聚焦成像图;a.dapi染料对4t1细胞的细胞核成像图;b.dio染料对4t1细胞的细胞膜成像图;c.4t1细胞对dii/adns的摄取情况成像图;d.明场及其他激光通道下4t1细胞形态成像图。
图4为实施例4中芦荟外泌体样囊泡作为药物载体用于肿瘤细胞杀伤的结果对比图。
图5为实施例5中激光共聚焦显微镜表征芦荟外泌体样囊泡对小鼠皮肤的渗透情况图。a.包载绿色荧光染料dio的芦荟外泌体样囊泡在鼠皮内的渗透情况;b.游离绿色荧光染料dio在鼠皮内的渗透情况。
具体实施方式
为详细说明本发明的技术内容、表征及性能分析方法,以下将结合附图对本发明的实施方式详予说明。
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用的试剂可以商业购买得到。
实施例1:
本发明的实施例1提供了一种从芦荟皮层及芦荟凝胶中分离外泌体样囊泡的制备方法,其制备步骤如下:
步骤a.制备新鲜芦荟皮及芦荟凝胶汁液:
取新鲜芦荟皮100g,洗净,切成小片,加入50g制备好的pbs冰块,以及400ml冰pbs,放入榨汁机中榨汁,每30s暂停一次,间隔10s,共计240s。获得新鲜的芦荟皮及芦荟凝胶汁液,经纱布过滤后,置于4℃,备用;
步骤b.制备芦荟皮及芦荟凝胶外泌体样囊泡:
将新鲜的芦荟皮和芦荟凝胶汁液,各以300×g离心10min,弃去沉淀,获得上清液a1、a2;接着将上清液a1、a2以1000×g离心10min,获得上清液b1、b2;上清液b1、b2以3000×g离心20min,获得上清液c1、c2;再将上清液c1、c2以11000×g离心40min,获得上清液d1、d2,最后上清液d1、d2经0.22μm滤膜过滤后,以50000×g离心90min,获得沉淀e1、e2,以适量pbs重悬沉淀e1、e2获得混悬液f1、f2,混悬液f1、f2以50000×g离心90min,获得沉淀g1、g2,以pbs重悬,分别获得芦荟皮层及芦荟凝胶外泌体样囊泡。如图1所示,a.动态光散射表征外泌体样囊泡的粒径分布;b.透射电子显微镜下外泌体样囊泡的形貌;c.sds-page凝胶电泳下芦荟皮层及凝胶层外泌体样囊泡的蛋白分布情况。
实施例2:
利用高效液相色谱法对实施例1制得的芦荟皮层及芦荟凝胶外泌体样囊泡中的活性成分进行分析的过程如下:
芦荟皮层及芦荟凝胶外泌体样囊泡分别经bca蛋白定量法测定蛋白含量后,根据两种外泌体样囊泡的实际蛋白浓度,取相应体积的外泌体样囊泡溶液,使其总蛋白质量为1mg,在4℃,50000×g条件下离心90min获得外泌体样囊泡沉淀,以1ml色谱级甲醇溶液重悬沉淀,超声20min,使有效成分充分溶解于甲醇中,再以11000×g离心10min,留取上清,经0.22μm滤膜过滤后用封口膜封住瓶口,置于4℃保存待用。
分别以流动相为乙腈-水(1:1),乙腈-水(14:86),流速为1ml/min,柱温为30℃的条件,对芦荟大黄素、芦荟苦素的标准品以及芦荟外泌体样囊泡进行分析,所获得的分析结果如图2所示,经芦荟皮层外泌体样囊泡中的芦荟大黄素含量为2.209g/kg,芦荟苦素含量为0.658g/kg,β-谷甾醇含量为100.7g/kg,芦荟凝胶层外泌体样囊泡中芦荟大黄素含量为0.187g/kg,芦荟苦素含量为0.631g/kg,β-谷甾醇含量为275.56g/kg。(此处单位g/kg为m活性药物成分/m外泌体样囊泡蛋白量)。如图2所示,a.芦荟外泌体样囊泡内的芦荟大黄素高效液相分析图;b.芦荟外泌体样囊泡内的芦荟苦素高效液相分析图;c.芦荟外泌体样囊泡内β-谷甾醇的高效液相分析图;d.不同时间段芦荟外泌体样囊泡内芦荟大黄素的含量分析图。
实施例3:
利用荧光染色法和激光共聚焦成像技术验证肿瘤细胞对实施例1中获得的芦荟外泌体样囊泡(adns)的摄取情况。鼠乳腺癌细胞株购买自中科院生化细胞所细胞库,培养于含10%胎牛血清(haikelong)的rpmi-1640(haikelong)培养液中,置于37℃,5%co2细胞培养箱中培养。通过荧光染料染色法,分别采用dapi、dio、dii对鼠乳腺癌4t1细胞的细胞核、细胞膜以及adns进行染色,通过激光共聚焦显微镜成像,验证细胞对芦荟外泌体样囊泡的摄取情况。具体过程如下:
a)选用1xpbs分别配制dapi、dio、dii染液,浓度分别为10μg/ml、10μmol/ml、10μmol/ml。取1mgadns与dii染料充分混匀后,于37℃,400rpm孵育30min后,经50000×g,4℃离心90min,所得沉淀用1xpbs重悬后,于50000×g,4℃离心90min,再重复用pbs清洗至上清无颜色,而后用完全细胞培养基重悬,制成dii/ands溶液,4℃保存。
b)细胞荧光染色步骤为:①从培养箱中取出预先培养于激光共聚焦培养皿中的细胞,吸弃培养液,用pbs清洗2次,加入400μldii/adns溶液,于37℃培养箱中孵育12h;②从培养箱中取出①中孵育结束的细胞培养皿,吸弃dii/adnss溶液,pbs清洗2次,加入400μl4%多聚甲醛溶液,继续培养20min后,吸弃多聚甲醛,pbs清洗2次后,加入400μldapi染液,放入细胞培养箱中孵育15min;③取出孵育后的细胞培养皿,吸弃dapi染液,pbs清洗2次后,加入400μldio染液,放入细胞培养箱中孵育15min后取出,吸弃dio染液,pbs清洗2次后,置于激光共聚焦显微镜下观察。图3为实施例3提供的芦荟外泌体样囊泡进入细胞的荧光染色激光共聚焦成像图。a.dapi染料对4t1细胞的细胞核成像图;b.dio染料对4t1细胞的细胞膜成像图;c.4t1细胞对dii/adns的摄取情况成像图;d.明场及其他激光通道下4t1细胞形态成像图。
实施例4:
利用mtt法分别验证adns、dox、dox/ands对4t1的细胞毒性。具体步骤如下:
a)细胞种板:4t1细胞经胰蛋白酶消化后,于4℃,1000rpm离心10min弃去上清,沉淀重悬于rpmi-1640完全细胞培养基中,经计数后,配制成5万个/ml的细胞悬液,在96孔板中加入200μl/孔的细胞悬液,置于37℃,5%co2的细胞培养箱中培养。
b)给药:分别设置ands、dox、dox/ands三个实验组,各组设置不同浓度梯度。其中adns浓度分别为:0、3、4.8、6、18、48、60μg/ml,游离的dox以及dox/and溶液的给药浓度为0、0.5、0.8、1、3、5、8、10μg/ml(此处浓度为包载入ands中的dox浓度),各浓度设置5个副孔,200μl/孔,置于细胞培养箱中培养24h。
c)mtt:将96孔板从细胞培养箱中取出,于超净台中吸弃药物溶液,pbs清洗两遍后,每孔加入经0.22μm微孔滤膜过滤的mtt溶液(5mg/ml,20μl),置于细胞培养箱中反应4h后,吸弃mtt溶液,加入150μl的二甲基亚砜(dmso),置于摇床上800rpm,震摇10min后,用酶标仪测定其在490nm处的吸光度。图4为实施例4中芦荟外泌体样囊泡作为药物载体用于肿瘤细胞杀伤的结果对比图。
实施例5:
利用荧光染色法和激光共聚焦成像技术验证实施例1中获得的芦荟外泌体样囊泡(adns)对小鼠皮肤的渗透情况。具体步骤如下:
a)取1mg的adns与1mldio染液(30μmol/l)充分混匀后,于37℃,400rpm孵育30min后,经50000×g,4℃离心90min,所得沉淀用1xpbs重悬后,于50000×g,4℃离心90min,再重复用pbs清洗至上清无颜色,而后用1mlpbs缓冲溶液重悬,使沉淀充分分散,制成dio/ands溶液,4℃保存。
小鼠经4%水合氯醛(10μl/g)麻醉后,以9%na2s溶液作脱毛剂脱去小鼠背部毛发,过程中以清水间断清洗,以减少对皮肤的损伤,充分脱毛后,以清水多次清洗,去除皮肤上残余的na2s溶液,1h后固定小鼠,分别于鼠皮上滴涂dio/ands及游离的dio溶液,经1.5h的渗透后,以脊椎脱臼法处死小鼠,取下滴涂部位的皮肤,于激光共聚焦显微镜下扫描二者的渗透情况。如图5所示,a.包载绿色荧光染料dio的芦荟外泌体样囊泡在鼠皮内的渗透情况;b.游离绿色荧光染料dio在鼠皮内的渗透情况。
- 还没有人留言评论。精彩留言会获得点赞!