一种基于斑马鱼炎症性肠病模型筛选药效物质的方法与流程
[0001]
本发明涉及药物筛选与评价技术领域,具体涉及一种基于斑马鱼炎症性肠病模型筛选或评价药效物质的方法。
背景技术:
[0002]
炎症性肠病(ibd)是表现为慢性或复发的免疫反应和炎症症状的胃肠道疾病的总称,包括溃疡性结肠炎(uc)和克罗恩病(cd),目前无法治愈。临床治疗用药主要包括氨基水杨酸类、皮质类固醇类、免疫抑制剂、生物制剂等,但由于炎症性肠病复杂的发病机制和病因学,现有临床药物存在治疗效果不佳及价格昂贵等缺点。
[0003]
在炎症性肠病的临床治疗中,中药发挥整体调节和综合治疗的优势,具有抗炎、抗菌、抗肿瘤、免疫调节等多种生物活性及药理作用,能显著改善腹泻、腹痛、便血等肠炎症状,在临床患者的治疗当中起到缓解症状的效果,其多途径、多靶点、整体性的作用特点在炎症性肠病的治疗防治中独具优势。
[0004]
迄今为止,ibd中最完善的模型是小鼠模型,它作为一种有价值的动物模型,在肠道菌群、免疫反应、感染、遗传等方面对ibd的认识做出了很大的贡献。但是小鼠模型也存在一定的局限性,比如病理变化不能通过连续观察来确定、遗传操作困难、通量小、速度慢等。近几年来,斑马鱼由于其高产卵率和胚胎体外受精发育等优势,在药物筛选领域受到研究者们的青睐,如专利文献cn 108719145 a、cn106755099 a。斑马鱼与人类基因同源性约为80%,且其肠道早期发育与人类肠道发育过程高度相似,可以成为研究炎症性肠病及胃肠疾病的有利工具。
[0005]
荧光成像技术是利用激发光使得荧光基团达到较高的能量水平,然后发射出较长波长的光这一原理进行检测。目前常用的荧光基团有绿色荧光蛋白(gfp)、红色荧光蛋白(ds red)等。活体荧光成像技术可从整体上展示完整的自然状态下的生物,与其他的活体内成像技术相比,荧光成像技术有着敏感度高、安全易操作、结果直观、数据真实可靠、费用低廉等优点,已被广泛应用于生命科学、医学研究及药物开发等领域。
技术实现要素:
[0006]
本发明的目的是提供一种斑马鱼炎症性肠病模型,利用该模型结合成像技术和分子生物学技术用于筛选和评价天然产物以及化学合成药物中对炎症性肠病具有治疗作用的物质。
[0007]
为实现上述目的,本发明采用如下技术方案:
[0008]
一种基于斑马鱼炎症性肠病模型筛选药效物质的方法,包括以下步骤:
[0009]
(1)将待测物质加入到含有斑马鱼胚胎的孵育液a中进行预保护,再换液加入含有三硝基苯磺酸的孵育液b,继续孵育,得到给药模型;
[0010]
(2)利用与活性氧反应的荧光染料对给药模型的斑马鱼胚胎进行处理,荧光成像并分析斑马鱼胚胎肠道区域内的平均荧光强度,与未给药模型组的活性氧水平进行比较,
筛选具有统计学差异的物质作为目标物质。
[0011]
当斑马鱼模型的肠道发生炎症反应,其活性氧(ros)水平显著上升。利用对炎症性肠病具有治疗作用的物质对斑马鱼胚胎先进行预保护,再造模,相较于未进行预保护的模型组,其活性氧水平呈现下降趋势,因此,本申请通过检测活性氧水平的变化情况来判断待测物质是否对炎症性肠病具有治疗或预防作用,从而筛选出对炎症性肠病具有治疗作用的药效物质。
[0012]
本发明利用三硝基苯磺酸(tnbs)处理斑马鱼胚胎,成功构建斑马鱼炎症性肠病模型,具体处理条件为:收集孵育至3dpf且发育良好的胚胎,破膜后加入到含有50~100μg/ml的三硝基苯磺酸的孵育液中,28.5℃孵育至5~6dpf。在上述诱导条件下,斑马鱼胚胎肠道形态改变,肠道区域的ros水平显著升高。
[0013]
所述孵育液采用常见的斑马鱼胚胎培养基,如e3培养液(0.29g/l nacl,0.013g/l kcl,0.048g/l cacl
2
·
2h
2
o,0.082g/l mgcl
2
·
6h
2
o,ph 7.2)、hank
’
s培养液等。
[0014]
所述孵育液a为在斑马鱼胚胎培养基中加入破膜后的斑马鱼胚胎,待测药物的具体浓度根据药物毒性或经验而定。所述孵育液b为在斑马鱼胚胎培养基中加入三硝基苯磺酸。
[0015]
模型应用于药物筛选或评价时,先将待测物质与斑马鱼胚胎共孵育对其进行预保护,再将预保护的斑马鱼胚胎置于造模环境中造模。
[0016]
预保护的时间为12~36h。作为优选,预保护时间为24h。
[0017]
进一步地,步骤(1)中,孵育液a中的斑马鱼胚胎为受精后24~72h的胚胎,所述孵育液b中三硝基苯磺酸的浓度为50~100μg/ml,在孵育液b中孵育的时间为48~72h。
[0018]
作为优选,步骤(1)中,斑马鱼胚胎在含有75μg/ml三硝基苯磺酸的孵育液b中孵育48h。
[0019]
步骤(2)中,利用荧光染料对斑马鱼胚胎细胞内的活性氧进行染色,利用平均荧光强度表征活性氧水平。作为优选,所述荧光染料为2
’
,7
’-
二氢二氯荧光素二乙酸酯(dcfh-da)。该染料进入细胞内水解后被活性氧氧化生成荧光物质,绿色荧光强度与活性氧的水平呈正比。本发明还可以采用其他用于检测氧化自由基水平的荧光染料。
[0020]
进一步地,步骤(2)中,筛选平均荧光强度小于未给药模型组70%的物质为目标物质。
[0021]
进一步地,所述斑马鱼胚胎采用免疫细胞带有荧光标记的转基因斑马鱼系。当发生炎症性肠病时,斑马鱼胚胎表现出其肠道区域中性粒细胞聚集情况,该免疫细胞带有荧光标记,通过荧光成像技术计算斑马鱼胚胎肠道区域内中性粒细胞个数,可以直观地反映出利用药物预保护与未进行预保护之间的区别。
[0022]
本发明在检测ros水平指标的基础上,增加检测肠道中性粒细胞聚集情况,采用两个指标评价药效,使评价体系更完善和可信。具体地,步骤(2)中,还包括:利用荧光成像计算给药模型斑马鱼胚胎肠道区域内免疫细胞个数,与未给药模型组比较,筛选具有统计学差异的物质作为目标物质。
[0023]
作为优选,所述斑马鱼胚胎采用转基因斑马鱼系tg(lyz:dsred)或转基因斑马鱼系tg(lyz:egfp)。
[0024]
上述转基因斑马鱼系本身带有荧光标记,采用ros水平和肠道中性粒细胞聚集情
况双指标评价药效时,应使用呈现不同荧光颜色的荧光染料和转基因斑马鱼系,比如:荧光染料dcfh-da呈现绿色荧光,则选择dsred红色荧光标记中性粒细胞(lyz)的转基因斑马鱼系tg(lyz:dsred)。
[0025]
进一步地,根据肠道中性粒细胞聚集情况筛选药效物质的方法为:利用荧光成像计算给药模型斑马鱼胚胎肠道区域内中性粒细胞个数,再根据如下公式计算回调指数,筛选回调指数>0.6的物质为目标物质;
[0026]
x=(n
model-n
drug
)/(n
model-n
control
)
[0027]
其中x-回调指数,n
model-未给药模型组中性粒细胞个数,n
drug-给药模型组中性粒细胞个数,n
control-空白组中性粒细胞个数。
[0028]
本发明通过实时荧光定量pcr技术检测炎症因子的相对表达情况进一步验证了上述方法在评价待测药物药效方面的准确性。
[0029]
为保证检测数据的准确性,各实验组设置5~10个重复。荧光信号采集区域限于在鳔和血管之下,从心脏和肝脏之后开始,到尿生殖孔结束。
[0030]
鉴于斑马鱼的个体差异较大,每组数值将去掉最大值与最小值再进行分析。数据以平均值
±
标准差的形式呈现。使用graphpad prism进行数据分析。各组间的差异用t检验,p值小于0.05被认为具有统计学意义。
[0031]
进一步地,所述方法还包括:利用实时荧光定量pcr技术检测促炎因子il-1β的相对表达情况。
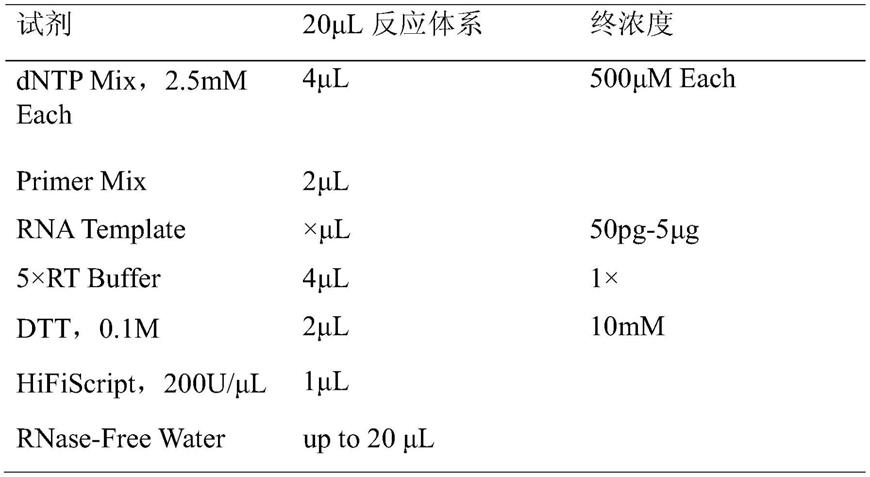
[0032]
本发明具备的有益效果:
[0033]
(1)本发明成功构建了斑马鱼炎症性肠病模型,利用显微成像技术显示表型变化,具体采用肠道中性粒细胞聚集情况和活性氧水平评价药物对炎症性肠病的治疗作用。本发明通过实时荧光定量pcr技术检测促炎因子il-1β的相对表达情况进一步验证了本发明方法在评价待测药物药效方面的准确性。与传统小鼠模型相比,本发明方法显著提高了筛选效率、缩短了筛选时间。
[0034]
(2)本发明设计合理,提供的筛选和评价系统效率高、结构完善,能够用于大规模天然产物库或组合化学库的筛选,而且设备简单经济,适合于在早期开展对于炎症性肠病治疗药物(包括化学合成药以及天然产物)的筛选和先导化合物的发现。
附图说明
[0035]
图1为本发明方法流程图。
[0036]
图2为斑马鱼tnbs诱导ibd模型中中性粒细胞分布变化,其中a为不同浓度tnbs中孵育2天后,中性粒细胞在肠道区域聚集情况,b为孵育3天后,中性粒细胞在肠道区域聚集情况,
*
p<0.05,vs control;c为斑马鱼空白组和tnbs造模后的代表性图片。
[0037]
图3为斑马鱼tnbs诱导ibd模型中ros水平变化,其中a为不同浓度tnbs孵育2天后以及5-asa给药后ros水平变化,b为孵育3天后ros水平变化,*p<0.05;**p<0.01,vs model;c为斑马鱼空白组和tnbs造模后的代表性图片。
[0038]
图4为斑马鱼肠道横截面切片。
[0039]
图5为5-氨基水杨酸对tnbs诱导的ibd模型的作用,其中a为肠道中性粒细胞数目变化,b为ros水平变化,*p<0.05,vs control;##p<0.01,vs model;c为斑马鱼空白组和
tnbs造模后及5-asa给药后的代表性图片,左图为中性粒细胞分布变化,右图为ros水平变化。
[0040]
图6为黄芩苷对tnbs诱导的ibd模型的作用,其中a为ros水平变化,b为斑马鱼空白组和tnbs造模后及黄芩苷给药后的代表性图片。
[0041]
图7为千层纸素a-7-o-b-葡萄糖醛酸苷对tnbs诱导的ibd模型的作用,其中a为肠道中性粒细胞数目变化,b为ros水平变化,**p<0.01,vs control;##p<0.01,vs model;c为斑马鱼空白组和tnbs造模后及千层纸素a-7-o-b-葡萄糖醛酸苷给药后的代表性图片,左图为中性粒细胞分布变化,右图为ros水平变化。
[0042]
图8为rt-qpcr检测ibd模型中以及给药后il-1β的相对表达情况,**p<0.01,vs control;#p<0.05,##p<0.01,vs model。
[0043]
图9为仲景方筛选结果。
具体实施方式
[0044]
下面结合附图和实施例对本发明作进一步的说明,但本发明并不局限于此。
[0045]
实施例中所用试剂:
[0046]
三硝基苯磺酸(tnbs)购自美仑生物;
[0047]
5-氨基水杨酸(5-asa)购自美仑生物;
[0048]
黄芩苷、千层纸素a-7-o-b-葡萄糖醛酸苷购自源叶生物;
[0049]
活性氧检测试剂盒购自美仑生物;
[0050]
二甲基亚砜(dmso)购自sigma公司;
[0051]
转录试剂盒、荧光定量pcr试剂盒购自康为uuzz。
[0052]
实施例所用仪器:
[0053]
zyla相机(andor公司)、imagexpress micro confocal high-content imaging system(molecular devices公司)。
[0054]
实施例1斑马鱼ibd模型构建
[0055]
1、本发明使用的斑马鱼系为dsred红色荧光标记的中性粒细胞(lyz)的转基因斑马鱼系tg(lyz:dsred)和gfp绿色荧光标记的中性粒细胞(lyz)的转基因斑马鱼系tg(lyz:egfp),经购买所得。
[0056]
收取胚胎之前一天,将雌雄成鱼放置于交配缸中,次日收集胚胎并清洗,去除发育不良的胚胎,将胚胎转移至含有亚甲基蓝的e3培养基(e3培养基:含有5mm的nacl、0.17mm的kcl、0.16mm的mgso
4
、0.4mm的cacl
2
)。在28.5℃恒温培养箱中培养一夜。次日除去发育不良的胚胎,将培养水换成含有2.5μm的1-苯基-2-硫脲(ptu)的e3培养液,继续在28.5℃恒温培养箱中孵育。在2dpf的时候,在显微镜下挑选出带有荧光的胚胎,继续在28.5℃中孵育至3dpf。
[0057]
将胚胎破膜后,加入24孔板中。设置空白组、模型组。空白组含有0.1%的dmso,模型组分别含有50、75、100μg/ml的tnbs和0.1%的dmso。每组8枚胚胎,孵育液体体积为1ml/孔。在28.5℃恒温培养箱中孵育。
[0058]
2、肠道中性粒细胞数目:在5和6dpf时,对胚胎进行侧面拍照,并计算肠道区域中性粒细胞个数。鉴于斑马鱼的个体差异较大,每组数值将去掉最大值与最小值再进行分析。
数据以平均值
±
标准差的形式呈现。使用graphpad prism进行数据分析。各组间的差异用t检验,p值小于0.05被认为具有统计学意义。
[0059]
如图2a所示,在75μg/ml tnbs中孵育2天后,中性粒细胞在肠道区域显著升高。在tnbs中孵育3天后,中性粒细胞在斑马鱼胚胎肠道聚集,所有浓度均有显著差异(图2b)。图2c展示了斑马鱼空白组和tnbs造模后的代表性图片。
[0060]
3、活性氧强度:在5和6dpf时,根据活性氧检测试剂盒说明,将胚胎浸泡于稀释了1000倍的2
’
,7
’-
二氢二氯荧光素二乙酸酯(dcfh-da)中30min。用e3培养液将染料洗3次。对胚胎侧面进行拍照,并分析平均荧光强度。荧光强度反应活性氧水平。数据以平均值
±
标准差的形式呈现。使用graphpad prism进行数据分析。各组间的差异用t检验,p值小于0.05被认为具有统计学意义。
[0061]
如图3所示,tnbs造模后引起了ros水平的升高,5-asa给药后,在造模2天后ros水平均显著下降,造模3天后降低效果不明显。图3c展示了斑马鱼空白组和tnbs造模后的代表性图片。
[0062]
4、肠道形态组织病理学检测:用4%多聚甲醛对斑马鱼胚胎常温固定过夜。之后进行梯度乙醇脱水,步骤依次是:60%乙醇浸泡0.5h,70%乙醇浸泡0.5h,80%乙醇浸泡0.5h,90%乙醇浸泡1h,95%乙醇浸泡1h,95%乙醇浸泡2h,无水乙醇浸泡40min,,无水乙醇浸泡过夜。将脱水后的斑马鱼进行透明处理,在60℃中浸泡二甲苯15min三次。将透明后的斑马鱼在二甲苯和加热的石蜡混合液中30min,再将斑马鱼置于纯蜡中过夜。将熔化的石蜡注入到包埋筐中,在石蜡凝固前,用镊子将斑马鱼摆成合适的姿势,使得斑马鱼最终处于包埋筐中间,静等石蜡冷却成型。将包埋完成后的石蜡块取出,修去多余的石蜡,用切片机进行切割,获得连续的蜡带。显微镜下观察样品并挑选合适位置的蜡片。按照标准流程进行脱蜡和伊红(he)染色,取斑马鱼躯干横切面染色。该过程由形态组织学平台负责完成。获得的切片在显微镜下进行拍摄。
[0063]
如图4所示,组织病理切片结果表明,空白组的肠粘膜向内折叠,形成肠绒毛,粘膜表面的柱状细胞排列整齐,细胞核成椭圆形,固有层完整,而造模组的肠绒毛基本已被破坏,固有层出现破损现象,伴细胞脱落等现象,提示在tnbs给药后,肠道形态发生改变。
[0064]
综上,模型采用tnbs 75μg/ml,造模2天为模型条件。
[0065]
实施例2 5-氨基水杨酸抗ibd活性研究
[0066]
待斑马鱼胚胎发育至2dpf,将胚胎破膜,加入24孔板中,每孔8枚胚胎,每孔含有1ml的液体,总共分为空白组、模型组、给药组。
[0067]
空白组:在3dpf加入0.1%的dmso;
[0068]
模型组:在3dpf加入75μg/ml的tnbs和0.1%的dmso;
[0069]
给药组:在2dpf时给药组预孵300μg/ml的5-氨基水杨酸24h。在3dpf时,给胚胎进行换液,加入75μg/ml的tnbs和0.1%的dmso。
[0070]
在5dpf的时候加入dcfh-da(1:1000)染色30min,对胚胎侧面进行拍照,并计算肠道区域中性粒细胞个数;分析dcfh-da染色平均荧光强度。
[0071]
如图5a所示,tnbs造模后,肠道中性粒细胞数目显著增加,而加入5-氨基水杨酸预保护可以显著降低肠道中性粒细胞数目,按照如下公式计算回调指数x,x=(n
model-n
drug
)/(n
model-n
control
),回调指数:1.214159。
[0072]
加入5-氨基水杨酸后ros的水平的降低到模型组的0.659506倍(图5b)。
[0073]
图5c展示了斑马鱼空白组和tnbs造模后及5-asa给药后的代表性图片。
[0074]
实施例3黄芩苷抗ibd活性研究
[0075]
待斑马鱼胚胎发育至2dpf,将胚胎破膜,加入24孔板中,每孔8枚胚胎,每孔含有1ml的液体,总共分为空白组、模型组、给药组。
[0076]
空白组:在3dpf加入0.1%的dmso;
[0077]
模型组:在3dpf加入75μg/ml的tnbs和0.1%的dmso;
[0078]
给药组:在2dpf时给药组预孵200μm的黄芩苷24h。在3dpf时,给胚胎进行换液,加入75μg/ml的tnbs和0.1%的dmso。
[0079]
在5dpf的时候加入dcfh-da(1:1000)染色30min,对胚胎侧面进行拍照,并计算肠道区域中性粒细胞个数,分析dcfh-da染色平均荧光强度。
[0080]
如图6a所示,黄芩苷可以显著降低tnbs造模后导致的活性氧水平升高。黄芩苷对肠道中性粒细胞聚集没有效果。图6b展示了斑马鱼空白组和tnbs造模后及黄芩苷给药后的代表性图片。
[0081]
实施例4千层纸素a-7-o-b-葡萄糖醛酸苷抗ibd活性研究
[0082]
待斑马鱼胚胎发育至2dpf,将胚胎破膜,加入24孔板中,每孔8枚胚胎,每孔含有1ml的液体,总共分为空白组、模型组、给药组。
[0083]
空白组:在3dpf加入0.1%的dmso;
[0084]
模型组:在3dpf加入75μg/ml的tnbs和0.1%的dmso;
[0085]
给药组:在2dpf时给药组预孵200μm的千层纸素a-7-o-b-葡萄糖醛酸苷24h。在3dpf时,给胚胎进行换液,加入75μg/ml的tnbs和0.1%的dmso。
[0086]
在5dpf的时候加入dcfh-da(1:1000)染色30min,对胚胎侧面进行拍照,并计算肠道区域中性粒细胞个数,分析dcfh-da染色平均荧光强度。
[0087]
如图7a所示,tnbs造模后,肠道中性粒细胞数目显著增加,而加入千层纸素a-7-o-b-葡萄糖醛酸苷预保护可以显著降低肠道中性粒细胞数目,回调指数:0.609052。
[0088]
加入千层纸素a-7-o-b-葡萄糖醛酸苷后ros的水平的降低到模型组的0.694083倍(图7b)。
[0089]
图7c展示了斑马鱼空白组和tnbs造模后及千层纸素a-7-o-b-葡萄糖醛酸苷给药后的代表性图片。
[0090]
实施例5活性化合物机制验证
[0091]
待斑马鱼胚胎发育至2dpf,将胚胎破膜,加入6孔板中,每孔32枚胚胎,每孔含有4ml的液体,总共分为空白组、模型组、给药组。
[0092]
空白组在3dpf加入0.1%的dmso;模型组在3dpf加入75μg/ml的tnbs和0.1%的dmso;给药组在2dpf时分别预孵300μg/ml的5-氨基水杨酸、200μm的黄芩苷、200μm的千层纸素a-7-o-b-葡萄糖醛酸苷24h,在3dpf时,给胚胎进行换液,加入75μg/ml的tnbs和0.1%的dmso。
[0093]
胚胎发育至5dpf时,提取胚胎总rna。将胚胎移入匀浆管中,每管加入500μl lysis buffer,用匀浆机匀浆,vortex 10s,12000
×
g离心2分钟,将上清转移到新的1.5ml离心管中。向离心管中加入等体积的无水乙醇充分混匀,将液体转移至离心柱。4000
×
g离心1分
钟。向rna柱中加入500μl的wash buffer,12000
×
g离心1分钟。倒掉废液,将rna柱装回收集管,空管离心一次。将柱子放到干净的无rna酶的1.5ml离心管上,开盖晾干2分钟。向rna柱的膜中心部位加入30μl的elution buffer,室温静置2分钟。12000
×
g离心1分钟,洗脱下来的rna溶液重新加入柱中,静置5分钟,再次离心。测定洗脱的rna浓度。
[0094]
根据表1配制逆转录反应体系:
[0095]
表1
[0096][0097]
涡旋振荡混匀,短暂离心,使管壁上的溶液收集到管底。42℃孵育15分钟,85℃孵育5分钟进行反应。
[0098]
染料法sybr green i进行实时荧光定量pcr反应,预变性95℃孵育10分钟,变性95℃15秒,退火/延伸60℃1分钟,进行35个循环。按δδct计算相对表达量。
[0099]
il-1β是一重要的促炎因子,在炎症中发挥着重要作用。本实验通过rt-qpcr检测ibd模型中以及给药后il-1β的相对表达情况。如图8所示,tnbs造模后,il-1β表达量显著升高,而5-氨基水杨酸、黄芩苷、千层纸素a-7-o-b-葡萄糖醛酸苷均可显著降低il-1β含量,说明三者都可在一定程度上缓解炎症。
[0100]
实施例6基于斑马鱼ibd模型的仲景方药物筛选
[0101]
用已构建好的斑马鱼模型对仲景方白头翁汤、葛根芩连汤、桃花汤这三个方剂中的74个组分进行筛选。
[0102]
待斑马鱼胚胎发育至2dpf,将胚胎破膜,加入96孔板中,每孔1枚胚胎,每孔含有300μl的液体,总共分为空白组、模型组、给药组。
[0103]
空白组加入0.1%的dmso;模型组加入75μg/ml的tnbs和0.1%的dmso;给药组在2dpf时预孵50μg/ml的组分24h,在3dpf时,给胚胎进行换液,加入75μg/ml的tnbs。每组5个胚胎。
[0104]
在5dpf的时候加入dcfh-da(1:10000)染色30min,对胚胎侧面进行拍照,并计算肠道区域中性粒细胞个数,分析dcfh-da染色平均荧光强度。
[0105]
将肠道的中性粒细胞个数的回调指数(n
model-n
drug
)/(n
model-n
control
)>0.6或ros水平小于模型组ros水平的0.7(平均荧光强度比例<0.7)即判定为有效。最终获得36个组分具
有潜在治疗炎性肠道疾病的作用,如图9所示,其中6个组分显示出对两个指标均有一定效果。图中灰色代表阴性组分,蓝色代表对中性粒细胞有回调效果的组分,红色代表对ros有抑制效果的组分,绿色代表对二者均有效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1