用于生产药物载体的方法与流程
用于生产药物载体的方法
1.本发明涉及一种用于注射模制用于包封药物组合物的药物载体的配制品。
背景技术:
2.用于口服固体药物组合物的两种常见剂型是填充的硬胶囊和压制片剂。硬胶囊典型地使用明胶制成。常见的生产方法是通过将不锈钢销浸入明胶溶液中来形成两个部分。然后将胶囊半体从销上剥下并修剪,然后连结在一起以制成每个胶囊。可以允许获得更复杂几何形状的替代性制造方法是使用注射模制。
3.传统胶囊的组成限于聚合物,聚合物在分散于水中时具有合适的流变学特性和成膜特性。然而,注射模制是热熔工艺,其需要非常不同的材料特性。这样既提出了摆脱传统胶囊材料如明胶(是源自动物的,机械特性取决于环境条件)和hpmc(溶解滞后时间)的机会,还因为注射模制工艺对所需的材料特性要求很高而提出了挑战。这些材料在工艺期间必须是热稳定的、必须具有良好的熔体流动特性
‑
特别是在高剪切条件下、必须在冷却后足够柔性以从机器中弹出、并且对于本技术而言必须机械强度高以能够进行药物加工并迅速溶于水中。此外,该材料必须适合人类食用并且已被批准用于药物用途。
4.gb 2501607 b描述了可熔融加工的水溶性聚合物组合物,其包含pvoh和按重量计15%
‑
75%的吸湿性盐。该组合物被建议用于模制具有小于200微米的厚度的薄壁制品。然而,预期gb 2501607 b中所描述的注射模制所需的工艺参数引起聚合物的热降解,并且吸湿性盐的添加将导致高湿度敏感性和软化,从而导致在散装装卸和储存的应力下载体打开的风险。
技术实现要素:
5.我们已经开发了一种新的用于注射模制药物载体的配制品。特别地,配制品在注射模制工艺中的高性能使得载体的设计具有灵活性,从而允许鲁棒地制造具有非常小尺寸的设计特征,这在传统上是注射模制中的挑战。配制品允许通过注射模制来制备包括非常精细且薄的设计细节的药物载体,这些药物载体在储存期间维持药物活性剂的稳定性。同时,配制品为药物载体提供良好的溶解速率。
6.此外,我们已经开发了一种新颖的药物剂型(在本文还称为prescido
tm
),其被设计为具有标准药物胶囊的功能,同时维持患者的片剂诉求。本文所描述的载体是经由精密注射模制工艺使用被设计用于在热加工中表现良好的配制品、如本发明的配制品来制造的。设计与制造特征连同其益处尤其包括薄壁区段(在水性介质中快速的载体崩解时间)、小的卡扣闭合特征(紧密闭合防止载体在输送期间被打开并且限制载体内容物被窃启)、空腔的编号(使用前多个部分的可追溯性和分类)以及高的重量与尺寸精度(鲁棒的操纵过程)。
7.因此,本发明涉及一种用于注射模制药物载体的配制品,其中配制品包含27%
‑
85%(w/w)的聚乙烯醇(特别是聚乙烯醇(4
‑
88))、以及10%
‑
60%(w/w)的选自玉米淀粉和小麦淀粉的崩解助剂。
8.在实施例中,配制品进一步包含0.3%
‑
3.0%(w/w)的润滑剂(特别是硬脂酸)、和/
或5%
‑
14%(w/w)的加工助剂(特别是丙
‑2‑
二醇(propan
‑2‑
glycol))。加工助剂允许在更低温度下加工配制品,从而降低热降解的风险。同时,增加量产生由配制品制备的药物载体的更高柔性,使得这些载体仅在少量所施加力的情况下打开。我们发现5%
‑
14%的加工助剂对于合理的工艺是最佳的。配制品还可以包含一种或多种赋形剂,如下文进一步定义的。
9.因此,配制品可以有利地应用于以下用于生产药物载体的方法中,该方法包括以下步骤:将本披露的配制品熔融;以及将熔体注入模具中;以及任选地将所注入的熔体冷却并且任选地将所模制的材料弹出。该方法可以包括另外的步骤:将载体部按模腔分类。在优选的实施例中,盖部和底部通过互补的闭合机构彼此连接,特别地其中,闭合机构包括第一卡扣部,第一卡扣部从底部突出以便面向从盖部突出的第二卡扣部并与之相互作用。
10.与传统胶囊相比,除了具有优异的热加工特性之外,所开发的配制品还赋予载体许多益处,例如像以及非常快的溶解(载体在水性介质中快速破裂)。
11.因此,在还另一方面,本发明涉及一种通过本披露的方法使用本披露的配制品生产的药物载体,该药物载体包括盖部和底部,其中盖部和底部中的至少一者具有第一壁区段(26,30)和第二壁区段,第一壁区段具有180
‑
220μm、优选地185
‑
215μm、甚至更优选地190
‑
210μm、甚至更优选地195
‑
205μm、并且最优选地约200μm的厚度,第二壁区段具有350
‑
450μm、优选地375
‑
425μm、更优选地390
‑
410μm、并且最优选地约400μm的厚度。盖部的第一壁区段可以限定该盖部的整个顶部分。替代于或附加于此,底部的第一壁区段可以限定该底部的整个底部分。在特别优选的实施例中,药物载体由盖部和底部组成,即,被设计呈两件式部件的形式、没有任何额外的元件。下文和权利要求中描述了另外的优选实施例。
附图说明
12.图1示出了药物载体的各种设计。
13.图2示出了根据图1的药物载体的示例性实施例的盖部和底部的截面视图,包括设置在盖部和底部上的闭合机构的详细视图。
14.图3a示出了如图2中右侧上所示的载体底部的三维视图。
15.图3b示出了设置在根据图2的药物载体的盖部和底部上的闭合机构的另外详细视图。
16.图4示出了在50℃、75%rh下储存12周之后,填充有api
‑
1的载体在(a)闭合状态和(b)打开状态的稳定性研究。该研究各自比较单独的api
‑
1对照(最上面的具有空心圆圈的图)与由本披露的pvoh配制品制备的pvoh载体(具有实心圆圈的图)、以及peo载体(1)(实心菱形)、(2)(实心方块)、或(3)(实心三角形)。
17.图5示出了填充有api
‑
1的载体在(a)打开状态和(b)闭合状态的稳定性研究。该研究各自比较单独的api
‑
1对照(各自具有空心圆圈的虚线和实线)、由配制品(1)制备的pvoh载体(实线,实心圆圈)、peo载体(虚线,空心方块)和由不包含崩解助剂的历史配制品制备的pvoh载体(虚线,实心圆圈)。
18.图6示出了在50℃、75%rh下储存12周之后,填充有api
‑
2的载体在(a)闭合状态和(b)打开状态的稳定性研究。该研究各自比较单独的api
‑
2对照(最上面的具有空心圆圈的图)与由本披露的pvoh配制品制备的pvoh载体(具有实心圆圈的图)、以及peo载体(1)(实心菱形)、(2)(实心方块)、或(3)(实心三角形)。
具体实施方式
19.可商购的胶囊通过浸涂工艺来制造。这涉及具有聚合物/水混合物的储液并将销浸入,使得销涂覆有混合物。然后将销从混合物中提起,并且将销上的聚合物混合物干燥以形成硬胶囊,然后将其移除。另一方面,prescido
tm
载体是经由注射模制来制造的。注射模制涉及在螺杆中使材料熔融,然后使用螺杆将熔体在高压下注入模具中,在模具中熔体被快速冷却,然后被弹出。此过程具有优于浸涂的许多优点:该过程可以极其精确,因为电驱动器精确地控制机器的运动,这与对于过程参数(如,温度和压力)的非常严格的控制以及精密模具制造一起得到了部件的高均匀性。
20.prescido
tm
容器是类似于胶囊的被填充的胶囊,但是具有膜包衣片剂的外观。在希望除了常规胶囊剂外的剂型呈现的情况下,这为市场创造了额外的呈现选项以供选择。图1(顶行)示出了prescido
tm
平台的一系列设计。
21.如从图1中变得显而易见的,prescido
tm
容器可以具有不同的设计和不同的填充体积。具体地,这些容器可以具有各种直径和高度,使得可以例如根据要填充到容器中的粉末的体积来选择适当的容器。
22.此外,使用注射模制为复杂的部件几何形状提供了机会。在浸渍模制中,胶囊的外部和内部几何形状两者都限于销的形状,而注射模制成的部件的形状由模具形状限定,这可以使得在载体的每个面上获得多个特征。
23.传统胶囊的组成限于聚合物,聚合物在分散于水中时具有合适的流变学特性和成膜特性。然而,注射模制是热熔工艺,其需要非常不同的材料特性。这样既提出了摆脱传统胶囊材料如明胶(是源自动物的,机械特性取决于环境条件)和hpmc(溶解滞后时间)的机会,还因为注射模制工艺对所需的材料特性要求很高而提出了挑战。这些材料在工艺期间必须是热稳定的、必须具有良好的熔体流动特性
‑
特别是在高剪切条件下、必须在冷却后足够柔性以从机器中弹出、并且对于本技术而言必须机械强度高以能够进行药物加工并迅速溶于水中。此外,该材料必须适合人类食用并且已被批准用于药物用途。
24.本发明的诸位发明人已经发现,适合于注射模制的配制品可以是基于聚乙烯醇(pvoh)的,参见下文的实例1。测试了不同含量的pvoh以实现具有希望的理化特性的配制品。
25.因此,本披露提供了一种用于注射模制药物载体的配制品,其中该配制品包含27%
‑
85%(w/w)的聚乙烯醇,以及10%
‑
60%(w/w)的选自玉米淀粉、小麦淀粉、以及其组合的崩解助剂;以及任选地一种或多种赋形剂。优选地,崩解助剂是玉米淀粉。
26.用于注射模制药物载体的合适配制品包含27%
‑
85%(w/w)聚乙烯醇。小于27%(w/w)的聚乙烯醇的量导致太弱的机械特性,使得预期由本发明的配制品生产的药物载体不具有足够的闭合力。因此,在实施例中,配制品包含35%
‑
82%(w/w)聚乙烯醇,优选地40%
‑
80%(w/w)、更优选地45%
‑
75%(w/w)、更优选地50%
‑
70%(w/w)、更优选地55%
‑
68%(w/w)、更优选地60%
‑
65%(w/w)、并且最优选地约62%(w/w)的所述聚乙烯醇。
27.特别合适的聚乙烯醇是聚乙烯醇(4
‑
88),其组合了良好的溶解性与注射模制期间的良好的可加工性。具有更高分子量的聚乙烯醇具有较不希望的溶解速率,并且难以加工。先前已经研究了聚合物分子量的增加与溶解速率的降低之间的关系(参见例如,ueberreiter k.the solutionprocess[溶液法]。在以下中:crank j,park gs,编辑
.diffusion in polymers[聚合物中的扩散].纽约,纽约州(new york,ny):academic press[学术出版社];1968.第219
‑
57页;miller
‑
chou,b和koenig,j.,a review of polymer dissolution[聚合物溶解综述],prog.polym.sci.[聚合物科学进展]2003,28:1223
‑
1270)。此外,约88%的水解度提供了良好的体内溶解特性。显著更高的水解度导致溶解速率的降低,和/或需要更高的温度用于良好的溶解。
[0028]
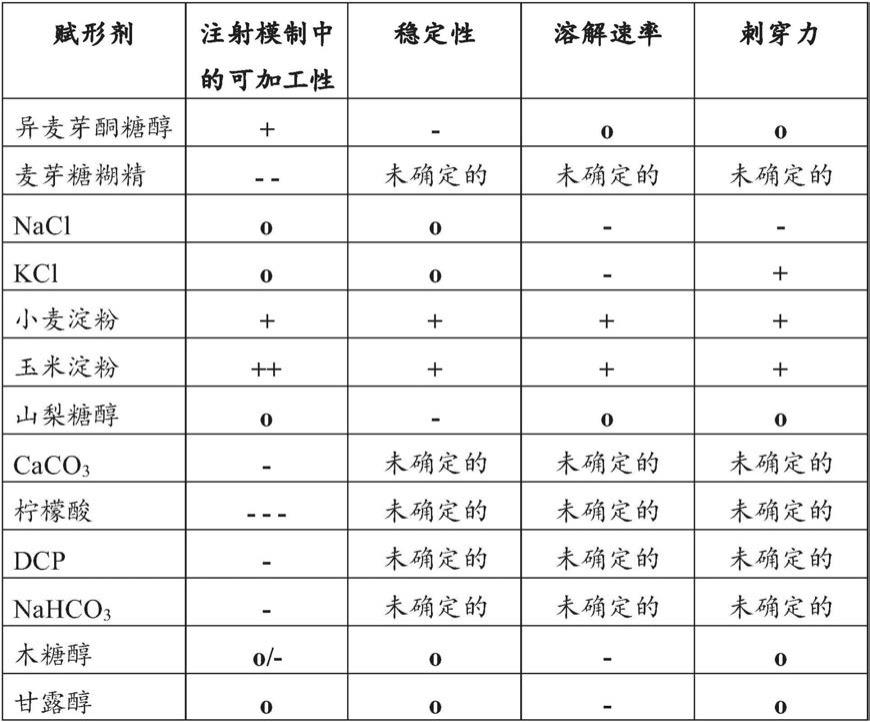
然而,为了提供在溶解速率和刚性方面的合适的特性,需要掺入合适量的崩解助剂(或成孔剂),同时维持通过注射模制的良好的可加工性。如实例中所示出的,测试了几种崩解助剂(成孔剂),导致不太有利的机械特性、较差的溶解或溶解中的轻微滞后时间、稳定性研究期间的相分离、或在注射模制期间需要过高的压力。出人意料地,发现聚乙烯醇与玉米淀粉或小麦淀粉的混合物提供了良好的机械特性和溶解速率,同时仍可通过注射模制良好地加工。在两种淀粉之中,玉米淀粉的表现略好于小麦淀粉。因此,在优选的实施例中,崩解助剂是玉米淀粉。
[0029]
在进一步测试时,发现用于注射模制药物载体的合适配制品包含10%
‑
60%(w/w)的所述崩解助剂。因此,用于注射模制药物载体的配制品包含取决于pvoh的含量的10%
‑
60%(w/w)的玉米淀粉、小麦淀粉、或其组合。小于10%(w/w)的崩解助剂的量导致溶解期间的滞后时间。大于60%(w/w)的所述崩解助剂的量导致太弱的机械特性,使得预期由本发明的配制品生产的药物载体不具有足够的闭合力。用于注射模制本披露的药物载体的特别合适的配制品可以包含15%
‑
55%(w/w)、优选地17.5%
‑
50%(w/w)、优选地20%
‑
45%(w/w)、优选地22.5%
‑
40%(w/w)、优选地25%
‑
37.5%(w/w)、优选地27.5%
‑
35%(w/w)、甚至更优选地28%
‑
32%(w/w)、并且最优选地约30%的所述崩解助剂。
[0030]
可以经由两种方法确定刺穿力和
‘
快速打开’力评估机械特性。首先,刺穿力是通过配备有限定表面积的平面销的标准质构分析仪测量的,该平面销向载体部施加压力直至材料失效并被刺穿。由压力和销表面积计算力。另外,还测量机械强度高的配制品的“快速打开”力。在这些测量中,将空的闭合载体放置在标准片剂破碎机中,并且测量载体快速打开时的力。
[0031]
可以使用如美国药典2011,章节<711>中所描述的“对立即释放的测定(assay for immediate release)”确定胶囊的溶解速率。该测定使用usp设备i(篮法)和禁食状态模拟胃液(fassgf;可商购),在37℃和100rpm下,其中n=3个胶囊。在一个实施例中,药物载体在15分钟内展现出至少80%、优选地至少85%、更优选地至少90%、并且最优选地至少95%药物物质的溶解速率;使用快速溶解的化合物,例如普萘洛尔.hcl作为测试物质。快速溶解的化合物是例如bcs(生物药物分类系统)1类或3类化合物。
[0032]
配制品还可以包含赋形剂。赋形剂可以是选自由以下组成的清单的至少一种:润滑剂、加工助剂、着色剂、遮光剂、填充剂、以及助流剂。
[0033]
通常,配制品将进一步包含润滑剂,润滑剂有助于将模制载体从模具中释放,并且通常降低粘性。例如,配制品可以包含0.3%
‑
3.0%(w/w)的润滑剂。在高于3%(w/w)的量下,预期润滑剂将影响溶解速率。另一方面,需要至少0.3%(w/w)的润滑剂以便使得注射模制步骤期间的压力足够低。在另外的实施例中,配制品可以优选地包含0.5%
‑
2.8%(w/w)、更优选地1.0%
‑
2.6%(w/w)、更优选地1.2%
‑
2.6%(w/w)、更优选地1.4%
‑
2.4%(w/w)、更优选地1.6%
‑
2.2%(w/w)、更优选地1.8%
‑
2.1%(w/w)、并且最优选地约2%(w/w)的润滑
剂。润滑剂可以是硬脂酸或其盐之一如硬脂酸镁或硬脂酸钙、硬脂富马酸钠(ssf)、硬脂醇、氢化植物油、山萮酸甘油酯、或其任意组合。在优选的实施例中,润滑剂是硬脂酸或其盐之一如硬脂酸镁或硬脂酸钙。特别合适的润滑剂是硬脂酸。
[0034]
此外,取决于聚乙烯醇的量,可以有利地进一步将加工助剂掺入到本披露的配制品中。加工助剂改善流动性并允许在注射模制工艺中降低温度和压力。虽然5%(w/w)的加工助剂对于药物载体的机械特性是最佳的,但也可以使用更高的量。然而,高于14%,配制品变得太软,并且机械特性不太有利。因此,预期载体打开力是有问题的。同时,随着加工助剂的量的增加,溶解速率开始降低。因此,配制品可以包含5%
‑
14%(w/w)的加工助剂,优选地5%
‑
12%(w/w)、更优选地5%
‑
10%(w/w)、更优选地5%
‑
8%(w/w)、甚至更优选地5%
‑
6%(w/w)、并且最优选地约5%(w/w)的加工助剂。用于在本披露的配制品中的特别合适的加工助剂是丙
‑2‑
二醇。
[0035]
进一步设想的是,本披露的配制品包含着色剂和/或遮光剂。添加着色剂和遮光剂仅仅是出于美观的原因,并且对于配制品不是必需的或关键的。着色剂和/或遮光剂的量可以适配于相应用途,但技术上不限于特定量。例如,配制品可以包括0%
‑
6%(w/w)的一种或多种着色剂和/或遮光剂、优选地0.01%
‑
5%(w/w)的一种或多种着色剂和/或遮光剂、更优选地0.25%
‑
4%(w/w)的一种或多种着色剂和/或遮光剂、更优选地0.5%
‑
3%(w/w)的一种或多种着色剂和/或遮光剂、更优选地0.75%
‑
2.5%(w/w)的一种或多种着色剂和/或遮光剂、更优选地1%
‑
2%(w/w)的一种或多种着色剂和/或遮光剂、更优选地1%
‑
1.5%(w/w)的一种或多种着色剂和/或遮光剂、并且最优选地约1%(w/w)的一种或多种着色剂和/或遮光剂。着色剂和/或遮光剂可以是本领域已知的任何合适的。例如,着色剂和/或遮光剂可以选自二氧化钛、氧化铁、色淀颜料、云母基颜料(例如,candurin)、配制的颜料(例如,)、及其任意组合。
[0036]
配制品可以任选地包含助流剂,以便在注射模制之前改善共混物的流动。如果存在的话,助流剂可以是例如胶体二氧化硅。
[0037]
替代性的赋形剂和着色剂、遮光剂、助流剂、润滑剂的实例对于技术人员将是显而易见的,并且在著名参考书如remington,handbook of pharmaceutical excipients[药用辅料手册]中描述。
[0038]
选择组分及其量以产生1112
‑
2760巴、优选地1200
‑
2750巴、更优选地1300
‑
2740巴、更优选地1400
‑
2730巴、更优选地1500
‑
2720巴、更优选地1600
‑
2710巴、特别是1700
‑
2700巴的注射压力,使用demag intelect 50
‑
45机器用于注射模制。技术人员将能够使注射压力范围适配于不同的注射模制机器并且考虑熔体温度的变化。注射压力必须与浇口痕迹平衡,并且取决于几何形状和配制品。此外,选择组分及其量以符合160℃
‑
220℃、优选地160℃
‑
210℃、更优选地160℃
‑
200℃、更优选地170℃
‑
200℃、更优选地180℃
‑
200℃、特别是185℃
‑
195℃、如约190℃的整体温度。增加整体温度需要优化停留时间。通常模具温度选择为约25℃
‑
50℃,例如30℃
‑
40℃。
[0039]
在这些实例中,示出了配制品的一个特别适合的实施例。在此实施例中,配制品包含60%
‑
65%(w/w)聚乙烯醇(4
‑
88)、28%
‑
32%(w/w)的玉米淀粉、1.8%
‑
2.1%(w/w)的硬脂酸、以及5%
‑
6%(w/w)的丙
‑2‑
二醇。
[0040]
如实例中所示出的,当在应力条件(如在50℃下储存)下测试时,通过使用本披露
的配制品注射模制生产的药物载体出人意料地维持活性药物成分(api)的高稳定性。因此,特别有利的是,与对比实例相比,当使用本披露的配制品时,观察到至少相同和/或改善的稳定性。
[0041]
本披露进一步提供了一种生产药物载体的方法,该方法包括以下步骤:(a)将如上所描述的配制品熔融;以及(b)将熔体注入模具中。所述方法可以任选地包括另外的步骤(c):将所注入的熔体冷却并且任选地将所模制的材料弹出。如上所描述,优选地,药物载体是胶囊,并且形成至少一个盖部和至少一个底部。
[0042]
盖部和底部中的至少一者具有厚度为180
‑
250μm、优选地185
‑
225μm、并且甚至更优选地190
‑
220μm的第一壁区段,以及厚度为350
‑
450μm、优选地375
‑
425μm、更优选地390
‑
410μm、并且最优选地约400μm的第二壁区段。在优选的实施例中,盖部(22)的第一壁区段(26)限定盖部(22)的整个顶部分,和/或其中,底部(24)的第一壁区段(30)限定底部(24)的整个底部分。
[0043]
在特别优选的实施例中,药物载体由盖部和底部组成,即,被设计呈两件式部件的形式、没有任何额外的元件。
[0044]
优选地,药物载体是片剂形状的,即,被设计为具有标准药物胶囊的功能、同时维持患者的片剂诉求。特别地,相比胶囊形状,这些容器典型地被选择成具有片剂形状、如盘形形状。当考虑药物载体的盖部和底部时,胶囊形状将沿着从底部的中心到盖部的中心延伸的中央轴线是长形的。因此,对于传统的胶囊,盖部和底部的横向延伸量、特别是直径与组装好的盖部和底部沿着中央轴线的高度之比将小于1∶1、如0.5∶1或更小。例如,0号胶囊具有7.64mm的直径和21.7mm的高度(比率为0.35∶1),并且3号胶囊具有5.82mm的直径和15.9mm的高度(比率也为0.37∶1)。相比之下,片剂形状的载体具有更扁平的形状,并且具有大于1的比率(1∶1基本上为球形)。因此,药物载体优选地被设计成使得盖部和底部的横向延伸量、特别是直径与组装好的盖部和底部的高度之比是>1、优选地≥1.4、更优选地≥1.5、甚至更优选地≥2、最优选地≥2,4、并且特别地≥2.5。图1中从左到右描绘的容器的盖部和底部的横向延伸量与组装好的盖部和底部的高度之比为1∶0.4、即2.5;1∶0.7、即1.43;1∶0.42、即2.38;1∶0.875、即1.14;1∶0.69、即1.45。
[0045]
第一壁区段的厚度已经被优化为190至220μm。这足够厚而使得在经由注射模制来制造药物载体期间,材料可以流动穿过薄的第一壁区段、并且仍可靠地填充第二壁区段的较厚的带壁的面积;同时又足够薄以实现为了获得填充化合物的立即释放溶解曲线而需要的快速载体崩解。第二壁区段已经被优化为400um的厚度。在此,在具有更大的可用于填充的内部容积与具有进行填充和操纵所需的机械强度(包括在填充后抵抗打开)之间实现了平衡。
[0046]
盖部的第一壁区段可以限定盖部的顶部分的至少一部分。优选地,盖部的第一壁区段限定盖部的整个顶部分,使得在薄的第一壁区段崩解时,实现填充到药物载体中的化合物经由盖部的顶部分崩解而快速且可靠地释放。
[0047]
盖部的第二壁区段可以限定盖部的侧壁部分的至少一部分。例如,盖部的第二壁区段可以限定盖部的、邻近于盖部的顶部分布置的肩部或拐角。具体地,盖部的第二壁区段可以从第一壁区段、即特别是盖部顶部分、沿着其外圆周朝底部的方向延伸。这种设计使盖部具有操纵盖部以及将其与底部相连形成期望的药物载体所需要的机械稳定性。
[0048]
在本技术的上下文中,表述“盖部的侧壁部分”定义了盖部的基本上平行于药物载体的中央轴线延伸的这部分。优选地,盖部的侧壁部分具有圆形的圆柱形形状,并且环绕药物载体的基本上与之平行的中央轴线。表述“盖部的顶部分”定义了盖部的连接至侧壁部分并且“覆盖”由侧壁部分在其一端环绕的自由空间的这部分。盖部的顶部分可以相对于药物载体的中央轴线基本上垂直地延伸;然而,其中,在特定的优选实施例中,顶部分相对于药物载体的中央轴线至少略微弯曲。当从载体的“外侧”观察时,盖部的顶部分特别地设有凹曲率。
[0049]
在药物载体的优选实施例中,底部的第一壁区段限定底部的底部分的至少一部分。优选地,底部的第一壁区段限定底部的底部分,使得在薄的第一壁区段崩解时,实现填充到药物载体中的化合物经由底部的底部分崩解而快速且可靠地释放。
[0050]
底部的第二壁区段可以限定盖部的侧壁部分的至少一部分。具体地,底部的第二壁区段可以从第一壁区段、即特别是底部的底部分、沿着其外圆周朝盖部的方向延伸。优选地,底部的第二壁区段的高度大于盖部的第二壁区段的高度。换言之,在药物载体的优选实施例中,底部具有总体上中空的圆柱形形状、并且因此限定了可以被填充药物化合物的“器皿”。相反,盖部(可以设有第二壁区段,第二壁区段仅限定了环绕盖部的顶部分的肩部或拐角)可以具有总体上“扁平的”形状。与第一壁区段相比,第二壁区段的更大壁厚度对底部提供了机械强度和稳定性,以允许不受阻碍地对底部填充药物化合物。
[0051]
在本技术的上下文中,表述“底部的侧壁部分”定义了底部的基本上平行于药物载体的中央轴线延伸的这部分。优选地,底部的侧壁部分具有圆形的圆柱形形状,并且环绕药物载体的基本上与之平行的中央轴线。表述“底部的底部分”定义了底部的连接至侧壁部分并且“覆盖”由侧壁部分在其一端环绕的自由空间的这部分。盖部的底部分可以相对于药物载体的中央轴线基本上垂直地延伸;然而,其中,在特定的优选实施例中,底部分相对于药物载体的中央轴线至少略微弯曲。当从载体的“外侧”观察时,底部的底部分特别地设有凹曲率。
[0052]
在优选的实施例中,盖部和底部通过互补的闭合机构彼此连接。互补的闭合机构提供了盖部与底部之间的可靠且易于建立的连接。
[0053]
更具体地,闭合机构可以包括第一卡扣部,第一卡扣部从底部的第二壁区段突出以便面向第二卡扣部并与之相互作用,第二卡扣部从盖部的第二壁区段突出。在闭合药物载体时,即,在将盖部连接至底部时,第一和第二卡扣部中的至少一者可以弹性地变形。在盖部和底部已经到达其最终相对位置时,即,在盖部被定位在底部的顶上而根据期望来密封底部的内部时,第一和第二卡扣部中的至少一者的弹性信息可以释放,其方式为使得这些卡扣部彼此完好以便将盖部和底部可靠地相连。
[0054]
例如,第一卡扣部可以包括突出部,突出部被适配成与设置在第二卡扣部上的对应突出部相接合,以便阻止第一卡扣部和第二卡扣部的分离、并且因此防止盖部和底部的分离。特别地,第一卡扣部的突出部可以包括第一抵接表面,第一抵接表面面向底部并且被适配成抵接第二抵接表面,第二抵接表面被形成在第二卡扣部上、并且在底部和盖部彼此连接时面向盖部。形成在第一卡扣部上的第一抵接表面可以相对于底部的侧壁部分呈90至150
°
角延伸。形成在第二卡扣部上的第二抵接表面可以相对于盖部的侧壁部分呈90至150
°
角延伸。
[0055]
设置在第一卡扣部上的突出部可以沿第一卡扣部的自由端的方向渐缩以便形成第一倾斜接合表面。第一倾斜接合表面可以被适配成与第二倾斜接合表面相接合,第二倾斜接合表面在设置在第二卡扣部上的、沿第二卡扣部的自由端的方向渐缩的突出部上形成。在将药物载体的盖部连接至底部时,第二倾斜接合表面可以沿着第一倾斜接合表面滑动,由此引导设置在第一卡扣部上的突出部与设置在第二卡扣部上的对应突出部相接合。因此,简化了盖部与底部的连接。
[0056]
第一和第二卡扣部中的一者可以从盖部或底部的第二壁区段在第二壁区段的内圆周的区域中突出,其中,第一和第二卡扣部中的另一者可以从盖部或底部的第二壁区段在底部的第二壁区段的外圆周的区域中突出。优选地,设置在药物载体的底部上的第一卡扣部从底部的第二壁区段在第二壁区段的内圆周的区域中延伸。如此设计的第一卡扣部特别适合于与从盖部的特别是肩部或拐角形第二壁区段在盖部的第二壁区段的外圆周的区域中突出的第二卡扣部相互作用。
[0057]
闭合机构可以进一步包括内肋,内肋从盖部或底部的第二壁区段在第二壁区段的内圆周的区域中、在距从盖部或底部的第二壁区段在第二壁区段的外圆周的区域中突出的第一或第二卡扣部一定距离处突出。特别地,闭合机构可以包括内肋,内肋从盖部的第二壁区段在其内圆周的区域中、并且因此在距从盖部的特别是肩部或拐角形第二壁区段沿在外圆周的区域突出的第二卡扣部一定距离处突出。因此,内肋和第二卡扣部之间限定了空隙,空隙被适配从在药物载体的盖部和底部彼此连接时容纳第一卡扣部。在盖部和底部的已连接状态下,第一卡扣部由于与第二卡扣部的相互作用、即特别是由于形成在第一卡扣部上的第一抵接表面与形成在第二卡扣部上的第二抵接表面的相互作用,而在内肋与第二卡扣部之间的空隙中被固持在位,同时内肋提供了闭合机构的额外的机械稳定性和刚度。
[0058]
然而,还设想了特别是在底部设有以下第一卡扣部的情况下对药物载体的底部提供内肋,第一卡扣部从底部的第二壁区段在其外圆周的区域中突出、并且被适配成与第二卡扣部相互作用,第二卡扣部从盖部的第二壁区段在其外圆周的区域中突出。在这种情况下,内肋和第一卡扣部之间可以限定空隙,空隙被适配成在药物载体的盖部和底部彼此连接时容纳第二卡扣部。
[0059]
优选地,内肋比与内肋相对布置的卡扣部更短。换言之,优选地,一个卡扣部与内肋一起限定了用于容纳另一个卡扣部的空隙,这个卡扣部从盖部的第二壁区段突出得比内肋突出的更远。另外,内肋可以沿内肋的自由端的方向渐缩以便形成第三倾斜接合表面,第三倾斜接合表面面向从盖部或底部的第二壁区段在第二壁区段的外圆周的区域中突出的并且因此与内肋相对布置的第一或第二卡扣部。优选地,设置在内肋上的第三倾斜接合表面基本上平行于设置在与内肋相对布置的卡扣部的突出部上的抵接表面延伸。因此,被适配成在药物载体的盖部和底部相连时容纳在内肋与同内肋相对布置的卡扣部之间所限定的空隙中的卡扣部被引导至与同内肋相对布置的卡扣部相接合。
[0060]
在药物载体的优选实施例中,盖部的第一壁区段、特别是在由制造盖部时到模具中的材料注入点所限定的区域中设有凹窝。这个凹窝的壁厚度可以大于第一壁区段的其余部分的壁厚度、但是小于盖部的第二壁区段的壁厚度。例如,凹窝可以布置在盖部的顶部分的中央区域中。可以在凹窝的表面上、特别是内表面上压印标记,标记指示其中在注射模制工艺期间在多腔模制工具上模制盖部的腔室。对于需要严格的重量均匀性的应用,这允许
将盖部按腔室进行自动分类。
[0061]
替代于或附加于此,底部的第一壁区段、特别是在由制造底部时到模具中的材料注入点所限定的区域中设有凹窝。这个凹窝的壁厚度可以大于第一壁区段的其余部分的壁厚度、但是小于盖部的第二壁区段的壁厚度。例如,凹窝可以布置在底部的底部分的中央区域中。可以在凹窝的表面上、特别是内表面上压印标记,标记指示其中在注射模制工艺期间在多腔模制工具上模制底部的腔室。对于需要严格的重量均匀性的应用,这允许将底部按腔室进行自动分类。
[0062]
盖部和底部中的至少一者在其内表面的区域中可以设有多个内突出部,内突出部从第二壁区段的内表面、和/或内肋的内表面径向地向内突出。在设有内突出部的盖部或底部还设有内肋的情况下,内突出部在盖部或底部的中央轴线的方向上可以从盖部的顶部分或底部的底部分、沿着底部的盖部的第二壁区段、并且最终沿着从第二壁区段在其内圆周的区域中突出的内肋延伸。在设有内突出部的底部的盖部不包括内肋的情况下,内突出部在盖部或底部的中央轴线的方向上可以从盖部的顶部分或底部的底部分沿着盖部或底部的第二壁区段延伸。内突出部中的至少一个、特别是每一个可以包括突出鼻部,突出鼻部突出超过第二壁区段和/或内肋。
[0063]
内突出部特别是在设有突出鼻部时减少了所谓“嵌套”现象,即,使彼此上下堆叠的部和/或底部粘附在一起。因此,可以消除在手动和自动操纵期间可能由于难以分离的堆叠部“嵌套体”导致的困难。
[0064]
药物载体可以填充有纯api。在此上下文中,表述“纯api”表示在药物药品的所有开发阶段(包括其最终的商业生产)中,包含至多5%(w/w)的添加剂的api。特别地,药物载体内的纯api可以包括至多5%(w/w)的添加剂,优选地至多4%(w/w)、更优选地至多3%(w/w)、甚至更优选地至多2%(w/w)、并且最优选地至多1%(w/w)。
[0065]
在优选的实施例中,药物载体包括盖部和底部。盖部和底部中的至少一者具有厚度为180
‑
250μm、优选地185
‑
225μm、并且甚至更优选地190
‑
220μm的第一壁区段,以及厚度为350
‑
450μm、优选地375
‑
425μm、更优选地390
‑
410μm、并且最优选地约400μm的第二壁区段。盖部的第一壁区段限定盖部的整个顶部分。替代于或附加于此,底部的第一壁区段限定底部的整个底部分。
[0066]
图2、图3a和图3b中更详细地示出了如图1描绘的示例性药物载体20。载体20包括盖部22和底部24。具体地,载体20被设计成两件式部件并且由盖部22和底部24组成。盖部22(在图2的左侧和图3a中示出)包括第一壁区段26和第二壁区段28,第一壁区段限定盖部22的顶部分,第二壁区域限定盖部22的侧壁部分。特别地,盖部22的第二壁区段28限定盖部22的、邻近于盖部22的顶部分布置的肩部或拐角。具体地,盖部22的第二壁区段28从盖部22的顶部分沿着其外圆周、朝底部24的方向延伸。第一壁区段26具有的壁厚度小于第二壁区段28的壁厚度。在图2中所示出的载体20的优选实施例中,第一壁区段26具有的壁厚度为190μm至220μm,而第二壁区段28具有的壁厚度为约400μm。
[0067]
类似地,底部24(在图2的右侧示出)包括第一壁区段30和第二壁区段32,第一壁区段限定底部24的底部分,第二壁区段限定底部24的侧壁部分。底部24的第二壁区段32从底部24的底部分沿着其外圆周、朝盖部22的方向延伸。第一壁区段30具有的壁厚度小于第二壁区段32的壁厚度。在图2中所示出的载体20的优选实施例中,第一壁区段30具有的壁厚度
为190μm至220μm,而第二壁区段32具有的壁厚度为约400μm。
[0068]
盖部22和底部24通过互补的闭合机构34彼此连接,闭合机构在图2以及图3b所示的详细视图中更详细地展示。闭合机构34包括第一钩形卡扣部36,第一钩形卡扣部从底部24的第二壁区段32在第二壁区段32的内圆周的区域中突出。第一钩形卡扣部36面向对应形状的第二钩形卡扣部38并与之相互作用,第二钩形卡扣部从盖部22的第二壁区段28在沿第二壁区段28的外圆周的区域中突出。然而,还可设想到对闭合机构34提供第一卡扣部36和第二卡扣部36,第一卡扣部从底部24的第二壁区段32在第二壁区段32的外圆周的区域中突出,第二卡扣部从盖部22的第二壁区段28在第二壁区段28的内圆周的区域中突出。
[0069]
如在图2和图3b所示出的详细视图中变得显而易见的,第一卡扣部36包含突出部37,该突出部在连接盖部22和底部24时被适配于与设置在第二卡扣部38上的对应突出部39接合。第一卡扣部36的突出部37包括面向底部24的第一抵接表面41。类似地,盖部22的突出部39包括面向盖部22的第二抵接表面43。形成在第一卡扣部36的突出部37上的第一抵接表面41相对于底部24的侧壁部分呈大致135
°
角延伸。形成在第二卡扣部38的突出部39上的第二抵接表面43相对于盖部22的侧壁部分呈大致135
°
角延伸。进一步,设置在第一卡扣部36上的突出部37沿第一卡扣部36的自由端的方向渐缩以便形成第一倾斜接合表面45。类似地,设置在第二卡扣部38上的突出部39同样沿第一卡扣部38的自由端的方向渐缩以便形成第二倾斜接合表面47。
[0070]
闭合机构34进一步包括内肋40,该内肋从盖部22的肩部或拐角形第二壁区段28在第二壁区段28的内圆周的区域中突出。因此,内肋40从盖部22的第二壁区段28、在距从盖部22的第二壁区段28在第二壁区段28的外圆周的区域中突出的第二卡扣部36一定距离处突出。因此,内肋40和第二卡扣部38之间限定了空隙,该空隙被适配用于在药物载体20的盖部22和底部24彼此连接时容纳第一卡扣部36。然而,在盖部22设有第二卡扣部38,该第二卡扣部被布置在第二壁区段28的内圆周的区域中以便与布置在底部24的第二壁区段32的外圆周的区域中的第一卡扣部38相互作用的情况下,还可设想到,闭合机构34包括内肋40,该内肋从底部24的第二壁区段32在第二壁区段32的内圆周的区域中突出。在这种情况下,是第一卡扣部36与内肋40一起限定了空隙,该空隙被适配用于在药物载体20的盖部22和底部24彼此连接时容纳第二卡扣部38。
[0071]
内肋40比与内肋40相对布置的第二卡扣部38更短,即,第二卡扣部38从盖部22的第二壁区段28突出得比内肋40突出的更远。另外,内肋40沿内肋40的自由端的方向渐缩以便形成第三倾斜接合表面49,第三倾斜接合表面面向从盖部22的第二壁区段28在第二壁区段28的外圆周的区域中突出的并且与内肋40相对的第二卡扣部38。第三倾斜接合表面49基本上平行于设置在与内肋40相对布置的第二卡扣部38的突出部39上的第二抵接表面43延伸。在盖部22设有第二卡扣部38,该第二卡扣部被布置在第二壁区段28的内圆周的区域中以便与布置在底部24的第二壁区段32的外圆周的区域中的第一卡扣部38相互作用的情况下,形成在内肋40上的第三倾斜接合表面49可以面向从底部24的第二壁区段32在第二壁区段32的外圆周的区域中突出的并且与内肋40相对的第一卡扣部36。
[0072]
在闭合药物载体20时,即,在盖部22连接至底部24时,设置在第一卡扣部36的突出部37上的第一倾斜接合表面45与设置在第二卡扣部38的突出部39上的第二倾斜接合表面47相接触。当盖部22接近底部24时,第二倾斜接合表面47沿着第一倾斜接合表面45滑动,这
造成第一卡扣部36和第二卡扣部38的略微弹性变形。具体地,第一卡扣部38略微径向地向内弯曲,而第二卡扣部36略微径向地向外弯曲。然而,第一卡扣部38的向内弯曲由内肋40限制。另外,设置在内肋40上的第三倾斜接合表面49将第二卡扣部38引导到第二卡扣部38与内肋40之间限定的空隙中的最终位置,参见图3b。
[0073]
当盖部22和底部24已经到达其最终相对位置,即,当盖部22定位在底部24的顶上以便密封底部24的内部时,第一卡扣部36和第二卡扣部38的弹性变形被释放,并且设置在第一卡扣部36的突出部37上的第一抵接表面41抵接设置在第二卡扣部38的突出部39上的第二抵接表面43。第一抵接表面41与第二抵接表面43之间的相互作用阻止底部24和盖部22的分离。内肋40提供了闭合机构34的额外的机械稳定性和刚度。
[0074]
盖部22的第一壁区段26在由制造盖部22时到模具中的材料注入点所限定的中央区域中设有凹窝42,该凹窝具有的壁厚度大于第一壁区段26的其余部分的壁厚度、但仍小于盖部22的第二壁区段28的壁厚度。在凹窝42的内表面上压印数字,在附图中为数字“1”,以指示其中在多腔模制工具上模制盖部22的腔室。类似地,底部24的第一壁区段30在由制造底部24时到模具中的材料注入点所限定的中央区域中也设有凹窝44,该凹窝具有的壁厚度大于第一壁区段30的其余部分的壁厚度、但仍小于底部24的第二壁区段32的壁厚度。在凹窝44的内表面上压印数字(附图中未示出),以指示其中在多腔模制工具上模制底部24的腔室。
[0075]
如从图3a变得显而易见的,盖部22进一步设有多个内突出部46,该内突出部分别从第二壁区段28的内表面和内环40的内表面径向地向内突出。在附图中所示出的盖部22的具体实施例中,设置有三个内突出部46。然而还可设想到,对盖部22提供少于或大于三个内突出部46。内突出部46用于放置彼此上下堆叠的多个部22在操纵期间卡住。每个内突出部46包括鼻部48,该鼻部从内肋40突出并且进一步降低了彼此上下堆叠的部22卡住的风险。在附图中所展示的载体20的实施例中,只有盖部22设置有内突出部46。然而还可设想到,替代性地或另外,载体20的底部24也设有内突出部,如本文所描述的。
[0076]
最终,如从图3b变得显而易见的,底部24设有成角度凹口50,该成角度凹口在第二壁区段32的外表面的邻近于第一钩形卡扣部36的区域中形成、并且从钩形卡扣部38的外圆周朝向第二壁区段32的外表面径向地向外倾斜。在闭合载体20时意外地落到凹口50上的粉末可以被容易地去除。
[0077]
有利的是,药物载体展现出相应载体部的标准质量偏差为小于1mg、优选地小于0.8mg、更优选地小于0.6mg、甚至更优选地小于0.4mg、还更优选地小于0.3mg、还甚至更优选地小于0.2mg、并且最优选地小于0.1mg,如下文的实例部分所示。
[0078]
通过以下实施例进一步描述本发明。
[0079]
1.一种用于注射模制药物载体的配制品,其中所述配制品包含27%
‑
85%(w/w)的聚乙烯醇;以及10%
‑
60%(w/w)的选自玉米淀粉、小麦淀粉、及其组合的崩解助剂;以及任选地一种或多种赋形剂。
[0080]
2.如实施例1所述的配制品,其中所述聚乙烯醇是聚乙烯醇(4
‑
88)。
[0081]
3.如实施例1或2所述的配制品,其中所述配制品包含35%
‑
82%(w/w)聚乙烯醇,优选地40%
‑
80%(w/w)、更优选地45%
‑
75%(w/w)、更优选地50%
‑
70%(w/w)、更优选地55%
‑
68%(w/w)、更优选地60%
‑
65%(w/w)、并且最优选地约62%(w/w)的所述聚乙烯醇。
[0082]
4.如实施例1至3中任一项所述的配制品,其中所述配制品包含15%
‑
55%(w/w)、优选地17.5%
‑
50%(w/w)、优选地20%
‑
45%(w/w)、优选地22.5%
‑
40%(w/w)、优选地25%
‑
37.5%(w/w)、优选地27.5%
‑
35%(w/w)、甚至更优选地28%
‑
32%(w/w)、并且最优选地约30%的所述崩解助剂。
[0083]
5.如实施例1
‑
4中任一项所述的配制品,其中所述崩解助剂是玉米淀粉。
[0084]
6.如实施例1至5中任一项所述的配制品,其中所述赋形剂是选自由以下组成的清单的至少一种:润滑剂、加工助剂、着色剂、遮光剂、以及助流剂。
[0085]
7.如实施例6所述的配制品,其中所述配制品包含0.3%
‑
3.0%(w/w)的润滑剂,优选地0.5%
‑
2.8%(w/w)、更优选地1.0%
‑
2.6%(w/w)、更优选地1.2%
‑
2.6%(w/w)、更优选地1.4%
‑
2.4%(w/w)、更优选地1.6%
‑
2.2%(w/w)、更优选地1.8%
‑
2.1%(w/w)、并且最优选地约2%(w/w)的润滑剂。
[0086]
8.如实施例6或7所述的配制品,其中所述配制品包含润滑剂,其中所述润滑剂是硬脂酸或其盐之一如硬脂酸镁或硬脂酸钙、硬脂富马酸钠(ssf)、硬脂醇、氢化植物油、山萮酸甘油酯、或其任意组合;
[0087]
优选地,其中所述润滑剂是硬脂酸或其盐之一如硬脂酸镁或硬脂酸钙。
[0088]
9.如实施例6或7所述的配制品,其中所述配制品包含润滑剂,其中所述润滑剂是硬脂酸。
[0089]
10.如实施例6
‑
9中任一项所述的配制品,其中所述配制品包含5%
‑
14%(w/w)的加工助剂,优选地5%
‑
12%(w/w)、更优选地5%
‑
10%(w/w)、更优选地5%
‑
8%(w/w)、甚至更优选地5%
‑
6%(w/w)、并且最优选地约5%(w/w)的加工助剂。
[0090]
11.如实施例6
‑
10中任一项所述的配制品,其中所述配制品包含加工助剂,其中所述加工助剂是丙
‑2‑
二醇。
[0091]
12.如实施例6
‑
11中任一项所述的配制品,其中所述配制品包含着色剂和/或遮光剂,优选地,其中所述着色剂和/或遮光剂选自二氧化钛、氧化铁、色淀颜料、云母基颜料、配制颜料、及其任意组合。
[0092]
13.如实施例6
‑
12中任一项所述的配制品,其中所述配制品包含约1%(w/w)的量的着色剂和/或遮光剂。
[0093]
14.如实施例6
‑
13中任一项所述的配制品,其中所述配制品包含助流剂,特别地其中所述助流剂是胶体二氧化硅。
[0094]
15.如实施例1
‑
14中任一项所述的配制品,所述配制品包含60%
‑
65%(w/w)聚乙烯醇(4
‑
88)、28%
‑
32%(w/w)的玉米淀粉、1.8%
‑
2.1%(w/w)的硬脂酸、以及5%
‑
6%(w/w)的丙
‑2‑
二醇。
[0095]
16.一种生产药物载体的方法,所述方法包括以下步骤:
[0096]
(a)将根据实施例1
‑
15中任一项所述的配制品熔融,以及
[0097]
(b)将熔体注入模具中。
[0098]
17.如实施例16所述的方法,所述方法进一步包括以下步骤
[0099]
(c)将所注入的熔体冷却并且任选地将所模制的材料弹出。
[0100]
18.如实施例16或实施例17所述的方法,其中药物载体(20)是胶囊,并且形成至少一个盖部(22)和至少一个底部(24)。
[0101]
19.如实施例18所述的方法,其中所述盖部(22)和所述底部(24)中的至少一者具有厚度为180
‑
250μm、优选地185
‑
225μm、并且甚至更优选地190
‑
220μm的第一壁区段(26,30),以及厚度为350
‑
450μm、优选地375
‑
425μm、更优选地390
‑
410μm、并且最优选地约400μm的第二壁区段(28,32)。
[0102]
20.如实施例18所述的方法,其中所述盖部(22)的第一壁区段(26)限定所述盖部(22)的整个顶部分,和/或其中所述底部(24)的第一壁区段(30)限定所述底部(24)的整个底部分。
[0103]
21.如实施例18
‑
20中任一项所述的方法,其中所述药物载体(20)被设计成使得所述盖部和底部(22,24)的横向延伸量与组装好的盖部和底部(22,24)的高度之比是>1、优选地≥1.4、更优选地≥1.5、甚至更优选地≥2、最优选地≥2.4、并且特别地≥2.5。
[0104]
22.如实施例18
‑
21中任一项所述的方法,其中所述盖部(22)和所述底部(24)通过互补的闭合机构(34)彼此连接;
[0105]
特别地其中所述闭合机构(34)包括第一卡扣部(36),所述第一卡扣部从所述底部(24)的第二壁区段(32)突出以便面向第二卡扣部(38)并与之相互作用,所述第二卡扣部从所述盖部(22)的第二壁区段(28)突出;
[0106]
更特别地其中所述第一卡扣部(36)包括突出部(37),所述突出部被适配成与设置在所述第二卡扣部(38)上的对应突出部(39)相接合,以便阻止所述第一卡扣部(36)和所述第二卡扣部(38)的分离、并且因此防止所述盖部(22)和所述底部(24)的分离;
[0107]
甚至更特别地其中设置在所述第一卡扣部(36)上的突出部(37)沿所述第一卡扣部(36)的自由端的方向渐缩,以便形成第一倾斜接合表面(45),所述第一倾斜接合表面被适配成与第二倾斜接合表面(47)相接合,所述第二倾斜接合表面在设置在所述第二卡扣部(38)上的、沿所述第二卡扣部(36)的自由端的方向渐缩的突出部(39)上形成;
[0108]
最优选地其中所述第一和第二卡扣部(36,38)中的一者从所述盖部(22)或所述底部(24)的第二壁区段(28,32)、在所述第二壁区段(28,32)的内圆周的区域中突出,并且其中,所述第一和第二卡扣部(36,38)中的另一者从所述盖部(22)或所述底部(24)的第二壁区段(28,32)、在所述第二壁区段(28,32)的外圆周的区域中突出。
[0109]
23.如实施例22所述的方法,其中所述闭合机构(34)进一步包括内肋(40),所述内肋从所述盖部(22)或所述底部(24)的第二壁区段(28)在所述第二壁区段(28,32)的内圆周的区域中、在距从所述盖部(22)或所述底部(24)的第二壁区段(28,32)在所述第二壁区段(28,32)的外圆周的区域中突出的所述第一或第二卡扣部(36,38)一定距离处突出;
[0110]
特别地其中所述内肋(40)沿所述内肋(40)的自由端的方向渐缩,以便形成第三倾斜接合表面(49),所述第三倾斜接合表面面向从所述盖部(22)或所述底部(24)的第二壁区段(28,32)在所述第二壁区段(28,32)的外圆周的区域中突出的所述第一或第二卡扣部(36,38)。
[0111]
24.如实施例18
‑
23中任一项所述的方法,其中所述药物载体(20)填充有纯api。
[0112]
25.如实施例18所述的方法,其中所述盖部(22)和所述底部(24)中的至少一者具有厚度为180
‑
250μm、优选地185
‑
225μm、并且甚至更优选地190
‑
220μm的第一壁区段(26,30),以及厚度为350
‑
450μm、优选地375
‑
425μm、更优选地390
‑
410μm、并且最优选地约400μm的第二壁区段(28,32),其中所述盖部(22)的第一壁区段(26)限定所述盖部(22)的整个顶
部分,和/或其中所述底部(24)的第一壁区段(30)限定所述底部(24)的整个底部分,并且其中所述药物载体(20)被设计成使得所述盖部和底部(22,24)的横向延伸量与组装好的盖部和底部(22,24)的高度之比是>1、优选地≥1.4、更优选地≥1.5、甚至更优选地≥2、最优选地≥2.4、并且特别地≥2.5。
[0113]
26.如实施例16
‑
25中任一项所述的方法,所述方法进一步包括步骤(d):将所述载体部按模腔分类。
[0114]
27.一种通过如实施例16
‑
26中任一项所述的方法使用如实施例1
‑
15中任一项所述的配制品生产的药物载体,所述药物载体包括:
[0115]
‑
盖部(22);以及
[0116]
‑
底部(24),
[0117]
其中所述盖部(22)和所述底部(24)中的至少一者具有厚度为180
‑
250μm、优选地185
‑
225μm、并且甚至更优选地190
‑
220μm的第一壁区段(26,30),以及厚度为350
‑
450μm、优选地375
‑
425μm、更优选地390
‑
410μm、并且最优选地约400μm的第二壁区段(28,32)。
[0118]
28.如实施例27所述的药物载体,其中药物载体(20)被设计成使得所述盖部和底部(22,24)的横向延伸量与组装好的盖部和底部(22,24)的高度之比是>1、优选地≥1.4、更优选地≥1.5、甚至更优选地≥2、最优选地≥2.4、并且特别地≥2.5。
[0119]
29.如实施例27或28所述的药物载体,其中所述盖部(22)的第一壁区段(26)限定所述盖部(22)的顶部分的至少一部分、特别是所述盖部(22)的整个顶部分。
[0120]
30.如实施例27
‑
29中任一项所述的药物载体,其中所述盖部(22)的第二壁区段(28)限定所述盖部(22)的侧壁部分的至少一部分,所述至少一部分特别地从所述盖部(22)的第一壁区段(26)沿着其外圆周朝所述底部(24)的方向延伸。
[0121]
31.如实施例27
‑
30中任一项所述的药物载体,其中所述底部(24)的第一壁区段(30)限定所述底部(24)的底部分的至少一部分、特别是所述底部(24)的整个底部分。
[0122]
32.如实施例27
‑
31中任一项所述的药物载体,其中所述底部(24)的第二壁区段(32)限定所述底部(24)的侧壁部分的至少一部分,所述至少一部分特别地从所述底部(24)的底部分沿着其外圆周朝所述盖部(22)的方向延伸。
[0123]
33.如实施例27
‑
32中任一项所述的药物载体,其中所述盖部(22)和所述底部(24)通过互补的闭合机构(34)彼此连接。
[0124]
34.如实施例33所述的药物载体,其中所述闭合机构(34)包括第一卡扣部(36),所述第一卡扣部从所述底部(24)的第二壁区段(32)突出以便面向第二卡扣部(38)并与之相互作用,所述第二卡扣部从所述盖部(22)的第二壁区段(28)突出。
[0125]
35.如实施例34所述的药物载体,其中所述第一卡扣部(36)包括突出部(37),所述突出部被适配成与设置在所述第二卡扣部(38)上的对应突出部(39)相接合,以便阻止所述第一卡扣部(36)和所述第二卡扣部(38)的分离、并且因此防止所述盖部(22)和所述底部(24)的分离。
[0126]
36.如实施例35所述的药物载体,其中设置在所述第一卡扣部(36)上的突出部(37)沿所述第一卡扣部(36)的自由端的方向渐缩,以便形成第一倾斜接合表面(45),所述第一倾斜接合表面被适配成与第二倾斜接合表面(47)相接合,所述第二倾斜接合表面在设置在所述第二卡扣部(38)上的、沿所述第二卡扣部(38)的自由端的方向渐缩的突出部(39)
上形成。
[0127]
37.如实施例34至36中任一项所述的药物载体,其中所述第一和第二卡扣部(36,38)中的一者从所述盖部(22)或所述底部(24)的第二壁区段(28,32)、在所述第二壁区段(28,32)的内圆周的区域中突出,并且其中所述第一和第二卡扣部(36,38)中的另一者从所述盖部(22)或所述底部(24)的第二壁区段(28,32)、在沿所述第二壁区段(28,32)的外圆周的区域中突出。
[0128]
38.如实施例34至37中任一项所述的药物载体,其中所述闭合机构(34)进一步包括内肋(40),所述内肋从所述盖部(22)或所述底部(24)的第二壁区段(28,32)在所述第二壁区段(28)的内圆周的区域中、在距从所述盖部(22)或所述底部(24)的第二壁区段(28,32)在所述第二壁区段(28,32)的外圆周的区域中突出的所述第一或第二卡扣部(36,38)一定距离处突出。
[0129]
39.如实施例38所述的药物载体,其中所述内肋(40)沿所述内肋(40)的自由端的方向渐缩,以便形成第三倾斜接合表面(49),所述第三倾斜接合表面面向从所述盖部(22)或所述底部(24)的第二壁区段(28,32)在所述第二壁区段(28,32)的外圆周的区域中突出的所述第一或第二卡扣部(36,38)。
[0130]
40.如实施例27至39中任一项所述的药物载体,其中所述盖部(22)的第一壁区段(26)、特别是在由制造所述盖部(22)时到模具中的材料注入点所限定的区域中设有凹窝(42),所述凹窝具有的壁厚度大于所述第一壁区段(26)的其余部分的壁厚度、但是小于所述盖部(22)的第二壁区段(28)的壁厚度,特别是在所述凹窝(42)的内表面上压印标记,所述标记指示了其中在多腔模制工具上模制所述盖部(22)的腔室,和/或
[0131]
其中所述底部(24)的第一壁区段(30)、特别是在由制造所述底部(24)时到模具中的材料注入点所限定的区域中设有凹窝(44),所述凹窝具有的壁厚度大于所述第一壁区段(30)的其余部分的壁厚度、但是小于所述底部(24)的第二壁区段(32)的壁厚度,在所述凹窝(44)的内表面上压印标记,所述标记指示了其中在多腔模制工具上模制所述底部(24)的腔室。
[0132]
41.如实施例27至40中任一项所述的药物载体,其中所述盖部(22)和所述底部(24)中的至少一者在其内表面的区域中设有多个内突出部(46),所述内突出部从所述第二壁区段(28,32)的内表面和/或所述内肋(40)的内表面径向地向内突出,所述内突出部(46)各自特别地包括突出鼻部(48),所述突出鼻部突出超过所述第二壁区段(28,32)和/或所述内肋(40)。
[0133]
42.如实施例27
‑
41中任一项所述的药物载体,其展现出相应载体部的绝对标准质量偏差为小于1mg、优选地小于0.8mg、更优选地小于0.6mg、甚至更优选地小于0.4mg、还更优选地小于0.3mg、还甚至更优选地小于0.2mg、并且最优选地小于0.1mg。
[0134]
43.如实施例27
‑
42中任一项所述的药物载体,其中所述药物载体在15分钟内展现出至少80%、优选地至少85%、更优选地至少90%、并且最优选地至少95%的药物物质的溶解速率;当使用美国药典2011,章节<711>中所描述的“对立即释放的测定”,使用usp设备i(篮法)和禁食状态模拟胃液(fassgf)在37℃和100rpm下以n=3个胶囊以及普萘洛尔.hcl作为测试物质测试时。
[0135]
44.如实施例27
‑
43中任一项所述的药物载体,其中所述药物载体填充有活性药物
成分(api),所述活性药物成分包含至多5%(w/w)、优选地至多4%(w/w)、更优选地至多3%(w/w)、甚至更优选地至多2%(w/w)、并且最优选地至多1%(w/w)的添加剂。
[0136]
45.一种通过如实施例16
‑
26中任一项所述的方法使用如实施例1
‑
15中任一项所述的配制品生产的药物载体,所述药物载体包括:
[0137]
‑
盖部(22);以及
[0138]
‑
底部(24),其中所述盖部(22)和所述底部(24)中的至少一者具有厚度为180
‑
250μm、优选地185
‑
225μm、并且甚至更优选地190
‑
220μm的第一壁区段(26,30),以及厚度为350
‑
450μm、优选地375
‑
425μm、更优选地390
‑
410μm、并且最优选地约400μm的第二壁区段(28,32),其中,所述盖部(22)的第一壁区段(26)限定所述盖部(22)的整个顶部分,和/或其中,所述底部(24)的第一壁区段(30)限定所述底部(24)的整个底部分,并且
[0139]
其中所述药物载体(20)被设计成使得所述盖部和底部(22,24)的横向延伸量与组装好的盖部和底部(22,24)的高度之比是>1、优选地≥1.4、更优选地≥1.5、甚至更优选地≥2、最优选地≥2.4并且特别地≥2.5。
[0140]
在下文中,通过以下实例来进一步展示实施例中定义的本发明,这些实例不旨在限制本发明的范围。本文引用的所有参考文献通过援引明确地并入。
[0141]
实例
[0142]
实例1
[0143]
在第一轮筛选中,研究了不同的初级基质形成剂。为了适合用作用于注射模制药物载体的配制品中的初级基质形成剂,初级基质形成剂本身或与其他载体壳组分的组合必须可经由热熔挤出和注射模制加工,为胶囊壳提供足够的机械强度并提供适当的药物释放。
[0144]
例如,在整体质量和模具的不同温度下测试eudragit e。观察到eudragit e显示出粘性行为,导致模具堵塞,即使当与增塑剂和其他第二基质形成剂一起配制时。焦糖化的麦芽糖糊精和羟丙基纤维素(hpc)在注射模制期间导致发泡和堵塞。另外,在注射模制工艺中不能适当地应用povacoat。单独的淀粉,例如豌豆淀粉、羟丙基豌豆淀粉、马铃薯淀粉、玉米或小麦淀粉在热熔挤出之后产生差的线料品质。在马铃薯淀粉的情况下,该物质是胶状的,并且对于其他淀粉,老化导致脆性。
[0145]
出人意料地,发现聚乙烯醇是可行的,特别是在与硬脂酸和丙
‑2‑
二醇(丙二醇)的混合物中。早期的配制品包含61.4%(w/w)聚乙烯醇pvoh(4
‑
88)、21.9%(w/w)滑石、2%(w/w)硬脂酸和15%(w/w)丙
‑2‑
二醇。我们还测试了这种无滑石的早期配制品,并且发现它效果良好。然而,溶解数据给出最高达10分钟的滞后时间。
[0146]
为了使pvoh配制品不仅适用于注射模制,而且特别适用于注射模制药物载体,本发明的诸位发明人测试了与不同成孔剂/崩解助剂组合的pvoh配制品。评价测试配制品在注射模制中的可加工性、稳定性、机械特性、以及溶解速率。
[0147]
通过在25℃和60%的室内湿度、30℃和75%的室内湿度、或40℃和75%的室内湿度下储存通过注射模制由测试配制品制备的药物载体,来测试稳定性。3个月和6个月之后通过光学检查来检查载体的变形、相分离等。
[0148]
可以使用如美国药典2011,章节<711>中所描述的“对立即释放的测定”确定胶囊的溶解速率。该测定使用usp设备ii(桨法)和禁食状态模拟胃液(fassgf;可商购)在37℃和
50rpm下以n=3个胶囊来进行。在一个实施例中,药物载体在5分钟内展现出至少30%、优选地至少40%、更优选地至少50%、更优选地至少60%、更优选地至少65%、并且最优选地至少70%药品物质的溶解速率;例如使用普萘洛尔.hcl作为测试物颀。
[0149]
可以使用本领域公知的标准化测定测试经由刺穿力和快速打开测量确定的机械强度。通过配备有限定表面积的平面销的质构分析仪测量刺穿力,该平面销向载体部施加压力直至材料失效并被刺穿。由压力和销表面积计算力。还可以测量机械强度高的配制品的“快速打开”力。在这些测量中,将空的闭合载体放置在标准片剂破碎机中,并且测量载体快速打开时的力。
[0150]
结果示出于下表中。
[0151][0152]
这些前述筛选研究示出,pvoh(4
‑
88)与玉米淀粉或小麦淀粉组合具有最适合的特性用于注射模制药物载体。从该初始数据开始,测试几种配制品,并发现其适用于通过注射模制制备药物载体。配制品(a)至(o)是此类配制品的实例,其被发现是合适的。
[0153][0154][0155]
进一步的测试揭示了特定的均衡配制品(1),其还被用于以下实验中。
[0156]
配制品(1)
[0157][0158]
配制品(1)可以适合应用于生产药物载体,如图1
‑
3中所示例的。
[0159]
实例2
[0160]
使用以上配制品(1)通过注射模制制备如图1中所示出的12mm标准prescido
tm
载体。
[0161]
为了对比,使用包含聚环氧乙烷(peo)作为基质形成剂而不是pvoh的配制品,通过注射模制来制备如图1中所示出的12mm标准prescido
tm
载体。peo配制品包含73.5%(w/w)polyox n10、20%(w/w)polyox n80、5%(w/w)滑石、以及1.5%(w/w)赋形剂。
[0162]
然后将载体各自用相同量的模型纯api(api
‑
1)填充,并在应力条件下在50℃/75%rh下在闭合和打开状态下储存十二周。4、8和12周之后取样并测试api
‑
1的降解,表示为与单独的api
‑
1相比的%api
‑
1。结果示于图4中。
[0163]
图4a示出了载体在闭合状态下的稳定性研究。对照(单独的api
‑
1)是最上面的具有空心圆圈的图。pvoh载体(实心圆圈)在应力条件下经储存十二周维持api
‑
1的稳定性。在研究结束时,载体仍然含有适当超过98%的api
‑
1,即使pvoh配制品不含有任何抗氧化剂。相比之下,peo载体(1)(实心菱形)、(2)(实心方块)、或(3)(实心三角形)示出显著更高的api
‑
1降解(4周之后小于97%;12周之后小于96%)。
[0164]
图4b示出了载体在打开状态下的稳定性研究。对照(单独的api
‑
1)是最上面的具有空心圆圈的图。pvoh载体(实心圆圈)在应力条件下经储存十二周维持api
‑
1的稳定性。在研究结束时,载体仍然含有适当超过99%的api
‑
1。相比之下,peo载体(1)(实心菱形)、(2)(实心方块)、或(3)(实心三角形)示出显著更高的api
‑
1降解(4周之后小于98%;8周之后小于97%;12周之后小于96%)。
[0165]
出人意料地,发现由本披露的用于注射模制的pvoh配制品制备的药物载体比由用于注射模制的peo配制品制备的相当的载体更好地维持api
‑
1的稳定性。
[0166]
实例3
[0167]
使用以上配制品(1)通过注射模制制备如图1中所示出的12mm标准prescido
tm
载体。
[0168]
为了对比,使用包含61.4%(w/w)聚乙烯醇pvoh(4
‑
88)、21.9%(w/w)滑石、2%(w/w)硬脂酸、以及15%(w/w)丙
‑2‑
二醇的历史pvoh配制品通过注射模制来制备如图1中所示出的12mm标准prescido
tm
载体。
[0169]
此外,使用包含73.5%(w/w)polyox n10、20%(w/w)polyoxn80、5%(w/w)滑石、以及1.5%(w/w)赋形剂(包括抗氧化剂)的peo配制品,通过注射模制来制备如图1中所示出的12mm标准prescido
tm
载体。
[0170]
然后将载体各自用相同量的模型纯api(api
‑
1)填充,并在应力条件下在50℃/75%rh下在闭合和打开状态下储存四周。4周之后取样并测试api
‑
1的降解,表示为与单独的api
‑
1相比的%api
‑
1。结果示于图5中。
[0171]
图5a示出了载体在打开状态下的稳定性研究。对照(单独的api
‑
1)示出为最上面的各自具有空心圆圈的虚线和实线。由配制品(1)所制备的pvoh载体(实线,实心圆圈)在应力条件下经储存四周维持api
‑
1的稳定性。在研究结束时,载体仍然含有适当超过99.7%的api
‑
1。相比之下,peo载体(虚线,空心方块)和由历史配制品所制备的pvoh载体(虚线,实心圆圈)示出较高的api
‑
1降解(4周之后小于99%)。
[0172]
图5b示出了载体在闭合状态下的稳定性研究。对照(单独的api
‑
1)示出为最上面的各自具有空心圆圈的虚线和实线。由配制品(1)所制备的pvoh载体(实线,实心圆圈)在应力条件下经储存四周维持api
‑
1的稳定性。在研究结束时,载体仍然含有适当超过99.3%的api
‑
1。相比之下,peo载体(虚线,空心方块)和由历史配制品所制备的pvoh载体(虚线,实心圆圈)示出较高的api
‑
1降解(4周之后小于99%)。
[0173]
该对比实例示出有利效果是由于pvoh和玉米淀粉的组合,而不是由于选择pvoh作为初级基质形成剂本身。
[0174]
实例4
[0175]
使用以上配制品(1)通过注射模制制备如图1中所示出的12mm标准prescido
tm
载体。
[0176]
为了对比,使用包含聚环氧乙烷(peo)作为基质形成剂而不是pvoh的配制品,通过注射模制来制备如图1中所示出的12mm标准prescido
tm
载体。peo配制品包含73.5%(w/w)polyox n10、20%(w/w)polyox n80、5%(w/w)滑石、以及1.5%(w/w)赋形剂。
[0177]
然后将载体各自用相同量的不同模型纯api(api
‑
2)填充,并在应力条件下在50℃/75%rh下在闭合和打开状态下储存十二周。4、8和12周之后取样并测试api
‑
2的降解,表示为与单独的api
‑
2相比的%api
‑
2。结果示于图6中。
[0178]
图6a示出了载体在闭合状态下的稳定性研究。对照(单独的api
‑
2)是具有空心圆圈的图。pvoh载体(实心圆圈)在应力条件下经储存十二周维持api
‑
2的稳定性。在研究结束时,载体含有与对照相当的量的api
‑
2。相比之下,peo载体(1)(实心菱形)、(2)(实心方块)、或(3)(实心三角形)示出api
‑
2的轻微降解。
[0179]
图6b示出了载体在打开状态下的稳定性研究。对照(单独的api
‑
2)是具有空心圆圈的图。pvoh载体(实心圆圈)在应力条件下经储存十二周维持api
‑
2的稳定性。在研究结束时,载体含有与对照相当的量的api
‑
2。相比之下,peo载体(1)(实心菱形)、(2)(实心方块)、或(3)(实心三角形)示出api
‑
2的轻微降解。
[0180]
出人意料地,发现由本披露的用于注射模制的pvoh配制品制备的药物载体比由用于注射模制的peo配制品制备的可比较的载体更好地维持api
‑
2的稳定性。
[0181]
实例5
[0182]
使用包含62%(w/w)聚乙烯醇pvoh(4
‑
88)、30%(w/w)玉米淀粉、2%(w/w)硬脂酸、5%(w/w)丙
‑2‑
二醇、以及1%赋形剂的配制品(1),通过注射模制来制备药物载体。
[0183]
作为对比实例,使用包含65%(w/w)聚乙烯醇pvoh(4
‑
88)、12%(w/w)丙
‑2‑
二醇、15%(w/w)caco3、5%(w/w)滑石、2%(w/w)硬脂酸、以及1%赋形剂的pvoh配制品,通过注射模制来制备药物载体。
[0184]
作为还另一对比实例,使用硬明胶胶囊。将胶囊各自直接用普萘洛尔.hcl填充,而不添加另外的赋形剂。使用如美国药典2011,章节<711>中所描述的“对立即释放的测定”确定胶囊的溶解速率。该测定使用usp设备i(篮法)和禁食状态模拟胃液(fassgf;可商购)在37℃和100rpm下在900ml体积中进行。获得以下数据:
[0185]
[0186][0187]
结果示出,由本披露的配制品所制备的注射模制载体的溶解曲线类似于工业标准硬明胶胶囊(hgc),给出api的快速且完全释放。相比之下,由pvoh所制备的并且在该具体实例中与吸湿性盐(碳酸钙)一起配制的胶囊显示出显著的滞后时间。15分钟之后,释放小于50%的api。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1