抗CD117抗体及其用途的制作方法
抗cd117抗体及其用途
1.相关申请
2.本技术要求于2019年4月24日提交的美国临时申请号62/838,264和于2019年5月1日提交的美国临时申请号62/841,733的优先权。每个前述优先权申请的内容通过引用并入本文。
3.序列表
4.本技术包含以ascii格式电子提交的序列表,并通过引用整体并入本文。所述ascii副本创建于2020年4月20日,命名为m103034_2150wo_sl.txt,且大小为186,529字节。
技术领域
5.本公开涉及抗cd117抗体、抗体药物缀合物(adc)及其抗原结合片段,以及通过施用能够结合由造血细胞,诸如造血干细胞表达的抗原的抗体或抗体药物缀合物(adc)来治疗患有各种病理学诸如血液疾病、代谢病症、癌症和自身免疫性疾病等的患者的方法。
背景技术:
6.尽管医药领域取得了进步,但仍需要治疗造血系统的病理学,诸如特定血细胞的疾病、代谢病症、癌症和自身免疫性病症等。虽然造血干细胞具有相当大的治疗潜力,但是阻碍其在临床中使用的限制是与确保造血干细胞移植物在宿主中的植入相关的困难。
7.目前需要靶向特定内源性干细胞的组合物,其可用作调理剂(conditioning agent)以促进外源性造血干细胞移植物的植入,从而使得这些细胞的多潜能性和造血功能性在移植后保留在患者体内。
8.cd117(也称为c-kit或干细胞因子受体(stem cell factor receptor,scrf))是一种单跨膜受体酪氨酸激酶,其结合配体干细胞因子(stem cell factor,scf)。scf诱导ckit的同源二聚化,这激活其酪氨酸激酶活性并通过pi3-akt和mapk途径两者发出信号(kindblom et al.,am j.path.1998152(5):1259)。
9.cd117最初是作为致癌基因发现的,并且已在肿瘤学领域研究(参见例如stankov et al.(2014)curr pharm des.20(17):2849-80)。目前正在研究针对cd117的抗体药物缀合物(ktn0158),用于治疗难治性胃肠道间质瘤(gist)(例如,“ktn0158,a humanized anti-kit monoclonal antibody,demonstrates biologic activity against both normal and malignant canine mast cells”london et al.(2016)clin cancer res doi:10.1158/1078-0432.ccr-16-2152)。
10.cd117在造血干细胞(hsc)上高度表达。这种表达模式使cd117成为极其多种疾病间调理的潜在靶标。然而,对于有效调理患者以便于移植(诸如骨髓移植)的基于抗cd117的疗法仍有需求。
技术实现要素:
11.本文描述了特异性结合人cd117(也称为c-kit)的抗体及其抗原结合部分,以及使
用所述抗体的组合物和方法。特别地,本文所述的抗体和片段可用于抗cd117抗体药物缀合物(adc)。
12.在一个实施方案中,本公开提供用于直接治疗各种造血系统病症、代谢病症、癌症和自体免疫疾病等的组合物和方法。本公开的特征还在于用于在接受造血干细胞移植物治疗之前调理患者(诸如人类患者)以促进造血干细胞移植物的植入的方法。该患者可以是患有一种或多种血液病症,诸如血红蛋白病或其它造血病理学,因此需要造血干细胞移植的患者。如本文所述,造血干细胞能够分化成造血谱系中的多种细胞类型,并且可以施用于患者以增殖(populate)或再殖患者中缺乏的细胞类型。本公开的特征在于用抗体和抗体药物缀合物(adc)治疗患者的方法,该抗体和抗体药物缀合物(adc)能够结合由造血细胞表达的蛋白质,诸如cd117(包括,例如,gnnk+cd117),以便(i)通过选择性地耗尽表达cd117的细胞群体,诸如异常血细胞、癌细胞或自身免疫细胞,来直接治疗疾病,诸如血液病症、代谢疾病、癌症或自身免疫性疾病等本文所述的疾病,和/或(ii)耗尽患者体内的内源性造血干细胞群体。前者的活性使得能够直接治疗与造血谱系细胞相关的极其多种病症,因为cd117可由癌性细胞(诸如白血病细胞)、自身免疫淋巴细胞(诸如表达与自身抗原交叉反应的t细胞受体的t细胞)等细胞类型表达。后者的活性,即造血干细胞的选择性耗尽,继而创建一个空缺(vacancy),该空缺随后可以通过移植外源性(例如,自体、同种异体或同基因)造血干细胞移植物来填充。因此,本公开提供了治疗多种造血病况诸如镰状细胞性贫血、地中海贫血、范可尼贫血(fanconi anemia)、威斯科特-奥尔德里奇二氏(wiskott-aldrich)综合征、腺苷脱氨酶缺乏症-重症综合性免疫缺陷(adenosine deaminase deficiency-severe combined immunodeficiency)、异染性脑白质营养不良(metachromatic leukodystrophy)、戴-布二氏(diamond-blackfan)贫血和舒-戴二氏(schwachman-diamond)综合征,人免疫缺陷病毒感染和获得性免疫缺陷综合征,以及癌症和自身免疫性疾病等的方法。
13.在一个方面,本公开提供了一种分离的抗cd117抗体或其抗原结合片段,其在seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少两个处与人cd117结合。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少三个结合。在另一个实施方案中,该分离的抗cd117抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少四个结合。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少五个结合。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少六个结合。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少7个结合。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的每一个结合。
14.在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2约80%相同的氨基酸序列,轻链可变区具有与
seq id no:6约80%相同的氨基酸序列。在另一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2至少80%相同的氨基酸序列,轻链可变区具有与seq id no:6至少80%相同的氨基酸序列。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2约85%相同的氨基酸序列,轻链可变区具有与seq id no:6约85%相同的氨基酸序列。在另一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2至少85%相同的氨基酸序列,轻链可变区具有与seq id no:6至少85%相同的氨基酸序列。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2约90%相同的氨基酸序列,轻链可变区具有与seq id no:6约90%相同的氨基酸序列。在另一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2至少90%相同的氨基酸序列,轻链可变区具有与seq id no:6至少90%相同的氨基酸序列。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2约95%相同的氨基酸序列,轻链可变区具有与seq id no:6约95%相同的氨基酸序列。在另一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2至少95%相同的氨基酸序列,轻链可变区具有与seq id no:6至少95%相同的氨基酸序列。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2约96%相同的氨基酸序列,轻链可变区具有与seq id no:6约96%相同的氨基酸序列。在另一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2至少96%相同的氨基酸序列,轻链可变区具有与seq id no:6至少96%相同的氨基酸序列。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2约97%相同的氨基酸序列,轻链可变区具有与seq id no:6约97%相同的氨基酸序列。在另一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2至少97%相同的氨基酸序列,轻链可变区具有与seq id no:6至少97%相同的氨基酸序列。在一个实施方案中,分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2约98%相同的氨基酸序列,轻链可变区具有与seq id no:6约98%相同的氨基酸序列。在另一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2至少98%相同的氨基酸序列,轻链可变区具有与seq id no:6至少98%相同的氨基酸序列。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2约99%相同的氨基酸序列,轻链可变区具有与seq id no:6约99%相同的氨基酸序列。在另一个实施方案中,该分离的抗cd117抗体或其抗原结合片段包含重链可变区和轻链可变区,重链可变区具有与seq id no:2至少99%相同的氨基酸序列,轻链可变区具有与seq id no:6至少99%相同的氨基酸序列。
15.在另一方面,本公开涉及一种能够结合cd117的抗体或其抗原结合片段,其结合cd117中的表位,该表位包含seq id no:1的cd117的氨基酸残基t67、k69、t71、s81、y83、
t114、t119和k129中的至少两个、至少三个、至少四个、至少五个、至少六个、至少七个或全部。
16.在一个方面,本公开提供了一种能够结合cd117的分离的抗cd117抗体或其抗原结合片段,其与具有在seq id no:1的至少氨基酸67-83和114-129内的氨基酸残基的表位结合。
17.在另一方面,本公开提供了一种能够结合cd117的分离的抗cd117抗体或其抗原结合片段,其与cd117中的表位结合,该表位包含seq id no:1的cd117的氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的两个、三个、四个、五个、六个、七个或全部。
18.在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:2和seq id no:6中所示的cdr或可变区。在另一个实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:22和seq id no:26中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:30和seq id no:31中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:32和seq id no:33中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:34和seq id no:35中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:36和seq id no:37中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:38和seq id no:39中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:40和seq id no:41中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:42和seq id no:43中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:44和seq id no:45中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:46和seq id no:47中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:48和seq id no:49中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:50和seq id no:51中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:52和seq id no:53中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:54和seq id no:55中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:56和seq id no:57中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:58和seq id no:59中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:60和seq id no:61中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:62和seq id no:63中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:64和seq id no:65中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:66和seq id no:67中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:68和seq id no:69中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:70和seq id no:71中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:72和seq id no:73中所示的cdr或可变区。在某些实
施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:74和seq id no:75中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:76和seq id no:77中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:78和seq id no:79中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:80和seq id no:81中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:82和seq id no:83中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:84和seq id no:85中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:86和seq id no:87中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:88和seq id no:89中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:90和seq id no:91中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:92和seq id no:93中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:94和seq id no:95中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:96和seq id no:97中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:98和seq id no:99中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:100和seq id no:101中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:102和seq id no:103中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:104和seq id no:105中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:106和seq id no:107中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:108和seq id no:109中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:110和seq id no:111中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:112和seq id no:113中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:114和seq id no:115中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:116和seq id no:117中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:118和seq id no:119中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:120和seq id no:121中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:122和seq id no:123中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:124和seq id no:125中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:126和seq id no:127中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:128和seq id no:129中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:130和seq id no:131中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:132和seq id no:133中所示的cdr或可变区。在某
些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:134和seq id no:135中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:136和seq id no:137中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:138和seq id no:139中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:140和seq id no:141中所示的cdr或可变区。在某些实施方案中,该抗cd117抗体或其抗原结合片段不包含seq id no:142和seq id no:143中所示的cdr或可变区。在另一个实施方案中,该抗cd117抗体或其抗原结合片段是拮抗性的。
19.在另一方面,本公开提供了一种包含分离的抗cd117抗体或其抗原结合片段的药物组合物,其中,当与cd117结合时,该抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少两个结合,并阻断或抑制cd117的生物活性。在一个实施方案中,该抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少三个结合,并阻断或抑制cd117的生物活性。在另一个实施方案中,该抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少四个结合,并阻断或抑制cd117的生物活性。在一些实施方案中,该抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少五个结合,并阻断或抑制cd117的生物活性。在另一个实施方案中,该抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少六个结合,并阻断或抑制cd117的生物活性。在另一个实施方案中,该抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少七个结合,并阻断或抑制cd117的生物活性。在其它实施方案中,该抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的每一个结合,并阻断或抑制cd117的生物活性。
20.在一个方面,本公开提供了一种分离的抗cd117抗体或其抗原结合片段,其在seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少两个处与人cd117结合,其中该分离的抗cd117抗体或其抗原结合片段不具有以下重链可变区和轻链可变区,该重链可变区包含含有如seq id no:3中所示氨基酸序列的cdr1结构域、含有如seq id no:4中所示氨基酸序列的cdr2结构域和含有如seq id no:5中所示氨基酸序列的cdr3结构域;该轻链可变区包含含有如seq id no:7中所示氨基酸序列的cdr1结构域、含有如seq id no:8中所示氨基酸序列的cdr2结构域和含有如seq id no:9中所示氨基酸序列的cdr3结构域。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少三个结合,其中该分离的抗cd117抗体或其抗原结合片段不具有以下重链可变区和轻链可变区,该重链可变区包含含有如seq id no:3中所示氨基酸序列的cdr1结构域、含有如seq id no:4中所示氨基酸序列的cdr2结构域和含有如seq id no:5中所示氨基酸序列的cdr3结构域;该轻链可变区包含含有如seq id no:7中所示氨基酸序列的cdr1结构域、含有如seq id no:8中所示氨基酸序列的cdr2结构域和含有如seq id no:9中所示氨基酸序
列的cdr3结构域。在另一个实施方案中,该分离的抗cd117抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少四个结合,其中该分离的抗cd117抗体或其抗原结合片段不具有以下重链可变区和轻链可变区,该重链可变区包含含有如seq id no:3中所示氨基酸序列的cdr1结构域、含有如seq id no:4中所示氨基酸序列的cdr2结构域和含有如seq id no:5中所示氨基酸序列的cdr3结构域;该轻链可变区包含含有如seq id no:7中所示氨基酸序列的cdr1结构域、含有如seq id no:8中所示氨基酸序列的cdr2结构域和含有如seq id no:9中所示氨基酸序列的cdr3结构域。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少五个结合,其中该分离的抗cd117抗体或其抗原结合片段不具有以下重链可变区和轻链可变区,该重链可变区包含含有如seq id no:3中所示氨基酸序列的cdr1结构域、含有如seq id no:4中所示氨基酸序列的cdr2结构域和含有如seq id no:5中所示氨基酸序列的cdr3结构域;该轻链可变区包含含有如seq id no:7中所示氨基酸序列的cdr1结构域、含有如seq id no:8中所示氨基酸序列的cdr2结构域和含有如seq id no:9中所示氨基酸序列的cdr3结构域。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少六个结合,其中该分离的抗cd117抗体或其抗原结合片段不具有以下重链可变区和轻链可变区,该重链可变区包含含有如seq id no:3中所示氨基酸序列的cdr1结构域、含有如seq id no:4中所示氨基酸序列的cdr2结构域和含有如seq id no:5中所示氨基酸序列的cdr3结构域;该轻链可变区包含含有如seq id no:7中所示氨基酸序列的cdr1结构域、含有如seq id no:8中所示氨基酸序列的cdr2结构域和含有如seq id no:9中所示氨基酸序列的cdr3结构域。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少七个结合,其中该分离的抗cd117抗体或其抗原结合片段不具有以下重链可变区和轻链可变区,该重链可变区包含含有如seq id no:3中所示氨基酸序列的cdr1结构域、含有如seq id no:4中所示氨基酸序列的cdr2结构域和含有如seq id no:5中所示氨基酸序列的cdr3结构域;该轻链可变区包含含有如seq id no:7中所示氨基酸序列的cdr1结构域、含有如seq id no:8中所示氨基酸序列的cdr2结构域和含有如seq id no:9中所示氨基酸序列的cdr3结构域。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的每一个结合,其中该分离的抗cd117抗体或其抗原结合片段不具有以下重链可变区和轻链可变区,该重链可变区包含含有如seq id no:3中所示氨基酸序列的cdr1结构域、含有如seq id no:4中所示氨基酸序列的cdr2结构域和含有如seq id no:5中所示氨基酸序列的cdr3结构域;该轻链可变区包含含有如seq id no:7中所示氨基酸序列的cdr1结构域、含有如seq id no:8中所示氨基酸序列的cdr2结构域和含有如seq id no:9中所示氨基酸序列的cdr3结构域。
21.在一个方面,本公开提供了一种分离的抗cd117抗体或其抗原结合片段,其与在seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少两个处与人cd117结合,其中该分离的抗cd117抗体或其抗原结合片段不具有包含如seq id no:2中所示的氨基酸序列的重链可变区和包含如seq id no:6中所示的氨基酸序
列的轻链可变区。
22.在另一个方面,本公开提供了一种耗尽需要造血干细胞移植物的人患者中cd117+细胞群体的方法,其通过向患者施用有效量的分离的抗cd117抗体或其抗原结合片段或抗cd117 adc来进行,其中该分离的抗cd117抗体或其抗原结合片段或抗cd117 adc包含与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少两个处与人cd117结合的抗体或其抗原结合片段。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段或抗cd117 adc与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少三个结合。在另一个实施方案中,该分离的抗cd117抗体或其抗原结合片段或抗cd117 adc与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少四个结合。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段或抗cd117 adc与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少五个结合。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段或抗cd117 adc与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少六个结合。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段或抗cd117 adc与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少七个结合。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段或抗cd117 adc与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的每一个结合。
23.在另一方面,本公开提供了一种方法,其包含向人类患者施用分离的抗cd117抗体或其抗原结合片段,或抗cd117 adc,其中该分离的抗cd117抗体或其抗原结合片段,或抗cd117 adc包含在seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少两个处与人cd117结合的抗体或其抗原结合片段,并随后向该患者施用包含造血干细胞的移植物。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段或抗cd117 adc与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少三个结合。在另一个实施方案中,该分离的抗cd117抗体或其抗原结合片段或抗cd117 adc与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少四个结合。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段或抗cd117adc与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少五个结合。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段或抗cd117 adc与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少六个结合。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段或抗cd117 adc与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119或k129中的至少七个结合。在一个实施方案中,该分离的抗cd117抗体或其抗原结合片段或抗cd117 adc与seq id no:1中所列的cd117的以下氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的每一个结合。
附图说明
24.图1a和1b提供了ab85和ck6的氨基酸序列的可变重链(vh)和可变轻链(vl)区。(a)
描述了ab85(seq id no:2)和ck6(seq id no:22)的可变重链(vh)区的比对。(b)描述了ab85(seq id no:6)和ck6(seq id no:26)的可变轻链(vl)区的比对。
25.图2图示了表征cd117和ab85之间的分子界面的表位作图分析的结果(按出现的顺序,分别为seq id no 147-148)。
具体实施方式
26.本文描述了与人cd117结合的分离的抗cd117人抗体。本文提供的抗体具有使其有利于治疗的许多特征,包括调理人类患者以进行干细胞移植的方法。例如,在某些实施方案中,本文公开的抗体对人cd117具有高亲和力和低解离速率,以及在表达cd117的细胞中内化的能力。此外,本文提供的某些抗体具有改善的生物物理稳定性。这些特征还使得本文公开的抗cd117抗体有利地用于将细胞毒素递送至表达cd117的细胞的缀合物(抗体药物缀合物(adc))。
27.本公开提供了抗cd117抗体,特别是与人cd117的胞外结构域结合的分离的人抗cd117抗体。本文鉴定的分离的抗cd117抗体的结合区描述于下文。
28.本文所述的抗cd117抗体和adc可用于治疗多种病症的方法中,诸如造血谱系细胞类型的疾病、癌症、自身免疫性疾病、代谢病症和干细胞病症等。本文所述的组合物和方法可(i)直接耗尽引起病理学的细胞群体,诸如癌细胞(例如,白血病细胞)和自身免疫细胞(例如,自身反应性t细胞)群体,和/或(ii)耗尽内源性造血干细胞群体,以便通过提供可接受移植细胞归巢的小生境(niche)来促进移植的造血干细胞的植入。前述活性可以通过施用能够结合由内源性致病细胞或造血干细胞表达的抗原的adc、抗体或其抗原结合片段来实现。在直接治疗疾病的情况下,这种施用可导致引起目的病理学的细胞数量减少。在为患者准备进行造血干细胞移植物治疗的情况下,这种施用可导致内源性造血干细胞群的选择性耗尽,从而在造血组织(诸如骨髓)中产生空缺,其随后可被移植的外源性造血干细胞填充。本公开部分地基于以下发现:能够结合cd117(诸如gnnk+d117)的adc、抗体或其抗原结合片段可以施用于患者以影响上述两种活性。结合cd117的adc、抗体或其抗原结合片段可以施用于患有癌症或自身免疫性疾病的患者,以直接耗尽癌性细胞或自身免疫细胞群体,并且也可以施用于需要造血干细胞移植物治疗的患者,以促进移植的造血干细胞的存活和移植潜能。
29.由于施用抗cd117 adc、抗体或其抗原结合片段而导致的造血干细胞移植物的植入可以在多种经验测量中表现。例如,移植的造血干细胞的植入可以通过在施用能够结合cd117的adc、抗体或其抗原结合片段并随后施用造血干细胞移植物后评估存在于患者骨髓内的竞争性再殖单位(competitive repopulating unit,cru)的量来评估。另外,可以通过将报道基因(诸如催化产生荧光、发色或发光产物的化学反应的酶)掺入已经转染供体造血干细胞的载体中,并随后监测已经接受造血干细胞归巢的组织(诸如骨髓)中的相应信号,来观察造血干细胞移植物的植入。还可以通过评估造血干细胞和祖细胞的数量和存活来观察造血干细胞的植入,例如,如通过本领域已知的荧光激活细胞分选(facs)分析方法来确定。移植还可以通过在移植后期间测量外周血中的白细胞计数,和/或通过测量骨髓抽吸物样品中供体细胞对骨髓细胞的恢复来确定。
30.以下部分提供了adc、抗体或其抗原结合片段以及向患者施用此类治疗剂的方法
(例如,在造血干细胞移植之前)的描述,所述adc、抗体或其抗原结合片段可以施用于患者,诸如患有癌症(诸如急性髓样白血病或骨髓增生异常综合征)或自身免疫性疾病的患者,或需要造血干细胞移植物治疗的患者,以促进造血干细胞移植物的植入。
31.定义
32.如本文所用,术语“约”是指高于或低于所述值的10%内的值。例如,术语“约5nm”表示4.5nm至5.5nm的范围。
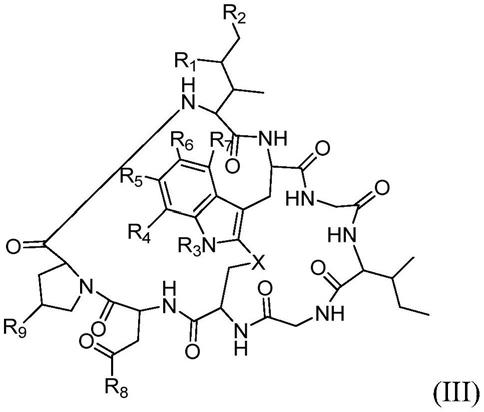
33.如本文所用,术语“鹅膏毒素(amatoxin)”是指由鬼笔鹅膏(amanita phalloides)蘑菇产生的鹅膏毒素肽家族的成员,或其变体或衍生物,诸如能够抑制rna聚合酶ii活性的其变体或衍生物。可与本文所述的组合物和方法结合使用的鹅膏毒素包括根据(但不限于)式(iii)的化合物,包括α-鹅膏蕈碱(amanitin)、β-鹅膏蕈碱、γ-鹅膏蕈碱、ε-鹅膏蕈碱、鹅膏素(amanin)、三羟鹅膏毒肽酰胺(amaninamide)、鹅膏无毒环肽(amanullin)、一羟鹅膏毒肽羧酸(amanullinic acid)或前鹅膏无毒环肽(proamanullin)。如本文所述,鹅膏毒素可(例如,通过接头部分(l))与抗体或其抗原结合片段缀合(从而形成adc)。下文描述了鹅膏毒素缀合的示例性方法和可用于此类方法的接头。本文还描述了根据所述组合物和方法可用于与抗体或抗原结合片段缀合的示例性含接头的鹅膏毒素。
34.式(iii)如下:
[0035][0036]
其中r1为h、oh或ora;
[0037]
r2为h、oh或orb;
[0038]
ra和rb,当存在时,与它们所键合的氧原子一起,结合形成任选取代的5元杂环烷基;
[0039]
r3为h或rd;
[0040]
r4为h、oh、ord或rd;
[0041]
r5为h、oh、ord或rd;
[0042]
r6为h、oh、ord或rd;
[0043]
r7为h、oh、ord或rd;
[0044]
r8为oh、nh2或ord;
[0045]
r9为h、oh或ord;
[0046]
x为-s-、-s(o)-或-so
2-;以及
[0047]
rd为任选取代的烷基(例如,c
1-c6烷基)、任选取代的杂烷基(例如,c
1-c6杂烷基)、任选取代的烯基(例如,c
2-c6烯基)、任选取代的杂烯基(例如,c
2-c6杂烯基)、任选取代的炔基(例如,c
2-c6炔基)、任选取代的杂炔基(例如,c
2-c6杂炔基)、任选取代的环烷基、任选取代的杂环烷基、任选取代的芳基或任选取代的杂芳基。
[0048]
例如,可与本文所述的组合物和方法结合使用的鹅膏毒素包括根据下式(iiia)的化合物:
[0049][0050]
其中r1为h、oh或ora;
[0051]
r2为h、oh或orb;
[0052]
ra和rb,当存在时,与它们所键合的氧原子一起,结合形成任选取代的5元杂环烷基;
[0053]
r3为h或rd;
[0054]
r4为h、oh、ord或rd;
[0055]
r5为h、oh、ord或rd;
[0056]
r6为h、oh、ord或rd;
[0057]
r7为h、oh、ord或rd;
[0058]
r8为oh、nh2或ord;
[0059]
r9为h、oh或ord;
[0060]
x为-s-、-s(o)-或-so
2-;以及
[0061]
rd为任选取代的烷基(例如,c
1-c6烷基)、任选取代的杂烷基(例如,c
1-c6杂烷基)、任选取代的烯基(例如,c
2-c6烯基)、任选取代的杂烯基(例如,c
2-c6杂烯基)、任选取代的炔基(例如,c
2-c6炔基)、任选取代的杂炔基(例如,c
2-c6杂炔基)、任选取代的环烷基、任选取代的杂环烷基、任选取代的芳基或任选取代的杂芳基。
[0062]
可与本文所述的组合物和方法结合使用的鹅膏毒素还包括根据下式(iiib)的化合物:
[0063][0064]
其中r1为h、oh或ora;
[0065]
r2为h、oh或orb;
[0066]
ra和rb,当存在时,与它们所键合的氧原子一起,结合形成任选取代的5元杂环烷基;
[0067]
r3为h或rd;
[0068]
r4为h、oh、ord或rd;
[0069]
r5为h、oh、ord或rd;
[0070]
r6为h、oh、ord或rd;
[0071]
r7为h、oh、ord或rd;
[0072]
r8为oh、nh2或ord;
[0073]
r9为h、oh或ord;
[0074]
x为-s-、-s(o)-或-so
2-;以及
[0075]
rd为任选取代的烷基(例如,c
1-c6烷基)、任选取代的杂烷基(例如,c
1-c6杂烷基)、任选取代的烯基(例如,c
2-c6烯基)、任选取代的杂烯基(例如,c
2-c6杂烯基)、任选取代的炔基(例如,c
2-c6炔基)、任选取代的杂炔基(例如,c
2-c6杂炔基)、任选取代的环烷基、任选取代的杂环烷基、任选取代的芳基或任选取代的杂芳基。
[0076]
例如,在一个实施方案中,可与本文所述的组合物和方法结合使用的鹅膏毒素包括根据式(iiic)的化合物
[0077][0078]
其中r4、r5、x和r8各自如上所定义。
[0079]
如本文所述,鹅膏毒素可例如通过接头部分(l)与抗体或其抗原结合片段缀合(从而形成adc)。下文描述了鹅膏毒素缀合的示例性方法和可用于此类方法的接头,包括表1。根据本文所述的组合物和方法,可用于与抗体或抗原结合片段缀合的示例性含接头的鹅膏毒素示于本文所述的结构式(i)、(ia)、(ib)、(ii)、(iia)或(iib)中。
[0080]
如本文所用,术语“抗体”是指与特定抗原特异性结合或与特定抗原免疫反应的免疫球蛋白分子。抗体包括但不限于单克隆抗体,多克隆抗体,多特异性抗体(例如,双特异性抗体),基因工程抗体的和其它方式修饰形式的抗体,包括但不限于去免疫化的抗体,嵌合抗体,人源化抗体,异源缀合物抗体(例如,双特异性抗体、三特异性抗体和四特异性抗体,双抗体(diabody)、三抗体(triabody)和四抗体(tetrabody))和抗体片段(即,抗体的抗原结合片段),包括例如fab',f(ab')2,fab,fv,rigg和scfv片段,只要它们表现出所需的抗原结合活性。
[0081]
本公开的抗体通常是分离的或重组的。“分离的”,当在本文中使用时,是指已经从表达它的细胞或细胞培养物中鉴定和分离和/或回收的多肽,例如抗体。通常,分离的抗体将通过至少一个纯化步骤制备。因此,“分离的抗体”是指基本上不含具有不同抗原特异性的其它抗体的抗体。例如,特异性结合cd117的分离的抗体基本上不含特异性结合cd117以外的抗原的抗体。
[0082]
如本文所用,术语“单克隆抗体”(mab)是指通过本领域可用的或已知的任何手段从单个克隆(包括任何真核、原核或噬菌体克隆)衍生的抗体,并且不限于通过杂交瘤技术产生的抗体。可使用本领域已知的极其多种技术(包括使用杂交瘤、重组和噬菌体展示技术或其组合)来制备可用于本公开的单克隆抗体。术语“单克隆抗体”意指包括能够与靶蛋白特异性结合的完整分子以及抗体片段(包括,例如,fab和f(ab')2片段)。如本文所用,fab和f(ab')2片段是指缺少完整抗体的fc片段的抗体片段。本文描述了这些抗体片段的实例。
[0083]
通常,抗体包含含有抗原结合区的重链和轻链。每条重链由重链可变区(本文缩写为hcvr或vh)和重链恒定区组成。重链恒定区由三个结构域(ch1、ch2和ch3)组成。每条轻链由轻链可变区(本文缩写为lcvr或vl)和轻链恒定区组成。轻链恒定区由一个结构域(cl)组成。vh和vl区可以进一步细分为超变区,称为互补决定区(cdr),散布有更保守的区域,称为框架区(fr)。每个vh和vl由三个cdr和四个fr组成,从氨基末端到羧基末端按以下顺序排
列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可介导免疫球蛋白与宿主组织或因子的结合,包括免疫系统的各种细胞(例如,效应细胞)和经典补体系统的第一组分(clq)。
[0084]
如本文所用,“完整”或“全长”抗体是指具有通过二硫键相互连接的两条重链(h)多肽和两条轻链(l)多肽的抗体。每条重链由重链可变区(本文缩写为hcvr或vh)和重链恒定区组成。重链恒定区由三个结构域(ch1、ch2和ch3)组成。每条轻链由轻链可变区(本文缩写为lcvr或vl)和轻链恒定区组成。轻链恒定区由一个结构域(cl)组成。vh和vl区可以进一步细分为超变区,称为互补决定区(cdr),散布有更保守的区域,称为框架区(fr)。每个vh和vl由三个cdr和四个fr组成,从氨基末端到羧基末端按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可介导免疫球蛋白与宿主组织或因子的结合,包括免疫系统的各种细胞(例如,效应细胞)和经典补体系统的第一组分(clq)。
[0085]
如本文所用,术语“fc”、“fc区”和“fc结构域”指与通过木瓜蛋白酶消化igg分子获得的可结晶片段相关的免疫球蛋白(例如igg分子)的部分。fc区包含通过二硫键连接的igg分子的两条重链的c末端半部分。它没有抗原结合活性,但含有碳水化合物部分和用于补体与fc受体(包括fcrn受体)的结合位点(见下文)。例如,fc区含有第二恒定结构域ch2(例如,igg1的eu位置231-340处的残基)和第三恒定结构域ch3(例如,人igg1的eu位置341-447处的残基)。如本文所用,fc结构域包括“下铰链区”(例如,igg1的eu位置233-239处的残基)。
[0086]
fc可以指分离的该区域,或在抗体、抗体片段或fc融合蛋白的上下文中的该区域。已经在fc结构域中的多个位置处观察到多态性,包括但不限于eu位置270、272、312、315、356和358,因此在本技术中呈现的序列和本领域已知的序列之间可以存在轻微差异。因此,“野生型igg fc结构域”或“wt igg fc结构域”指任何天然存在的igg fc区域(即任何等位基因)。人igg1、igg2、igg3和igg4的重链序列可以在许多序列数据库中找到,例如,在uniprot数据库(www.uniprot.org)中,分别以登录号p01857(ighg1_human)、p01859(ighg2_human)、p01860(ighg3_human)和p01861(ighg1_human)找到。“wt”fc区的实例在seq id no:10中提供(其提供含有fc区的重链恒定区)。
[0087]
如本文所用,术语“修饰的fc区”或“变体fc区”是指包含在fc区内的任何位置引入的一个或多个氨基酸取代、缺失、插入或修饰的igg fc结构域。在某些方面,变体igg fc结构域包含一个或多个氨基酸取代,与不包含所述一个或多个氨基酸取代的野生型fc结构域相比,所述取代导致对fcγr和/或c1q的结合亲和力降低或消除。此外,fc结合相互作用对于多种效应子功能和下游信号传导事件是必需的,包括但不限于抗体依赖性细胞介导的细胞毒性(adcc)和补体依赖性细胞毒性(cdc)。因此,在某些方面,包含变体fc结构域的抗体(例如,抗体、融合蛋白或缀合物)相对于其它方面具有相同氨基酸序列但不包含一个或多个氨基酸取代、缺失、插入或修饰的相应抗体(诸如,例如,在fc区中的相应位置处含有天然存在的氨基酸残基的未修饰的fc区)可展现对至少一个或多个fc配体(例如,fcγr)的改变的结合亲和力。
[0088]
变体fc结构域是根据组成它们的氨基酸修饰定义的。对于本文关于fc区讨论的所有氨基酸取代,编号总是根据如kabat中的eu索引。因此,例如,d265c是一种相对于亲本fc结构域在eu位置265处的天冬氨酸(d)被半胱氨酸(c)取代的fc变体。注意,提供取代的顺序
是任意的。同样,例如,d265c/l234a/l235a定义了相对于亲本fc结构域在eu位置265(d至c)、234(l至a)和235(l至a)具有取代的变体fc变体。变体也可根据其在突变eu氨基酸位置中的最终氨基酸组成来命名。例如,l234a/l235a突变体可称为“lala”。作为另一个实例,e233p.l234v.l235a.delg236(236的缺失)突变体可称为“eplvladelg”。作为另一个实例,i253a.h310a.h435a突变体可称为“ihh”。注意,提供取代的顺序是任意的。
[0089]
如本文所用,术语“fcγ受体”或“fcγr”是指结合igg抗体fc区并由fcγr基因编码的蛋白质家族的任何成员。在人类中,该家族包括但不限于fcgγri(cd64),包括同种型fcγria、fcγrib和fcγric;fcγrii(cd32),包括同种型fcγriia(包括同种异型h131和r131),fcγriib(包括fcγriib-1和fcγriib-2)和fcγriic;以及fcγriii(cd16),包括同种型fcγriiia(包括同种异型v158和f158)和fcγriiib(包括同种异型fcγriiib-na1和fcγriiib-na2),以及任何未发现的人类fcγr或fcγr同种型或同种异型。fcγr可以来自任何生物体,包括但不限于人类、小鼠、大鼠、兔和猴。小鼠fcγr包括但不限于fcγri(cd64)、fcγrii(cd32)、fcγriii(cd16)和fcγriii-2(cd16-2),以及任何未发现的小鼠fcγr或fcγr同种型或同种异型。
[0090]
如本文所用,术语“效应子功能”是指从fc结构域与fc受体相互作用产生的生化事件。效应子功能包括但不限于adcc、adcp和cdc。如本文所用,“效应细胞”是指表达一种或多种fc受体并介导一种或多种效应子功能的免疫系统细胞。效应细胞包括但不限于单核细胞、巨噬细胞、嗜中性粒细胞、树突细胞、嗜酸性粒细胞、肥大细胞、血小板、b细胞、大颗粒淋巴细胞,朗格汉斯细胞、自然杀伤(nk)细胞和γδt细胞,并且可以来自任何生物体,包括但不限于人类、小鼠、大鼠、兔和猴。
[0091]
如本文所用,术语“沉默性的(silent)”、“沉默的(silenced)”或“沉默(silencing)”是指相对于包含未修饰的fc区的相同抗体与fcγr的结合,具有本文所述的修饰的fc区的抗体与fcγ受体(fcγr)的结合降低(例如,相对于包含未修饰的fc区的相同抗体与fcγr的结合,与fcγr的结合降低至少70%,至少80%,至少90%,至少95%,至少98%,至少99%,或100%,如通过例如bli测量的)。在一些实施方案中,fc沉默抗体与fcγr没有可检测的结合。具有修饰的fc区的抗体与fcγr的结合可以使用本领域已知的多种技术测定,例如但不限于平衡方法(例如,酶联免疫吸附测定(elisa);kinexa,rathanaswami et al.analytical biochemistry,vol.373:52-60,2008;或放射免疫测定(ria)),或通过表面等离子体共振测定或基于动力学的测定的其他机制(例如,biacoretm分析或octettm分析(fortebio)),以及其他方法,诸如间接结合测定、竞争性结合测定、荧光共振能量转移(fret)、凝胶电泳和色谱法(例如,凝胶过滤)。这些和其它方法可以利用一种或多种检查的组分上的标记物和/或采用各种检测方法(包括但不限于生色、荧光、发光或同位素标记物)。结合亲和力和动力学的详细描述可见于paul,w.e.编,fundamental immunology,第4版,lippincott-raven,philadelphia(1999),其聚焦于抗体-免疫原相互作用。竞争性结合测定的一个实例是放射免疫测定,其包括在存在增加量的未标记抗原的情况下将标记抗原与感兴趣的抗体温育,并检测与标记抗原结合的抗体。感兴趣的抗体对特定抗原的亲和力和结合解离速率可通过scatchard图分析从数据确定。与第二抗体的竞争也可以使用放射免疫测定法来测定。在这种情况下,在增加量的未标记的第二抗体存在下,将抗原同与经标记的化合物缀合的感兴趣的抗体一起温育。
[0092]
如本文所用,术语“包含未修饰的fc区的相同抗体”是指缺少叙述的氨基酸取代(例如,d265c、h435a、l234a和/或l235a),但在其他方面具有与同其比较的经fc修饰的抗体相同的氨基酸序列的抗体。
[0093]
术语“抗体依赖性细胞介导的细胞毒性”或“adcc”是指一种细胞毒性形式,其中包含fc结构域的多肽(例如,抗体)与存在于某些细胞毒性细胞(例如,主要是nk细胞、嗜中性粒细胞和巨噬细胞)上的fc受体(fcr)结合,并使这些细胞毒性效应细胞能够特异性结合到携带抗原的“靶细胞”,并且随后用细胞毒素杀死靶细胞(hogarth et al.,nature review drug discovery 2012,11:313)。涵盖的是在抗体及其片段之外,具有与携带抗原的靶细胞特异性结合的能力的其他包含fc结构域的多肽(例如,fc融合蛋白和fc缀合蛋白)将能够实现细胞介导的细胞毒性。
[0094]
为简单起见,由包含fc结构域的多肽的活性产生的细胞介导的细胞毒性在本文中也称为adcc活性。可以测定本公开的任何特定多肽介导通过adcc对靶细胞的裂解的能力。为了评估adcc活性,将感兴趣的多肽(例如,抗体)与免疫效应细胞组合添加至靶细胞,导致靶细胞的细胞溶解。细胞溶解通常通过从裂解的细胞释放标记物(例如,放射性底物、荧光染料或天然细胞内蛋白质)来检测。可用于此类测定的效应细胞包括外周血单个核细胞(pbmc)和天然杀伤(nk)细胞。体外adcc测定的具体实例描述于bruggemann et al.,j.exp.med.166:1351(1987);wilkinson et al.,j.immunol.methods 258:183(2001);patel et al.,j.immunol.methods 184:29(1995)。可选地或另外地,可以在体内(例如,在动物模型中,诸如clynes et al.,proc.natl.acad.sci.usa 95:652(1998)中所公开的)评估感兴趣的抗体的adcc活性。
[0095]
如本文所用,术语“抗原结合片段”是指保留与靶抗原特异性结合的能力的抗体的一个或多个部分。抗体的抗原结合功能可以通过全长抗体的片段进行。抗体片段可以是例如fab、f(ab’)2、scfv、双抗体(diabody)、三抗体(triabody)、亲和体(affibody)、纳米抗体(nanobody)、适体或结构域抗体。术语抗体的“抗原结合片段”涵盖的结合片段的实例包括但不限于:(i)fab片段,由v
l
、vh、c
l
和ch1结构域组成的单价片段;(ii)f(ab')2片段,含有在铰链区通过二硫键连接的两个fab片段的二价片段;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗体的单臂的v
l
和vh结构域组成的fv片段,(v)包括vh和v
l
结构域的dab;(vi)由vh结构域组成的dab片段(参见例如ward et al.,nature341:544-546,1989);(vii)由vh和v
l
结构域组成的dab;(viii)分离的互补决定区(cdr);以及(ix)两个或更多个(例如,两个,三个,四个,五个或六个)分离的cdr的组合,其可任选地通过合成接头连接。此外,尽管fv片段的两个结构域(v
l
和vh)由不同的基因编码,但它们可以使用重组方法通过接头连接,该接头使它们能够被制成单个蛋白质链,其中v
l
和vh区配对以形成单价分子(称为单链fv(scfv);参见例如bird et al.,science 242:423-426,1988和huston et al.,proc.natl.acad.sci.usa85:5879-5883,1988)。可以使用本领域技术人员已知的常规技术获得这些抗体片段,并且可以以与完整抗体相同的方式筛选片段的效用。抗原结合片段可通过重组dna技术、完整免疫球蛋白的酶促或化学切割产生,或在某些情况下,通过本领域已知的化学肽合成方法产生。
[0096]
如本文所用,术语“抗cd117抗体”或“与cd117结合的抗体”是指能够以足够的亲和力与cd117结合,使得该抗体可用作靶向cd117中的诊断剂和/或治疗剂的抗体。
institute of health,bethesda,md.,1987)。在某些实施方案中,除非另有说明,否则免疫球蛋白氨基酸残基的编号根据kabat等人的免疫球蛋白氨基酸残基编号系统进行(尽管可以使用任何抗体编号方案,包括但不限于imgt和chothia)。
[0104]
如本文所用,术语“调理(conditioning)”是指使患者准备好接受移植物(例如,含有造血干细胞的移植物)的过程。这种规程促进造血干细胞移植物的植入(例如,从调理程序和随后的造血干细胞移植后从患者分离的血液样品中存活的造血干细胞数量的持续增加推断)。根据本文所述的方法,可以通过向患者施用能够结合由造血干细胞表达的抗原(诸如cd117(例如,gnnk+cd117))的adc、抗体或其抗原结合片段来对患者进行调理以进行造血干细胞移植物治疗。如本文所述,抗体可与细胞毒素共价缀合以形成抗体药物缀合物(adc)。向需要造血干细胞移植物治疗的患者施用能够结合一种或多种前述抗原的抗体、其抗原结合片段或adc可促进造血干细胞移植物的植入,例如,通过选择性耗尽内源性造血干细胞,从而产生由外源性造血干细胞移植物填充的空缺。
[0105]
如本文所用,术语“缀合物”或“抗体药物缀合物”或“adc”是指与细胞毒素连接的抗体。adc通过一个分子(诸如抗体或其抗原结合片段)的反应性官能团与另一个分子(诸如本文所述的细胞毒素)的适当反应性官能团的化学键合而形成。缀合物可包括彼此结合的两个分子之间的接头,例如,抗体和细胞毒素之间的接头。可用于形成缀合物的接头的实例包括含肽的接头,诸如含有天然存在或非天然存在的氨基酸(诸如d-氨基酸)的那些。接头可使用本文所述和本领域已知的多种策略来制备。取决于其中的反应性组分,可以切割接头,例如,通过酶水解、光解、在酸性条件下水解、在碱性条件下水解、氧化、二硫化物还原、亲核裂解或有机金属裂解(参见例如leriche et al.,bioorg.med.chem.,20:571-582,2012)。前述缀合物在本文中也可互换地称为“药物抗体缀合物”、“抗体药物缀合物”和“adc”。
[0106]
如本文所用,术语“偶联反应”是指一种化学反应,其中适合于彼此反应的两个或更多个取代基反应以形成连接(例如,共价地)与每个取代基结合的分子片段的化学部分。偶联反应包括如下那些,其中与作为细胞毒素的片段(诸如本领域已知或本文描述的细胞毒素)结合的反应性取代基与同作为抗体或其抗原结合片段,诸如本领域已知或本文描述的对cd117(诸如gnnk+cd117)具有特异性的抗体或其抗原结合片段结合的适当反应性取代基反应。合适的反应性取代基的实例包括亲核体/亲电体对(例如,硫醇/卤代烷基对、胺/羰基对或硫醇/α,β-不饱和羰基对等)、二烯/亲二烯体对(例如,叠氮化物/炔烃对等)等。偶联反应包括不限于硫醇烷基化、羟基烷基化、胺烷基化、胺缩合、酰胺化、酯化、二硫化物形成、环加成(例如,[4+2]diels-alder环加成,[3+2]huisgen环加成等)、亲核芳族取代、亲电芳族取代和本领域已知或本文所述的其它反应形式。
[0107]
如本文所用,“cru(竞争性再殖单位)”是指可在体内移植后检测的长期移植干细胞的测量单位。
[0108]
如本文所用,“药物与抗体比”或“dar”是指与adc的抗体连接的细胞毒素(例如,鹅膏毒素)的数目。adc的dar可以在1至8的范围内,尽管更高的负载也是可能的,这取决于抗体上连接位点的数目。因此,在某些实施方案中,本文所述的adc具有1、2、3、4、5、6、7或8的dar。
[0109]
如本文所用,术语“供体”是指将细胞或其后代施用于接受体(recipient)之前分
离一种或多种细胞的人类或动物。一种或多种细胞可以是例如造血干细胞群体。
[0110]
如本文所用,术语“双抗体”是指含有两条肽链的二价抗体,其中每条多肽链包括通过接头连接的vh和v
l
结构域,该接头太短(例如,由五个氨基酸组成的接头)而不允许同一肽链上的vh和v
l
结构域分子内缔合。这种构造迫使每个结构域与另一条多肽链上的互补结构域配对,从而形成同型二聚体结构。因此,术语“三抗体”是指含有三条肽链的三价抗体,每条肽链含有通过接头连接的一个vh结构域和一个v
l
结构域,该接头极短(例如,由1-2个氨基酸组成的接头)而不允许同一肽链内vh和v
l
结构域的分子内缔合。为了折叠成它们的天然结构,以这种方式配置的肽通常三聚化,以便将相邻肽链的vh和v
l
结构域定位在空间上彼此邻近(参见例如holliger et al.,proc.natl.acad.sci.usa90:6444-48,1993)。
[0111]
如本文所用,“双可变结构域免疫球蛋白”(“dvd-ig”)是指通过接头组合两种单克隆抗体的靶结合可变结构域以产生四价、双靶向单一剂的抗体(参见例如gu et al.,meth.enzymol.,502:25-41,2012)。
[0112]
如本文所用,术语“内源性”描述在特定生物体(诸如人类患者)中天然存在的物质,诸如分子、细胞、组织或器官(例如,造血干细胞或造血谱系细胞,诸如巨核细胞、凝血细胞、血小板、红细胞、肥大细胞、成髓细胞(myeoblast)、嗜碱性粒细胞、嗜中性粒细胞、嗜酸性粒细胞、小胶质细胞、粒细胞、单核细胞、破骨细胞、抗原呈递细胞、巨噬细胞、树突细胞、自然杀伤细胞、t淋巴细胞或b淋巴细胞)。
[0113]
如本文所用,术语“移植潜力”用于指造血干细胞和祖细胞再殖组织的能力,无论此类细胞是自然循环的还是通过移植提供的。该术语涵盖围绕或导致移植的所有事件,诸如细胞的组织归巢和细胞在感兴趣组织内的定殖。植入效率或植入速率可以使用本领域技术人员已知的任何临床上可接受的参数来评估或量化,并且可以包括例如竞争性再殖单位(cru)的评估;在已经接受干细胞归巢、定殖或植入的组织中的标志物掺入或表达;或通过疾病进展、造血干细胞和祖细胞的存活或接受体的存活来评估受试者的进展。移植也可以通过在移植物后期期间测量外周血中的白细胞计数来确定。移植还可以通过测量骨髓抽吸物样品中供体细胞对骨髓细胞的恢复来评估。
[0114]
如本文所用,术语“表位”包括能够与结合蛋白(例如,抗体或其抗原结合部分)特异性结合的任何多肽决定簇。在某些实施方案中,表位决定簇包括分子,诸如氨基酸、糖侧链、磷酰基或磺酰基的化学活性表面分组,并且在某些实施方案中,可以具有特定的三维结构特征和/或特定的电荷特征。在各种实施方案中,表位可以是抗原(即,cd117)的一级结构的线性或顺序表位,即氨基酸的线性序列。或者,在其它实施方案中,当抗原呈现其二级结构时,表位可以是具有特定三维形状的构象表位。例如,构象表位可包含抗原的非线性(即,非顺序性)氨基酸。
[0115]
在一个具体的实施方案中,表位是由结合蛋白(例如,抗体或其抗原结合部分)结合的抗原的区域。在某些实施方案中,当结合蛋白(例如,抗体或其抗原结合部分)在蛋白质和/或大分子的复杂混合物中优先识别其靶抗原时,其被称为特异性结合抗原。在一个具体的实施方案中,当结合蛋白与抗原结合时,抗原(即,cd117)的表位包括在结合蛋白(例如,抗体或其抗原结合部分)的约4埃内的那些氨基酸残基。
[0116]
如本文所用,术语“外源性”描述在特定生物体(诸如人类患者)中天然不存在的物质,诸如分子、细胞、组织或器官(例如,造血干细胞或造血谱系细胞,诸如巨核细胞、凝血细
胞、血小板、红细胞、肥大细胞、成髓细胞、嗜碱性粒细胞、嗜中性粒细胞、嗜酸性粒细胞、小胶质细胞、粒细胞、单核细胞、破骨细胞、抗原呈递细胞、巨噬细胞、树突细胞、自然杀伤细胞、t淋巴细胞或b淋巴细胞)。对接受体生物(例如,接受体患者)而言是外源性的物质可以天然存在于衍生物质的供体生物(例如,供体受试者)中。例如,同种异体细胞移植物含有对于接受体外源的,但对于供体天然的细胞。外源性物质包括从外部来源提供给生物体或从中提取的培养物质的那些。
[0117]
如本文所用,术语“框架区”或“fw区”包括与抗体或其抗原结合片段的cdr相邻的氨基酸残基。fw区残基可存在于例如人类抗体、人源化抗体、单克隆抗体、抗体片段、fab片段、单链抗体片段、scfv片段、抗体结构域和双特异性抗体等中。
[0118]
还提供了本文所述的seq id no中所示序列的“保守序列修饰”,即不消除由核苷酸序列编码或含有氨基酸序列的抗体与抗原结合的核苷酸和氨基酸序列修饰。这种保守序列修饰包括保守核苷酸和氨基酸取代,以及核苷酸和氨基酸添加和缺失。例如,可以通过本领域已知的标准技术(诸如定点诱变和pcr介导的诱变)将修饰引入本文所述的seq id no。保守序列修饰包括保守氨基酸取代,其中氨基酸残基被具有相似侧链的氨基酸残基取代。具有相似侧链的氨基酸残基家族已在本领域中定义。这些家族包括具有碱性侧链(例如,赖氨酸、精氨酸、组氨酸)、酸性侧链(例如,天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如,甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸)、非极性侧链(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸)、β-支链侧链(例如,苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)的氨基酸。因此,抗cd117抗体中预测的非必需氨基酸残基优选被来自相同侧链家族的另一氨基酸残基替代。鉴定不消除抗原结合的核苷酸和氨基酸保守取代的方法是本领域熟知的(参见例如brummell et al.,biochem.32:1180-1187(1993);kobayashi et al.protein eng.12(10):879-884(1999);以及burks et al.proc.natl.acad.sci.usa94:412-417(1997))。
[0119]
如本文所用,术语“半衰期”是指受试者(例如,人类受试者)体内抗体药物的血浆浓度降低一半或50%所花费的时间。血清浓度降低50%反映了药物循环量。
[0120]
如本文所用,术语“造血干细胞”(“hsc”)是指具有自我更新和分化成含有多种多样的谱系的成熟血细胞的能力的未成熟血细胞,所述谱系细胞包括但不限于粒细胞(例如,早幼粒细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、红细胞(例如,网织红细胞、红细胞)、凝血细胞(例如,原巨核细胞、产生血小板的巨核细胞、血小板)、单核细胞(例如,单核细胞、巨噬细胞)、树突细胞、小胶质细胞、破骨细胞和淋巴细胞(例如,nk细胞、b细胞和t细胞)。这些细胞可包括cd34
+
细胞。cd34
+
细胞是表达cd34细胞表面标志物的未成熟细胞。在人类中,cd34+细胞被认为包括具有上文限定的干细胞特性的细胞亚群,而在小鼠中,hsc是cd34-。此外,hsc还指长期再殖hsc(long term repopulating hsc,lt-hsc)和短期再殖hsc(short term repopulating hsc,st-hsc)。lt-hsc和st-hsc基于功能潜力和细胞表面标志物表达来区分。例如,人类hsc是cd34+、cd38-、cd45ra-、cd90+、cd49f+和lin-(成熟谱系标志物呈阴性,包括cd2、cd3、cd4、cd7、cd8、cd10、cd11b、cd19、cd20、cd56、cd235a)。在小鼠中,骨髓lt-hsc是cd34-、sca-1+、c-kit+、cd135-、slamfl/cd150+、cd48-和lin-(成熟谱系标志物呈阴性,包括ter119、cd11b、gr1、cd3、cd4、cd8、b220、il7ra),而st-hsc是cd34+、sca-1+、c-kit+、cd135-、slamfl/cd150+和lin-(成熟谱系标志物呈阴性,包括ter119、
cd11b、gr1、cd3、cd4、cd8、b220、il7ra)。此外,在稳态条件下,st-hsc比lt-hsc具有更低的静止性和更高的增殖性。然而,lt-hsc具有更大的自我更新潜力(即,它们在整个成年期存活,并且可以通过连续的接受体连续移植),而st-hsc具有有限的自我更新(即,它们仅存活有限的时间段,并且不具有连续移植潜力)。这些hsc中的任一种均可用于本文所述的方法中。st-hsc是特别有用的,因为它们具有高度增殖性,因此可以更快地产生分化的后代。
[0121]
如本文所用,术语“造血干细胞功能潜力”是指造血干细胞的功能特性,其包括1)多潜能性(其是指分化成多种不同血液谱系细胞的能力,该血液谱系细胞包括但不限于粒细胞(例如,早幼粒细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、红细胞(例如,网织红细胞、红细胞)、凝血细胞(例如,原巨核细胞、产生血小板的巨核细胞、血小板)、单核细胞(例如,单核细胞、巨噬细胞)、树突细胞、小胶质细胞、破骨细胞和淋巴细胞(例如,nk细胞、b细胞和t细胞),2)自我更新(其是指造血干细胞产生与母细胞具有等同潜能的子细胞的能力,并且此外这种能力可以在个体的整个寿命中反复发生而不会衰竭),以及3)造血干细胞或其后代被重新引入到移植物接受体的能力,届时它们归巢至造血干细胞小生境,并重新建立富有成效的和持续的造血功能。
[0122]
如本文所用,术语“人抗体”意图包括具有源自人种系免疫球蛋白序列的可变区和恒定区的抗体。人抗体可包括不由人种系免疫球蛋白序列编码的氨基酸残基(例如,在体外通过随机或位点特异性诱变或在基因重排期间或通过体内体细胞突变引入的突变)。然而,如本文所用,术语“人抗体”不意图包括其中源自另一哺乳动物物种(诸如小鼠)种系的cdr序列已移植到人框架序列上的抗体。人抗体可以在人细胞中产生(例如,通过重组表达)或通过非人动物或能够表达功能上重排的人免疫球蛋白(诸如重链和/或轻链)基因的原核或真核细胞产生。当人抗体为单链抗体时,其可以包括在天然人抗体中没有发现的接头肽。例如,fv可以含有连接重链可变区和轻链可变区的接头肽,诸如2至约8个甘氨酸或其它氨基酸残基。这种接头肽认为是人源的。人抗体可以通过本领域已知的多种方法制备,包括使用源自人免疫球蛋白序列的抗体文库的噬菌体展示方法。也可以使用不能表达功能性内源性免疫球蛋白,但能表达人免疫球蛋白基因的转基因小鼠产生人抗体(参见例如pct公开号wo 1998/24893;wo 1992/01047;wo 1996/34096;wo 1996/33735;美国专利号5,413,923;5,625,126;5,633,425;5,569,825;5,661,016;5,545,806;5,814,318;5,885,793;5,916,771;以及5,939,598)。
[0123]
非人(例如,鼠或大鼠)抗体的“人源化”形式是含有源自非人免疫球蛋白的最小序列的免疫球蛋白。一般而言,人源化抗体将包含至少一个,通常为两个基本上整个可变域,其中所有或基本上所有的cdr区对应于非人免疫球蛋白的cdr区,并且所有或基本上所有的fr区为人免疫球蛋白序列的fr区。人源化抗体还可以包含免疫球蛋白恒定区(fc)的至少一部分,通常是人免疫球蛋白共有序列的。抗体人源化的方法是本领域已知的并且已经描述于例如riechmann et al.,nature 332:323-7,1988;queen等人的美国专利号:5,530,101;5,585,089;5,693,761;5,693,762;以及6,180,370;ep239400;pct公开wo 91/09967;美国专利号5,225,539;ep592106;ep519596;padlan,1991,mol.immunol.,28:489-498;studnicka et al.,1994,prot.eng.7:805-814;roguska et al.,1994,proc.natl.acad.sci.91:969-973;以及美国专利号5,565,332。
[0124]
如本文所用,“需要”造血干细胞移植物的患者包括表现出一种或多种血细胞类型
缺陷或缺乏的患者,以及患有干细胞病症、自身免疫性疾病、癌症或本文所述的其它病理学的患者。造血干细胞通常表现出1)多潜能性,并因此可分化成多种不同血液谱系,包括但不限于粒细胞(例如,早幼粒细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、红细胞(例如,网织红细胞、红细胞)、凝血细胞(例如,原巨核细胞、产生血小板的巨核细胞、血小板)、单核细胞(例如,单核细胞、巨噬细胞)、树突细胞、小胶质细胞、破骨细胞和淋巴细胞(例如,nk细胞、b细胞和t细胞),2)自我更新,并因此可产生具有与母细胞具有同等潜能的子细胞,以及3)重新引入移植接受体的能力,由此它们归巢到造血干细胞小生境并重新建立富有成效的和持续的造血功能。因此,造血干细胞可以施用于造血谱系的一种或多种细胞类型缺陷或缺乏的患者,以便在体内重建缺陷或缺乏的细胞群体。例如,患者可以患有癌症,并且该缺乏可以由选择性或非特异性地耗尽癌性细胞群体的化疗剂或其它药物的施用引起。另外地或可选地,患者可以患有血红蛋白病(例如,非噁性血红蛋白病),诸如镰状细胞性贫血、地中海贫血、范可尼贫血、再生障碍性贫血和威斯科特-奥尔德里奇二氏综合征。受试者可以是患有腺苷脱氨酶重症综合性免疫缺陷(ada scid)、hiv/aids、异染性脑白质营养不良、戴-布二氏贫血和舒-戴二氏综合征的受试者。受试者可以患有或者受累于遗传性血液病症(例如,镰状细胞性贫血)或自身免疫性病症。另外地或可选地,受试者可以患有或受累于噁性肿瘤(诸如成神经细胞瘤或血液癌症)。例如,受试者可患有白血病、淋巴瘤或骨髓瘤。在一些实施方案中,受试者患有急性髓样白血病、急性淋巴样白血病、慢性髓样白血病、慢性淋巴样白血病、多发性骨髓瘤、弥漫性大b细胞淋巴瘤或非霍奇金淋巴瘤。在一些实施方案中,受试者患有骨髓增生异常综合征。在一些实施方案中,受试者患有自身免疫性疾病,诸如硬皮病、多发性硬化、溃疡性结肠炎、克罗恩病、1型糖尿病或本文所述的另一种自身免疫病理学。在一些实施方案中,受试者需要嵌合抗原受体t细胞(cart)疗法。在一些实施方案中,受试者患有或在其它情况下受累于代谢性贮积症。受试者可以患有或在其它情况下受累于代谢病症,该代谢病症选自由以下组成的组:糖原贮积病、粘多糖症(mucopolysaccharidoses)、戈谢病(gaucher's disease)、胡尔勒(hurlers)病、鞘脂贮积病(sphingolipidoses)、异染性脑白质营养不良或可受益于本文公开的治疗和疗法的任何其它疾病或病症,并且包括但不限于重症综合性免疫缺陷、威斯科特-奥尔德里奇(wiscott-aldrich)综合征、高免疫球蛋白m(igm)综合征、切东病(chediak-higashi disease)、遗传性淋巴组织细胞增生症、骨硬化病、成骨不全、贮积病、重型地中海贫血、镰状细胞病、系统性硬化症、系统性红斑狼疮、多发性硬化、幼年型类风湿性关节炎以及“bone marrow transplantation for non-malignant disease,”ash education book,1:319-338(2000)(其公开内容通过引用整体并入本文,因为其涉及可通过施用造血干细胞移植物疗法来治疗的病理学)中描述的那些疾病或病症。另外地或可选地,“需要”造血干细胞移植物的患者可以是患有或未患有前述病理学之一,但仍然表现出造血谱系内一种或多种内源性细胞类型的水平降低(例如,与其它方面健康的受试者的水平相比)的患者,所述内源性细胞类型诸如巨核细胞、凝血细胞、血小板、红细胞、肥大细胞、成髓细胞、嗜碱性粒细胞、嗜中性粒细胞、嗜酸性粒细胞、小胶质细胞、粒细胞、单核细胞、破骨细胞、抗原呈递细胞、巨噬细胞、树突细胞、自然杀伤细胞、t淋巴细胞和b淋巴细胞。本领域技术人员可以容易地确定一种或多种上述细胞类型或其它血细胞类型的水平相对于其它方面健康的受试者是否降低,例如特别通过本领域已知的流式细胞术和荧光激活细胞分选(facs)方法。
[0125]
如本文所用,术语“接受体”是指接受移植物(诸如含有造血干细胞群体的移植物)的患者。对接受体施用的移植细胞可以是例如自体、同基因或同种异体细胞。
[0126]
如本文所用,术语“样品”是指取自受试者的样本(例如,血液、血液组分(例如,血清或血浆)、尿液、唾液、羊水、脑脊液、组织(例如,胎盘或皮肤)、胰液、绒毛膜绒毛样品和细胞)。
[0127]
如本文所用,术语“scfv”是指单链fv抗体,其中来自抗体的重链和轻链的可变域已经连接形成一条链。scfv片段含有单一多肽链,其包括通过接头隔开的抗体轻链的可变区(v
l
)(例如,cdr-l1、cdr-l2和/或cdr-l3)和抗体重链的可变区(vh)(例如,cdr-h1、cdr-h2和/或cdr-h3)。连接scfv片段的v
l
和vh区的接头可以是由蛋白质源性(proteinogenic)氨基酸组成的肽接头。可使用替代接头以增加scfv片段对蛋白水解降解的抗性(例如,含有d-氨基酸的接头),以提高scfv片段的溶解度(例如,亲水性接头,诸如含有聚乙二醇的接头或含有重复甘氨酸和丝氨酸残基的多肽),以提高分子的生物物理稳定性(例如,含有形成分子内或分子间二硫键的半胱氨酸残基的接头),或减弱scfv片段的免疫原性(例如,含有糖基化位点的接头)。本领域普通技术人员还将理解,本文所述的scfv分子的可变区可以经修饰,使得它们的氨基酸序列与衍生它们的抗体分子不同。例如,可以进行导致氨基酸残基上的保守取代或改变的核苷酸或氨基酸取代(例如,在cdr和/或框架残基中),以保持或增强scfv结合由相应抗体识别的抗原的能力。
[0128]
如本文所用,术语“特异性结合”或“特异性地结合”是指抗体(或adc)通常识别并结合特定蛋白质结构(表位)而非结合蛋白质的能力。如果抗体对表位“a”具有特异性,则在含有标记的“a”和抗体的反应中,含有表位a(或游离的、未标记的a)的分子的存在将减少与抗体结合的标记的a的量。例如,如果抗体在被标记时可以由相应的未标记抗体竞争而远离其靶标,则该抗体与靶标“特异性结合”。在一个实施方案中,如果抗体对靶标的kd为至少约10-4
m,10-5
m,10-6
m,10-7
m,10-8
m,10-9
m,10-10
m,10-11
m,10-12
m或更小(更小意指小于10-12
的数字,例如10-13
),则抗体与靶标(例如,cd117)特异性结合。在一个实施方案中,如本文所用,术语“与cd117特异性结合”或“与cd117特异性地结合”是指结合cd117并具有1.0x10-7
m或更小的解离常数(kd)的抗体(或adc),如通过表面等离振子共振测定。在一个实施方案中,kd(m)根据标准生物层干涉术(interferometery)(bli)测定。在一个实施方案中,k
off
(1/s)根据标准生物层干涉术(bli)测定。然而,应当理解的是,抗体可能能够特异性结合两个或更多个序列相关的抗原。例如,在一个实施方案中,抗体可特异性结合cd117的人和非人(例如,小鼠或非人灵长类动物)直向同源物。
[0129]
如本文所用,术语“受试者”和“患者”是指接受本文所述的特定疾病或病症的治疗的生物体,诸如人类。例如,患者(诸如人类患者)可以在造血干细胞移植物治疗之前接受治疗,以促进外源性造血干细胞的植入。
[0130]
如本文所用,短语“基本上从血液中清除”是指在向患者施用治疗剂(诸如抗cd117抗体、其抗原结合片段或抗cd117 adc)后的时间点,此时从患者分离的血液样品中治疗剂的浓度使得该治疗剂通过常规手段检测不到(例如,使得该治疗剂在用于检测该治疗剂的装置或测定的噪声阈值以上检测不到)。本领域已知的多种技术可用于检测抗体、抗原结合片段和adc,诸如本领域已知的或本文所述的基于elisa的检测测定。可用于检测抗体或抗体片段的其它测定法包括免疫沉淀技术和免疫印迹测定法,以及本领域已知的其它测定
法。
[0131]
如本文所用,短语“干细胞病症”泛指可通过对受试者的靶组织进行调理和/或通过消融靶组织中的内源性干细胞群体(例如,消融来自受试者骨髓组织的内源性造血干细胞或祖细胞群体)和/或通过在受试者的靶组织中植入或移植干细胞来治疗或治愈的任何疾病、病症或病状。例如,已经显示了i型糖尿病可通过造血干细胞移植物治愈,并且可受益于根据本文所述的组合物和方法的调理。可使用本文所述的组合物和方法治疗的其他病症包括但不限于镰状细胞性贫血、地中海贫血、范可尼贫血、再生障碍性贫血、威斯科特-奥尔德里奇二氏综合征、adascid、hiv/aids、异染性脑白质营养不良、戴-布二氏贫血和舒-戴二氏综合征。可使用本文所述的患者调理和/或造血干细胞移植物方法治疗的其它疾病包括遗传性血液病症(例如,镰状细胞性贫血)和自身免疫性病症,诸如硬皮病、多发性硬化、溃疡性结肠炎和克罗恩病。可使用本文所述的调理和/或移植方法治疗的其它疾病包括噁性肿瘤,诸如成神经细胞瘤或血液癌症,诸如白血病、淋巴瘤和骨髓瘤。例如,癌症可以是急性髓样白血病、急性淋巴样白血病、慢性髓样白血病、慢性淋巴样白血病、多发性骨髓瘤、弥漫性大b细胞淋巴瘤或非霍奇金淋巴瘤。可使用本文所述的调理和/或移植方法治疗的其它疾病包括骨髓增生异常综合征。在一些实施方案中,受试者患有或在其它情况下受累于代谢性贮积症。例如,受试者可以患有或在其它情况下受累于代谢病症,该代谢病症选自由以下组成的组:糖原贮积病、粘多糖症、戈谢病、胡尔勒病、鞘脂贮积病、异染性脑白质营养不良或可受益于本文公开的治疗和疗法的任何其它疾病或病症,并且包括但不限于重症综合性免疫缺陷、威斯科特-奥尔德里奇综合征、高免疫球蛋白m(igm)综合征,切东病、遗传性淋巴组织细胞增生症、骨硬化病、成骨不全、贮积病、重型地中海贫血、镰状细胞病、系统性硬化症、系统性红斑狼疮、多发性硬化、幼年型类风湿性关节炎以及“bone marrow transplantation for non-malignant disease,”ash education book,1:319-338(2000)(其公开内容通过引用整体并入本文,因为其涉及可通过施用造血干细胞移植疗法来治疗的病理学)中描述的那些疾病或病症。
[0132]
如本文所用,术语“转染”是指通常用于将外源dna引入原核或真核宿主细胞的极其多种技术中的任一种,诸如电穿孔、脂质转染、磷酸钙沉淀、deae-葡聚糖转染等。
[0133]
如本文所用,术语“治疗”或“处理”是指降低疾病症状的严重性和/或频率,消除疾病症状和/或所述症状的根本原因,降低疾病症状和/或其根本原因的频率或可能性,以及改善或补救由疾病直接或间接造成的损伤,对疾病的任何后果的任何改善,诸如延长生存期、降低发病率和/或减轻作为替代治疗形式的副产物的副作用;如本领域容易理解的,完全根除疾病是优选的,但不是治疗行为的要求。有益的或期望的临床结果包括但不限于在本文所述的抗体调理治疗和随后的造血干细胞移植物治疗后,促进患者中外源性造血细胞的植入。另外的有益结果包括调理治疗和随后对患者施用外源性造血干细胞移植物后需要造血干细胞移植物的患者中造血干细胞的细胞计数或相对浓度的增加。本文所述治疗的有益结果还可包括调理治疗和随后的造血干细胞移植物治疗后,造血谱系的一种或多种细胞的细胞计数或相对浓度的增加,所述造血谱系的一种或多种细胞诸如巨核细胞、凝血细胞、血小板、红细胞、肥大细胞、成髓细胞、嗜碱性粒细胞、嗜中性粒细胞、嗜酸性粒细胞、小胶质细胞、粒细胞、单核细胞、破骨细胞、抗原呈递细胞、巨噬细胞、树突细胞、自然杀伤细胞、t淋巴细胞或b淋巴细胞。另外的有益结果可以包括减少致病细胞群体的数量,诸如癌细胞(例
如,cd117+白血病细胞)或自身免疫细胞(例如,cd117+自身免疫淋巴细胞,例如表达与自身抗原交叉反应的t细胞受体的cd117+t细胞)的群体。在本公开的方法涉及预防病症的情况下,应理解术语“预防”不要求疾病状态被完全阻遏。相反,如本文所用,术语预防是指本领域技术人员鉴定易患病症的群体的能力,使得本公开的化合物的施用可在疾病发作之前发生。该术语并不意味着完全避免疾病状态。
[0134]
如本文所用,术语“变体”和“衍生物”可互换使用,并且是指本文所述的化合物、肽、蛋白质或其它物质的天然存在的、合成的和半合成的类似物。本文所述的化合物、肽、蛋白质或其它物质的变体或衍生物可保留或改善原始材料的生物活性。
[0135]
如本文所用,术语“载体”包括核酸载体,诸如质粒、dna载体、质粒、rna载体、病毒或其它合适的复制子。本文所述的表达载体可含有多核苷酸序列以及例如用于表达蛋白质和/或将这些多核苷酸序列整合到哺乳动物细胞基因组中的其他序列元件。可用于表达本公开的抗体和抗体片段的某些载体包括含有指导基因转录的调控序列(诸如启动子和增强子区)的质粒。用于表达抗体和抗体片段的其它有用载体含有提高这些基因的翻译速率或改善由基因转录产生的mrna的稳定性或核输出的多核苷酸序列。这些序列元件可包括例如5'和3'非翻译区和聚腺苷酸化信号位点,以指导表达载体上携带的基因的有效转录。本文所述的表达载体还可以含有编码用于选择含有这种载体的细胞的标志物的多核苷酸。合适的标志物的实例包括编码对抗生素(诸如氨苄青霉素、氯霉素、卡那霉素和诺尔丝菌素)的抗性的基因。
[0136]
如本文所用,术语“酰基”是指-c(=o)r,其中r为氢(“醛”)、烷基、烯基、炔基、碳环基、芳基、杂芳基或杂环基,如本文所定义的。非限制性实例包括甲酰基、乙酰基、丙酰基、苯甲酰基和丙烯酰基。
[0137]
如本文所用,术语“烷基”是指在链中具有例如1至20个碳原子的直链或支链烷基。烷基的实例包括甲基、乙基、正丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、叔戊基、己基、异己基等。
[0138]
如本文所用,术语“亚烷基”是指直链或支链二价烷基。二价位置可以在烷基链内的相同或不同原子上。亚烷基的实例包括亚甲基、亚乙基、亚丙基、亚异丙基等。
[0139]
如本文所用,术语“杂烷基”是指在链中具有例如1至20个碳原子并且在链中进一步含有一个或多个杂原子(例如,氧、氮或硫等)的直链或支链烷基。
[0140]
如本文所用,术语“杂亚烷基”是指直链或支链二价杂烷基。二价位置可以在杂烷基链内的相同或不同原子上。二价位置可以是一个或多个杂原子。
[0141]
如本文所用,术语“烯基”是指在链中具有例如2至20个碳原子的直链或支链烯基。烯基的实例包括乙烯基、丙烯基、异丙烯基、丁烯基、叔丁烯基、己烯基等。
[0142]
如本文所用,术语“亚烯基”是指直链或支链二价烯基。二价位置可以在烯基链内的相同或不同原子上。亚烯基的实例包括亚乙烯基、亚丙烯基、亚异丙烯基、亚丁烯基等。
[0143]
如本文所用,术语“杂烯基”是指在链中具有例如2至20个碳原子并且在链中进一步含有一个或多个杂原子(例如,氧、氮或硫等)的直链或支链烯基。
[0144]
如本文所用,术语“杂亚烯基”是指直链或支链二价杂烯基。二价位置可以在杂烯基链内的相同或不同原子上。二价位置可以是一个或多个杂原子。
[0145]
如本文所用,术语“炔基”是指在链中具有例如2至20个碳原子的直链或支链炔基。
炔基的实例包括炔丙基、丁炔基、戊炔基、己炔基等。
[0146]
如本文所用,术语“亚炔基”是指直链或支链二价炔基。二价位置可以在炔基链内的相同或不同原子上。
[0147]
如本文所用,术语“杂炔基”是指在链中具有例如2至20个碳原子并且在链中进一步含有一个或多个杂原子(例如,氧、氮或硫等)的直链或支链炔基。
[0148]
如本文所用,术语“杂亚炔基”是指直链或支链二价杂炔基。二价位置可以在杂炔基链内的相同或不同原子上。二价位置可以是一个或多个杂原子。
[0149]
如本文所用,术语“环烷基”是指饱和的且具有例如3至12个碳环原子的单环或稠合、桥接或螺多环结构。环烷基的实例包括环丙基、环丁基、环戊基、环己基、环庚基、环辛基、双环[3.1.0]己烷等。
[0150]
如本文所用,术语“亚环烷基”是指二价环烷基。二价位置可以在环结构内的相同或不同原子上。亚环烷基的实例包括亚环丙基、亚环丁基、亚环戊基、亚环己基等。
[0151]
如本文所用,术语“杂环烷基”是指饱和的且每个环结构具有例如3至12个环原子的单环或稠合、桥接或螺多环结构,所述环原子选自碳原子和杂原子,杂原子选自例如氮、氧和硫等。环结构可以在碳、氮或硫环成员上含有例如一个或多个氧代基团。杂环烷基的实例包括例如但不限于二氢吡啶基、四氢吡啶基(哌啶基)、四氢噻吩基、哌啶基、4-哌啶酮基、吡咯烷基、2-吡咯烷酮基、四氢呋喃基、四氢吡喃基、双-四氢吡喃基、四氢喹啉基、四氢异喹啉基、十氢喹啉基、八氢异喹啉基、哌嗪基、奎宁环基(quinuclidinyl)和吗啉基。
[0152]
如本文所用,术语“杂环亚烷基”是指二价杂环烷基。二价位置可以在环结构内的相同或不同原子上。
[0153]
如本文所用,术语“芳基”是指含有例如6至19个碳原子的单环或多环芳香族环体系。芳基包括但不限于苯基、芴基、萘基等。二价位置可以是一个或多个杂原子。
[0154]
如本文所用,术语“亚芳基”是指二价芳基。二价位置可以在相同或不同的原子上。
[0155]
如本文所用,术语“杂芳基”是指单环杂芳族或双环或三环稠环杂芳族基团,其中一个或多个环原子是杂原子,例如氮、氧或硫。杂芳基基团包括吡啶基、吡咯基、呋喃基、噻吩基、咪唑基、噁唑基、异噁唑基、噻唑基、异噻唑基、吡唑基、1,2,3-三唑基、1,2,4-三唑基、1,2,3-噁二唑基、1,2,4-噁二唑基、1,2,5-噁二唑基、1,3,4-噁二唑基、1,3,4-三嗪基、1,2,3-三嗪基、苯并呋喃基、[2,3-二氢]苯并呋喃基、异苯并呋喃基、苯并噻吩基、苯并三唑基、异苯并噻吩基、吲哚基、异吲哚基、3h-吲哚基、苯并咪唑基、咪唑并[1,2-a]吡啶基、苯并噻唑基、苯并噁唑基、喹嗪基、喹唑啉基、酞嗪基、喹喔啉基、噌啉基、萘啶基、吡啶并[3,4-b]吡啶基、吡啶并[3,2-b]吡啶基、吡啶并[4,3-b]吡啶基、喹啉基、异喹啉基、四唑基、5,6,7,8-四氢喹啉基、5,6,7,8-四氢异喹啉基、嘌呤基、蝶啶基、咔唑基、呫吨基、苯并喹啉基等。
[0156]
如本文所用,术语“亚杂芳基”是指二价杂芳基。二价位置可以在相同或不同的原子上。二价位置可以是一个或多个杂原子。
[0157]
除非另外受个别取代基的定义限制,否则前述化学部分,诸如“烷基”、“亚烷基”、“杂烷基”、“杂亚烷基”、“烯基”、“亚烯基”、“杂烯基”、“杂亚烯基”、“炔基”、“亚炔基”、“杂炔基”、“杂亚炔基”、“环烷基”、“环亚烷基”、“杂环烷基”、“杂环亚烷基”、“芳基”、“亚芳基”、“杂芳基”和“杂亚芳基”基团可以任选地被例如1个至5个选自由以下组成的组的取代基取代:烷基、烯基、炔基、环烷基、杂环烷基、烷基芳基、烷基杂芳基、烷基环烷基、烷基杂环烷
基、氨基、铵基、酰基、酰氧基、酰氨基、氨基羰基、烷氧基羰基、脲基、氨基甲酸酯、芳基、杂芳基、亚磺酰基、磺酰基、烷氧基、硫烷基、卤素、羧基、三卤甲基、氰基、羟基、巯基、硝基等。典型的取代基包括但不限于-x、-r、-oh、-or、-sh、-sr、nh2、-nhr、-n(r)2、-n
+
(r)3、-cx3、-cn、-ocn、-scn、-nco、-ncs、-no、-no2、-n3、-nc(=o)h、-nc(=o)r、-c(=o)h、-c(=o)r、-c(=o)nh2、-c(=o)n(r)2、-so
3-、-so3h、-s(=o)2r、-os(=o)2or、-s(=o)2nh2、-s(=o)2n(r)2、-s(=o)r、-op(=o)(oh)2、-op(=o)(or)2、-p(=o)(or)2、-po3、-po3h2、-c(=o)x、-c(=s)r、-co2h、-co2r、-co
2-、-c(=s)or、-c(=o)sr、-c(=s)sr、-c(=o)nh2、-c(=o)n(r)2、-c(=s)nh2、-c(=s)n(r)2、-c(=nh)nh2和-c(=nr)n(r)2;其中每个x在每种情况下独立地选自f、cl、br和i;并且每个r在每种情况下独立地选自烷基、芳基、杂环烷基或杂芳基、保护基团和前药部分。在基团被描述为“任选地取代”的所有情况下,该基团在每种情况下独立地可以被一个或更多个以上取代基取代。取代可以包括其中邻近取代基发生环闭合的情况,诸如邻位官能取代基的环闭合,以形成例如通过环闭合形成的内酰胺、内酯、环酐、缩醛、半缩醛、硫代缩醛、缩醛胺和半缩醛胺以提供保护基团。
[0158]
应理解,取决于上下文,某些自由基命名惯例可以包括单自由基或双自由基。例如,在取代基需要有两个与分子的其余部分的连接点的情况下,应理解该取代基是双自由基。例如,鉴定为需要两个连接点的烷基的取代基包括双自由基,诸如-ch
2-、-ch2ch
2-、-ch2ch(ch3)ch
2-等。其他自由基命名惯例清楚地表明该自由基是双自由基,诸如“亚烷基”、“亚烯基”、“亚芳基”、“杂环亚烷基”等。
[0159]
当取代基描述为双自由基(即,具有两个与分子的其余部分的连接点)时,应理解,除非另外指明,否则该取代基可以以任何定向构型连接。
[0160]“异构”是指具有相同分子式但其原子的键合顺序或其原子的空间排列不同的化合物。原子空间排列不同的异构体称为“立体异构体”。彼此不为镜像的立体异构体称为“非对映异构体”,而彼此为不可重叠镜像的立体异构体称为“对映异构体”或有时称为“光学异构体”。
[0161]
与四个不同取代基键合的碳原子称为“手性中心”。“手性异构体”是指具有至少一个手性中心的化合物。具有多于一个手性中心的化合物可以作为单独的非对映异构体或非对映异构体的混合物存在,称为“非对映异构混合物”。当存在一个手性中心时,立体异构体可通过该手性中心的绝对构型(r或s)来表征。绝对构型是指与手性中心连接的取代基的空间排列。所考虑的与手性中心连接的取代基根据cahn、ingold和prelog的顺序规则进行排序(cahn et al.,angew.chem.inter.edit.1966,5,385;errata 511;cahn et al.,angew.chem.1966,78,413;cahn and ingold,j.chem.soc.1951(london),612;cahn et al.,experientia 1956,12,81;cahn,j.chem.educ.1964,41,116)。含有等量的相反手性的个别对映体形式的混合物称为“外消旋混合物”。
[0162]
本说明书和权利要求书中公开的化合物可包含一个或多个不对称中心,并且每种化合物可存在不同的非对映异构体和/或对映异构体。除非另有说明,否则本说明书和权利要求书中对任何化合物的描述旨在包括所有对映异构体、非对映异构体及其混合物。此外,除非另有说明,否则本说明书和权利要求书中对任何化合物的描述旨在包括单独的对映异构体以及对映异构体的任何混合物(外消旋的或其它)。当化合物的结构描述为特定对映异构体时,应理解本技术的公开内容不限于该特定对映异构体。因此,本文考虑了本公开的每
个结构式的对映异构体、光学异构体和非对映异构体。在本说明书中,为了方便起见,在一些情况下,化合物的结构式代表某种异构体,但本公开包括所有异构体,诸如几何异构体、基于不对称碳的光学异构体、立体异构体、互变异构体等,应当理解并非所有异构体可具有相同水平的活性。化合物可以以不同的互变异构形式存在。除非另有说明,根据本公开的化合物旨在包括所有互变异构形式。当化合物的结构描述为特定互变异构体时,应理解本技术的公开内容不限于该特定互变异构体。
[0163]
本文所述的任何式的化合物包括化合物本身,以及它们的盐和它们的溶剂化物(如果适用的话)。例如,可以在本公开的化合物上的阴离子和带正电荷的基团(例如,氨基)之间形成盐。合适的阴离子包括氯离子、溴离子、碘离子、硫酸根、硫酸氢根、氨基磺酸根、硝酸根、磷酸根、柠檬酸根、甲磺酸根、三氟乙酸根、谷氨酸根、葡糖醛酸根、戊二酸根、苹果酸根、马来酸根、琥珀酸根、富马酸根、酒石酸根、甲苯磺酸根、水杨酸根、乳酸根、萘磺酸根和乙酸根(例如,三氟乙酸根)。术语“药学上可接受的阴离子”是指适于形成药学上可接受的盐的阴离子。同样地,还可以在阳离子和本公开的化合物上的带负电荷的基团(例如,羧酸根)之间形成盐。合适的阳离子包括钠离子、钾离子、镁离子、钙离子和铵阳离子(诸如四甲基铵离子)。一些合适的取代的铵离子的实例是衍生自以下的那些:乙胺、二乙胺、二环己胺、三乙胺、丁胺、乙二胺、乙醇胺、二乙醇胺、哌嗪、苄胺、苯基苄胺、胆碱、葡甲胺和氨丁三醇,以及氨基酸,诸如赖氨酸和精氨酸。本公开的化合物还包括含有季氮原子的那些盐。
[0164]
合适的无机阴离子的实例包括但不限于衍生自以下无机酸的那些:盐酸、氢溴酸、氢碘酸、硫酸、亚硫酸、硝酸、亚硝酸、磷酸和亚磷酸。合适的有机阴离子的实例,包括但不限于,衍生自以下有机酸的那些:2-乙酰氧基苯甲酸、乙酸、抗坏血酸、天冬氨酸、苯甲酸、樟脑磺酸、肉桂酸、柠檬酸、乙二胺四乙酸、乙二磺酸、乙磺酸、富马酸、葡庚糖酸、葡糖酸、谷氨酸、乙醇酸、羟基马来酸、羟基萘羧酸、羟乙磺酸、乳酸、乳糖酸、月桂酸、马来酸、苹果酸、甲磺酸、粘酸、油酸、草酸、棕榈酸、双羟萘酸、泛酸、苯乙酸、苯磺酸、丙酸、丙酮酸、水杨酸、硬脂酸、琥珀酸、磺胺酸、酒石酸、甲苯磺酸和戊酸。合适的聚合有机阴离子的实例包括但不限于衍生自以下聚合酸的那些:单宁酸、羧甲基纤维素。
[0165]
另外,本公开的化合物,例如化合物的盐,可以以水合或非水合(无水)形式或作为与其它溶剂分子的溶剂化物存在。水合物的非限制性实例包括一水合物、二水合物等。溶剂化物的非限制性实例包括乙醇溶剂化物、丙酮溶剂化物等。“溶剂化物”是指含有化学计量或非化学计量量的溶剂的溶剂加成形式。一些化合物倾向于在结晶固态中捕获固定摩尔比的溶剂分子,从而形成溶剂化物。如果溶剂是水,则形成的溶剂化物为水合物;而如果溶剂是醇,则形成的溶剂化物为醇化物。水合物通过一个或多个水分子与一个水分子保持其分子状态为h2o的一个物质分子的组合而形成。水合物是指例如一水合物、二水合物、三水合物等。
[0166]
此外,由本文公开的式表示的化合物或其盐可存在晶体多晶型。应注意,任何晶型、晶型混合物或其酸酐或水合物都包括在本公开的范围内。
[0167]
抗cd117抗体
[0168]
本公开部分地基于可用于治疗目的的新型抗cd117抗体及其抗原结合部分的发现。本公开还部分地基于以下发现:能够结合cd117(诸如gnnk+cd117)的抗体或其抗原结合片段可单独用作治疗剂(或用作adc)以(i)治疗以cd117+细胞为特征的癌症(诸如急性髓性
白血病或骨髓增生异常综合征)和自身免疫性疾病以及(ii)促进需要移植治疗的患者中移植的造血干细胞的植入。这些治疗活性可以例如通过抗cd117抗体或其抗原结合片段与细胞(诸如癌细胞、自身免疫细胞或造血干细胞)表面上表达的cd117(例如gnnk+cd117)的结合并随后诱导细胞死亡而引起。内源性造血干细胞的耗尽可以提供移植的造血干细胞可以归巢的小生境,并随后建立富有成效的造血功能。以这种方式,移植的造血干细胞可以成功地移植到患者中,诸如患有本文所述的干细胞病症的人类患者。
[0169]
能够结合人cd117(也称为c-kit,mrna ncbi参考序列:nm_000222.2,protein ncbi参考序列:np_000213.1)的抗体和抗原结合片段(包括能够结合gnnk+cd117的那些)可以与本文描述的组合物和方法结合使用,以对患者进行调理以进行造血干细胞移植物治疗。在相当大百分比的群体中影响cd117的编码区或胞外结构域的多态性目前在非肿瘤学适应症中尚不是熟知的。已鉴定出cd117的至少四种同种型,具有在肿瘤细胞中表达的其它同种型的潜力。cd117同种型中的两种位于蛋白质的细胞内结构域,并且两种存在于外部近膜区。两种细胞外同种型gnnk+和gnnk-在4个氨基酸的序列的存在(gnnk+)或不存在(gnnk-)中有所不同。据报道,这些同种型对配体(scf)具有相同的亲和力,但是据报道,配体与gnnk-同种型的结合增加了内化和降解。gnnk+同种型可用作免疫原以产生能够结合cd117的抗体,因为针对该同种型产生的抗体将包括gnnk+和gnnk-蛋白。
[0170]
在一些实施方案中,抗体或其抗原结合片段在位于seq id no:1的氨基酸残基内的表位处结合人cd117。seq id no:1对应于人cd117抗原并具有以下氨基酸序列:
[0171][0172]
如pct/us2018/057180(其公开内容通过引用整体并入本文)所述,进行人抗体的scfv噬菌体展示文库筛选以鉴定具有治疗用途的新型抗cd117抗体及其片段。在该筛选中鉴定了抗体85(ab85)等。
[0173]
ab85的重链可变区(vh)氨基酸序列在下面作为seq id no:2提供。ab85的vh cdr氨基酸序列在下面加下划线并且如下:nywig(vh cdr1;seq id no:3);iinprdsdtryrpsfqg(vh cdr2;seq id no:4);以及hgrgyegyegafdi(vh cdr3;seq id no:5)。
[0174]
ab85 vh序列
[0175][0176]
ab85的轻链可变区(vl)氨基酸序列在下文中提供为seq id no:6。ab85的vl cdr氨基酸序列在下面加下划线并且如下:rssqgirsdlg(vl cdr1;seq id no:7);dasnlet(vl cdr2;seq id no:8);以及qqangfplt(vl cdr3;seq id no:9)。
[0177]
ab85 vl序列
[0178][0179]
人抗体ab85源自抗体ck6,其为一种拮抗性抗cd117抗体。ab85和ab249的可变区的氨基酸序列与ck6的比较示于图1a至1b(其中也指定了cdr)。与ck6相比,ab85抗体具有改善的特性,例如改善的结合特性。
[0180]
ck6在重链可变区的cdr3结构域中包括潜在的脱酰胺位点。虽然为了将来生产抗体而除去是有利的,但天冬酰胺的位置存在重大挑战。然而,在ab85重链cdr3中成功除去了潜在的脱酰胺位点,使得抗体(具有ab85重链和轻链cdr)能够保持对人cd117的高亲和力水平特异性和内化能力。此外,ab85相对于其亲本具有改善的解离速率。
[0181]
因此,在某些实施方案中,抗cd117抗体包含重链和轻链,并在表达cd117的细胞中内化,所述重链包含seq id no:3、4和5中所示的cdr组(cdr1、cdr2和cdr3),所述轻链包含seq id no:7、8和9中所示的cdr组。
[0182]
本文所述的抗cd117抗体或结合片段还可以包括改变抗体和/或片段的性质的修饰和/或突变,例如增加半衰期、增加或减少adcc等的那些,如本领域已知的。
[0183]
在一个实施方案中,抗cd117抗体或其结合片段包含变体(或修饰的)fc区,其中所述变体fc区相对于野生型fc区包含至少一个氨基酸修饰,使得所述分子对fcγr具有改变的亲和力。通过结晶学研究已知fc区内的某些氨基酸位置与fcγr直接接触。具体而言,氨基酸234-239(铰链区)、氨基酸265-269(b/c环)、氨基酸297-299(c’/e环)和氨基酸327-332(f/g)环。(参见sondermann et al.,2000nature,406:267-273)。例如,在fc区氨基酸位置234和235处的氨基酸取代已鉴定为降低igg抗体结合fc受体,特别是fcγ受体(fcγr)的亲和力。在一个实施方案中,本文所述的抗cd117抗体包含fc区,该fc区包含l234和/或l235处的氨基酸取代,例如,l234a和l235a(eu索引)。在一些实施方案中,本文所述的抗cd117抗体可包含变体fc区,该变体fc区包含基于结构和晶体学分析与fcγr直接接触的至少一个残基的修饰。在一个实施方案中,根据kabat et al.,sequences of proteins of immunological interest,5th ed.public health service,nh1,md(1991)(通过引用明确并入本文)的eu索引,抗cd117抗体(或其含有fc的片段)的fc区在氨基酸265处包含氨基酸取代。“kabat中的eu索引”或“eu索引”是指人igg1eu抗体的编号,并且在本文中用于参考fc氨基酸位置,除非另有说明。
[0184]
在一个实施方案中,fc区包含d265a突变。在一个实施方案中,fc区包含d265c突变。
[0185]
在一些实施方案中,根据kabat中的eu索引,抗cd117抗体(或其片段)的fc区在氨基酸234处包含氨基酸取代。在一个实施方案中,fc区包含l234a突变。在一些实施方案中,根据kabat中的eu索引,抗cd117抗体(或其片段)的fc区在氨基酸235处包含氨基酸取代。在一个实施方案中,fc区包含l235a突变。在另一个实施方案中,fc区包含l234a和l235a突变。在另一个实施方案中,fc区包含d265c、l234a和l235a突变。
[0186]
在一些实施方案中,根据kabat中的eu索引,抗cd117抗体(或其片段)的fc区在氨基酸239处包含氨基酸取代。在一个实施方案中,fc区包含s239c突变。
[0187]
在一个实施方案中,fc区在氨基酸位置d265、v205、h435、i253和/或h310处包含突
变。例如,在这些位置的特定突变包括d265c、v205c、h435a、i253a和/或h310a。
[0188]
在一个实施方案中,fc区包含l234a突变。在一些实施方案中,根据kabat中的eu索引,抗cd117抗体(或其片段)的fc区在氨基酸235处包含氨基酸取代。在一个实施方案中,fc区包含l235a突变。在另一个实施方案中,fc区包含l234a和l235a突变。在另一个实施方案中,fc区包含d265c、l234a和l235a突变。在另一个实施方案中,fc区包含d265c、l234a、l235a和h435a突变。在另一个实施方案中,fc区包含d265c和h435a突变。
[0189]
在另一个实施方案中,fc区包含l234a和l235a突变(本文也称为“l234a.l235a”或“lala”)。在另一个实施方案中,fc区包含l234a和l235a突变,其中fc区不包含p329g突变。在另一个实施方案中,fc区包含d265c、l234a和l235a突变(本文也称为“d265c.l234a.l235a”)。在另一个实施方案中,fc区包含d265c、l234a和l235a突变,其中fc区不包含p329g突变。在另一个实施方案中,fc区包含d265c、l234a、l235a和h435a突变(本文也称为“d265c.l234a.l235a.h435a”)。在另一个实施方案中,fc区包含d265c、l234a、l235a和h435a突变,其中fc区不包含p329g突变。在另一个实施方案中,fc区包含d265c和h435a突变(本文也称为“d265c.h435a”)。在另一个实施方案中,fc区包含d265a,s239c,l234a和l235a突变(本文也称为“d265a.s239c.l234a.l235a”)。在另一个实施方案中,fc区包含d265a、s239c、l234a和l235a突变,其中fc区不包含p329g突变。在另一个实施方案中,fc区包含d265c、n297g和h435a突变(本文也称为“d265c.n297g.h435a”)。在另一个实施方案中,fc区包含d265c、n297q和h435a突变(本文也称为“d265c.n297q.h435a”)。在另一个实施方案中,fc区包含e233p、l234v、l235a和delg236(236缺失)突变(本文也称为“e233p.l234v.l235a.delg236”或“eplvladelg”)。在另一个实施方案中,fc区包含e233p、l234v、l235a和delg236(236缺失)突变,其中fc区不包含p329g突变。在另一个实施方案中,fc区包含e233p、l234v、l235a、delg236(236缺失)和h435a突变(本文也称为“e233p.l234v.l235a.delg236.h435a”或“eplvladelg.h435a”)。在另一个实施方案中,fc区包含e233p、l234v、l235a、delg236(236缺失)和h435a突变,其中fc区不包含p329g突变。在另一个实施方案中,fc区包含l234a、l235a、s239c和d265a突变。在另一个实施方案中,fc区包含l234a、l235a、s239c和d265a突变,其中fc区不包含p329g突变。在另一个实施方案中,fc区包含h435a、l234a、l235a和d265c突变。在另一个实施方案中,fc区包含h435a、l234a、l235a和d265c突变,其中fc区不包含p329g突变。
[0190]
在一些实施方案中,抗体具有修饰的fc区,使得在体外效应子功能测定中,在相对于包含未修饰的fc区的相同抗体与fcr的结合,与fc受体(fc r)的结合降低的情况下,抗cd117抗体降低效应子功能。在一些实施方案中,抗体具有修饰的fc区,使得在体外效应子功能测定中,在相对于包含未修饰的fc区的相同抗体与fcγr的结合,与fcγ受体(fcγr)的结合降低的情况下,抗cd117抗体降低效应子功能。在一些实施方案中,fcγr为fcγr1。在一些实施方案中,fcγr为fcγr2a。在一些实施方案中,fcγr为fcγr2b。在其它实施方案中,fcγr为fcγr2c。在一些实施方案中,fcγr为fcγr3a。在一些实施方案中,fcγr为fcγr3b。在其它实施方案中,相对于包含未修饰的fc区的相同抗体与fcγr的结合,结合的减少为抗体与fcγr的结合减少至少70%,减少至少80%,减少至少90%,减少至少95%,减少至少98%,减少至少99%或减少100%。在其它实施方案中,相对于包含未修饰的fc区的相同抗体与fcγr的结合,结合的减少为抗体与fcγr的结合减少至少70%至100%,减少至
少80%至100%,减少至少90%至100%,减少至少95%至100%,或减少至少98%至100%。
[0191]
在一些实施方案中,抗cd117抗体具有经修饰的fc区,使得该抗体在体外细胞因子释放测定中减少细胞因子释放,其中相对于包含未修饰的fc区的相同抗体的细胞因子释放,细胞因子释放减少至少50%。在一些实施方案中,相对于包含未修饰的fc区的相同抗体的细胞因子释放,细胞因子释放的减少是细胞因子释放减少至少70%,减少至少80%,减少至少90%,减少至少95%,减少至少98%,减少至少99%或减少100%。在一些实施方案中,相对于包含未修饰的fc区的相同抗体的细胞因子释放,细胞因子释放的减少是细胞因子释放减少至少70%至100%,减少至少80%至100%,减少至少90%至100%,减少至少95%至100%。在某些实施方案中,细胞因子释放是由免疫细胞释放的。
[0192]
在一些实施方案中,抗cd117抗体具有修饰的fc区,使得所述抗体在体外肥大细胞脱粒测定中减少肥大细胞脱粒,相对于包含未修饰的fc区的相同抗体的肥大细胞脱粒,肥大细胞脱粒减少至少50%。在一些实施方案中,相对于包含未修饰的fc区的相同抗体的肥大细胞脱粒,肥大细胞脱粒的减少是减少至少70%,减少至少80%,减少至少90%,减少至少95%,减少至少98%,减少至少99%或减少100%。在一些实施方案中,相对于包含未修饰的fc区的相同抗体的肥大细胞脱粒,肥大细胞脱粒的减少是减少至少70%至100%,减少至少80%至100%,减少至少90%至100%,或减少至少95%至100%。
[0193]
在一些实施方案中,抗cd117抗体具有经修饰的fc区,使得该抗体在体外抗体依赖性细胞吞噬作用测定中减少或防止抗体依赖性细胞吞噬作用(adcp),其中相对于包含未修饰的fc区的相同抗体的adcp,adcp减少至少50%。在一些实施方案中,相对于包含未修饰的fc区的相同抗体的细胞因子释放,adcp的减少是细胞因子释放减少至少70%,减少至少80%,减少至少90%,减少至少95%,减少至少98%,减少至少99%或减少100%。
[0194]
在一些实施方案中,如本文所述的抗cd117抗体包含fc区,该fc区包含以下修饰之一或修饰的组合:d265a、d265c、d265c/h435a、d265c/lala、d265c/lala/h435a、d265a/s239c/l234a/l235a/h435a、d265a/s239c/l234a/l235a、d265c/n297g、d265c/n297g/h435a、d265c(eplvladelg*)、d265c(eplvladelg)/h435a、d265c/n297q/h435a、d265c/n297q、eplvladelg/h435a、eplvladelg/d265c、eplvladelg/d265a、n297a、n297g或n297q。在一些实施方案中,本文的抗cd117抗体包含fc区,该fc区包含以下修饰之一或修饰的组合:d265a、d265c、d265c/h435a、d265c/lala、d265c/lala/h435a、d265c/n297g、d265c/n297g/h435a、d265c(igg2*)、d265c(igg2)/h435a、d265c/n297q/h435a、d265c/n297q、eplvladelg/h435a、n297a、n297g或n297q。
[0195]
修饰的fc区与fcγ受体之间的结合或亲和力可使用本领域已知的多种技术测定,例如但不限于平衡方法(例如,酶联免疫吸附测定(elisa);kinexa,rathanaswami et al.analytical biochemistry,vol.373:52-60,2008;或放射免疫测定(ria)),或通过表面等离振子共振测定或其他基于动力学的机制的测定(例如,biacore.rtm.分析或octettm分析(fortebio)),以及其他方法,诸如间接结合测定、竞争性结合测定、荧光共振能量转移(fret)、凝胶电泳和色谱法(例如,凝胶过滤)。这些和其它方法可以在检查的组分的一种或多种上使用标记物和/或采用各种检测方法(包括但不限于显色、荧光、发光或同位素标记物)。结合亲和力和动力学的详细描述可见于paul,w.e.,ed.,fundamental immunology,4th ed.,lippincott-raven,philadelphia(1999),其重点在于抗体-免疫原相互作用。竞
争性结合测定的一个实例是放射免疫测定,其包括在存在增加量的未标记抗原的情况下将标记抗原与感兴趣的抗体温育,并检测与标记抗原结合的抗体。感兴趣的抗体对特定抗原的亲和力和结合解离速率可通过scatchard作图分析由数据确定。与第二抗体的竞争也可以使用放射免疫测定法来测定。在这种情况下,在增加量的未标记的第二抗体存在下,将抗原与同标记化合物缀合的感兴趣的抗体一起温育。
[0196]
在一个实施方案中,相对于包含未修饰的fc区的相同抗体与fcγ受体的结合,具有本文所述fc修饰(例如,d265c、l234a、l235a和/或h435a)的抗体与fcγ受体的结合具有至少70%减少,至少80%减少,至少90%减少,至少95%减少,至少98%减少,至少99%减少或100%减少。
[0197]
不希望受任何理论束缚,据信fc区与fcγ受体的结合相互作用对于多种效应子功能和下游信号事件是必需的,所述效应子功能和下游信号事件包括但不限于抗体依赖性细胞介导的细胞毒性(adcc)和补体依赖性细胞毒性(cdc)。因此,在某些方面,包含修饰的fc区(例如,包含l234a、l235a和/或d265c突变)的抗体具有显著降低的或消除的效应子功能。效应子功能可以使用本领域已知的多种方法测定,例如通过测量响应于感兴趣的抗体的细胞反应(例如,肥大细胞脱粒或细胞因子释放)。例如,使用本领域的标准方法,可以测定fc修饰的抗体在例如人外周血单个核细胞中引发肥大细胞脱粒的能力或引发例如人外周血单个核细胞的细胞因子释放的能力。
[0198]
在某些方面,变体igg fc结构域包含一个或多个氨基酸取代,导致与不包含一个或多个氨基酸取代的野生型fc结构域相比对fcgammar和/或c1q的结合亲和力降低或消除。fc结合相互作用对于多种效应子功能和下游信号事件是必需的,所述效应子功能和下游信号事件包括但不限于抗体依赖性细胞介导的细胞毒性(adcc)和补体依赖性细胞毒性(cdc)。因此,在某些方面,包含修饰的fc区(例如,包含l234a、l235a和d265c突变)的抗体具有显著降低的或消除的效应子功能。
[0199]
对fc区的亲和力可以使用本领域已知的多种技术测定,例如但不限于平衡方法(例如,酶联免疫吸附测定(elisa);kinexa,rathanaswami et al.analytical biochemistry,vol.373:52-60,2008;或放射免疫测定(ria)),或通过表面等离振子共振测定或基于动力学的其他机制的测定(例如biacore
tm
分析或octet
tm
分析(fortebio)),以及其他方法,诸如间接结合测定、竞争性结合测定、荧光共振能量转移(fret)、凝胶电泳和色谱法(例如,凝胶过滤)。这些和其它方法可以在检查的组分的一种或多种上使用标记物和/或各种检测方法(包括但不限于显色、荧光、发光或同位素标记物)。结合亲和力和动力学的详细描述可见于paul,w.e.,ed.,fundamental immunology,4th ed.,lippincott-raven,philadelphia(1999),其重点在于抗体-免疫原相互作用。竞争性结合测定的一个实例是放射免疫测定,其包括在存在增加量的未标记抗原的情况下将标记抗原与感兴趣的抗体温育,并检测与标记抗原结合的抗体。感兴趣的抗体对特定抗原的亲和力和结合解离速率可通过scatchard作图分析由数据确定。与第二抗体的竞争也可以使用放射免疫测定法来测定。在这种情况下,在增加量的未标记的第二抗体存在下,将抗原与同标记化合物缀合的感兴趣的抗体一起温育。
[0200]
在一个实施方案中,本文所述的抗cd117抗体包含fc区,该fc区包含l235a、l235a和d265c(eu索引)。本公开的抗体可以通过引入另外的fc突变而被进一步工程化以进一步
调节抗体半衰期,诸如在例如(dall'acqua et al.(2006)j biol chem 281:23514-24)、(zalevsky et al.(2010)nat biotechnol28:157-9)、(hinton et al.(2004)j biol chem 279:6213-6)、(hinton et al.(2006)j immunol 176:346-56)、(shields et al.(2001)j biol chem 276:6591-604)、(petkova et al.(2006)int immunol 18:1759-69)、(datta-mannan et al.(2007)drug metab dispos 35:86-94)、(vaccaro et al.(2005)nat biotechnol 23:1283-8)、(yeung et al.(2010)cancer res 70:3269-77)和(kim et al.(1999)eur j immunol29:2819-25)中描述的那些,并且包括位置250、252、253、254、256、257、307、376、380、428、434和435。可单独或组合产生的示例性突变为t250q、m252y、i253a、s254t、t256e、p2571、t307a、d376v、e380a、m428l、h433k、n434s、n434a、n434h、n434f、h435a和h435r突变。
[0201]
因此,在一个实施方案中,fc区包含导致半衰期缩短的突变。具有短半衰期的抗体在某些情况下可能是有利的,其中预期该抗体作为短寿命治疗剂起作用,例如本文所述的调理步骤,其中施用该抗体后施用hsc。理想地,该抗体在递送hsc之前基本上清除,hsc通常也表达cd117,但不是抗cd117抗体的靶标,这与内源性干细胞不同。在一个实施方案中,fc区在位置435(根据kabat的eu索引)处包含突变。在一个实施方案中,突变为h435a突变。
[0202]
在一个实施方案中,本文所述的抗cd117抗体的半衰期等于或小于约24小时,等于或小于约22小时,等于或小于约20小时,等于或小于约18小时,等于或小于约16小时,等于或小于约14小时,等于或小于约13小时,等于或小于约12小时,或等于或小于约11小时。在一个实施方案中,该抗体的半衰期为约11小时至约24小时;约12小时至约22小时;约10小时至约20小时;约8小时至约18小时;或约14小时至约24小时。
[0203]
在一些方面,fc区包含两个或更多个突变,其赋予缩短的半衰期并极大地降低或完全消除抗体的效应子功能。在一些实施方案中,fc区包含导致半衰期缩短的突变和至少一个可与fcγr直接接触的残基的突变(例如,基于结构和结晶学分析)。在一个实施方案中,fc区包含h435a突变、l234a突变和l235a突变。在一个实施方案中,fc区包含h435a突变和d265c突变。在一个实施方案中,fc区包含h435a突变、l234a突变、l235a突变和d265c突变。在一个实施方案中,fc区包含s239c突变。
[0204]
在一些实施方案中,抗cd117抗体或其抗原结合片段通过抗体或其抗原结合片段的fc结构域中的半胱氨酸残基与细胞毒素(例如,加利车霉素(calicheamicin))缀合。在一些实施方案中,通过抗体或其抗原结合片段的fc结构域中的突变引入半胱氨酸残基。例如,半胱氨酸残基可以选自由cys118、cys239(例如,s239c)和cys265组成的组。在一个实施方案中,根据kabat中的eu索引,抗cd117抗体(或其片段)的fc区在氨基酸265处包含氨基酸取代。在一个实施方案中,fc区包含d265c突变。在一个实施方案中,fc区包含d265c和h435a突变。在一个实施方案中,fc区包含d265c、l234a和l235a突变。在一个实施方案中,fc区包含d265c、l234a、l235a和h435a突变。在一个实施方案中,根据kabat中的eu索引,抗cd117抗体或其抗原结合片段的fc区在氨基酸239处包含氨基酸取代。在一个实施方案中,fc区包含s239c突变。在一个实施方案中,fc区包含l234a突变、l235a突变、s239c突变和d265a突变。在另一个实施方案中,fc区包含s239c和h435a突变。在另一个实施方案中,fc区包含l234a突变、l235a突变和s239c突变。在另一个实施方案中,fc区包含h435a突变、l234a突变、l235a突变和s239c突变。在另一个实施方案中,fc区包含h435a突变、l234a突变、l235a突
变、s239c突变和d265a突变。
[0205]
值得注意的是,除非另有说明,fc氨基酸位置参照eu编号索引。
[0206]
在这些方面的一些实施方案中,半胱氨酸残基天然存在于抗cd117抗体或其抗原结合片段的fc结构域中。例如,fc结构域可以是igg fc结构域,诸如人igg1 fc结构域,并且半胱氨酸残基可以选自由cys261、csy321、cys367和cys425组成的组。
[0207]
本文所述的变体fc结构域根据组成它们的氨基酸修饰来定义。对于本文关于fc区讨论的所有氨基酸取代,编号总是根据eu索引。因此,例如,d265c是一种相对于亲本fc结构域在eu位置265处的天冬氨酸(d)被半胱氨酸(c)取代的fc变体。同样,例如,d265c/l234a/l235a定义了相对于亲本fc结构域在eu位置265(d到c)、234(l到a)和235(l到a)具有取代的变体fc变体。变体也可根据其在突变eu氨基酸位置的最终氨基酸组成来命名。例如,l234a/l235a突变体可称为lala。注意,提供取代的顺序是任意的。
[0208]
可与本文所述的患者调理方法结合使用的抗cd117抗体包括例如从atcc登录号10716(保藏为ba7.3c.9)产生和释放的抗体,诸如sr-1抗体,其描述于例如美国专利号5,489,516中,其公开内容通过引用并入本文,因为其涉及抗cd117抗体。
[0209]
在一个实施方案中,本文所述的抗cd117抗体包含fc区,该fc区包含l235a、l235a、d265c和h435a(eu索引)。
[0210]
可与本文所述的患者调节方法结合使用的其他抗cd117抗体包括美国专利号7,915,391中描述的那些,其描述例如人源化sr-1抗体;美国专利号5,808,002,其描述了例如抗cd117 a3c6e2抗体,以及描述于例如wo2015/050959中的那些,其描述了与含有人cd117的pro317、asn320、glu329、val331、asp332、lus358、glue360、glue376、his378和/或thr380的表位结合的抗cd117抗体;以及us 2012/0288506(也公开为美国专利号8,552,157),其描述了例如具有以下cdr序列的抗cd117抗体ck6:
[0211]
具有氨基酸序列sywig(seq id no:23)的cdr-h1;
[0212]
具有氨基酸序列iiypgdsdtryspsfqg(seq id no:24)的cdr-h2;
[0213]
具有氨基酸序列hgrgyngyegafdi(seq id no:25)的cdr-h3;
[0214]
具有氨基酸序列rasqgissala(seq id no:27)的cdr-l1;
[0215]
具有氨基酸序列dassles(seq id no:28)的cdr-l2;以及
[0216]
具有氨基酸序列cqqfnsyplt(seq id no:29)的cdr-l3。
[0217]
ck6的重链可变区氨基酸序列提供于seq id no:22):
[0218][0218]
(seq id no:22;cdr以粗体加下划线表示)。
[0219]
ck6的轻链氨基酸可变区序列提供于seq id no:26:
[0220][0220]
(seq id no:26;cdr以粗体加下划线表示)。
[0221]
可与本文所述的组合物和方法结合使用的其他抗cd117抗体及其抗原结合片段包
括us2015/0320880中所述的那些,诸如克隆9p3、neg024、neg027、neg085、neg086和20376。
[0222]
上述每篇出版物的公开内容均通过引用并入本文,因为它们涉及抗cd117抗体。可与本文所述的组合物和方法结合使用的抗体和抗原结合片段包括上述抗体和其抗原结合片段,以及上述那些非人抗体和抗原结合片段的人源化变体和结合与上述那些相同表位的抗体或抗原结合片段,如例如通过竞争性cd117结合测定所评估的。
[0223]
上述抗体的示例性抗原结合片段包括双可变免疫球蛋白结构域、单链fv分子(scfv)、双抗体、三抗体、纳米抗体、抗体样蛋白支架、fv片段、fab片段、f(ab’)2分子和串联双scfv等。
[0224]
抗体可以使用重组方法和组合物产生,例如,如美国专利号4,816,567中所述。在一个实施方案中,提供了编码本文所述的抗cd117抗体的分离的核酸。这种核酸可以编码包含抗体的vl的氨基酸序列和/或包含抗体的vh的氨基酸序列(例如,抗体的轻链和/或重链)。在另一个实施方案中,提供了一种或多种包含这种核酸的载体(例如,表达载体)。在另一个实施方案中,提供了一种包含这种核酸的宿主细胞。在一个这样的实施方案中,宿主细胞包含(例如,已用其转化):(1)一种包含核酸的载体,该核酸编码包含抗体vl的氨基酸序列和包含抗体vh的氨基酸序列,或(2)包含核酸的第一载体,该核酸编码包含抗体vl的氨基酸序列,和包含核酸的第二载体,该核酸编码包含抗体vh的氨基酸序列。在一个实施方案中,宿主细胞是真核的,例如,中国仓鼠卵巢(cho)细胞或淋巴样细胞(例如,y0、ns0、sp20细胞)。在一个实施方案中,提供了一种制备抗cll-1抗体的方法,其中该方法包含在适合于抗体表达的条件下培养包含编码如上提供的抗体的核酸的宿主细胞,并任选地从宿主细胞(或宿主细胞培养基)中回收抗体。
[0225]
为了重组产生抗cd117抗体,分离编码抗体的核酸,例如如上所述,并将其插入一种或多种载体中,用于在宿主细胞中进一步克隆和/或表达。可以使用常规方法(例如,通过使用能够与编码抗体的重链和轻链的基因特异性结合的寡核苷酸探针)容易地分离和测序这种核酸。
[0226]
用于克隆或表达编码抗体的载体的合适宿主细胞包括本文所述的原核或真核细胞。例如,抗体可以在细菌中产生,特别是当不需要糖基化和fc效应子功能时。对于抗体片段和多肽在细菌中的表达,参见例如美国专利号5,648,237、5,789,199和5,840,523(也参见charlton,methods in molecular biology,vol.248(b.k.c.lo,ed.,humana press,totowa,n.j.,2003),pp.245-254,描述抗体片段在大肠杆菌(e.coli)中的表达)。表达后,抗体可以以可溶性级分从细菌细胞糊(bacterial cell paste)中分离,并可进一步纯化。
[0227]
脊椎动物细胞也可用作宿主。例如,适于在悬浮液中生长的哺乳动物细胞系可能是有用的。有用的哺乳动物宿主细胞系的其他实例是由sv40(cos-7)转化的猴肾cv1系;人胚胎肾系(293或293细胞,如例如graham et al.,j.gen virol.36:59(1977)中所述);幼仓鼠肾细胞(bhk);小鼠支持细胞(tm4细胞,如例如mather,biol.reprod.23:243-251(1980)中所述);猴肾细胞(cv1);非洲绿猴肾细胞(vero-76);人宫颈癌细胞(hela);犬肾细胞(mdck);buffalo大鼠肝细胞(brl 3a);人肺细胞(w138);人肝细胞(hep g2);小鼠乳腺肿瘤(mmt 060562);tri细胞,如例如mather et al.,annals n.y.acad.sci.383:44-68(1982)中所述;mrc 5细胞;以及fs4细胞。其它有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(cho)细胞,包括dhfr-cho细胞(urlaub et al.,proc.natl.acad.sci.usa 77:4216
(1980));以及骨髓瘤细胞系诸如y0、ns0和sp2/0。关于适用于抗体生产的某些哺乳动物宿主细胞系的综述,参见例如yazaki and wu,methods in molecular biology,vol.248(b.k.c.lo,ed.,humana press,totowa,n.j.),pp.255-268(2003)。
[0228]
在一个实施方案中,抗cd117抗体或其抗原结合片段包含具有与本文公开的seq id nos至少约80%,约85%,约90%,约91%,约92%,约93%,约94%,约95%,约96%,约97%,约98%,约99%或更高相同的氨基酸序列的可变区。或者,抗cd117抗体或其抗原结合片段包含cdr和本文所述的可变区的框架区,该cdr包含本文公开的seq id no,该框架区具有与本文公开的seq id no至少约80%,约85%,约90%,约91%,约92%,约93%,约94%,约95%,约96%,约97%,约98%,约99%或更高相同的氨基酸序列。
[0229]
在一个实施方案中,抗cd117抗体或其抗原结合片段包含具有本文公开的氨基酸序列的重链可变区和重链恒定区。在另一个实施方案中,抗cd117抗体或其抗原结合片段包含具有本文公开的氨基酸序列的轻链可变区和轻链恒定区。在另一个实施方案中,抗cd117抗体或其抗原结合片段包含具有本文公开的氨基酸序列的重链可变区、轻链可变区、重链恒定区和轻链恒定区。
[0230]
鉴定抗cd117抗体的方法
[0231]
用于高通量筛选能够结合cd117(例如,gnnk+cd117)的分子的抗体或抗体片段文库的方法可用于鉴定和亲和力成熟抗体,该抗体可用于治疗癌症、自身免疫性疾病以及调节需要如本文所述的造血干细胞治疗的患者(例如,人类患者)。这种方法包括本领域已知的体外展示技术,诸如噬菌体展示、细菌展示、酵母展示、哺乳动物细胞展示、核糖体展示、mrna展示和cdna展示等。使用噬菌体展示来分离结合生物相关分子的配体已被综述于,例如,felici et al.,biotechnol.annual rev.1:149-183,1995;katz,annual rev.biophys.biomol.struct.26:27-45,1997;和hoogenboom et al.,immunotechnology 4:1-20,1998,其各自的公开内容通过引用并入本文,因为它们涉及体外展示技术。已构建了随机组合肽文库来选择结合细胞表面抗原的多肽,如kay,perspect.drug discovery des.2:251-268,1995和kay et al.,mol.divers.1:139-140,1996中所述,其各自的公开内容通过引用并入文本,因为它们涉及抗原结合分子的发现。蛋白质(诸如多聚体蛋白质)已经成功地噬菌体展示为功能分子(参见例如ep 0349578;ep 4527839;和ep 0589877,以及chiswell and mccafferty,trends biotechnol.10:80-84 1992,其各自的公开内容通过引用并入本文,因为它们涉及体外展示技术用于发现抗原结合分子的用途)。此外,功能性抗体片段(诸如fab和scfv片段)已经以体外展示形式表达(参见例如mccafferty et al.,nature 348:552-554,1990;barbas et al.,proc.natl.acad.sci.usa 88:7978-7982,1991;和clackson et al.,nature352:624-628,1991,其各自的公开内容通过引用并入本文,因为它们涉及用于发现抗原结合分子的体外展示平台)。这些技术尤其可用于鉴定和改善结合cd117(例如,gnnk+cd117)的抗体的亲和力,该抗体又可用于耗尽需要造血干细胞移植物治疗的患者(例如,人类患者)中的内源性造血干细胞。
[0232]
除体外展示技术外,计算建模技术可用于设计和鉴定结合cd117(例如gnnk+cd117)的抗体或抗体片段。例如,使用计算建模技术,本领域技术人员可以在计算机上筛选抗体或抗体片段的文库,筛选能够结合特异性表位(诸如该抗原的胞外表位)的分子。通过这些计算技术鉴定的抗体或其抗原结合片段可与本文所述的治疗方法结合使用,例如本文
所述的癌症和自身免疫性疾病治疗方法和本文所述的患者调理方法。
[0233]
可以使用其他技术来鉴定结合细胞(例如,癌细胞、自身免疫细胞或造血干细胞)表面上的cd117(例如,gnnk+cd117)并且由细胞内化(例如,通过受体介导的胞吞作用)的抗体或其抗原结合片段。例如,上述体外展示技术可适用于筛选结合癌细胞、自身免疫细胞或造血干细胞表面上的cd117(例如,gnnk+cd117)并随后内化的抗体或其抗原结合片段。噬菌体展示代表了一种可与这种筛选范例结合使用的技术。为了鉴定结合cd117(例如,gnnk+cd117)并随后被癌细胞、自身免疫细胞或造血干细胞内化的抗体或其片段,本领域技术人员可采用例如williams et al.,leukemia19:1432-1438,2005中所述的噬菌体展示技术,其公开内容通过引用整体并入本文。例如,使用本领域已知的诱变方法,可以产生重组噬菌体文库,其编码抗体、抗体片段,诸如scfv片段、fab片段、双抗体、三抗体和10fn3结构域等,其含有随机化的氨基酸盒(例如,在一个或多个或所有cdr或其等效区域或抗体或抗体片段中)。可以设计抗体或抗体片段的框架区、铰链、fc结构域和其它区域,使得它们在人类中是非免疫原性的,例如,由于具有人种系抗体序列或相对于人种系抗体仅显示微小变异的序列。
[0234]
使用本文所述或本领域已知的噬菌体展示技术,含有与噬菌体颗粒共价结合的随机化抗体或抗体片段的噬菌体文库可与cd117(例如,gnnk+cd117)抗原一起温育,例如,通过首先将噬菌体文库与封闭剂(诸如,例如,乳蛋白、牛血清白蛋白和/或igg)一起温育以去除展示非特异性蛋白结合的编码抗体或其片段的噬菌体和编码结合fc结构域的抗体或其片段的噬菌体,然后将噬菌体文库与造血干细胞群一起温育。噬菌体文库可以与靶细胞(诸如癌细胞、自身免疫细胞或造血干细胞)温育足够长的时间,以允许cd117特异性抗体或其抗原结合片段(例如,gnnk+cd117特异性抗体或其抗原结合片段)结合细胞表面cd117(例如,细胞表面gnnk+cd117)抗原并随后被癌细胞、自身免疫细胞或造血干细胞内化(例如,在4℃下温育30分钟至6小时,诸如在4℃下温育1小时)。含有抗体或其片段的噬菌体,其对这些抗原中的一种或多种没有表现出足够的亲和力以允许与癌细胞、自身免疫细胞或造血干细胞结合并被其内化,随后可通过洗涤细胞来去除,例如用冷(4℃)0.1m甘氨酸缓冲液(ph 2.8)。与抗体或其片段结合的噬菌体,或已被癌细胞、自身免疫细胞或造血干细胞内化的噬菌体可以通过例如裂解细胞并从细胞培养基中回收内化的噬菌体来鉴定。然后可以在细菌细胞中扩增噬菌体,例如通过使用本领域已知的方法将细菌细胞与回收的噬菌体在2xyt培养基中温育。然后,从该培养基中回收的噬菌体例如通过确定插入噬菌体基因组中的编码抗体或其片段的基因的核酸序列来表征。编码的抗体或其片段随后可以通过化学合成(例如,抗体片段,诸如scfv片段)或通过重组表达(例如,全长抗体)从头制备。
[0235]
用于本文所述的组合物和方法一起使用的抗cd117(例如,抗gnnk+cd117)抗体的体外进化的示例性方法是噬菌体展示。噬菌体展示文库可通过在抗体的cdr或抗体样支架的类似区域(例如,10fn3结构域的bc、cd和de环)的编码序列内产生设计的一系列突变或变异来产生。引入这些突变的模板抗体编码序列可以是例如天然人种系序列。这些突变可以使用本领域已知的标准诱变技术进行。因此,每个突变序列编码对应于除一个或多个氨基酸变异外的模板的抗体。逆转录病毒和噬菌体展示载体可以使用本领域已知的标准载体构建技术进行工程化改造。p3噬菌体展示载体以及相容的蛋白质表达载体可用于产生用于抗体多样化的噬菌体展示载体。
[0236]
突变的dna提供序列多样性,并且每种转化体噬菌体展示了由该dna编码的初始模板氨基酸序列的一种变体,导致噬菌体群体(文库)展示大量不同但结构上相关的氨基酸序列。由于抗体高变区的明确结构,预期在噬菌体展示筛选中引入的氨基酸变异会改变结合肽或结构域的结合特性,而不会显著改变其整体分子结构。
[0237]
在典型的筛选中,噬菌体文库可以与前述抗原之一或其表位接触并使其结合。为了促进结合剂和非结合剂的分离,将靶标固定在固相支持物上是方便的。携带cd117结合部分的噬菌体可与固相支持物上的靶标形成复合物,而非结合噬菌体保留在溶液中,并可以用过量缓冲液洗去。结合的噬菌体然后可以通过将缓冲液改变至极端ph(ph 2或ph 10)、改变缓冲液的离子强度、加入变性剂或其它已知的手段从靶标释放。
[0238]
然后,可以通过感染细菌细胞扩增回收的噬菌体,并且可以用此时已耗尽非结合抗体并富集结合cd117(例如,gnnk+cd117)的抗体的新合并物重复筛选过程。甚至几个结合噬菌体的回收也足以扩增噬菌体用于随后的筛选迭代。经过几轮选择后,通过常规方法测定编码源自结合合并物中所选噬菌体克隆的抗体或其抗原结合片段的基因序列,从而揭示赋予噬菌体对靶标的结合亲和力的肽序列。在淘选过程中,群体的序列多样性随着每轮选择而减少,直到保留所需的肽结合抗体。这些序列可汇聚(converge)在少量相关抗体或其抗原结合片段上。在每轮选择中回收的噬菌体数量的增加表明文库在筛选中发生了汇聚。
[0239]
另一种鉴定抗体的方法包括例如根据以下程序使用结合细胞表面靶抗原(例如,cd117)的人源化非人抗体。共有人抗体重链和轻链序列是本领域已知的(参见例如“vbase”人种系序列数据库;kabat et al.sequences of proteins of immunological interest,fifth edition,u.s.department of health and human services,nih publication no.91-3242,1991;tomlinson et al.,j.mol.biol.227:776-798,1992;以及cox et al.eur.j.immunol.24:827-836,1994,其各自的公开内容通过引用并入本文,因为它们涉及共有人抗体重链和轻链序列)。使用已建立的程序,本领域技术人员可鉴定共有抗体序列的可变域框架残基和cdr(例如,通过序列比对)。可以用本文所述的结合细胞表面抗原(例如,cd117)的非人抗体的一个或多个相应cdr取代共有人抗体的重链和/或轻链可变结构域的一个或多个cdr,以产生人源化抗体。这种cdr交换可使用本文所述或本领域已知的基因编辑技术进行。
[0240]
为了产生人源化抗体,可以重组表达编码上述共有序列的多核苷酸,其中一个或多个可变区cdr已被结合cd117(例如,gnnk+cd117)的非人抗体的一个或多个可变区cdr序列替代。由于抗体对造血干细胞抗原的亲和力主要由cdr序列决定,因此预期所得人源化抗体对造血干细胞抗原的亲和力与人源化抗体来源的非人抗体的亲和力大致相同。测定抗体对靶抗原的亲和力的方法包括例如本文所述和本领域已知的基于elisa的技术,以及表面等离振子共振、荧光各向异性和等温滴定量热法等。
[0241]
所制备的抗体或其片段的内化能力例如使用本领域已知的放射性核素内化测定来评估。例如,使用本文所述或本领域已知的体外展示技术鉴定的抗体或其片段可以通过掺入放射性同位素(诸如
18
f、
75
br、
77
br、
122
i、
123
i、
124
i、
125
i、
129
i、
131
i、
211
at、
67
ga、
111
in、
99
tc、
169
yb、
186
re、
64
cu、
67
cu、
177
lu、
77
as、
72
as、
86
y、
90
y、
89
zr、
212
bi、
213
bi或
225
ac)来功能化。例如,放射性卤素(诸如
18
f、
75
br、
77
br、
122
i、
123
i、
124
i、
125
i、
129
i、
131
i、
211
at)可使用含有亲电卤素试剂的珠(诸如聚苯乙烯珠(例如,碘化珠,thermo fisher scientific,inc.,cambridge,ma)掺
入抗体或其片段中。放射性标记的抗体或其片段可以与癌细胞、自身免疫细胞或造血干细胞温育足以允许内化的时间(例如,在4℃下温育30分钟至6小时,诸如在4℃下温育1小时)。然后可以洗涤细胞以去除非内化抗体或其片段(例如,使用冷(4℃)0.1m甘氨酸缓冲液(ph 2.8))。内化的抗体或其片段可通过检测所得癌细胞、自身免疫细胞或造血干细胞的发射辐射(例如,γ辐射)与回收的洗涤缓冲液的发射辐射(例如,γ辐射)进行比较来鉴定。
[0242]
cd117表位
[0243]
在另一方面,本公开涉及一种能够结合cd117的抗体或其抗原结合片段,其结合cd117中的表位,该表位包含seq id no:1的氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的至少两个,至少三个,至少四个,至少五个,至少六个,至少七个或全部八个。在一个实施方案中,该能够结合cd117的抗体或其抗原结合片段结合cd117中的表位,该表位包含seq id no:1的氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129的中的至少两个。在一个实施方案中,该能够结合cd117的抗体或其抗原结合片段结合cd117中的表位,该表位包含seq id no:1的氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的至少三个。在一个实施方案中,该能够结合cd117的抗体或其抗原结合片段结合cd117中的表位,该表位包含seq id no:1的氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的至少四个。在一个实施方案中,该能够结合cd117的抗体或其抗原结合片段结合cd117中的表位,该表位包含seq id no:1的氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的至少五个。在一个实施方案中,该能够结合cd117的抗体或其抗原结合片段结合cd117中的表位,该表位包含seq id no:1的氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的至少六个。在一个实施方案中,该能够结合cd117的抗体或其抗原结合片段结合cd117中的表位,该表位包含seq id no:1的氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的至少七个。在另一个实施方案中,该能够结合cd117的结合蛋白(例如,抗体或其抗原结合片段)结合cd117中的表位,该表位包含seq id no:1的氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的全部。
[0244]
在另一方面,本公开涉及一种能够结合cd117的抗体或其抗原结合片段,其结合cd117中的表位,其中该表位包含选自由seq id no:1的氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的至少两个,至少三个,至少四个,至少五个,至少六个,至少七个或八个中的每一个组成的组的氨基酸残基。
[0245]
在另一方面,本公开涉及一种能够结合cd117的抗体或其抗原结合片段,其结合具有在seq id no:1的至少氨基酸67-83和114-129内的残基的表位。
[0246]
如蛋白质数据库(pdb)中参考编号p10721所述(参见https://www.rcsb.org/pdb/protein/p10721(截至2019年4月24日),cd117的胞外部分包含五个结构域,称为ig样c2型1结构域(又名d1)、ig样c2型2结构域(又名d2)、ig样c2型3结构域(又名d3)、ig样c2型4结构域(又名d4)和ig样c2型5结构域(又名d5)。在另一个方面,本公开内容涉及一种能够结合cd117的抗体或其抗原结合片段,其结合ig样c2型1结构域和ig样c2型2结构域内的cd117的表位(又名d2)。在一些实施方案中,该抗体或其抗原结合片段与包含ig样c2型1结构域的氨基酸残基和氨基酸残基t114、t119或k129中的至少一个、至少两个或所有三个的表位结合。在另一个实施方案中,该能够结合cd117的抗体或其抗原结合片段与包含ig样c2型2结构域的氨基酸残基和氨基酸残基t67、k69、t71、s81和y83中的至少一个、至少两个、至少三个、至
少四个或所有五个的表位结合。
[0247]
另一方面,本文所述的抗体对cd117具有拮抗活性,而没有显著的激动活性。因此,本公开内容包括与抗体ab85识别的表位结合的抗体。在一个具体的实施方案中,本公开内容包括分离的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段结合人cd117,使得cd117与所述抗体或其抗原结合片段结合至由seq id no:1的拓扑区域(topographic region)t67-y83和/或t114-k129限定的表位阻止cd117与scf(干细胞因子)的结合或被抑制与另外的人cd117二聚化。在另一方面,本公开涉及一种能够结合人cd117的抗体或其抗原结合片段,其结合人cd117中的表位,该表位包含seq id no:1的氨基酸残基t67、k69、t71、s81、y83、t114、t119和k129中的两个、三个、四个、五个、六个、七个或全部。
[0248]
抗体药物缀合物(adc)
[0249]
细胞毒素
[0250]
本文所述的抗cd117抗体及其抗原结合片段可与细胞毒素缀合(连接)。特别地,抗cd117 adc包括与细胞毒性部分(或细胞毒素)缀合(即,通过接头共价连接)的抗体(或其抗原结合片段)。在各种实施方案中,当结合在缀合物中时,细胞毒性部分表现出降低的细胞毒性或无细胞毒性,但在从接头裂解后恢复细胞毒性。在各种实施方案中,细胞毒性部分保持细胞毒性而不从接头裂解。在一些实施方案中,细胞毒性分子与本文公开的细胞内化抗体或其抗原结合片段缀合,使得在细胞摄取抗体或其片段后,细胞毒素可接近其细胞内靶标,并例如介导t细胞死亡。
[0251]
本文所述的抗体及其抗原结合片段(例如,识别并结合cd117的抗体及其抗原结合片段)可与细胞毒素缀合(或连接)。
[0252]
因此,本公开的adc可以具有通式ab-(z-l-d)n,其中抗体或其抗原结合片段(ab)通过化学部分(z)与接头(l)缀合(共价连接),缀合至细胞毒性部分(“药物”,d)。“n”代表与抗体连接的药物的数目,通常范围为1至8。
[0253]
因此,抗体或其抗原结合片段可以与一定数目的药物部分缀合,如由整数n表示的,该整数n代表每个抗体的细胞毒素的平均数,其可以在例如约1至约20的范围内。在一些实施方案中,n为1至4。在一些实施方案中,n为1。在一些实施方案中,n为2。自缀合反应制备adc中每个抗体的药物部分的平均数可以通过常规手段(诸如质谱法、elisa测定和hplc)表征。还可以就n而言确定adc的定量分布。在一些情况下,其中的n为某个值的均质adc与具有其他药物负载的adc的分离、纯化和表征可通过诸如反相hplc或电泳的手段实现。
[0254]
对于一些抗cd117 adc,每个抗体的细胞毒素的平均数可受抗体上的连接位点的数目限制。例如,当连接是半胱氨酸硫醇时,抗体可以仅具有一个或几个半胱氨酸硫醇基团,或者可以仅具有一个或几个足够反应性的硫醇基团,通过该硫醇基团可以连接接头和化学部分。通常,抗体不含有许多可连接至药物部分的游离和反应性半胱氨酸硫醇基团;主要地,抗体中的半胱氨酸硫醇残基以二硫键存在。在某些实施方案中,抗体可以用还原剂(诸如二硫苏糖醇(dtt)或三羰基乙基膦(tcep))在部分或全部还原条件下还原,以产生反应性半胱氨酸硫醇基团。
[0255]
在某些实施方案中,在缀合反应期间与抗体缀合少于理论最大值的药物部分。抗体可以含有例如不与药物-接头中间体或接头试剂反应的赖氨酸残基,如下所讨论。仅最具反应性的赖氨酸基团可以与胺反应性接头试剂反应。在某些实施方案中,使抗体经受变性
条件以显示反应性亲核基团,诸如赖氨酸或半胱氨酸。
[0256]
adc的负载(药物/抗体比)可以以不同的方式控制,例如通过:(i)限制药物-接头中间体或接头试剂相对于抗体的摩尔过量,(ii)限制缀合反应时间或温度,(iii)用于半胱氨酸硫醇修饰的部分或限制性还原条件,(iv)通过重组技术工程化改造抗体的氨基酸序列,使得半胱氨酸残基的数目和位置得到修饰以控制接头-药物连接的数目和/或位置。
[0257]
在一些实施方案中,细胞毒性分子与本文公开的细胞内化抗体或其抗原结合片段缀合,使得在细胞摄取抗体或其片段后,细胞毒素可接近其细胞内靶标并介导造血细胞死亡。可以将任意数目的细胞毒素与抗cd117抗体缀合,例如1、2、3、4、5、6、7或8。
[0258]
适用于本文所述的组合物和方法的细胞毒素包括dna嵌合剂(例如,蒽环类药物)、能够破坏有丝分裂纺锤体装置的药剂(例如,长春花生物碱、美登素、美登木素生物碱及其衍生物)、rna聚合酶抑制剂(例如,鹅膏毒素,诸如α-鹅膏蕈碱及其衍生物)以及能够破坏蛋白质生物合成的药剂(例如,表现出rrnan-糖苷酶活性的药剂,诸如皂草素和蓖麻毒蛋白a链),以及本领域已知的其它药剂。
[0259]
在一些实施方案中,细胞毒素是微管结合剂(例如,美登素或美登木素生物碱)、鹅膏毒素、假单胞菌外毒素a、debouganin、白喉毒素、皂草素、澳瑞他汀(auristatin)、蒽环类药物(anthracycline)、加利车霉素、伊立替康、sn-38、多卡米星(duocarmycin)、吡咯并苯二氮杂卓(pyrrolobenzodiazepine)、吡咯并苯二氮杂卓二聚体、吲哚啉并苯二氮杂卓(indolinobenzodiazepine)、吲哚啉并苯二氮杂卓二聚体、吲哚啉并苯二氮杂卓假二聚体,或其变体,或本文所述或本领域已知的另一种细胞毒性化合物。
[0260]
本文所述的抗cd117抗体及其抗原结合片段可与作为微管结合剂的细胞毒素缀合。如本文所用,术语“微管结合剂”是指通过破坏细胞中有丝分裂和分裂间期细胞功能所必需的微管网络而起作用的化合物。微管结合剂的实例包括但不限于美登素、美登木素生物碱及其衍生物,如本文所述或本领域已知的那些,长春花生物碱,诸如长春碱、硫酸长春碱、长春新碱、硫酸长春新碱、长春地辛和长春瑞滨,紫杉烷类,诸如多西他赛和紫杉醇,大环内酯类,诸如圆皮海绵内酯(discodermolide)、秋水仙素和埃坡霉素,及其衍生物,诸如埃坡霉素b或其衍生物。
[0261]
美登木素生物碱
[0262]
本文所述的抗体及其抗原结合片段可与作为微管结合剂的细胞毒素缀合。在一些实施方案中,微管结合剂为美登素、美登木素生物碱或美登木素生物碱类似物。美登木素生物碱是有丝分裂抑制剂,其结合微管并通过抑制微管蛋白聚合起作用。美登素首次从东非灌木齿叶美登木(maytenus serrata)分离出来(美国专利号3,896,111)。随后,发现某些微生物也产生美登木素生物碱,诸如美登醇和c-3美登醇酯(美国专利号4,151,042)。合成的美登醇及其衍生物和类似物公开于,例如,美国专利号4,137,230;4,248,870;4,256,746;4,260,608;4,265,814;4,294,757;4,307,016;4,308,268;4,308,269;4,309,428;4,313,946;4,315,929;4,317,821;4,322,348;4,331,598;4,361,650;4,364,866;4,424,219;4,450,254;4,362,663和4,371,533。美登木素生物碱药物部分在抗体药物缀合物中是有吸引力的药物部分,因为它们:(i)通过发酵或化学修饰、发酵产物的衍生化可相对容易地制备,(ii)易于用适于通过非二硫化物接头与抗体缀合的官能团衍生化,(iii)在血浆中稳定,以及(iv)对多种肿瘤细胞系有效。
[0263]
合适的美登木素生物碱的实例包括美登醇的酯、合成的美登醇以及美登醇类似物和衍生物。本文包括抑制微管形成并对哺乳动物细胞具有高毒性的任何细胞毒素,如美登木素生物碱、美登醇和美登醇类似物和衍生物。
[0264]
合适的美登醇酯的实例包括具有修饰的芳环的那些和在其它位置具有修饰的那些。这种合适的美登木素生物碱公开于美国专利号4,137,230;4,151,042;4,248,870;4,256,746;4,260,608;4,265,814;4,294,757;4,307,016;4,308,268;4,308,269;4,309,428;4,313,946;4,315,929;4,317,821;4,322,348;4,331,598;4,361,650;4,362,663;4,364,866;4,424,219;4,450,254;4,322,348;4,362,663;4,371,533;5,208,020;5,416,064;5,475,092;5,585,499;5,846,545;6,333,410;7,276,497和7,473,796,其各自的公开内容均通过引用并入本文,因为它们涉及美登木素生物碱及其衍生物。
[0265]
在一些实施方案中,本公开的抗体药物缀合物(adc)利用含硫醇的美登木素生物碱(dm1)(其正式名称为n2′‑
脱乙酰基-n2′‑
(3-巯基-1-氧代丙基)-美登素)作为细胞毒剂。dm1由结构式(v)表示:
[0266][0267]
在另一个实施方案中,本公开的缀合物利用含硫醇的美登木素生物碱n2′‑
脱乙酰基-n2′
(4-甲基-4-巯基-1-氧代戊基)-美登素(例如,dm4)作为细胞毒剂。dm4由结构式(vi)表示:
[0268][0269]
另一种包含含有空间位阻硫醇键的侧链的美登木素生物碱是n2′‑
脱乙酰基-n-2
′
(4-巯基-1-氧代戊基)-美登素(称为dm3),由结构式(vii)表示:
[0270][0271]
美国专利号5,208,020和7,276,497中教导的每种美登木素生物碱也可用于本公开的缀合物中。在这方面,5,208,020和7,276,497的全部公开内容通过引用并入本文。
[0272]
美登木素生物碱上的许多位置可用作化学连接连接部分的位置。例如,具有羟基的c-3位、经羟甲基修饰的c-14位、经羟基修饰的c-15位和具有羟基的c-20位均预期是有用的。在一些实施方案中,c-3位用作化学连接连接部分的位置,并且在一些特定实施方案中,美登醇的c-3位用作化学连接连接部分的位置。本领域已知有许多用于制备抗体-美登木素生物碱缀合物的接头团,包括,例如,美国专利号5,208,020、6,441,163、ep专利号0425235b1;chari et al.,cancer research 52:127-131(1992);和u.s.2005/0169933 a1,其公开内容通过引用明确并入本文。本文描述并举例说明了另外的接头团。
[0273]
本公开还包括美登木素生物碱和缀合物的各种异构体和混合物。本公开的某些化合物和缀合物可以以各种立体异构、对映异构和非对映异构形式存在。在美国专利号5,208,020、5,416,064、6,333,410、6,441,163、6,716,821和7,368,565提供了几种用于制备这种抗体-美登木素生物碱缀合物的描述,其中每一者均通过引用整体并入本文。
[0274]
每个抗体分子结合的美登木素生物碱分子的治疗有效数量可以通过分光光度法测定252nm和280nm处吸光度之比来确定。在某些实施方案中,平均每个抗体分子缀合3至4个美登木素生物碱分子可增强靶细胞的细胞毒性而不会对抗体的功能或溶解度产生负面影响,尽管一分子的毒素/抗体可增强细胞毒性超过单独的抗体。美登木素生物碱分子/抗体或其抗原结合片段的平均数可以为,例如,1-10或2-5。
[0275]
蒽环类药物
[0276]
在其它实施方案中,本文所述的抗体及其抗原结合片段可以与细胞毒素缀合,所述细胞毒素为蒽环类药物分子。蒽环类药物是具有细胞毒活性的抗生素化合物。研究表明,蒽环类药物可以通过多种不同的机制杀死细胞,包括:1)药物分子嵌入细胞的dna中,从而抑制dna依赖性核酸合成;2)药物产生自由基,然后自由基与细胞大分子反应,造成细胞损伤,或3)药物分子与细胞膜的相互作用[参见例如c.peterson et al.,"transport and storage of anthracycline in experimental systems and human leukemia"in anthracycline antibiotics in cancer therapy;n.r.bachur,"free radical damage"id.at pp.97-102]。由于其细胞毒性潜力,蒽环类药物已被用于治疗多种癌症,诸如白血
病、乳腺癌、肺癌、卵巢腺癌和肉瘤[参见例如p.h-wiernik,in anthracycline: current status and new developments p 11]。常用的蒽环类药物包括多柔比星、表柔比星、伊达比星和道诺霉素。在一些实施方案中,细胞毒素是选自由柔红霉素、多柔比星、表柔比星和伊达比星组成的组的蒽环类药物。蒽环类药物的代表性实例包括但不限于柔红霉素(cerubidine;bedford laboratories)、多柔比星(adriamycin;bedford laboratories;也称为盐酸多柔比星、羟基柔红霉素和rubex)、表柔比星(ellence;pfizer)和伊达比星(idamycin;pfizer inc.)。
[0277]
认为蒽环类药物类似物多柔比星(adriamycino)通过嵌入和抑制拓扑异构酶ii的进程与dna相互作用,所述拓扑异构酶ii使dna解旋用于转录。在拓扑异构酶ii复合物破坏dna链以进行复制后,多柔比星稳定了拓扑异构酶ii复合物,阻止了dna双螺旋被重新密封,从而停止了复制进程。多柔比星和柔红霉素(daunomycin)是原型细胞毒性天然产物蒽环类药物化学治疗剂(sessa et al.,(2007)cardiovasc.toxicol.7:75-79)。
[0278]
适用于本文的蒽环类药物的一个非限制性实例是pnu-159682(“pnu”)。相对于母体奈莫柔比星,pnu表现出大于3000倍的细胞毒性(quintieri et al.,clinical cancer research 2005,11,1608-1617)。pnu由以下结构式表示:
[0279][0280]
蒽环类药物(诸如pnu)上的多个位置可用作共价结合连接部分的位置,因此与本文所述的抗cd117抗体或其抗原结合片段共价结合。例如,可以通过对羟甲基酮侧链的修饰来引入接头。
[0281]
在一些实施方案中,细胞毒素是由以下结构式表示的pnu衍生物:
[0282][0283]
其中波形线表示与本文所述的adc的接头的共价连接点。
[0284]
在一些实施方案中,细胞毒素是由以下结构式表示的pnu衍生物:
[0285][0286]
其中波形线表示与本文所述的adc的接头的共价连接点。
[0287]
苯二氮杂卓细胞毒素(例如,吡咯并苯二氮杂卓(pbd))
[0288]
在其它实施方案中,本文所述的抗cd117抗体或其抗原结合片段可以与细胞毒素缀合,所述细胞毒素为吡咯并苯二氮杂卓(pbd)或包含pbd的细胞毒素。pbd是由某些放线菌产生的天然产物,并且已被证明是序列选择性dna烷基化化合物。pbd细胞毒素包括但不限于氨茴霉素、二聚pbd以及公开于例如hartley,j.a.(2011).“the development of pyrrolobenzodiazepines as antitumour agents.”expert opin.inv.drug,20(6),733-744;和antonow,d.;thurston,d.e.(2011)“synthesis of dna-interactive pyrrolo[2,1-c][1,4]benzodiazepines(pbds).”chem.rev.111:2815
–
2864中的那些。
[0289]
在一些实施方案中,细胞毒素可以是由下式表示的吡咯并苯二氮杂卓二聚体:
[0290][0291]
其中波形线表示接头的连接点。
[0292]
在一些实施方案中,细胞毒素通过马来酰亚胺基己酰基接头与抗体或其抗原结合片段缀合。
[0293]
在一些实施方案中,接头包含以下中的一种或多种:肽、寡糖、-(ch2)
p-、-(ch2ch2o)
q-、-(c=o)(ch2)
r-、-(c=o)(ch2ch2o)
t-、-(nhch2ch2)
u-、-pab、val-cit-pab、val-ala-pab、val-lys(ac)-pab、phe-lys-pab、phe-lys(ac)-pab、d-val-leu-lys、gly-gly-arg、ala-ala-asn-pab或ala-pab,其中p、q、r、t和u各自为1-12的整数,每次出现时独立地选择。
[0294]
在一些实施方案中,接头具有下式的结构:
[0295][0296]
其中r1为ch3(ala)或(ch2)3nh(co)nh2(cit)。
[0297]
在一些实施方案中,接头(在与抗体缀合之前且包括反应性取代基z'(一起作为l-z'))具有以下结构:
international edition english 2017,56,462-488,其公开内容通过引用整体并入本文。
[0309]
在一些实施方案中,细胞毒素可以是具有下式的结构的吲哚啉并苯二氮杂卓假二聚体:
[0310][0311]
其中波形线表示接头的连接点。
[0312]
在一些实施方案中,细胞毒素-接头缀合物(在与抗体缀合之前且包括反应性取代基z'(一起作为cy-l-z'))具有下式结构:
[0313][0314]
该结构包含adc imgn632,其公开于例如国际专利申请公开号wo 2017004026,其通过引用并入本文。
[0315]
加利车霉素
[0316]
在其它实施方案中,本文所述的抗体及其抗原结合片段可以与细胞毒素缀合,所述细胞毒素为烯二炔抗肿瘤抗生素(例如,加利车霉素、奥佐米星(ozogamicin))。加利车霉素抗生素家族能够以亚皮摩尔浓度产生双链dna断裂。对于加利车霉素家族的缀合物的制备,参见美国专利号5,712,374;5,714,586;5,739,116;5,767,285;5,770,701;5,770,710;5,773,001;和5,877,296(全部归american cyanamid company所有)。可使用的加利车霉素的结构类似物包括但不限于例如hinman et al.,cancer research 53:3336-3342(1993),lode et al.,cancer research 58:2925-2928(1998)和属于american cyanamid的前述美国专利中公开的那些。
[0317]
示例性加利车霉素命名为γ1,其在本文中简称为γ,并具有以下结构式:
[0318][0319]
在一些实施方案中,加利车霉素可以是γ-加利车霉素衍生物或n-乙酰基γ-加利车霉素衍生物。可以使用的加利车霉素的结构类似物包括但不限于例如hinman et al.,cancer research 53:3336-3342(1993),lode et al.,cancer research 58:2925-2928(1998)和前述美国专利中公开的那些。加利车霉素含有甲基三硫化物部分,其可以与合适的硫醇反应以形成二硫化物,同时引入官能团,该官能团可用于经由接头将加利车霉素衍生物连接至本文所述的抗cd117抗体或其抗原结合片段。对于加利车霉素家族的缀合物的制备,参见美国专利号5,712,374;5,714,586;5,739,116;5,767,285;5,770,701;5,770,710;5,773,001;和5,877,296(全部归american cyanamid company所有)。可以使用的加利车霉素的结构类似物包括但不限于例如hinman et al.,cancer research 53:3336-3342(1993),lode et al.,cancer research 58:2925-2928(1998)和属于american cyanamid的前述美国专利中公开的那些。
[0320]
在一个实施方案中,本文公开的adc的细胞毒素可以是由下式表示的加利车霉素二硫化物衍生物:
[0321][0322]
其中波形线表示接头的连接点。
[0323]
核糖体失活蛋白(rip)
[0324]
在一些实施方案中,与抗cd117抗体缀合的细胞毒素为核糖体失活蛋白(rip)。核糖体失活蛋白是作用于核糖体(通常不可逆)的蛋白合成抑制剂。rip存在于植物以及细菌中。rip的实例包括但不限于皂草素、蓖麻毒蛋白、相思豆毒蛋白、白树毒素、假单胞菌外毒素(或外毒素a)、天花粉蛋白、丝瓜籽蛋白(luffin)、凝集素和白喉毒素。
[0325]
可用于本文公开的adc和方法的rip的另一个实例是志贺毒素(stx)或志贺样毒素(slt)。志贺毒素(stx)是一种在痢疾志贺菌(shigella dysenteriae)1和大肠杆菌
(escherichia coli)的一些血清组(包括血清型o157:h7和o104:h4)(称为大肠杆菌中的stx1)中的有力的细菌毒素。除stx1外,一些大肠杆菌菌株产生第二种类型的stx(stx2),其具有与stx/stx1相同的作用模式,但在抗原性上是不同的。这些毒素以kiyoshi shiga命名,其首次描述了由痢疾志贺菌引起的痢疾的细菌来源。slt是由大肠杆菌产生的相似或相同毒素的历史术语。由于已经鉴定了每种毒素的亚型,因此每组的原型毒素现在被命名为stx1a或stx2a。stx1a和stx2a在对各种细胞类型的细胞毒性中表现出差异,与受体类似物或模拟物结合不同,并且诱导不同的趋化因子应答,并具有几种不同的结构特征。
[0326]
志贺毒素家族的成员是指天然存在的蛋白质毒素家族的在结构上和功能上相关的任何成员,特别是从痢疾志贺菌和大肠杆菌分离的毒素(johannes l,romer w,nat rev microbiol 8:105-16(2010))。例如,志贺毒素家族包括从痢疾志贺菌血清型1分离的真正的志贺毒素(stx)、从肠出血性大肠杆菌的血清型中分离的志贺样毒素1变体(slt1或stx1或slt-1或slt-i)和从肠出血性大肠杆菌的血清型中分离的志贺样毒素2变体(slt2或stx2或slt-2)。slt1与stx仅相差一个残基,并且两者均被称为verocytotoxin或verotoxin(vt)(o'brien a et al.,curr top microbiol immunol 180:65-94(1992))。尽管slt1和slt2变体在氨基酸序列水平上彼此仅约53-60%相似,但它们共享志贺毒素家族成员共有的酶活性和细胞毒性机制(johannes,nat rev microbiol 8:105-16(2010))。
[0327]
志贺毒素家族的成员具有两个亚基;a亚基和b亚基。该毒素的b亚基与细胞膜的成分(称为糖脂球形三脂酰基鞘鞍醇(globotriaosylceramide,gb3)结合。亚基b与gb3的结合引起窄管状膜内陷的诱导,这驱动向内的膜小管的形成,用于细菌摄取到细胞中。志贺毒素(一种非孔形成毒素)通过高尔基体网络和er转移到细胞溶质中。从高尔基体将毒素运往er。志贺毒素通过与蓖麻毒蛋白的机制类似的机制起抑制靶细胞内蛋白质合成的作用(sandvig and van deurs(2000)embo j 19(220:5943))。在进入细胞后,毒素的a亚基从核糖体的60s亚基的28s rna上裂解特定的腺嘌呤核碱基,从而停止蛋白质合成(donohue-rolfe et al.(2010)reviews of infectious diseases 13 suppl.4(7):s293-297)。
[0328]
如本文所用,对志贺家族毒素的提及是指在结构上和功能上相关的天然存在蛋白质毒素的志贺毒素家族的任何成员(例如,从痢疾志贺菌和大肠杆菌分离的毒素)。例如,志贺毒素家族包括从痢疾志贺菌血清型1分离的真正的志贺毒素(stx)、从肠出血性大肠杆菌的血清型中分离的志贺样毒素1变体(slt1或stx1或slt-1或slt-i)和从肠出血性大肠杆菌的血清型中分离的志贺样毒素2变体(slt2或stx2或slt-2)。如本文所用,“来自志贺家族毒素的亚基a”或“志贺家族毒素亚基a”是指来自志贺毒素家族的任何成员(包括志贺毒素或志贺样毒素)的亚基a。
[0329]
在一个实施方案中,抗cd117 adc包含与志贺家族毒素亚基a或具有细胞毒活性(即,核糖体抑制活性)的志贺家族毒素亚基a的一部分缀合的抗cd117抗体。志贺毒素亚基a细胞毒活性包括例如核糖体失活、蛋白质合成抑制、n-糖苷酶活性、多核苷酸:腺苷糖苷酶活性、rna酶活性和dna酶活性。志贺毒素效应物活性测定的非限制性实例测量蛋白质合成抑制活性、脱嘌呤活性、细胞生长抑制、细胞毒性、超螺旋dna松弛活性和核酸酶活性。
[0330]
在某些实施方案中,抗cd117抗体或其抗原结合片段与志贺家族毒素a亚基或其具有核糖体抑制活性的片段缀合。志贺家族毒素亚基a的实例是志贺样毒素1亚基a(slt-1a),其氨基酸序列提供如下
[0331][0332]
志贺家族毒素亚基a的另一个实例是志贺毒素亚基a(stxa),其氨基酸序列提供如下
[0333][0334]
志贺家族毒素亚单位a的另一个实例是志贺样毒素2亚基a(slt-2a),其氨基酸序列提供如下
[0335][0336]
在某些情况下,天然存在的志贺家族毒素亚基a可以包含前体形式,其在其氨基末端含有约22个氨基酸的信号序列,所述信号序列被去除以产生成熟的志贺家族毒素a亚基并且是技术人员可识别的。志贺家族毒素亚基a的细胞毒性片段或截短形式也可用于本文公开的adc和方法中。
[0337]
在某些实施方案中,志贺家族毒素亚基a与天然存在的志贺毒素a亚基的不同之处多达1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40或更多个氨基酸残基(但相差不超过如下情况,其保留至少约85%,至少约90%,至少约95%,至少约96%,至少约97%,至少约98%,至少约99%或更高氨基酸序列同一性)。在一些实施方案中,志贺家族毒素亚基a与天然存在的志贺家族毒素a亚基的不同之处多达1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40或更多个氨基酸残基(但不超过如下的情况,其保留至少约85%,至少约90%,至少约95%,至少约96%,至少约97%,至少约98%,至少约99%或更高氨基酸序列同一性)。因此,只要与天然存在的志贺家族毒素亚基a保留至少约85%,至少约90%,至少约95%,至少约96%,至少约97%,至少约98%,至少约99%或更高氨基酸序列同一性,源自志贺毒素家族成员的a亚基的多肽区域自原始序列可包含添加、缺失、截短或其它改变。
[0338]
因此,在某些实施方案中,志贺家族毒素亚基a包含与天然存在的志贺家族毒素亚基a(诸如slt-1a(seq id no:144)、stxa(seq id no:145)和/或slt-2a(seq id no:146))具有至少约55%,至少约60%,至少约65%,至少约70%,至少约75%,至少约80%,至少约85%,至少约90%,至少约95%,至少约96%,至少约97%,至少约98%,至少约99%,至少约99.5%,至少约99.6%,至少约99.7%,至少约99.8%,至少约99.9%,或更高总序列同一性的氨基酸序列或基本上由其组成。
[0339]
适合作为细胞毒素的合适的志贺毒素和rip公开于例如us 20180057544,其通过
引用整体并入本文。
[0340]
澳瑞他汀
[0341]
本文所述的抗cd117抗体及其抗原结合片段可以与细胞毒素缀合,所述细胞毒素是澳瑞他汀(美国专利号5,635,483;5,780,588)。澳瑞他汀是抗有丝分裂剂,其可干扰微管动力学、gtp水解以及核和细胞分裂(woyke et al(2001)antimicrob.agents and chemother.45(12):3580-3584)并具有抗癌活性(美国专利号5,663,149)和抗真菌活性(pettit et al(1998)antimicrob.agents chemother.42:2961-2965)(美国专利号5,635,483;5,780,588)。澳瑞他汀药物部分可以通过肽药物部分的n-(氨基)末端或c-(羧基)末端与抗体连接(wo 02/088172)。
[0342]
示例性澳瑞他汀实施方案包括n-末端连接的单甲基澳瑞他汀药物部分de和df,其公开于senter et al,proceedings of the american association for cancer research,volume 45,abstract number 623,于2004年3月28日发表,其公开内容通过引用明确地整体并入本文。
[0343]
一个示例性澳瑞他汀实施方案是mmae:
[0344][0345]
其中波浪线表示与抗体-接头缀合物(-l-z-ab,如本文所述)的接头的共价连接点。
[0346]
另一个示例性澳瑞他汀实施方案是mmaf:
[0347][0348]
其中波浪线表示与抗体-接头缀合物(-l-z-ab,如本文所述)的接头的共价连接点,如us 2005/0238649中所公开的。
[0349]
澳瑞他汀可根据以下方法制备:美国专利号5,635,483;美国专利号5,780,588;pettit et al(1989)j.am.chem.soc.111:5463-5465;pettit et al(1998)anti-cancer drug design 13:243-277;pettit,g.r.,et al.synthesis,1996,719-725;pettit et al(1996)j.chem.soc.perkin trans.15:859-863;和doronina(2003)nat.biotechnol.21(7):778-784。
[0350]
鹅膏毒素
[0351]
在一些实施方案中,抗体-药物缀合物的细胞毒素为rna聚合酶抑制剂。在一些实施方案中,rna聚合酶抑制剂为鹅膏毒素或其衍生物。
c6杂亚烷基)、任选取代的亚烯基(例如,c
2-c6亚烯基)、任选取代的杂亚烯基(例如,c
2-c6杂亚烯基)、任选取代的亚炔基(例如,c
2-c6亚炔基)、任选取代的杂亚炔基(例如,c
2-c6杂亚炔基)、任选取代的亚环烷基、任选取代的杂亚环烷基、任选取代的亚芳基、任选取代的杂亚芳基、肽、二肽、-(c=o)-、二硫化物、硫醚、腙或其组合;以及
[0369]
z为由存在于l上的反应性取代基与存在于结合cd117(诸如gnnk+cd117)的抗体或其抗原结合片段内的反应性取代基之间的偶联反应形成的化学部分。
[0370]
在一些实施方案中,am确切地含有一个rc取代基。
[0371]
在一些实施方案中,接头包含-(ch)
2n-单元,其中n为2-6的整数。在一些实施方案中,接头包括-((ch2)n,其中n为6。在一些实施方案中,l-z为
[0372][0373]
其中s为硫原子,其代表存在于结合cd117的抗体或其抗原结合片段内的反应性取代基(例如,来自半胱氨酸残基的-sh基团)。
[0374]
在一些实施方案中,l-z为
[0375][0376]
其中s为硫原子,其代表存在于结合cd117的抗体或其抗原结合片段内的反应性取代基(例如,来自半胱氨酸残基的-sh基团)。
[0377]
在一些实施方案中,am-l-z-ab为以下之一:
[0378][0379]
其中x为-s-、-s(o)-或-so
2-,且ab显示为ab的连接点。在一些实施方案中,am-l-z-ab为
[0380][0381]
在一些实施方案中,am-l-z-ab为
[0382][0383]
在一些实施方案中,am-l-z-ab为
[0384][0385]
在一些实施方案中,am-l-z=ab由式(ia)表示
[0386][0387]
其中r1为h、oh、ora或orc;
[0388]
r2为h、oh、orb或orc;
[0389]
ra和rb,当存在时,与它们所键合的氧原子一起,结合形成任选取代的5元杂环烷基;
[0390]
r3为h、rc或rd;
[0391]
r4为h、oh、orc、ord、rc或rd;
[0392]
r5为h、oh、orc、ord、rc或rd;
[0393]
r6为h、oh、orc、ord、rc或rd;
[0394]
r7为h、oh、orc、ord、rc或rd;
[0395]
r8为oh、nh2、orc、ord、nhrc或nrcrd;
[0396]
r9为h、oh、orc或ord;
[0397]
x为-s-、-s(o)-或-so
2-;
[0398]
rc为-l-z;
[0399]
rd为任选取代的烷基(例如,c
1-c6烷基)、任选取代的杂烷基(例如,c
1-c6杂烷基)、任选取代的烯基(例如,c
2-c6烯基)、任选取代的杂烯基(例如,c
2-c6杂烯基)、任选取代的炔基(例如,c
2-c6炔基)、任选取代的杂炔基(例如,c
2-c6杂炔基)、任选取代的环烷基、任选取代的杂环烷基、任选取代的芳基或任选取代的杂芳基;
[0400]
l为接头,诸如任选取代的亚烷基(例如,c
1-c6亚烷基)、任选取代的杂亚烷基(c
1-c6杂亚烷基)、任选取代的亚烯基(例如,c
2-c6亚烯基)、任选取代的杂亚烯基(例如,c
2-c6杂亚烯基)、任选取代的亚炔基(例如,c
2-c6亚炔基)、任选取代的杂亚炔基(例如,c
2-c6杂亚炔基)、任选取代的亚环烷基、任选取代的杂亚环烷基、任选取代的亚芳基、任选取代的杂亚芳基、肽、二肽、-(c=o)-、二硫化物、硫醚、腙或其组合;
[0401]
z为由存在于l上的反应性取代基与存在于结合cd117(诸如gnnk+cd117)的抗体或其抗原结合片段内的反应性取代基之间的偶联反应形成的化学部分;以及
[0402]
其中am确切地含有一个rc取代基。
[0403]
在一些实施方案中,接头包括-((ch2)n,其中n为6。在一些实施方案中,l-z为
[0404][0405]
在一些实施方案中,l-z为
[0406][0407]
在一些实施方案中,am-l-z由式(ib)表示
[0408][0409]
其中r1为h、oh、ora或orc;
[0410]
r2为h、oh、orb或orc;
[0411]
ra和rb,当存在时,与它们所键合的氧原子一起,结合形成任选取代的5元杂环烷基;
[0412]
r3为h、rc或rd;
[0413]
r4为h、oh、orc、ord、rc或rd;
[0414]
r5为h、oh、orc、ord、rc或rd;
[0415]
r6为h、oh、orc、ord、rc或rd;
[0416]
r7为h、oh、orc、ord、rc或rd;
[0417]
r8为oh、nh2、orc、ord、nhrc或nrcrd;
[0418]
r9为h、oh、orc或ord;
[0419]
x为-s-、-s(o)-或-so
2-;
[0420]
rc为-l-z;
[0421]
rd为任选取代的烷基(例如,c
1-c6烷基)、任选取代的杂烷基(例如,c
1-c6杂烷基)、任选取代的烯基(例如,c
2-c6烯基)、任选取代的杂烯基(例如,c
2-c6杂烯基)、任选取代的炔基(例如,c
2-c6炔基)、任选取代的杂炔基(例如,c
2-c6杂炔基)、任选取代的环烷基、任选取代的杂环烷基、任选取代的芳基或任选取代的杂芳基;
[0422]
l为接头,诸如任选取代的亚烷基(例如,c
1-c6亚烷基)、任选取代的杂亚烷基(c
1-c6杂亚烷基)、任选取代的亚烯基(例如,c
2-c6亚烯基)、任选取代的杂亚烯基(例如,c
2-c6杂亚烯基)、任选取代的亚炔基(例如,c
2-c6亚炔基)、任选取代的杂亚炔基(例如,c
2-c6杂亚炔基)、任选取代的亚环烷基、任选取代的杂亚环烷基、任选取代的亚芳基、任选取代的杂亚芳基、肽、二肽、-(c=o)-、二硫化物、硫醚、腙或其组合;
[0423]
z为由存在于l上的反应性取代基与存在于结合cd117(诸如gnnk+cd117)的抗体或其抗原结合片段内的反应性取代基之间的偶联反应形成的化学部分;以及
[0424]
其中am确切地含有一个rc取代基。
[0425]
在一些实施方案中,接头l和化学部分z(一起作为l-z)为
[0426][0427]
在一些实施方案中,l-z为
[0428][0429]
在一些实施方案中,ra和rb,与它们所键合的氧原子一起,结合形成任选取代的5元杂环烷基:
[0430][0431]
其中y为-(c=o)-、-(c=s)-、-(c=nr
e)-或-(crer
e’)-;以及
[0432]
re和re'各自独立地为任选取代的c
1-c6亚烷基-rc、任选取代的c
1-c6杂亚烷基-rc、任选取代的c
2-c6亚烯基-rc、任选取代的c
2-c6杂亚烯基-rc、任选取代的c
2-c6亚炔基-rc、任选取代的c
2-c6杂亚炔基-rc、任选取代的亚环烷基-rc、任选取代的杂亚环烷基-rc、任选取代的亚芳基-rc或任选取代的杂亚芳基-rc。
[0433]
在一些实施方案中,am-l-z由式(ia)或式(ib)表示,
[0434]
其中r1为h、oh、ora或orc;
[0435]
r2为h、oh、orb或orc;
[0436]
ra和rb,当存在时,与它们所键合的氧原子一起,结合形成:
[0437][0438]
r3为h或rc;
[0439]
r4为h、oh、orc、ord、rc或rd;
[0440]
r5为h、oh、orc、ord、rc或rd;
[0441]
r6为h、oh、orc、ord、rc或rd;
[0442]
r7为h、oh、orc、ord、rc或rd;
[0443]
r8为oh、nh2、orc或nhrc;
[0444]
r9为h或oh;
[0445]
x为-s-、-s(o)-或-so
2-;以及
[0446]
其中rc和rd各自如上所定义。
[0447]
在一些实施方案中,am-l-z由式(ia)或式(ib)表示,
[0448]
其中r1为h、oh、ora或orc;
[0449]
r2为h、oh、orb或orc;
[0450]
ra和rb,当存在时,与它们所键合的氧原子一起,结合形成:
[0451][0452]
r3为h或rc;
[0453]
r4和r5各自独立地为h、oh、orc、rc或ord;
[0454]
r6和r7各自为h;
[0455]
r8为oh、nh2、orc或nhrc;
[0456]
r9为h或oh;
[0457]
x为-s-、-s(o)-或-so
2-;以及
[0458]
其中rc如上所定义。
[0459]
在一些实施方案中,am-l-z由式(ia)或式(ib)表示,
[0460]
其中r1为h、oh或ora;
[0461]
r2为h、oh或orb;
[0462]
ra和rb,当存在时,与它们所键合的氧原子一起,结合形成:
[0463][0464]
r3、r4、r6和r7各自为h;
[0465]
r5为orc;
[0466]
r8为oh或nh2;
[0467]
r9为h或oh;
[0468]
x为-s-、-s(o)-或-so
2-;以及
[0469]
其中rc如上所定义。此类鹅膏毒素缀合物描述于例如美国专利申请公开号2016/0002298中,其公开内容通过引用整体并入本文。
[0470]
在一些实施方案中,am-l-z由式(ia)或式(ib)表示,
[0471]
其中r1和r2各自独立地为h或oh;
[0472]
r3为rc;
[0473]
r4、r6和r7各自为h;
[0474]
r5为h、oh或oc
1-c6烷基;
[0475]
r8为oh或nh2;
[0476]
r9为h或oh;以及
[0477]
其中rc如上所定义。此类鹅膏毒素缀合物描述于例如美国专利申请公开号2014/0294865中,其公开内容通过引用整体并入本文。
[0478]
在一些实施方案中,am-l-z由式(ia)或式(ib)表示,
[0479]
其中r1和r2各自独立地为h或oh;
[0480]
r3、r6和r7各自为h;
[0481]
r4和r5各自独立地为h、oh、orc或rc;
[0482]
r8为oh或nh2;
[0483]
r9为h或oh;以及
[0484]
其中rc如上所定义。此类鹅膏毒素缀合物描述于例如美国专利申请公开号2015/0218220中,其公开内容通过引用整体并入本文。
[0485]
在一些实施方案中,am-l-z由式(ia)或式(ib)表示,
[0486]
其中r1和r2各自独立地为h或oh;
[0487]
r3、r6和r7各自为h;
[0488]
r4和r5各自独立地为h或oh;
[0489]
r8为oh、nh2、orc或nhrc;
[0490]
r9为h或oh;以及
[0491]
其中rc如上所定义。此类鹅膏毒素缀合物描述于例如美国专利号9,233,173和9,399,681,以及us 2016/0089450中,其各自的公开内容通过引用整体并入本文。
[0492]
在一些实施方案中,am-l-z'为
[0493][0494]
根据本文所述的组合物和方法,可用于与抗体或其抗原结合片段缀合的另外的鹅膏毒素描述于例如wo 2016/142049;wo 2016/071856;wo2017/046658;和wo2018/115466,其各自的公开内容通过引用整体并入本文。
[0495]
在一些实施方案中,am-l-z由式(ii)、式iia或式iib表示
[0496]
[0497][0498]
其中x为s、so或so2;r1为h或通过化学部分z与抗体或其抗原结合片段共价结合的接头,所述化学部分z由存在于接头上的反应性取代基与存在于抗体或其抗原结合片段内的反应性取代基之间的偶联反应形成;并且r2为h或通过化学部分z与抗体或其抗原结合片段共价结合的接头,所述化学部分z由存在于接头上的反应性取代基与存在于抗体或其抗原结合片段内的反应性取代基之间的偶联反应形成;其中当r1为h时,r2为接头,而当r2为h时,r1为接头。
[0499]
在一些实施方案中,r1为接头且r2为h,且接头和化学部分(一起作为l-z)为
[0500][0501]
在一些实施方案中,接头包括-(ch2)n–
单元,其中n为2-6的整数。在一些实施方案中,r1为接头且r2为h,且接头和化学部分(一起作为l-z)为
[0502][0503]
在一些实施方案中,am-l-z-ab为:
[0504][0505]
在一些实施方案中,am-l-z-ab为:
[0506][0507]
在一些实施方案中,am-l-z-ab前体(即,am-l-z’)是以下之一:
[0508][0509]
其中马来酰亚胺与在抗体中的半胱氨酸上发现的硫醇基团反应。
[0510]
在一些实施方案中,细胞毒素为α-鹅膏蕈碱。在一些实施方案中,α-鹅膏蕈碱为式iii的化合物。在一些实施方案中,式iii的α-鹅膏蕈碱经由接头l与抗cd117抗体连接。接头l可以在若干可能位置中的任一个(例如,r
1-r9中的任一个)处与式iii的α-鹅膏蕈碱连接,
以提供式i、ia、ib、ii、iia、iib、iv、iva或ivb的α-鹅膏蕈碱-接头缀合物。在一些实施方案中,接头连接在位置r1处。在一些实施方案中,接头连接在位置r2处。在一些实施方案中,接头连接在位置r3处。在一些实施方案中,接头连接在位置r4处。在一些实施方案中,接头连接在位置r5处。在一些实施方案中,接头连接在位置r6处。在一些实施方案中,接头连接在位置r7处。在一些实施方案中,接头连接在位置r8处。在一些实施方案中,接头连接在位置r9处。在一些实施方案中,接头包括肼、二硫化物、硫醚或二肽。在一些实施方案中,接头包括选自val-ala和val-cit的二肽。在一些实施方案中,接头包括对氨基苄基(pab)。在一些实施方案中,接头包括pab-cit-val部分。在一些实施方案中,接头包括pab-ala-val部分。在一些实施方案中,接头包括
–
((c=o)(ch2)n–
单元,其中n为1-6的整数。
[0511]
在一些实施方案中,接头包括-(ch2)n–
单元,其中n为2-6的整数。在一些实施方案中,接头为
–
pab-cit-val-((c=o)(ch2)n–
。在一些实施方案中,接头为
–
pab-ala-val-((c=o)(ch2)n–
。在一些实施方案中,接头l和化学部分z(一起作为l-z)为
[0512][0513]
在一些实施方案中,细胞毒素为β-鹅膏蕈碱。在一些实施方案中,β-鹅膏蕈碱为式iii的化合物。在一些实施方案中,式iii的β-鹅膏蕈碱经由接头l与抗cd117抗体连接。接头l可以在若干可能位置中的任一个(例如,r
1-r9中的任一个)处与式iii的β-鹅膏蕈碱连接,以提供式i、ia、ib、ii、iia或iib的β-鹅膏蕈碱-接头缀合物。在一些实施方案中,接头连接在位置r1处。在一些实施方案中,接头连接在位置r2处。在一些实施方案中,接头连接在位置r3处。在一些实施方案中,接头连接在位置r4处。在一些实施方案中,接头连接在位置r5处。在一些实施方案中,接头连接在位置r6处。在一些实施方案中,接头连接在位置r7处。在一些实施方案中,接头连接在位置r8处。在一些实施方案中,接头连接在位置r9处。在一些实施方案中,接头包括肼、二硫化物、硫醚或二肽。在一些实施方案中,接头包括选自val-ala和val-cit的二肽。在一些实施方案中,接头包括对氨基苄基(pab)。在一些实施方案中,接头包括pab-cit-val部分。在一些实施方案中,接头包括pab-ala-val部分。在一些实施方案中,接头包括
–
((c=o)(ch2)n–
单元,其中n为1-6的整数。
[0514]
在一些实施方案中,接头包括-(ch2)n–
单元,其中n为2-6的整数。在一些实施方案中,接头为
–
pab-cit-val-((c=o)(ch2)n–
。在一些实施方案中,接头为
–
pab-ala-val-((c=o)(ch2)n–
。在一些实施方案中,接头l和化学部分z(一起作为l-z)为
[0515]
[0516]
在一些实施方案中,细胞毒素为γ-鹅膏蕈碱。在一些实施方案中,γ-鹅膏蕈碱为式iii的化合物。在一些实施方案中,式iii的γ-鹅膏蕈碱经由接头l与抗cd117抗体连接。接头l可以在若干可能位置中的任一个(例如,r
1-r9中的任一个)处与式iii的γ-鹅膏蕈碱连接,以提供式i、ia、ib、ii、iia或iib的γ-鹅膏蕈碱-接头缀合物。在一些实施方案中,接头连接在位置r1处。在一些实施方案中,接头连接在位置r2处。在一些实施方案中,接头连接在位置r3处。在一些实施方案中,接头连接在位置r4处。在一些实施方案中,接头连接在位置r5处。在一些实施方案中,接头连接在位置r6处。在一些实施方案中,接头连接在位置r7处。在一些实施方案中,接头连接在位置r8处。在一些实施方案中,接头连接在位置r9处。在一些实施方案中,接头包括肼、二硫化物、硫醚或二肽。在一些实施方案中,接头包括选自val-ala和val-cit的二肽。在一些实施方案中,接头包括对氨基苄基(pab)。在一些实施方案中,接头包括pab-cit-val部分。在一些实施方案中,接头包括pab-ala-val部分。在一些实施方案中,接头包括
–
((c=o)(ch2)n–
单元,其中n为1-6的整数。
[0517]
在一些实施方案中,接头包括-(ch2)n–
单元,其中n为2-6的整数。在一些实施方案中,接头为
–
pab-cit-val-((c=o)(ch2)n–
。在一些实施方案中,接头为
–
pab-ala-val-((c=o)(ch2)n–
。在一些实施方案中,接头l和化学部分z(一起作为l-z)为
[0518][0519]
在一些实施方案中,细胞毒素为ε-鹅膏蕈碱。在一些实施方案中,ε-鹅膏蕈碱为式iii的化合物。在一些实施方案中,式iii的ε-鹅膏蕈碱经由接头l与抗cd117抗体连接。接头l可以在若干可能位置中的任一个(例如,r
1-r9中的任一个)处与式iii的ε-鹅膏蕈碱连接,以提供式i、ia、ib、ii、iia或iib的ε-鹅膏蕈碱-接头缀合物。在一些实施方案中,接头连接在位置r1处。在一些实施方案中,接头连接在位置r2处。在一些实施方案中,接头连接在位置r3处。在一些实施方案中,接头连接在位置r4处。在一些实施方案中,接头连接在位置r5处。在一些实施方案中,接头连接在位置r6处。在一些实施方案中,接头连接在位置r7处。在一些实施方案中,接头连接在位置r8处。在一些实施方案中,接头连接在位置r9处。在一些实施方案中,接头包括肼、二硫化物、硫醚或二肽。在一些实施方案中,接头包括选自val-ala和val-cit的二肽。在一些实施方案中,接头包括对氨基苄基(pab)。在一些实施方案中,接头包括pab-cit-val部分。在一些实施方案中,接头包括pab-ala-val部分。在一些实施方案中,接头包括
–
((c=o)(ch2)n–
单元,其中n为1-6的整数。
[0520]
在一些实施方案中,接头包括-(ch2)n–
单元,其中n为2-6的整数。在一些实施方案中,接头为
–
pab-cit-val-((c=o)(ch2)n–
。在一些实施方案中,接头为
–
pab-ala-val-((c=o)(ch2)n–
。在一些实施方案中,接头l和化学部分z(一起作为l-z)为
[0521][0522]
在一些实施方案中,细胞毒素为鹅膏素。在一些实施方案中,鹅膏素为式iii的化合物。在一些实施方案中,式iii的鹅膏素经由接头l与抗cd117抗体连接。接头l可以在若干可能位置中的任一个(例如,r
1-r9中的任一个)处与式iii的鹅膏素连接,以提供式i、ia、ib、ii、iia或iib的鹅膏素-接头缀合物。在一些实施方案中,接头连接在位置r1处。在一些实施方案中,接头连接在位置r2处。在一些实施方案中,接头连接在位置r3处。在一些实施方案中,接头连接在位置r4处。在一些实施方案中,接头连接在位置r5处。在一些实施方案中,接头连接在位置r6处。在一些实施方案中,接头连接在位置r7处。在一些实施方案中,接头连接在位置r8处。在一些实施方案中,接头连接在位置r9处。在一些实施方案中,接头包括肼、二硫化物、硫醚或二肽。在一些实施方案中,接头包括选自val-ala和val-cit的二肽。在一些实施方案中,接头包括对氨基苄基(pab)。在一些实施方案中,接头包括pab-cit-val部分。在一些实施方案中,接头包括pab-ala-val部分。在一些实施方案中,接头包括
–
((c=o)(ch2)n–
单元,其中n为1-6的整数。
[0523]
在一些实施方案中,接头包括-(ch2)n–
单元,其中n为2-6的整数。在一些实施方案中,接头为
–
pab-cit-val-((c=o)(ch2)n–
。在一些实施方案中,接头为
–
pab-ala-val-((c=o)(ch2)n–
。在一些实施方案中,接头l和化学部分z(一起作为l-z)为
[0524][0525]
在一些实施方案中,细胞毒素为三羟鹅膏毒肽酰胺。在一些实施方案中,三羟鹅膏毒肽酰胺为式iii的化合物。在一些实施方案中,式iii的三羟鹅膏毒肽酰胺经由接头l与抗cd117抗体连接。接头l可以在若干可能位置中的任一个(例如,r
1-r9中的任一个)处与式iii的三羟鹅膏毒肽酰胺连接,以提供式i、ia、ib、ii、iia或iib的三羟鹅膏毒肽酰胺-接头缀合物。在一些实施方案中,接头连接在位置r1处。在一些实施方案中,接头连接在位置r2处。在一些实施方案中,接头连接在位置r3处。在一些实施方案中,接头连接在位置r4处。在一些实施方案中,接头连接在位置r5处。在一些实施方案中,接头连接在位置r6处。在一些实施方案中,接头连接在位置r7处。在一些实施方案中,接头连接在位置r8处。在一些实施方案中,接头连接在位置r9处。在一些实施方案中,接头包括肼、二硫化物、硫醚或二肽。在一些实施方案中,接头包括选自val-ala和val-cit的二肽。在一些实施方案中,接头包括对氨基苄基(pab)。在一些实施方案中,接头包括pab-cit-val部分。在一些实施方案中,接头包括pab-ala-val部分。在一些实施方案中,接头包括
–
((c=o)(ch2)n–
单元,其中n为1-6的整数。
[0526]
在一些实施方案中,接头包括-(ch2)n–
单元,其中n为2-6的整数。在一些实施方案中,接头为
–
pab-cit-val-((c=o)(ch2)n–
。在一些实施方案中,接头为
–
pab-ala-val-((c=o)(ch2)n–
。在一些实施方案中,接头l和化学部分z(一起作为l-z)为
[0527][0528]
在一些实施方案中,细胞毒素为鹅膏无毒环肽。在一些实施方案中,鹅膏无毒环肽为式iii的化合物。在一些实施方案中,式iii的鹅膏无毒环肽经由接头l与抗cd117抗体连接。接头l可以在若干可能位置中的任一个(例如,r
1-r9中的任一个)处与式iii的鹅膏无毒环肽连接,以提供式i、ia、ib、ii、iia或iib的鹅膏无毒环肽-接头缀合物。在一些实施方案中,接头连接在位置r1处。在一些实施方案中,接头连接在位置r2处。在一些实施方案中,接头连接在位置r3处。在一些实施方案中,接头连接在位置r4处。在一些实施方案中,接头连接在位置r5处。在一些实施方案中,接头连接在位置r6处。在一些实施方案中,接头连接在位置r7处。在一些实施方案中,接头连接在位置r8处。在一些实施方案中,接头连接在位置r9处。在一些实施方案中,接头包括肼、二硫化物、硫醚或二肽。在一些实施方案中,接头包括选自val-ala和val-cit的二肽。在一些实施方案中,接头包括对氨基苄基(pab)。在一些实施方案中,接头包括pab-cit-val部分。在一些实施方案中,接头包括pab-ala-val部分。在一些实施方案中,接头包括
–
((c=o)(ch2)n–
单元,其中n为1-6的整数。
[0529]
在一些实施方案中,接头包括-(ch2)n–
单元,其中n为2-6的整数。在一些实施方案中,接头为
–
pab-cit-val-((c=o)(ch2)n–
。在一些实施方案中,接头为
–
pab-ala-val-((c=o)(ch2)n–
。在一些实施方案中,接头l和化学部分z(一起作为l-z)为
[0530][0531]
在一些实施方案中,细胞毒素为一羟鹅膏毒肽羧酸。在一些实施方案中,一羟鹅膏毒肽羧酸为式iii的化合物。在一些实施方案中,式iii的一羟鹅膏毒肽羧酸经由接头l与抗cd117抗体连接。接头l可以在若干可能位置中的任一个(例如,r
1-r9中的任一个)处与式iii的一羟鹅膏毒肽羧酸连接,以提供式i、ia、ib、ii、iia或iib的一羟鹅膏毒肽羧酸-接头缀合物。在一些实施方案中,接头连接在位置r1处。在一些实施方案中,接头连接在位置r2处。在一些实施方案中,接头连接在位置r3处。在一些实施方案中,接头连接在位置r4处。在一些实施方案中,接头连接在位置r5处。在一些实施方案中,接头连接在位置r6处。在一些实施方案中,接头连接在位置r7处。在一些实施方案中,接头连接在位置r8处。在一些实施方案中,接头连接在位置r9处。在一些实施方案中,接头包括肼、二硫化物、硫醚或二肽。在一些实施方
案中,接头包括选自val-ala和val-cit的二肽。在一些实施方案中,接头包括对氨基苄基(pab)。在一些实施方案中,接头包括pab-cit-val部分。在一些实施方案中,接头包括pab-ala-val部分。在一些实施方案中,接头包括
–
((c=o)(ch2)n–
单元,其中n为1-6的整数。
[0532]
在一些实施方案中,接头包括-(ch2)n–
单元,其中n为2-6的整数。在一些实施方案中,接头为
–
pab-cit-val-((c=o)(ch2)n–
。在一些实施方案中,接头为
–
pab-ala-val-((c=o)(ch2)n–
。在一些实施方案中,接头l和化学部分z(一起作为l-z)为
[0533][0534]
在一些实施方案中,细胞毒素为前鹅膏无毒环肽。在一些实施方案中,前鹅膏无毒环肽为式iii的化合物。在一些实施方案中,式iii的前鹅膏无毒环肽经由接头l与抗cd117抗体连接。接头l可以在若干可能位置中的任一个(例如,r
1-r9中的任一个)处与式iii的前鹅膏无毒环肽连接,以提供式i、ia、ib、ii、iia或iib的前鹅膏无毒环肽-接头缀合物。在一些实施方案中,接头连接在位置r1处。在一些实施方案中,接头连接在位置r2处。在一些实施方案中,接头连接在位置r3处。在一些实施方案中,接头连接在位置r4处。在一些实施方案中,接头连接在位置r5处。在一些实施方案中,接头连接在位置r6处。在一些实施方案中,接头连接在位置r7处。在一些实施方案中,接头连接在位置r8处。在一些实施方案中,接头连接在位置r9处。在一些实施方案中,接头包括肼、二硫化物、硫醚或二肽。在一些实施方案中,接头包括选自val-ala和val-cit的二肽。在一些实施方案中,接头包括对氨基苄基(pab)。在一些实施方案中,接头包括pab-cit-val部分。在一些实施方案中,接头包括pab-ala-val部分。在一些实施方案中,接头包括
–
((c=o)(ch2)n–
单元,其中n为1-6的整数。
[0535]
在一些实施方案中,接头包括-(ch2)n–
单元,其中n为2-6的整数。在一些实施方案中,接头为
–
pab-cit-val-((c=o)(ch2)n–
。在一些实施方案中,接头为
–
pab-ala-val-((c=o)(ch2)n–
。在一些实施方案中,接头l和化学部分z(一起作为l-z)为
[0536][0537]
制备鹅膏毒素的合成方法描述于美国专利号9,676,702中,其通过引用并入本文。
[0538]
用于本文所述的组合物和方法的抗体或抗原结合片段可使用本领域已知或本文所述的缀合技术与鹅膏毒素(诸如α-鹅膏蕈碱或其变体)缀合。例如,识别和结合cd117(诸如gnnk+cd117)的抗体或其抗原结合片段可以与鹅膏毒素(诸如α-鹅膏蕈碱或其变体)缀合,如us 2015/0218220中所述,其公开内容通过引用并入本文,因为其涉及例如鹅膏毒素(诸如α-鹅膏蕈碱及其变体),以及可用于共价缀合的共价接头。
[0539]
可与本文所述方法结合使用的示例性抗体-药物缀合物可通过抗体或其抗原结合片段与鹅膏毒素的反应形成,所述鹅膏毒素与含有适于与抗体或其抗原结合片段上的反应性残基反应的取代基的接头缀合。与含有适于与本文所述的抗体或其抗原结合片段上的反应性残基反应的取代基的接头缀合的鹅膏毒素包括但不限于7'c-(4-(6-(马来酰亚胺基)己酰基)哌嗪-1-基)-鹅膏毒素;7'c-(4-(6-(马来酰亚氨基)己酰氨基)哌啶-1-基)-鹅膏毒素;7'c-(4-(6-(6-(马来酰亚胺基)己酰胺基)己酰基)哌嗪-1-基)-鹅膏毒素;7'c-(4-(4-((马来酰亚胺基)甲基)环己烷羰基)哌嗪-1-基)-鹅膏毒素;7'c-(4-(6-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)己酰基)哌嗪-1-基)-鹅膏毒素;7'c-(4-(2-(6-(马来酰亚氨基)己酰氨基)乙基)哌啶-1-基)-鹅膏毒素;7'c-(4-(2-(6-(6-(马来酰亚胺基)己酰氨基)己酰氨基)乙基)哌啶-1-基)-鹅膏毒素;7'c-(4-(2-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)乙基)哌啶-1-基)-鹅膏毒素;7'c-(4-(2-(6-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)己酰胺基)乙基)哌啶-1-基)-鹅膏毒素;7'c-(4-(2-(3-羧基丙酰胺基)乙基)哌啶-1-基)-鹅膏毒素;7'c-(4-(2-(2-溴乙酰胺基)乙基)哌啶-1-基)-鹅膏毒素;7'c-(4-(2-(3-(吡啶-2-基二硫烷基)丙酰氨基)乙基)哌啶-1-基)-鹅膏毒素;7'c-(4-(2-(4-(马来酰亚胺基)丁酰胺基)乙基)哌啶-1-基)-鹅膏毒素;7'c-(4-(2-(马来酰亚胺基)乙酰基)哌嗪-1-基)-鹅膏毒素;7'c-(4-(3-(马来酰亚胺基)丙酰基)哌嗪-1-基)-鹅膏毒素;7'c-(4-(4-(马来酰亚胺基)丁酰基)哌嗪-1-基)-鹅膏毒素;7'c-(4-(2-(6-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)己酰胺基)乙基)哌啶-1-基)-鹅膏毒素;7'c-(3-((6-(马来酰亚胺基)己酰胺基)甲基)吡咯烷-1-基)-鹅膏毒素;7'c-(3-((6-(6-(马来酰亚胺基)己酰胺基)己酰胺基)甲基)吡咯烷-1-基)-鹅膏毒素;7'c-(3-((4-((马来酰亚胺基)甲基)环己烷甲酰胺基)甲基)吡咯烷-1-基)-鹅膏毒素;7'c-(3-((6-((4-(马来酰亚胺基)甲基)环己烷甲酰胺基)己酰胺基)甲基)吡咯烷-1-基)-鹅膏毒素;7'c-(4-(2-(6-(2-(氨氧基)乙酰胺基)己酰胺基)乙基)哌啶-1-基)-鹅膏毒素;7'c-(4-(2-(4-(2-(氨氧基)乙酰胺基)丁酰胺基)乙基)哌啶-1-基)-鹅膏毒素;7'c-(4-(4-(2-(氨氧基)乙酰胺基)丁酰基)哌嗪-1-基)-鹅膏毒素;7'c-(4-(6-(2-(氨氧基)乙酰氨基)己酰基)哌嗪-1-基)-鹅膏毒素;7'c-((4-(6-(马来酰亚胺基)己酰胺基)哌啶-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(6-(马来酰亚胺基)己酰胺基)乙基)哌啶-1-基)甲基)-鹅膏毒素;7'c-((4-(6-(马来酰亚胺基)己酰基)哌嗪-1-基)甲基)-鹅膏毒素;(r)-7'c-((3-((6-(马来酰亚胺基)己酰胺基)甲基)吡咯烷-1-基)甲基)-鹅膏毒素;(s)-7'c-((3-((6-(马来酰亚胺基)己酰胺基)甲基)吡咯烷-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(6-(6-(马来酰亚胺基)己酰胺基)己酰胺基)乙基)哌啶-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)乙基)哌啶-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(6-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)己酰胺基)乙基)哌啶-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(6-(马来酰亚胺基)己酰胺基)乙基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(6-(6-(马来酰亚胺基)己酰胺基)己酰胺基)乙基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)乙基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(6-(4-((马来酰亚胺基)甲基)环己烷甲酰氨基)己酰胺基)乙基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((3-((6-(6-(马来酰亚胺基)己酰胺基)己酰胺基)-s-甲基)吡咯烷-1-基)甲基)-鹅膏毒素;7'c-((3-((6-(6-(马来酰亚胺基)己酰胺基)己酰胺基)-r-甲基)吡咯烷-1-基)甲基)-鹅膏毒素;7'c-((3-((4-((马来酰亚胺基)甲基)
环己烷甲酰胺基)-s-甲基)吡咯烷-1-基)甲基)-鹅膏毒素;7'c-((3-((4-((马来酰亚胺基)甲基)环己烷甲酰胺基)-r-甲基)吡咯烷-1-基)甲基)-鹅膏毒素;7'c-((3-((6-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)己酰胺基)甲基)吡咯烷-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(3-羧基丙酰胺基)乙基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(6-(6-(马来酰亚胺基)己酰胺基)己酰基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(6-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)己酰基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(马来酰亚胺基)乙酰基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(3-(马来酰亚胺基)丙酰基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(4-(马来酰亚胺基)丁酰基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(2-(马来酰亚胺基)乙酰胺基)乙基)哌啶-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(4-(马来酰亚胺基)丁酰胺基)乙基)哌啶-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(6-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)己酰胺基)乙基)哌啶-1-基)甲基)-鹅膏毒素;7'c-((3-((6-(马来酰亚胺基)己酰胺基)甲基)氮杂环丁-1-基)甲基)-鹅膏毒素;7'c-((3-(2-(6-(马来酰亚胺基)己酰胺基)乙基)氮杂环丁-1-基)甲基)-鹅膏毒素;7'c-((3-((4-((马来酰亚胺基)甲基)环己烷甲酰胺基)甲基)氮杂环丁烷-1-基)甲基)-鹅膏毒素;7'c-((3-(2-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)乙基)氮杂环丁烷-1-基)甲基)-鹅膏毒素;7'c-((3-(2-(6-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)己酰胺基)乙基)氮杂环丁烷-1-基)甲基)-鹅膏毒素;7'c-(((2-(6-(马来酰亚胺基)-n-甲基己酰胺基)乙基)(甲基)氨基)甲基)-鹅膏毒素;7'c-(((4-(6-(马来酰亚胺基)-n-甲基己酰胺基)丁基(甲基)氨基)甲基)-鹅膏毒素;7'c-((2-(2-(6-(马来酰亚胺基)己酰胺基)乙基)氮丙啶-1-基)甲基)-鹅膏毒素;7'c-((2-(2-(6-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)己酰胺基)乙基)氮丙啶-1-基)甲基)-鹅膏毒素;7'c-((4-(6-(6-(2-(氨氧基)乙酰胺基)己酰胺基)己酰)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(1-(氨氧基)-2-氧代-6,9,12,15-四氧杂-3-氮杂十七烷-17-酰基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(2-(氨氧基)乙酰胺基)乙酰基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(3-(2-(氨氧基)乙酰胺基)丙酰基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(4-(2-(氨氧基)乙酰胺基)丁酰基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(6-(2-(氨氧基)乙酰胺基)己酰胺基)乙基)哌啶-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(2-(2-(氨氧基)乙酰胺基)乙酰胺基)乙基)哌啶-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(4-(2-(氨氧基)乙酰胺基)丁酰胺基)乙基)哌啶-1-基)甲基)-鹅膏毒素;7'c-((4-(20-(氨氧基)-4,19-二氧代-6,9,12,15-四氧杂-3,18-二氮杂二十烷基)哌啶-1-基)甲基)-鹅膏毒素;7'c-(((2-(6-(2-(氨氧基)乙酰胺基)-n-甲基己酰胺基)乙基)(甲基)氨基)甲基)-鹅膏毒素;7'c-(((4-(6-(2-(氨氧基)乙酰胺基)-n-甲基己酰胺基)丁基)(甲基)氨基)甲基)-鹅膏毒素;7'c-((3-((6-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)己酰胺基)甲基)吡咯烷-1-基)-s-甲基)-鹅膏毒素;7'c-((3-((6-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)己酰胺基)-r-甲基)吡咯烷-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(2-溴乙酰氨基)乙基)哌嗪-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(2-溴乙酰胺基)乙基)哌啶-1-基)甲基)-鹅膏毒素;7'c-((4-(2-(3-(吡啶-2-基二硫烷基)丙酰胺基)乙基)哌啶-1-基)甲基)-鹅膏毒素;6'o-(6-(6-(马来酰亚胺基)己酰胺基)己基)-鹅膏毒素;6'o-(5-(4-((马来酰亚胺基)甲基)环己烷甲酰胺基)戊基)-鹅膏毒素;6'o-(2-((6-(马来酰亚胺基)己基)氧基)-2-氧代乙基)-鹅膏毒素;6'o-((6-(马来酰亚胺基)己基)氨基甲酰基)-鹅膏毒素;6'o-((6-(4-((马
来酰亚胺基)甲基)环己烷甲酰胺基)己基)氨基甲酰基)-鹅膏毒素;6'o-(6-(2-溴乙酰胺基)己基)-鹅膏毒素;7'c-(4-(6-(叠氮基)己酰胺基)哌啶-1-基)-鹅膏毒素;7'c-(4-(己-5-炔基氨基)哌啶-1-基)-鹅膏毒素;7'c-(4-(2-(6-(马来酰亚胺基)己酰胺基)乙基)哌嗪-1-基)-鹅膏毒素;7'c-(4-(2-(6-(6-(马来酰亚胺基)己酰胺基)己酰胺基)乙基)哌嗪-1-基)-鹅膏毒素;6'o-(6-(6-(11,12-二脱氢-5,6-二氢二苯并[b,f]吖辛因-5-基)-6-氧代己酰胺基)己基)-鹅膏毒素;6'o-(6-(己-5-炔基氨基)己基)-鹅膏毒素;6'o-(6-(2-(氨氧基)乙酰胺基)己基)-鹅膏毒素;6'o-((6-氨氧基)己基)-鹅膏毒素;以及6'o-(6-(2-碘乙酰胺基)己基)-鹅膏毒素。前述接头,以及可与本文所述的组合物和方法结合使用的其他接头描述于例如美国专利申请公开号2015/0218220,其公开内容通过引用整体并入本文。
[0540]
可以与识别并结合cd117(例如gnnk+cd117)的抗体或其抗原结合片段缀合以用于直接治疗癌症、自身免疫性病症或用于对患者(例如,人类患者)进行调理以准备造血干细胞移植物治疗的其他细胞毒素包括但不限于5-乙炔基尿嘧啶、阿比特龙(acylfulvene)、酰基富烯(acylfulvene)、腺环戊醇(adecypenol)、阿多来新(adozelesin)、阿地白介素(aldesleukin)、六甲蜜胺(altretamine)、氨莫司汀(ambamustine)、艾美多(amidox)、氨磷汀(amifostine)、氨基酮戊酸(aminolevulinic acid)、氨柔比星(amrubicin)、安吖啶(amsacrine)、阿那格雷(anagrelide)、阿那曲唑(anastrozole)、穿心莲内酯(andrographolide)、血管生成抑制剂、安雷利克斯(antarelix)、抗背侧形态发生蛋白-1(anti-dorsalizing morphogenetic protein-1)、抗雄激素(antiandrogen)、前列腺癌(prostatic carcinoma)、抗雌激素、抗瘤酮(antineoplaston)、反义寡核苷酸、阿非迪霉素甘氨酸盐(aphidicolin glycinate)、凋亡基因调节剂、凋亡调节剂、脱嘌呤核酸、奥沙那宁(asulacrine)、阿他美坦(atamestane)、阿莫司汀(atrimustine)、阿西他汀(axinastatin)1、阿西他汀2、阿西他汀3、阿扎司琼(azasetron)、阿扎毒素(azatoxin)、重氮酪氨酸(azatyrosine)、巴卡亭iii衍生物(baccatin iii derivatives)、班兰诺(balanol)、巴马司他(batimastat)、bcr/abl拮抗剂、苯并二氢卟酚(benzochlorins)、苯甲酰基星形孢菌素(benzoylstaurosporine)、β-内酰胺衍生物、β-阿立辛(beta-alethine)、β-可来霉素b(betaclamycin b)、桦木酸、bfgf抑制剂、比卡鲁胺(bicalutamide)、比生群(bisantrene)、双氮丙啶基精胺(bisaziridinylspermine)、双奈法德(bisnafide)、bistratene a、比折来新(bizelesin)、比锐来特(breflate)、博来霉素a2、博来霉素b2、溴匹立明(bropirimine)、布多替坦(budotitane)、丁硫氨酸亚砜胺(buthionine sulfoximine)、卡泊三醇(calcipotriol)、钙磷酸蛋白c(calphostin c)、喜树碱衍生物(例如10-羟基-喜树碱)、卡培他滨(capecitabine)、甲酰胺-氨基三唑(carboxamide-amino-triazole)、羧酰胺基三唑(carboxyamidotriazole)、卡折来新(carzelesin)、酪蛋白激酶抑制剂、栗树精胺(castanospermine)、杀菌肽b(cecropin b)、西曲瑞克(cetrorelix)、二氢卟酚(chlorins)、氯喹喔啉磺胺(chloroquinoxaline sulfonamide)、西卡前列素(cicaprost)、顺式卟啉、克拉屈滨(cladribine)、氯米芬(clomifene)及其类似物、克霉唑(clotrimazole)、克立霉素a(collismycin a)、克立霉素b、康普瑞汀a4(combretastatin a4)、康普瑞汀类似物、康纳京尼(conagenin)、卡那贝西汀816(crambescidin 816)、克里斯奈托(crisnatol)、念珠藻环肽(cryptophycin)8、念珠藻环肽a衍生物、卡拉新a(curacin a)、环戊蒽醌(cyclopentanthraquinones)、环普兰姆(cycloplatam)、西匹霉素
(cypemycin)、阿糖胞苷十八烷基磷酸钠(cytarabine ocfosfate)、溶细胞因子、磷酸己烷雌酚(cytostatin)、达昔单抗(dacliximab)、地西他滨(decitabine)、脱氢膜海鞘素b、2'脱氧柯福霉素(2'deoxycoformycin)(dcf)、地洛瑞林(deslorelin)、右异环磷酰胺(dexifosfamide)、右雷佐生(dexrazoxane)、右维拉帕米(dexverapamil)、地吖醌(diaziquone)、膜海鞘素b(didemnin b)、地多西(didox)、二乙基去甲精胺(diethylnorspermine)、二氢-5-氮杂胞苷(dihydro-5-azacytidine)、二氢紫杉醇(dihydrotaxol)、二噁霉素(dioxamycin)、二苯基螺莫司汀(diphenyl spiromustine)、圆皮海绵内酯(discodermolide)、二十二烷醇(docosanol)、多拉司琼(dolasetron)、去氧氟尿苷(doxifluridine)、屈洛昔芬(droloxifene)、屈大麻酚(dronabinol)、多卡米星(duocarmycin)sa、依布硒啉(ebselen)、依考莫司汀(ecomustine)、依地福新(edelfosine)、依决洛单抗(edrecolomab)、依氟鸟氨酸(eflornithine)、榄香烯(elemene)、乙嘧替氟(emitefur)、埃博霉素(epothilones)、epithilones、爱普列特(epristeride)、雌莫司汀及其类似物、依托泊苷(etoposide)、依托泊苷4'-磷酸酯(也称为etopofos)、依西美坦(exemestane)、法倔唑(fadrozole)、法扎拉滨(fazarabine)、芬维a胺(fenretinide)、非格司亭(filgrastim)、非那雄胺(fmasteride)、夫拉平度(flavopiridol)、夫来折司汀(flezelastine)、夫斯特隆(fluasterone)、氟达拉滨、盐酸氟道诺霉素(fluorodaunorunicin hydrochloride)、福酚美克(forfenimex)、福美司坦(formestane)、福司曲星(fostriecin)、福莫司汀(fotemustine)、钆德卟啉(gadoliniumtexaphyrin)、硝酸镓、加洛他滨(galocitabine)、加尼瑞克(ganirelix)、明胶酶抑制剂、吉西他滨、谷胱甘肽抑制剂,和普苏姆(hepsulfam)、高三尖杉酯碱(homoharringtonine,hht)、金丝桃素(hypericin)、伊班膦酸(ibandronic acid)、艾多昔芬(idoxifene)、伊决孟酮(idramantone)、伊莫福新(ilmofosine)、伊洛马司他(ilomastat)、咪唑吖啶酮(imidazoacridones)、咪喹莫特(imiquimod)、免疫刺激肽、碘苄胍(iobenguane)、碘多柔比星(iododoxorubicin)、甘薯苦醇(ipomeanol)、伊立替康(irinotecan)、伊罗普拉(iroplact)、伊索拉定(irsogladine)、异苯胍唑(isobengazole)、jasplakinolide、kahalalide f、片螺素-n三乙酸酯(lamellarin-n triacetate)、兰瑞肽(lanreotide)、leinamycin、来格司亭(lenograstim)、硫酸香菇多糖(lentinan sulfate)、雷托他汀(leptolstatin)、来曲唑、亲脂性铂类化合物、立索克林酰胺7(lissoclinamide 7)、洛铂(lobaplatin)、洛美曲索(lometrexol)、氯尼达明(lonidamine)、洛索蒽醌(losoxantrone)、洛索立宾(loxoribine)、勒托替康(lurtotecan)、镥德卟啉(lutetium texaphyrin)、立索茶碱(lysofylline)、马索罗酚(masoprocol)、马司非(maspin)、基质金属蛋白酶抑制剂、美诺立尔(menogaril)、rnerbarone、美替瑞林(meterelin)、甲硫氨酸酶、甲氧氯普胺(metoclopramide)、mif抑制剂、ifepristone、米替福新(miltefosine)、米立司亭(mirimostim)、光辉霉素(mithracin)、米托胍腙(mitoguazone)、二溴卫矛醇(mitolactol)、丝裂霉素及其类似物、米托萘胺(mitonafide)、米托蒽醌(mitoxantrone)、莫法罗汀(mofarotene)、莫拉司亭(molgramostim)、myloroxide b、myriaporone、n-乙酰基地那林(n-acetyldinaline)、n-取代的苯甲酰胺、那法瑞林(nafarelin)、nagrestip、napavin、naphterpin、那托司亭(nartograstim)、奈达铂(nedaplatin)、奈莫柔比星(nemorubicin)、奈立膦酸、尼鲁米特(nilutamide)、nisamycin、nitrullyn、奥曲肽
(octreotide)、okicenone、奥那司酮(onapristone)、昂丹司琼(ondansetron)、oracin、奥马铂(ormaplatin)、奥沙利铂(oxaliplatin)、oxaunomycin、紫杉醇(paclitaxel)及其类似物、帕诺明(palauamine)、十六酰基根霉素(palmitoylrhizoxin)、帕米膦酸(pamidronic acid)、人参炔三醇(panaxytriol)、帕诺米芬(panomifene)、帕拉贝新(parabactin)、帕折普汀(pazelliptine)、培门冬酶(pegaspargase)、皮地新(peldesine)、戌聚糖聚硫酸钠(pentosan polysulfate sodium)、喷司他丁(pentostatin)、pentrozole、全氟溴烷(perflubron)、培磷酰胺(perfosfamide)、苯连氮霉素(phenazinomycin)、沙培林(picibanil)、吡柔比星(pirarubicin)、吡曲克辛(piritrexim)、鬼臼毒素、泊非霉素(porfiromycin)、嘌呤核苷磷酸化酶抑制剂、雷替曲塞(raltitrexed)、根霉素(rhizoxin)、罗谷亚胺(rogletimide)、罗希吐碱(rohitukine)、rubiginone b1、ruboxyl、沙芬戈(safingol)、saintopin、肌肉叶绿醇a(sarcophytol a)、沙格司亭(sargramostim)、索布佐生(sobuzoxane)、索纳明(sonermin)、斯帕磷酸(sparfosic acid)、斯卡霉素(spicamycin)d、螺莫司汀(spiromustine)、斯替皮米德(stipiamide)、sulfinosine、他莫司汀、喃氟啶、替莫唑胺、替尼泊苷、thaliblastine、噻可拉林(thiocoraline)、替拉扎明(tirapazamine)、拓扑替康(topotecan)、topsentin、曲西立滨(triciribine)、三甲曲沙(trimetrexate)、藜芦胺(veramine)、长春瑞滨、vinxaltine、伏氯唑(zeniplatin)、折尼铂(zeniplatin)和亚苄维c(zilascorb)等。
[0541]
用于化学缀合的接头
[0542]
多种接头可用于将本文所述的抗体或抗原结合片段(例如,识别并结合cd117(诸如gnnk+cd117)的抗体或其抗原结合片段)与细胞毒性分子缀合。
[0543]
如本文所用,术语“接头”是指包含共价键或原子链的二价化学部分,其将抗体或其片段(ab)共价连接至药物部分(d)以形成本公开的抗体-药物缀合物(adc;ab-z-l-d,其中d为细胞毒素)。合适的接头具有两个反应性末端,一个用于与抗体缀合,而另一个用于与细胞毒素缀合。接头的抗体缀合反应性末端(反应性部分,z)通常是能够通过抗体上的半胱氨酸硫醇或赖氨酸胺基团与抗体缀合的位点,并且因此通常是硫醇反应性基团诸如双键(如在马来酰亚胺中)或离去基团诸如氯、溴、碘或r-硫烷基,或胺反应性基团诸如羧基;而接头的抗体缀合反应性末端通常是能够通过与细胞毒素上的碱性胺或羧基形成酰胺键而与细胞毒素缀合的位点,因此通常为羧基或碱性胺基团。当术语“接头”用于描述缀合形式的接头时,由于在接头和/或细胞毒素之间以及在接头和/或抗体或其抗原结合片段之间形成键,一个或两个反应性末端将不存在(诸如反应性部分z,已转化为化学部分z)或不完整(诸如仅为羧酸的羰基)。这种缀合反应在下文中进一步描述。
[0544]
通常,适用于本公开的接头在循环中可以是基本上稳定的,但允许细胞毒素(例如,如本文公开的鹅膏毒素)在靶细胞内或紧邻靶细胞释放。在一些实施方案中,接头在某些细胞内条件下是可裂解的,使得接头的裂解可在细胞内环境中从抗体释放药物单元。在其它实施方案中,接头单元是不可裂解的,而药物可以例如通过抗体降解而释放。通常,可裂解接头含有一个或多个响应生理环境而裂解的官能团。例如,可裂解接头可以含有在细胞内的酶(例如,组织蛋白酶b)的存在下降解的酶底物(例如,缬氨酸-丙氨酸)、在细胞区室的酸性环境下降解的酸可裂解基团(例如,腙),或在细胞内的还原环境下降解的可还原基团(例如,二硫化物)。相比之下,通常,不可裂解接头在靶细胞内adc的抗体部分的降解(例
如,溶酶体降解)期间从adc释放。在一些实施方案中,接头在靶细胞外可以是基本上稳定的,而在细胞内可以以一定的有效速率裂解。在一些实施方案中,有效接头可以:(i)维持抗体的特异性结合特性;(ii)允许缀合物或药物部分的细胞内递送;(iii)保持稳定和完整,即不裂解,直到缀合物被递送或转运至其靶位点;以及(iv)保持细胞毒性部分的细胞毒性、细胞杀伤作用或细胞生长抑制作用。adc的稳定性可以通过标准分析技术(诸如质谱法、hplc和分离/分析技术lc/ms)来测量。在一些实施方案中,抗体和药物部分的共价连接需要接头具有两个反应性官能团,即在反应意义上的二价。可用于连接两个或更多个功能性或生物活性部分(诸如肽、核酸、药物、毒素、抗体、半抗原和报告基团)的二价接头试剂是已知的,并且已经描述了由其制备的缀合物的方法(hermanson,g.t.(1996)bioconjugate techniques;academic press:new york,p.234-242)。
[0545]
在一些实施方案中,接头包括可以例如通过酶促水解、光解、在酸性条件下水解、在碱性条件下水解、氧化、二硫化物还原、亲核裂解或有机金属裂解而裂解的那些(参见例如leriche et al.,bioorg.med.chem.,20:571-582,2012,其公开内容通过引用并入本文,因为其涉及适合于共价缀合的接头)。
[0546]
在酸性条件下可水解的接头包括例如腙、缩氨基脲、缩氨基硫脲、顺式乌头酰胺、原酸酯、缩醛、缩酮等。(参见例如美国专利号5,122,368;5,824,805;5,622,929;dubowchik and walker,1999,pharm.therapeutics 83:67-123;neville et al.,1989,biol.chem.264:14653-14661,其各自的公开内容通过引用整体并入本文,因为其涉及适合于共价缀合的接头)。这种接头在中性ph条件下(诸如在血液中的条件下)相对稳定,但在低于ph 5.5或5.0(溶酶体的近似ph)时不稳定。
[0547]
在还原条件下可裂解的接头包括例如二硫化物。多种二硫化物接头是本领域已知的,包括例如可以使用以下形成的二硫化物接头:sata(n-琥珀酰亚胺基-s-乙酰硫代乙酸酯)、spdp(n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯)、spdb(n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丁酸酯)和smpt(n-琥珀酰亚胺基-氧羰基-α-甲基-α-(2-吡啶基二硫代)甲苯)、spdb和smpt。(参见例如thorpe et al.,1987,cancer res.47:5924-5931;wawrzynczak et al.,于immunoconjugates:antibody conjugates in radioimagery and therapy of cancer(c.w.vogel ed.,oxford u.press,1987。还参见美国专利号4,880,935,其各自的公开内容通过引用整体并入本文,因为其涉及适合于共价缀合的接头。
[0548]
对酶水解易感的接头可以为例如被细胞内肽酶或蛋白酶(包括但不限于溶酶体或内体蛋白酶)裂解的含肽接头。使用治疗剂的细胞内蛋白水解释放的一个优点是当缀合时该药剂通常被减弱并且缀合物的血清稳定性通常较高。在一些实施方案中,肽基接头为至少两个氨基酸长或至少三个氨基酸长。示例性的氨基酸接头包括二肽、三肽、四肽或五肽。合适的肽的实例包括含有诸如缬氨酸、丙氨酸、瓜氨酸(cit)、苯丙氨酸、赖氨酸、亮氨酸和甘氨酸的氨基酸的那些。构成氨基酸接头组分的氨基酸残基包括天然存在的那些,以及次要氨基酸和非天然存在的氨基酸类似物,诸如瓜氨酸。示例性的二肽包括缬氨酸-瓜氨酸(vc或val-cit)和丙氨酸-苯丙氨酸(af或ala-phe)。示例性的三肽包括甘氨酸-缬氨酸-瓜氨酸(gly-val-cit)和甘氨酸-甘氨酸-甘氨酸(gly-gly-gly)。在一些实施方案中,接头包括二肽,诸如val-cit、ala-val或phe-lys、val-lys、ala-lys、phe-cit、leu-cit、ile-cit、phe-arg或trp-cit。含有二肽(诸如val-cit或phe-lys)的接头公开于例如美国专利号6,
214,345中,其公开内容通过引用整体并入本文,因为其涉及适于共价缀合的接头。在一些实施方案中,接头包括选自val-ala和val-cit的二肽。在一些实施方案中,二肽与自毁(self-immolative)接头组合使用。
[0549]
适用于合成本文所述的药物-抗体缀合物的其它接头包括能够通过1,6-消除过程释放细胞毒素的接头(“自毁”基团),诸如对氨基苄醇(pabc)、对氨基苄基(pab)、6-马来酰亚氨基己酸、ph-敏感的碳酸盐/酯和jain et al.,pharm.res.32:3526-3540,2015中描述的其他试剂,其公开内容通过引用整体并入本文。
[0550]
在一些实施方案中,接头包括自毁基团,诸如上述pab或pabc(对氨基苄氧基羰基),其公开于例如carl et al.,j.med.chem.(1981)24:479-480;chakravarty et al(1983)j.med.chem.26:638-644;us 6214345;us20030130189;us20030096743;us6759509;us20040052793;us6218519;us6835807;us6268488;us20040018194;w098/13059;us20040052793;us6677435;us5621002;us20040121940;w02004/032828)。能够进行该过程的其它此类化学部分(“自毁接头”)包括氨基甲酸亚甲基酯和杂芳基基团诸如氨基噻唑、氨基咪唑、氨基嘧啶等。含有此类杂环自毁基团的接头公开于例如美国专利公开号20160303254和20150079114,以及美国专利号7,754,681;hay et al.(1999)bioorg.med.chem.lett.9:2237;us 2005/0256030;de groot et al(2001)j.org.chem.66:8815-8830;以及us 7223837。适用于本文的接头还可包括一个或多个选自c
1-c6亚烷基、c
1-c6杂亚烷基、c
2-c6亚烯基、c
2-c6杂亚烯基、c
2-c6亚炔基、c
2-c6杂亚炔基、c
3-c6亚环烷基、杂亚环烷基、亚芳基、杂亚芳基及其组合的基团,其各自可任选地被取代。此类基团的非限制性实例包括(ch2)n、(ch2ch2o)n和
–
(c=o)(ch2)n–
单元,其中n为对于每种情况独立地选择的1-6的整数。
[0551]
合适的接头可以包含具有溶解度增强特性的基团。例如,包括(ch2ch2o)
p
单元(聚乙二醇,peg)的接头可以提高溶解度,其可以是用氨基、磺酸、膦酸或磷酸残基取代的烷基链。包括此类部分的接头公开于例如美国专利号8,236,319和9,504,756,其各自的公开内容通过引用整体并入本文,因为其涉及适于共价缀合的接头。另外的溶解度增强基团包括例如酰基和氨基甲酰基磺酰胺基团,具有以下结构:
[0552][0553]
其中a为0或1;以及
[0554]r10
选自由以下组成的组:氢、c
1-c
24
烷基、c
3-c
24
环烷基、c
1-c
24
(杂)芳基、c
1-c
24
烷基(杂)芳基和c
1-c
24
(杂)芳烷基,所述c
1-c
24
烷基、c
3-c
24
环烷基、c
2-c
24
(杂)芳基、c
3-c
24
烷基(杂)芳基和c
3-c
24
(杂)芳烷基,其各自可任选被一个或多个选自o、s和nr
11r12
的杂原子取代和/或任选地间隔,其中r
11
和r
12
独立地选自由以下组成的组:氢和c
1-c4烷基;或r
10
为细胞毒素,其中所述细胞毒素任选地经由间隔基部分连接至n。含有此类基团的接头描述于,例如,美国专利号9,636,421和美国专利申请公开号2017/0298145中,其公开内容通过引用整体并入本文,因为它们涉及适于与细胞毒素和抗体或其抗原结合片段共价缀合的接头。
[0555]
在一些实施方案中,接头可以包括以下中的一种或多种:肼、二硫化物、硫醚、二
肽、对氨基苄基(pab)基团、杂环自毁基团、任选取代的c
1-c6烷基、任选取代的c
1-c6杂烷基、任选取代的c
2-c6烯基、任选取代的c
2-c6杂烯基、任选取代的c
2-c6炔基、任选取代的c
2-c6杂炔基、任选取代的c
3-c6环烷基、任选取代的杂环烷基、任选取代的芳基、任选取代的杂芳基、酰基、-(c=o)-或-(ch2ch2o)
n-基团,其中n为1-6的整数。本领域技术人员将认识到,所列基团中的一个或多个可以二价(双基)物质的形式存在,例如,c
1-c6亚烷基等。
[0556]
在一些实施方案中,接头l包含部分*-l1l
2-**,其中:
[0557]
l1不存在或为-(ch2)mnr
13
c(=o)-、-(ch2)mnr
13-、-(ch2)mx3(ch2)
m-、
[0558][0559]
l2不存在或为-(ch2)
m-、-nr
13
(ch2)
m-、-(ch2)mnr
13
c(=o)(ch2)
m-、-x4、-(ch2)mnr
13
c(=o)x4、-(ch2)mnr
13
c(=o)-、-((ch2)mo)n(ch2)
m-、-((ch2)mo)n(ch2)mx3(ch2)
m-、-nr
13
((ch2)mo)nx3(ch2)
m-、-nr
13
((ch2)mo)n(ch2)mx3(ch2)
m-、-x1x2c(=o)(ch2)
m-、-(ch2)m(o(ch2)m)
n-、-(ch2)mnr
13
(ch2)
m-、-(ch2)mnr
13
c(=o)(ch2)mx3(ch2)
m-、-(ch2)mc(=o)nr
13
(ch2)mnr
13
c(=o)(ch2)
m-、-(ch2)mc(=o)-、-(ch2)mnr
13
(ch2)mc(=o)x2x1c(=o)-、-(ch2)mx3(ch2)mc(=o)x2x1c(=o)-、-(ch2)mc(=o)nr
13
(ch2)
m-、-(ch2)mc(=o)nr
13
(ch2)mx3(ch2)
m-、-(ch2)mx3(ch2)mnr
13
c(=o)(ch2)
m-、-(ch2)mx3(ch2)mc(=o)nr
13
(ch2)
m-、-(ch2)mo)n(ch2)mnr
13
c(=o)(ch2)
m-、-(ch2)mc(=o)nr
13
(ch2)m(o(ch2)m)
n-、-(ch2)m(o(ch2)m)nc(=o)-、-(ch2)mnr
13
(ch2)mc(=o)-、-(ch2)mc(=o)nr
13
(ch2)mnr
13
c(=o)-、-(ch2)m(o(ch2)m)nx3(ch2)
m-、-(ch2)mx3((ch2)mo)n(ch2)
m-、-(ch2)mx3(ch2)mc(=o)-、-(ch2)mc(=o)nr
13
(ch2)mo)n(ch2)mx3(ch2)
m-、-(ch2)mx3(ch2)m(o(ch2)m)nnr
13
c(=o)(ch2)
m-、-(ch2)mx3(ch2)m(o(ch2)m)nc(=o)-、-(ch2)mx3(ch2)m(o(ch2)m)
n-、-(ch2)mc(=o)nr
13
(ch2)mc(=o)-、-(ch2)mc(=o)nr
13
(ch2)m(o(ch2)m)nc(=o)-、-((ch2)mo)n(ch2)mnr
13
c(=o)(ch2)
m-、-(ch2)mc(=o)nr
13
(ch2)mc(=o)nr
13
(ch2)
m-、-(ch2)mnr
13
c(=o)(ch2)mnr
13
c(=o)(ch2)-(ch2)mx3(ch2)mc(=o)nr
13-、-(ch2)mc(=o)nr
13-、-(ch2)mx
3-、-c(r
13
)2(ch2)
m-、-(ch2)mc(r
13
)2nr
13-、-(ch2)mc(=o)nr
13
(ch2)mnr
13-、-(ch2)mc(=o)nr
13
(ch2)mnr
13
c(=o)nr
13-、-(ch2)mc(=o)x2x1c(=o)-、-c(r
13
)2(ch2)mnr
13
c(=o)(ch2)
m-、-(ch2)mc(=o)nr
13
(ch2)mc(r
13
)2nr
13-、-c(r
13
)2(ch2)mx3(ch2)
m-、-(ch2)mx3(ch2)mc(r
13
)2nr
13-、-c(r
13
)2(ch2)moc(=o)nr
13
(ch2)
m-、-(ch2)mnr
13
c(=o)o(ch2)mc(r
13
)2nr
13-、-(ch2)mx3(ch2)mnr
13-、-(ch2)mx3(ch2)m(o(ch2)m)nnr
13-、-(ch2)mnr
13-、-(ch2)mc(=o)nr
13
(ch2)m(o(ch2)m)nnr
13-、-(ch2)m(o(ch2)m)nnr
13-、-(ch2ch2o)n(ch2)
m-、-(ch2)m(och2ch2)n;-(ch2)mo(ch2)
m-、-(ch2)ms(=o)
2-、-(ch2)mc(=o)nr
13
(ch2)ms(=o)
2-、-(ch2)mx3(ch2)ms(=o)
2-、-(ch2)mx2x1c(=o)-、-(ch2)m(o(ch2)m)nc(=o)x2x1c(=o)-、-(ch2)m(o(ch2)m)nx2x1c(=o)-、-(ch2)mx3(ch2)mx2x1c(=o)-、-(ch2)mx3(ch2)m(o(ch2)m)nx2x
1 c(=o)-、-(ch2)mx3(ch2)mc(=o)nr
13
(ch2)mnr
13
c(=o)-、-(ch2)mx3(ch2)mc(=o)nr
13
(ch2)mc(=o)-、-(ch2)mx3(ch2)mc(=o)nr
13
(ch2)m(o(ch2)m)nc(=o)-、-(ch2)mc(=o)x2x1c(=o)nr
13
(ch2)
m-、-(ch2)mx3(o(ch2)m)nc(=o)-、-(ch2)mnr
13
c(=o)((ch2)mo)n(ch2)
m-、-(ch2)m(o
(ch2)m)nc(=o)nr
13
(ch2)
m-、-(ch2)mnr
13
c(=o)nr
13
(ch2)
m-或-(ch2)mx3(ch2)mnr
13
c(=o)-;
[0560]
其中
[0561]
x1为
[0562][0563]
x2为
[0564][0565]
x
3 is
[0566]
以及
[0567]
x4为
[0568][0569]
其中
[0570]r13
在每种情况下独立地选自h和c
1-c6烷基;
[0571]
m在每种情况下独立地选自1、2、3、4、5、6、7、8、9和10;
[0572]
n在每种情况下独立地选自1、2、3、4、5、6、7、8、9、10、11、12、13和14;以及
[0573]
其中单星号(*)表示与细胞毒素(例如,鹅膏毒素)的连接点,双星号(**)表示与反应性取代基z'或化学部分z的连接点,条件是l1和l2不同时不存在。
[0574]
在一些实施方案中,接头包括对氨基苄基(pab)。在一个实施方案中,对氨基苄基位于细胞毒性药物和接头中的蛋白酶切割位点之间。在一个实施方案中,对氨基苄基是对氨基苄氧基羰基单元的一部分。在一个实施方案中,对氨基苄基是对氨基苄基酰氨基单元的一部分。
[0575]
在一些实施方案中,接头包含pab、val-cit-pab、val-ala-pab、val-lys(ac)-pab、phe-lys-pab、phe-lys(ac)-pab、d-val-leu-lys、gly-gly-arg、ala-ala-asn-pab或ala-pab。
[0576]
在一些实施方案中,接头包含以下中的一种或多种的组合:肽、寡糖、-(ch2)
n-、-(ch2ch2o)
n-、pab、val-cit-pab、val-ala-pab、val-lys(ac)-pab、phe-lys-pab、phe-lys(ac)-pab、d-val-leu-lys、gly-gly-arg、ala-ala-asn-pab或ala-pab。
[0577]
在一些实施方案中,接头包含-(c=o)(ch2)
n-单元,其中n为1-6的整数。
[0578]
在一些实施方案中,接头包含-(ch2)
n-单元,其中n为2至6的整数。
[0579]
在一个具体的实施方案中,接头包含以下结构:
[0580][0581]
其中波浪线表示与细胞毒素和反应部分z
′
的连接点。在另一个具体的实施方案中,接头包含以下结构:
[0582][0583]
其中波浪线表示与细胞毒素和反应部分z
′
的连接点。此类pab-二肽-丙酰基接头公开于例如专利申请公开号wo2017/149077中,其通过引用整体并入本文。此外,wo2017/149077中公开的细胞毒素通过引用并入本文。
[0584]
在某些实施方案中,adc的接头为马来酰亚胺基己酰基-val-ala-对氨基苄基(mc-val-ala-pab)。
[0585]
在某些实施方案中,adc的接头为马来酰亚胺基己酰基-val-cit-对氨基苄基(mc-vc-pab)。
[0586]
在一些实施方案中,接头包含
[0587][0588]
在一些实施方案中,接头包含mcc(4-[n-马来酰亚胺基甲基]环己烷-1-羧酸酯)。
[0589]
可用于将抗体或其抗原结合片段与细胞毒剂缀合的接头包括在接头的一端与细胞毒剂共价结合并且在接头的另一端含有化学部分的那些,该化学部分由存在于接头上的反应性取代基与存在于结合cd117(诸如gnnk+cd117)的抗体或其抗原结合片段内的反应性取代基之间的偶联反应形成。可存在于结合cd117(诸如gnnk+cd117)的抗体或其抗原结合片段内的反应性取代基包括但不限于丝氨酸、苏氨酸和酪氨酸残基的羟基部分;赖氨酸残基的氨基部分;天冬氨酸和谷氨酸残基的羧基部分;和半胱氨酸残基的硫醇部分,以及非天然存在的氨基酸的炔丙基、叠氮基、卤代芳基(例如,氟代芳基)、卤代杂芳基(例如,氟代杂芳基)、卤代烷基和卤代杂烷基部分。
[0590]
可用于合成药物-抗体缀合物的接头的实例包括含有亲电子试剂的那些,所述亲电子试剂诸如迈克尔受体(例如,马来酰亚胺)、活化酯、缺电子羰基化合物和醛等,其适于与抗体或抗原结合片段内存在的亲核取代基(诸如胺和硫醇部分)反应。例如,适于合成药物-抗体缀合物的接头包括但不限于琥珀酰亚胺基4-(n-马来酰亚胺基甲基)-环己烷-l-羧酸酯(smcc)、n-琥珀酰亚胺基碘乙酸酯(sia)、磺基-smcc、间马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯(m-maleimidobenzoyl-n-hydroxysuccinimidyl ester,mbs)、磺基-mbs和琥珀酰亚胺基碘乙酸酯,以及例如liu et al.,18:690-697,1979所述的其它接头,其公开内容通过引用并入本文,因为其涉及用于化学缀合的接头。另外的接头包括不可裂解的马来酰亚胺基己酰基接头,其特别可用于微管破坏剂(诸如澳瑞他汀)的缀合,如doronina et al.,bioconjugate chem.17:14-24,2006所述,其公开内容通过引用并入本文,因为其涉及用于化学缀合的接头。
[0591]
本领域技术人员将认识到,本文公开的任何一个或多个化学基团、部分和特征可以以多种方式组合以形成可用于缀合本文公开的抗体和细胞毒素的接头。可与本文所述的组合物和方法结合使用的其它接头描述于,例如,美国专利申请公开号2015/0218220中,其公开内容通过引用整体并入本文。
[0592]
可用于缀合本文所述的抗体-药物的接头包括但不限于含有通过如下表1所示的偶联反应形成的化学部分的接头。曲线分别表示与抗体或抗原结合片段和细胞毒性分子的连接点。
[0593]
表1.在抗体-药物的形成中通过偶联反应形成的示例性化学部分z
[0594]
[0595]
[0596]
[0597]
[0598][0599]
本领域技术人员将认识到,连接至接头的反应性取代基z'和抗体或其抗原结合片段上的反应性取代基参与共价偶联反应以产生化学部分z,并将认识到反应性取代基z'。因此,可与本文描述的方法结合使用的抗体-药物缀合物可以通过抗体或其抗原结合片段与如本文描述的接头或细胞毒素-接头缀合物反应而形成,该接头或细胞毒素-接头缀合物包括反应性取代基z',其适用于与抗体或其抗原结合片段上的反应性取代基反应以形成化学部分z。
[0600]
在一些实施方案中,z'为-nr
13
c(=o)ch=ch2、-n3、-sh、-s(=o)2(ch=ch2)、-(ch2)2s(=o)2(ch=ch2)、-nr
13
s(=o)2(ch=ch2)、-nr
13
c(=o)ch2r
14
、-nr
13
c(=o)ch2br、-nr
13
c(=o)ch2i、-nhc(=o)ch2br、-nhc(=o)ch2i、-onh2、-c(o)nhnh2、-co2h、-nh2、-nh(c=o)、-nc(=s)、
[0601]
[0602]
[0603]
其中
[0604]r13
在每种情况下独立地选自h和c
1-c6烷基;
[0605]r14
为-s(ch2)nchr
15
nhc(=o)r
13
;
[0606]r15
为r
13
或-c(=o)or
13
;
[0607]r16
在每种情况下独立地选自h、c
1-c6烷基、f、cl和-oh;
[0608]r17
在每种情况下独立地选自h、c
1-c6烷基、f、cl、-nh2、-och3、-och2ch3、-n(ch3)2、-cn、-no2和-oh;以及
[0609]r18
在每种情况下独立地选自h、c
1-c6烷基、f、被-c(=o)oh取代的苄氧基、被-c(=o)oh取代的苄基、被-c(=o)oh取代的c
1-c4烷氧基和被-c(=o)oh取代的c
1-c4烷基。
[0610]
如表1所示,接头和抗体或其抗原结合片段上的适当反应性取代基的实例包括亲核试剂/亲电试剂对(例如,硫醇/卤代烷基对、胺/羰基对或硫醇/α,β-不饱和羰基对等)、二烯/亲二烯试剂对(例如,叠氮化物/炔烃对或二烯/α,β-不饱和羰基对等)等。形成化学部分z的反应性取代基之间的偶联反应包括但不限于硫醇烷基化、羟基烷基化、胺烷基化、胺或羟胺缩合、肼形成、酰胺化、酯化、二硫化物形成、环加成(例如,[4+2]diels-alder环加成、[3+2]huisgen环加成等)、亲核芳族取代、亲电芳族取代和本领域已知或本文所述的其它反应形式。优选地,接头含有用于与抗体或其抗原结合片段上的亲核官能团反应的亲电官能团。
[0611]
如本文所公开的,可存在于抗体或其抗原结合片段内的反应性取代基包括但不限于亲核基团,诸如(i)n-末端胺基,(ii)侧链胺基,例如赖氨酸,(iii)侧链硫醇基,例如半胱氨酸,以及(iv)糖羟基或氨基,其中抗体被糖基化。如本文所公开的,可存在于抗体或其抗原结合片段内的反应性取代基包括但不限于丝氨酸、苏氨酸和酪氨酸残基的羟基部分;赖氨酸残基的氨基部分;天冬氨酸和谷氨酸残基的羧基部分;和半胱氨酸残基的硫醇部分,以及非天然存在的氨基酸的炔丙基、叠氮基、卤代芳基(例如,氟代芳基)、卤代杂芳基(例如,氟代杂芳基)、卤代烷基和卤代杂烷基部分。在一些实施方案中,本文公开的抗体或其抗原结合片段中存在的反应性取代基包括胺或硫醇部分。某些抗体具有可还原的链间二硫键,即半胱氨酸桥。通过用还原剂(诸如dtt(二硫苏糖醇))处理,可以使抗体与接头试剂反应以缀合。因此,理论上,每个半胱氨酸桥将形成两个反应性硫醇亲核试剂。另外的亲核基团可以通过赖氨酸与2-亚氨基硫烷盐酸盐(2-iminothiolane)(traut试剂)的反应引入抗体,导致胺转化成硫醇。可以通过引入一个、两个、三个、四个或更多个半胱氨酸残基将反应性硫醇基团引入抗体(或其片段)中(例如,制备包含一个或多个非天然半胱氨酸氨基酸残基的突变抗体)。美国专利号7,521,541教导了通过引入反应性半胱氨酸氨基酸来工程化改造抗
体。
[0612]
在一些实施方案中,连接至接头的反应性部分z'是与抗体上存在的亲电基团反应的亲核基团。抗体上有用的亲电基团包括但不限于醛和酮羰基。亲核基团的杂原子可与抗体上的亲电基团反应并与抗体形成共价键。有用的亲核基团包括但不限于酰肼、肟、氨基、羟基、肼、缩氨基硫脲、肼羧酸酯和芳基酰肼。
[0613]
在一些实施方案中,z是存在于抗体或其抗原结合片段内的反应性亲核取代基(诸如胺和硫醇部分)与反应性亲电取代基z'之间的反应产物。例如,z'可以是迈克尔受体(例如,马来酰亚胺)、活化酯、缺电子羰基化合物或醛等。在一些实施方案中,连接至接头l的反应性取代基z
′
为马来酰亚胺、叠氮化物或炔烃。含马来酰亚胺的接头的实例为不可裂解的基于马来酰亚胺己酰基的接头,其特别可用于缀合微管破坏剂(诸如澳瑞他汀)。在一些实施方案中,反应性取代基z'为
–
(c=o)-或-nh(c=o)-,使得接头可分别通过酰胺或脲部分与抗体或其抗原结合片段连接,所述酰胺或脲部分由
–
(c=o)-或-nh(c=o)-基团与抗体或其抗原结合片段的氨基反应产生。
[0614]
在一些实施方案中,adc包含抗cd117抗体,其经由本文公开的接头和化学部分z与本文公开的式iii、iiia、iiib或iiic中任一个的鹅膏毒素缀合,形成本文公开的式i、ia、ib、ii、iia或iib中任一个的接头-鹅膏毒素或抗体药物缀合物。在一些实施方案中,接头包括肼、二硫化物、硫醚或二肽。在一些实施方案中,接头包括选自val-ala和val-cit的二肽。在一些实施方案中,接头包括对氨基苄基(pab)。在一些实施方案中,接头包括pab-cit-val部分。在一些实施方案中,接头包括pab-ala-val部分。在一些实施方案中,接头包括
–
((c=o)(ch2)n–
单元,其中n为1-6的整数。在一些实施方案中,接头为
–
pab-cit-val-((c=o)(ch2)n–
。
[0615]
在一些实施方案中,接头包括-(ch2)n–
单元,其中n为2-6的整数。在一些实施方案中,接头为
–
pab-cit-val-((c=o)(ch2)n–
。在一些实施方案中,接头为
–
pab-ala-val-((c=o)(ch2)n–
。在一些实施方案中,接头是-(ch2)n–
。在一些实施方案中,接头为-((ch2)n–
,其中n为6。
[0616]
在一些实施方案中,化学部分z选自表1。在一些实施方案中,化学部分z为
[0617][0618]
其中s为硫原子,其代表存在于结合cd117的抗体或其抗原结合片段中的反应性取代基(例如,来自半胱氨酸残基的-sh基团)。
[0619]
在一些实施方案中,接头l和化学部分z(一起作为l-z),为
[0620][0621]
本领域技术人员将认识到,接头-反应性取代基结构(在与抗体或其抗原结合片段
缀合之前)包括马来酰亚胺作为基团z'。
[0622]
在一些实施方案中,接头-反应性取代基结构l-z'(在与抗体或其抗原结合片段缀合之前)为:
[0623][0624]
在一些实施方案中,如本文所公开的鹅膏毒素与具有下式的接头-反应性部分-l-z
′
缀合:
[0625][0626]
在一些实施方案中,如本文所公开的鹅膏毒素与具有下式的接头-反应性部分-l-z
′
缀合:
[0627][0628]
前述接头部分和鹅膏毒素-接头缀合物,尤其是可与本文所述的组合物和方法结合使用的接头部分和鹅膏毒素-接头缀合物描述于例如美国专利申请公开号2015/0218220和专利申请公开号wo2017/149077,其各自的公开内容通过引用整体并入本文。
[0629]
抗体-药物缀合物的制备
[0630]
在本文公开的式i的adc中,抗cd117抗体或其抗原结合片段通过本文公开的接头l和化学部分z与一个或多个细胞毒性药物部分(d)(例如约1至约20个药物部分/抗体)缀合。本公开的adc可以通过若干途径,使用本领域技术人员已知的有机化学反应、条件和试剂来制备,包括:(1)抗体或其抗原结合片段的反应性取代基与二价接头试剂反应以形成如上文所述的ab-z-l,然后与药物部分d反应;或(2)药物部分的反应性取代基与二价接头试剂反应以形成d-l-z,然后与如本文上文所述的抗体或其抗原结合片段的反应性取代基反应以形成式d-l-z-ab的adc,诸如am-z-l-ab。本文描述了制备adc的其它方法。
[0631]
另一方面,抗cd117抗体或其抗原结合片段具有一个或多个赖氨酸残基,所述赖氨酸残基可被化学修饰以引入一个或多个巯基。然后如上所述通过巯基的硫原子缀合形成adc。可用于修饰赖氨酸的试剂包括但不限于n-琥珀酰亚胺基s-乙酰硫代乙酸酯(sata)和2-亚氨基硫烷盐酸盐(traut试剂)。
[0632]
另一方面,抗cd117抗体或其抗原结合片段可具有一个或多个碳水化合物基团,所
述碳水化合物基团可被化学修饰以具有一个或多个巯基。然后如上所述通过巯基的硫原子缀合形成adc。
[0633]
在另一方面,抗cd117抗体可具有一个或多个碳水化合物基团,所述碳水化合物基团可被氧化以提供醛(-cho)基(参见例如laguzza,et al.,j.med.chem.1989,32(3),548-55)。然后如上所述通过相应的醛缀合形成adc。用于修饰蛋白质以连接或结合细胞毒素的其他方案描述于coligan et al.,current protocols in protein science,vol.2,john wiley&sons(2002),其通过引用并入本文。
[0634]
将接头-药物部分与细胞靶向蛋白(诸如抗体、免疫球蛋白或其片段)缀合的方法可见于例如美国专利号5,208,020;美国美国专利号6,441,163;wo2005037992;wo2005081711;以及wo2006/034488,其通过引用明确地整体并入本文。
[0635]
或者,包含抗cd117抗体和细胞毒剂的融合蛋白可通过例如重组技术或肽合成来制备。dna的长度可以包含编码缀合物的两个部分的各自区域,所述两个部分彼此相邻或被编码接头肽的区域隔开,所述接头肽不破坏缀合物的期望特性。
[0636]
治疗方法
[0637]
如本文所述,造血干细胞移植物治疗可施用于需要治疗的受试者,以填充或再填充一种或多种血细胞类型。造血干细胞通常表现出多潜能性,并且因此可以分化成多种不同的血液谱系,包括但不限于粒细胞(例如,早幼粒细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、红细胞(例如,网织红细胞、红细胞)、凝血细胞(例如,巨核细胞、产生血小板的巨核细胞、血小板)、单核细胞(例如,单核细胞、巨噬细胞)、树突细胞、小胶质细胞、破骨细胞和淋巴细胞(例如,nk细胞、b细胞和t细胞)。另外,造血干细胞能够自我更新,因此可以产生具有与母细胞具有同等潜能的子细胞,并且还具有重新引入移植受体的能力的特征,由此它们归巢到造血干细胞小生境并重新建立富有成效的和持续的造血功能。
[0638]
因此,造血干细胞可以施用于造血谱系的一种或多种细胞类型有缺陷或缺乏的患者,以便在体内重建缺陷或缺乏的细胞群体,从而治疗与内源性血细胞群体的缺陷或耗尽相关的病状。因此,本文所述的组合物和方法可用于治疗非噁性血红蛋白病(例如,选自由镰状细胞性贫血、地中海贫血、范可尼贫血、再生障碍性贫血和威斯科特-奥尔德里奇二氏综合征组成的组的血红蛋白病)。另外地或可选地,本文所述的组合物和方法可用于治疗免疫缺陷,诸如先天性免疫缺陷。另外地或可选地,本文所述的组合物和方法可用于治疗获得性免疫缺陷(例如,选自由hiv和aids组成的组的获得性免疫缺陷)。本文所述的组合物和方法可用于治疗代谢病症(例如,选自糖原贮积病、粘多糖症、戈谢病、胡尔勒病、鞘脂贮积病、异染性脑白质营养不良的代谢病症)。
[0639]
另外地或可选地,本文所述的组合物和方法可用于治疗噁性肿瘤或增生性病症,诸如血液癌症、骨髓增生性疾病。在癌症治疗的情况下,本文所述的组合物和方法可以施用于患者,以便在造血干细胞移植物治疗之前耗尽内源性造血干细胞群体,在这种情况下,移植的细胞可以归巢到由内源性细胞耗尽步骤产生的小生境并建立富有成效的造血功能。这又可以重建在癌细胞根除期间(诸如在全身化疗期间)耗尽的细胞群。可使用本文所述的组合物和方法治疗的示例性血液癌症包括但不限于急性髓样白血病、急性淋巴样白血病、慢性髓样白血病、慢性淋巴样白血病、多发性骨髓瘤、弥漫性大b细胞淋巴瘤和非霍奇金淋巴瘤,以及其它癌性病症,包括成神经细胞瘤。
[0640]
可用本文所述的组合物和方法治疗的其它疾病包括但不限于腺苷脱氨酶缺乏症和重症综合性免疫缺陷、高免疫球蛋白m综合征、切东病、遗传性淋巴组织细胞增生症、骨硬化病、成骨不全、贮积病、重型地中海贫血、系统性硬化症、系统性红斑狼疮、多发性硬化、幼年型类风湿性关节炎。
[0641]
本文所述的抗cd117抗体、其抗原结合片段和缀合物(即adc)可用于诱导实体器官移植物耐受性。例如,本文所述的组合物和方法可用于从靶组织耗尽或消融细胞群体(例如,耗尽来自骨髓干细胞小生境的造血干细胞)。在来自靶组织的细胞的此耗尽之后,可以将来自器官供体的干细胞或祖细胞群体(例如,来自器官供体的造血干细胞)施用于移植受体,并且在这种干细胞或祖细胞的移植之后,可以实现暂时的或稳定的混合嵌合状态,从而在无需另外的免疫抑制剂的情况下实现长期移植器官耐受性。例如,本文所述的组合物和方法可用于在实体器官移植物接受体(例如,肾移植物、肺移植物、肝移植物和心脏移植物等)中诱导移植物耐受性。本文所述的组合物和方法非常适合于结合使用以诱导实体器官移植物耐受性,例如,因为低百分比的暂时或稳定的供体移植物足以诱导移植器官的长期耐受性。
[0642]
此外,本文所述的组合物和方法可用于直接治疗癌症,诸如以cd117+细胞为特征的癌症。例如,本文所述的组合物和方法可用于治疗白血病,特别是在表现出cd117+白血病细胞的患者中。通过耗尽cd117+癌细胞(诸如白血病细胞),本文所述的组合物和方法可直接用于治疗各种癌症。可以以这种方式治疗的示例性癌症包括血液癌症,诸如急性髓样白血病、急性淋巴样白血病、慢性髓样白血病、慢性淋巴样白血病、多发性骨髓瘤、弥漫性大b细胞淋巴瘤和非霍奇金淋巴瘤。
[0643]
急性髓样白血病(aml)是一种血细胞髓样系癌症,其特征在于在骨髓中积累,并干扰正常血细胞的产生的异常白细胞快速生长。aml是影响成人的最常见的急性白血病,其发病率随年龄增长而增加。aml的症状是由白血病细胞替代正常骨髓引起的,其引起红细胞、血小板和正常白细胞减少。作为一种急性白血病,aml进展迅速,并且如果不进行治疗,则可能在数周或数月内致命。在一个实施方案中,本文所述的抗cd117 adc用于在有此需要的人类患者中治疗aml。在某些实施方案中,抗cd117 adc治疗耗尽所治疗的受试者中的aml细胞。在一些实施方案中,约50%或更多的aml细胞被耗尽。在其它实施方案中,约60%或更多的aml细胞被耗尽,或约70%或更多的aml细胞被耗尽,或约80%或更多,或约90%或更多,或约95%或更多的aml细胞被耗尽。在某些实施方案中,抗cd117 adc治疗是单剂量治疗。在某些实施方案中,单剂量抗cd117 adc治疗耗尽约60%,约70%,约80%,约90%,约95%或更多的aml细胞。
[0644]
此外,本文所述的组合物和方法可用于治疗自身免疫性病症。例如,可以将抗cd117抗体或其抗原结合片段施用于受试者,诸如患有自身免疫性病症的人类患者,以杀死cd117+免疫细胞。cd117+免疫细胞可以是自身反应性淋巴细胞,诸如表达特异性结合并引发针对自身抗原的免疫应答的t细胞受体的t细胞。通过耗尽自身反应性cd117+细胞,本文所述的组合物和方法可用于治疗自身免疫病理学,诸如下文所述的那些。另外地或可选地,本文所述的组合物和方法可用于通过在造血干细胞移植物治疗之前耗尽内源性造血干细胞群体来治疗自身免疫性疾病,在这种情况下,移植的细胞可归巢至由内源性细胞耗尽步骤产生的小生境并建立富有成效的造血功能。这又可以重建在自身免疫细胞根除过程中耗
尽的细胞群体。
[0645]
可以使用本文所述的组合物和方法治疗的自身免疫性疾病包括但不限于银屑病、银屑病性关节炎、1型糖尿病(1型糖尿病)、类风湿性关节炎(ra)、人类系统性红斑狼疮(sle)、多发性硬化(ms)、炎性肠病(ibd)、淋巴细胞性结肠炎、急性播散性脑脊髓炎(adem)、阿狄森氏病(addison's diseas)、普秃、强直性脊柱炎(ankylosing spondylitisis)、抗磷脂抗体综合征(aps)、再生障碍性贫血、自身免疫性溶血性贫血、自身免疫性肝炎、自身免疫性内耳病(aied)、自身免疫性淋巴细胞增生综合征(alps)、自身免疫性卵巢炎、巴洛病(balo disease)、白塞氏病(behcet's disease)、大疱性类天疱疮、心肌病、恰加斯氏病(chagas'disease)、慢性疲劳免疫功能障碍综合征(cfids)、慢性炎性脱髓鞘性多神经病、克罗恩病、疤痕性类天疱疮、口炎性腹泻-疱疹样皮炎(coeliac sprue-dermatitis herpetiformis)、冷凝集素病(cold agglutinin disease)、crest综合征、德戈斯(degos)病、盘状狼疮(discoid lupus)、自主神经机能异常(dysautonomia)、子宫内膜异位(endometriosis)、原发性混合型冷球蛋白血症(ntial mixed cryoglobulinemia)、纤维肌痛-纤维肌炎(fibromyalgia-fibromyositis)、肺出血肾炎综合征(goodpasture's syndrome)、格雷夫斯病(grave's disease)、格林-巴利综合征(guillain-barre syndrome,gbs)、桥本氏甲状腺炎(hashimoto's thyroiditis)、化脓性汗腺炎(hidradenitis suppurativa)、特发性和/或急性血小板减少性紫癜、特发性肺纤维化、iga神经病变、间质性膀胱炎、幼年型关节炎、川崎病(kawasaki's disease)、扁平苔藓(lichen planus)、莱姆病(lyme disease)、梅尼埃病(meniere disease)、混合性结缔组织病(mctd)、重症肌无力、神经性肌强直、视性眼阵挛肌阵挛综合征(opsoclonus myoclonus syndrome,oms)、视神经炎、奥德氏甲状腺炎(ord's thyroiditis)、寻常型天疱疮、噁性贫血、多软骨炎、多肌炎和皮肌炎、原发性胆汁性肝硬化、结节性多动脉炎、多腺体综合征、风湿性多肌痛、原发性丙种球蛋白缺乏血症(primary agammaglobulinemia)、雷诺现象(raynaud phenomenon)、莱特尔综合征(reiter's syndrome)、风湿热、结节病、硬皮病、舍格伦综合征(syndrome)、僵人综合征、高安氏动脉炎(takayasu's arteritis)、颞动脉炎(又称“巨细胞动脉炎”)、溃疡性结肠炎、胶原性结肠炎、葡萄膜炎、血管炎、白癜风、外阴痛(“外阴前庭炎”)和韦格纳肉芽肿病(wegener's granulomatosis)。
[0646]
施用和给药途径
[0647]
本文所述的adc、抗体或其抗原结合片段可以以多种剂型施用于患者(例如,患有癌症、自身免疫性疾病或需要造血干细胞移植物治疗的人类患者)。例如,本文所述的抗体或其抗原结合片段可以水溶液(诸如含有一种或多种药学上可接受的赋形剂的水溶液)的形式施用于患有癌症、自身免疫性疾病或需要造血干细胞移植物治疗的患者。与本文所述的组合物和方法一起使用的药学上可接受的赋形剂包括粘度调节剂。水溶液可以使用本领域已知的技术进行灭菌。
[0648]
包含本文所述的抗cd117 adc或抗体的药物制剂通过将此类adc或抗cd117抗体与一种或多种任选的药学上可接受的载体(remington's pharmaceutical sciences 16th edition,osol,a.ed.(1980))混合,以冻干制剂或水溶液形式来制备。药学上可接受的载体在所采用的剂量和浓度下通常对接受体无毒,并且包括但不限于:缓冲剂,诸如磷酸盐、柠檬酸盐和其它有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(诸如十八烷基二甲基
苄基氯化铵;六甲双铵氯化物;苯扎氯铵;苄索氯铵;酚、丁醇或苯甲醇;对羟基苯甲酸烷基酯,诸如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(小于约10个残基)多肽;蛋白质,诸如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,诸如聚乙烯吡咯烷酮;氨基酸,诸如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其它碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂诸如edta;糖,诸如蔗糖、甘露醇、海藻糖或山梨醇;成盐抗衡离子诸如钠;金属络合物(例如zn-蛋白络合物);和/或非离子表面活性剂,诸如聚乙二醇(peg)。
[0649]
本文所述的抗cd117 adc、抗体或抗原结合片段可以通过多种途径施用,诸如口服、透皮、皮下、鼻内、静脉内、肌内、眼内或肠胃外。在任何给定情况下最适合的施用途径将取决于所施用的具体抗体或抗原结合片段、患者、药物制剂方法、施用方法(例如,施用时间和施用途径)、患者的年龄、体重、性别、所治疗疾病的严重程度、患者的饮食和患者的排泄率。
[0650]
本文所述的抗cd117 adc、抗体或其抗原结合片段的有效剂量的范围可以为例如约0.001至约100mg/kg体重/单次(例如,推注)施用、多次施用或连续施用,或达到抗体、其抗原结合片段的最佳血清浓度(例如,0.0001-5000μg/ml的血清浓度)。抗cd117 adc的剂量可以每天、每周或每月一次或多次(例如,2-10次)施用于受试者(例如,人类),其患有癌症、自身免疫性疾病或在经历调节以准备接受造血干细胞移植物。在造血干细胞移植之前的调理程序的情况下,抗cd117 adc、抗体或其抗原结合片段可以在最佳促进外源性造血干细胞植入的时间施用于患者,例如在施用外源性造血干细胞移植物之前约1小时至约1周(例如,约1小时,约2小时,约3小时,约4小时,约5小时,约6小时,约7小时,约8小时,约9小时,约10小时,约11小时,约12小时,约13小时,约14小时,约15小时,约16小时,约17小时,约18小时,约19小时,约20小时,约21小时,约22小时,约23小时,约24小时,约2天,约3天,约4天,约5天,约6天或约7天)或更长时间。
[0651]
使用本文公开的方法,本领域有技术的内科医生可以向需要造血干细胞移植物治疗的人类患者施用能够结合由造血干细胞表达的抗原的抗cd117adc、抗体或其抗原结合片段,诸如结合cd117的抗体或其抗原结合片段(例如,结合gnnk+cd117的抗体或其抗原结合片段)。以这种方式,可以在施用外源性造血干细胞移植物之前耗尽内源性造血干细胞群体,从而促进造血干细胞移植物的植入。
[0652]
如上所述,抗体可以与毒素(诸如本文所述或本领域已知的细胞毒性分子)共价缀合。例如,抗cd117抗体或其抗原结合片段(诸如抗gnnk+cd117抗体或其抗原结合片段)可以与细胞毒素,诸如假单胞菌外毒素a、debouganin、白喉毒素、鹅膏毒素(诸如γ-鹅膏蕈碱、α-鹅膏蕈碱)、皂草素、美登素、美登木素生物碱、澳瑞他汀、蒽环类药物、加利车霉素、伊立替康、sn-38、多卡米星、志贺毒素、吡咯并苯二氮杂卓、吡咯并苯二氮杂卓二聚体、吲哚啉并苯二氮杂卓、吲哚啉并苯二氮杂卓二聚体或其变体共价缀合。这种缀合可以使用本文所述的或本领域已知的形成共价键的技术进行。在将外源性造血干细胞(诸如自体、同基因或同种异体造血干细胞)移植给患者之前,可以将抗体、其抗原结合片段或药物-抗体缀合物顺序施用于患者,例如通过静脉内施用。
[0653]
抗cd117(例如,抗gnnk+cd117)抗体、其抗原结合片段或药物-抗体缀合物可以在造血干细胞移植物治疗之前以足以使内源性造血干细胞的量降低例如约10%,约20%,约
30%,约40%,约50%,约60%,约70%,约80%,约90%,约95%或更多的量施用。造血干细胞计数的减少可使用本领域已知的常规技术监测,诸如通过在调理治疗期间以不同间隔从患者抽取的血液样品中表达特征性造血干细胞表面抗原的细胞的facs分析。例如,本领域的有技术的内科医生可以在调理治疗期间的不同时间点从患者抽取血液样品,并通过使用与造血干细胞标志物抗原结合的抗体进行facs分析来阐明样品中造血干细胞的相对浓度以确定内源性造血干细胞减少的程度。根据一些实施方案,当响应用抗cd117(例如,抗gnnk+cd117)抗体、其抗原结合片段或药物-抗体缀合物进行的调理治疗,造血干细胞的浓度已经达到最小值时,内科医生可以结束调理治疗,并且可以开始为患者准备造血干细胞移植物治疗。
[0654]
抗cd117(例如,抗gnnk+cd117)抗体、其抗原结合片段或药物-抗体缀合物可以在含有一种或多种药学上可接受的赋形剂(诸如粘度调节剂)的水溶液中施用于患者。水溶液可使用本文所述或本领域已知的技术进行灭菌。在将造血干细胞移植物施用于患者之前,可以将抗体、其抗原结合片段或药物-抗体缀合物以例如0.001mg/kg至100mg/kg的剂量施用于患者。抗体、其抗原结合片段或药物-抗体缀合物可在最佳促进外源性造血干细胞植入的时间施用于患者,例如在施用外源性造血干细胞移植物之前约1小时至约1周(例如,约1小时,约2小时,约3小时,约4小时,约5小时,约6小时,约7小时,约8小时,约9小时,约10小时,约11小时,约12小时,约13小时,约14小时,约15小时,约16小时,约17小时,约18小时,约19小时,约20小时,约21小时,约22小时,约23小时,约24小时,约2天,约3天,约4天,约5天,约6天或约7天)或更长时间。
[0655]
在调理治疗结束后,患者然后可以接受外源性造血干细胞的输注(例如静脉内输注),诸如通过进行调理治疗的同一位内科医生或来自不同内科医生。内科医生可以对患者施用自体、同基因或同种异体造血干细胞的输注,例如,以1x103至1x109个造血干细胞/kg的剂量。内科医生可以监测造血干细胞移植物的植入,例如,通过从患者抽取血样并测定施用移植物后造血干细胞或造血谱系细胞(诸如巨核细胞、凝血细胞、血小板、红细胞、肥大细胞、成髓细胞、嗜碱性粒细胞、嗜中性粒细胞、嗜酸性粒细胞、小胶质细胞、粒细胞、单核细胞、破骨细胞、抗原呈递细胞、巨噬细胞、树突细胞、自然杀伤细胞、t淋巴细胞和b淋巴细胞)的浓度增加。该分析可以在例如造血干细胞移植物治疗后约1小时至约6个月或更长时间(例如,约1小时,约2小时,约3小时,约4小时,约5小时,约6小时,约7小时,约8小时,约9小时,约10小时,约11小时,约12小时,约13小时,约14小时,约15小时,约16小时,约17小时,约18小时,约19小时,约20小时,约21小时,约22小时,约23小时,约24小时,约2天,约3天,约4天,约5天,约6天,约7天,约2周,约3周,约4周,约5周,约6周,约7周,约8周,约9周,约10周,约11周,约12周,约13周,约14周,约15周,约16周,约17周,约18周,约20周,约21周,约22周,约23周,约24周或更长时间)进行。相对于移植物治疗前相应细胞类型的浓度,移植物治疗后造血干细胞或造血谱系细胞的浓度有所增加(例如,增加约1%,约2%,约3%,约4%,约5%,约6%,约7%,约8%,约9%,约10%,约20%,约30%,约40%,约50%,约60%,约70%,约80%,约90%,约100%,约200%,约500%或更多),这一发现表明用抗cd117(例如,抗gnnk+cd117)抗体、其抗原结合片段或药物-抗体缀合物的治疗成功地促进移植的造血干细胞移植物的植入。
[0656]
实施例
[0657]
提出以下实施例以便向本领域普通技术人员提供如何使用、制备和评估本文所述的组合物和方法的描述,并且旨在纯粹作为本公开的示例,而不旨在限制发明人视为其发明的范围。
[0658]
实施例1.抗cd117抗体85(ab85)的鉴定
[0659]
抗cd117抗体85(即,ab85)的鉴定基于如pct/us2018/057180(其公开内容通过引用整体并入本文)中所述的人ck6抗体(即,ab1)的衍生物产生。抗体85是一种拮抗性抗体,其可通过测定ab85阻断cd117介导的活化的能力来确定,如本领域技术人员已知的,其包含下文提供的氨基酸序列。简言之,可以在存在cd117结合抗体的情况下温育依赖于cd117配体scf1进行增殖的细胞(原代cd34+细胞或mo7e细胞),以评估它们阻断cd117和scf1之间相互作用的能力,从而导致细胞增殖的可测量的减少。或者,可以进行简单的结合实验以测量cd117和scf1结合事件的拮抗作用。
[0660]
抗体hc-85/lc-85(ab85)
[0661]
ab85的重链可变区(vh)氨基酸序列在下面提供为seq id no:2。ab85的vh cdr氨基酸序列在下面加下划线并且如下:nywig(vh cdr1;seq id no:3);iinprdsdtryrpsfqg(vh cdr2;seq id no:4);和hgrgyegyegafdi(vh cdr3;seq id no:5)。
[0662]
ab85 vh序列
[0663][0664]
ab85的轻链可变区(vl)氨基酸序列在下文中提供为seq id no 6。ab85的vl cdr氨基酸序列在下面加下划线并且如下:rssqgirsdlg(vl cdr1;seq id no:7);dasnlet(vl cdr2;seq id no:8);和qqangfplt(vl cdr3;seq id no:9)。
[0665]
ab85 vl序列
[0666][0667]
ab85和ab1的重链和轻链可变区以及cdr的氨基酸序列的比较描述于图1a和1b中。
[0668]
实施例2.ab85的表位分析
[0669]
化学交联实验
[0670]
交联实验允许通过高质量maldi质谱术直接分析非共价相互作用。通过将含有非共价相互作用的蛋白质样品与特别开发的交联混合物(bich,c et al.anal.chem.,2010,82(1),pp 172
–
179)混合,可以以高灵敏度特异性地检测非共价复合物。产生的共价结合允许相互作用的物质在样品制备过程和maldi电离中存活。一种特殊的高质量检测系统允许在高质量范围内表征相互作用。
[0671]
将ab85样品在蒸馏水中稀释至2.7mg/ml的浓度。然后将1μl稀释的ab85与1μl基质混合,该基质由在乙腈/水(1:1,v/v)、tfa(0.1%(k200maldi kit)中的重结晶芥子酸基质(10mg/ml)组成。使用covalx’s k200maldi ms分析试剂盒使混合物交联。将蛋白质溶液与1μl k200稳定剂试剂(2mg/ml)混合并在室温下温育。温育时间(180分钟)后,制备样品用于maldi分析。在室温下结晶后立即通过high-mass maldi ms分析样品。
[0672]
已经使用具有标准氮激光并聚焦在0-1500kda的不同质量范围的covalx的hm4相
互作用模块进行了maldi tof ms分析。
[0673]
肽质量指纹实验
[0674]
为了表征cd117,将cd117样品进行胰蛋白酶、胰凝乳蛋白酶、asp-n、弹性蛋白酶和嗜热菌蛋白酶蛋白水解,然后使用与ltq-orbitrap质谱仪(thermo scientific)成线的nlc ultimate 3000-rslc系统进行nlc-ltq-orbitrap ms/ms分析。
[0675]
将100μl的cd117(6.8μm)与1μl的dss d0/d12(2mg/ml;dmf)混合,然后在室温下温育180分钟。温育后,通过加入1μl碳酸氢铵(终浓度:20mm),然后在室温下温育1小时时间终止反应。然后在h2o 8m尿素悬浮液(10μl)之前使用speedvac干燥溶液。混合后,向溶液中加入1μl dtt(500mm)。然后将混合物在37℃下温育1小时。温育后,加入1μl碘乙酰胺(1m),然后在室温下在暗室中温育1小时时间。温育后,加入100μl蛋白水解缓冲液。胰蛋白酶缓冲液含有50mm ambic ph 8.5、5%乙腈,胰凝乳蛋白酶缓冲液含有tris hcl 100mm、cacl2 10mm ph 7.8;asp-n缓冲液含有磷酸盐缓冲液50mm ph 7.8;弹性蛋白酶缓冲液含有tris hcl 50mm ph8.0,并且嗜热菌蛋白酶缓冲液含有tris hcl 50mm、cacl
2 0.5mm ph 9.0。
[0676]
胰蛋白酶蛋白水解:将100μl还原的/烷基化的cd117与1μl胰蛋白酶(roche diagnostic)以1/100的比例混合。将蛋白水解混合物在37℃下温育过夜。
[0677]
胰凝乳蛋白酶蛋白水解:将100μl还原的/烷基化的cd117与0.5μl胰凝乳蛋白酶(roche diagnostic)以1/200的比例混合。将蛋白水解混合物在25℃下温育过夜。
[0678]
asp-n蛋白水解:将100μl还原的/烷基化的cd117与0.5μl asp-n(roche diagnostic)以1/200的比例混合。将蛋白水解混合物在37℃下温育过夜。
[0679]
弹性蛋白酶蛋白水解:将100μl还原的/烷基化的cd117与1μl弹性蛋白酶(roche diagnostic)以1/100的比例混合。将蛋白水解混合物在37℃下温育过夜。
[0680]
嗜热菌蛋白酶蛋白水解:将100μl还原的/烷基化的cd117与2μl嗜热菌蛋白酶(roche diagnostic)以1/50的比例混合。将蛋白水解混合物在70℃下温育过夜。
[0681]
消化后,将甲酸加入溶液中,终浓度1%。蛋白水解后,将10μl通过蛋白水解产生的肽溶液上样到纳液相色谱系统(ultimate 3000-rslc)上。使用xquest 2.0版和stavrox 3.6软件分析交联的肽。使用与ltq-orbitrap质谱仪(thermo scientific)成线的nlc ultimate 3000-rslc系统进行nlc-ltq-orbitrap ms/ms系统。
[0682]
结果
[0683]
使用high-mass maldi质谱术和化学交联,未检测到ab85抗体的非共价聚集体或抗原cd117的多聚体。使用化学交联、high-mass maldi质谱术和nlc-orbitrap质谱术测定cd117和ab85之间的分子界面。基于此分析,相互作用包括cd117上的以下氨基酸:t67、k69、t71、s81、y83和t114、t119、k129(图2)。
[0684]
表2:氨基酸序列汇总
[0685]
[0686]
[0687]
[0688]
[0689]
[0690]
[0691]
[0692]
[0693]
[0694]
[0695]
[0696]
[0697][0698]
其他实施方案
[0699]
本说明书中提及的所有出版物、专利和专利申请均通过引用并入本文,其程度如同每个独立的出版物或专利申请被具体和单独地指出通过引用并入一样。
[0700]
虽然本公开已经结合其具体实施方案进行了描述,但是将理解的是,能够进行进一步的修改,并且本技术旨在涵盖总体上遵循本公开的原理的本公开的任何变化、使用或改编,并且包括在本公开所属领域内的已知或惯常实践内的与本公开的这种偏离,并且可以应用于上文阐述的必要特征,并且遵循在权利要求书的范围内。
[0701]
其它实施方案在权利要求书内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1