术后腔内化疗/免疫协同治疗的缓释凝胶递药系统及其制备方法和应用
1.本发明属于医药技术领域,具体涉及一种原位缓释凝胶递药系统构建以及在胶质瘤术后腔内进行化疗/免疫协同治疗的应用。
背景技术:
2.脑胶质瘤是最常见的原发性中枢神经系统(central nervous system,cns)肿瘤,约占所有原发性cns肿瘤的80%。脑胶质瘤恶性程度高,治疗效果不理想,预后极差且死亡率极高,其中位生存期小于18个月,5年生存率不足3%。目前脑胶质瘤在临床上的治疗手段主要包括外科手术、术后化疗与放疗等,且在大多数情况下,手术切除是首要选择。然而,胶质瘤多生长在重要脑功能区,且呈浸润性生长,与正常脑组织无明显界限,所以外科手术难度大,不可能完全切除肿瘤细胞,残留的少量浸润胶质瘤细胞和因手术激活的休眠期胶质瘤细胞迅速进入增殖期,造成术后短期内肿瘤复发而导致死亡。目前临床上对胶质瘤术后患者进行全身系统化疗都是在手术2周后进行。全身系统化疗不仅难以克服血脑屏障(bbb),而且破坏机体免疫系统,从而加剧胶质瘤微环境的免疫抑制,促进胶质瘤细胞的免疫逃逸。因此,胶质瘤术后腔内化疗是胶质瘤术后治疗重要策略。
3.紫杉醇(ptx)是目前已发现最优秀的天然抗癌药物,体外显示出非常强的胶质瘤细胞毒性。研究显示,ptx不仅可以直接杀伤胶质瘤细胞,还可以诱导其凋亡,释放钙网蛋白(calreticulin,crt)以及高迁移率蛋白1(high mobility group box 1protein,hmgb1) 等损伤相关分子模式(damage-associated molecular pattern,damp)肿瘤抗原,增强肿瘤免疫原性。但由于血脑屏障和血脑肿瘤屏障(blood-brain tumor barrier,bbtb)的存在,使得ptx难以进入脑组织和肿瘤部位。所以目前对ptx抗胶质瘤研究主要集中在ptx脑靶向纳米递药系统开发上。受体介导的内吞可以克服bbtb以实现脑部递药。白介素13 受体α2(il-13rα2)是一种在胶质瘤表面高度表达的特异性受体,而pep-1(cgemgwvrc) 肽是一种对il-13rα2有高度亲和力并能与其特异性结合的线性多肽。因此,将pep-1锚定于纳米粒表面,通过il-13rα2介导的内吞可促进胶质瘤细胞对纳米递药系统的摄取,提高ptx在胶质瘤内的分布,从而增强抗肿瘤效果。
4.除了利用化疗药直接杀伤浸润胶质瘤外,胶质瘤免疫治疗受到越来越多的关注。由于调节性t细胞(regulatory cell,treg)以及骨髓来源性抑制细胞(myeloid-derived suppressorcells,mdscs)等免疫抑制性细胞浸润,导致胶质瘤微环境为高度免疫抑制状态,使胶质瘤细胞躲避了机体免疫系统的攻击,促进胶质瘤生长与复发。所以,逆转胶质瘤免疫抑制微环境,是胶质瘤免疫治疗的关键所在。cpg是人工合成的含未甲基化cpg基序的寡核苷酸。作为一种新型免疫佐剂,cpg能够模拟细菌dna,激活树突状细胞(dendritic cells, dc)与胶质瘤相关巨噬细胞(glioma-associated macrophages,gams)等抗原提呈细胞 (antigen-presenting cell,apc)内toll样受体9(toll-like receptor 9,tlr-9),增强apc 的肿瘤抗原递呈能力。此外,cpg也可以通过促进apc细胞分泌细胞因子,激活nk细
胞和cd8+t细胞,激活中枢神经系统的固有免疫和获得性免疫。然而,cpg只有在脑内持续刺激才能有效激活胶质瘤免疫反应,而cpg在脑脊液的半衰期只有1小时,所以,目前cpg用于胶质瘤免疫治疗必须通过反复脑室注射或瘤内注射给药,这种给药方式不利于临床转化应用。
5.tlr-9位于apc胞内,对cpg的识别及信号转导继发于cpg被apc内吞后,所以cpg的摄取与内化决定了其免疫激活作用。研究显示,利用纳米递药系统可以促进apc 的摄取与内吞。甘露糖受体属于多凝集素受体,可识别细胞表面和病原体细胞壁上的多种糖分子,广泛分布在gams和dc细胞等apc细胞膜上。因此,利用甘露糖修饰cpg纳米粒,可以提高胶质瘤微环境中apc对cpg的摄取与吞噬,增强cpg的免疫激活作用。鉴于此,将化疗药联合免疫佐剂用于胶质瘤术后腔内治疗有望能将化疗与免疫治疗结合双管齐下杀伤残留胶质瘤。所以,研究一种能够在胶质瘤术后立即给药,能在手术腔内缓控释药并能将ptx和cpg分别递送至胶质瘤细胞和抗原递呈细胞内的药物递送系统有迫切的必要性。
6.原位凝胶是一种具有三维网络结构的聚合物,在用药部位立即发生物理或化学交联,由液态转变成半固体凝胶的药物新剂型,广泛应用于缓控释给药系统。聚(乳酸-羟基乙酸)
ꢀ‑
聚(乙二醇)-聚(乳酸-乙醇酸)(plga-peg-plga)三嵌段共聚物是一种常用温度敏感原位凝胶,在室温或低于室温时为可流动的溶胶状态,当温度接近体温则交联形成水凝胶。plga-peg-plga具有良好的生物相容性,注射后能填充于手术空腔并与其完全吻合,在体温刺激下交联成凝胶药物储库并持续缓慢释放药物。因此plga-peg-plga原位温敏凝胶在胶质瘤术后腔内局部治疗中具有很好的应用前景。
技术实现要素:
7.本发明的目的是,利用ptx直接杀伤浸润胶质瘤与cpg增强抗原提呈细胞的肿瘤抗原递呈能力,设计一种嵌入ptx靶向纳米粒和cpg靶向纳米粒胶质瘤术后腔内缓释递药系统,将化学治疗与免疫治疗相结合,发挥协同治疗的作用。
8.本发明利用pep-1(cgemgwvrc)肽对胶质瘤表面特异性受体il-13rα2有高度亲和力,并能与其特异性结合的特点,将pep-1锚定于纳米粒表面,构建ptx前药靶向纳米粒。又利用甘露糖修饰cpg纳米粒,提高抗原提呈细胞对cpg的摄取与吞噬,增强cpg的免疫激活作用。将两种纳米粒联合应用,可将化疗药联合免疫佐剂,用于胶质瘤术后腔内治疗,有望能将化疗与免疫治疗结合,双管齐下,杀伤残留胶质瘤细胞。
9.本发明另一目的在于,通过温敏凝胶装载的方式,将化疗药物ptx前药靶向纳米粒与免疫治疗药物cpg靶向纳米粒同时在胶质瘤术后腔内进行递送,达到缓慢释放药物,原位治疗胶质瘤的目的。
10.本发明的目的通过以下技术方案实现:
11.一种化疗/免疫协同治疗胶质瘤术后的缓释递药体系是由温度敏感的凝胶材料做为骨架嵌入ptx前药靶向纳米粒以及cpg靶向聚合物纳米粒制成。其中,温度敏感的凝胶材料为聚(乳酸-羟基乙酸)-聚(乙二醇)-聚(乳酸-乙醇酸)三嵌段共聚物。
12.ptx前药靶向纳米粒和cpg靶向纳米粒与温度敏感的凝胶材料体积比为1:1:8。
13.所述的聚(乳酸-羟基乙酸)-聚(乙二醇)-聚(乳酸-乙醇酸)(plga-peg-plga) 三嵌段共聚物可以通过市售获得。
14.所述温度敏感的凝胶溶液是通过以下方法制备得到的:称取一定量的 plga
1750
–
peg
1500
–
plga
1750
,均匀分散在蒸馏水中,在室温放置24h,使其充分溶胀得到plga
1750
–
peg
1500
–
plga
1750
浓度为10-30%(w/v)凝胶水溶液,浓度优选为20%。
15.ptx前药靶向纳米粒是由自组装ptx前药纳米粒(psnps)表面修饰靶向肽 pep-peg
2000-dspe制备而成,自组装ptx前药纳米粒(psnps)由ptx前药分子ptx-ss-c
18
通过乙醇注入法制备,靶向肽pep-peg
2000-dspe与自组装ptx前药纳米粒psnps的质量比为1:5~10。
16.上述ptx前药靶向纳米粒的具体制备步骤是将pep-peg
2000-dspe溶于水中,并与自组装ptx前药纳米粒混合,得到ptx前药靶向纳米粒,靶向肽pep-peg
2000-dspe与psnps 的质量比为1:5~10。
17.所述的ptx前药纳米粒(psnps),是利用二硫代甘醇酸将ptx与十八醇化学键合,得到ptx前药分子ptx-ss-c18,前药分子自组装形成ptx前药纳米粒np/ptx;其中, ptx-ss-c18制备方法包括以下步骤:将1.0g二硫代甘醇酸与15ml无水乙酸酐混合,在氮气保护下,35℃搅拌反应3h后,旋转蒸发去除乙酸和多余的乙酸酐,旋蒸后的产物溶于二氯甲烷,并加入1.49g的十八醇和65mg的dmap,室温下搅拌反应15h后用1%hac终止,有机层用无水硫酸钠干燥;粗产物经硅胶柱层析纯化后得到中间体 hooc-ch
2-ss-ch
2-cooc
18
;将中间体和hbtu在冰浴下溶于二氯甲烷,并逐滴加入n,n
‑ꢀ
二异丙基乙胺,反应30min后加入200mgptx,在避光条件下,继续室温反应10h;待反应完全后,混合物先后用1%hac和纯水洗涤,并用无水硫酸钠干燥;粗产物经硅胶柱层析纯化,干燥后得到ptx-ss-c18。
18.所述ptx前药靶向纳米粒由靶向脂质材料pep-peg
2000-dspe锚定于自组装ptx前药纳米粒(psnps)组成,靶向材料pep-peg
2000-dspe由前药ptx-ss-c18通过乙醇注入法制备
19.所述自组装ptx前药纳米粒(psnps)的制备步骤为:称取5mg ptx-ss-c18溶于0.5 ml无水乙醇得有机相,室温下用微量注射器将有机相缓慢滴入到不断搅拌(700rpm)的10 ml纯水(水相)中,滴加完毕后继续敞口搅拌5min,60℃旋转蒸发5min除去残余有机溶剂,最后经0.45μm,0.22μm微孔滤膜过滤,得自组装ptx前药纳米粒(psnps)。
20.上述ptx前药靶向纳米粒的制备步骤为:将pep-peg-dspe溶于水中,并与上述方法制得的自组装ptx前药纳米粒(psnps)混合(pep-peg2000-dspe/psnps=20/100,w/w),得到ptx前药靶向纳米粒(pnp
ptx
)。
21.所述的cpg靶向纳米粒是由水相与油相通过复乳法制备。
22.所述的cpg靶向纳米粒的水相由cpg溶于纯净水中得到。
23.所述的cpg靶向纳米粒的油相由plga
20000
和甘露糖化plga
30000
聚合物 (man-plga
30000
)、阳离子脂质dc-chol溶于二氯甲烷中得到;所述的油相中plga20000 和阳离子脂质dc-chol的质量比为45:2,man-plga和阳离子脂质dc-chol的质量比为 5:2。
24.上述cpg靶向纳米粒的制备步骤为:将0.5mg cpg溶于50μl纯净水中得水相,取 22.5mg plga20000和2.5mg man-plga
30000
与阳离子脂质dc-chol 1mg溶于0.5ml二氯甲烷中得油相,将油相与水相混合,冰浴下用超声波细胞粉碎仪超声,形成初乳。将初乳加入到1.5ml 1%的pva水溶液中,冰浴下超声得到复乳(w/o/w),分散到25ml 0.3%的pva水溶液中,在室温下敞口搅拌蒸发除去有机溶剂。所得溶液高速冷冻离心,弃上清,水洗后即得mnp
cpg
。
25.所述初乳的超声时间为30秒,超声粉碎仪的能量值为40%。
26.所述复乳的超声时间为2分钟,超声粉碎仪的能量值为50%-60%。
27.所述室温下敞口搅拌时间为2-3小时
28.所述高速冷冻离心条件为4℃,14000rpm,40分钟,3次。
29.上述化疗/免疫协同治疗胶质瘤术后的缓释递药体系的制备方法是以ptx前药靶向纳米粒和cpg靶向聚合物纳米粒为活性成分,将其分散在温度敏感的原位凝胶骨架内;其中,温度敏感的凝胶材料为聚(乳酸-羟基乙酸)-聚(乙二醇)-聚(乳酸-乙醇酸)三嵌段共聚物,ptx前药靶向纳米粒和cpg靶向纳米粒的摩尔比为1:1。
30.所述的化疗/免疫协同治疗胶质瘤术后的缓释递药体系的具体制备步骤为:将ptx前药靶向纳米粒以及cpg靶向聚合物纳米粒分别加入凝胶水溶液中,加入pnp
ptx
和mnp
cpg
溶液的摩尔比为1:1,使plga
1750
–
peg
1500
–
plga
1750
的最终浓度为10-30%(优选为20%),搅拌均匀,即得载药纳米凝胶pnp
ptx
&mnp
cpg
@gel
31.所述的化疗/免疫协同治疗胶质瘤术后的缓释递药体系在胶质瘤术后治疗应用具有显著的效果,因此,本发明可在制备脑胶质瘤术后腔内进行化疗/免疫协同治疗的药物中应用。
32.对本发明制备的用于治疗术后胶质瘤的化疗/免疫协同治疗纳米递药体系进行了体内外评价:
33.对本发明制备的化疗/免疫协同治疗胶质瘤术后的缓释递药体系进行了细胞毒性实验、细胞摄取实验、肿瘤损伤相关分子模式检测、体内协同治疗机制、抗胶质瘤药效研究。结果表明,经pep-1修饰后,显著增加肿瘤细胞对纳米粒的摄取,且细胞对纳米粒的摄取是浓度和时间依赖的过程,并且体内靶向性研究结果证明提高了ptx纳米粒在胶质瘤部位的蓄积,达到预期目的。而经甘露糖的修饰可显著提高抗原提呈细胞对cpg纳米粒的吞噬和摄取,有利于增加cpg在抗原提呈细胞的内化,从而增强cpg的免疫激活作用。将两种纳米粒分散于温敏凝胶骨架中,注射到手术腔后,在体温刺激下能快速胶凝形成凝胶药物贮库,在手术腔内缓慢释放达15天以上。释放出来的ptx前药靶向纳米粒被残留胶质瘤细胞摄取后,释放ptx直接杀伤胶质瘤细胞,发挥化学治疗的作用。释放出来的cpg靶向纳米粒可以靶向激活抗原提呈细胞分泌il-2,ifn-γ和tnf等细胞因子,促进免疫细胞的活化,发挥免疫治疗的作用,二者联合应用,协同发挥抗胶质瘤作用,延长胶质瘤大鼠的中位生存期。
34.1)细胞毒性实验
35.采用mtt法测定ptx前药靶向纳米粒对人恶性胶质瘤细胞(u87mg细胞)和大鼠胶质瘤细胞(9l细胞)的细胞毒性,ptx前药靶向纳米粒显著减小了ptx对普通细胞的毒性同时保留对肿瘤细胞的细胞毒作用。
36.2)细胞摄取
37.ptx前药纳米粒通过包载荧光物质香豆素-6考察的u87mg细胞、9l细胞定量摄取情况,荧光染料香豆素-6浓度为1、2、5μg/ml时,随着香豆素-6浓度的升高,纳米粒组摄取量明显强于普通纳米粒组,说明pep-1修饰的纳米粒显著提高胶质瘤细胞对纳米粒的摄取量。
38.cpg纳米粒通过标记荧光物质cy5.5考察小鼠树突状细胞(dc2.4)定性摄取情况,同一浓度下靶向纳米粒组的荧光强度强于普通纳米粒组,表明甘露糖的修饰可以通过抗原递呈细胞表面的甘露糖受体介导的内吞,显著提高抗原递呈细胞对纳米粒的吞噬和摄取
39.3)肿瘤损伤相关分子模式检测
40.激光共聚焦显微镜观察钙网蛋白(crt)的转位情况并拍照,同一浓度下,pnp
ptx
组和taxol 组与np
ptx
组相比,细胞核有明显裂解现象,且pnp
ptx
组细胞膜上的crt荧光强度显著强于 np
ptx
组,且说明pnp
ptx
组与np
ptx
组相比对肿瘤的细胞毒性更强,且能更好的诱导肿瘤凋亡释放crt。
41.通过hmgb1 elisa试剂盒测定高迁移率蛋白b1(hmgb1),在同一浓度条件下, pnp
ptx
组释放的hmgb1是npptx组的1.95倍,显著高于np
ptx
组,说明pnp
ptx
能更好的诱导肿瘤凋亡释放hmgb1。
42.4)体内协同治疗机制研究
43.胶质瘤术后模型大鼠分别在胶质瘤术后腔原位注射,将其分为生理盐水组、 pnp
ptx
&mn
pcpg
溶液组、pnp
ptx
&mnp
cpg
凝胶组、pnp
ptx
凝胶组、mnp
cpg
凝胶组。各组用elisa 试剂盒检测il-2,ifn-γ和tnf等细胞因子水平,各组中协同治疗应用组细胞因子检测最多。
44.5)抗胶质瘤作用研究
45.胶质瘤术后模型大鼠分别在胶质瘤术后腔原位注射,将其按照不同的生理盐水组、 pnp
ptx
&mn
pcpg
溶液组、pnp
ptx
&mnp
cpg
凝胶组、pnp
ptx
凝胶组、mnp
cpg
凝胶组进行给药,分笼饲养,每组8只。观察大鼠给药后的生存情况,各治疗组中,pnp
ptx
&mnp
cpg
凝胶组组生存期最长。
46.本发明的有益效果:本发明构建的化疗/免疫协同治疗胶质瘤术后的缓释递药体系。一方面,缓释递药系统释放的紫杉醇(ptx)前药靶向纳米粒(pnp
ptx
)在胶质瘤表面高表达的特异性白介素13受体α2(il13rα2)介导下靶向术后残留的浸润胶质瘤细胞,并被其内吞入胞,在胞内谷胱甘肽(glutathione,gsh)响应下,释放出ptx,杀死胶质瘤细胞,
47.发挥化学作用,并释放肿瘤新生抗原,诱导免疫原性肿瘤细胞死亡;另一方面,凝胶递药系统释放的cpg靶向聚合物纳米粒(mnp
cpg
)在甘露糖受体介导下靶向抗原提呈细胞 (apc),通过激活apc胞内toll样受体9(tlr-9)活化apc,增强apc对ptx化疗诱导的肿瘤抗原提呈作用,促进cd8
+
t细胞活化。此外,mnp
cpg
促进apc细胞因子释放,激活nk细胞和cd8
+
t细胞,激活中枢神经系统的固有免疫和获得性免疫,清除术后残留的胶质瘤细胞。从直接靶向杀伤残留胶质瘤细胞和激活胶质瘤免疫微环境两个角度,协同提高胶质瘤术后治疗效果。该协同体系不仅可以装载于原位温敏凝胶中,也可以装载于其他骨架材料中发挥其协同治疗效果。并有利于其作为药物储库并缓慢释放靶向纳米药物。
附图说明
48.图1为本发明实施例1pnp
ptx
和mnp
cpg
的透射电镜图以及pnp
ptx
的还原响应性研究。
49.图a为pnp
ptx
透射电镜图及粒径分布;
50.图b为mnp
cpg
的透射电镜图及粒径分布;
51.图c为pnp
ptx
在含有10mm gsh的hac-naac缓冲液中孵育1h后的透射电镜扫描图
52.图2为本发明实施例2pnp
ptx
和mnp
cpg
体外释放图。
53.图a为在含有1μm gsh的csf和含有10mm gsh的hac-naac缓冲液中的累计释放图;
54.图b为mnp
cpg
在pbs缓冲液中的累计释放图
55.图3为实施例u87mg、9l细胞对pnp
ptx
的摄取图;
56.图a为在1,2和5μg/ml的香豆素-6浓度下37℃孵育1h后,u87mg细胞对香豆素
ꢀ‑
6标
记的pnp
ptx
(a,b,c)和pnp
ptx
(d,e,f)的摄取定性图;
57.图b为在1,2和5μg/ml的香豆素-6浓度下37℃孵育1h(a-f,d,h)或2h(c,g)后, 9l细胞对香豆素-6标记的pnp
ptx
(a-d)和pnp
ptx
(e-h)的摄取定性图;
58.图c为在1,2和5μg/ml的香豆素-6浓度下37℃孵育1h后,u87mg细胞和9l细胞对香豆素-6标记的np
ptx
和pnp
ptx
的摄取定量图。
59.图4为实施例dc2.4细胞对mnp
cpg
的定性摄取图
60.图5为实施例9l细胞细胞膜上表达crt的免疫荧光图以及释放高迁移率蛋白1定量图图6为实施例pnp
ptx
细胞毒作用
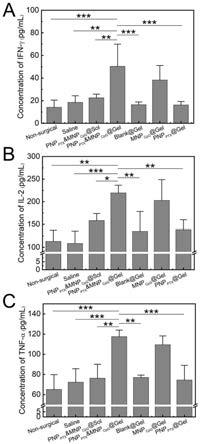
61.图7为实施例胶质瘤和周围脑组织内ifn-γ(a),il-2(b)和tnf-α(c)等细胞因子分泌情况。
62.图8为实施例胶质瘤术后大鼠给药后生存期。
具体实施方式
63.下面结合具体实施例和附图对本发明作进一步的阐述,具体实施例是在本发明的优选条件下进行。所述方法如无特别说明均为常规方法,所述原材料如无特别说明均能从公开商业途径而得。
64.实施例1
65.(1)psnps,np
ptx
和pnp
ptx
的制备合成
66.称取5mg ptx-ss-c
18
溶于0.5ml无水乙醇得有机相,室温下用微量注射器将有机相缓慢滴入到不断搅拌(700rpm)的10ml纯水(水相)中,滴加完毕后继续敞口搅拌5min,60℃旋转蒸发 5min除去残余有机溶剂,最后经0.45μm,0.22μm微孔滤膜过滤,得自组装ptx前药纳米粒 (psnps)。将meo-peg
2000-dspe和pep-peg
2000-dspe分别溶于水中,并与上述方法制得的 psnps混合(meo-peg
2000-dspe或pep-peg
2000-dspe/psnps=20/100,w/w),得到非靶向纳米粒 (np
ptx
)和靶向纳米粒(pnp
ptx
)。
67.将psnps,np
ptx
和pnp
ptx
分别用去离子水稀释适当倍数后,用马尔文激光粒度仪zetasizernano-s90测定其粒径。
68.取适量pnp
ptx
,将喷碳铜网小心置于纳米粒溶液中,浸润捞出数次,置于滤纸上,自然晾干后,滴加2%磷钨酸染液至铜网,10min后吸弃多余染液,自然干燥后于透射电镜下观测并拍摄图片。结果如图1中a所示;纳米粒呈类球形实体粒子,形态规整,大小比较均匀,表面光滑,平均粒径约为120nm。
69.(2)np
cpg
与mnp
cpg
制备
70.将0.5mg cpg溶于50μl纯净水中得水相,取plga
20000 25mg与阳离子脂质dc-chol 1mg溶于0.5ml二氯甲烷中得油相,将油相与水相混合,冰浴下用超声波细胞粉碎仪超声30s,形成初乳。将初乳加入到1.5ml 1%的pva水溶液中,冰浴下超声2min得到复乳(w/o/w),分散到25 ml 0.3%的pva水溶液中,在室温下敞口搅拌2h蒸发除去有机溶剂。所得溶液30000g高速冷冻离心40min,弃上清,水洗后即得非靶向npcpg。mnpcpg同样通过复乳法制备,除在初始投料时将25mg plga
20000
改为22.5mg plga
20000
和2.5mg man-plga
30000
,其余步骤同npcpg的制备方法。
71.将np
cpg
与mnp
cpg
分别用去离子水稀释适当倍数后,用马尔文激光粒度仪zetasizernano-s90测定其粒径。
72.取适量mnp
cpg
,将喷碳铜网小心置于纳米粒溶液中,浸润捞出数次,置于滤纸上,自然晾干后,滴加2%磷钨酸染液至铜网上,10min后吸弃多余染液,自然干燥后于透射电镜下观测并拍摄图片。结果如图1中b所示:纳米粒呈类球形实体粒子,形态规整,大小比较均匀,表面光滑,平均粒径约为250nm。
73.(3)pnp
ptx
还原响应性研究
74.取适量pnp
ptx
,用含10mm gsh的hac-naac缓冲液(0.04m,ph 5.6)孵育1h后,将喷碳铜网小心置于纳米粒溶液中,浸润捞出数次,置于滤纸上,自然晾干后,滴加2%
75.磷钨酸染液至铜网上,10min后吸弃多余染液,自然干燥后于透射电镜下观测并拍摄图片。
76.将pnp
ptx
分别用pbs(ph 7.4)和含10mm gsh的hac-naac缓冲液(0.04m,ph 5.6) 稀释适当倍数后,放入37℃摇床中,100rpm恒温震荡,分别于1,2,3,4,6,8和12h 时间点取适量样品,用马尔文激光粒度仪zetasizer nano-s90测定其粒径。
77.本实施例中,制备得到的pnp
ptx
的透射电镜结果显示:pnp
ptx
纳米粒呈类球形实体粒子,形态规整,大小比较均匀,表面光滑,平均粒径约为120nm,如图1中a;并且pnp
ptx
用谷胱甘肽孵育1h后可以发现纳米粒不再是规整的类球形,轮廓模糊,有明显解聚现象,表明纳米粒在gsh所致的还原环境下发生了降解,具有一定的还原响应性。而pep-1多肽的修饰会使纳米粒粒径有略微的增加,但是粒径变化并无显著差异,如图1中c;此外,pnp
ptx
和psnps的zeta电位没有明显差异,表明pep-1的修饰并没有显著改变纳米粒的理化性质。且ptx纳米粒表现出了超高的载药量,psnps和pnp
ptx
的载药量分别为67.23%和57.03%。制备得到的。mnp
cpg
的透射电镜图显示纳米粒呈类球形实体粒子,形态规整,大小比较均匀,表面光滑,平均粒径约为250nm,包封率为92.99%,结果如图1中b所示。
78.所用的原料:本实验室前期实验方案合成前药ptx-ss-c18以及靶向材料 pep-peg
2000-dspe。meo-peg
2000-dspe购自corden pharma international gmbh公司; cpg-odn购自苏州泓迅生物科技有限公司;dc-chol购自sigma,其它原料均为市售所得。
79.实施例2pnp
ptx
和mnp
cpg
的体外释放
80.(1)按照实施例ptx纳米粒的制备方法,采用超滤离心法考察纳米粒中ptx的体外释放行为。取适量制备的纳米粒溶液,用释放介质稀释至30ml,置于50ml ep管中,ptx 的总量为15μg,以保证药物释放是在漏槽条件下进行。释放介质分别为含10mm gsh和 0.5%吐温-80的hac-naac缓冲液(0.04m,ph 5.6)以模拟肿瘤微环境,以及含1μm gsh 和0.5%吐温-80的脑脊液(csf,ph 7.4)以模拟脑脊液微环境。将稀释后的纳米粒放入 37℃恒温摇床中(150rpm),分别于0.25,0.5,0.75,1,2,3,4,8,12h平行取出三组样品,立即转移至截留分子量为30000的超滤离心管中,以4000rpm离心10min,滤液中ptx的浓度通过hplc方法测定,计算释放百分率(%)。结果显示,在脑脊液中在1μmgsh存在下ptx无释放,而在肿瘤微环境中,gsh浓度较高,纳米粒在前4h内快速释放,4h时释放率可达59.7%;4h后释放趋于平缓,12h累计释放率为67.6%,表现了良好的释药性。结果见图2中a。
81.(2)按照上述cpg纳米粒的制备方法,采用高速离心法考察纳米粒中cpg的体外释放行为,取适量制备的纳米粒溶液,用释放介质稀释至30ml,置于50ml ep管中,cpg 的总量
为20μg,释放介质为ph 7.4的pbs缓冲液。将稀释后的纳米粒放入37℃恒温摇床 (150rpm),分别于4,12,24,36,48,60,72,96,120h取出平行的三组样品,立即转移离心管中,以30000g高速冷冻离心40min,取上清,用ssdna荧光(oligreen) 定量试剂盒测定样品浓度,计算释放百分率(%)。结果显示mnp
cpg
可匀速释放cpg,没有表现出明显的突释,mnp
cpg
在144h天内累计释放约35%的cpg,表明mnp
cpg
可在生理环境下匀速稳定释放纳米粒,如图2中b。
82.实施例3:
83.将pnp
ptx
以及mnp
cpg
加入温度敏感的凝胶溶液中,三者体积比为1:1:8,pnp
ptx
以及mnp
cpg
在温度敏感的凝胶溶液中的浓度分别为10%,搅拌均匀,即得载药纳米凝胶 pnp
ptx
&mnp
cpg
@gel;温度敏感的凝胶溶液是通过以下方法制备得到的:称取一定量的 plga
1750
–
peg
1500
–
plga
1750
,均匀分散在蒸馏水中,在室温放置24h,使其充分溶胀得到plga
1750
–
peg
1500
–
plga
1750
浓度为10-30%(w/v)凝胶水溶液,浓度为20%。
84.实施例4
85.(1)u87mg、9l细胞对香豆素-6标记的pnp
ptx
的定性摄取
86.制备香豆素-6标记的纳米粒:分别将ptx-ss-c18和香豆素-6溶于乙醇,混合均匀后用微量注射器滴加到不断搅拌的水相中,后续步骤同实施例1pnp
ptx
中的制备。
87.将对数生长期u87mg细胞和9l细胞按2
×
104cells/pore的密度接种于24孔板中,培养24h后,显微镜下观察细胞融合度和形态。pbs洗涤细胞单层,然后用不含血清的培养基将香豆素-6标记的pnp
ptx
和np
ptx
分别配制成含香豆素-6浓度为1,2和5μg/ml的溶液,于37℃孵育1h或2h。孵育结束后,用预冷的pbs洗涤细胞3遍,每孔加入4%多聚甲醛pbs溶液,室温固定15min,每孔再加入10μg/ml hoechst33342于室温孵育10min 进行细胞核染色,孵育结束后,快速吸掉染液,用预冷pbs洗涤细胞3遍后立即置于倒置荧光显微镜下观察并拍照。如图3中a、图3中b
88.(2)u87mg、9l细胞对香豆素-6标记的pnp
ptx
的定量摄取
89.按照上述方法制备香豆素-6标记的pnp
ptx
90.将对数生长期u87mg细胞和9l细胞按1
×
105cells/pore的密度接种于24孔板中,培养24h后,显微镜下观察细胞融合度和形态。pbs洗涤细胞单层,然后用不含血清的培养基将香豆素-6标记的pnp
ptx
和np
ptx
分别配制成含香豆素-6浓度为1,2和5μg/ml的溶液,于37℃孵育1h。孵育结束后,用预冷的pbs洗涤细胞3遍,然后每孔加入0.4ml 1.0%tritonx-100裂解细胞,避光振荡10min,细胞样品于8000rpm离心10min,上清液一部分用bca定量试剂盒测定细胞蛋白含量,另一部分用荧光分光光度计测定溶液中香豆素-6标记的纳米粒的含量。如图3中c
91.结果如图3,u87mg细胞对pnp
ptx
的摄取均具有浓度依赖性。在各条件下,香豆素
ꢀ‑
6浓度增加,细胞内绿色荧光明显增强。此外,同一浓度下,pnp
ptx
组细胞内的荧光强度均强于np
ptx
组。9l细胞对pnp
ptx
的摄取均具有浓度和时间依赖性。在各条件下,香豆素-6浓度增加,细胞内绿色荧光明显增强。此外,同一浓度下,pnp
ptx
组细胞内的荧光强度均强于np
ptx
组;且在同一浓度条件下,孵育2h后细胞内荧光强度明显强于孵育1h 后的强度。说明pep-1肽的修饰可以促进纳米粒被胶质瘤细胞的摄取,提高ptx在胞内的分布
92.实施例5dc2.4细胞对mnp
cpg
的定性摄取观察
93.在6孔板中放入大小适宜的盖玻片,将对数生长期dc2.4细胞按2
×
105cells/pore
的密度接种于6孔板中,培养24h后,用不含血清的培养基将cy5.5-cpg,cy5.5-npcpg和cy5.5-mnp
cpg
分别配制成含cy5.5-cpg浓度相同的溶液,或只加纯培养基设阴性对照blank组,于37℃孵育12h。孵育结束后,用预冷的pbs洗涤单层细胞3遍,每孔加入4%多聚甲醛pbs溶液,室温固定15min,每孔再加入dapi于室温孵育10min进行细胞核染色,孵育结束后,快速吸掉染液,用预冷pbs洗涤细胞3遍后将盖玻片放在载玻片上,封片液封片。封片后用激光共聚焦显微镜观察并拍照。如图4显示:同一浓度下,cy5.5-mnp
cpg
组细胞内的荧光强度强于cy5.5-npcpg组,说明甘露糖的修饰可以通过抗原递呈细胞表面的甘露糖受体介导的内吞,显著提高抗原递呈细胞对纳米粒的吞噬和摄取,有利于增加cpg在apc内的富集,从而增强cpg的免疫激活作用
94.实施例6pnp
ptx
的体外细胞毒
95.分别以u87mg细胞和9l细胞为模型细胞,用mtt法评价pnp
ptx
的细胞毒性。取对数生长期的细胞,将细胞以5
×
103cell/pore的浓度接种于96孔板中,于37℃,5%co2的培养箱中培养24h后,加入不同浓度的无血清培养基稀释的taxol,np
ptx
和pnp
ptx
,每个浓度设置5个复孔,以纯培养液组为阴性对照组,无细胞组为空白对照组,在常规条件下继续培养48h。培养结束后,每孔加入5mg/ml的mtt溶液20μl。继续孵育4h后,弃去上清,每孔加入200μl的dmso溶液,于振荡器上避光震荡10min,随后在酶标仪上检测各孔490nm波长处的od值。按以下公式计算细胞存活率。
[0096][0097]
并计算半数抑制浓度ic
50
值。纳米粒作用于u87mg细胞和9l细胞时,细胞毒作用均呈现明显的浓度依赖性。如图5所示,纳米粒作用于u87mg细胞时,在各个浓度范围内,pnp
ptx
组(ic50值:4.163
±
0.619μg/ml)的毒性均大于np
ptx
组(ic50值》10μg/ml)。如图5所示,纳米粒作用于9l细胞时,各浓度条件下的pnp
ptx
组(ic50值:4.780
±
0.679μg/ml)的毒性也均大于np
ptx
组(ic50值》10μg/ml)。以上结果表明,pep-1修饰的纳米粒通过促进纳米粒的入胞,增大纳米粒对肿瘤细胞的毒性。
[0098]
实施例7肿瘤损伤相关分子模式检测
[0099]
在6孔板中放入大小适宜的盖玻片,将对数生长期的9l细胞以2
×
105cell/pore的密度接种于6孔板中,培养24h后,加入不同浓度的无血清培养基稀释的taxol,np
ptx
和pnp
ptx
。培养24h后,弃上清液,用pbs洗涤细胞,加入用无血清培养基稀释的5μl/mldid细胞膜染料,37℃孵育30min后,弃去染色液,用预热培养基继续孵育10min,重复洗三次。然后弃去培养基,pbs洗涤细胞三遍后用4%多聚甲醛固定15-20min。pbs洗涤三遍,室温封闭1h后加入抗大鼠crt抗体4℃孵育过夜。次日,pbs清洗玻片后,coralite488标记的二抗室温孵育1h,然后pbs清洗玻片,dapi染色,染色结束后将盖玻片放在载玻片上,封片液封片。封片后用激光共聚焦显微镜观察钙网蛋白(crt)的转位情况并拍照。将对数生长期的9l细胞以1
×
105cell/pore的密度接种于24孔板中,培养24小时后,加入不同浓度的无血清培养基稀释的taxol,np
ptx
和pnp
ptx
。继续孵育48小时后,收集上清液,于3000rpm离心10min。上清液中的高迁移率蛋白b1(hmgb1)通过hmgb1elisa试剂盒进行测定。结果显示,同一浓度下,pnp
ptx
组和taxol组与np
ptx
组相比,细胞核有明显裂解现象,且pnp
ptx
组细胞膜上的crt荧光强度显著强于npptx组,且说明pnp
ptx
组与np
ptx
组相比对肿瘤的细胞毒性更强,且能更好的
诱导肿瘤凋亡释放crt。如图6所示,同一浓度条件下,pnp
ptx
组释放的hmgb1是np
ptx
组的1.95倍,显著高np
ptx
组,说明pnp
ptx
能更好的诱导肿瘤凋亡释放hmgb1
[0100]
实施例8pnp
ptx
&mnp
cpg
@gel协同治疗机制研究
[0101]
(1)建立fischer344大鼠胶质瘤术后模型
[0102]
取fischer344大鼠,经10%水合氯醛麻醉后固定于脑立体定位仪,头部经75%酒精消毒后,于内毗连线与头部矢状中线交汇处纵向作1cm长头皮切口,用棉棒沾取少量双氧水搽拭头骨表面组织,分离暴露颅骨,从前囟矢状缝右侧2mm处颅骨钻孔。25μl微量注射器吸取5μl上述细胞悬液后垂直穿刺脑膜和脑组织达纹状体处。缓慢注射完毕后留针5 min,缓慢拔出注射器。生理盐水擦拭手术部位,用医用缝合线缝合并消毒皮肤。14天后,对荷瘤大鼠行胶质瘤不完全切除手术。同上述操作分离暴露颅骨后,用颅骨钻行一直径为 3.4mm的颅骨切口,剔除硬脑膜,充分暴露脑组织。在外科显微镜下不完全切除脑肿瘤组织,并用真空泵吸除手术切除组织。电凝止血后,颅内手术腔给药30μl,人工硬脑膜覆盖手术窗,缝合头皮并消毒
[0103]
(2)将fischer344大鼠胶质瘤不完全切除术后模型,随机分成七组,按照以下方案进行给药:不手术组,pnp
ptx
&mnp
cpg
@gel组,mnp
cpg
@gel组,pnp
ptx
@gel组, pnp
ptx
&mnp
cpg
@sol组,blank@gel组和生理盐水组(ptx:10mg/kg,cpg:300μg/kg) (上述组分均按照实施例方法制备得到),于给药10天后,处死大鼠,取手术腔周围的残留胶质瘤组织,以不手术组为对照组,进行细胞因子检测:各组取等量的组织,加预冷的生理盐水后进行匀浆,经两次反复冻融裂解细胞,1000
×
g离心10min后取上清,用elisa 试剂盒检测il-2,ifn-γ和tnf等细胞因子水平,如图7所示,pnp
ptx
&mnp
cpg
@gel组和mnp
cpg
@ge组il-2,ifn-γ和tnf的分泌显著高于其余组。pnp
ptx
&mnp
cpg
@gel 在体内释放mnpcpg可激活抗原提呈细胞分泌il-2,ifn-γ,和tnf等细胞因子,促进免疫细胞的活化,发挥免疫治疗作用。
[0104]
实施例8pnp
ptx
&mnp
cpg
@gel治疗胶质瘤效果考察
[0105]
(1)建立fischer344大鼠胶质瘤术后模型
[0106]
取fischer344大鼠,经10%水合氯醛麻醉后固定于脑立体定位仪,头部经75%酒精消毒后,于内毗连线与头部矢状中线交汇处纵向作1cm长头皮切口,用棉棒沾取少量双氧水搽拭头骨表面组织,分离暴露颅骨,从前囟矢状缝右侧2mm处颅骨钻孔。25μl微量注射器吸取5μl上述细胞悬液后垂直穿刺脑膜和脑组织达纹状体处。缓慢注射完毕后留针5 min,缓慢拔出注射器。生理盐水擦拭手术部位,用医用缝合线缝合并消毒皮肤。14天后,对荷瘤大鼠行胶质瘤不完全切除手术。同上述操作分离暴露颅骨后,用颅骨钻行一直径为 3.4mm的颅骨切口,剔除硬脑膜,充分暴露脑组织。在外科显微镜下不完全切除脑肿瘤组织,并用真空泵吸除手术切除组织。电凝止血后,颅内手术腔给药30μl,人工硬脑膜覆盖手术窗,缝合头皮并消毒
[0107]
(2)将fischer344大鼠胶质瘤不完全切除术后模型,随机分成5组,每组8只,按照以下方案进行给药:pnp
ptx
&mnp
cpg
@gel组,mnp
cpg
@gel组,pnp
ptx
@gel组, pnp
ptx
&mnp
cpg
@sol组,blank@gel组(ptx:10mg/kg,cpg:300μg/kg),将每组分笼饲养,生存时间以大鼠给药后时间作为观察起点,每周定时更换垫料饮水1-2次,光暗照明12h交替,每天观察大鼠给药后的状态,记录大鼠表现和生存时间。如图8所示, pnp
ptx
&mnp
cpg
@gel组发挥协同治疗的作用,生存期明显比单用药物组延长。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1