PD-1信号抑制剂的并用疗法
pd-1信号抑制剂的并用疗法
1.本技术是申请日为2016年12月5日的中国专利申请201680081286.8“pd-1信号抑制剂的并用疗法”的分案申请。
技术领域
2.本发明涉及pd-1(programmedcelldeath-1,程序性细胞死亡-1)信号抑制剂的并用疗法。
背景技术:
3.近年来的临床试验的结果表明,抗pd-1抗体治疗是在各种癌症中较以往的标准治疗更有效[非专利文献1~3]。在晚期肺癌患者的pd-1抗体治疗的奏效率与以往的抗癌剂相比显著地提高而达到20~30%。然而,事实上仍有约半数左右的患者显示出无应答性。目前几乎尚未知晓为何这些患者对pd-1抗体治疗无应答。
[0004]
现有技术文献
[0005]
非专利文献
[0006]
非专利文献1:bramerj,reckampk,etal:nivolumabversusdocetaxelinadvancednonsquamousnon-small-celllungcancer.nengljmed,373:1627-1639,2015.
[0007]
非专利文献2:hamanishij,mandaim,ikedat,etal:safetyandantitumoractivityofanti-pd-1antibody,nivoluimab,inpatientswithplatinum-resistantovariancancer.jclinoncol,33:4015-4022,2015.
[0008]
非专利文献3:motzerrj,escudierb,mcdermottdf,etal:nivolumab,373:1803-1813,2015.。
技术实现要素:
[0009]
发明所要解决的课题
[0010]
本发明的目的在于提供抗pd-1抗体治疗的新颖的治疗战略。
[0011]
用于解决课题的手段
[0012]
抗pd-1抗体治疗不同于以往的具有直接的癌细胞杀伤作用的抗癌剂,是通过使抗肿瘤免疫活化而抑制癌增殖。若存在如支持抗肿瘤免疫的试剂,则通过并用可提高抗肿瘤效果,而期待也可适用于无应答患者。
[0013]
本发明人发现,若将pd-1信号抑制抗体与ros(reactiveoxygenspecies)发生剂或线粒体膜电位控制剂(解偶联剂)并用,则抗肿瘤效果协同性地提高。若单独使用ros发生剂、或线粒体膜电位控制剂,则在活体内未发挥出抗肿瘤效果。根据以上的结果认为,ros发生剂、或线粒体膜电位控制剂具有通过与pd-1信号抑制抗体并用,支持抗肿瘤免疫,而协同性地抑制癌增殖的效果。
[0014]
本发明的要旨如下所述。
[0015]
(1)药物组合物,其包含选自下述(i)~(iii)的至少1种物质,且在 给予pd-1信号抑制剂之前、之后或同时的任一时期进行给予:
[0016]
(i)ros发生剂和控制其下游信号的物质、
[0017]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0018]
(iii)氨基酸。
[0019]
(2)(1)所述的药物组合物,其中,pd-1信号抑制剂为抗体。
[0020]
(3)(1)或(2)所述的药物组合物,其中,抗体为选自下述的至少1 种抗体:抗pd-1抗体、抗pd-l1抗体和抗pd-l2抗体。
[0021]
(4)(1)~(3)中任一项所述的药物组合物,其中,ros发生剂为选 自下述的至少1种化合物:氢过氧化叔丁基、羰基氰对三氟甲氧基苯 腙、2,4-二硝基苯酚、2,3-二甲氧基-1,4-萘醌和它们的类似物。
[0022]
(5)(1)~(3)中任一项所述的药物组合物,其中,显示解偶联作用 的物质为选自下述的至少1种化合物:羰基氰对三氟甲氧基苯腙、2,4
‑ꢀ
二硝基苯酚、羰基氰间氯苯腙、水杨酸、4,4
′‑
[戊烷-1,5-二基双(氧基)] 二苯甲脒)、2-(2-(2,6-二氯苯基氨基)苯基)乙酸、4-羟基-2-甲基-n-(2
‑ꢀ
吡啶基)-2h-1,2-苯并噻嗪-3-甲酰胺-1,1-二氧化物、2-{1-[(4-氯苯基) 羰基]-5-甲氧基-2-甲基-1h-吲哚-3-基}乙酸、n-(4-硝基-2-苯氧基苯基) 甲磺酰胺、4-羟基-2-甲基-n-(5-甲基-2-噻唑基)-2h-1,2-苯并噻嗪-3-甲 酰胺-1,1-二氧化物、氯硝柳胺乙醇胺盐、4-甲氧基-8-(3-甲基丁-2-烯 氧基)喹啉-2-羧酸3-甲基丁-2-烯酯和它们的类似物。
[0023]
(6)(1)~(3)中任一项所述的药物组合物,其中,控制ros发生剂 或显示解偶联作用的物质的下游信号的物质为控制 mtor(mammalian target of rapamycin)、ampk(adenosinemonophosphate activated protein kinase)、sirt(sirtuin)1、 pgc-1α(peroxisome proliferator-activated receptor gammacoactivator-1α)/转录因子复合物(包含pgc-1α的转录因子复合物)和 foxo1中的任一种或其以上的物质。
[0024]
(7)(6)中所述的药物组合物,其中,控制mtor的物质为选自下 述的至少1种化合物:4,6-二-4-吗啉基-n-(4-硝基苯基)-1,3,5-三嗪-2
‑ꢀ
胺、磷脂酸和它们的类似物。
[0025]
(8)(6)中所述的药物组合物,其中,控制ampk的物质为选自下 述的至少1种化合物:6,7-二氢-4-羟基-3-(2
′‑
羟基[1,1
′‑
联苯]-4-基)-6
‑ꢀ
氧代-噻吩并[2,3-b]吡啶-5-甲腈、5-氨基咪唑-4-甲酰胺1-β,-d-呋喃核 糖苷、n,n-二甲双胍、6-[4-[2-(1-哌啶基)乙氧基]苯基]-3-(4-吡啶基) 吡唑并[1,5-a]嘧啶和它们的类似物。
[0026]
(9)(6)中所述的药物组合物,其中,控制sirt1的物质为选自下 述的至少1种化合物:反式-3,5,4
′‑
三羟基芪、n-(2-(3-(哌嗪-1-基甲基) 咪唑并[2,1-b]噻唑-6-基)苯基)喹喔啉-2-甲酰胺、n-苄基-3,5-二乙氧羰 基-4-苯基-1,4-二氢吡啶、2-氨基-n-环戊基-1-(3-甲氧基丙基)-1h-吡咯 并[2,3-b]喹喔啉-3-甲酰胺、烟酰胺单核苷酸和它们的类似物。
[0027]
(10)(6)中所述的药物组合物,其中,控制pgc-1α/转录因子复合 物(包含pgc-1α的转录因子复合物)的物质为选自下述的至少1种化 合物:2-(4-{2-[(4-氯苯甲酰基)氨基]乙基}苯氧基)-2-甲基丙酸、9-顺 式,12-顺式-十八碳二烯酸)、2-[4-(4-氯苯甲酰基)苯氧基]-2-甲基丙酸
ꢀ‑
d6 1-甲基乙酯、(十一烷硫基)-乙酸、4-甲基-5-(2-吡嗪基)-3-二硫杂环 戊烯硫酮、n,n-二甲基甲酰胺、3-[4-(2,4-双(三氟甲基)苄氧基)-3-甲氧 基苯
基]-2-氰基-n-(5-三氟甲基-1,3,4-噻二唑-2-基)丙烯酰胺和它们的 类似物。
[0028]
(11)(6)中所述的药物组合物,其中,控制foxo1的物质为选自下 述的至少1种化合物:5-氨基-7-(环己基氨基)-1-乙基-6-氟-4-氧代-1,4
‑ꢀ
二氢喹啉-3-羧酸、2-环戊基-n-{2,4-二氯-3-[(异喹啉-5-基氧基)甲基] 苯基}-n-甲基乙酰胺及其类似物。
[0029]
(12)(1)~(3)中任一项所述的药物组合物,其中,氨基酸为选自下 述的至少1种化合物:色氨酸、苯丙氨酸、亮氨酸、异亮氨酸、酪氨 酸、组氨酸、赖氨酸、甲硫氨酸、苏氨酸、缬氨酸、丙氨酸、精氨酸、 天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、脯氨 酸、丝氨酸、鸟氨酸、瓜氨酸和它们的类似物。
[0030]
(13)(1)~(12)中任一项所述的药物组合物,其被用作抗癌剂、感 染症治疗剂或它们的组合。
[0031]
(14)(1)~(13)中任一项所述的药物组合物,其分别给予pd-1信号 抑制剂与选自下述(i)~(iii)的至少1种物质:
[0032]
(i)ros发生剂和控制其下游信号的物质、
[0033]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0034]
(iii)氨基酸。
[0035]
(15)(1)~(13)中任一项所述的药物组合物,其为包含pd-1信号抑 制剂与选自下述(i)~(iii)的至少1种物质的调配剂:
[0036]
(i)ros发生剂和控制其下游信号的物质、
[0037]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0038]
(iii)氨基酸。
[0039]
(16)pd-1信号抑制活性增强剂,其包含选自下述(i)~(iii)的至少1 种物质:
[0040]
(i)ros发生剂和控制其下游信号的物质、
[0041]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0042]
(iii)氨基酸。
[0043]
(17)癌症、感染症或它们的组合的治疗方法,其包括下述的步 骤:在给予pd-1信号抑制剂之前、之后或同时的任一时期,以药物 上有效的量对受验者或受验动物给予选自下述(i)~(iii)的至少1种物 质:
[0044]
(i)ros发生剂和控制其下游信号的物质、
[0045]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0046]
(iii)氨基酸。
[0047]
(18)选自下述(i)~(iii)的至少1种物质的应用,其是用于治疗癌 症、感染症或它们的组合,且在给予pd-1信号抑制剂之前、之后或 同时的任一时期,给予选自下述(i)~(iii)的至少1种物质:
[0048]
(i)ros发生剂和控制其下游信号的物质、
[0049]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0050]
(iii)氨基酸。
[0051]
(19)选自下述(i)~(iii)的至少1种物质的应用,其是用于在治疗癌 症、感染症或它们的组合的方法中应用,且给予选自下述(i)~(iii)的至 少1种物质:
[0052]
(i)ros发生剂和控制其下游信号的物质、
[0053]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0054]
(iii)氨基酸。
[0055]
发明效果
[0056]
通过将ros发生剂或控制其下游信号的物质和/或显示解偶联作 用的物质或控制其下游信号的物质与pd-1信号抑制剂并用,协同性 地提高抗肿瘤效果。
[0057]
本说明书包含作为本技术的优先权基础的日本专利申请、特愿 2015-238511和特愿2016-119695的说明书和/或附图中所记载的内 容。
[0058]
附图简述
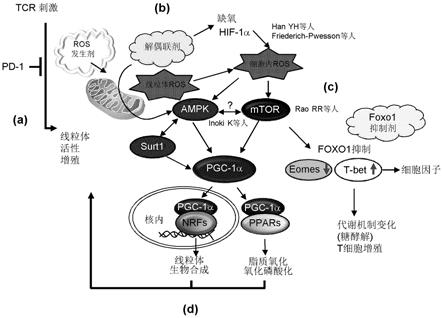
[0059]
[图1]由pd-1抑制与化学试剂所引起的线粒体活化的假设图。 a)pd-1抑制将肿瘤反应性t细胞的线粒体活化。b)ros诱导剂或解 偶联剂使细胞的ros增加。c)细胞的ros将ampk与mtor活化, 其结果,除了t-bet的表达以外,pgc-1a也被活化。d)与pgc-1a 结合的nrf(neutrophil releasing factor)或ppars(peroxisomeproliferator activated receptors)的活化引起线粒体中的正反馈活化。
[0060]
[图2]由pd-1抑制所引起的tr(tumor-reactive)ctl(cytotoxict lymphocyte)的活体内检测与其线粒体的活性。α~d)是实验步骤的 概要图。将利用cell trace标记的cd45.1
+
cd8
+
t细胞移植至cd45.2
+ cd8-/-小鼠。对小鼠接种mc38,并利用pd-l1抗体进行治疗。对所 属淋巴结的cd8
+
cd45.1
+
t细胞设门并进行分析(a)。显示该门内的 细胞的cd62l与cell trace的强度(b)(左)。对高分裂细胞的频率进行 组间比较。数据是显示4~5只小鼠的平均值
±
标准误差。*p<0.05,单 向方差分析(one-way analysis of variance)(右)(b)。在(a)中所示的门内 的细胞中,对cell trace和担载有mlama4肽或无关系肽的 mhc(major histocompatibility complex)四聚物的阳性率以进行了 pd-l1抗体治疗的组进行分析(c)。利用与线粒体的活性相关的试剂将 进行了pd-l1抗体治疗的所属淋巴结细胞进行染色。显示(a)的门中 的代表性facs(fluorescence-activated cell sorting)数据(上图)(d)。对 各线粒体染色试剂的荧光强度的中央值分析为高分裂(高)与低分裂 (低)并加以比较。数据是显示5只小鼠的平均值
±
标准误差。*p<0.05, ****p<0.0001,单向方差分析(下图)(d)。数据是显示三个独立的实 验中的代表性者(α~d)。e、f)向mc38带癌野生型小鼠每4天给予3 次pd-l1抗体。利用xfe96分析器对自治疗或未治疗小鼠分离的所 属淋巴结的cd8
+
t细胞的氧消耗量(ocr)进行计测。在第二次治疗 的2天后混合3只小鼠的细胞并进行分析(e)。对定义为(寡霉素 (oligomycin)给予后的最终计测值)-(寡霉素给予后的最低计测值)的atp(adenosine triphosphate)转化率进行计测(f)。数据是显示3孔的 平均值
±
标准误差。****p<0.0001,2标本的学生t检验分布。数据 是显示两个独立的实验中的代表性数据。
[0061]
[图3]pd-l1抗体治疗与活性氧发生剂luperox的协同效果。a) 对小鼠接种mc38 3週,每7天给予氢过氧化叔丁基溶液(luperox)。 显示肿瘤的体积。数据是显示5只小鼠的平均值
±
标准误差。b)是并 用治疗的步骤的概要图。c)对小鼠接种mc38 7天后给予pd-l1抗 体与luperox。显示肿瘤的体积与存活曲线。数据是显示5只小鼠的 平均值
±
标准误差。*p<0.05,**p<0.01,2标本的t检验分布(抗pd-l1 相对于抗pd-l1+luperox)。数据是显示两个独立的实验中的代表性 者。
[0062]
[图4]解偶联剂的协同效果与ros相关。a)如图3b所示,在相 同的步骤中向mc38带
癌小鼠给予fccp或dnp与pd-l1抗体。显 示肿瘤的体积与存活曲线。数据是显示5~6只小鼠的平均值
±
标准误 差。*p<0.05,**p<0.01,2标本的t检验分布(抗pd-l1相对于抗 pd-l1+fccp或dnp)。b)在与(a)相同的步骤中向mc38带癌小鼠仅 给予fccp或dnp。显示肿瘤的体积。数据是显示5只小鼠的平均 值
±
标准误差。c)向mc38带癌小鼠给予ros清除剂(mntbap)、 pd-l1抗体及fccp(左)或dnp(右)。数据是显示4~5只小鼠的平均 值
±
标准误差。*p<0.05,**p<0.01,2标本的t检验分布(并用治疗 相对于并用治疗+mntbap)。dnp并用治疗中的对照igg组的小鼠(右) 是与图4b共用。数据是显示两个独立的实验中的代表性者。
[0063]
[图5]通过同时并用dnp与luperox而增进抗肿瘤效果。在与 图3b同样的步骤中,向mc38带癌小鼠给予dnp或luperox、或其 两者与抗pd-l1抗体。显示肿瘤的体积。数据是显示5~6只小鼠的 平均值
±
标准误差。数据是显示两个独立的实验中的代表性数据。
[0064]
[图6]由fccp给予所引起的效应cd8
+
t细胞的增加。a)如图3b所示,在相同的步骤中向mc38带癌小鼠给予pd-l1抗体与fccp。 在第14天利用抗cd8、cd62l、cd44抗体将所属淋巴结的细胞进 行染色,对cd8
+
t细胞设门。基于cd62l与cd44的强度,对p1~p3 的细胞组进行定义(上图)。计算各组中的p1~p3的细胞的绝对数。数 据是显示5只小鼠的平均值
±
标准误差。*p<0.05,单向方差分析(下 图)。b)利用各线粒体染料将给予了pd-l1抗体与fccp的小鼠的所 属淋巴结cd8
+
t细胞进行染色。p1~p3的代表性facs分布图(上段 图)。各组中的利用各线粒体染料进行染色的p3细胞组的代表性 facs分布图(中段图)。将利用各染料进行染色的p1~p3的mfi(meanfluorescence intensity)在给予组间进行比较。颜色是与p1~p3细胞组 对应。数据是显示5只小鼠的平均值
±
标准误差(下段图)。*p<0.05, **p<0.01,单向方差分析。c)在肿瘤给予后第11天将经酶处理的癌 组织的细胞利用抗cd8、cd45、cd62l、cd44抗体进行染色。对 cd45
+
cd8
+
t细胞设门,并对该cd62l与cd44的表型进行分析(左 图)。对cd45
+
t细胞中的cd8
+
t细胞的频率与cd45
+
cd8
+
t细胞 的绝对数进行组间比较(右图)。数据是显示5只小鼠的平均值
±
标准 误差。*p<0.05,**p<0.01,单向方差分析。facs数据是显示各组 的5只小鼠数据中的代表性者。数据是显示两个独立的实验中的代表 性者。
[0065]
[图7]由解偶联剂与pd-l1抗体的并用所引起的协同效果是与 mtor和ampk的途径相关。a)在dnp或fccp的并用治疗时,混 合5只小鼠的所属淋巴结细胞,将cd8
+
t细胞分离。通过蛋白质印 迹法对ampk与acc(acetyl-coa carboxylase)、mtor、s6k的磷 酸化和sirt1与4ebp1(4e-binding protein 1)的表达进行分析。b)在 与图3b同样的步骤中,向mc38带癌小鼠将ampk活性剂(a76966) 与mtor活性剂(mhy1485)、或其两者与pd-l1小鼠抗体一并给予。 显示肿瘤的体积与存活曲线。数据是显示5只小鼠的平均值
±
标准误 差。*p<0.05,**p<0.01,2标本的t检验分布(抗pd-l1抗体相对于 并用治疗)。星号的各颜色是与相同的颜色所示的组一致。c)向mc38 带癌小鼠给予sirt1活性剂(白藜芦醇)与pd-l1抗体。显示肿瘤的体 积与存活曲线。数据是显示5只小鼠的平均值
±
标准误差。*p<0.05, **p<0.01,2标本的t检验分布(抗pd-l1抗体相对于并用治疗)。
[0066]
[图8]mtor与ampk的不同活化状态是与cd8
+
t细胞的分化 阶段相对应。向mc38带癌小鼠给予dnp与抗pd-l1抗体。在第1 次治疗的次日,将所属淋巴结的细胞利用针对cd8、cd62l、cd44、 p-mtor和p-ampk的抗体进行染色。如图6a所示,对p1~p3设门, 并对p-ampk
与p-mtor的荧光强度进行比较。数据是显示两个独 立的实验中的代表性者。
[0067]
[图9]pd-l1抗体治疗与ampk抑制剂的协同效果。在与图3b同样的步骤中,向mc38带癌小鼠给予化合物c与抗pd-l1抗体。 显示肿瘤的体积。
[0068]
[图10]pd-l1抗体治疗与ampk抑制剂的协同效果。在与图3b同样的步骤中,向renca(renal cancer)带癌小鼠给予化合物c与抗 pd-l1抗体。显示肿瘤的体积。
[0069]
[图11]pd-l1抗体治疗与pgc-1α/转录因子复合物活性剂的协同 效果。在与图3b同样的步骤中,向mc38带癌小鼠给予nrf2活化 剂(oltipraz,奥替普拉)或ppars活化剂(bezafibrate,苯扎贝特)与抗 pd-l1抗体。显示肿瘤的体积。数据是显示5只小鼠的平均值
±
标准 误差。*p<0.05,双尾学生t检验(pd-l1抗体相对于各并用疗法)。 图11a:使用fccp、mtor激活剂或ampk激活剂与pd-l1抗体的 联合治疗增加了pgc-1α蛋白和mrna的表达水平。图11b:奥替 普拉和苯扎贝特均增强了pd-l1抗体的肿瘤生长抑制作用,并提高 了带癌小鼠的存活率。
[0070]
[图12]luperox和fccp几乎不影响活体内的肿瘤细胞。a)肿瘤 组织是在自第2次的fccp或luperox单独给予起1天后进行回收。 在酶消化后,肿瘤细胞是通过可去除肿瘤细胞以外之细胞的细胞分离 试剂盒而加以筛选。所分离的肿瘤细胞进一步通过aria进行纯化, 并用于以下的实验。b)肿瘤细胞是利用将pd-l1、i型mhc、 cd155(tigit的配体)和vista作为靶的抗体、或将线粒体质量、膜 电位或超氧化物染色的色素进行染色。c)线粒体能量代谢或凋亡相 关基因的表达水平是使用rt
2 profiler pcr试剂盒进行研究。所表示 的基因名是在82个基因中与未处理的肿瘤细胞相比显著地增加2倍 以上者。
[0071]
[图13]线粒体活化相关试剂的抗肿瘤协同效果。a)并用治疗时 间表的模式图。b)对小鼠进行pd-l1抗体与巴拉刈(paraquat)的并用 治疗。数据是显示5~6只鼠之值的平均值
±
标准误差。数据是2次独 立的实验的代表。
[0072]
[图14]线粒体活化相关试剂在不同的肿瘤或小鼠的系统中也发 挥功能。向移植了纤维肉瘤metha的balb/c小鼠,依据图3的时 间表给予pd-l1抗体与fccp、luperox、parawuat或奥替普拉。显 示肿瘤的尺寸。数据是显示5只鼠之值的平均值
±
标准误差。*p<0.05, 双尾学生t检验(pd-l1抗体相对于各自的并用治疗)。
[0073]
[图15]t-bet与ifn-γ产生是在fccp或苯扎贝特与pd-l1抗体 的并用治疗组中增加。a)利用流式细胞仪,对源自利用pd-l1抗体 与fccp进行并用治疗的小鼠的所属淋巴结的cd8阳性细胞中的 t-bet与eomes表达进行分析。显示代表性facs数据(上图)。算出源 自利用pd-l1抗体与fccp或苯扎贝特进行并用治疗的小鼠的所属 淋巴结中的t-bet与eomes阳性t细胞的频率与数量(下图)。b)将进 行了酶消化的肿瘤组织在37℃下培养6小时,并进行源自利用pd-l1 抗体与fccp或苯扎贝特进行并用治疗的小鼠的cd8阳性细胞中的 ifn-γ的细胞内染色。显示代表性facs数据(左图)与cd8阳性细胞 内的ifn-γ的频率(右图)。数据是显示5只鼠之值的平均值
±
标准误差。 *p<0.05,**p<0.01是利用单向方差分析所获得者。
[0074]
[图16]pd-l1抗体治疗与foxo1抑制剂:as1842856的协同效 果。对balb/c小鼠接种5
×
105的metha,在7天后给予抗pd-l1抗 体(80μg)与foxo1抑制剂(2mg/kg)。给予时间表依据图3。显示肿瘤 的体积。
[0075]
[图17]血中代谢物(氨基酸)的变化。通过gc-ms分析,对5只 pd-1-/-小鼠与野生型
小鼠的血清中所含的氨基酸的量进行鉴定。图显 示将野生型的值设为1时的pd-1-/-小鼠的值。n=5,*p<0.05,** p<0.01,***p<0.001,****p<0.0001,t-检验(t-test).
[0076]
[图18]aminoleban的组成。
[0077]
[图19]pd-l1抗体治疗与aminoleban的协同效果。在对balb/c 小鼠接种5
×
105的纤维肉瘤metha 7天后,给予抗pd-l1抗体(60μg) 与aminoleban(400μl/mouse)。给予时间表依据图3。
具体实施方式
[0078]
以下,对本发明详细地进行说明。
[0079]
本发明提供药物组合物,其包含选自下述(i)~(iii)的至少1种物 质,且在给予pd-1信号抑制剂之前、之后或同时的任一时期进行给 予:
[0080]
(i)ros发生剂和控制其下游信号的物质、
[0081]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0082]
(iii)氨基酸。
[0083]
作为ros发生剂,可例示:氢过氧化叔丁基(luperox)、羰基氰 对三氟甲氧基苯腙(fccp)、2,4-二硝基苯酚(dnp)、2,3-二甲氧基-1,4
‑ꢀ
萘醌(dmnq)、2-甲基萘-1,4-二酮(甲萘醌)、1,1
′‑
二甲基-4,4
′‑
联吡啶鎓 二氯化物(巴拉刈)和它们的类似物。
[0084]
在ros发生剂的下游存在mtor、atm(ataxia telangiectasiamutated protein,血管扩张性失调症变异蛋白质)、ampk(amp-activated protein kinase)等信号转导(图1),本发明的药物 组合物可含有控制这些中的任一种的物质。控制是包括激活与失活 (不活化)的概念。
[0085]
ros下游信号的mtor将细胞的糖酵解进行活化,引起细胞分 裂所需的蛋白质、脂质、核酸的扩增(同化作用的促进)。由此,认为 进一步强化通过pd-1信号抑制而增强的t细胞受体信号。若利用解 偶联物质的下游信号使ampk活化,则引起线粒体的生物合成,能 量的产生所需的氧化磷酸化在线粒体内进行活化。由此,认为进一步 强化通过pd-1信号抑制而增强的t细胞受体信号。
[0086]
作为控制mtor的物质,可例示:4,6-二吗啉代-n-(4-硝基苯 基)-1,3,5-三嗪-2-胺、4,6-二-4-吗啉基-n-(4-硝基苯基)-1,3,5-三嗪-2-胺 (mhy1485)、磷脂酸(pa)和它们的类似物,这些物质将mtor激活。
[0087]
ampk也称为能量传感器,因能量消耗而atp量减少,若amp 量增加则进行活化。ampk的作用是抑制能量的消耗,向积蓄能量的 方向控制代谢。因此,若ampk进行活化,则会抑制生物合成(同化 作用的抑制),自线粒体的atp产生变得活跃(异化作用的促进)
1、2、3
。 在ampk信号的下游存在pgc-1a与转录因子的复合物,由此,活化 线粒体的生物合成或氧化磷酸化代谢4。若将ampk活化,则可见糖 尿病的改善,因此一部分的ampk活化剂被用作糖尿病治疗药。作 为控制ampk的物质,可例示:6,7-二氢-4-羟基-3-(2
′‑
羟基[1,1
′‑
联 苯]-4-基)-6-氧代-噻吩并[2,3-b]吡啶-5-甲腈(a769662)、5-氨基咪唑-4
‑ꢀ
甲酰胺1-β,-d-呋喃核糖苷(aicar)、n,n-二甲双胍(metformin)和它们 的类似物,这些物质将ampk激活。作为将ampk失活的物质(ampk 的抑制剂),可例示:6-[4-[2-(1-哌啶基)乙氧基]苯基]-3-(4-吡啶基)吡 唑并[1,5-a]嘧啶(化合物c)和它们的类似物。
metab.3:160-6,2009.puigserver p et al.nature.423:550-5, 2003.
[0095]
作为控制foxo1的物质,可例示:5-氨基-7-(环己基氨基)-1-乙基
ꢀ‑
6-氟-4-氧代-1,4-二氢喹啉-3-羧酸、2-环戊基-n-{2,4-二氯-3-[(异喹啉
ꢀ‑
5-基氧基)甲基]苯基}-n-甲基乙酰胺和它们的类似物。
[0096]
作为氨基酸,可例示:色氨酸、苯丙氨酸、亮氨酸、异亮氨酸、 酪氨酸、组氨酸、赖氨酸、甲硫氨酸、苏氨酸、缬氨酸、丙氨酸、精 氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、 脯氨酸、丝氨酸、鸟氨酸、瓜氨酸和它们的类似物。氨基酸可为1种 也可为2种以上的组合。氨基酸可为l-氨基酸、d-氨基酸或dl-氨 基酸的任一者。若抑制pd-1,则氨基酸等代谢物的同化作用(细胞增 殖)变得剧烈而被消耗。若向其中导入成为细胞等之骨架的氨基酸, 则认为细胞增殖进一步发展。若补充氯基酸而细胞增殖变快,则 mtor向活化的方向进行。例如有作为氨基酸制剂的aminoleban将mtor活化的报道(tamanna n,mahmood n.int sch res notices. 2014:235619,2014)。在后述实施例中,由于aminoleban可见与pd-l1 抗体治疗的协同效果,所以认为优选aminoleban中所含的氨基酸中 的1种或2种以上的组合。
[0097]
上述(i)~(iii)的物质也可为盐的形态。盐只要是药物上可接受的盐 即可,作为此种盐,可列举:钠盐、钾盐、锂盐之类的碱金属盐、钙 盐、镁盐之类的碱土金属盐、铝盐、铁盐、锌盐、铜盐、镍盐、钴盐 等金属盐;铵盐之类的无机盐、叔辛基胺盐、二苄基胺盐、吗啉盐、 葡糖胺盐、苯基甘氨酸烷基酯盐、乙二胺盐、n-甲基葡糖胺盐、胍盐、 二乙基胺盐、三乙基胺盐、二环己基胺盐、n,n
′‑
二苄基乙二胺盐、 氯普鲁卡因盐、普鲁卡因盐、二乙醇胺盐、n-苄基-苯乙基胺盐、哌 嗪盐、四甲基铵盐、三(羟基甲基)氨基甲烷盐之类的有机盐等胺盐; 氢氟酸盐、盐酸盐、氢溴酸盐、氢碘酸盐之类的氢卤酸盐、硝酸盐、 过氯酸盐、硫酸盐、磷酸盐等无机酸盐;甲磺酸盐、三氟甲磺酸盐、 乙磺酸盐之类的低级烷烃磺酸盐、苯磺酸盐、对甲苯磺酸盐之类的芳 基磺酸盐、乙酸盐、苹果酸盐、富马酸盐、琥珀酸盐、柠檬酸盐、酒 石酸盐、草酸盐、马来酸盐等有机酸盐;甘氨酸盐、赖氨酸盐、精氨 酸盐、鸟氨酸盐、谷氨酸盐、天冬氨酸盐之类的氨基酸盐等。这些盐 可通过公知的方法进行制造。
[0098]
另外,上述(i)~(iii)的物质及其盐也可与水、甲醇、乙醇、乙腈等 溶剂而生成溶剂合物。另外,溶剂合物可为单独者也可为多种的混合 物。
[0099]
在本说明书中,“类似物”是指无需较大的结构变化,显示略微追 加变更侧链等所得的同等效果的物质,是包含药品中的先导化合物的 衍生物、针对活性代谢物的前体药物、针对前体药物的活性代谢物等 的概念。作为前体药物,可例示:活性化合物的氨基经酰化、烷基化、 磷酸化的化合物(例如,活性化合物的氨基经二十烷酰化、丙氨酰化、 戊基氨基羰基化、(5-甲基-2-氧代-1,3-二氧杂环戊烷-4-基)甲氧基羰基 化、四氢呋喃化、吡咯烷基甲基化、特戊酰氧基甲基化、叔丁基化的 化合物等)、活性化合物的羟基经酰化、烷基化、磷酸化、硼酸化的 化合物(例如,活性化合物的羟基经乙酰化、棕榈酰化、丙酰化、特 戊酰化、琥珀酰化、富马酰化、丙氨酰化、二甲基氨基甲基羰基化的 化合物等)、活性化合物的羧基经酯化、酰胺化的化合物(例如,活性 化合物的羧基经乙酯化、苯酯化、羧基甲酯化、二甲基氨基甲酯化、 特戊酰氧基甲酯化、乙氧基羰氧基乙酯化、酞酯化、(5-甲基-2-氧代
ꢀ‑
1,3-二氧杂环戊烷-4-基)甲酯化、环己氧基羰基乙酯化、甲基酰胺化 的化合物等)等。
[0100]
在本说明书中,“pd-1信号”是指pd-1所承担的信息转导机制, 作为其一,可例示
pd-1与作为其配体的pd-l1、pd-l2共同抑制t 细胞的活化的信息转导机制。pd-1(programmed cell death-1)是在活化 的t细胞或b细胞中表达的膜蛋白质,作为其配体的pd-l1与pd-l2 是在单核细胞或树突细胞等抗原呈递细胞、癌等各种细胞中表达。 pd-1、pd-l1和pd-l2是作为抑制t细胞的活化的抑制因子而发挥 作用。某种癌细胞或病毒感染细胞通过表达pd-1的配体,而抑制t 细胞的活化,逃避宿主的免疫监视。
[0101]
作为pd-1信号抑制剂,可列举与pd-1、pd-l1或pd-l2特异 性地结合的物质,作为此种物质,可为蛋白质、多肽、寡肽、核酸(包 含天然型核酸、人工核酸)、低分子有机化合物、无机化合物、细胞 提取物、源自动植物或土壤等的提取物等。物质可为天然物也可为合 成物。优选的pd-1信号抑制剂为抗体,更优选为抗pd-1抗体、抗 pd-l1抗体、抗pd-l2抗体等的抗体。抗体只要是可抑制pd-1信号 者即可,可为多克隆抗体、单克隆抗体、嵌合抗体、单链抗体、人源 化抗体、人型抗体的任一种。这些抗体的制造方法为公知方法。抗体 可为源自人、小鼠、大鼠、兔、山羊、豚鼠等任一种生物的抗体。另 外,在本说明书中,抗体是指也包含fab、f(ab)
′2、scfv、双抗体、 vh、v
l
、sc(fv)2、双特异性sc(fv)2、微型抗体、scfv-fc单体、scfv-fc 二聚物等的低分子化所得物的概念。
[0102]
本发明的药物组合物可用作抗癌剂、感染症治疗剂或它们的组 合。
[0103]
在将本发明的药物组合物作为抗癌剂给予的情形下,作为成为对 象的癌或肿瘤,可例示:白血病、淋巴瘤(霍奇金病、非霍奇金淋巴 瘤等)、多发性骨髓瘤、脑肿瘤、乳癌、子宫体癌、子宫颈癌、卵巢 癌、食道癌、胃癌、阑尾癌、大肠癌、肝癌、胆囊癌、胆管癌、胰腺 癌、肾上腺癌、消化道间质肿瘤、间皮瘤、头颈部癌(咽喉癌等)、口 腔癌(口底癌等)、牙龈癌、舌癌、颊粘膜癌、唾液腺癌、鼻窦癌(上颌 窦癌、前额窦癌、筛窦癌、蝶窦癌等)、甲状腺癌、肾癌、肺癌、骨 肉瘤、前列腺癌、睾丸肿瘤(睾丸癌)、肾细胞癌、膀胱癌、横纹肌肉 瘤、皮肤癌(基底细胞癌、鳞状细胞癌(squamous cell carcinoma)、恶 性黑色素瘤(melanoma,黑色素瘤)、日光性角化症、鲍文氏病(bowen
′
sdisease)、佩吉特氏病(paget
′
s disease)等)、肛门癌等,但并不限定于这 些。
[0104]
在将本发明的药物组合物作为感染症治疗剂给予的情形下,作为 成为对象的感染症,可例示:细菌感染症(由链球菌(a组β链球菌、 肺炎球菌等)、金黄色葡萄球菌(mssa(methicillin susceptiblestaphylococcus aureus)、mrsa(methicillin resistant staphylococcusaureus))、表皮葡萄球菌、肠球菌、李氏菌、脑脊髓膜炎球菌、淋菌、 病原性大肠杆菌(0157:h7等)、克雷伯氏菌(肺炎杆菌)、变形杆菌、 百日咳菌、绿脓杆菌、沙雷氏菌、柠檬酸杆菌属(citrobacter)、不动杆 菌属、肠杆菌属、支原体、梭菌属等所引起的各种感染症、结核、霍 乱、鼠疫、白喉、痢疾、猩红热、碳疽、梅毒、破伤风、麻风病、军 团菌肺炎(legionellosis,退伍军人病)、钩端螺旋体症、莱姆病、兔热 病、q热等)、立克次体感染症(流行性斑疹伤寒(epidemic typhus)、恙 虫病(scrub typhus)、日本红斑热等)、衣原体感染症(沙眼、生殖器衣 原体感染症、鹦鹉病等)、真菌感染症(曲霉病、念珠菌病、隐球菌病、 发癣菌病、组织浆菌病、肺炎肺囊虫等)、寄生性原虫感染症(阿米巴 痢疾、疟疾、弓形虫病、利什曼体病、隐孢子虫属等)、寄生性蠕虫 感染症(棘球蚴病、日本血吸虫病、丝虫病、蛔虫病、阔节裂头绦虫 病等)、病毒感染症(流行性感冒、病毒性肝炎、病毒性髓膜炎、获得 性免疫缺乏综合征(aids,acquired immune deficiency syndrome)、 成人t细胞性白血病、埃博拉出血热、黄热病、感冒综合征、狂犬病、 巨细胞病毒感染症、严重急性呼吸系统综合征
(sars,severe acute respiratory syndrome)、进行性多灶性白质脑病、水痘、带状疱疹、 手足口病、登革热、传染性红斑、传染性单核细胞症、天花、风疹、 急性脊髓灰质炎(polio)、麻疹、咽结膜热(pool热)、马尔堡出血热、 汉坦病毒肾出血热、拉沙热、流行性腮腺炎、西尼罗热、疱疹性咽峡 炎、奇昆古尼亚热等)等,但并不限定于这些。
[0105]
本发明的药物组合物包含选自下述(i)~(iii)的至少1种物质,且 在给予pd-1信号抑制剂之前、之后或同时的任一时期进行给予:
[0106]
(i)ros发生剂和控制其下游信号的物质、
[0107]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0108]
(iii)氨基酸。
[0109]
在本发明的药物组合物中,可将pd-1信号抑制剂与选自上述 (i)~(iii)的至少1种物质进行并用或合剂化。
[0110]
在将pd-1信号抑制剂与选自上述(i)~(iii)的至少1种物质并用的 情形下,可分别给予pd-1信号抑制剂与选自上述(i)~(iii)的至少1种 物质。
[0111]
在将pd-1信号抑制剂与选自上述(i)~(iii)的至少1种物质进行合 剂化的情形下,可制成包含pd-1信号抑制剂与选自上述(i)~(iii)的至 少1种物质的调配剂。
[0112]
本发明的药物组合物是全身或局部地通过口服或胃肠外对受验 者或受验动物进行给予。
[0113]
pd-1信号抑制剂(例如,抗pd-1抗体、抗pd-l1抗体、抗pd-l2 抗体)是溶解于pbs(phosphate buffer solution)等缓冲液、生理盐水、 灭菌水等中,可根据需要利用过滤器等进行过滤灭菌,然后通过注射 或点滴对受验者或受验动物进行给予。另外,也可向该溶液中添加添 加剂(例如,着色剂、乳化剂、悬浮剂、表面活性剂、溶解助剂、稳 定剂、保存剂、抗氧化剂、缓冲剂、等渗剂等)等。作为给予途径, 可进行静脉、肌肉、腹腔、皮下、皮内给予等。
[0114]
pd-1信号抑制剂(例如,抗pd-1抗体、抗pd-l1抗体、抗pd-l2 抗体)在制剂中的含量根据制剂的种类而有所不同,通常为1~100重 量%,优选为50~100重量%。制剂可制剂化为单位给予制剂。
[0115]
pd-1信号抑制剂(例如,抗pd-l抗体、抗pd-l1抗体、抗pd-l2 抗体)的给予量、给予次数和频率根据受验者或受验动物的症状、年 龄、体重、给予方法、给予形态等而有所不同,例如通常可向成人每 人以至少1次、可确认到所需效果的频率给予换算成有效成分的量为 0.1~100mg/kg体重、优选为1~10mg/kg体重。
[0116]
选自上述(i)~(iii)的至少1种物质可含有在包含pd-1信号抑制剂 的制剂中,也可单独或与赋形剂或载体混合,并制剂化为片剂、胶囊 剂、散剂、颗粒剂、液剂、糖浆、气溶胶、栓剂、注射剂等。赋形剂 或载体只要为本领域中常规地使用且药物上可接受者即可,其种类和 组成可适宜变更。例如,作为液状载体,可使用水、植物油等。作为 固体载体,使用乳糖、白糖、葡萄糖等糖类,马铃薯淀粉、玉米淀粉 等淀粉,结晶纤维素等纤维素衍生物等。也可添加硬脂酸镁等润滑剂、 明胶、羟丙基纤维素等粘合剂、羧甲基纤维素等崩解剂等。除此以外, 也可添加抗氧化剂、着色剂、矫味剂、保存剂等。
[0117]
选自上述(i)~(iii)的至少1种物质可通过口服、经鼻、直肠、经皮、 皮下、静脉内、肌内等各种途径进行给予。
[0118]
选自上述(i)~(iii)的至少1种物质在制剂中的含量根据制剂的种 类而有所不同,通常为1~100重量%,优选为50~100重量%。例如, 在液剂的情形下,选自上述(i)~(iii)的至少1种物质在制剂中的含量优 选为1~100重量%。在胶囊剂、片剂、颗粒剂、散剂的情形下,选自 上述(i)~(iii)的至少1种物质在制剂中的含量通常为约10~100重量%, 优选为50~100重量%,其余部分为载体。制剂可制剂化为单位给予 制剂。
[0119]
选自上述(i)~(iii)的至少1种物质的给予量、给予次数和频率根据 受验者或受验动物的症状、年龄、体重、给予方法、给予形态等而有 所不同,例如,通常可向成人每人以至少1次、可确认到所需效果的 频率给予换算成有效成分的量的0.005μg(或ml)~25000mg(或ml)/kg 体重左右。关于各药剂(物质)的给予量,将适当的范围、优选的范围 和更优选的范围示于下述的表中,但并不限定于这些值。
[0120]
(表)
[0121][0122]
pd-1信号抑制剂(例如,抗pd-1抗体、抗pd-l1抗体、抗pd-l2 抗体)与ros发生剂或控制其下游信号的物质之比率(质量)适当为1∶ 0.1~1∶100,优选为1∶1~1∶50。
[0123]
pd-1信号抑制剂(例如,抗pd-1抗体、抗pd-l1抗体、抗pd-l2 抗体)与显示解偶联作用的物质或控制其下游信号的物质之比率(质 量)适当为1∶0.01~1∶10,优选为1∶0.1~1∶1。
[0124]
pd-1信号抑制剂(例如,抗pd-1抗体、抗pd-l1抗体、抗pd-l2 抗体)与氨基酸之比率(质量)适当为1∶0.001~1∶100,优选为1∶0.01~1∶ 10。
[0125]
另外,本发明还提供一种癌症、感染症或它们的组合的治疗方法, 其包括下述的步骤:在给予pd-1信号抑制剂之前、之后或同时的任 一时期,以药物上有效的量对受验者或受验动物给予选自上述(i)~(iii) 的至少1种物质。进一步,本发明提供选自上述(i)~(iii)的至少1种物 质的应用,其是用于治疗癌症、感染症或它们的组合,且在给予pd-1 信号抑制剂之前、之后或同时的任一时期,给予选自上述(i)~(iii)的至 少1种物质。进一步,本发明也提供选自上述(i)~(iii)的至少1种物质 的应用,其是用于在治疗癌症、感染症或它们的组合的方法中应用, 且在给予pd-1信号抑制剂之前、之后或同时的任一时期,给予选自 上述(i)~(iii)的至少1种物质。
[0126]
另外,本发明提供增强pd-1信号抑制活性的药剂,其包含选自 上述(i)~(iii)的至少1种物质。
[0127]
本发明的药剂可用作与pd-1信号抑制剂的并用药或调配剂。关 于pd-1信号抑制剂与选自上述(i)~(iii)的至少1种物质的并用和合剂 化,已在上文中进行了说明。本发明的药剂除了作为药物的应用以外, 也可用作实验试剂。
[0128]
在研究某种物质是否为ros发生剂时,可在试管内对细胞(例如, 小鼠脾脏细胞)添加该物质,并对细胞内的ros的浓度进行测定。在 研究某种物质是否具有解偶联作用或控制其下游信号的作用时,可在 试管内对细胞(例如,小鼠脾脏细胞)添加该物质,在细胞内染色后利 用流式细胞仪(flow cytometer)测定细胞内的线粒体的质子梯度,或 使用seahorse直接进行测定。
[0129]
实施例
[0130]
以下,通过实施例更详细地说明本发明。
[0131]
[实施例1]
[0132]
[要旨]
[0133]
通过利用pd-1抑制的癌免疫治疗,癌症患者的存活率显著地提 高。但是,对于某些的患者无应答。认为pd-1抑制与其他并用剂的 并用疗法会改善免疫治疗效果。本发明人使用小鼠癌症治疗模型,发 现所属淋巴结中所出现的癌反应性细胞毒性t细胞(tumor-reactivecytotoxic t lymphocytes:tr ctls)具有较大的线粒体体积与较高的膜 电位,并且具有较高的活性氧(ros)产生。另外,证明通过ros发生 剂或利用解偶联剂的源自线粒体的ros,cd8
+
cd44
+
cd62l-t细胞 在所属淋巴结与肿瘤内增加,由pd-1抑制所引起的抗肿瘤效果增强。 进一步明确,包含白藜芦醇、直接使mtor、ampk、sirt等新陈 代谢传感器活化的试剂会增强pd-1抑制治疗效果,而长期抑制肿瘤。 重要的是这些并用治疗药单独使用时未显示出抗肿瘤效果。
[0134]
[序言]
[0135]
通过pd-1抑制的免疫疗法给癌症治疗带来了革命性冲击。作为 其特征,可列举对各种癌肿瘤具有较高的效果、长期持续抗肿瘤效果、 并且副作用较少
9、10、11
。作为活化t细胞的表面受体而表达的pd-1 在免疫应答中是作为抑制因子而发挥作用。pd-1与2个作为配体的 pd-l1或pd-l2结合,将itsm(immunoreceptor tyrosine-based switchimotif)中的酪氨酸残基磷酸化,而补充作为酪氨酸磷酸酶的shp-2。 利用shp-2,使通过t细胞受体的活化而磷酸化的zap70等活化信号 转导分子脱磷酸化,从而抑制t细胞的活化
12、13
。在动物实验中pd-1 缺损小鼠患上自身免疫疾病,由此确认到通过pd-1的免疫抑制功能 14、15、16
。如此得知,pd-1是作为免疫检测点而发挥作用,发生自身 免疫耐受。
[0136]
本发明人查明pd-1的基本作用,明确利用pd-1的特性可辅助 针对癌症或感染症的免疫应答
17、18
。实际上,在2010年发表针对恶 性黑色素瘤的临床试验的结果后
19
,迄今为止已进行了针对各种癌肿 瘤的通过pd-1抑制疗法的临床试验,其大部分显示出令人惊讶的效 果
20
。目前,对于pd-1抑制疗法,日本正下达应用于恶性黑色素瘤 或非小细胞肺癌、肾细胞癌的医疗保险的许可。pd-1抑制疗法不仅 与迄今为止的免疫疗法相比显著地提高癌症患者的存活率,而且与实 际上所使用的标准的化学疗法相比也显著地提高癌症患者的存活率。 然而,令人遗憾的是,30~50%左右的患者仍对pd-1抑制疗法无应答。 为了克服该无应答例,业界将pd-1抑制疗法与作为其他免疫检测点 因子的lag3或tim3、癌症疫苗、放射线治疗、低用量的化学疗法等 加以并用
21
。但是,迄今为止尚无通过并用疗法确认到显
著的协同效 果的报道。
[0137]
本发明人已在2002年在动物模型中确立了pd-1抑制疗法的癌症 治疗效果
17
,但尚未查明通过pd-1抑制疗法的杀肿瘤效果或免疫耐 受状态的解除是因何种机理而发生的。例如,在利用检测点抑制剂所 进行的免疫疗法中,主要是癌特异性突变抗原成为靶
22、23
,但尚不明 确效应t细胞被活化的部位是肿瘤部位还是所属淋巴结。另外,在通 过pd-1抗体治疗而根除肿瘤时,也不明确何种信号使效应t细胞向 肿瘤部位移行。另外,也几乎未知识别肿瘤反应性细胞毒杀性t细胞 与肿瘤非反应性t细胞的方法、或pd-1信号的阻断如何影响肿瘤反 应性细胞毒杀性t细胞的活化、分化状态。进一步,对于通过pd-1 抑制疗法进行治疗的癌症患者而言,通过pd-1信号的阻断而活化的 免疫监视机制为何持续数年仍为谜团
24、25
。
[0138]
为了确立使pd-1抑制疗法更有效的新颖的治疗战略,必须解答 出上述若干问题。因此,业界专注于效应功能所需的代谢重编程,并 对肿瘤反应性细胞毒杀性t细胞进行分析
1、2、3、26、27
。颇有意味的是, 在pd-1抑制疗法下自所属淋巴结提取的肿瘤特异性细胞毒杀性效应 t细胞显示出更大的线粒体的质量、更高的膜电位、和较高的线粒体 的活性氧种(ros)。这些结果显示通过阻断pd-1信号而增加线粒体 的活性,与迄今为止所报道的活体中的报道一致
28、29
。
[0139]
基于这些结果,本发明人建立了效应t细胞中的线粒体的功能刺 激使pd-1阻断疗法中的抗肿瘤效果的增强的假说。实际上将作为能 量代谢传感器的腺苷酸活化蛋白激酶(ampk,amp-activated proteinkinase)或sirt1、雷帕霉素机制性靶蛋白(mtor,mechanistic target ofrapamycin)活化的药剂显示出与pd-1阻断疗法的协同性抗肿瘤效果。 这些见解或许会开辟用于开发针对对于pd-1抑制疗法的效果较弱的 患者的并用疗法的道路。
[0140]
[结果]
[0141]
由pd-1阻断所引起的dln(draining lymph node)中的肿瘤反应性cd8阳性t细胞的线粒体活性的增大。
[0142]
随着t细胞的活化,必须迅速地供给急剧的细胞增殖所需的因 子。因此,本发明人决定在所属淋巴结中研究通过pd-1抑制诱导的 肿瘤反应性cd8阳性t细胞的代谢变化。作为pd-1抑制疗法的机制 查明中的1个问题,可列举如下方面:由于通过pd-1阻断发生具有 与各种肿瘤抗原反应的多样化的t细胞受体库的ctl,所以难以进 行肿瘤反应性细胞毒杀性t细胞(tr ctls)的全面鉴定
30、31
。为了解 决该问题,将利用cell trace标记的cd45.1阳性cd8阳性t细胞移 植至cd45.2阳性cd8 ko小鼠。推测其后肿瘤反应性cd8阳性t 细胞会选择性地活跃地增殖,并对所属淋巴结中的经标记的t细胞的 增殖进行研究(图2a)。在mc38带癌小鼠中,所移植的cd45.1阳性 cd8阳性t细胞分成活跃地分裂的细胞组(高分裂组)与分裂较少的细 胞组(低分裂组)(图2b)。带癌小鼠中的cd45.1阳性cd8阳性t细胞 的高分裂组的绝对数或比率与给予对照抗体igg的组相比,在利用 pd-l1抗体进行治疗的组中增加(图2b)。值得指出的是,pd-l1抗体 在非带癌小鼠中在上述增殖方面未见差异。由此表明,剧烈地发生分 裂的cd8阳性t细胞实际上因肿瘤抗原而活化可能性较高(图2b)。 进一步,在所属淋巴结中的cd45.1阳性cd8阳性t细胞中,在因 pd-l1抑制而造成的高分裂组的组分中,检测到作为mc38的变异抗 原决定基的mlama4肽/mhc四聚物阳性细胞组(图2c)
22
。因此,
认 为在活跃地增殖的细胞组中包含大量tr ctls。
[0143]
其次,本发明人对于所属淋巴结中较强地增殖的tr ctl的代谢 功能进行了研究。认为线粒体的代谢不仅对t细胞的活化较重要,而 且对持续的t细胞的增殖或记忆t细胞的形成也重要,因此本发明 人专注于trctls中的线粒体的功能
26、32
。cd8阳性t细胞中的高 分裂组与低分裂组相比,线粒体的质量较大,膜电位较高,线粒体的 活性氧种(ros)的产生较多
33
,由此表明通过pd-1阻断在tr ctls 中线粒体不断活化(图2d)。与上述结果一致,作为线粒体的呼吸的指 标的ocr(oxygen consumption rate,氧消耗速度)与atp的基本使用 量在利用pd-l1抗体进行治疗的小鼠的所属淋巴结中的cd8阳性t 细胞中显著地增高(图2e-f)
34
。由这些结果证明,在pd-1阻断治疗中 伴随tr ctls的增殖,线粒体的代谢速度上升。
[0144]
ros是为了增强由pd-1阻断所引起的抗肿瘤活性而必需。
[0145]
如上述所示,ros因pd-l1抗体治疗而显著地增加。ros是在 线粒体的电气转导系统(etc)的复合物i、复合物ii、复合物iii中发 生
35
。并且,线粒体的ros也作为用于t细胞的抗原性的扩张的信 号转导因子而发挥功能
26、32
。另一方面,已知外因性的ros或其发 生源会直接损伤肿瘤细胞,考虑作为癌症治疗药候补
36
。考虑这些的 两者,本发明人决定首先试验ros发生剂单独是否具有杀肿瘤效果。 虽然向mc38带癌小鼠给予作为ros的前体物质的氢过氧化叔丁基 溶液(luperox),但未确认到抗肿瘤效果(图3a)。进一步,确认到没有 通过luperox单独进行活体内处理的肿瘤细胞的免疫控制表面标记物 和转录分布图的显著变化(图12)。然而,若与pd-l1抗体并用,则显 著地强化抗肿瘤效果,带癌小鼠的存活率延长(图3b、c)。根据这些 数据暗示到,luperox是并非通过对肿瘤细胞的直接作用而是经由t 细胞的活化来提高pd-l1抗体的抗肿瘤效果。作为直接的线粒体ros 发生剂的巴拉刈也增强pd-1抑制的效果(图13a、b)。作为对照,给 予作为使线粒体不稳定、抑制atp合成的药剂的寡霉素与羰基氰对 三氟甲氧基苯腙(fccp)、2,4-二硝基苯酚(dnp)
37
。于是出乎意料的是, 作为线粒体的解偶联剂的fccp与dnp增强pd-l1抗体治疗的效果, 与pd-l1单独给予组相比显著地提高小鼠模型的存活率(图4a)。重要 的是得知,与leuperox同样,fccp与dnp也是若单剂给予则未显 示出抗肿瘤效果,且不具有对肿瘤细胞的直接作用而提高pd-l1抗 体的抗肿瘤效果(图4b)。进一步,在自单独给予fccp的小鼠采集的 肿瘤细胞的表型分析、转录分布图分析中未显示出显著差异,该情况 显示,解偶联剂增强杀伤肿瘤的杀伤性t细胞的功能而非直接杀伤肿 瘤(图12)。由于认为线粒体的解偶联(uncoupling)有通过在降低线粒 体膜电位时减少ros,而进行保护免受氧化性损伤的作用,所以fccp 与dnp的抗肿瘤效果中的协同效果出乎意料
37
。起初有解偶联剂会 减少或增加线粒体的ros发生是相反的报道
38、39
。本发明人确认到 pd-l1抗体与解偶联剂的并用疗法的效果因mntbap(具有ros消除 效果的合成金属卟啉)的给予而受到抑制(图4c)。由此表明,解偶联 剂的协同效果是经由ros信号的效果。不可思议的是,通过pd-l1 抗体与dnp、luperox的3剂并用确认到较强的抗肿瘤效果(图5)。 这暗示解偶联剂在ros以外的任一途径中也提高pd-1抑制的效果的 可能性。
[0146]
解偶联剂促进di,n中的cd62l阴性cd44阳性效应t细胞的生成,增强在肿瘤部位的它们的聚集。
[0147]
那么,解偶联剂如何经由ros而提高pd-l1抗体的抗肿瘤免疫?为了解答该疑问,本
发明人首先对所属淋巴结与肿瘤部位的两者 中的cd8阳性t细胞的组分进行研究。如图6a所示,在所属淋巴结 中,关于效应cd8阳性t细胞(cd62l阴性cd44阳性:p3门)的绝 对数或比率,pd-l1抗体与fccp的并用疗法组与pd-l1抗体单独组 相比显著地增加。作为对照,幼稚t细胞(cd62l阳性cd44阴性: p1门)与中心记忆t细胞(cd62l阳性cd44阳性:p2门)虽然在单独 使用pd-l1抗体时增加,但即便添加fccp也无更多的增加(图6a)。 重要的要点为任何治疗组中的p3细胞组与p1或p2细胞组相比,每 个细胞的线粒体的质量、膜电位均较高,ros均较多;及关于膜电 位与ros产生,在与fccp的并用疗法中显著地增加(图6b)。由这 些现象暗示到:a)关于所使用的fccp的用量,并无线粒体的质量 的降低或膜电位的下落,无毒性(若为更高的用量则预测到毒性);b) 由于增加的p3细胞组中确认到较高的线粒体ros产生,所以利用解 偶联剂的协同效果是经由ros的效果;c)适度的线粒体损伤的反馈 反而有可能增强线粒体活性(图6b)。
[0148]
值得指出的是,随着所属淋巴结中的此种变化,即使对于浸润于 肿瘤内的cd8阳性t细胞而言,p3细胞组也显著地增加(图6c)。由 这些结果表明下述的效果:pd-l1抗体与解偶联剂的并用疗法,在所 属淋巴结与作为其靶的肿瘤部位的两者中,增强效应cd8阳性t细 胞的尺寸或功能性。
[0149]
能量代谢传感器的ampk及mtor与解偶联剂的免疫增强效果相关。
[0150]
ampk与mtor虽然为相反的能量代谢传感器,但认为磷酸化 ampk与mtor的均衡性控制cd8阳性t细胞的分化
1、40、41、42、43、44
。由于可知由解偶联剂所引起的amp(adenosinemonophosphate)/atp比的增加将ampk活化
45
,所以本发明人对通 过pd-l1抗体与解偶联剂的并用疗法进行治疗的带癌小鼠的所属淋 巴结中的cd8阳性t细胞的ampk与mtor的磷酸化状态进行研究。 在自通过pd-l1抗体与dnp或fccp的并用疗法进行治疗的小鼠采 集的cd8阳性t细胞中,ampk与作为与其相关的蛋白的acc与 sirt1在并用疗法后的多个时刻进行活化(图7a)。但是,意料以外的 是,mtor与作为其相关蛋白的s6k与4ebp1也在并用疗法后进行 活化(图7a)。
[0151]
然而,该无法理解的结果是通过所属淋巴结中的cd8阳性t细 胞之中不均匀地混合存在有ampk/mtor均衡性不同的细胞而说 明。实际上在p2细胞组中p-ampk虽然较p-mtor上升,但在p3 细胞组中p-mtor高于p-ampk(图8)。基于这些结果,其次研究若 直接使mtor与ampk的任一者活化,是否可增强pd-1抑制疗法 的效果。如图7b所示,mtor活性剂与ampk活性剂均在早期(20 天以前)略微增强pd-1抑制疗法的效果,相对于此,若为mtor活 性剂与ampk活性剂的3剂并用,则会增强pd-l1抗体的效果,改 善存活率。这些结果显示,mtor与ampk的两者的活化是与pd-l1 抗体和解偶联剂的协同性杀肿瘤活性相关。
[0152]
根据pd-l1抗体和解偶联剂的并用疗法使sirt1增加的情况(图 7a),研究作为nad(nicotinamide adenine dinucleotide)依赖性蛋白脱 乙酰化酶的sirt1的活化是否对pd-l1抗体治疗的效果有影响。报 道了利用被报道有可能具有肿瘤抑制效果的多酚的1种、白藜芦醇, 使sirt1进行活化
6、46
。进一步报道了低用量的白藜芦醇sirt1依赖 性地引起ampk活化与线粒体的生物合成6,进一步报道了在特定的 条件下还辅助mtor途径
47、48、49
。实际上,在pd-l1抗体与白藜芦 醇的并用疗法中,与pd-l1单独治疗相比,显著地确认到肿瘤尺寸 的减少与存活率的延长(图7c)。由该结果表明:pd-l1抗体与作为能 量代谢传感器的ampk或mtor、sirt1的活化的并用会增强活体 内的tr ctl的增殖或功能性。
[0153]
pgc-1α活性剂增强pd-1抗体的治疗效果
[0154]
pgc-1α是通过ampk或mtor进行调节的转录辅因子,是使 线粒体的生物合成或氧化磷酸化增强的因子
45、46
。在fccp、或mtor 活性剂、ampk活性剂与pd-l1抗体的并用治疗中,蛋白质与mrna 中的pgc-1α的表达不断增加,是与迄今为止的报道并不矛盾的结果 (图11a)
37、45、46
。在仅给予pd-l1抗体的情形下,蛋白质中的pgc-1α 的表达虽然增加,但mrna中的pgc-1α的表达减少。认为其原因 在于:pgc-1α的调节是与转录、翻译和蛋白质稳定性等较多阶段相 关
46、47
。pgc-1α是通过与nrfs或ppars等转录因子相关而发挥功 能
46
。本发明人对作为pgc-1α/nrf2的活性剂的奥替普拉与作为 pgc-1α/ppars活性剂的苯扎贝特是否会增强pd-l1抗体的抗肿瘤效 果进行实验
48、29
。结果奥替普拉与苯扎贝特均增强pd-l1抗体的肿 瘤成长抑制效果,改善带癌小鼠的存活率(图11b)。
[0155]
为了研究mc38以外的肿瘤中的pd-1抗体的并用治疗效果,将 作为小鼠的皮肤肉瘤细胞株的metha移植至balb/c小鼠的皮内, 对使用fccp或巴拉刈、奥替普拉的并用疗法进行试验。结果所有药 剂均显示出pd-l1抗体的抗肿瘤效果的增强(图14)。这显示线粒体活 性剂与pd-1抑制抗体的并用治疗对具有不同的基因背景的各种肿瘤 存在效果。
[0156]
与fccp或苯扎贝特的并用治疗增强ctl的t-bet表达。
[0157]
已知对于由pd-1抑制所引起的细胞因子分泌或肿瘤反应性ctl 的活化重要的转录因子t-bet是利用mtor并经由foxo1抑制而进 行活化。因此,本发明人对pd-l1抗体与fccp的并用治疗是否会 影响t-bet与eomes的表达进行了研究。与pd-l1抗体及fccp的并 用疗法使mtor活化的上述发现一致,fccp在cd8阳性细胞中虽 然会使t-bet的表达增加,但不会使eomes的表达增加(图15a)。非常 有趣的是,与foxo1逆向地控制t-bet及eomes的报道一致,使mtor 的下游的转录因子活化的苯扎贝特也会使t-bet增加,反而使eomes 减少(图15a)。进一步在并用治疗中作为杀伤性t细胞功能之一的干 扰素(ifn)-γ产生在肿瘤内增强(图15b)。这与对于th1型免疫重要的 t-bet的表达增强一致。这些结果暗示苯扎贝特或许将线粒体活化, 进一步发生正反馈,而使mtor活化。对以上的结果进行总结,解 偶联剂与pd-1抑制的协同效果的分子机制是经由ampk或mtor 与其下游的包含nrf2或ppars的转录因子或pgc-1a等偶联因子的 活化(图1)。
[0158]
[考察]
[0159]
本发明人显示利用pd-l1抗体进行活化的tr ctl等使线粒体活 化,增强ros的产生,进一步发生ros的药剂增强pd-1抑制的抗 肿瘤效果。意料以外的是判明,2个有名的作为线粒体的解偶联剂的 fccp与dnp也增强pd-l1抗体的抗肿瘤效果。根据ros清除剂会 抵消其协同效果的情况表明,解偶联剂的协同效果取决于ros的发 生。由于线粒体的解偶联剂存在抑制ros产生的作用,因此认为对 缺血性损伤或心力衰竭、胰岛素抗性、肥胖、老化等与氧化应激相关 的疾病的治疗有用,所以此次的结果是意料以外的
50
。根据解偶联剂 的单独给予不会对t细胞的增殖及肿瘤增生造成影响的情况得知,本 研究中使用的最低剂量下的解偶联剂反而具有弥补因pd-1阻断而诱 发的免疫学现象或免疫反应的作用。
[0160]
虽然作为天然多酚的白藜芦醇以心血管改善作用或抗衰老效果、 抗肿瘤效果而已知,但其显示出白藜芦醇诱导线粒体生物合成,而诱 导保护不生病的代谢功能的可能性。本发明人查明了低用量的白藜芦 醇会增强pd-1抑制治疗的效果。与解偶联剂同样地,白藜芦醇本身 与肿瘤增殖无关,或反而会使肿瘤增大。然而,通过与pd-l1抗体 并用,显著
地显示出肿瘤的抑制效果,使动物模型中的存活率提高。
[0161]
可是,这些药剂如何同样地发生与pd-1抑制疗法的协同效果? 线粒体的能量代谢与经由mtor或ampk的细胞内代谢密切相关
5、6、49、51
。本发明人确认到ampk及其相关蛋白通过pd-l1抗体与解 偶联剂的并用疗法而进行活化。重要的是,ampk或sirt1的直接 活性剂均增强pd-l1抗体的抗肿瘤效果。
[0162]
本发明人证明了偶联剂与pd-1抑制的并用疗法不仅将ampk途 径活化,也将mtor途径活化,mtor的直接活性剂也增强pd-l1 抗体的效果。由于迄今为止认为mtor途径的活化与ampk的磷酸 化进行竞争,所以这些结果是意料以外的
1、41、42、43、52
。但是,在认为 所分离的cd8阳性t细胞由不仅根据不同的活化功能状态、也根据 生物化学反应或动态的变动而有所不同的不均匀细胞所构成的情形 下,可以说明本发明人的结果与迄今为止的报道并不矛盾。本发明人 认为mtor途径的活化发生由pd-l1抑制以及fccp或苯扎贝特刺 激所得的dln ctl中的t-bet的表达。t-bet在对于肿瘤消退所需的 成为终末分化效应ctl的供给源的记忆前体物质的分化中是重要的, 关于ctl的抗肿瘤效果也认为是重要的
55、56
。另一方面,认为高效 表达eomes的终末分化ctl因慢性的抗原识别而为免疫耐受的状 态
56、57
。在本发明人的实验结果中,通过fccp或苯扎贝特与pd-1 抗体治疗的并用,t-bet与ifn-γ的表达上升,eomes的表达反而降 低。该结果与通过并用疗法伴有线粒体的活化的效应记忆细胞组(p3 细胞组)增加的本发明人的结论并不矛盾。
[0163]
pgc-1α是调节与线粒体的生物合成或线粒体的氧化磷酸化相关 的一系列转录因子的分子。ampk或mtor的活化是使pgc-1α的 表达增加,并经由磷酸化进行活化。本发明人显示通过解偶联剂与 pd-1抗体的并用疗法pgc-1α的表达增加,或在肿瘤的治疗模型中 pgc-1α活性剂(苯扎贝特、奥替普拉)也与pd-l1抗体具有协同性增 强效果。由该结果表明,pgc-1α是引起线粒体的活化或扩大的重要 分子,且是诱导ampk或mtor活化的正反馈信号转导的重要分子。 进一步,解偶联剂或苯扎贝特通过与pd-l1抗体并用,而将位于mtor下游的作为重要的细胞因子调节因子的t-bet加以活化。
[0164]
将迄今为止的与机理相关的假说的整体情况汇总于图1。
[0165]
a)通过pd-1阻断,引起活化cd8阳性t细胞中的线粒体的扩 大或增殖。
[0166]
b)解偶联剂或ros发生剂使线粒体的体积增加,导致ros的 增加。认为或许ros通过某种途径将ampk与mtor进行活化
36
。
[0167]
c)ampk与mtor的活化是使pgc-1α的表达增加并使之活化。
[0168]
d)最终,pgc-1α与作为其结合转录因子的nrfs与ppars增加 使脂肪酸的氧化与氧化磷酸化活化的一系列转录因子的表达,另外, 引起导致ctl的活化或分化的线粒体的扩大。
[0169]
最近,虽然有报道称pd-1途径会抑制线粒体的活化与pgc-1α 的表达,但这些报道与本发明人的假说也不矛盾
63、64
。ros或解偶 联剂、ampk活性剂、mtor活性剂、pgc-1α活性剂等本发明人在 本研究中所使用的所有药剂在与pd-1抗体并用的情形下,虽然经由 线粒体的活化或扩大而导致cd8
+
t细胞的活化或分化,但在以单剂 给予的情形下并无同样效果。
[0170]
本发明人通过至今为止的结果而显示了可应用于对pd-1抗体治 疗无应答性的癌症患者的革新性并用疗法的有效性。自移植了对 pd-1治疗无应答性的肿瘤的小鼠所提取的ctl未引起线粒体的活 化,由此认为本发明人的研究也有助于与判定pd-1抗体治疗的有
效 性的生物标记物的研究。今后,重要的是研究根据线粒体的代谢变化 而发生变化的血清中代谢物量、或在pd-1抗体治疗前后收集的样品 中的cd8
+
t细胞的ocr活性、与线粒体的活化信号相关的rna的 表达是否可以成为与pd-1抗体治疗的应答性相关的生物标记物。另 外,由并用药所引起的pd-1抗体治疗的协同性增强效果有助于减少 被争论会危及社会保障制度的昂贵的pd-1抗体的给予量。
[0171]
目前,通过pd-1/pd-l1阻断的癌症治疗大致有2个问题。第1 个问题如上所述是pd-1抑制治疗不会对所有患者有效果。因此,进 行增强pd-1抑制疗法的抗肿瘤效果的可能性较高且可临床应用的药 物的开发。本发明人的结果针对对pd-1抑制疗法无效果的患者,提 供新颖的并用疗法的选项。另一个问题是与由pd-1抑制疗法单独或 并用疗法所发生的副作用相关,尤其可列举由药剂所特有的毒性或过 度的免疫应答所诱发的自身免疫性疾病
57
。伴随此种增强免疫治疗的 治疗介入,副作用也被增强的可能性很大。在pd-l1抗体与此次的 研究中所使用的药剂的并用治疗中,虽然未见特别明显的自身免疫反 应,但若考虑临床应用,则需要使用本发明人在以前所确立的自身免 疫疾病模型小鼠而评价该风险
14、15、16
。dnp在1930年代是用作膳食 增补剂(diet supplement)或提高代谢速度的药剂
58
。但是,由于因质子 驱动力的崩解所发生的效果,所以dnp会引发严重的健康伤害,而 被禁止使用
59
。fccp被广泛用于线粒体的活体能量学的研究,但 fccp也存在细胞毒性及一定程度的质膜去极化作用,所以未进行临 床应用
50
。在本研究中,5种药剂虽然显示出增强由pd-1抑制所引 起的抗肿瘤效果,但若考虑在代谢性疾病的治疗中较多地尝试或作为 日常的增补剂(supplement)服用,则作为sirt1活性剂的天然多酚的 白藜芦醇较为理想
5、51
。虽然报道了白藜芦醇单独的抗肿瘤效果,但 也存在其剂量依赖性,在抗肿瘤效果方面存在异议
60
。本试验中所使 用的剂量为最低剂量,至少在本发明人所进行的试验中,并无肿瘤增 生抑制效果(反而呈现其相反)。本发明人所鉴定的其他并用疗法为解 偶联剂或ros下游的信号的活性剂。若考虑脱靶的减少,则以mtor 与ampk、sirt1的下游作为靶的治疗法有增强抗肿瘤效果并且弱化 不期望的副作用的可能性。
[0172]
总之,本发明人对控制线粒体的能量代谢检测点,并增强pd-1 抑制治疗的效果的药剂进行了鉴定。对于经由pd-1的t细胞的控制、 或针对pd-1抑制疗法抗性的癌症患者、或感染疾病的并用疗法,本 研究的结果可谓开辟出了新的途径。值得关注的是,由于奥替普拉和 苯扎贝特已用作临床药物,所以可应用于与pd-1抗体的并用疗法的 临床研究。
[0173]
[步骤与材料]
[0174]
小鼠与细胞
[0175]
所有小鼠均在京都大学研究生院医学部动物实验设施中,在无病 原体的特别的spf(specific-pathogen free)环境下饲养,并在适当的实 验计划下使用。c57bl/6和balb/c(5-6周龄)是自日本查尔斯河实验 室(charles river laboratories japan)(横滨)获取。小鼠结肠腺癌mc38 细胞是由dr.jim allison(memorial sloan-kettering cancer center,newyork,ny)提供。纤维肉瘤metha是自生物医学研究细胞资源中心 (cell resource center for biomedical research)(仙台、日本)获得。这些 细胞是在包含10%热灭活fbs(fetal bovine serum)和1%抗真菌性抗 生素(invitrogen)的dmem(dulbecco modified eaglemedium)(invitrogen)中进行培养。该细胞系统在分枝杆菌属中不会被 感染。
biotec),利用胶原 酶iv型(thermo fisher scientific)进行酶处理。使用每毫克的肿瘤细 胞数作为绝对数。使用小鼠癌细胞分离试剂盒(tumor cell isolation kit, mouse)(miltenyibiotec)自消化的肿瘤组织将肿瘤细胞分离。该试剂盒 通过排除淋巴细胞、红细胞、成纤维细胞、内皮细胞和肿瘤相关的基 质细胞,将肿瘤细胞纯化。通过facsaria(bd bioscience),进一步 将肿瘤细胞集团分离、纯化而使用。
[0189]
流式细胞仪分析
[0190]
使用识别所示抗原的以下的抗体:来自biolegend的 cd44(1m7)、cd45.2(104)、cd45.1(a20)、cd8(53-6.7)、 cd62l(mel-14)、t-bet(4b/o)和ifn-γ(xmg1.2)、i型 mhc(af6-88.5)、cd155(tx56)和vista(mih63);来自ancam的 p-ampk(epr5683);来自ebioscience的p-mtor(mrrby)、 eomes(danllmag)和pd-l1(m1h5)。所有流式细胞仪是利用facscanto ii(bd biosciences)进行,并利用flowjo软件(flowjo、llc) 进行分析。在细胞内磷酸化蛋白的评价中,利用0.5%tritonx对细 胞进行透过处理,在染色前利用1.5%pfa(paraformaldehyde)进行固 定。线粒体的质量、膜电位、线粒体的超氧化物和细胞的ros的测 定分别使用mitotracker green、mitotracker deep red、mitosox red 和cellrox green reagents进行(均为life technologies)。这些色素的 各自的最终浓度是设为0.125μm、0.125μm、5.0μm和0.625μm,并 在37℃5%co2加湿培养箱中培养30分钟。
[0191]
氧消耗率的测定
[0192]
氧消耗率是利用xf96细胞外流量分析仪(seahorse biosciences) 进行测定。将4
×
105的cd8
+
t细胞撒在规定的xf96板上。向模组中 依序添加xf cell mito stress测试试剂盒(seahorse bioscience)附有的 线粒体的氧化磷酸化的4种药剂。具体而言,基本性的ocr测定是 在依序添加寡霉素、fccp、鱼藤酮/抗霉素a后进行。atp转化率是 定义为(寡霉素添加前的最终值-寡霉素添加后的最小值)
34
。
[0193]
实时pcr(real-time rt-pcr)
[0194]
使用rneasy迷你试剂盒(qiagen)自cd8阳性t细胞或肿瘤细 胞将rna分离,并通过逆转录合成cdna。pgc-1a的实时pcr是 使用以下的引物而进行:正向actcggattgctccggccct(序列编 号1)与反向actgacggcctaactccaccca(序列编号2)。为了对 凋亡与线粒体的能量代谢相关基因的表达量进行分析,使用rt2 profiler pcr阵列基因表达试剂盒pamm-012z或 pamm-008z(qiagen)。本分析中所含的基因列表可在下述的网址查 看http://www.sabiosciences.com/apoptosis.php。
[0195]
蛋白质印迹(western blotting)
[0196]
利用小鼠cd8微珠(milteni biotec)对cd8
+
t细胞进行分离。在 进行pbs 2次洗净后,利用包含30mm tris-hcl(ph7.4)、150mm nacl、 10%甘油、0.1%sds(sodium dodeeyl sulfonate)、1%triton-x-100、 0.05%na-doc、5mm edta(ethylenediamine tetraacetic acid)(ph8.0)、 蛋白酶抑制剂混合物(protease inhibitor mixture)(roche molecularbiochemicals)、以及磷酸酶抑制剂(phosphatase inhibitors)(nacalaitesque)的溶解缓冲液使2
×
106的细胞可溶化。在利用dc蛋白分析 (bio-rad)进行的蛋白质浓度测定后,将蛋白质4μg置在4-20%梯度 mini-protean tgx gels(bio-rad),电印迹到硝酸纤维素膜上,之 后在于tbs(tris buffered saline)中包含1%bsa的封闭缓冲液中进行 培养。一次抗体培养是在封闭缓冲液中在4℃下进行一晚。洗净后, 二次抗体培养是在封闭缓冲液中
在室温下进行40分钟。印迹是利用增强化学发光(enhancedchemiluminescence)(amershampharmacia)进行展开。使用识别以下蛋白质的一次抗体:phospho-mtor(p-mtor)(cat#5536)、phospho-ampkα(p-ampk)(#2535)、phospho-p70s6激酶(p-s6k)(#9205)、4e-bp1(#9644)、phospho-acetyl-coacarboxylase(磷酸乙酰辅酶a羧化酶)(p-acc)(#3661)、sirt1(#9475)。所有一次抗体是自cellsignalingtechnology获取。识别pgc-1α(sc-13067)的抗体是自santcruz获得。
[0197]
统计分析
[0198]
统计分析是利用prism6来进行。为了对3个以上的变量进行分析,在单向anova分析(单向方差分析)后进行sidak的多重比较检验(sidak’smultiplecomparisontest)。为了对两个组进行比较而进行学生t检验(studentttest)。所有统计分析是假设为参数数据,进行2标本的检验。将p值小于0.05者设为显著。数据的偏差是作为平均值
±
标准误差(sem)进行评价。为了推定本研究中的试样尺寸,认为5个以上的试样较为合适。试样与动物是自集团中随机选择并进行处理。试样或动物的处理并非盲检。
[0199]
文献
[0200]
1.chih.regulationandfunctionofmtorsignallingintcellfatedecisions.natrevimmnunol2012,12(5):325-338.
[0201]
2.cunninghamjt,rodgersjt,arlowdh,vazquezf,moomavk,puigserverp.mtorcontrolsmitochondrialoxidativefunctionthroughayy1-pgc-lalphatranscriptionalcomplex.nature2007,450(7170):736-740.
[0202]
3.toyamaeq,herzigs,courchetj,lewistl,jr.,losonoc,hellbergk,etal.metabolism.amp-activatedproteinkinasemediatesmitochondrialfissioninresponsetoenergystress.science2016,351(6270):275-281.
[0203]
4.venturα-clapierr,garniera,vekslerv.transcriptionalcontrolofmitochondrialbiogenesis:thecentralroleofpgc-1alpha.cardiovascres2008,79(2):208-217.
[0204]
5.cantoc,auwerxj.targetingsirtuin1toimprovemetabolism:allyouneedisnad(+)?pharmacolrev2012,64(1):166-187.
[0205]
6.pricenl,gomesap,lingaj,duartefv,martin-montalvoa,northbj,etal.sirt1isrequiredforampkactivationandthebeneficialeffectsofresveratrolonmitochondrialfunction.cellmetabolism2012,15(5):675-690.
[0206]
7.scarpullarc.metaboliccontrolofmitochondrialbiogenesisthroughthepgc-1familyregulatorynetwork.biochimbiophysacta2011,1813(7):1269-1278.
[0207]
8.blaschkef,takatay,caglayane,lawre,hsuehwa.obesity,peroxisomeproliferator-activatedreceptor,andatherosclerosisintype2diabetes.arteriosclerthrombvascbiol2006,26(1):28-40.
[0208]
9.couzin-frankelj.breakthroughoftheyear2013.cancerimmunotherapy.science2013,342(6165):1432-1433.
[0209]
10.topaliansl,drakecg,pardolldm.immunecheckpointblockade:a
commondenominatorapproachtocancertherapy.cancercell2015,27(4):450-461.
[0210]
11.okazakit,chikμmas,iwaiy,fagarasans,honjot.arheostatforimmuneresponses:theuniquepropertiesofpd-1andtheiradvantagesforclinicalapplication.natimmunol2013,14(12):1212-1218.
[0211]
12.okazakit,maedaa,nishimurah,kurosakit,honjot.pd-1immunoreceptorinhibitsbcellreceptor-mediatedsignalingbyrecruitingsrchomology2-domain-containingtyrosinephosphatase2tophosphotyrosine.procnatlacadsciusa2001,98(24):13866-13871.
[0212]
13.chemnitzjm,parryrv,nicholske,junech,rileyjl.shp-1andshp-2associatewithimmunoreceptortyrosine-basedswitchmotifofprogrammeddeath1uponprimaryhμmantcellstimulation,butonlyreceptorligationpreventstcellactivation.jimmunol2004,173(2):945-954.
[0213]
14.nishimurah,nosem,hiaih,minaton,honjot.developmentoflupus-likeautoimmunediseasesbydisruruptionofthepd-1geneencodinganitimmotif-carryingimmunoreceptor.immunity1999,11(2):141-151.
[0214]
15.nishimurah,okazakit,tanakay,nakatanik,haram,matsμmoria,etal.autoimmunedilatedcardiomyopathyinpd-1receptor-deficientmice.science2001,291(5502):319-322.
[0215]
16.okazakit,tanakay,nishior,mitsuiyet,mizoguchia,wangj,etal.autoantibodiesagainstcardiactroponiniareresponsiblefordilatedcardiomyopathyinpd-1-deficientmice.natmed2003,9(12):1477-1483.
[0216]
17.iwaiy,ishidam,tanakay,okazakit,honjot,minaton.involvementofpd-llontμmorcellsintheescapefromhostimmunesystemandtμmorimmunotherapybypd-l1blockade.procnatlacadsciusa2002,99(19):12293-12297.
[0217]
18.iwaiy,terawakis,ikegawam,okazakit,honjot.pd-1inhibitsantiviralimmunityattheeffectorphaseintheliver.jexpmed2003,198(1):39-50.
[0218]
19.brahmerjr,drakecg,wollneri,powderlyjd,picusj,sharfmanwh,etal.phaseistudyofsingle-agentanti-programmeddeath-1(mdx-1106)inrefractorysolidtμmors:safety,clinicalactivity,pharmacodynamics,andimmunologiccorrelates.jclinoncol2010,28(19):3167-3175.
[0219]
20.zouw,wolchokjd,chenl.pd-l1(b7-h1)andpd-1pathwayblockadeforcancertherapy:mechanisms,responsebiomarkers,andcombinations.scitranslmed2016,8(328):328rv324.
[0220]
21.mahoneykm,rennertpd,freemangj.combinationcancerimmunotherapyandnewimmunomodulatorytargets.natrevdrugdiscov2015,14(8):561-584.
[0221]
22.gubinmm,zhangx,schusterh,carone,wardjp,noguchit,etal.
mediatedmechanisms:aradicaltherapeuticapproach?natrevdrugdiscov2009,8(7):579-591.
[0236]
37.krausss,zhangcy,lowellbb.themitochondrialuncoupling-proteinhomologues.natrevmolcellbiol2005,6(3):248-261.
[0237]
38.olssonm,wiisonm,ullert,isakssonc.freeradicalsruninlizardfamilieswithout(andperhapswith)mitochondrialuncoupling.biollett2009,5(3):345-346.
[0238]
39.hanyh,kimsh,kimsz,parkwh.carbonylcyanidep-(trifluoromethoxy)phenylhydrazone(fccp)asano2(*-)generatorinducesapoptosisviathedepletionofintracellulargshcontentsincalu-6cells.lungcancer2009,63(2):201-209.
[0239]
40.arakik,ahmedr.ampk:ametabolicswitchforcd8+t-cellmemory.eurjimmunol2013,43(4):878-881.
[0240]
41.buckmd,o
′
sullivand,pearceel.tcellmetabolismdrivesimmunity.jexpmed2015,212(9):1345-1360.
[0241]
42.siskapj,rathmelljc.tcellmetabolicfitnessinantitμmorimmunity.trendsimmunol2015,36(4):257-264.
[0242]
43.finlayd,cantrellda.metabolism,migrationandmemoryincytotoxictcells.natrevimmunol2011,11(2):109-117.
[0243]
44.blagihj,coulombef,vincentee,dupuyf,galiciα-vazquezg,yurchenkoe,etal.theenergysensorampkregulatestcellmetabolicadaptationandeffectorresponsesinviv0.immunity2015,42(1):41-54.
[0244]
45.rohaslm,st-pierrej,uldrym,jagers,handschinc,spiegelmanbm.afundamentalsystemofcellularenergyhomeostasisregulatedbypgc-lalpha.proenatlacadsciusa2007,104(19):7933-7938.
[0245]
46.jangm,cail,udeanigo,slowingkv,thomascf,beechercw,etal.cancerchemopreventiveactivityofresveratrol,anaturalproductderivedfromgrapes.science1997,275(5297):218-220.
[0246]
47.zongy,sunl,liub,dengys,zhand,chenyl,etal.resveratrolinhibitslps-inducedmapksactivationviaactivationofthephosphatidylinositol3-kinasepathwayinmurineraw264.7macrophagecells.plosone2012,7(8):e44107.
[0247]
48.leontievaov,paszkiewiczg,demidenkozn,blagosklonnymv.resveratrolpotentiatesrapamycintopreventhyperinsulinemiaandobesityinmalemiceonhighfatdiet.celldeathdis2013,4:e472.
[0248]
49.hongs,zhaob,lombarddb,fingardc,inokik.cross-talkbetweensirtuinandmammaliantargetofrapamycincomplex1(mtorc1)signalingintheregulationofs6kinase1(s6k1)phosphorylation.jbiolchem2014,289(19):13132-13141.
infiltrating cd8+ t cells.cancer immunology research 3,116-124 (2015).
[0260]
[实施例2]
[0261]
对c57bl/6小鼠接种5
×
105的小鼠大肠癌mc38。7天后腹腔内 给予抗pd-l1抗体(1-111a、150μg)与ampk抑制剂(化合物c:200μg 的bbs液,200μl)。抗pd-l1抗体是每隔6天给予3次,化合物c(c.c) 是每隔2天给予7次。显示自接种mc38至第25天的肿瘤的体积 (mm3)。
[0262]
将结果示于图9。ampk抑制剂会增强抗pd-l1抗体治疗的效 果。
[0263]
[实施例3]
[0264]
对balb/c小鼠接种2
×
106的小鼠肾癌renca。7天后腹腔内给 予抗pd-l1抗体(1-111a、150μg)与ampk抑制剂(化合物c:200μg 的pbs液、200μl)。抗pd-l1抗体是每隔6天给予3次,化合物c(c.c) 是每隔2天给予7次。显示自renca接种至第25天的肿瘤的体积 (mm3)。
[0265]
将结果示于图10。ampk抑制剂会增强抗pd-l1抗体治疗的效 果。
[0266]
[实施例4]
[0267]
对c57bl/6小鼠接种5
×
105的mc38。7天后腹腔内给予抗pd-l1 抗体(1-111a、150μg)与pgc-1α/转录因子复合物活化剂(2-(4-{2-[(4
‑ꢀ
氯苯甲酰基)氨基]乙基}苯氧基)-2-甲基丙酸(苯扎贝特):10μg的pbs 液、200μl)。抗pd-l1抗体是每隔6天给予3次,苯扎贝特是每隔2 天给予7次。显示自接种mc38至第25天的肿瘤的体积(mm3)。
[0268]
将结果示于图11。pgc-1α/转录因子复合物活化剂会增强抗 pd-l1抗体治疗的效果。
[0269]
[实施例5]
[0270]
对balb/c小鼠接种5
×
105的metha,7天后腹腔内给予抗pd-l1 抗体(1-111a、80μg)与foxo1抑制剂(5-氨基-7-(环己基氨基)-1-乙基-6
‑ꢀ
氟-4-氧代-1,4-二氢喹啉-3-羧酸、calbiochem)(2mg/kg)。给予时间表是 依据图3。将自metha接种至第28天的肿瘤的体积(mm3)示于图16。 foxo1抑制剂会增强抗pd-l1抗体治疗的效果。
[0271]
[实施例6]
[0272]
通过gc-ms分析对5只pd-1-/-小鼠(immunity 11,141-151 (1999).;science 291,319-322(2001).;nat.med.9,1477-1483(2003).) 与野生型c57bl/6n小鼠(与pd-1-/-小鼠同胎出生的小鼠)的血清中所 含的氨基酸量进行鉴定。将结果示于图17。图17是表示将野生型的 值设为1时的pd-1-/-小鼠的值。在缺损pd1的小鼠体内进行t细胞 的分裂,血中氨基酸进行代谢,其值减少。
[0273]
对balb/c小鼠接种5
×
105的纤维肉瘤metha(cell resourcecenter for biomedical research),7天后给予抗pd-l1抗体(1-111a、 60μg)与aminoleban(大冢(塚)制药、400μl/mouse)。给予时间表是依据 图3。将aminoleban的组成示于图18。
[0274]
将结果示于图19。氨基酸会增强抗pd-l1抗体治疗的效果。
[0275]
将本说明书中所引用的所有刊物、专利和专利申请直接作为参考 而编入至本说明书中。
[0276]
产业上的可利用性
[0277]
本发明的药物组合物可以用作抗癌剂、感染症治疗剂或它们的组 合。
[0278]
序列表自由文本
1α的转录因子复合物)的物质为选自下述的至少1种 化合物:2-(4-{2-[(4-氯苯甲酰基)氨基]乙基}苯氧基)-2-甲基丙酸、9
‑ꢀ
顺式,12-顺式-十八碳二烯酸)、2-[4-(4-氯苯甲酰基)苯氧基]-2-甲基丙 酸-d6 1-甲基乙酯、(十一烷硫基)-乙酸、4-甲基-5-(2-吡嗪基)-3-二硫杂 环戊烯硫酮、n,n-二甲基甲酰胺、3-[4-(2,4-双(三氟甲基)苄氧基)-3
‑ꢀ
甲氧基苯基]-2-氰基-n-(5-三氟甲基-1,3,4-噻二唑-2-基)丙烯酰胺和它 们的类似物。
[0297]
11.实施方案6所述的药物组合物,其中,控制foxo1的物质为选自 下述的至少1种化合物:5-氨基-7-(环己基氨基)-1-乙基-6-氟-4-氧代
ꢀ‑
1,4-二氢喹啉-3-羧酸、2-环戊基-n-{2,4-二氯-3-[(异喹啉-5-基氧基)甲 基]苯基}-n-甲基乙酰胺及其类似物。
[0298]
12.实施方案1~3中任一项所述的药物组合物,其中,氨基酸为选自 下述的至少1种化合物:色氨酸、苯丙氨酸、亮氨酸、异亮氨酸、酪 氨酸、组氨酸、赖氨酸、甲硫氨酸、苏氨酸、缬氨酸、丙氨酸、精氨 酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、 脯氨酸、丝氨酸、鸟氨酸、瓜氨酸和它们的类似物。
[0299]
13.实施方案1~12中任一项所述的药物组合物,其被用作抗癌剂、 感染症治疗剂或它们的组合。
[0300]
14.实施方案1~13中任一项所述的药物组合物,其分别给予pd-1信 号抑制剂与选自下述(i)~(iii)的至少1种物质:
[0301]
(i)ros发生剂和控制其下游信号的物质、
[0302]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0303]
(iii)氨基酸。
[0304]
15.实施方案1~13中任一项所述的药物组合物,其为包含pd-1信号 抑制剂与选自下述(i)~(iii)的至少1种物质的调配剂:
[0305]
(i)ros发生剂和控制其下游信号的物质、
[0306]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及(iii)氨基酸。
[0307]
16.pd-1信号抑制活性增强剂,其包含选自下述(i)~(iii)的至少1种物 质:
[0308]
(i)ros发生剂和控制其下游信号的物质、
[0309]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0310]
(iii)氨基酸。
[0311]
17.癌症、感染症或它们的组合的治疗方法,其包括下述的步骤:在 给予pd-1信号抑制剂之前、之后或同时的任一时期,以药物上有效 的量对受验者或受验动物给予选自下述(i)~(iii)的至少1种物质:
[0312]
(i)ros发生剂和控制其下游信号的物质、
[0313]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0314]
(iii)氨基酸。
[0315]
18.选自下述(i)~(iii)的至少1种物质的应用,其是用于治疗癌症、感 染症或它们的组合,且在给予pd-1信号抑制剂之前、之后或同时的 任一时期,给予选自下述(i)~(iii)的至少1种物质:
[0316]
(i)ros发生剂和控制其下游信号的物质、
[0317]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0318]
(iii)氨基酸。
[0319]
19.选自下述(i)~(iii)的至少1种物质的应用,其是用于在治疗癌症、 感染症或它们的组合的方法中应用,且在给予pd-1信号抑制剂之前、 之后或同时的任一时期,给予选自下述(i)~(iii)的至少1种物质:
[0320]
(i)ros发生剂和控制其下游信号的物质、
[0321]
(ii)显示解偶联作用的物质和控制其下游信号的物质、以及
[0322]
(iii)氨基酸。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1