AHR抑制剂及其用途的制作方法
ahr抑制剂及其用途
1.相关申请的交叉引用
2.本技术要求于2020年1月10日提交的美国临时专利申请第62/959,246号和2020年12月21日提交的美国临时专利申请第63/128,465号的根据35u.s.c.
§
119(e)的权益,所述临时专利申请中每一者的内容均通过引用方式以其整体并入本文。
技术领域
3.本发明涉及ahr抑制剂用于治疗ahr核阳性的癌症患者的用途。
背景技术:
4.芳烃受体(ahr)是一种配体激活的核转录因子,其在与配体结合后,从细胞质移位到细胞核,并且与芳烃受体核转运体(arnt)形成异源二聚体(stevens,2009)。ahr-arnt复合物与含有二噁英反应元件(dre)的基因结合从而激活转录。许多基因受ahr调控;记载最充分的基因包括细胞色素p450(cyp)基因cyp1b1和cyp1a1(murray,2014)。
5.多种内源性和外源性配体能够结合至ahr并将其激活(shinde和mcgaha,2018;rothhammer,2019)。ahr的一种内源性配体是由吲哚胺2,3-双加氧酶1(ido1)和色氨酸2,3-双加氧酶(tdo2)从前体色氨酸生成的犬尿氨酸。许多癌症过表达ido1和/或tdo2,导致高水平的犬尿氨酸。犬尿氨酸或其他配体对ahr的激活会改变多种免疫调节基因的基因表达,导致先天性和适应性免疫系统内的免疫抑制(opitz,2011)。ahr的激活导致幼稚t细胞分化为调节性t细胞(tregs)而不是效应t细胞(funatake,2005;quintana 2008)。最近已经证明,经激活的ahr上调cd8+t细胞上的程序性细胞死亡蛋白1(pd-1)从而降低它们的细胞毒活性(liu,2018)。在骨髓细胞中,ahr激活导致树突细胞上产生致耐受性表型(vogel,2013)。此外,ahr激活驱动抑制肿瘤巨噬细胞中nf-κb的klf4的表达,并促进阻断cd8+t细胞功能的cd39表达(takenaka,2019)。
6.ahr介导的免疫抑制在癌症中发挥作用,因为它的活性阻止免疫细胞识别和攻击正在生长的肿瘤(murray,2014;xue,2018;takenaka,2019)。
技术实现要素:
7.如本文所述,发明人已发现ahr核定位和/或ahr基因扩增指示患者对ahr抑制剂或ahr拮抗剂治疗的反应性。令人惊讶的是,发现ahr核阳性患者的百分比在不同类型的癌症之间存在显著差异。例如,已确定ahr核阳性的膀胱癌患者的百分比高于其他癌症类型。一些ahr抑制剂,诸如(r)-n-(2-(5-氟吡啶-3-基)-8-异丙基吡唑并[1,5-a][1,3,5]三嗪-4-基)-2,3,4,9-四氢-1h-咔唑-3-胺(化合物a),可以阻断ahr在配体的存在下从细胞质移位到细胞核,并且可以阻断体内肿瘤模型中的下游信号传导。因此,对于某些癌症类型(诸如,例如膀胱癌),确定ahr核阳性度(positivity)和/或ahr基因扩增可以被用于确定或预测使用ahr拮抗剂的治疗的功效以及被用于患者选择目的。
[0008]
因此,本文提供了用于确定或预测使用ahr拮抗剂的治疗的功效以及/或者为包含
诸如化合物a的ahr拮抗剂的治疗的应用或施用选择患者的方法。此类方法部分地包括鉴定具有ahr核阳性度和/或ahr基因扩增的患者的方法,以及使用ahr拮抗剂(诸如化合物a)治疗具有ahr核阳性度和/或ahr基因扩增的患者的方法。
[0009]
本文提供了用于鉴定ahr核阳性的癌症患者的方法,以及ahr抑制剂用于治疗ahr核阳性的癌症患者的用途。
[0010]
在一个方面,本发明提供了鉴定或选择ahr核阳性的癌症患者的方法,所述方法包括对患者的肿瘤组织进行免疫组化(ihc)染色,以及选择ahr核染色阳性的患者。
[0011]
在另一个方面,本发明提供了治疗癌症的方法,所述方法包括选择ahr核阳性的患者,以及向该患者施用治疗有效量的ahr抑制剂。
[0012]
在一些方面和实施方案中,本发明提供了治疗患者的诸如癌症的增殖性病症的方法,所述方法包括例如使用如本文所述的方法选择ahr核阳性的患者,以及给患者施用治疗有效量的例如如本文所述的ahr拮抗剂。在一些实施方案中,治疗方法进一步包括例如使用如本文所述的ihc染色方法测量或确定来自患者的肿瘤样本是否为ahr核阳性。
[0013]
在一些方面和实施方案中,本发明提供了治疗患者的诸如癌症的增殖性病症的方法,所述方法包括例如使用如本文所述的方法选择具有ahr基因扩增的患者,以及给患者施用治疗有效量的例如如本文所述的ahr拮抗剂。在一些实施方案中,治疗方法进一步包括例如使用本文所述的任何方法,例如ngs、rnascope或fish,测量或确定来自患者的肿瘤样本是否具有ahr基因扩增。
[0014]
在一些方面和实施方案中,本发明提供了治疗ahr核阳性的患者的诸如癌症的增殖性病症的方法,所述方法包括给患者施用治疗有效量的例如如本文所述的ahr拮抗剂。在一些实施方案中,患者是例如使用如本文所述的方法确定为ahr核阳性的。在一些实施方案中,治疗方法进一步包括例如使用如本文所述的ihc染色方法测量或确定来自患者的肿瘤样本是否为ahr核阳性。
[0015]
在一些方面和实施方案中,本发明提供了治疗具有ahr基因扩增的患者的诸如癌症的增殖性病症的方法,所述方法包括给患者施用治疗有效量的例如如本文所述的ahr拮抗剂。在一些实施方案中,例如使用如本文所述的方法确定患者具有ahr基因扩增。在一些实施方案中,治疗方法进一步包括例如使用本文所述的任何方法,例如ngs、rnascope或fish,测量或确定来自患者的肿瘤样本是否具有ahr基因扩增。
[0016]
在一些实施方案中,癌症选自如本文所述的那些癌症。在一些实施方案中,ahr抑制剂选自如本文所述的那些ahr抑制剂。在这些方法的一些实施方案中,ahr拮抗剂是化合物a或其药学上可接受的盐。在这些方法的一些实施方案中,ahr拮抗剂是化合物a的代谢物或其药学上可接受的盐或其前药。在一些实施方案中,化合物a的代谢物是化合物b或化合物c。
附图说明
[0017]
图1描绘了所有强度(a)和合并的2+3+强度(b)下的膀胱癌的ahr核染色的cta评分。
[0018]
图2描绘了所有强度(a)和合并的2+3+强度(b)下的黑素瘤tma(811)的ahr核染色的cta评分。
[0019]
图3描绘了所有强度(a)和合并的2+3+强度(b)下的黑素瘤tma(804b)的ahr核染色的cta评分。
[0020]
图4描绘了所有强度(a)和合并的2+3+强度(b)下的卵巢癌症的ahr核染色的cta评分。
[0021]
图5描绘了所有强度(a)和合并的2+3+强度(b)下的hnscc的ahr核染色的cta评分。
[0022]
图6描绘了膀胱癌、黑素瘤、卵巢癌症和hnscc的h分数。线代表均值。
具体实施方式
[0023]
1.本发明的某些实施方案的一般描述
[0024]
如本文所述,已发现可使用ahr核定位和/或ahr基因扩增作为预测性生物标志物,用于鉴定和选择可以从用诸如(r)-n-(2-(5-氟吡啶-3-基)-8-异丙基吡唑并[1,5-a][1,3,5]三嗪-4-基)-2,3,4,9-四氢-1h-咔唑-3-胺(化合物a)的ahr抑制剂进行的治疗获得临床益处或对该治疗有反应的癌症患者。
[0025]
已发现ahr抑制剂(r)-n-(2-(5-氟吡啶-3-基)-8-异丙基吡唑并[1,5-a][1,3,5]三嗪-4-基)-2,3,4,9-四氢-1h-咔唑-3-胺(化合物a)有效地阻断ahr在配体的存在下从细胞质易位到细胞核,以及体内肿瘤模型中的下游信号传导。化合物a是一种新型的合成小分子抑制剂,其被设计用于靶向和选择性地抑制ahr,并且正在被开发作为经口施用的治疗药物。已经发现多种具有如由ahr基因签名(signature)确定的高水平ahr信号转导的肿瘤类型。由犬尿氨酸和其他配体水平升高引起的高水平ahr激活,以及其在驱动免疫抑制性肿瘤微环境(tme)中的作用,使ahr成为多种癌症类型的有吸引力的治疗靶标。
[0026]
化合物a强效地抑制人和啮齿动物细胞系中的ahr活性(半数最大抑制浓度[ic50]为约35-150nm),并且与其他受体、转运体和激酶相比,对ahr具有高度选择性。在人t细胞测定中,化合物a诱导激活的t细胞状态。化合物a抑制cyp1a1和白细胞介素(il)-22基因表达,并导致促炎细胞因子(诸如il-2和il-9)的增加。
[0027]
已在啮齿动物和非啮齿动物物种的一系列药理学、单次剂量和重复剂量毒理学研究(包括在大鼠和猴子中进行的28天良好实验室规范(good laboratory practice,glp)研究)中评价了化合物a的非临床安全性。这些与人类潜在相关的研究中值得注意的发现包括:呕吐、稀便、脱水、体重减轻、非腺性胃溃疡和水肿(大鼠)、生精小管变性和附睾管腔中有碎片(大鼠)、至多11%的qtc延长(猴子)以及胸腺重量减轻和皮质淋巴细胞(猴子)。除大鼠睾丸变化外,在停药2周后所有变化均消退或正在消退。这些研究的非临床安全性评估支持化合物a在人体中的临床评估。已在没有严重不良事件(sae)的人患者中测试了作为单一疗法的每天一次(qd)200mg、400mg、800mg和1200mg的化合物a。
[0028]
还发现免疫组织化学(ihc)染色可以鉴定ahr核阳性的癌症患者。已经使用免疫组织化学(ihc)染色分析了各种肿瘤组织。参见,例如,如本文所述的膀胱癌、黑素瘤、卵巢癌症和头颈鳞状细胞癌(hnscc)的ihc染色数据。不希望受任何特定理论的束缚,ahr核阳性的癌症患者更有可能从ahr抑制剂治疗中获益。
[0029]
令人惊讶的是,发现ahr核阳性患者的百分比在不同类型的癌症之间存在显著差异。例如,根据ihc染色,ahr核阳性的膀胱癌患者比例高于其他癌症类型。因此,对于某些癌症类型(例如,膀胱癌),预先选择ahr核阳性患者可以显著提高ahr抑制剂治疗的有效性。
[0030]
因此,在一些方面,本发明提供了治疗患者的诸如癌症的增殖性病症的方法,所述方法包括例如使用如本文所述的方法选择ahr核阳性的患者,以及给患者施用治疗有效量的例如如本文所述的ahr拮抗剂。在一些实施方案中,治疗方法进一步包括例如使用如本文所述的ihc染色方法测量或确定来自患者的肿瘤样本是否为ahr核阳性。
[0031]
在一些方面,本发明提供了治疗患者的诸如癌症的增殖性病症的方法,所述方法包括例如使用如本文所述的方法选择具有ahr基因扩增的患者,以及给患者施用治疗有效量的例如如本文所述的ahr拮抗剂。在一些实施方案中,治疗方法进一步包括例如使用本文所述的任何方法,例如ngs、rnascope或fish,测量或确定来自患者的肿瘤样本是否具有ahr基因扩增。
[0032]
在一些方面,本发明提供了治疗ahr核阳性的患者的诸如癌症的增殖性病症的方法,所述方法包括给患者施用治疗有效量的例如如本文所述的ahr拮抗剂。在一些实施方案中,患者是例如使用如本文所述的方法确定为ahr核阳性的。在一些实施方案中,治疗方法进一步包括例如使用如本文所述的ihc染色方法测量或确定来自患者的肿瘤样本是否为ahr核阳性。
[0033]
在一些方面,本发明提供了治疗具有ahr基因扩增的患者的诸如癌症的增殖性病症的方法,所述方法包括给患者施用治疗有效量的例如如本文所述的ahr拮抗剂。在一些实施方案中,例如使用如本文所述的方法确定患者具有ahr基因扩增。在一些实施方案中,治疗方法进一步包括例如使用本文所述的任何方法,例如ngs、rnascope或fish,测量或确定来自患者的肿瘤样本是否具有ahr基因扩增。
[0034]
因此,在一个方面,本发明提供了用于对患者的肿瘤组织进行ihc染色的方法,所述方法包括使用ahr单克隆抗体对肿瘤组织切片进行染色。在另一个方面,本发明提供了一种用于鉴定或选择癌症患者的方法,所述方法包括使用如本文所述的ihc染色。在另一个方面,本发明提供了用于治疗癌症的方法,所述方法包括使用如本文所述的ihc染色选择癌症患者,以及施用治疗有效量的如本文所述的ahr抑制剂。
[0035]
2.定义
[0036]
如本文所用,术语“ahr抑制剂”是指抑制生物样本或患者中的a hr活性的化合物或其药学上可接受的盐或其酯。ahr抑制剂,在本文中也称为ahr拮抗剂,可以结合但不激活ahr多肽或编码ahr的多核苷酸,并且该结合破坏相互作用,置换ahr激动剂,并且/或者抑制ahr激动剂的功能。ahr抑制剂或ahr拮抗剂可以包括通过减少细胞中存在的ahr量或通过降低ahr的结合或信号转导活性或生物活性(诸如,通过例如阻断ahr在配体的存在下从细胞质易位到细胞核和/或阻断下游信号转导活动)来降低ahr活性的小分子(有机或无机)、诸如拮抗性抗ahr抗体的蛋白质、核酸、氨基酸、肽、碳水化合物或任何其他化合物或组合物。各种ahr拮抗剂先前已描述于例如wo2017202816a1、wo2018085348a1、wo2018195397、wo2019101642a1、wo2019101643a1、wo2019101641a1、wo2019101647a1、wo2019036657a1、us10570138b2、us10689388b1、us10696650b2、wo2020051207a2、wo2020081636a1和wo 2020081840a1中,该文献中的每一篇的内容均通过引用方式整体并入本文中,并且本文中描述了其他ahr拮抗剂。
[0037]
如本文所用,术语“化合物a”是指下式的ahr抑制剂(r)-n-(2-(5-氟吡啶-3-基)-8-异丙基吡唑并[1,5-a][1,3,5]三嗪-4-基)-2,3,4,9-四氢-1h-咔唑-3-胺:
[0038]
在一些实施方案中,化合物a或其药学上可接受的盐是无定形的。在一些实施方案中,化合物a或其药学上可接受的盐是晶体形式。
[0039]
如本文所用,术语“化合物a的代谢物”是指化合物a代谢后的中间体或终产物。在一些实施方案中,化合物a的代谢物是下式的化合物:
[0040]
(化合物b),或其药学上可接受的盐。在一些实施方案中,化合物a的代谢物是下式的化合物:
[0041]
(化合物c),或其药学上可接受的盐。
[0042]
如本文所用,术语“其前药”是指在代谢后产生所叙述的一种或多种化合物的化合物。在一些实施方案中,化合物a的代谢物的前药是在代谢后产生化合物a的代谢物的化合物。在一些实施方案中,化合物a的代谢物的前药是代谢后产生化合物b或其药学上可接受的盐的化合物。在一些实施方案中,化合物a的代谢物是代谢后产生化合物c或其药学上可接受的盐的化合物。
[0043]
如本文所用,术语“药学上可接受的盐”是指在合理的医学判断范围内适用于与人和低级动物的组织接触使用而没有异常毒性、刺激性、过敏反应等并且与合理的获益/风险比相称的那些盐。药学上可接受的盐是本领域众所周知的。例如,s.m.berge等人在j.pharmaceutical sciences,1977,66,1
–
19中详细描述了药学上可接受的盐,该文献通过引用并入本文。本发明的化合物的药学上可接受的盐包括衍生自合适的无机的酸和碱以及有机的酸和碱的那些盐。药学上可接受的无毒酸加成盐的实例是氨基与诸如盐酸、氢溴酸、磷酸、硫酸和高氯酸的无机酸或者与诸如乙酸、草酸、马来酸、酒石酸、柠檬酸、琥珀酸或丙二酸的有机酸形成或通过使用本领域中使用的诸如离子交换的其他方法形成的盐。其他药学上可接受的盐包括己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二烷基硫酸盐、乙磺酸盐、甲酸盐、富马酸盐、葡庚酸盐、甘油磷酸盐、葡萄糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘酸盐、2-羟基-乙磺酸盐、乳糖醛酸盐(lactobionate)、乳酸盐、月桂酸盐、十二烷基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、
硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、特戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐、十一酸盐、戊酸盐等。
[0044]
衍生自适当碱的盐包括碱金属盐、碱土金属盐、铵盐和n
+
(c1–4烷基)4盐。代表性的碱金属盐或碱土金属盐包括钠盐、锂盐、钾盐、钙盐、镁盐等。进一步的药学上可接受的盐在适当时包括无毒的铵盐、季铵盐和使用诸如卤离子、氢氧根、羧酸根、硫酸根、磷酸根、硝酸根、低级烷基磺酸根和芳基磺酸根的抗衡离子形成的胺阳离子。
[0045]
除非另有说明,本文描述的结构还意在包括该结构的所有异构(例如,对映异构、非对映异构和几何(或构象))形式;例如,针对每个不对称中心的r和s构型、z和e双键异构体,以及z和e构象异构体。因此,本发明化合物的单一立体化学异构体以及对映异构体、非对映异构体和几何异构体(构象异构体)混合物在本发明的范围内。除非另有说明,本发明的化合物的所有互变异构形式都在本发明的范围内。此外,除非另外说明,否则本文所描绘的结构也意在包括这样的化合物,其不同之处仅在于存在一个或多个同位素富集的原子。例如,具有本发明的结构(包括氢被氘或氚代替,或者碳被富含
13
c-或
14
c-的碳代替)的化合物在本发明的范围内。此类化合物可用作例如分析工具、生物测定中的探针或根据本发明的治疗剂。
[0046]
如本文所用,术语“约”或“大约”具有给定值或范围的20%以内的含义。在一些实施方案中,术语“约”是指在给定值的20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%或者1%范围内。
[0047]
如本文所用,术语“增加”、“升高”或“增强”可互换使用,并且涵盖生物功能和/或生物活性和/或浓度和/或量的任何可测量的增加,诸如,例如,ahr核阳性度的增加。例如,增加可以为相对于对照,或者功能或活性或浓度的基线量增加了至少约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约96%、约97%、约98%、约99%、约100%、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍、约10倍、约20倍、约25倍、约50倍、约100倍或更高。
[0048]
如本文所用,术语诸如肿瘤活检物的样本中的物质(例如,核ahr)的“增加的浓度”或“增加的水平”或“增加的量”是指如通过本领域已知的技术确定的,该物质的量相对于一个或多个对照样本(诸如未患有该疾病或病症(例如癌症)的个体或个体组)或内部对照中的该物质的量增加了约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约96%、约97%、约98%、约99%、约100%、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍、约10倍、约20倍、约25倍、约50倍、约100倍或更高。如果物质的浓度相对于样本对照组或样本基线组或患者样本的回顾性分析中物质的均值(平均值)或中值量增加了一个标准偏差、两个标准偏差、三个标准偏差、四个标准偏差、五个标准偏差,或更多个标准偏差,也可确定受试者具有“增加的浓度”或“增加的量”的该物质。如本领域所实践的,此类对照或基线水平可以在样本测量之前预先确定或测量,或者可以从此类对照样本的数据库中获得。换言之,对照样本和受试者样本不必同时进行测试。类似地,“减小的浓度”、“降低的浓度”、“降低的量”、“降低的水平”或“减小的水平”是指相对于对照而言,在样本中的浓度或
水平降低了至少约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约96%、约97%、约98%、约99%或100%。
[0049]
如本文所用,“需要预防”、“需要治疗”或“有此需要”的受试者是指根据适当的医疗执业者(例如,在人的情况下,则为医生、护士或执业护士;在非人类哺乳动物的情况下,则为兽医)的判断,将合理地从给定的治疗或疗法中获益的受试者。
[0050]
如本文所用,术语“治疗(treatment)”、“治疗(treat)”和“治疗(treating)”是指逆转、减轻如本文所述的疾病或病症或其一种或多种症状,延迟如本文所述的疾病或病症或其一种或多种症状的发作,或者抑制如本文所述的疾病或病症或其一种或多种症状的进展。在一些实施方案中,可以在一种或多种症状出现后施用治疗。在其他实施方案中,可以在没有症状的情况下施用治疗。例如,可以在症状发作之前给易感个体施用治疗(例如,根据症状史以及/或者根据遗传或其他易感因素)。在症状消退后也可以继续治疗,例如以预防或延迟它们的复发。
[0051]
如本文所用,术语“患者”是指动物,优选哺乳动物,最优选人。
[0052]
如本文所用,“需要预防”、“需要治疗”或“有此需要”的患者或受试者是指根据适当的医疗执业者(例如,在人的情况下,则为医生、护士或执业护士;在非人类哺乳动物的情况下,则为兽医)的判断,将合理地从给定的治疗或疗法中获益的患者或受试者。
[0053]
如本文所用,术语“治疗有效量”是指有效抑制生物样本或患者中的ahr活性的ahr抑制剂(例如,化合物a或其药学上可接受的盐)的量。在一些实施方案中,“治疗有效量”是指可测量地抑制ahr在配体存在的情况下从细胞质易位到细胞核的ahr抑制剂(例如,化合物a或其药学上可接受的盐)的量。在一些实施方案中,“治疗有效量”是指可测量地置换结合至细胞核中的ahr的内源性配体的ahr抑制剂(例如,化合物a或其药学上可接受的盐)的量。
[0054]
术语“促进癌症消退”意指施用单独的或者与一种或多种另外的抗肿瘤剂组合的有效量的药物导致肿瘤生长或大小减少、肿瘤坏死、至少一种疾病症状的严重程度降低、无疾病症状期的频率和持续时间增加,或预防由于疾病折磨引起的损伤或残疾。此外,关于治疗的术语“有效(的)”和“有效性”包括药理学有效性和生理学安全性二者。药理学有效性是指药物促进患者的癌症消退的能力。生理学安全性是指由施用药物引起的毒性水平,或在细胞、器官和/或生物体水平上的其他不良生理学影响(不良反应)。
[0055]
如本文所用,术语“治疗功效”或“对治疗的反应性”或“治疗获益”或“从疗法获益”是指总生存期、无进展生存期、部分应答、完全应答和总体应答率中的一者或多者的改善,并且还可以包括癌症或肿瘤生长或大小的减少、疾病症状严重程度的降低、无疾病症状期的频率和持续时间的增加,或预防因疾病折磨引起的损伤或残疾。
[0056]
3.示例性方法和用途的描述
[0057]
在一些方面和实施方案中,本发明提供了鉴定或选择呈ahr核阳性并且/或者具有ahr基因扩增的癌症患者以用ahr拮抗剂进行治疗的方法。在一些方面和实施方案中,所述方法包括鉴定或选择ahr核阳性的癌症患者。此类方法可以包括,例如,使用本领域已知的可用方法(诸如,例如ihc染色)确定患者是否为ahr核阳性。在一些方面和实施方案中,所述方法包括鉴定或选择具有ahr基因扩增的癌症患者。在一些实施方案中,所述方法还包括给
ahr核阳性的患者施用ahr拮抗剂,诸如化合物a或其药学上可接受的盐。在一些实施方案中,所述方法还包括给ahr核阳性的患者施用ahr拮抗剂,诸如化合物a的代谢物或其药学上可接受的盐或其前药。
[0058]
在一些实施方案中,本发明提供了用于给患者的肿瘤组织进行ihc染色的方法,所述方法包括使用ahr单克隆抗体给肿瘤组织切片染色。在一些实施方案中,ahr单克隆抗体是ff3399。
[0059]
在一些实施方案中,肿瘤组织切片是带正电荷的载玻片上约4μm厚的组织切片。在一些实施方案中,肿瘤组织切片在带正电荷的载玻片上为约2.0、2.5、3.0、3.5、4.5、5.0、5.5或6.0μm厚。在一些实施方案中,肿瘤组织切片是在约ph 6.0下染色的。在一些实施方案中,肿瘤组织切片是在约ph 5.0、5.5、6.5或7.0下染色的。在一些实施方案中,将肿瘤组织切片染色约40分钟。在一些实施方案中,将肿瘤组织切片染色约20、25、30、35、45、50、55或60分钟。
[0060]
在一些实施方案中,本发明提供了鉴定或选择ahr核阳性的癌症患者的方法,所述方法包括对患者的肿瘤组织进行ihc染色,以及选择ahr核染色阳性的患者。
[0061]
如本文所用,术语“ahr核阳性”是指样本(诸如肿瘤样本)中一定百分比的细胞在细胞核中具有可检测量的ahr。在一些实施方案中,ahr核阳性是指样本中约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约96%、约97%、约98%、约99%或100%的细胞在细胞核中具有可检测量的ahr。如本文所用,术语“ahr核阳性”是指肿瘤活检物核心(tumor biopsy core)中一定百分比的细胞在细胞核中具有可检测量的ahr。在一些实施方案中,ahr核阳性是指肿瘤活检物核心中约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约96%、约97%、约98%、约99%或100%的细胞在细胞核中具有可检测量的ahr。在一些实施方案中,ahr核阳性是指肿瘤活检物核心中约5%或更多的细胞在细胞核中具有可检测量的ahr。在一些实施方案中,ahr核阳性是指肿瘤活检物核心中约20%或更多的细胞在细胞核中具有可检测量的ahr。在一些实施方案中,ahr核阳性是指肿瘤活检物核心中约50%或更多的细胞在细胞核中具有可检测量的ahr。在一些实施方案中,肿瘤活检物核心是指肿瘤活检物核心的肿瘤区域。在一些实施方案中,肿瘤活检物核心是指肿瘤活检物核心的肿瘤微环境(或间质)区域。
[0062]
在一些实施方案中,本发明提供了用于鉴定或选择具有ahr基因扩增的癌症患者的方法,该方法包括测量来自患者的样本(诸如肿瘤样本)中的ahr基因拷贝,以及选择具有ahr基因扩增的患者以用ahr拮抗剂进行治疗。在一些实施方案中,所述方法还包括给具有ahr核基因扩增的患者施用ahr拮抗剂,诸如化合物a或其药学上可接受的盐。在一些实施方案中,所述方法还包括给具有ahr核基因扩增的患者施用ahr拮抗剂,诸如化合物a的代谢物或其药学上可接受的盐或其前药。
[0063]
如本文所用,术语“ahr基因扩增”是指样本(诸如肿瘤样本)中一定百分比的细胞具有可检测量的ahr基因扩增。在一些实施方案中,ahr基因扩增是指样本中约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约96%、约97%、约98%、约99%或100%
的细胞(诸如肿瘤细胞)具有至少约3个ahr拷贝、至少约4个ahr拷贝、至少约5个ahr拷贝、至少约6个ahr拷贝、至少约7个ahr拷贝、至少约8个ahr拷贝、至少约9个ahr拷贝、至少约10个ahr拷贝、至少约11个ahr拷贝、至少约12个ahr拷贝、至少约9个ahr拷贝、至少约10个ahr拷贝、至少约11个ahr拷贝、至少约12个ahr拷贝、至少约13个ahr拷贝、至少约14个ahr拷贝、至少约15个ahr拷贝、至少约20个ahr拷贝或更多个ahr拷贝。在一些实施方案中,ahr基因扩增是指样本中约10%的肿瘤细胞具有至少约15个ahr拷贝。在一些实施方案中,ahr基因扩增是指样本中约40%的肿瘤细胞具有至少约4个ahr拷贝。在一些实施方案中,ahr基因扩增是指样本中约10%的肿瘤细胞具有至少约四个ahr拷贝。
[0064]
测量或确定样本中的ahr基因扩增和ahr过表达(包括细胞核中ahr的过表达,或ahr核染色阳性)的方法和测定法是本领域已知的,并且可以与本文所述的方法一起使用。有多种用于检测在结合至配体后从细胞质易位到细胞核的ahr的量的方法。此类测定法和方法的非限制性实例包括免疫测定法,诸如免疫组织化学、下一代测序(ngs)、rnascope和荧光原位杂交(fish)。
[0065]
在一些实施方案中,下一代测序(ngs)被用于检测ahr基因扩增或检测在结合至配体后从细胞质易位至细胞核的ahr的量。下一代测序(ngs)涵盖使用目标板(targeted panels)进行的dna测序、全外显子组测序和全基因组测序,这些方法允许确定感兴趣基因中的拷贝数变异(cnv)(zhao,bmc bioinformatics 2012)。拷贝数改变包括基因的缺失或扩增。为了检测cnv,从感兴趣的样本中分离出dna,该样本可以是新鲜的或ffpe组织(诸如活检物和血液)以及其他组织。对dna进行扩增和标记以形成文库,然后使该文库运行到ngs测序仪中。然后使用专门设计用于推断cnv的计算算法分析来自测序仪的结果。
[0066]
在一些实施方案中,rnascope被用于检测ahr基因扩增或检测在结合至配体后从细胞质易位至细胞核的ahr的量。rnascope是允许在福尔马林固定、石蜡包埋的组织中进行原位rna分析检测和定量的方法(wand j mol diagn.2012)。rna ish以及特别是rnascope可以被用于量化细胞中给定基因的表达。例如,rnascope在本文中被用于评估来自肿瘤微阵列中的10种肿瘤类型(胰腺癌、结肠癌、肾癌、头颈癌、黑素瘤、前列腺癌、肺癌、卵巢癌症、膀胱癌和乳腺癌)的癌细胞系和免疫细胞中的ahr mrna表达。使用计算软件(halo)扫描和分析图像。这种方法是适合于根据h分数确定肿瘤细胞和肿瘤微环境中的ahr表达。
[0067]
在一些实施方案中,荧光原位杂交(fish)被用于检测ahr基因扩增或检测在结合至配体后从细胞质易位至细胞核的ahr的量。例如,细胞是从生物样本(诸如ffpe样本)获得,并将该细胞与对ahr有特异性的探针组杂交。捕获探针信号并查看倒置dapi图像。如果满足各种标准,则可以将样本视为对ahr扩增呈阳性。例如,≥10%的肿瘤细胞≥15个ahr拷贝、≥40%的肿瘤细胞≥4个ahr拷贝和/或≥10%的肿瘤细胞≥4个ahr拷贝(簇)。
[0068]
在一些实施方案中,免疫组织化学(ihc)染色测定被用于检测在结合至配体后从细胞质易位至细胞核的ahr的量。在一些实施方案中,免疫组织化学(ihc)染色测定被用于检测ahr基因扩增。ihc是使用抗体检查组织样本中诸如ahr的某些抗原(标志物)的方法。抗体通常连接到酶或荧光染料。在抗体结合至组织样本中的抗原后,酶或染料被激活,然后可以在显微镜下观察到抗原。
[0069]
在一些实施方案中,ihc染色测定如本文实施例1中所述。因此,在一些实施方案中,ahr核阳性是指在ihc染色测定中的ahr核染色阳性。在一些实施方案中,ahr核染色阳性
是指肿瘤活检物核心中有可检测数量的细胞在ihc染色测定中染色呈阳性。在一些实施方案中,ahr核染色阳性是指肿瘤活检物核心中约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约96%、约97%、约98%、约99%或100%的细胞在ihc染色测定中染色呈阳性。
[0070]
在一些实施方案中,肿瘤活检物核心是指肿瘤活检物核心的肿瘤区域。在一些实施方案中,肿瘤活检物核心是指肿瘤活检物核心的肿瘤微环境(或间质)区域。
[0071]
在一些实施方案中,ihc染色测定包括测量肿瘤活检物核心中的染色强度。在ihc染色测定中,有多种方法来测量染色强度。在一些实施方案中,染色强度是通过如本文实施例1中描述的方法来测量的。在一些实施方案中,染色强度是通过视觉评分例如通过使用常规光学显微镜的手动评分来测量的。在一些实施方案中,染色强度是通过计算组织分析(cta)评分测量的。染色强度水平可以是无染色(0)、弱染色(1+)、中等染色(2+)或强染色(3+)。在一些实施方案中,染色阳性是指所有染色强度(包括1+、2+和3+强度)。在一些实施方案中,染色阳性是指合并的2+和3+染色强度(包括2+和3+强度)。在一些实施方案中,染色强度是在肿瘤活检物核心的肿瘤区域中测量的。在一些实施方案中,染色强度是在肿瘤活检物核心的肿瘤微环境(或间质)区域中测量的。
[0072]
如本文所述,ihc染色显示ahr核阳性患者的百分比在不同类型的癌症中有显著差异。因此,在ahr抑制剂治疗之前选择ahr核阳性患者可能对某些类型的癌症特别有益。在一些实施方案中,本发明提供了选择特定癌症类型的ahr核阳性患者的方法。在一些实施方案中,所述特定癌症类型选自膀胱癌、黑素瘤、卵巢癌症和hnscc。
[0073]
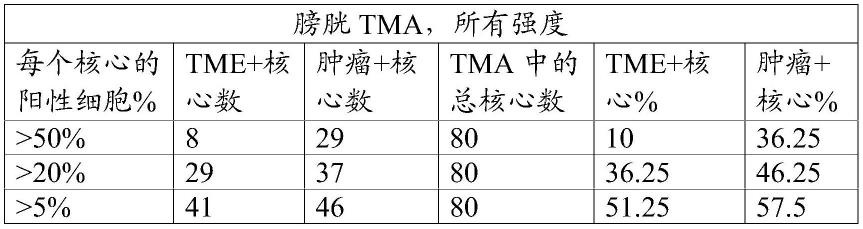
在一些实施方案中,选择ahr核阳性患者的方法用于选择膀胱癌患者。在一些实施方案中,ihc染色显示一定百分比的膀胱癌是ahr核阳性,如下表1和6中所示。在一些实施方案中,ihc染色显示约58%的膀胱癌患者的在肿瘤活检物核心的肿瘤区域中的约5%或更多的细胞根据cta评分在所有强度(包括1+、2+和3+强度)下都为ahr核染色阳性。在一些实施方案中,ihc染色显示约46%的膀胱癌患者的在肿瘤活检物核心的肿瘤区域中的约20%或更多的细胞根据cta评分在所有强度下都为ahr核染色阳性。在一些实施方案中,ihc染色显示约36%的膀胱癌患者的在肿瘤活检物核心的肿瘤区域中的约50%或更多的细胞根据cta评分在所有强度下都为ahr核染色阳性。在一些实施方案中,ihc染色显示约51%的膀胱癌患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约5%或更多的细胞根据cta评分在所有强度下都为ahr核染色阳性。在一些实施方案中,ihc染色显示约36%的膀胱癌患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约20%或更多的细胞根据cta评分在所有强度下都为ahr核染色阳性。在一些实施方案中,ihc染色显示约10%的膀胱癌患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约50%或更多的细胞根据cta评分在所有强度下都为ahr核染色阳性。
[0074]
在一些实施方案中,ihc染色显示约45%的膀胱癌患者的在肿瘤活检物核心的肿瘤区域中的约5%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约35%的膀胱癌患者的在肿瘤活检物核心的肿瘤区域中的约20%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约21%的膀胱癌患者的在肿瘤活检物核心的肿瘤区域中的约
50%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约43%的膀胱癌患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约5%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约20%的膀胱癌患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约20%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约1%的膀胱癌患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约50%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。
[0075]
在一些实施方案中,选择ahr核阳性患者的方法用于选择黑素瘤患者。在一些实施方案中,ihc染色显示一定百分比的黑素瘤是ahr核阳性,如下表2、3、7和8中所示。在一些实施方案中,ihc染色显示约11-20%的黑素瘤患者的在肿瘤活检物核心的肿瘤区域中的约5%或更多的细胞根据cta评分在所有强度下都为ahr核染色阳性。在一些实施方案中,ihc染色显示约5-13%的黑素瘤患者的在肿瘤活检物核心的肿瘤区域中的约20%或更多的细胞根据cta评分在所有强度下都为ahr核染色阳性。在一些实施方案中,ihc染色显示约1-3%的黑素瘤患者的在肿瘤活检物核心的肿瘤区域中的约50%或更多的细胞根据cta评分在所有强度下都为ahr核染色阳性。在一些实施方案中,ihc染色显示约9-11%的黑素瘤患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约5%或更多的细胞根据cta评分在所有强度下都为ahr核染色阳性。在一些实施方案中,ihc染色显示约3-5%的黑素瘤患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约20%或更多的细胞根据cta评分在所有强度下都为ahr核染色阳性。在一些实施方案中,ihc染色显示约6-16%的黑素瘤患者的在肿瘤活检物核心的肿瘤区域中的约5%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约3-8%的黑素瘤患者的在肿瘤活检物核心的肿瘤区域中的约20%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约3%的黑素瘤患者的在肿瘤活检物核心的肿瘤区域中的约50%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约5-9%的黑素瘤患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约5%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约3%的黑素瘤患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约20%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。
[0076]
在一些实施方案中,选择ahr核阳性患者的方法用于选择卵巢癌症患者。在一些实施方案中,ihc染色显示一定百分比的卵巢癌症是ahr核阳性,如下表4和9中所示。在一些实施方案中,ihc染色显示约10%的卵巢癌症患者的在肿瘤活检物核心的肿瘤区域中的约5%或更多的细胞根据cta评分在所有强度下都为ahr核染色阳性。在一些实施方案中,ihc染色显示约10%的卵巢癌症患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约5%或更多的细胞根据cta评分在所有强度下都为ahr核染色阳性。在一些实施方案中,ihc染色显示约3%的卵巢癌症患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约20%或更多的细胞根据cta评分在所有强度下都为ahr核染色阳性。在一些实施方案中,ihc染色显示约6%的卵巢癌症患者的在肿瘤活检物核心的肿瘤区域中的约5%或更多的细胞根据cta评
分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约3%的卵巢癌症患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约5%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约3%的卵巢癌症患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约20%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。
[0077]
在一些实施方案中,选择ahr核阳性患者的方法用于选择hnscc患者。在一些实施方案中,ihc染色显示一定百分比的hnscc是ahr核阳性,如下表5和10中所示。在一些实施方案中,ihc染色显示约28%的hnscc患者的在肿瘤活检物核心的肿瘤区域中的约5%或更多的细胞根据cta评分在所有强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约21%的hnscc患者的在肿瘤活检物核心的肿瘤区域中的约20%或更多的细胞根据cta评分在所有强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约8%的hnscc患者的在肿瘤活检物核心的肿瘤区域中的约50%或更多的细胞根据cta评分在所有强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约29%的hnscc患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约5%或更多的细胞根据cta评分在所有强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约13%的hnscc患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约20%或更多的细胞根据cta评分在所有强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约1%的hnscc患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约50%或更多的细胞根据cta评分在所有强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约25%的hnscc患者的在肿瘤活检物核心的肿瘤区域中的约5%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约13%的hnscc患者的在肿瘤活检物核心的肿瘤区域中的约20%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约3%的hnscc患者的在肿瘤活检物核心的肿瘤区域中的约50%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约21%的hnscc患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约5%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。在一些实施方案中,ihc染色显示约4%的hnscc患者的在肿瘤活检物核心的肿瘤微环境(或间质)区域中的约20%或更多的细胞根据cta评分在合并的2+和3+染色强度下为ahr核染色阳性。
[0078]
在一些实施方案中,本发明提供了选择ahr核阳性患者的方法,所述方法包括选择h分数等于或高于该癌症类型的均值的癌症患者。在一些实施方案中,来自膀胱癌、黑素瘤、卵巢癌症和hnscc的ihc染色的h分数和均值如图6所示。在一些实施方案中,本发明提供了选择ahr核阳性患者的方法,所述方法包括选择h分数等于或高于如图6所示的膀胱癌平均h分数的患者。在一些实施方案中,本发明提供了选择ahr核阳性患者的方法,所述方法包括选择h分数等于或高于如图6所示的黑素瘤平均h分数的患者。在一些实施方案中,本发明提供了选择ahr核阳性患者的方法,所述方法包括选择h分数等于或高于如图6所示的卵巢癌症平均h分数的患者。在一些实施方案中,本发明提供了选择ahr核阳性患者的方法,所述方法包括选择h分数等于或高于如图6所示的hnscc平均h分数的患者。在一些实施方案中,本发明提供了治疗患者癌症的方法,所述方法包括选择ahr核阳性的患者,以及向所述患者施用治疗有效量的ahr抑制剂或其药物组合物。在一些实施方案中,癌症是膀胱癌。在一些实
施方案中,膀胱癌是移行细胞癌(tcc)。在一些实施方案中,癌症是黑素瘤。在一些实施方案中,癌症是卵巢癌症。在一些实施方案中,癌症是hnscc。
[0079]
在一些实施方案中,本发明提供了治疗患者癌症的方法,所述方法包括选择根据如本文所述的ihc染色测定为ahr核阳性的患者,以及给患者施用治疗有效量如本文所述的ahr抑制剂或其药物组合物。
[0080]
在一些实施方案中,本发明提供了治疗患者的癌症的方法,所述方法包括选择在肿瘤活检物核心的肿瘤区域中的约5%或更多的细胞根据cta评分在所有强度或合并的2+和3+染色强度下为ahr核染色阳性的患者,以及给该患者施用治疗有效量的如本文所述的ahr抑制剂或其药物组合物。
[0081]
在一些实施方案中,本发明提供了治疗患者的癌症的方法,所述方法包括选择在肿瘤活检物核心的肿瘤区域中的约20%或更多的细胞根据cta评分在所有强度或合并的2+和3+染色强度下为ahr核染色阳性的患者,以及给该患者施用治疗有效量的如本文所述的ahr抑制剂或其药物组合物。
[0082]
在一些实施方案中,本发明提供了治疗患者的癌症的方法,所述方法包括选择在肿瘤活检物核心的肿瘤区域中的约50%或更多的细胞根据cta评分在所有强度或合并的2+和3+染色强度下为ahr核染色阳性的患者,以及给该患者施用治疗有效量的如本文所述的ahr抑制剂或其药物组合物。
[0083]
在一些实施方案中,ahr抑制剂选自如wo2017202816a1、wo2018085348a1、wo2018195397、wo2019101642a1、wo2019101643a1、wo2019101641a1、wo2019101647a1、wo2019036657a1、us10570138b2、us10689388b1、us10696650b2、wo2020051207a2、wo2020081636a1和wo2020081840a1中所述的化合物。
[0084]
在一些实施方案中,ahr抑制剂选自如wo2018195397、us20180327411、wo2019036657和wo2020081636a1中描述的化合物,其中每一者的内容都通过引用方式以其整体并入本文。
[0085]
在一些实施方案中,ahr抑制剂选自如wo2018195397、us20180327411和pct/us2019/056455中描述的化合物,其中每一者的内容都通过引用方式以其整体并入本文。
[0086]
在一些实施方案中,ahr抑制剂是化合物a或其药学上可接受的盐。在一些实施方案中,ahr抑制剂是化合物a的代谢物或其药学上可接受的盐或其前药。在一些实施方案中,ahr抑制剂是化合物b或其药学上可接受的盐或其前药。在一些实施方案中,ahr抑制剂是化合物c或其药学上可接受的盐或其前药。
[0087]
在一些实施方案中,本发明提供了治疗患者的膀胱癌的方法,所述方法包括:
[0088]
对患者的肿瘤组织进行ihc染色;
[0089]
选择在肿瘤活检物核心的肿瘤区域中的约5%或更多的细胞根据cta评分在所有染色强度(包括1+、2+和3+强度)或在合并的2+和3+染色强度下为ahr核染色阳性的患者;和
[0090]
给患者施用治疗有效量的化合物a或其药学上可接受的盐。
[0091]
在一些实施方案中,本发明提供了治疗患者的膀胱癌的方法,所述方法包括:
[0092]
对患者的肿瘤组织进行ihc染色;
[0093]
选择在肿瘤活检物核心的肿瘤区域中的约20%或更多的细胞根据cta评分在所有染色强度(包括1+、2+和3+强度)或在合并的2+和3+染色强度下为ahr核染色阳性的患者;和
[0094]
给患者施用治疗有效量的化合物a或其药学上可接受的盐。
[0095]
在一些实施方案中,本发明提供了治疗患者的膀胱癌的方法,所述方法包括:
[0096]
对患者的肿瘤组织进行ihc染色;
[0097]
选择在肿瘤活检物核心的肿瘤区域中的约50%或更多的细胞根据cta评分在所有染色强度(包括1+、2+和3+强度)或在合并的2+和3+染色强度下为ahr核染色阳性的患者;和
[0098]
给患者施用治疗有效量的化合物a或其药学上可接受的盐。
[0099]
在一些实施方案中,本发明提供了治疗患者的hnscc的方法,所述方法包括:
[0100]
对患者的肿瘤组织进行ihc染色;
[0101]
选择在肿瘤活检物核心的肿瘤区域中的约5%或更多的细胞根据cta评分在所有染色强度(包括1+、2+和3+强度)或在合并的2+和3+染色强度下为ahr核染色阳性的患者;和
[0102]
给患者施用治疗有效量的化合物a或其药学上可接受的盐。
[0103]
在一些实施方案中,本发明提供了治疗患者的hnscc的方法,所述方法包括:
[0104]
对患者的肿瘤组织进行ihc染色;
[0105]
选择在肿瘤活检物核心的肿瘤区域中的约20%或更多的细胞根据cta评分在所有染色强度(包括1+、2+和3+强度)或在合并的2+和3+染色强度下为ahr核染色阳性的患者;和
[0106]
给患者施用治疗有效量的化合物a或其药学上可接受的盐。
[0107]
在一些实施方案中,本发明提供了治疗患者的hnscc的方法,所述方法包括:
[0108]
对患者的肿瘤组织进行ihc染色;
[0109]
选择在肿瘤活检物核心的肿瘤区域中的约50%或更多的细胞根据cta评分在所有染色强度(包括1+、2+和3+强度)或在合并的2+和3+染色强度下为ahr核染色阳性的患者;和
[0110]
给患者施用治疗有效量的化合物a或其药学上可接受的盐。
[0111]
在一些实施方案中,本发明提供了治疗患者的卵巢癌症的方法,所述方法包括:
[0112]
对患者的肿瘤组织进行ihc染色;
[0113]
选择在肿瘤活检物核心的肿瘤区域中的约5%或更多的细胞根据cta评分在所有染色强度(包括1+、2+和3+强度)或在合并的2+和3+染色强度下为ahr核染色阳性的患者;和
[0114]
给患者施用治疗有效量的化合物a或其药学上可接受的盐。
[0115]
在一些实施方案中,本发明提供了治疗患者的卵巢癌症的方法,所述方法包括:
[0116]
对患者的肿瘤组织进行ihc染色;
[0117]
选择在肿瘤活检物核心的肿瘤区域中的约20%或更多的细胞根据cta评分在所有染色强度(包括1+、2+和3+强度)或在合并的2+和3+染色强度下为ahr核染色阳性的患者;和
[0118]
给患者施用治疗有效量的化合物a或其药学上可接受的盐。
[0119]
在一些实施方案中,本发明提供了治疗患者的卵巢癌症的方法,所述方法包括:
[0120]
对患者的肿瘤组织进行ihc染色;
[0121]
选择在肿瘤活检物核心的肿瘤区域中的约50%或更多的细胞根据cta评分在所有染色强度(包括1+、2+和3+强度)或在合并的2+和3+染色强度下为ahr核染色阳性的患者;和
[0122]
给患者施用治疗有效量的化合物a或其药学上可接受的盐。
[0123]
在一些实施方案中,本发明提供了治疗患者的黑素瘤的方法,所述方法包括:
[0124]
对患者的肿瘤组织进行ihc染色;
[0125]
选择在肿瘤活检物核心的肿瘤区域中的约5%或更多的细胞根据cta评分在所有
染色强度(包括1+、2+和3+强度)或在合并的2+和3+染色强度下为ahr核染色阳性的患者;和
[0126]
给患者施用治疗有效量的化合物a或其药学上可接受的盐。
[0127]
在一些实施方案中,本发明提供了治疗患者的黑素瘤的方法,所述方法包括:
[0128]
对患者的肿瘤组织进行ihc染色;
[0129]
选择在肿瘤活检物核心的肿瘤区域中的约20%或更多的细胞根据cta评分在所有染色强度(包括1+、2+和3+强度)或在合并的2+和3+染色强度下为ahr核染色阳性的患者;和
[0130]
给患者施用治疗有效量的化合物a或其药学上可接受的盐。
[0131]
在一些实施方案中,本发明提供了治疗患者的黑素瘤的方法,所述方法包括:
[0132]
对患者的肿瘤组织进行ihc染色;
[0133]
选择在肿瘤活检物核心的肿瘤区域中的约50%或更多的细胞根据cta评分在所有染色强度(包括1+、2+和3+强度)或在合并的2+和3+染色强度下为ahr核染色阳性的患者;和
[0134]
给患者施用治疗有效量的化合物a或其药学上可接受的盐。
[0135]
4.制剂和施用
[0136]
在一些实施方案中,本文所述的方法包括施用药物组合物,所述药物组合物包含如本文所述的ahr抑制剂和药学上可接受的载体、佐剂或媒介物。在一些实施方案中,组合物中ahr抑制剂的量使得可有效地可测量地阻断生物样本中或患者中ahr在配体的存在下从细胞质易位到细胞核。在一些实施方案中,ahr抑制剂组合物被配制用于经口施用给患者。
[0137]
术语“药学上可接受的载体、佐剂或媒介物”是指这样的无毒载体、佐剂或媒介物,该无毒载体、佐剂或媒介物不破坏与其一起配制的化合物的药理学活性。可用于本发明的药物组合物中的药学上可接受的载体、佐剂或媒介物包括但不限于离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白如人血清白蛋白、缓冲物质如磷酸盐、甘氨酸、山梨酸、山梨酸钾、饱和植物脂肪酸的部分甘油酯混合物、水、盐或电解质例如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶体二氧化硅、三硅酸镁、聚乙烯吡咯烷酮、纤维素基物质、聚乙二醇、羧甲基纤维素钠、聚丙烯酸酯、蜡、聚乙烯-聚氧丙烯嵌段聚合物、聚乙二醇和羊毛脂。
[0138]
本发明的组合物可经口、胃肠外、通过雾化吸入、局部地、经直肠、经鼻、经颊、阴道或经由植入的贮库施用。如本文中所用的术语“肠胃外”包括皮下、静脉内、肌肉内、关节内、滑膜内、胸骨内、鞘内、肝内、病灶内及颅内注射或输注技术。优选地,组合物经口、腹膜内或静脉内施用。
[0139]
本公开的组合物的无菌可注射形式可为水性或油性悬浮液。这些悬浮液可根据本领域中已知的技术使用合适的分散剂或湿润剂和悬浮剂来配制。无菌可注射制品也可为在无毒肠胃外可接受的稀释剂或溶剂中的无菌可注射溶液或悬浮液,例如为在1,3-丁二醇中的溶液。在可接受的媒介物和溶剂中,可采用水、林格氏溶液(ringer’s solution)以及等渗氯化钠溶液。此外,无菌、不挥发性油通常用作为溶剂或悬浮介质。
[0140]
为达成此目的,包括合成的单甘油酯或二甘油酯在内的任何温和的不挥发性油均可被使用。脂肪酸诸如油酸及其甘油酯衍生物可用于制备注射剂,天然的药学上可接受的油,如橄榄油或蓖麻油(尤其是呈其聚氧乙烯化的形式)也可用于制备注射剂。这些油溶液或悬浮液还可含有长链醇稀释剂或分散剂,如羧甲基纤维素或通常用于配制药学上可接受的剂型(包括乳液和悬浮液)的类似分散剂。其他通常使用的表面活性剂,诸如吐温
(tween)、司盘(span)和其他通常用于制造药学上可接受的固体、液体或其他剂型的乳化剂或生物利用度增强剂也可用于配制目的。
[0141]
本发明的药学上可接受的组合物可以任何经口可接受的剂型经口施用,所述经口可接受的剂型包括但不限于胶囊、片剂、水性悬浮液或溶液。在用于经口使用的片剂的情况下,常用的载体包括乳糖和玉米淀粉。通常还添加润滑剂诸如硬脂酸镁。对于以胶囊形式经口施用,有用的稀释剂包括乳糖和经干燥的玉米淀粉。当水性悬浮液需经口使用时,将活性成分与乳化剂和悬浮剂组合在一起。如果需要,也可添加某些甜味剂、调味剂或着色剂。
[0142]
替代地,本发明的药学上可接受的组合物可以以用于直肠施用的栓剂的形式施用。这些组合物可以通过将该剂与合适的无刺激性赋形剂混合来制备,在赋形剂在室温下为固体但在直肠温度下为液体,因此将在直肠中融化从而释放该剂。此类材料包括可可脂、蜂蜡和聚乙二醇。
[0143]
本发明的药学上可接受的组合物还可局部施用,尤其当治疗靶标包括局部施用容易达到的区域或器官(包括眼、皮肤或下肠道的疾病)时更是如此。很容易针对这些区域或器官中的每一者制备合适的局部制剂。
[0144]
下肠道的局部施用可以以直肠栓剂制剂(参见上文)或以合适的灌肠制剂实现。还可使用局部的经皮贴剂。
[0145]
对于局部施用而言,可将提供的药学上可接受的组合物配制成含有悬浮或溶解于一种或多种载体中的活性组分的合适膏剂。用于本发明化合物的局部施用的载体包括但不限于矿物油、液体凡士林、白凡士林、丙二醇、聚氧乙烯、聚氧丙烯化合物、乳化蜡和水。替代地,可将药学上可接受的组合物配制成含有悬浮或溶解于一种或多种药学上可接受的载体中的活性组分的合适洗剂或霜剂。合适的载体包括但不限于矿物油、单硬脂酸脱水山梨糖醇酯、聚山梨酯60、鲸蜡基酯蜡、鲸蜡硬脂醇、2-辛基十二烷醇、苄醇和水。
[0146]
对于眼科应用而言,可将提供的药学上可接受的组合物在等渗的、ph调节的无菌盐水中配制成微粉化悬浮液,或者优选地,在使用或不使用诸如氯苄烷铵的防腐剂的情况下,在等渗的、ph调节的无菌盐水中配制成溶液。替代地,对于眼科使用而言,可将药学上可接受的组合物配制成诸如凡士林的膏剂。
[0147]
本发明的药学上可接受的组合物还可以通过鼻气雾剂或吸入施用。根据药物配制领域中熟知的技术制备此类组合物,并且可采用苄醇或其他合适的防腐剂、增强生物利用率的吸收促进剂、碳氟化合物和/或其他常规增溶或分散剂将此类组合物制备成在生理盐水中的溶液。
[0148]
最优选地,本发明的药学上可接受的组合物被配制用于经口施用。此类制剂可以在随食物或不随食物施用。在一些实施方案中,本发明的药学上可接受的组合物不随食物施用。在其他实施方案中,本发明的药学上可接受的组合物随食物施用。
[0149]
可与载体物质组合以产生呈单一剂型的组合物的本发明化合物的量将根据所治疗的宿主、特定的施用模式而变化。优选地,提供的组合物应当被配制成使得介于0.01-100mg/kg体重/天之间的剂量的抑制剂可被施用于接受这些组合物的患者。应当理解,对任何特殊患者的特殊剂量和治疗方案将取决于多个因素,包括所用特定化合物的活性、年龄、体重、健康状况、性别、饮食、施用时间、排泄率、药物组合、治疗医生的判断和正在治疗的特定疾病的严重程度。所述组合物中的本发明化合物的量还将取决于所述组合物中的特定化
合物。
[0150]
在一些实施方案中,本发明的方法包括每天给患者施用约100-2000mg的化合物a或其药学上可接受的盐。在一些实施方案中,本发明的方法包括每天给患者施用约150-1800mg的化合物a或其药学上可接受的盐。在一些实施方案中,本发明的方法包括每天给患者施用约200-1600mg的化合物a或其药学上可接受的盐。
[0151]
在一些实施方案中,本发明的方法包括每天给患者施用约200mg的化合物a或其药学上可接受的盐。在一些实施方案中,本发明的方法包括每天给患者施用约400mg的化合物a或其药学上可接受的盐。在一些实施方案中,本发明的方法包括每天给患者施用约600mg的化合物a或其药学上可接受的盐。在一些实施方案中,本发明的方法包括每天给患者施用约800mg的化合物a或其药学上可接受的盐。在一些实施方案中,本发明的方法包括每天给患者施用约1000mg的化合物a或其药学上可接受的盐。在一些实施方案中,本发明的方法包括每天给患者施用约1200mg的化合物a或其药学上可接受的盐。在一些实施方案中,本发明的方法包括每天给患者施用约1400mg的化合物a或其药学上可接受的盐。在一些实施方案中,本发明的方法包括每天给患者施用约1600mg的化合物a或其药学上可接受的盐。在一些实施方案中,本发明的方法包括施用化合物a的制剂或单位剂型,每天一次。在一些实施方案中,本发明的方法包括施用化合物a的制剂或单位剂型,每天两次。在一些实施方案中,本发明的方法包括施用化合物a的制剂或单位剂型,每天三次。在一些实施方案中,本发明的方法包括施用化合物a的制剂或单位剂型,每天四次。
[0152]
在一些实施方案中,在每天给患者施用约1200mg化合物a或其药学上可接受的盐的情况下,给药是每天两次或bid,即两次分开的约600mg的剂量。在一些实施方案中,在每天给患者施用约1200mg化合物a或其药学上可接受的盐的情况下,给药是每天三次或tid,即三次分开的约400mg的剂量。在一些实施方案中,在每天给患者施用约1200mg化合物a或其药学上可接受的盐的情况下,给药是每天四次或qid,即四次分开的约300mg的剂量。
[0153]
在一些实施方案中,在每天给患者施用约1600mg化合物a或其药学上可接受的盐的情况下,给药是每天两次或bid,即两次分开的约800mg的剂量。在一些实施方案中,在每天给患者施用约1600mg化合物a或其药学上可接受的盐的情况下,给药是每天三次或tid,即三次分开的约533mg的剂量。在一些实施方案中,在每天给患者施用约1600mg化合物a或其药学上可接受的盐的情况下,给药是每天四次或qid,即四次分开的约400mg的剂量。
[0154]
5.用途
[0155]
在一些方面和实施方案中,本发明提供了治疗患者的诸如癌症的增殖性病症的方法,所述方法包括例如使用如本文所述的方法选择ahr核阳性的患者,以及给患者施用治疗有效量的例如如本文所述的ahr拮抗剂。在一些实施方案中,治疗方法进一步包括例如使用如本文所述的ihc染色方法测量或确定来自患者的肿瘤样本是否为ahr核阳性。
[0156]
在一些方面和实施方案中,本发明提供了治疗患者的诸如癌症的增殖性病症的方法,所述方法包括例如使用如本文所述的方法选择具有ahr基因扩增的患者,以及给患者施用治疗有效量的例如如本文所述的ahr拮抗剂。在一些实施方案中,治疗方法进一步包括例如使用本文所述的任何方法,例如ngs、rnascope或fish,测量或确定来自患者的肿瘤样本是否具有ahr基因扩增。
[0157]
在一些方面和实施方案中,本发明提供了治疗ahr核阳性的患者的诸如癌症的增
tumor)、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、卵巢癌症、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝细胞瘤(hepatoma)、胆管癌(nile duct carcinoma)、绒毛膜癌、精原细胞瘤、胚胎性癌、肾母细胞瘤(wilm's tumor)、宫颈癌、子宫癌、睾丸癌、肺癌、小细胞肺癌、膀胱癌、上皮癌、胶质瘤、星形细胞瘤、多形性胶质母细胞瘤(gbm,也称为胶质母细胞瘤)、髓母细胞瘤、颅咽管瘤(crailiopharyngioma)、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质瘤(oligodenroglioma)、施旺氏细胞瘤(schwannoma)、神经纤维肉瘤、脑膜瘤、黑素瘤、神经母细胞瘤和视网膜母细胞瘤)。
[0166]
在一些实施方案中,所述癌症是胶质瘤、星形细胞瘤、多形性胶质母细胞瘤(gbm,也称为胶质母细胞瘤)、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质瘤、施旺氏细胞瘤、神经纤维肉瘤、脑膜瘤、黑素瘤、神经母细胞瘤或视网膜母细胞瘤。
[0167]
在一些实施方案中,所述癌症是听神经瘤、星形细胞瘤(例如i度-毛细胞型星形细胞瘤、ii度-低度星形细胞瘤、iii度-间变性星形细胞瘤或iv度-胶质母细胞瘤(gbm)、脊索瘤、cns淋巴瘤、颅咽管瘤、脑干胶质瘤、室管膜瘤,混合性胶质瘤、视神经胶质瘤、室管膜下瘤、髓母细胞瘤、脑膜瘤、转移性脑瘤、少突胶质瘤、垂体瘤、原始神经外胚层(pnet)肿瘤或施旺氏细胞瘤。在一些实施方案中,所述癌症是在儿童中比在成人中更常见的类型,诸如脑干胶质瘤、颅咽管瘤、室管膜瘤、幼年毛细胞型星形细胞瘤(jpa)、髓母细胞瘤、视神经胶质瘤、松果体瘤、原始神经外胚层肿瘤(pnet)或横纹肌样瘤。在一些实施方案中,患者是成年人。在一些实施方案中,患者是儿童或儿科患者。
[0168]
在另一个实施方案中,癌症包括但不限于间皮瘤、肝胆(肝和胆管)癌、骨癌、胰腺癌、皮肤癌、头颈部癌、皮肤或眼内黑素瘤、卵巢癌症、结肠癌、直肠癌、肛门区癌、胃癌、胃肠道(胃、结直肠和十二指肠)癌、子宫癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、霍奇金病、食管癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤,尿道癌、阴茎癌、前列腺癌、睾丸癌、慢性或急性白血病、慢性髓系白血病、淋巴细胞性淋巴瘤、膀胱癌、肾癌或输尿管癌、肾细胞癌、肾盂癌、非霍奇金淋巴瘤、脊髓轴肿瘤、脑干胶质瘤、垂体腺瘤、肾上腺皮质癌、胆囊癌、多发性骨髓瘤、胆管癌、纤维肉瘤、神经母细胞瘤、视网膜母细胞瘤,或前述癌症中一种或多种的组合。
[0169]
在一些实施方案中,所述癌症选自肝细胞癌、卵巢癌症、卵巢上皮癌或输卵管癌;乳头状浆液性囊腺癌或子宫乳头状浆液性癌(upsc);前列腺癌;睾丸癌;胆囊癌;肝胆管细胞癌;软组织和骨滑膜肉瘤;横纹肌肉瘤;骨肉瘤;软骨肉瘤;尤文肉瘤;间变性甲状腺癌;肾上腺皮质腺瘤;胰腺癌;胰腺导管癌或胰腺腺癌;胃肠/胃(gist)癌;淋巴瘤;头颈部鳞状细胞癌(scchn);涎腺癌;胶质瘤或脑癌;神经纤维瘤病-1相关的恶性周围神经鞘瘤(mpnst);瓦尔登斯特伦(waldenstrom)巨球蛋白血症;或髓母细胞瘤。
[0170]
在一些实施方案中,所述癌症选自肝细胞癌(hcc)、肝母细胞瘤、结肠癌、直肠癌、卵巢癌症、卵巢上皮癌、输卵管癌、乳头状浆液性囊腺癌、子宫乳头状浆液癌(upsc)、肝胆管细胞癌、软组织和骨滑膜肉瘤、横纹肌肉瘤、骨肉瘤、间变性甲状腺癌、肾上腺皮质腺瘤、胰腺癌、胰腺导管癌、胰腺腺癌、胶质瘤、神经纤维瘤病-1相关恶性周围神经鞘瘤(mpnst)、瓦尔登斯特伦巨球蛋白血症或髓母细胞瘤。
[0171]
在一些实施方案中,所述癌症是实体瘤,诸如肉瘤、癌或淋巴瘤。实体瘤一般包含组织的异常肿块,其通常不包括囊肿或液体区域。在一些实施方案中,所述癌症选自肾细胞癌或肾癌;肝细胞癌(hcc)或肝母细胞瘤或肝癌;黑素瘤;乳腺癌;结肠直肠癌或结肠直肠癌症;结肠癌;直肠癌;肛门癌;肺癌,诸如非小细胞肺癌(nsclc)或小细胞肺癌(sclc);卵巢癌症、卵巢上皮癌、卵巢癌或输卵管癌;乳头状浆液性囊腺癌或子宫乳头状浆液性癌(upsc);前列腺癌;睾丸癌;胆囊癌;肝胆管细胞癌;软组织和骨滑膜肉瘤;横纹肌肉瘤;骨肉瘤;软骨肉瘤;尤文肉瘤;间变性甲状腺癌;肾上腺皮质癌;胰腺癌;胰腺导管癌或胰腺腺癌;胃肠/胃(gist)癌;淋巴瘤;头颈部鳞状细胞癌(scchn);涎腺癌;胶质瘤或脑癌;神经纤维瘤病-1相关恶性周围神经鞘膜瘤(mpnst);瓦尔登斯特伦巨球蛋白血症;或髓母细胞瘤。
[0172]
在一些实施方案中,所述癌症选自肾细胞癌、肝细胞癌(hcc)、肝母细胞瘤、结肠直肠癌、结肠直肠癌症、结肠癌、直肠癌、肛门癌、卵巢癌症、卵巢上皮癌、卵巢癌、输卵管癌、乳头状浆液性囊腺癌、子宫乳头状浆液性癌(upsc)、肝胆管细胞癌、软组织和骨滑膜肉瘤、横纹肌肉瘤、骨肉瘤、软骨肉瘤、间变性甲状腺癌、肾上腺皮质癌、胰腺癌、胰腺导管癌、胰腺腺癌、胶质瘤、脑癌、神经纤维瘤病-1相关恶性外周神经鞘膜瘤(mpnst)、瓦尔登斯特伦巨球蛋白血症或髓母细胞瘤。
[0173]
在一些实施方案中,所述癌症选自肝细胞癌(hcc)、肝母细胞瘤、结肠癌、直肠癌、卵巢癌症、卵巢上皮癌、卵巢癌、输卵管癌、乳头状浆液性囊腺癌、子宫乳头状浆液癌(upsc)、肝胆管细胞癌、软组织和骨滑膜肉瘤、横纹肌肉瘤、骨肉瘤、间变性甲状腺癌、肾上腺皮质癌、胰腺癌、胰腺导管癌、胰腺腺癌、胶质瘤、神经纤维瘤病-1相关恶性周围神经鞘瘤(mpnst)、瓦尔登斯特伦巨球蛋白血症或髓母细胞瘤。
[0174]
在一些实施方案中,癌症是肝细胞癌(hcc)。在一些实施方案中,癌症是肝母细胞瘤。在一些实施方案中,癌症是结肠癌。在一些实施方案中,癌症是直肠癌。在一些实施方案中,癌症是卵巢癌症或卵巢癌。在一些实施方案中,癌症是卵巢上皮癌。在一些实施方案中,癌症是输卵管癌。在一些实施方案中,癌症是乳头状浆液性囊腺癌。在一些实施方案中,癌症是子宫乳头状浆液性癌(upsc)。在一些实施方案中,癌症是肝胆管细胞癌。在一些实施方案中,癌症是软组织和骨滑膜肉瘤。在一些实施方案中,癌症是横纹肌肉瘤。在一些实施方案中,癌症是骨肉瘤。在一些实施方案中,癌症是间变性甲状腺癌。在一些实施方案中,癌症是肾上腺皮质癌。在一些实施方案中,癌症是胰腺癌或胰腺导管癌。在一些实施方案中,癌症是胰腺腺癌。在一些实施方案中,癌症是胶质瘤。在一些实施方案中,癌症是恶性周围神经鞘瘤(mpnst)。在一些实施方案中,癌症是神经纤维瘤病-1相关的mpnst。在一些实施方案中,癌症是瓦尔登斯特伦巨球蛋白血症。在一些实施方案中,癌症是髓母细胞瘤。
[0175]
在一些实施方案中,癌症是急性淋巴母细胞白血病(all)、急性髓系白血病(aml)、肾上腺皮质癌、肛门癌、阑尾癌、非典型畸胎/横纹肌样瘤、基底细胞癌、胆管癌、膀胱癌、骨癌、脑肿瘤、星形细胞瘤、脑和脊髓肿瘤、脑干胶质瘤、中枢神经系统非典型畸胎/横纹肌样瘤、中枢神经系统胚胎肿瘤、乳腺癌、支气管肿瘤、伯基特淋巴瘤、类癌瘤、原发部位不详的癌、中枢神经系统癌、宫颈癌、儿童癌症、脊索瘤、慢性淋巴细胞白血病(cll)、慢性髓细胞白血病(cml)、慢性骨髓增殖性病症、结肠癌、结肠直肠癌、颅咽管瘤、皮肤t细胞淋巴瘤、导管原位癌(dcis)、胚胎性肿瘤、子宫内膜癌、室管膜母细胞瘤、室管膜瘤、食管癌、食管神经母细胞瘤、尤文肉瘤、颅外生殖细胞肿瘤、性腺外生殖细胞肿瘤、肝外胆管癌、眼癌、骨纤维组
织细胞瘤、胆囊癌、胃癌、胃肠道类癌肿瘤、胃肠道间质瘤(gist)、生殖细胞肿瘤、卵巢生殖细胞肿瘤、妊娠滋养母细胞肿瘤、胶质瘤、毛细胞白血病、头颈癌、心脏癌、肝细胞癌、组织细胞增多症、朗格汉斯细胞癌、霍奇金淋巴瘤、下咽部癌、眼内黑素瘤、胰岛细胞瘤、卡波西肉瘤、肾癌、朗格汉斯细胞组织细胞增多症、喉癌、白血病、唇和口腔癌、肝癌、小叶原位癌(lcis)、肺癌、淋巴瘤、艾滋病相关淋巴瘤、巨球蛋白血症、男性乳腺癌、髓母细胞瘤、髓上皮瘤、黑素瘤、merkel细胞癌、恶性间皮瘤、隐匿性原发性转移性颈部鳞状细胞癌、累及nut基因的中线束癌(midline tract carcinoma involving nut gene)、口部癌(mouth cancer)、多发性内分泌肿瘤综合征、多发性骨髓瘤/浆细胞肿瘤、蕈样肉芽肿、骨髓增生异常综合征、骨髓增生异常/骨髓增殖性肿瘤、慢性髓细胞白血病(cml)、急性髓系白血病(aml)、骨髓瘤、多发性骨髓瘤、慢性骨髓增殖性病症、鼻腔癌、鼻窦癌、鼻咽癌、神经母细胞瘤、非霍奇金淋巴瘤、非小细胞肺癌、口癌、口腔癌、唇癌、口咽癌、骨肉瘤、卵巢癌症、胰腺癌、乳头状瘤病、副神经节瘤、副鼻窦癌、鼻腔癌、甲状旁腺癌、阴茎癌、咽喉癌、嗜铬细胞瘤、中间分化松果体实质肿瘤、松果体母细胞瘤、垂体瘤、浆细胞肿瘤、胸膜肺母细胞瘤、乳腺癌、原发性中枢神经系统(cns)淋巴瘤、前列腺癌、直肠癌、肾细胞癌、肾透明细胞癌、肾盂癌、输尿管癌、移行细胞癌、视网膜母细胞瘤、横纹肌肉瘤、涎腺癌、肉瘤、sezary综合征、皮肤癌、小细胞肺癌、小肠癌、软组织肉瘤、鳞状细胞癌、隐匿性原发性颈部鳞状细胞癌,头颈部鳞状细胞癌(hnscc)、胃癌、幕上原始神经外胚层肿瘤、t细胞淋巴瘤、睾丸癌、咽喉、胸腺瘤(thymoma)、胸腺癌(thymic carcinoma、)甲状腺癌、肾盂输尿管移行细胞癌、三阴乳腺癌(tnbc)、妊娠滋养母细胞肿瘤(原发部位不详)、异常的儿童癌症、尿道癌、子宫癌、子宫肉瘤、瓦尔登斯特伦巨球蛋白血症或肾母细胞瘤。
[0176]
在某些实施方案中,癌症选自膀胱癌、乳腺癌(包括tnbc)、宫颈癌、结肠直肠癌、慢性淋巴细胞白血病(cll)、弥漫性大b细胞淋巴瘤(dlbcl)、食管腺癌、胶质母细胞瘤、头颈癌、白血病(急性和慢性)、低度胶质瘤、肺癌(包括腺癌、非小细胞肺癌和鳞状细胞癌)、霍奇金淋巴瘤、非霍奇金淋巴瘤(nhl)、黑素瘤、多发性骨髓瘤(mm)、卵巢癌症、胰腺癌、前列腺癌、肾癌(包括肾透明细胞癌和肾乳头状细胞癌)和胃癌。
[0177]
在一些实施方案中,癌症是小细胞肺癌、非小细胞肺癌、结肠直肠癌、多发性骨髓瘤、急性髓系白血病(aml)、急性淋巴母细胞白血病(all)、胰腺癌、肝癌、肝细胞癌、神经母细胞瘤、其他实体瘤或其他血液癌症。
[0178]
在一些实施方案中,癌症是小细胞肺癌、非小细胞肺癌、结肠直肠癌、多发性骨髓瘤或aml。
[0179]
本发明进一步描述了用于病毒相关癌症的诊断、预后和治疗的方法和组合物,所述病毒相关癌症包括人免疫缺陷病毒(hiv)相关实体瘤、人乳头瘤病毒(hpv)-16阳性不可治愈实体瘤和成人t细胞白血病(由人t细胞白血病病毒i型(htlv-i)引起,并且是cd4+t细胞白血病的高度侵袭性形式,其特征在于白血病细胞中htlv-i的克隆整合(参见https://clinicaltrials.gov/ct2/show/study/nct02631746));以及胃癌、鼻咽癌、宫颈癌、阴道癌、外阴癌、头颈部鳞状细胞癌和merkel细胞癌中的病毒相关肿瘤。(参见https://clinicaltrials.gov/ct2/show/study/nct02488759;也可参见https://clinicaltrials.gov/ct2/show/study/nct0240886;https://clinicaltrials.gov/ct2/show/nct02426892)
[0180]
在一些实施方案中,本文所述的方法或用途抑制或减少或遏制癌症或肿瘤的生长或扩散。在一些实施方案中,本文所述的方法或用途抑制或减少或遏制癌症或肿瘤的进一步生长。在一些实施方案中,本文所述的方法或用途使癌症或肿瘤的大小(例如,体积或质量)相对于治疗前癌症或肿瘤的大小减少了至少5%、至少10%、至少25%、至少50%、至少75%、至少90%或至少99%。在一些实施方案中,本文所述的方法或用途使患者中的癌症或肿瘤的数量相对于治疗前癌症或肿瘤的数量减少了至少5%、至少10%、至少25%、至少50%、至少75%、至少90%或至少99%。
[0181]
根据本发明的方法,所述化合物和组合物可以使用对治疗癌症或肿瘤或减轻其严重程度有效的任何量和任何施用途径来施用。所需的确切量因受试者而异,这取决于受试者的物种、年龄和一般状况,疾病或病状的严重程度,特定剂、其施用模式等。根据本发明的方法,所述化合物和组合物优选被配制为剂量单位形式以便容易施用和剂量均匀。如本文所用的表述“剂量单位形式”是指适用于待治疗患者的物理上离散的剂单位。然而,应当理解所述化合物和组合物的每日总用量是由主治医师在合理的医学判断范围内决定。对于任何特定患者或生物体的具体有效剂量水平取决于多种因素,包括正在治疗的病症和所述病症的严重程度;采用的特定化合物的活性;采用的特定组合物;患者的年龄、体重、一般健康状况、性别和饮食;采用的特定化合物的施用时间、施用途径及排泄速率;治疗持续时间;与采用的特定化合物联合或一致使用的药物;以及医学领域熟知的类似因素。如本文所用的术语“患者”或“受试者”是指动物,优选哺乳动物,并且最优选人。
[0182]
本发明的药学上可接受的组合物可以经口、直肠、肠胃外、脑池内、阴道内、腹膜内、局部(如通过粉末、膏剂或滴剂)、经颊、作为口或鼻喷雾剂等施用给人类和其他动物,这取决于所治疗的疾病或病症的严重程度。在某些实施方案中,本发明的化合物可以以约0.01mg/kg至约50mg/kg并且优选从约1mg/kg至约25mg/kg受试者体重/天的剂量水平一天一次或多次地经口或肠胃外施用,以获得所需的治疗效果。以下实施例仅用于示例目的,并且不应将其解读为以任何方式限制本发明。
[0183]
实施例
[0184]
化合物a可以通过本领域普通技术人员已知的方法制备,例如,如wo2018195397和us20180327411中所述的那样制备,该文献的内容通过引用方式整体并入本文。
[0185]
缩写:
[0186]
cta:计算组织分析。
[0187]
tme:肿瘤微环境或基质区,这是与肿瘤区域分开的区域
[0188]
tma:组织微阵列。在实施例1中,所有tma都是人肿瘤活检物。
[0189]
染色强度
[0190]
●
1+:弱染色
[0191]
●
2+:中等染色
[0192]
●
3+:强染色
[0193]
所有强度:包括1+、2+和3+强度
[0194]
合并的2+3+强度:包括2+和3+强度
[0195]
h分数由染色阳性的“细胞%”和染色强度计算:
[0196]
[((0
×
(处于0的细胞%))+((1
×
(处于1+的细胞%))+((2
×
(处于2+的细胞%))+
((3
×
(处于3的细胞%))]
[0197]
每个核心的阳性细胞%:活检物核心中为ahr核染色阳性的细胞的百分比
[0198]
tme+核心数:tme区域中所有强度下具有》50%(或者20%、5%)ahr核阳性细胞的核心数
[0199]
肿瘤+核心数:肿瘤区域中所有强度下具有》50%(或者20%、5%)ahr核阳性细胞的核心数
[0200]
tma中总核心数:tma(肿瘤微阵列)中有多少个核心
[0201]
%tme+核心:tme区域中呈》50%(或者20%、5%)ahr核阳性的核心的百分比
[0202]
%肿瘤+核心:肿瘤区域中呈》50%(或者20%、5%)ahr核阳性的核心的百分比
[0203]
%1+核心:一个活检物核心中具有处于1+强度下的ahr核染色的阳性细胞的百分比
[0204]
%2+核心:一个活检物核心中具有处于2+强度下的ahr核染色的阳性细胞的百分比
[0205]
%3+核心:一个活检物核心中具有处于3+强度下的ahr核染色的阳性细胞的百分比
[0206]
实施例1.ihc染色方案:用于ffpe的ahr monoplex
[0207]
将膀胱癌的福尔马林固定石蜡包埋(ffpe)组织块切成4μm厚的组织切片,放在带正电荷的载玻片上。使用leica bond rx自动染色平台,用芳基烃受体(ahr)单克隆抗体ff3399对载玻片进行染色。染色条件为ph 6持续40分钟,dab持续10分钟。leica bprd试剂盒使用山羊抗兔聚合物和小鼠抗兔接头。
[0208]
将抗体以0.5微克/毫升的终浓度施加于组织切片上;用同种型和浓度匹配的无关抗体作为阴性对照。每次抗体运行包括两个正常人膀胱切片作为阳性对照,因为在膀胱移行上皮中观察到强ahr染色。
[0209]
ihc染色玻璃载玻片是由通过职业验证的md病理学家使用常规光学显微镜利用手动评分进行解释。细胞核和细胞质的染色强度是根据以下标准按0-3量表分级:0(未观察到染色)、1(弱染色)、2(中等染色)和3(强染色)。确定每种染色强度的频率,并使用根据以下公式的h分数报告结果:
[0210]
[((0
×
(处于0的细胞%))+((1
×
(处于1+的细胞%))+((2
×
(处于2+的细胞%))+((3
×
(处于3的细胞%))]
[0211]
替代地,经由flotilla平台使用flagship的图像分析服务对样本进行数字分析(cta评分)。应用了在整个载玻片扫描中表征每个细胞的算法,并且生成关于每个细胞的许多测量的特征,诸如形态学或与ihc染色有关的测量结果。此外,还将实施进一步定义肿瘤和间质的算法,以提供与免疫肿瘤学研究相关的背景数据。研究了整个组织载玻片或组织微阵列(tma)载玻片上的单个肿瘤核心,以及ahr表达的肿瘤/间质/边缘特定测量结果。对ahr评分范式进行了数字评估。与人工评分相似,细胞核和细胞质的染色强度是根据以下标准按0-3量表分级:0(未观察到染色)、1(弱染色)、2(中染色)和3(强染色)。确定每种染色强度的频率,并使用根据以下公式的h分数报告结果:
[0212]
[((0
×
(处于0的细胞%))+((1
×
(处于1+的细胞%))+((2
×
(处于2+的细胞%))+((3
×
(处于3的细胞%))]
[0213]
膀胱癌、黑素瘤、卵巢癌症和hnscc患者中ahr核染色的cta评分示出在下表1至表10和图1至图5中。膀胱癌、黑素瘤、卵巢癌症和hnscc的h分数示出在图6中。
[0214]
表1.膀胱癌的ahr核染色cta评分。
[0215][0216]
表2.黑素瘤tma(811)的ahr核染色cta评分。
[0217][0218]
表3.黑素瘤tma(804b)的ahr核染色cta评分。
[0219][0220][0221]
表4.卵巢癌症的ahr核染色cta评分。
[0222][0223]
表5.hnscc的ahr核染色cta评分。
[0224][0225]
表6.膀胱癌的ahr核染色cta评分。
[0226][0227]
表7.黑素瘤tma(811)的ahr核染色cta评分。
[0228][0229]
表8.黑素瘤tma(804b)的ahr核染色cta评分。
[0230][0231]
表9.卵巢癌症的ahr核染色cta评分。
[0232][0233]
表10.hnscc的ahr核染色cta评分。
[0234][0235]
虽然我们已经描述了本发明的许多实施方案,但显然我们的基本实施例可以改变以提供其他利用本发明的化合物和方法的实施方案。因此,应当理解,本发明的范围将由本技术和权利要求书来限定,而不是由已经通过举例描述的特定实施方案来限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1