液体药物制剂聚乙二醇基肾上腺髓质素前药和用途的制作方法
液体药物制剂聚乙二醇基肾上腺髓质素前药和用途
1.本发明涉及用于吸入的包含聚乙二醇(peg)基肾上腺髓质素(adm)前药的新型药物制剂,及其用于治疗和/或预防急性肺损伤/急性呼吸窘迫综合征(ali/ards)的用途。
2.52种氨基酸肽激素adm在肾上腺、肺、肾、心肌以及其他的器官中产生。adm的血浆水平在较低的皮摩尔范围内。adm为降钙素基因相关肽(cgrp)肽家族的成员,并且其本身与由crlr和ramp 2或3(降钙素受体样受体和受体活性修饰蛋白2或3)组成的异二聚体g蛋白偶联受体结合。adm受体的激活导致受体细胞中腺苷3',5'-环磷酸(camp)的细胞内升高。adm受体存在于几乎所有器官中的不同的细胞类型(包括内皮细胞)上。adm被认为是通过中性内肽酶代谢的,并且主要在adm受体高度表达的肺中被清除[gibbons c.,et al.,mol endocrinol 21(4),783-796(2007)]。
[0003]
来自文献的实验数据表明,adm参与了多种功能角色,包括血压调节、支气管扩张、肾功能、激素分泌、细胞生长、分化、神经传递和调节免疫反应。此外,adm作为自分泌因子在内皮细胞的增殖和再生过程中起着至关重要的作用[garc
í
a m.a.,et al.,expert opin ther targets,10(2),303-317(2006)]。
[0004]
来自文献的大量证据表明,adm对于完整的内皮屏障功能是必不可少的,并且在动物实验中的多种炎症条件(包括败血症、急性肺损伤和肠道炎症)下,给药adm至超生理水平发挥强大的抗水肿和抗炎功能[temmesfeld-wollbr
ü
ck b.,et al.,thromb haemost;98,944-951(2007)]。
[0005]
迄今为止,adm的临床试验已在具有可测量的血液动力学终点的心血管指征中进行,例如肺动脉高压、高血压、心力衰竭和急性心肌梗塞。在对患有上述病症的患者进行的几项研究中,adm显示出血液动力学效应。然而,效应仅短暂持续,并且在结束给药后立即停止。这些发现与adm的已知药代动力学特征密切相关。药效作用包括降低全身和肺动脉血压以及增加心输出量[troughton r.w.,et al.,hypertension,36(4),588-93(2000);nagaya n.和kanawa k.,peptides,25(11),2013-8(2004);kataoka y.,et al.,j cardiovasc pharmacol,56(4),413-9(2010)]。
[0006]
在这方面,描述于wo 2013/064508 a1中的化合物(“peg-adm”)作为adm的缓释前药,与“游离”adm相比,具有延长的药理作用持续时间,并且基于这种特定的作用机制,其在体内表现出持续的抗炎和血流动力学功效,分别为例如稳定内皮屏障功能和降低血压。
[0007]
根据wo 2013/064508 a1所述的化合物可以全身地和/或局部地起作用。为此目的,它们可以合适的方式给药,例如作为旨在通过合适的吸入器装置吸入的药用气雾剂。
[0008]
呼吸道可从外部直接进入,因此是靶向给药治疗剂的有吸引力的途径。吸入的基本概念被用于治疗多种呼吸系统疾病,因为这种方法的优点是例如药物起效快、局部药物浓度高、治疗选择性更好和副作用减少[rau j.l.,respir care,50(3),367-82(2005)]。不同类型的药物气雾剂可通过吸入沉积进入肺部。通常,这些制剂由含有活性成分的直径为几微米的颗粒或液滴(在本说明书中统称为“颗粒”)组成(hofmann w.,j aerosol sci,42(10),693-724(2011)]。考虑到气雾剂的物理化学性质对肺沉积的显著影响,以及因此所递送的药物的治疗效果,目前制剂和设备设计开发的目标是生产优化的气雾剂[dolovich m.
和dhand r.,lancet 377(9770),1032-45(2011)]。
[0009]
peg-adm作为吸入治疗剂正在开发中。peg-adm在液态溶液中的稳定性不足以长期储存,因为分子可以通过不同的途径降解,例如聚集、接头分离或二硫化物氧化。此外,即使发现了相当稳定的制剂,也应该注意它也必须适合雾化。此外,最终将治疗有效浓度递送给患者也很重要。
[0010]
记载了健康志愿者吸入递送需要一定浓度的氯离子(30mmol)以避免咳嗽(eschenbacher wl,boushey ha,sheppard d.alteration in osmolarity of inhaled aerosols cause bronchoconstriction and cough,but absence of a permeant anion causes cough alone.am rev respir dis 1984;129:211
–
215.)。此外,对于吸入溶液,严重偏离等渗条件是不可取的。因此,开发了氯化钠含量相对较高的制剂,其对产品的热特性产生了负面影响,并表明需要非常寒冷的储存温度。
[0011]
kohle和goswami(kohle p,goswami s.bulk protein solution:freeze-thaw process,storage and shipping considerations.challenges in protein product development,ed.n.warne,hc mahler,aaps/springer 2018)研究了含有氯化钠(nacl)的溶液的冷冻,并报道了从nacl的相图中可明显看出,由于包含赋形剂而导致的相行为的复杂性。生理盐水体系(0.9重量%nacl于水中)的冷冻导致水以冰晶的形式从本体溶液相中出来,因此,本体相中nacl的浓度显著增加。随着体系的温度降低至-21.2℃,本体相的盐浓度增加了26倍(23.3重量%)。在该温度(称为共晶点)下,体系为冰、冰盐(nacl
×
2h2o)和饱和盐水溶液的复杂平衡混合物。共晶点也指该水/nacl体系的降低的冰点。这可从水/nacl二元体系的相行为中清楚地理解,所述水/nacl二元体系在-20℃下储存可能不足以实现真正的冷冻状态。”[0012]
izutsu和aoyagu(izutsu k,aoyagi n.effect of inorganic salts on crystallization of poly(ethylene glycol)in frozen solutions.international journal of pharmaceutics 288(2005)101-108)研究了nacl对含有较低链长的peg(peg 3000)的溶液的冷冻行为的影响。他们声称加入nacl显著降低溶液的熔化吸热(endotherm)至较低的温度。溶质在冷冻浓缩液中保持无定形,除了高nacl浓度,在该浓度下一部分nacl结晶并且剩余部分保留在冷冻浓缩液中。结果表明,溶质的结晶度是由冷冻溶液中共溶质之间复杂的相互作用决定的。
[0013]
izutsu和kojima(izutsu k,kojima s.freeze-concentration separates proteins and polymer excipients into different amorphous phases.pharmaceutical research,第17卷,第10期,2000年)研究了冷冻浓缩对蛋白质和聚合物体系的影响,并发现分离成不同的无定形相。对于含有40kda pvp和卵清蛋白的溶液,加入nacl导致最大冷冻浓缩溶质的玻璃转化温度显著降低。他们的结果强烈表明,在冷冻溶液中,nacl将无定形卵清蛋白和pvp 40k组合分离成富含卵清蛋白(无明显的tg')相和富含pvp(在-22℃下的tg')相。盐诱导的tg'的突然变化类似于之前在deae-葡聚糖和葡聚糖结合物中观察到的tg'分裂。由于冷冻诱导的相分离,聚电解质和非离子聚合物结合物的单一tg'在某些盐(例如nacl)浓度下分裂为两个转变。一些聚合物结合物可在冷却过程中分离,因为聚合物相互作用取决于温度。冷冻会显著浓缩溶质并引起一些聚合物结合物发生相分离。
[0014]
本发明的一个目的是提供稳定的药物制剂,其包含peg基adm前药(peg-adm),其通过吸入递送至呼吸道。
[0015]
本发明的另一个目的是提供合适的稳定药物制剂,其包含用于治疗和/或预防ali/ards的peg基adm前药(peg-adm),其通过吸入递送至呼吸道。
[0016]
此外,本发明的一个目的是允许雾化治疗相关浓度的peg-adm的水制剂。此外,本发明的一个目的是允许通过振动网状雾化器雾化治疗相关浓度的peg-adm的水制剂。
[0017]
振动网状雾化器通常描述于例如us 6,467,476 b1、us 8,398,001 b2或us 7,331,339 b2中。振动网状雾化器包含一个薄板,通常由金属制成,即所谓的网。所述网包括正面和背面。所述网具有在正面和背面之间延伸的多个孔。在一些实施方案中,所述孔从背面至正面呈锥形变窄。待雾化的液体通常位于与所述网的背面流体连通的储液器中。
[0018]
制剂雾化的效率(即产生的气雾剂颗粒的大小和输出速率,其中输出速率定义为每次由雾化器装置递送的气雾剂质量)一方面为所采用的振动网状雾化器的振动网的孔横截面的函数。另一方面,所用制剂的物理化学性质也揭示了对从雾化器装置中递送气雾剂颗粒的显著影响。许多研究调查了制剂参数与振动网雾化模式的相互作用([beck-broichsitter m.and oesterheld n.,eur j pharm biopharm,119,11-6(2017)]),以使性能与单个应用的要求相匹配。
[0019]
微米级孔径尺寸是产生适合吸入肺部深处的精细药剂雾所必需的。然而,制造适合产生最小颗粒的孔具有挑战性[kohno m.和matsuoka y.,jsme int j,ser b 47(3),497-500(2004);shen et al.,sens.actuators a,144(1),135-43(2008)]。此外,尽管有复杂的技术可将网格的孔直径制造至小于5μm的尺寸,但由于整体尺寸小,单个网格中孔之间的尺寸变化仍然相当大。对于相同的药物制剂,这将直接导致从一种振动网状雾化器到另一种振动网状雾化器的制剂雾化效率的显著差异。
[0020]
一个这样的实例是当通过solo雾化时peg-adm(即与adm缀合的40kda peg;参见下式(ia)的化合物)的水制剂。将peg-adm(参见wo 2013/064508 a1)描述为这样的化合物,其作为缓释adm-前药,具有延长的药理作用持续时间,旨在应用于自主呼吸和通气患者。solo装置是本领域技术人员熟知的[el hansy m.,et al.,pulm pharmacol ther,45(xx),159-63(2017);dugernier j.,et al.,ann intensive care,6,73(2016);ari a.,et al.,respir care 55(7),837-44(2010)]。开发了一种用于peg-adm的药物制剂。所述药物制剂包含peg-adm(组分a)、溶剂(组分b)、ph调节剂(组分c)和渗透压调节剂(组分d)。通过差示扫描量热法(dsc)研究了药物制剂的热特性。结果表明,非晶态溶质的玻璃转化温度相对较低,为-58℃,而完全结晶的氯化钠溶液的共晶温度为-22℃。这些热特性清楚地表明,除非溶液在大约-58℃或更低的储存温度下以完全冷冻状态存在,否则该溶液是不稳定的。
[0021]
然而,尽管存在负热特性,但研究了-20℃+/-℃(相当于《-15℃)的替代的更高储存温度,并且在所应用的分析技术中观察到不稳定的peg-adm具有出人意料地足够好的稳定性。因此,出人意料的是,稳定性结果表明药物制剂可在《-15℃下储存并具有良好的稳定性。在该温度下,药物制剂为部分冷冻和部分液态的。相反,技术人员会预计只有完全冷冻的溶液才会具有所需的稳定性要求。因此,出人意料的是,药物制剂也仅部分冷冻,而稳定
性良好。这种升高的储存温度在供应链、储存成本和临床中心合适的储存容量的可用性方面具有显著的优势。此类有利的发现也应用于药物制剂及其中间体(例如下文在b至d部分中所描述的实施例1和8)。此外,研究了储存稳定性和雾化特性(参见下文c和d部分)。
[0022]
出人意料地,已经表明根据本发明的药物制剂具有以下出人意料的技术效果:
[0023]-药物制剂稳定;
[0024]-药物制剂稳定并表现出良好的雾化性能;
[0025]-即使在冷冻(冷冻溶液)或解冻时,药物制剂仍然稳定;
[0026]-在冷冻和/或解冻后,药物制剂仍然稳定;这同样适用于重新解冻和重新冷冻的药物制剂;
[0027]-在冷冻和/或解冻后,药物制剂仍显示出良好的雾化性能;
[0028]-药物制剂可以多次冷冻和解冻而不会损失其稳定性和/或雾化特性;
[0029]-药物制剂可以在-15℃以下储存且稳定性良好——这种升高的储存温度在供应链、储存成本和临床中心合适的储存容量的可用性方面具有显著优势。
[0030]
因此,本发明提供了一种液体药物制剂,其包含:
[0031]
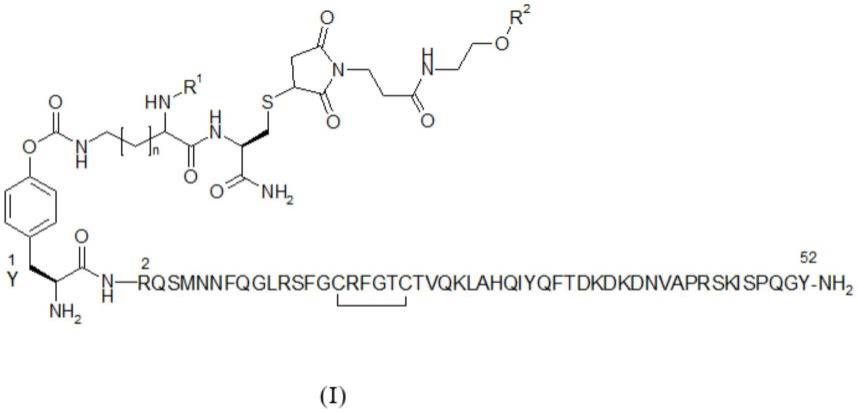
a.0.04mg/ml至145mg/ml的peg-adm,其中所述peg-adm为通式(i)的化合物,
[0032][0033]
其中
[0034]
n代表数字0、1、2或3,
[0035]
r1代表氢、甲基、乙基、正丙基或异丙基,
[0036]
r2代表用甲氧基封端的直链或支链peg 20kda至80kda,
[0037]
或其水合物、其溶剂化物、其盐、其药学上可接受的盐,或其盐的溶剂化物;
[0038]
b.溶剂;
[0039]
c.ph调节剂;和
[0040]
d.渗透压调节剂;
[0041]
其中所述药物制剂的ph为3至5;和
[0042]
其中所述渗透浓度在150至450mosmol/l之间,和
[0043]
其中所述组分的浓度基于液体药物制剂的总体积计。
[0044]
式(i)中的氨基酸编号是指相应的人肾上腺髓质素(adm)序列。
[0045]
药物制剂
[0046]
本发明的药物制剂为液体。术语“药物制剂”和“液体药物制剂”为同义词。在一个实施方案中,本发明的药物制剂用于吸入和/或吸入用途。
[0047]
本发明的药物制剂包含组分a、b、c和d。下文详细描述了这些组分。
[0048]
组分的浓度基于液体药物制剂的总体积计。所述药物制剂的渗透浓度为150至450mosmol/l。所述药物制剂的ph值为3至5。
[0049]
因此,即使在本文公开的本发明的实施方案中没有具体说明,以下特征适用于所有公开的实施方案:
[0050]-当提及“peg-adm”时,意指式(i)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物;
[0051]-组分a、b、c和d的浓度基于液体药物制剂的总体积计,
[0052]-所述药物制剂的ph为3至5,并且
[0053]-所述药物制剂的渗透浓度为150至450mosmol/l。
[0054]
某些浓度以“mg/ml”给出。溶液的质量浓度表示为“mg/ml”即“毫克/毫升”。在本文中,将固体化合物溶解在液体中。例如,如果使用100mg氯化钠配制成100ml的总体积,则制成1mg/ml的氯化钠溶液。组分的浓度基于药物制剂的总体积计。
[0055]
此外,包含在药物制剂中的组分c也可以作为渗透压调节剂(组分d)。这意味着它们可具有重叠的功能。例如,如下文更详细描述的,由于溶液中含有离子,柠檬酸、柠檬酸钠和/或盐酸和氢氧化钠的缓冲体系也可作为渗透压调节剂。在那种情况下,组分c和d由同一组分d表示。然而,组分c和d的功能存在重叠。然而,当分别计算ph调节剂或渗透压调节剂的浓度时,忽略这些重叠的浓度。渗透压调节剂为中性盐,例如氯化钠(nacl)。ph调节剂可包含有助于渗透压的盐或物质(例如,包含柠檬酸、柠檬酸钠和盐酸的缓冲液包含溶液中的钠离子和氯离子)。这些起作用的盐的浓度不包括在渗透压调节剂的浓度中。
[0056]
在一个实施方案中,本发明的药物制剂为溶液。术语“溶液”通常在本领域中使用。它是指一种均质液体制剂,其含有一种或多种溶解(即分子分散)于合适的溶剂和/或相互混溶的溶剂混合物中的物质。
[0057]
在一个实施方案中,本发明的药物制剂为冷冻溶液。术语“冷冻”意指溶液为至少部分冷冻的。在一个实施方案中,所述药物制剂为部分冷冻的。
[0058]
在一个实施方案中,本发明的药物制剂为水溶液。所述水溶液基本上含有作为溶剂b的水或由作为溶剂b的水组成。在本文中,“基本上”意指大于或等于80重量%、90重量%、95重量%、99重量%或99.9重量%,在各种情况下均基于药物制剂的全部重量的总重量计。
[0059]
在一个实施方案中,本发明的药物制剂的液相基本上含有水或由水组成。在本文中,“基本上”意指大于或等于80重量%、90重量%、95重量%、96重量%、97重量%、98重量%、99重量%或99.9重量%,在各种情况下,均基于液相的全部重量的总重量计。
[0060]
在一个实施方案中,本发明的药物制剂为分散剂。原则上,“分散剂”和/或“分散剂系”为本领域技术人员已知的(参见“pharmazeutische technologie”,voigt,deutscher apotheker verlag stuttgart,2000年,第81页及以后)。分散相可根据它们的粒径分类如下:粒径《1nm的分子分散溶液(例如实际溶液/流体相);粒径大于和/或等于1nm至1μm的胶体分散溶解的;以及粒径大于1μm的粗分散的。在一个实施方案中,本发明的药物制剂为水
分散剂。术语“水性”如上文所定义并指分散剂的液相。
[0061]
peg-adm(组分a)
[0062]
本发明的药物制剂包含peg-adm。术语“式(i)的化合物”或“通式(i)的化合物”或“peg-adm”或“peg基adm前药”或“组分a”用作同义词并指通式(i)的化合物,
[0063][0064]
其中
[0065]
n代表数字0、1、2或3,
[0066]
r1代表氢、甲基、乙基、正丙基或异丙基,
[0067]
r2代表用甲氧基封端的直链或支链peg 20kda至80kda。
[0068]
术语“peg-adm”还包含其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。因此,“peg-adm”为式(i)的化合物、式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物的同义词。peg-adm的合成描述于wo 2013/064508 a1中。peg-adm作为前药。在体内,肾上腺髓质素(adm)从peg-adm中释放出来。这详细描述于wo 2013/064508 a1中。
[0069]
在一个实施方案中,药物制剂peg-adm选自通式(i)的化合物,其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物,
[0070][0071]
其中
[0072]
n代表数字0、1、2或3,
[0073]
r1代表氢、甲基、乙基、正丙基或异丙基,
[0074]
r2代表用甲氧基封端的直链或支链peg 20kda至80kda。
[0075]
在一个实施方案中,药物制剂peg-adm选自式(i)的化合物,其中n代表数字1或2,
[0076]
r1代表氢或甲基,
[0077]
r2代表用甲氧基封端的线性peg 40kda。
[0078]
在一个实施方案中,药物制剂peg-adm选自式(i)的化合物,其中
[0079]
n代表数字1或2,
[0080]
r1代表氢,
[0081]
r2代表用甲氧基封端的线性peg 40kda。
[0082]
在一个实施方案中,药物制剂peg-adm为式(ia)的化合物
[0083][0084]
式(ia)的化合物详细描述于wo 2013/064508 a1中。它的cas号为1432735-93-7。
[0085]
在本发明的药物制剂的一个实施方案中,peg-adm为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0086]
根据它们的结构,本发明的化合物可以立体异构的形式(对映异构体、非对映异构体)存在。因此,本发明包括对映异构体或非对映异构体及其特定的混合物。可以已知的方式从对映异构体和/或非对映异构体的此种混合物中分离立体异构均一的成分。
[0087]
当本发明的化合物可以互变异构的形式存在时,本发明包括所有的互变异构的形式。
[0088]
在本发明的上下文中,优选的盐为本发明的化合物的生理学上可接受的盐。
[0089]
本发明的化合物的“生理上可接受的盐”或“药学上可接受的盐”包括无机酸、羧酸和磺酸的酸加成盐,例如盐酸、氢溴酸、硫酸、磷酸、甲磺酸、乙磺酸、甲苯磺酸、苯磺酸、萘二磺酸、乙酸、三氟乙酸、丙酸、乳酸、酒石酸、马来酸、柠檬酸、富马酸、马来酸和苯甲酸的盐。
[0090]
本发明的化合物的“生理上可接受的盐”或“药学上可接受的盐”还包括常用碱的盐,例如并优选碱金属盐(例如钠盐和钾盐)、碱土金属盐(例如钙盐和镁盐)和衍生自氨或具有1至16个碳原子的有机胺的铵盐,例如并优选乙胺、二乙胺、三乙胺、乙基-二异-丙胺、单乙醇胺、二乙醇胺、三乙醇胺、二环己胺、二甲基氨基乙醇、普鲁卡因、二苄基胺、n-甲基-吗啉、精氨酸、赖氨酸、乙二胺和n-甲基哌啶。可用于本发明的结合物的合适的药学上可接受的盐为本领域技术人员熟知的并包括无机酸、有机酸、无机碱、碱性阳离子、碱土阳离子和有机碱的盐。在一个实施方案中,药学上可接受的盐可选自盐酸、氢溴酸、硫酸、磷酸、甲磺酸、三氟甲磺酸、苯磺酸、对甲苯磺酸、1-萘磺酸、2-萘磺酸、乙酸、三氟乙酸、苹果酸、酒石酸、柠檬酸、乳酸、草酸、琥珀酸、富马酸、马来酸、苯甲酸、水杨酸、苯乙酸和扁桃酸乙酸盐、苯甲酸盐、苯磺酸盐、溴化物、樟脑磺酸盐(camsylate)、碳酸盐、柠檬酸盐、乙二磺酸盐、依
托酸盐(estolate)、延胡索酸盐(fumarate)、葡庚糖酸盐(gluceptate)、葡糖酸盐(gluconate)、葡萄糖醛酸盐(glucuronate)、马尿酸盐(hippurate)、碘化物、羟乙基磺酸盐、乳酸盐、乳糖酸盐、苹果酸盐、甲磺酸盐、硫酸甲酯、萘磺酸盐、硝酸盐、草酸盐、双羟萘酸盐、磷酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、酒石酸氢盐、甲苯磺酸盐、钙、二乙醇胺、锂、赖氨酸、镁、葡甲胺、n-甲基葡糖胺、乙醇胺、钾、氨丁三醇、三(羟甲基)氨基甲烷、苯磺酸盐、乙磺酸盐和锌。
[0091]
在一个实施方案中,药学上可接受的盐可选自盐酸盐、硫酸盐、甲磺酸盐、甲苯磺酸盐、酒石酸盐、柠檬酸盐、苯磺酸盐、乙磺酸盐、马来酸盐和磷酸盐。
[0092]
在本发明的上下文中,溶剂化物是指本发明化合物的那些形式,其在固态或液态下通过与溶剂分子配位形成络合物。水合物为溶剂化物的一种特定形式,其中与水配位。在本发明上下文中,优选的溶剂化物为水合物。
[0093]
本发明的药物制剂包含0.04mg/ml至145mg/ml的peg-adm。组分a的浓度基于液体药物制剂的总体积计。
[0094]
如上所述,peg-adm充当前药。adm从peg-adm中释放出来(参见wo 2013/064508 a1)。在治疗中,药物中所包含的adm的量和/或前药peg-adm在体内释放的adm的量是一个重要方面。此外,包含在一定量的peg-adm中的adm的各自浓度或量可根据peg链的长度广泛变化。peg链的长度对peg-adm的重量有影响,并因此对提供一定浓度的adm所需的peg-adm的量有影响。例如,对于根据式(i)的peg-adm,其中r2包含用甲氧基封端的peg 20kda,约1mg adm包含在约4.4mg peg-adm中。例如,对于根据式(i)的peg-adm,其中r2代表用甲氧基封端的线性peg 40kda(参见式(ia)的化合物),约1mg adm包含在约7.7mg peg-adm中。例如,对于根据式(i)的peg-adm,其中r2包含用甲氧基封端的peg 80kda,约1mg adm包含在约14.35mg peg-adm中。因此,本文中给出的peg-adm的浓度为近似值。
[0095]
在一个实施方案中,本发明的药物制剂包含0.077mg/ml至77mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0096]
在一个实施方案中,本发明的药物制剂包含0.77mg/ml至77mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0097]
在一个实施方案中,本发明的药物制剂包含0.385mg/ml至77mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0098]
在一个实施方案中,本发明的药物制剂包含3.85mg/ml至77mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义
的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0099]
在一个实施方案中,本发明的药物制剂包含7.7mg/ml至77mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0100]
在一个实施方案中,本发明的药物制剂包含2.31mg/ml至77mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0101]
在一个实施方案中,本发明的药物制剂包含3.85mg/ml至77mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0102]
在一个实施方案中,本发明的药物制剂包含7.7mg/ml至77mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0103]
在一个实施方案中,本发明的药物制剂包含0.385mg/ml至38.5mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0104]
在一个实施方案中,本发明的药物制剂包含0.77mg/ml至38.5mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0105]
在一个实施方案中,本发明的药物制剂包含0.77mg/ml至21.3mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0106]
在一个实施方案中,本发明的药物制剂包含0.77mg/ml至7.7mg/ml peg-adm,其中
peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0107]
在一个实施方案中,本发明的药物制剂包含2.31mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0108]
在一个实施方案中,本发明的药物制剂包含2.31mg/ml至3.85mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0109]
在一个实施方案中,本发明的药物制剂包含3.08mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0110]
在一个实施方案中,本发明的药物制剂包含3.08mg/ml至77mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0111]
在一个实施方案中,本发明的药物制剂包含3.08mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0112]
在一个实施方案中,本发明的药物制剂包含3.08mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0113]
在一个实施方案中,本发明的药物制剂包含7.7mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0114]
在一个实施方案中,本发明的药物制剂包含6.16mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0115]
在一个实施方案中,本发明的药物制剂包含4.62mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0116]
在一个实施方案中,本发明的药物制剂包含3.85mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0117]
在一个实施方案中,本发明的药物制剂包含00.37mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0118]
在一个实施方案中,本发明的药物制剂包含3.7mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0119]
在一个实施方案中,本发明的药物制剂包含3.696mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0120]
在一个实施方案中,本发明的药物制剂包含3.08mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0121]
在一个实施方案中,本发明的药物制剂包含1.54mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的
盐或其盐的溶剂化物。
[0122]
在一个实施方案中,本发明的药物制剂包含0.77mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0123]
在一个实施方案中,本发明的药物制剂包含0.385mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0124]
在一个实施方案中,本发明的药物制剂包含0.2mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0125]
在一个实施方案中,本发明的药物制剂包含2.31mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物。
[0126]
在一个实施方案中,所述药物制剂包含约0.044mg/ml至44mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm所公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(i)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中r2代表直链或支链peg 20kda.
[0127]
在一个实施方案中,所述药物制剂包含约0.22mg/ml至22mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(i)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中r2代表直链或支链peg 20kda。
[0128]
在一个实施方案中,所述药物制剂包含约0.44mg/ml至13.2mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(i)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中r2代表直链或支链peg 20kda。
[0129]
在一个实施方案中,所述药物制剂包含约0.44mg/ml至4.4mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案
的一个替代方案中,所述化合物为式(i)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中r2代表直链或支链peg 20kda。
[0130]
在一个实施方案中,所述药物制剂包含约1.3mg/ml至2.2mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(i)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中r2代表直链或支链peg 20kda。
[0131]
在一个实施方案中,所述药物制剂包含约0.14mg/ml至144mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(i)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中r2代表直链或支链peg 80kda。
[0132]
在一个实施方案中,所述药物制剂包含约0.7mg/ml至71.7mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(i)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中r2代表直链或支链peg 80kda。
[0133]
在一个实施方案中,所述药物制剂包含约1.4mg/ml至43mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(i)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中r2代表直链或支链peg 80kda。
[0134]
在一个实施方案中,所述药物制剂包含约1.4mg/ml至14.3mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(i)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中r2代表直链或支链peg 80kda。
[0135]
在一个实施方案中,所述药物制剂包含约4.3mg/ml至7.2mg/ml peg-adm,其中所述peg-adm为通式(i)的化合物(如本文中针对peg-adm公开的实施方案中任一项所定义的)、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。在该实施方案的一个替代方案中,所述化合物为式(i)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中r2代表直链或支链peg 80kda。
[0136]
在一个实施方案中,本发明的药物制剂包含0.04mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0137]
在一个实施方案中,本发明的药物制剂包含0.04mg/ml至10mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0138]
在一个实施方案中,本发明的药物制剂包含0.04mg/ml至7.7mg/ml peg-adm,其中
所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0139]
在一个实施方案中,本发明的药物制剂包含0.04mg/ml至6.16mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0140]
在一个实施方案中,本发明的药物制剂包含0.04mg/ml至4.62mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0141]
在一个实施方案中,本发明的药物制剂包含0.04mg/ml至3.696mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0142]
在一个实施方案中,本发明的药物制剂包含0.04mg/ml至3.08mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0143]
在一个实施方案中,本发明的药物制剂包含0.04mg/ml至1.54mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0144]
在一个实施方案中,本发明的药物制剂包含0.04mg/ml至0.77mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0145]
在一个实施方案中,本发明的药物制剂包含0.04mg/ml至0.385mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0146]
在一个实施方案中,本发明的药物制剂包含0.04mg/ml至0.2mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0147]
在一个实施方案中,本发明的药物制剂包含0.2mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0148]
在一个实施方案中,本发明的药物制剂包含0.2mg/ml至10mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0149]
在一个实施方案中,本发明的药物制剂包含0.2mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0150]
在一个实施方案中,本发明的药物制剂包含0.2mg/ml至6.16mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0151]
在一个实施方案中,本发明的药物制剂包含0.2mg/ml至4.62mg/ml peg-adm,其中
所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0152]
在一个实施方案中,本发明的药物制剂包含0.2mg/ml至3.696mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0153]
在一个实施方案中,本发明的药物制剂包含0.2mg/ml至3.08mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0154]
在一个实施方案中,本发明的药物制剂包含0.2mg/ml至1.54mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0155]
在一个实施方案中,本发明的药物制剂包含0.2mg/ml至0.77mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0156]
在一个实施方案中,本发明的药物制剂包含0.2mg/ml至0.385mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0157]
在一个实施方案中,本发明的药物制剂包含0.385mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0158]
在一个实施方案中,本发明的药物制剂包含0.385mg/ml至10mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0159]
在一个实施方案中,本发明的药物制剂包含0.385mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0160]
在一个实施方案中,本发明的药物制剂包含0.385mg/ml至6.16mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0161]
在一个实施方案中,本发明的药物制剂包含0.385mg/ml至4.62mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0162]
在一个实施方案中,本发明的药物制剂包含0.385mg/ml至3.696mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0163]
在一个实施方案中,本发明的药物制剂包含0.385mg/ml至3.08mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0164]
在一个实施方案中,本发明的药物制剂包含0.385mg/ml至1.54mg/ml peg-adm,其
adm,其中peg-adm是根据通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0178]
在一个实施方案中,本发明的药物制剂包含1.54mg/ml至4.62mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0179]
在一个实施方案中,本发明的药物制剂包含1.54mg/ml至3.696mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0180]
在一个实施方案中,本发明的药物制剂包含1.54mg/ml至3.08mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0181]
在一个实施方案中,本发明的药物制剂包含3.08mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0182]
在一个实施方案中,本发明的药物制剂包含3.08mg/ml至10mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0183]
在一个实施方案中,本发明的药物制剂包含3.08mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0184]
在一个实施方案中,本发明的药物制剂包含3.08mg/ml至6.16mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0185]
在一个实施方案中,本发明的药物制剂包含3.08mg/ml至4.62mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0186]
在一个实施方案中,本发明的药物制剂包含3.08mg/ml至3.696mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0187]
在一个实施方案中,本发明的药物制剂包含3.696mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0188]
在一个实施方案中,本发明的药物制剂包含3.696mg/ml至10mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0189]
在一个实施方案中,本发明的药物制剂包含3.696mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0190]
在一个实施方案中,本发明的药物制剂包含3.696mg/ml至6.16mg/ml peg-adm,其
中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0191]
在一个实施方案中,本发明的药物制剂包含3.696mg/ml至4.62mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0192]
在一个实施方案中,本发明的药物制剂包含4.62mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0193]
在一个实施方案中,本发明的药物制剂包含4.62mg/ml至10mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0194]
在一个实施方案中,本发明的药物制剂包含4.62mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0195]
在一个实施方案中,本发明的药物制剂包含4.62mg/ml至6.16mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0196]
在一个实施方案中,本发明的药物制剂包含6.16mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0197]
在一个实施方案中,本发明的药物制剂包含6.16mg/ml至10mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0198]
在一个实施方案中,本发明的药物制剂包含6.16mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0199]
在一个实施方案中,本发明的药物制剂包含7.7mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0200]
在一个实施方案中,本发明的药物制剂包含7.7mg/ml至10mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0201]
在一个实施方案中,本发明的药物制剂包含10mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0202]
在一个实施方案中,本发明的药物制剂包含通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中所述peg-adm的浓度选自0.385mg/ml、0.77mg/ml、1.54mg/ml、3.08mg/ml、3.696mg/ml、4.62mg/ml、6.16mg/ml和7.7mg/ml。
[0203]
在一个实施方案中,本发明的药物制剂包含通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中所述peg-adm的浓度选自0.04mg/ml、0.02mg/ml、0.385mg/ml、0.77mg/ml、1.54mg/ml、3.08mg/ml、3.696mg/ml、4.62mg/ml、6.16mg/ml、7.7mg/ml、10mg/ml和23.1mg/ml。
[0204]
在一个实施方案中,本发明的药物制剂包含通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中所述peg-adm的浓度选自0.02mg/ml、0.385mg/ml、0.77mg/ml、1.54mg/ml、3.08mg/ml、3.696mg/ml、4.62mg/ml、6.16mg/ml、7.7mg/ml、10mg/ml和23.1mg/ml。
[0205]
在一个实施方案中,本发明的药物制剂包含通式(i)或式(ia)的化合物、其水合物、其溶剂化物、其盐、其药学上可接受的盐或其盐的溶剂化物,其中所述peg-adm的浓度选自0.02mg/ml、0.385mg/ml、0.77mg/ml、1.54mg/ml、3.08mg/ml、3.696mg/ml、4.62mg/ml、6.16mg/ml、7.7mg/ml和10mg/ml。
[0206]
在一个实施方案中,本发明的药物制剂包含式(i)或式(ia)的peg-adm,其中包含在peg-adm中的adm的浓度选自
[0207]
[0208][0209]
溶剂(组分b)
[0210]
本发明的药物制剂包含溶剂。术语“溶剂”如本领域中通常所使用的。术语“溶剂”和“组分b”是同义词。术语溶剂是指纯溶剂和/或不同溶剂的混合物。
[0211]
在本发明的药物制剂的一个实施方案中,所述溶剂包含水。在本发明的药物制剂
的一个实施方案中,所述溶剂由水组成。
[0212]
ph调节剂(组分c)
[0213]
本发明的药物制剂包含ph调节剂。术语“ph调节剂”和“组分c”是同义词。术语“ph调节剂”包含调节ph的物质。术语“ph调节剂”也指多种ph调节剂。术语“ph调节剂”是指一种ph调节剂或两种或更多种ph调节剂。因此,术语“ph调节剂”还涵盖包含不同的ph调节剂或由不同的ph调节剂组成的混合物。当给出多种ph调节剂时,这些ph调节剂的浓度的总和为ph调节剂的总浓度。例如,如果给出浓度为1mg/ml柠檬酸和1mg/ml氢氧化钠,则ph调节剂的总浓度为2mg/ml。
[0214]
ph调节剂的一个实例是缓冲体系。“缓冲液”由弱酸及其共轭碱的混合物组成,反之亦然。当将少量强酸或强碱加入缓冲液后,其ph变化很小。在各种化学应用中,将缓冲溶液用作保持ph接近恒定值的一种方式。一个实例为柠檬酸盐/柠檬酸体系。柠檬酸盐为柠檬酸的盐,例如柠檬酸的钠盐、钾盐或钙盐。柠檬酸盐、药学上可接受的盐、衍生物的其他实例包括无水柠檬酸、柠檬酸钠和柠檬酸一水合物。可用于本发明的制剂中的缓冲液的实施方案是磷酸盐柠檬酸盐缓冲液(ph 2.2-8.0,pka=7.2/6.4)、柠檬酸盐缓冲液(ph 3-6.2,pka 6.15-8.06)、乙酸钠缓冲液(ph 3.6
–
5.6,pka 4.76)、甘氨酸-hcl(ph 2.2-3.6,pka 2.35)。即使本文中没有明确说明,任何适合将ph调节至3至5的缓冲液都可用于本发明的药物制剂中。
[0215]
在一个实施方案中,ph调节剂包括柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物。
[0216]
在一个实施方案中,ph调节剂包括盐酸、柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物。
[0217]
在一个实施方案中,ph调节剂包括盐酸。
[0218]
在一个实施方案中,ph调节剂包括含有盐酸和氢氧化钠的混合物。在一个实施方案中,ph调节剂包括含有盐酸、氢氧化钠和柠檬酸的混合物。在一个实施方案中,ph调节剂包括含有氢氧化钠和柠檬酸的混合物。在一个实施方案中,ph调节剂包括含有柠檬酸钠和盐酸的混合物。在前面列出的这些实施方案的替代方案中,柠檬酸为柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物,优选地无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0219]
在一个实施方案中,ph调节剂由盐酸组成。在一个实施方案中,ph调节剂由含有盐酸和氢氧化钠的混合物组成。在一个实施方案中,ph调节剂由含有盐酸、氢氧化钠和柠檬酸的混合物组成。在一个实施方案中,ph调节剂由含有氢氧化钠和柠檬酸的混合物组成。在一个实施方案中,ph调节剂由含有柠檬酸钠和盐酸的混合物组成。在前面列出的实施方案的替代方案中,柠檬酸为柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物,优选地无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0220]
在一个实施方案中,本发明的药物制剂包含至少一种ph调节剂。在一个实施方案中,本发明的药物制剂包含两种或更多种ph调节剂。在一个实施方案中,本发明的药物制剂包含三种或更多种ph调节剂。在一个实施方案中,本发明的药物制剂包含ph调节剂的混合物。
[0221]
在一个实施方案中,药物制剂包含0.1mg/ml至250mg/ml的ph调节剂。在一个实施
方案中,药物制剂包含0.3mg/ml至250mg/ml的ph调节剂。在一个实施方案中,药物制剂包含0.5mg/ml至100mg/ml的ph调节剂。在一个实施方案中,药物制剂包含0.9mg/ml至90mg/ml的ph调节剂。在一个实施方案中,药物制剂包含2.5mg/ml至46mg/ml的ph调节剂。在一个实施方案中,药物制剂包含7.8mg/ml至29mg/ml的ph调节剂。在一个实施方案中,药物制剂包含12.5mg/ml至19mg/ml的ph调节剂。在一个实施方案中,药物制剂包含0.01mg/ml至100mg/ml的ph调节剂。在一个实施方案中,药物制剂包含0.1mg/ml至50mg/ml的ph调节剂。在一个实施方案中,药物制剂包含0.5mg/ml至25mg/ml的ph调节剂。在一个实施方案中,药物制剂包含0.8mg/ml至15mg/ml的ph调节剂。在一个实施方案中,药物制剂包含1.5mg/ml至9mg/ml的ph调节剂。
[0222]
组分c的浓度基于液体药物制剂的总体积计。
[0223]
在一个实施方案中,药物制剂包含0.1mg/ml至100mg/ml的柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物。在一个实施方案中,药物制剂包含0.3mg/ml至30mg/ml的柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物。在一个实施方案中,药物制剂包含1mg/ml至15mg/ml的柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物。在一个实施方案中,药物制剂包含2mg/ml至10mg/ml柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物。在一个实施方案中,药物制剂包含4mg/ml至7mg/ml柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物。在前面列出的实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0224]
在一个实施方案中,药物制剂包含0.01mg/ml至50mg/ml氢氧化钠。在一个实施方案中,药物制剂包含0.1mg/ml至10mg/ml氢氧化钠。在一个实施方案中,药物制剂包含0.5mg/ml至6mg/ml氢氧化钠。在一个实施方案中,药物制剂包含0.8mg/ml至4mg/ml氢氧化钠。在一个实施方案中,药物制剂包含1.5mg/ml至3mg/ml氢氧化钠。
[0225]
在一个实施方案中,药物制剂包含0.1mg/ml至100mg/ml盐酸。在一个实施方案中,药物制剂包含0.5mg/ml至50mg/ml盐酸。在一个实施方案中,药物制剂包含1mg/ml至25mg/ml盐酸。在一个实施方案中,药物制剂包含5mg/ml至15mg/ml盐酸。在一个实施方案中,药物制剂包含7mg/ml至9mg/ml盐酸。在这些实施方案的一个替代方案中,盐酸为10%(m/v)的盐酸或含有10%(m/v)的盐酸。
[0226]
在一个实施方案中,药物制剂包含以下ph调节剂的混合物作为组分c
[0227]-0.1mg/ml至100mg/ml柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物;
[0228]-0.01mg/ml至50mg/ml氢氧化钠;和
[0229]-0.1mg/ml至100mg/ml盐酸。
[0230]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0231]
在一个实施方案中,药物制剂包含以下ph调节剂的混合物作为组分b
[0232]-0.3mg/ml至30mg/ml柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物;
[0233]-0.1mg/ml至10mg/ml氢氧化钠;和
[0234]-0.5mg/ml至50mg/ml盐酸。
[0235]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0236]
在一个实施方案中,药物制剂包含以下ph调节剂的混合物作为组分b
[0237]-1mg/ml至15mg/ml柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物;
[0238]-0.5mg/ml至6mg/ml氢氧化钠;和
[0239]-1mg/ml至25mg/ml盐酸。
[0240]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0241]
在一个实施方案中,药物制剂包含以下ph调节剂的混合物作为组分b
[0242]-2mg/ml至10mg/ml柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物;
[0243]-0.8mg/ml至4mg/ml氢氧化钠;和
[0244]-5mg/ml至15mg/ml盐酸。
[0245]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0246]
在一个实施方案中,药物制剂包含以下ph调节剂的混合物作为组分b
[0247]-4mg/ml至7mg/ml柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物;
[0248]-1.5mg/ml至3mg/ml氢氧化钠;和
[0249]-7mg/ml至9mg/ml盐酸。
[0250]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0251]
在一个实施方案中,药物制剂包含
[0252]-0.077mg/ml至77mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0253]-0.1mg/ml至100mg/ml柠檬酸;
[0254]-0.01mg/ml至50mg/ml氢氧化钠;
[0255]-0.1mg/ml至100mg/ml盐酸。
[0256]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0257]
在一个实施方案中,药物制剂包含
[0258]-0.385mg/ml至3.85mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0259]-0.3mg/ml至30mg/ml柠檬酸;
[0260]-0.1mg/ml至10mg/ml氢氧化钠;
[0261]-0.5mg/ml至50mg/ml盐酸。
[0262]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0263]
在一个实施方案中,药物制剂包含
[0264]-0.77mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0265]-1mg/ml至15mg/ml柠檬酸;
[0266]-0.5mg/ml至6mg/ml氢氧化钠;
[0267]-1mg/ml至25mg/ml盐酸。
[0268]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0269]
在一个实施方案中,药物制剂包含
[0270]-0.77mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0271]-2mg/ml至10mg/ml柠檬酸;
[0272]-0.8mg/ml至4mg/ml氢氧化钠;和
[0273]-5mg/ml至15mg/ml盐酸。
[0274]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0275]
在一个实施方案中,药物制剂包含
[0276]-2.31mg/ml至3.85mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0277]-4mg/ml至7mg/ml柠檬酸;
[0278]-1.5mg/ml至3mg/ml氢氧化钠;和
[0279]-7mg/ml至9mg/ml盐酸。
[0280]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0281]
在一个实施方案中,药物制剂包含
[0282]-0.077mg/ml至77mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0283]-0.1mg/ml至100mg/ml柠檬酸;
[0284]-0.01mg/ml至50mg/ml氢氧化钠;
[0285]-0.1mg/ml至100mg/ml盐酸;
[0286]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍
生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0287]
在一个实施方案中,药物制剂包含
[0288]-0.385mg/ml至3.85mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物,
[0289]-0.3mg/ml至30mg/ml柠檬酸;
[0290]-0.1mg/ml至10mg/ml氢氧化钠;
[0291]-0.5mg/ml至50mg/ml盐酸;
[0292]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0293]
在一个实施方案中,药物制剂包含
[0294]-0.77mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0295]-1mg/ml至15mg/ml柠檬酸;
[0296]-0.5mg/ml至6mg/ml氢氧化钠;
[0297]-1mg/ml至25mg/ml盐酸;
[0298]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0299]
在一个实施方案中,药物制剂包含
[0300]-0.77mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0301]-2mg/ml至10mg/ml柠檬酸;
[0302]-0.8mg/ml至4mg/ml氢氧化钠;
[0303]-5mg/ml至15mg/ml盐酸。
[0304]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0305]
在一个实施方案中,药物制剂包含
[0306]-2.31mg/ml至3.85mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0307]-4mg/ml至7mg/ml柠檬酸;
[0308]-1.5mg/ml至3mg/ml氢氧化钠;
[0309]-7mg/ml至9mg/ml盐酸。
[0310]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0311]
药物制剂的ph
[0312]
本发明的药物制剂的ph为3至5。在一个实施方案中,本发明制剂的药物制剂的ph
为3.5至4.5。在一个实施方案中,本发明的药物制剂的ph为3至4。在一个实施方案中,本发明的药物制剂的ph为3至3.5。在一个实施方案中,本发明的药物制剂的ph为3.25至3.75。在一个实施方案中,本发明的药物制剂的ph为3.5至4。在一个实施方案中,本发明的药物制剂的ph为3。在一个实施方案中,本发明的药物制剂的ph为3.5。在一个实施方案中,本发明的药物制剂的ph为4。在一个实施方案中,本发明的药物制剂的ph为4。在一个实施方案中,本发明的药物制剂的ph为5。
[0313]
渗透压调节剂(组分d)
[0314]
本发明的药物制剂包含渗透压调节剂。术语“渗透压调节剂”和“组分d”是同义词。术语“渗透压调节剂”是指一种渗透压调节剂以及一两种或更多种用于调节渗透压的化合物的混合物。通过冰点降低[osmomat 030,gonotec,model 030-d3p]测定渗透浓度。当给出多种渗透压调节剂时,这些渗透压调节剂的浓度的总和为ph调节剂的总浓度。例如,如果给出的浓度为1mg/ml氯化钠和1mg/ml柠檬酸,则渗透压调节剂的总浓度为2mg/ml。
[0315]
在本发明的药物制剂的一个实施方案中,渗透压调节剂为氯化钠、柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物。
[0316]
在本发明的药物制剂的一个实施方案中,渗透压调节剂为柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物。在本发明的药物制剂的一个实施方案中,渗透压调节剂为选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物的柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物。
[0317]
在本发明的药物制剂的一个实施方案中,渗透压调节剂为氯化钠。
[0318]
在一个实施方案中,本发明的药物制剂包含0.01mg/ml至100mg/ml的渗透压调节剂。组分d的浓度基于液体药物制剂的总体积计。
[0319]
在本发明的药物制剂的一个实施方案中,所述药物制剂包含的渗透压调节剂为0.1mg/ml至30mg/ml。在本发明的药物制剂的一个实施方案中,所述药物制剂包含的渗透压调节剂为0.5mg/ml至15mg/ml。在本发明的药物制剂的一个实施方案中,所述药物制剂包含的渗透压调节剂为2mg/ml至10mg/ml。在本发明的药物制剂的一个实施方案中,所述药物制剂包含的渗透压调节剂为5mg/ml至7mg/ml。在前面列出的这些实施方案中,渗透压调节剂可以是在本文中针对组分d公开的任何实施方案。
[0320]
药物制剂的渗透浓度
[0321]
在本发明的药物制剂中,渗透浓度为150至450mosmol/l。渗透压表示为“mosmol/l”或“毫渗摩尔每升”的渗透浓度。在一个实施方案中,药物制剂的渗透浓度为150至450mosmol/l。在一个实施方案中,药物制剂的渗透浓度为200至400mosmol/l。在一个实施方案中,药物制剂的渗透浓度为270至330mosmol/l。在一个实施方案中,药物制剂的渗透浓度为250至310mosmol/l。在一个实施方案中,药物制剂的渗透浓度为300mosmol/l。
[0322]
药物制剂的粘度
[0323]
本发明的药物制剂也可通过其粘度来表征。粘度的单位为“毫帕斯卡秒”或“mpa*s”。使用anton paar amvn自动微粘度计,根据ph.eur.2.2.49(2018)通过自动滚球粘度计法测定粘度。
[0324]
在一个实施方案中,本发明的制剂的粘度为0.9至2.2mpa*s。在一个实施方案中,本发明的制剂的粘度约为1至2mpa*s。在一个实施方案中,本发明的制剂的粘度约为1.05至
2mpa*s。在一个实施方案中,本发明的制剂的粘度约为1.05至1.9mpa*s。在一个实施方案中,本发明的制剂的粘度约为1.1至2mpa*s。在一个实施方案中,本发明的制剂的粘度约为1.05mpa*s。在一个实施方案中,根据本发明的制剂的粘度约为1.1mpa*s。在一个实施方案中,本发明的制剂的粘度约为1.2mpa*s。在一个实施方案中,本发明的制剂的粘度约为1.3mpa*s。在一个实施方案中,本发明的制剂的粘度约为1.4mpa*s。在一个实施方案中,本发明的制剂的粘度约为1.5mpa*s。在一个实施方案中,本发明的制剂的粘度约为1.9mpa*s。在一个实施方案中,本发明的制剂的粘度约为2mpa*s。
[0325]
药物制剂的其他实施方案
[0326]
在一个实施方案中,药物制剂包含
[0327]-0.077mg/ml至77mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0328]-0.1mg/ml至100mg/ml柠檬酸;
[0329]-0.01mg/ml至50mg/ml氢氧化钠;
[0330]-0.1mg/ml至100mg/ml盐酸;
[0331]-0.01mg/ml至100mg/ml氯化钠。
[0332]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0333]
在一个实施方案中,药物制剂包含
[0334]-0.385mg/ml至3.85mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0335]-0.3mg/ml至30mg/ml柠檬酸;
[0336]-0.1mg/ml至10mg/ml氢氧化钠;
[0337]-0.5mg/ml至50mg/ml盐酸;
[0338]-0.1mg/ml至30mg/ml氯化钠。
[0339]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0340]
在一个实施方案中,药物制剂包含
[0341]-0.77mg/ml至23.1mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0342]-1mg/ml至15mg/ml柠檬酸;
[0343]-0.5mg/ml至6mg/ml氢氧化钠;
[0344]-1mg/ml至25mg/ml盐酸;
[0345]-0.5mg/ml至15mg/ml氯化钠。
[0346]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0347]
在一个实施方案中,药物制剂包含
[0348]-0.77mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0349]-2mg/ml至10mg/ml柠檬酸;
[0350]-0.8mg/ml至4mg/ml氢氧化钠;
[0351]-5mg/ml至15mg/ml盐酸;
[0352]-2mg/ml至10mg/ml氯化钠。
[0353]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0354]
在一个实施方案中,药物制剂包含
[0355]-2.31mg/ml至3.85mg/ml peg-adm,其中所述peg-adm为如在本文中公开的实施方案中任一项所定义的通式(i)的化合物或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0356]-4mg/ml至7mg/ml柠檬酸;
[0357]-1.5mg/ml至3mg/ml氢氧化钠;
[0358]-7mg/ml至9mg/ml盐酸;
[0359]-5mg/ml至7mg/ml氯化钠。
[0360]
在该实施方案的替代方案中,柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物均选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0361]
在本发明的药物制剂的一个实施方案中,所述药物制剂包含
[0362]-0.01mg/ml至10mg/ml的peg-adm,其中所述peg-adm为式(i)或(ia)的化合物,其中浓度是指peg-adm中包含的adm浓度;
[0363]-溶剂;
[0364]-0.1mg/ml至100mg/ml柠檬酸,
[0365]-0.01mg/ml至50mg/ml氢氧化钠,
[0366]-0.1mg/ml至100mg/ml 10%(m/v)盐酸;和
[0367]-0.01mg/ml至100mg/ml氯化钠,
[0368]
其中所述组分的浓度均基于液体药物制剂的总体积计;其中水性制剂的ph为3.5至4.5,优选ph为3至4,更优选ph为4;其中任选地,柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物;其中任选地,盐酸为10%(m/v)的盐酸;其中任选地溶剂为水或含有水。
[0369]
在本发明的药物制剂的一个实施方案中,所述药物制剂包含
[0370]-0.01mg/ml至10mg/ml的peg-adm,其中所述peg-adm为式(ia)的化合物,其中浓度是指peg-adm中包含的adm浓度;
[0371]-水;
[0372]-0.1mg/ml至100mg/ml的柠檬酸,
[0373]-0.01mg/ml至50mg/ml的氢氧化钠,
[0374]-0.1mg/ml至100mg/ml 10%(m/v)盐酸;和
[0375]-0.01mg/ml至100mg/ml氯化钠,
[0376]
其中所述组分的浓度均基于液体药物制剂的总体积计;其中水性制剂的ph为3.5至4.5;其中任选地,柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0377]
在本发明的药物制剂的一个实施方案中,所述药物制剂包含
[0378]-0.05mg/ml至5mg/ml的peg-adm,其中所述peg-adm为式(i)或(ia)的化合物,其中浓度是指包含在peg-adm中的adm浓度;
[0379]-溶剂;
[0380]-0.3mg/ml至30mg/ml柠檬酸,
[0381]-0.1mg/ml至10mg/ml氢氧化钠,
[0382]-0.5mg/ml至50mg/ml盐酸;和
[0383]-0.1mg/ml至30mg/ml氯化钠,
[0384]
其中所述组分的浓度均基于液体药物制剂的总体积计;其中水性制剂的ph为3.5至4.5,优选ph为3至4,更优选ph为4;其中任选地,柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物;其中任选地,所述盐酸为10%(m/v)的盐酸;其中任选地溶剂为水或含有水。
[0385]
在本发明的药物制剂的一个实施方案中,所述药物制剂包含
[0386]-0.05mg/ml至5mg/ml的peg-adm,其中所述peg-adm为式(ia)的化合物,其中浓度是指包含在peg-adm中的adm浓度;
[0387]-水;
[0388]-0.3mg/ml至30mg/ml柠檬酸,
[0389]-0.1mg/ml至10mg/ml氢氧化钠,
[0390]-0.5mg/ml至50mg/ml 10%(m/v)盐酸;和
[0391]-0.1mg/ml至30mg/ml氯化钠,
[0392]
其中所述组分的浓度均基于液体药物制剂的总体积计;其中水性制剂的ph为3.5至4.5;其中任选地,柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0393]
在本发明的药物制剂的一个实施方案中,所述药物制剂包含
[0394]-0.1mg/ml至3mg/ml的peg-adm,其中所述peg-adm为式(i)或(ia)的化合物,其中浓度是指peg-adm中包含的adm浓度;
[0395]-溶剂;
[0396]-1mg/ml至15mg/ml柠檬酸,
[0397]-0.5mg/ml至6mg/ml氢氧化钠,
[0398]-1mg/ml至25mg/ml盐酸和
[0399]-0.5mg/ml至15mg/ml氯化钠,
[0400]
其中所述组分的浓度均基于液体药物制剂的总体积计;
[0401]
其中水性制剂的ph为3.5至4.5,优选ph为3至4,更优选ph为4;其中任选地,柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物;其中任选地,所述盐酸为10%(m/v)的盐酸;其中任选地溶剂为水或含有水。
[0402]
在本发明的药物制剂的一个实施方案中,所述药物制剂包含
[0403]-0.1mg/ml至3mg/ml的peg-adm,其中所述peg-adm为式(ia)的化合物,其中浓度是指peg-adm中包含的adm浓度;
[0404]-水;
[0405]-1mg/ml至15mg/ml柠檬酸,
[0406]-0.5mg/ml至6mg/ml氢氧化钠,
[0407]-1mg/ml至25mg/ml 10%(m/v)盐酸;和
[0408]-0.5mg/ml至15mg/ml氯化钠,
[0409]
其中所述组分的浓度均基于液体药物制剂的总体积计;其中水性制剂的ph为3.5至4.5;其中任选地,柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0410]
在本发明的药物制剂的一个实施方案中,所述药物制剂包含
[0411]-0.1mg/ml至1mg/ml的peg-adm,其中所述peg-adm为式(i)或(ia)的化合物,其中浓度是指peg-adm中包含的adm浓度;
[0412]-溶剂;
[0413]-2mg/ml至10mg/ml柠檬酸,
[0414]-0.8mg/ml至4mg/ml氢氧化钠,
[0415]-5mg/ml至15mg/ml盐酸和
[0416]-2mg/ml至10mg/ml氯化钠,
[0417]
其中所述组分的浓度均基于液体药物制剂的总体积计;其中水性制剂的ph为3.5至4.5,优选ph为3至4,更优选ph为4;其中任选地,柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物;其中任选地,所述盐酸为10%(m/v)的盐酸;其中任选地溶剂为水或含有水。
[0418]
在本发明的药物制剂的一个实施方案中,所述药物制剂包含
[0419]-0.1mg/ml至1mg/ml的peg-adm,其中所述peg-adm为式(ia)的化合物,其中浓度是指peg-adm中包含的adm浓度;
[0420]-水;
[0421]-2mg/ml至10mg/ml柠檬酸,
[0422]-0.8mg/ml至4mg/ml氢氧化钠,
[0423]-5mg/ml至15mg/ml 10%(m/v)盐酸;和
[0424]-2mg/ml至10mg/ml氯化钠,
[0425]
其中所述组分的浓度均基于液体药物制剂的总体积计;其中水性制剂的ph为3.5至4.5;其中任选地,柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0426]
在本发明的药物制剂的一个实施方案中,所述药物制剂包含
[0427]-0.3mg/ml至0.5mg/ml的peg-adm,其中所述peg-adm为式(i)或(ia)的化合物,其中浓度是指包含在peg-adm中的adm浓度;
[0428]-溶剂;
[0429]-4mg/ml至7mg/ml柠檬酸,
[0430]-1.5mg/ml至3mg/ml氢氧化钠,
[0431]-7mg/ml至9mg/ml盐酸和
[0432]-5mg/ml至7mg/ml氯化钠,
[0433]
其中所述组分的浓度均基于液体药物制剂的总体积计;其中水性制剂的ph为3.5至4.5,优选ph为3至4,更优选ph为4;其中任选地,柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物;其中任选地,所述盐酸为10%(m/v)的盐酸;其中任选地溶剂为水或含有水。
[0434]
在本发明的药物制剂的一个实施方案中,所述药物制剂包含
[0435]-0.3mg/ml至0.5mg/ml的peg-adm,其中所述peg-adm为式(ia)的化合物,其中浓度是指peg-adm中包含的adm浓度;
[0436]-水
[0437]-4mg/ml至7mg/ml柠檬酸,
[0438]-1.5mg/ml至3mg/ml氢氧化钠,
[0439]-7mg/ml至9mg/ml 10%(m/v)盐酸;和
[0440]-5mg/ml至7mg/ml氯化钠,
[0441]
其中所述组分的浓度均基于液体药物制剂的总体积计;其中水性制剂的ph为3.5至4.5;其中任选地,柠檬酸、柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0442]
在本发明的药物制剂的一个实施方案中,所述药物制剂包含
[0443]-0.48mg/ml的peg-adm,其中所述peg-adm为式(ia)的化合物,其中浓度是指peg-adm中包含的adm浓度;
[0444]-水;
[0445]-5.38mg/ml无水柠檬酸,
[0446]-2.24mg/ml氢氧化钠,
[0447]-8.07mg/ml 10%(m/v)盐酸;和
[0448]-6.54mg/ml氯化钠,
[0449]
其中所述组分的浓度均基于液体药物制剂的总体积计;其中水性制剂的ph为3.5至4.5,优选ph为3至4,更优选ph为4。
[0450]
在本发明的药物制剂的一个实施方案中,所述药物制剂包含
[0451]-1mg/ml的peg-adm,其中所述peg-adm为式(ia)的化合物,其中浓度是指peg-adm中包含的adm浓度;
[0452]-水;
[0453]-5.4mg/ml无水柠檬酸,
[0454]-2.2mg/ml氢氧化钠,
[0455]-8.1mg/ml 10%(m/v)盐酸;和
[0456]-6.54mg/ml氯化钠,
[0457]
其中所述组分的浓度均基于液体药物制剂的总体积计;其中水性制剂的ph为3.5至4.5,优选ph为3至4,更优选ph为4。
[0458]
在一个实施方案中,本发明的药物制剂包含
[0459]-0.04mg/ml至10mg/ml peg-adm,其中所述peg-adm为式(i)或(ia)的化合物,
[0460]-0.5mg/ml至25mg/ml的ph调节剂,和
[0461]-0.1mg/ml至30mg/ml的渗透压调节剂。
[0462]
在一个实施方案中,本发明的药物制剂包含
[0463]-0.04mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为式(i)或(ia)的化合物,
[0464]-0.8mg/ml至15mg/ml的ph调节剂,和
[0465]-0.5mg/ml至15mg/ml的渗透压调节剂。
[0466]
在一个实施方案中,本发明的药物制剂包含
[0467]-0.04mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为式(i)或(ia)的化合物,
[0468]-0.8mg/ml至15mg/ml的ph调节剂,和
[0469]-2mg/ml至10mg/ml的渗透压调节剂。
[0470]
在一个实施方案中,本发明的药物制剂包含
[0471]-0.2mg/ml至10mg/ml peg-adm,其中所述peg-adm为式(i)或(ia)的化合物,
[0472]-0.5mg/ml至25mg/ml的ph调节剂,和
[0473]-0.1mg/ml至30mg/ml的渗透压调节剂。
[0474]
在一个实施方案中,本发明的药物制剂包含
[0475]-0.2mg/ml至7.7mg/ml peg-adm,其中所述peg-adm为式(i)或(ia)的化合物,
[0476]-0.8mg/ml至15mg/ml的ph调节剂,和
[0477]-0.5mg/ml至15mg/ml的渗透压调节剂。
[0478]
在一个实施方案中,本发明的药物制剂包含
[0479]-0.2mg/ml至7.7mg/ml peg-adm,其中peg-adm为式(i)或(ia)的化合物,
[0480]-0.8mg/ml至15mg/ml的ph调节剂,和
[0481]-2mg/ml至10mg/ml的渗透压调节剂。
[0482]
在一个实施方案中,本发明的药物制剂包含
[0483]-3.696mg/ml peg-adm,其中所述peg-adm为式(ia)的化合物,
[0484]-0.5mg/ml至25mg/ml的ph调节剂,和
[0485]-0.1mg/ml至30mg/ml的渗透压调节剂。
[0486]
在一个实施方案中,本发明的药物制剂包含
[0487]-3.696mg/ml peg-adm,其中所述peg-adm为式(ia)的化合物,
[0488]-0.8mg/ml至15mg/ml的ph调节剂,和
[0489]-0.5mg/ml至15mg/ml的渗透压调节剂。
[0490]
在一个实施方案中,本发明的药物制剂包含
[0491]-3.696mg/ml peg-adm,其中所述peg-adm为式(ia)的化合物,
[0492]-0.8mg/ml至15mg/ml的ph调节剂,和
[0493]-2mg/ml至10mg/ml的渗透压调节剂。
[0494]
本部分“其他的实施方案”中公开的实施方案也可具有如“药物制剂的ph”、“药物制剂的粘度”或“药物制剂的渗透浓度”部分中分别公开的ph、渗透浓度和/或粘度。
[0495]
赋形剂
[0496]
本发明或在本文中公开的任何实施方案的药物制剂可进一步包含至少一种赋形
剂。在本发明的上下文中,赋形剂是在药物制剂中用于例如微生物学地、化学地和物理地稳定制剂或改善味道或视觉外观的目的的物质。术语“赋形剂”还包括惰性无毒药学上合适的赋形剂。在本发明的上下文中,赋形剂的实例为抗氧化剂,稳定剂,防腐剂,用于调节张力、香味的物质,香料或染料。
[0497]
组合药物剂型
[0498]
在本发明的一个实施方案中,结合物是组合药物剂型。“组合药物剂型”用于将两种或更多种药物剂型组合成一个术语,以描述由两种或更多种制成品组成的药物产品,所述制成品旨在组合以生产用于给药给患者的单一药物产品。组合药物剂型不用于组合包装在一起但单独给药的药物剂型,而不是组合以生产单一药物产品(参见组合包)。“药物剂型”和“剂型”是同义词。“药物剂型”或“剂型”是产品的物理表现形式,所述产品含有或包含旨在递送给患者的活性成分和/或非活性成分(例如载体、赋形剂)。“剂型”是在欧洲药典中使用的术语。“剂型”以前在标准术语中使用,但现在使用术语“药物剂型”是为了与整个药品标识项目(参见https://www.edqm.eu/sites/default/files/standard_terms_introduction_and_guidance_for_use.pdf)中使用的词汇相协调。
[0499]
常用剂型包括丸剂、片剂、胶囊剂、糖浆剂、气雾剂、液体注射剂、粉末剂或固体晶剂等。下文公开了其他的药物制剂或剂型。药物递送的给药途径取决于活性成分的剂型。
[0500]
组合包
[0501]
本发明的一方面是一种组合包。在“组合包”中,成分包含在同一包装中销售的不同剂型中。结合物不同于组合药物剂型。在一个实施方案中,组合包包含本文中公开的药物制剂的任一实施方案和雾化器。在一个实施方案中,所述雾化器为网状雾化器或振动网状雾化器。在一个实施方案中,所述雾化器为任选地与aerogen pro-x或aerogen usb控制器结合的aerogen solo雾化器。
[0502]
制备药物制剂的方法
[0503]
本发明的一个主题是制备本发明的药物制剂。
[0504]
所述方法包括至少以下步骤
[0505]
步骤1.提供组分a、b、c和d;和
[0506]
步骤2.混合步骤1中提供的组分;
[0507]
从而获得以下药物制剂:
[0508]
一种液体药物制剂,所述制剂包含:
[0509]
a.0.04mg/ml至145mg/ml的peg-adm,其中所述peg-adm为通式(i)的化合物,
[0510][0511]
其中
[0512]
n代表数字0、1、2或3,
[0513]
r1代表氢、甲基、乙基、正丙基或异丙基,
[0514]
r2代表用甲氧基封端的直链或支链peg 20kda至80kda,
[0515]
或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0516]
b.溶剂;
[0517]
c.ph调节剂;和
[0518]
d.渗透压调节剂;
[0519]
其中所述药物制剂的ph为3至5;且其中所述渗透浓度为150至450mosmol/l,并且其中所述组分的浓度均基于液体药物制剂的总体积计。
[0520]
步骤1和/或2可单独和/或同时和/或随后进行。
[0521]
在所述方法的一个实施方案中,peg-adm(或组分a)为在上文“peg-adm(组分a)”部分中公开的实施方案中任一项的化合物。在所述方法的一个实施方案中,peg-adm为式(ia)的化合物。在所述方法的一个实施方案中,组分b为在上文“溶剂(组分b)”部分中公开的实施方案中任一项的化合物。在所述方法的一个实施方案中,组分c为在上文“ph调节剂(组分c)”部分中公开的实施方案中任一项的化合物。在所述方法的一个实施方案中,组分d为在上文“渗透压调节剂(组分d)”部分中公开的实施方案中任一项的化合物。在所述方法的一个实施方案中,所获得的药物制剂选自“药物制剂的其他实施方案”部分中公开的实施方案。
[0522]
在所述方法的一个实施方案中,所述方法还包括步骤3
[0523]
步骤3.将药物制剂的ph调节至ph为3至5,
[0524]
其中步骤3可在步骤1、2和/或步骤4之前、之间和/或之后进行。
[0525]
在一个实施方案中,可将ph调节至“药物制剂的ph”部分中公开的任何ph。步骤1和/或2和/或3可单独和/或同时和/或随后进行。步骤1和/或2和/或3和/或4可单独和/或同时和/或随后进行。
[0526]
在所述方法的一个实施方案中,所述方法还包括步骤4
[0527]
步骤4.将药物制剂的渗透压调节至渗透浓度为150至450mosmol/l;
[0528]
其中步骤4可在步骤1、2和/或步骤3之前、之间和/或之后进行。
[0529]
步骤1和/或2和/或3和/或4可单独和/或同时和/或随后进行。
[0530]
在所述方法的一个实施方案中,所述方法包括步骤1至4,并且所述药物制剂制备如下
[0531]-提供peg-adm的水性制剂,其包含柠檬酸和任选地至少一种ph调节剂以将ph调节至3.5和4.5,
[0532]-然后浓缩peg-adm的水性制剂和
[0533]-随后通过加入柠檬酸和/或柠檬酸钠溶液、任选地至少一种ph调节剂和渗透压调节剂和水来重构/稀释浓缩产物,和
[0534]
其中所述药物制剂的渗透浓度为150至450mosmol/lmosmol/l;并且其中所得的水性制剂的ph在3.5和4.5之间。
[0535]
在所述方法的一个实施方案中,所述方法包括步骤1至4,并且所述药物制剂制备如下
[0536]-提供peg-adm的水性制剂,其包含柠檬酸和任选地至少一种ph调节剂以将ph调节至3.5和4.5,
[0537]-提供柠檬酸和/或柠檬酸钠,任选地至少一种ph调节剂和渗透压调节剂,和
[0538]-混合所提供的溶液,和
[0539]
其中所述药物制剂的渗透浓度为150至450mosmol/lmosmol/l;并且其中所得的水性制剂的ph在3.5和4.5之间。
[0540]
本发明或其实施方案的方法还可包括步骤5:
[0541]
步骤5至少部分冷冻在步骤1、2、3和/或4中任一步之后获得的药物制剂。
[0542]
步骤1和/或2和/或3和/或4和/或5可单独和/或同时和/或随后进行。
[0543]
适应症
[0544]
在一个实施方案中,本发明的药物制剂和式(i)或(ia)的化合物适用于治疗和/或预防肺部疾病,例如肺动脉高压;继发性肺动脉高压;伴有或不伴有急性肺心病的肺栓塞后肺动脉高压;原发性肺动脉高压;慢性阻塞性肺疾病;哮喘;急性肺水肿;慢性肺水肿;过敏性肺泡炎;吸入有机粉尘引起的肺炎;吸入真菌、放线菌或其他来源的颗粒引起的肺炎;急性化学性支气管炎;急性化学性肺水肿和/或慢性化学性肺水肿(例如在吸入光气、氮氧化物后);神经源性肺水肿;辐射引起的急性肺部表现;辐射引起的慢性肺部表现;急性和/或慢性间质性肺疾病(例如但不限于药物诱导的间质性肺疾病,例如继发于博来霉素(bleomycin)治疗);急性肺损伤(ali);成人或儿童(包括新生儿)的急性肺损伤(ali);急性呼吸窘迫综合征(ards);成人或儿童(包括新生儿)的急性呼吸窘迫综合征(ards);继发于肺炎和败血症的ali/ards、吸入性肺炎和继发于吸入性肺炎的ali/ards(例如但不限于胃内容物反流引起的吸入性肺炎);继发于烟气吸入的ali/ards;输血相关的急性肺损伤(trali)、ali/ards或手术后的急性肺功能不全;创伤或烧伤,呼吸机引起的肺损伤(vili);胎粪吸入后的肺损伤;肺纤维化;和高山病。
[0545]
在一个实施方案中,本发明的药物制剂和式(i)或(ia)的化合物适用于治疗和/或预防继发于由肺部细菌感染引起的肺炎的ali/ards,例如,但不限于由肺炎球菌(pneumococci)、流感嗜血杆菌(haemophilus influenzae)、肺炎支原体(mycoplasma pneumoniae)、衣原体属种(chlamydia species)、肠球菌(enterococci)、β-溶血性链球菌(beta-hemolytic streptococci)、葡萄球菌(staphylococci)、革兰氏阴性肠杆菌科
(gram-negative enterobacteriaceae)、假单胞菌属种(pseudomonas species)、克雷伯氏菌属种(klebsiella species)、不动杆菌属种(acinetobacter species)、军团杆菌属种(legionella species)和分枝杆菌(mycobacteria)引起的细菌性肺炎。
[0546]
在一个实施方案中,本发明的药物制剂和式(i)或(ia)的化合物适用于治疗和/或预防继发于由病毒感染引起的肺炎的ali/ards,例如但不限于,流感病毒(influenza viruses)(例如由血清型h1n1、h5n1、h7n9毒株(strain)引起)、冠状病毒(corona viruses)(例如严重急性呼吸综合征(sars)的病原体sars-cov、中东呼吸综合征(mers)的病原体mers-cov和covid-19大流行病的病原体sars-cov-2)、呼吸道合胞病毒(respiratory-syncytial-virus(rsv))和巨细胞病毒(cytomegalovirus(cmv))。
[0547]
在一个实施方案中,本发明的药物制剂和式(i)或(ia)的化合物也适用于治疗和/或预防继发于由真菌感染引起的肺炎的ali/ards,例如但不限于由耶氏肺孢子菌(pneumocystis jirovecii)引起的真菌性肺炎。
[0548]
在一个实施方案中,本发明的药物制剂和式(i)或(ia)的化合物适用于治疗和/或预防继发于肺炎的ali/ards,不考虑肺炎的起源,例如社区获得性肺炎(cap)以及医院获得性肺炎(hap),尤其是在人工通气(vap)条件下获得的hap。
[0549]
在一个实施方案中,本发明的药物制剂和式(i)或(ia)的化合物适用于治疗和/或预防继发于肺炎的ali/ards,不考虑肺炎的不同病理解剖表现,例如但不限于肺叶(即影响整个肺叶)、小叶(即影响较小的肺小叶)、间质性(即肺组织的弥漫性病变)。
[0550]
在一个实施方案中,本发明的药物制剂和式(i)或(ia)的化合物适用于治疗和/或预防继发于由于细菌和/或病毒感染而引发的肺炎的ali/ards。
[0551]
在一个实施方案中,本发明的药物制剂和式(i)或(ia)的化合物适用于治疗和/或预防继发于由病毒引起的原发性肺部感染的细菌重复感染而引发的肺炎的ali/ards。
[0552]
在一个实施方案中,本发明的药物制剂和式(i)或(ia)的化合物适用于预防和/或治疗肺移植后的肺功能障碍。
[0553]
基于它们的药理学性质,本发明的药物制剂和本发明的式(i)或(ia)的化合物可用于预防和/或改善继发于细菌性肺炎的败血症的发展(因此称为肺炎性败血症)。
[0554]
另一个实施方案是用于治疗和/或预防本部分“适应症”中列出的病症和/或疾病的式(i)的化合物或式(ia)的化合物。本发明的药物制剂和式(i)或(ia)的化合物特别适用于治疗和/或预防患有肺炎的免疫功能低下的患者的ali/ards,例如在获得性免疫缺陷综合征(aids)、化学疗法和骨髓移植的情况下。
[0555]
条款
[0556]
以下条款也构成本公开的一部分并涉及本发明的其他实施方案:
[0557]
1.液体药物制剂,其包括:
[0558]
a.0.04mg/ml至145mg/ml的peg-adm,其中所述peg-adm为通式(i)的化合物,
[0559][0560]
(i)其中
[0561]
n代表数字0、1、2或3,
[0562]
r1代表氢、甲基、乙基、正丙基或异丙基,
[0563]
r2代表用甲氧基封端的直链或支链peg 20kda至80kda,或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物;
[0564]
b.溶剂;
[0565]
c.ph调节剂;和
[0566]
d.渗透压调节剂;
[0567]
其中药物制剂的ph为3至5;和其中渗透浓度为150至450mosmol/l,和
[0568]
其中组分的浓度基于液体药物制剂的总体积计。
[0569]
2.根据条款1所述的药物制剂,其中所述药物制剂为溶液或分散剂。
[0570]
3.根据条款1或2中任一项所述的药物制剂,其中所述药物制剂为冷冻溶液或冷冻分散剂。
[0571]
4.根据前述条款中任一项所述的药物制剂,其中所述药物制剂为水溶液。
[0572]
5.根据前述条款中任一项所述的药物制剂,其中所述peg-adm选自通式(i)的化合物并且r2代表用甲氧基封端的直链或支链peg 20kda,其中所述peg-adm为如前述条款中任一项所定义的通式(i)的化合物,或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0573]
6.根据前述条款中任一项所述的药物制剂,其中所述peg-adm选自通式(i)的化合物并且r2代表用甲氧基封端的直链或支链peg 40kda,其中所述peg-adm为如前述条款中任一项所定义的通式(i)的化合物,或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0574]
7.根据前述条款中任一项所述的药物制剂,其中所述peg-adm选自通式(i)的化合物并且r2代表用甲氧基封端的直链或支链peg 80kda,其中所述peg-adm为如前述条款中任一项所定义的通式(i)的化合物,或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0575]
8.根据前述条款中任一项所述的药物制剂,其中所述peg-adm选自通式(i)的化合物,
[0576][0577]
其中
[0578]
n代表数字0、1、2或3,
[0579]
r1代表氢、甲基、乙基、正丙基或异丙基,
[0580]
r2代表用甲氧基封端的直链或支链peg 20kda至80kda,或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或其盐的溶剂化物。
[0581]
9.根据前述条款中任一项所述的药物制剂,其中所述peg-adm选自式(i)的化合物,其中
[0582]
n代表数字1或2,
[0583]
r1代表氢或甲基,
[0584]
r2代表用甲氧基封端的线性peg 40kda。
[0585]
10.根据前述条款中任一项所述的药物制剂,其中所述peg-adm选自式(i)的化合物,其中
[0586]
n代表数字1或2,
[0587]
r1代表氢,
[0588]
r2代表用甲氧基封端的线性peg 40kda。
[0589]
11.根据前述条款中任一项所述的药物制剂,其中所述peg-adm为式(ia)的化合物
[0590][0591]
12.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.385mg/ml至77mg/ml peg-adm。
[0592]
13.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含2.31mg/ml至77mg/ml peg-adm。
[0593]
14.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含3.85mg/ml至77mg/ml peg-adm。
[0594]
15.根据前述条款中任一项所述的药物制剂,其中,其中所述药物制剂包含7.7mg/ml至77mg/ml peg-adm。
[0595]
16.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.385mg/ml至38.5mg/ml peg-adm。
[0596]
17.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.77mg/ml至38.5mg/ml pegadm。
[0597]
18.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.77mg/ml至23.1mg/ml pegadm。
[0598]
19.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.77mg/ml至7.7mg/ml peg-adm。
[0599]
20.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含2.31mg/ml至7.7mg/ml peg-adm。
[0600]
21.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含2.31mg/ml至3.85mg/ml peg-adm。
[0601]
22.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含3.08mg/ml至23.1mg/ml peg-adm。
[0602]
23.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含3.08mg/ml至7.7mg/ml peg-adm。
[0603]
24.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.77mg/ml peg-adm。
[0604]
25.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含6.16mg/ml peg-adm。
[0605]
26.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含4.6g/ml peg-adm。
[0606]
27.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含3.85mg/ml peg-adm。
[0607]
28.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含3.7mg/ml peg-adm。
[0608]
29.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含2.31mg/ml peg-adm。
[0609]
30.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含约0.044mg/ml至44mg/ml peg-adm。
[0610]
31.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含约0.22mg/ml至22mg/ml peg-adm。
[0611]
32.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含约0.44mg/ml至13.2mg/ml peg-adm。
[0612]
33.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含约0.44mg/ml至4.4mg/ml peg-adm。
[0613]
34.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含约1.3mg/ml
至2.2mg/ml peg-adm。
[0614]
35.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含约0.14mg/ml至144mg/ml peg-adm。
[0615]
36.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含约0.7mg/ml至71.7mg/ml peg-adm。
[0616]
37.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含约1.4mg/ml至43mg/ml peg-adm。
[0617]
38.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含约1.4mg/ml至14.3mg/ml peg-adm。
[0618]
39.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含约4.3mg/ml至7.2mg/ml peg-adm。
[0619]
40.根据前述条款中任一项所述的药物制剂,其中所述溶剂包含水。
[0620]
41.根据前述条款中任一项所述的药物制剂,其中所述溶剂为水。
[0621]
42.根据前述条款中任一项所述的药物制剂,其中所述溶剂基本上为水。
[0622]
43.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.1mg/ml至250mg/ml的ph调节剂。
[0623]
44.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.3mg/ml至250mg/ml的ph调节剂。
[0624]
45.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.5mg/ml至100mg/ml的ph调节剂。
[0625]
46.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.9mg/ml至90mg/ml的ph调节剂。
[0626]
47.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含2.5mg/ml至46mg/ml的ph调节剂。
[0627]
48.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含7.8mg/ml至29mg/ml的ph调节剂。
[0628]
49.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含12.5mg/ml至19mg/ml的ph调节剂。
[0629]
50.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.01mg/ml至100mg/ml的ph调节剂。
[0630]
51.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.1mg/ml至50mg/ml的ph调节剂。
[0631]
52.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.5mg/ml至25mg/ml的ph调节剂。
[0632]
53.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.8mg/ml至15mg/ml的ph调节剂。
[0633]
54.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含1.5mg/ml至9mg/ml的ph调节剂。
[0634]
55.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含柠檬酸、柠檬
酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物。
[0635]
56.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含盐酸、柠檬酸、柠檬酸盐、柠檬酸盐的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物。
[0636]
57.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含盐酸。
[0637]
58.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含含有盐酸和氢氧化钠的混合物。
[0638]
59.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含含有盐酸、氢氧化钠和柠檬酸的混合物。
[0639]
60.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含含有氢氧化钠和柠檬酸的混合物。
[0640]
61.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含含有柠檬酸钠和盐酸的混合物。
[0641]
62.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂由盐酸组成。
[0642]
63.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂由包含盐酸和氢氧化钠的混合物组成。
[0643]
64.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂由包含盐酸、氢氧化钠和柠檬酸的混合物组成。
[0644]
65.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂由包含氢氧化钠和柠檬酸的混合物组成。
[0645]
66.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂由包含柠檬酸钠和盐酸的混合物组成。
[0646]
67.根据前述条款中任一项所述的药物制剂,其中所述柠檬酸为柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物。
[0647]
68.根据前述条款中任一项所述的药物制剂,其中所述柠檬酸盐、柠檬酸的药学上可接受的盐、柠檬酸的衍生物和/或它们的混合物选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物。
[0648]
69.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含盐酸或由盐酸组成,优选盐酸。
[0649]
70.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含0.1mg/ml至100mg/ml柠檬酸或由0.1mg/ml至100mg/ml柠檬酸组成。
[0650]
71.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含0.3mg/ml至30mg/ml柠檬酸或由0.3mg/ml至30mg/ml柠檬酸组成。
[0651]
72.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含1mg/ml至15mg/ml柠檬酸或由1mg/ml至15mg/ml柠檬酸组成。
[0652]
73.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含2mg/ml至10mg/ml柠檬酸或由2mg/ml至10mg/ml柠檬酸组成。
[0653]
74.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含4mg/ml至7mg/ml柠檬酸或由4mg/ml至7mg/ml柠檬酸组成。
[0654]
75.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含或由其组成,
其中所述ph调节剂包含0.01mg/ml至50mg/ml氢氧化钠或由0.01mg/ml至50mg/ml氢氧化钠组成。
[0655]
76.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含0.1mg/ml至10mg/ml氢氧化钠或由0.1mg/ml至10mg/ml氢氧化钠组成。
[0656]
77.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含0.5mg/ml至6mg/ml氢氧化钠或由0.5mg/ml至6mg/ml氢氧化钠组成。
[0657]
78.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含0.8mg/ml至4mg/ml氢氧化钠或由0.8mg/ml至4mg/ml氢氧化钠组成。
[0658]
79.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含0.1mg/ml至100mg/ml盐酸或由0.1mg/ml至100mg/ml盐酸组成。
[0659]
80.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含0.5mg/ml至50mg/ml盐酸或由0.5mg/ml至50mg/ml盐酸组成。
[0660]
81.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含1mg/ml至25mg/ml盐酸或由1mg/ml至25mg/ml盐酸组成。
[0661]
82.根据前述条款中任一项所述的药物制剂,其中所述ph调节剂包含5mg/ml至15mg/ml 10%(m/v)盐酸或由5mg/ml至15mg/ml 10%(m/v)盐酸组成。
[0662]
83.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含两种或更多种ph调节剂。
[0663]
84.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含三种或更多种ph调节剂。
[0664]
85.根据前述条款中任一项所述的药物制剂,其中所述渗透压调节剂选自氯化钠,柠檬酸,柠檬酸盐、药学上可接受的盐、衍生物和/或它们的混合物。
[0665]
86.根据前述条款中任一项所述的药物制剂,其中所述柠檬酸为选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物的柠檬酸盐、药学上可接受的盐、衍生物。
[0666]
87.根据前述条款中任一项所述的药物制剂,其中所述渗透压调节剂为氯化钠。
[0667]
88.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.01mg/ml至100mg/ml的渗透压调节剂。
[0668]
89.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.1mg/ml至30mg/ml的渗透压调节剂。
[0669]
90.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含0.5mg/ml至15mg/ml的渗透压调节剂。
[0670]
91.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含2mg/ml至10mg/ml的渗透压调节剂或5mg/ml至7mg/ml的渗透压调节剂。
[0671]
92.根据前述条款中任一项所述的药物制剂,其中所述药物制剂的渗透浓度为150mosmol/l至450mosmol/l或200mosmol/l至400mosmol/l。
[0672]
93.根据前述条款中任一项所述的药物制剂,其中所述药物制剂的渗透浓度为270至330mosmol/l。
[0673]
94.根据前述条款中任一项所述的药物制剂,其中所述药物制剂的渗透浓度为250至310mosmol/l。
[0674]
95.根据前述条款中任一项所述的药物制剂,其中所述药物制剂的渗透浓度为300mosmol/l。
[0675]
96.根据前述条款中任一项所述的药物制剂,其中所述制剂的ph为3.5至4.5。
[0676]
97.根据前述条款中任一项所述的药物制剂,其中所述制剂的ph为3至4。
[0677]
98.根据前述条款中任一项所述的药物制剂,其中所述制剂的ph为3至3.5。
[0678]
99.根据前述条款中任一项所述的药物制剂,其中所述制剂的ph为3.5至4。
[0679]
100.根据前述条款中任一项所述的药物制剂,其中所述制剂的ph为3.5。
[0680]
101.根据前述条款中任一项所述的药物制剂,其中所述制剂的ph为4。
[0681]
102.根据前述条款中任一项所述的药物制剂,其中所述制剂的粘度为0.9至2.2mpa*s、1至2mpa*s、1.05至2mpa*s、1.1至2mpa*s或1.05至1.9mpa*s。
[0682]
103.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含以下物质作为ph调节剂
[0683]-0.1mg/ml至100mg/ml柠檬酸;
[0684]-0.01mg/ml至50mg/ml氢氧化钠;
[0685]-0.1mg/ml至100mg/ml盐酸。
[0686]
104.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含以下物质作为ph调节剂
[0687]-0.3mg/ml至30mg/ml柠檬酸;
[0688]-0.1mg/ml至10mg/ml氢氧化钠;
[0689]-0.5mg/ml至50mg/ml盐酸。
[0690]
105.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含以下物质作为ph调节剂
[0691]-1mg/ml至15mg/ml柠檬酸;
[0692]-0.5mg/ml至6mg/ml氢氧化钠;
[0693]-1mg/ml至25mg/ml盐酸。
[0694]
106.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含以下物质作为ph调节剂
[0695]-2mg/ml至10mg/ml柠檬酸;
[0696]-0.8mg/ml至4mg/ml氢氧化钠;
[0697]-5mg/ml至15mg/ml盐酸。
[0698]
107.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含
[0699]-0.077mg/ml至77mg/ml peg-adm,
[0700]-0.1mg/ml至100mg/ml柠檬酸;
[0701]-0.01mg/ml至50mg/ml氢氧化钠;
[0702]-0.1mg/ml至100mg/ml盐酸。
[0703]
108.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含
[0704]-0.385mg/ml至3.85mg/ml peg-adm,
[0705]-0.3mg/ml至30mg/ml柠檬酸;
[0706]-0.1mg/ml至10mg/ml氢氧化钠;
[0707]-0.5mg/ml至50mg/ml盐酸。
[0708]
109.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含
[0709]-0.77mg/ml至23.1mg/ml peg-adm,
[0710]-1mg/ml至15mg/ml柠檬酸;
[0711]-0.5mg/ml至6mg/ml氢氧化钠;
[0712]-1mg/ml至25mg/ml盐酸。
[0713]
110.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含
[0714]-0.77mg/ml至7.7mg/ml peg-adm,
[0715]-2mg/ml至10mg/ml柠檬酸;
[0716]-0.8mg/ml至4mg/ml氢氧化钠;和
[0717]-5mg/ml至15mg/ml盐酸。
[0718]
111.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含
[0719]-2.31mg/ml至3.85mg/ml peg-adm,
[0720]-4mg/ml至7mg/ml柠檬酸;
[0721]-1.5mg/ml至3mg/ml氢氧化钠;和
[0722]-7mg/ml至9mg/ml盐酸。
[0723]
112.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含
[0724]-0.077mg/ml至77mg/ml peg-adm,
[0725]-0.1mg/ml至100mg/ml柠檬酸;
[0726]-0.01mg/ml至50mg/ml氢氧化钠;
[0727]-0.1mg/ml至100mg/ml盐酸;
[0728]-0.01mg/ml至100mg/ml氯化钠。
[0729]
113.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含
[0730]-0.385mg/ml至3.85mg/ml peg-adm,
[0731]-0.3mg/ml至30mg/ml柠檬酸;
[0732]-0.1mg/ml至10mg/ml氢氧化钠;
[0733]-0.5mg/ml至50mg/ml盐酸;
[0734]-0.1mg/ml至30mg/ml氯化钠。
[0735]
114.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含
[0736]-0.77mg/ml至23.1mg/ml peg-adm,
[0737]-1mg/ml至15mg/ml柠檬酸;
[0738]-0.5mg/ml至6mg/ml氢氧化钠;
[0739]-1mg/ml至25mg/ml盐酸;
[0740]-0.5mg/ml至15mg/ml氯化钠。
[0741]
115.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含
[0742]-0.77mg/ml至7.7mg/ml peg-adm,
[0743]-2mg/ml至10mg/ml柠檬酸;
[0744]-0.8mg/ml至4mg/ml氢氧化钠;
[0745]-5mg/ml至15mg/ml盐酸;
[0746]-2mg/ml至10mg/ml氯化钠。
[0747]
116.根据前述条款中任一项所述的药物制剂,其中所述药物制剂包含
[0748]-2.31mg/ml至3.85mg/ml peg-adm,
[0749]-4mg/ml至7mg/ml柠檬酸;
[0750]-1.5mg/ml至3mg/ml氢氧化钠;
[0751]-7mg/ml至9mg/ml盐酸;
[0752]-5mg/ml至7mg/ml氯化钠。
[0753]
117.根据前述条款中任一项所述的药物制剂,其中所述柠檬酸为选自无水柠檬酸、柠檬酸钠和柠檬酸一水合物的柠檬酸盐、药学上可接受的盐、衍生物。
[0754]
118.根据前述条款中任一项所述的药物制剂,其中所述盐酸为盐酸。119.根据条款1至118中任一项所述的用于吸入的药物制剂。
[0755]
120.包含根据条款1至119中任一项所述的药物制剂的药物或包含根据条款1至119中任一项所述的药物制剂与惰性无毒药学上合适的赋形剂结合,任选地与其他活性成分结合的药物。
[0756]
121.包含组分(1)和(2)的组合药物剂型,其中
[0757]
组分(1)包括包含peg-adm的药物制剂、用于调节ph的化合物和渗透压调节剂;其中所述药物制剂包含如条款1至119中任一项所定义的peg-adm、用于调节ph的化合物和任选地渗透压调节剂;和
[0758]
组分(2)包括如条款1至119中任一项所定义的溶剂。
[0759]
122.根据条款121所述的组合药物剂型,其中组分(1)为溶液、水性制剂、冻干物(lyophilizate)或冷冻溶液。
[0760]
123.根据条款121或122所述的组合药物剂型,其中组分(1)为溶液、分散剂、可溶性粉末、冻干物、片剂或颗粒剂,其包含组分a、c和/或组分d中的至少一种,并且组分(2)包含用于溶解或分散组分(1)的组分b。
[0761]
124.包含组分(1)和(2)的组合包,其中
[0762]
组分(1)包括根据条款1至119中任一项所述的药物制剂、根据条款120所述的药物或根据条款121至123中任一项所述的组合药物剂型;和
[0763]
组分(2)包括雾化器,优选网状雾化器。
[0764]
125.根据条款1至119中任一项所述的药物制剂、根据条款120所述的药物、根据条款121至123中任一项所述的组合药物剂型或根据条款124所述的组合包,其用于治疗和/或预防疾病。
[0765]
126.根据条款1至119中任一项所述的药物制剂、根据条款120所述的药物、或根据条款121至123中任一项所述的组合药物剂型、根据条款124所述的组合包、如条款1至119中任一项所定义的式(i)的化合物、如条款1至119中任一项所定义的式(ia)的化合物,其用于治疗和/或预防疾病和/或病症,其中所述疾病和/或病症选自
[0766]-肺部疾病,例如肺动脉高压;继发性肺动脉高压;伴有或不伴有急性肺心病的肺栓塞后肺动脉高压;原发性肺动脉高压;慢性阻塞性肺疾病;哮喘;急性肺水肿;慢性肺水肿;过敏性肺泡炎;吸入有机粉尘引起的肺炎;吸入真菌、放线菌或其他来源的颗粒引起的肺炎;急性化学性支气管炎;急性化学性肺水肿和/或慢性化学性肺水肿(例如吸入光气、氮
氧化物后);神经源性肺水肿;辐射引起的急性肺部表现;辐射引起的慢性肺部表现;急性和/或慢性间质性肺疾病(例如但不限于药物诱导的间质性肺疾病,例如继发于博来霉素治疗);急性肺损伤(ali);成人或儿童(包括新生儿)的急性肺损伤(ali);急性呼吸窘迫综合征(ards);成人或儿童(包括新生儿)的急性呼吸窘迫综合征(ards);继发于肺炎和败血症的ali/ards、吸入性肺炎和继发于吸入性肺炎的ali/ards(例如但不限于胃内容物反流引起的吸入性肺炎);继发于烟气吸入的ali/ards;输血相关的急性肺损伤(trali)、ali/ards或手术后的急性肺功能不全;创伤或烧伤,呼吸机引起的肺损伤(vili);胎粪吸入后的肺损伤;肺纤维化;和高山病;
[0767]-继发于肺部细菌感染引起的肺炎的ali/ards,例如但不限于由以下细菌引起的细菌性肺炎:肺炎双球菌、流感嗜血杆菌、肺炎支原体、衣原体属种、肠球菌、β-溶血性链球菌、葡萄球菌、革兰氏阴性肠杆菌科、假单胞菌属种、克雷伯氏菌属种、不动杆菌属种、军团杆菌属种和分枝杆菌;
[0768]-继发于由以下病毒感染引起的肺炎的ali/ards,例如但不限于流感病毒(例如由血清型h1n1、h5n1、h7n9毒株引起)、冠状病毒(例如严重急性呼吸综合症(sars)的病原体sars-cov,中东呼吸综合征(mers)的病原体mers-cov和covid-19大流行病的病原体sars-cov-2)、呼吸道合胞病毒(rsv)和巨细胞病毒(cmv);
[0769]-继发于由真菌感染引起的肺炎的ali/ards,例如但不限于由耶氏肺孢子菌引起的真菌性肺炎;
[0770]-继发于肺炎的ali/ards,不考虑肺炎的来源,例如社区获得性肺炎(cap)和医院获得性肺炎(hap),特别是在人工通气(vap)条件下获得的hap;
[0771]-继发于肺炎的ali/ards,不考虑肺炎的不同病理解剖表现,例如但不限于大叶(即影响整个肺叶)、小叶(即影响较小的肺小叶)、间质(即肺组织的弥漫性病变);
[0772]-继发于由细菌和/或病毒感染引起的肺炎的ali/ards;
[0773]-继发于由病毒引起的原发性肺部感染的细菌重复感染引起的肺炎的ali/ards;和
[0774]-预防和/或治疗肺移植后的肺功能障碍。
[0775]
127.式(i)的化合物
[0776][0777]
其中
[0778]
n代表数字0、1、2或3,r1代表氢、甲基、乙基、正丙基或异丙基;r2代表用甲氧基封端的直链或支链peg 20kda至80kda;或其水合物、其溶剂化物、其盐、其药学上可接受的盐、或
其盐的溶剂化物;如条款1至119中任一项所定义的或根据式(ia)的化合物
[0779][0780]
如条款1至119中任一项所定义,用于治疗和/或预防继发于由肺部细菌感染引起的肺炎的ali/ards,例如但不限于由肺炎双球菌、流感嗜血杆菌、肺炎支原体、衣原体属种、肠球菌、β-溶血性链球菌、葡萄球菌、革兰氏阴性肠杆菌科、假单胞菌属种、克雷伯氏菌属种、不动杆菌属种、军团杆菌属种和分枝杆菌;继发于由以下病毒感染引起的肺炎的ali/ards,例如但不限于流感病毒(例如由血清型h1n1、h5n1、h7n9毒株引起)、冠状病毒(例如,严重急性呼吸综合症(sars)的病原体sars-cov、中东呼吸综合征(mers)的病原体mers-cov和covid-19大流行病的病原体sars-cov-2)、呼吸道合胞病毒(rsv)和巨细胞病毒(cmv);继发于由真菌感染引起的肺炎的ali/ards,例如但不限于由耶氏肺孢子菌引起的真菌性肺炎;继发于肺炎的ali/ards,不考虑肺炎的来源,例如社区获得性肺炎(cap)和医院获得性肺炎(hap),特别是在人工通气(vap)条件下获得的hap;继发于肺炎的ali/ards,不考虑肺炎的不同病理解剖表现,例如但不限于大叶(即影响整个肺叶)、小叶(即影响较小的肺小叶)、间质(即肺组织的弥漫性病变);继发于由细菌和/或病毒感染引起的肺炎的ali/ards;继发于由病毒引发的原发性肺部感染的细菌重复感染引起的肺炎的ali/ards。
[0781]
128.根据条款1至119中任一项所述的药物制剂、根据条款120所述的药物或根据条款121至123中任一项所述的组合药物剂型、根据条款124所述的组合包、如条款1至119中任一项所定义的式(i)的化合物,如条款1至119中任一项所定义的式(ia)的化合物,用于治疗和/或预防疾病或病症,优选选自条款126和/或127中列出的疾病的用途。
[0782]
129.根据条款1至119中任一项所述的药物制剂,用于制备用于治疗和/或预防疾病或病症,优选选自条款126和/或127中列出的疾病的药物。
[0783]
130.治疗和/或预防病症和/或疾病,优选选自条款126和/或127中列出的疾病的方法,其包括施用条款1至119中任一项的药物制剂、条款120的药物,或条款121至123中任一项的组合药物剂型、条款124的组合包、如条款1至119中任一项所定义的式(i)的化合物、如条款1至119条中任一项所定义的式(ia)的化合物。
[0784]
131.一种用于制备条款1至119中任一项的药物制剂的方法,其包括
[0785]
以下步骤:
[0786]
步骤1.提供组分a、b、c和d;和
[0787]
步骤2.混合步骤1中提供的组分;
[0788]
从而获得条款1至119中任一项的以下药物制剂。
[0789]
132.根据条款131所述的方法,其中所述方法还包括步骤3和/或步
[0790]
骤4:和/或步骤5
[0791]
步骤3.将药物制剂的ph调节至ph为3至5;和/或
[0792]
步骤4.将药物制剂的渗透压调节至渗透浓度为150至450mosmol/l;
[0793]
其中步骤3可在步骤1、2和/或步骤4之前、期间和/或之后进行;和/或其中步骤4可在步骤1、2和/或步骤3之前、期间和/或之后进行。
[0794]
133.根据条款131至132中任一项所述的方法,其中所述方法包括以下步骤
[0795]-提供peg-adm的水性制剂,其包含柠檬酸和任选地至少一种ph调节剂以调节ph至3.5和4.5,
[0796]-然后浓缩peg-adm的水性制剂和
[0797]-随后通过添加柠檬酸和/或柠檬酸钠的溶液、任选地至少一种ph调节剂和渗透压调节剂和水来重构/稀释浓缩的产物,和
[0798]
其中药物制剂的渗透浓度为150-450mosmol/l;并且其中所得水性制剂的ph在3.5和4.5之间。
[0799]
134.根据条款131至133中任一项所述的方法,其中所述方法包括以下步骤
[0800]-提供peg-adm的水性制剂,其包含柠檬酸和任选地至少一种ph调节剂以调节ph至3.5和4.5,
[0801]-提供柠檬酸和/或柠檬酸钠,任选地至少一种ph调节剂和渗透压调节剂,和
[0802]-混合所提供的溶液,和
[0803]
其中药物制剂的渗透浓度为150至450mosmol/l;并且其中所得水性制剂的ph在3.5和4.5之间。
[0804]
135.根据条款131至134中任一项所述的方法,其中所述方法还包括步骤5
[0805]
步骤5至少部分冷冻在步骤1、2、3和/或4中任一步骤后获得的药物制剂;其中步骤4可在步骤1、2、3和/或步骤4之前、期间和/或之后进行。
[0806]
136.根据条款1至119中任一项所述的制剂可通过条款131至135中任一项的方法获得。
附图说明
[0807]
图1:图1示出了实施例1的dsc。实施例的制备在下文b-1部分中描述。dsc方法在下文c-1部分中描述。结果在下文d-1部分中描述。
[0808]
图2:图2示出了实施例8的dsc。实施例的制备在下文b-1部分中描述。dsc方法在下文c-1部分中描述。结果在下文d-1部分中描述。
[0809]
图3:在图3中,示出了实施例1-批次1、实施例1-批次2和实施例8在24个月的时间段内的聚集和降解(方法如c-2部分“sec-hplc纯度,单体部分”中所描述)。
[0810]
图4:在图4中,描绘了使用如c-3部分中描述的“用于测定peg-adm的rp-hplc”的纯度分析(用于peg-adm以及相关物质和降解产物的定量和鉴定)。
实施例
[0811]
以下工作实施例说明了本发明。本发明不限于所述实施例。除非另有说明,否则以下测试和实施例中的百分比均为重量百分比;份数为重量份数。液体/液体溶液的溶剂比、稀释比和浓度数据均各自基于体积计。
[0812]
对于下文描述的所有实施例,使用40kda peg-adm(参见式(ia)的化合物)。大约7.7mg该40kda peg-adm等于1mg adm。
[0813]
a.缩写
[0814]
adm肾上腺髓质素(人)dsc差示扫描量热法fpf细颗粒分数gsd几何标准差peg聚乙二醇p.a.分析纯(pro analysis)q.s.适量vmd体积中值直径
[0815]
氨基酸和肽序列的命名根据:
[0816]
国际纯粹与应用化学联合会和国际生物化学联合会:氨基酸和肽的命名和符号(推荐规范1983)。在pure&appl.chem.56,第5卷,1984,第595
–
624页中。
[0817][0818][0819]
b制备补充有柠檬酸和柠檬酸钠的peg-adm溶液
[0820]
b-1制备包含组分a至d的药物制剂:
[0821]
制备包含组分a至d的不同的药物制剂(实施例1至13)。对于下文描述的所有实施例,使用式(ia)的化合物(40kda peg-adm)。约7.7mg该40kda peg-adm等于1mg adm。药物制剂的组成和所得的包含于最终药物制剂中的peg-adm[adm]的浓度列于下文表1-1和1-2中:
[0822]
表1-1和表1-2分别示出了实施例1至8和实施例9至13的组成。包含于peg-adm中的adm的浓度在方括号中给出。当提及peg-adm时,使用式(ia)的化合物。在使用的peg-adm批次中,约7.7mg peg-adm包含约1mg adm(参见例如浓度为7.7mg/ml peg-adm的实施例8,其等于浓度为1mg/ml adm)。“hcl”意指10%(m/v)盐酸。使用10%盐酸调节ph至大约4。“q.s.”意指“适量”,用于调节ph至大约4。
[0823]
表1-1使用的peg-adm为式(ia)的化合物。包含于peg-adm中的adm的浓度在方括号中给出([adm浓度])。
[0824][0825][0826]
表1-2使用的peg-adm为式(ia)的化合物。包含于peg-adm中的adm的浓度在方括号中给出([adm浓度])。
[0827][0828]
对于实施例1至13的制备,使用缓冲溶液和包含peg-adm(bayer ag,germany)溶液的储备溶液来制备实施例1至13的药物制剂。实施例1至13的最终ph约为4。通过mettler toledo的卓越t5(excellence t5)滴定仪测定ph。
[0829]
下文描述了实施例1的制备。对于实施例1的制备,使用储备缓冲溶液和包含peg-adm(bayer ag,germany)溶液的储备溶液。实施例1的最终ph约为4。渗透浓度约为300mosmol/l。
[0830]
储备缓冲溶液:如下制备ph为4.0的储备缓冲溶液:将容器装满水并与5.8877g柠檬酸一水合物和2.3203g氢氧化钠混合。用6.3ml盐酸将ph调节至4.0。将溶液装入容量瓶中,并加水至1000ml。将500ml缓冲液与4.50g氯化钠混合。加入1.3ml 1n氢氧化钠以将ph调节至4.0。
[0831]
包含peg-adm的储备溶液:peg-adm储备溶液的peg-adm浓度为7.7mg/ml(包含1mg/ml adm)。
[0832]
实施例1:对于实施例1,将9.6ml peg-adm储备溶液与10.4ml储备缓冲溶液混合,获得0.48mg/ml adm的溶液。
[0833]
实施例2:对于实施例2,将1ml peg-adm储备溶液与19ml储备缓冲溶液混合,获得0.05mg/ml adm的溶液。
[0834]
相应地制备实施例3至11。
[0835]
用于实施例12和13的储备溶液的peg-adm浓度为31.26mg/ml(包括4.06mg/ml adm)。
[0836]
b-2粘度
[0837]
实施例1至13的粘度测定如下:使用anton paar amvn自动微粘度计,根据ph.eur 2.2.49(2018)的自动滚球粘度计法测定粘度。
[0838]
测量结果列于下文表2-1和2-2中:
[0839]
表2-1实施例1至7和缓冲液的粘度
[0840][0841]
表2-2实施例8至13的粘度
[0842][0843]
b-3制备用于dsc分析的peg-adm溶液
[0844]
用于dsc分析的peg-adm溶液通过以下方式制备:融化分别含有约3.696和7.7mg/ml peg-adm(相当于peg-adm中包含0.48mg/ml和1mg/ml adm)于ph为4的柠檬酸盐缓冲液中的实施例1和8(参见上文b-1部分),并将融化的溶液与含有氯化钠于ph为4的柠檬酸盐中的制剂缓冲液混合。搅拌所得溶液,通过预过滤器和除菌过滤器过滤,并无菌灌装至小瓶中,所述小瓶随后用注射塞封闭并用制药帽密封。将装有配制的peg-adm溶液的小瓶冷冻至《-15℃。
[0845]
以与b.1部分所述溶液相同的方式制备实施例9-13的用于dsc分析的样品。
[0846]
c分析:方法
[0847]
本部分c描述了用于分析药物制剂的一般方法。该分析的结果在下文d部分中进行了描述和讨论。
[0848]
c-1部分中描述的dsc方法用于热表征药物制剂。
[0849]
还分析了药物制剂的稳定性。稳定性分析包括研究药物制剂特别是peg-adm的潜
在聚集和降解。特别地,如c-2部分中所述的“用于纯度、单体部分的sec-hplc”用于确定peg-adm(单体部分)的量和/或hmw聚集体(高分子量聚集体)一定时期内形成。单体部分为peg-adm的预期形式,hmw的形成表明peg-adm分子聚集形成二聚体或更高的聚集体,因此hmw的形成是药物制剂不稳定的指标。研究了在-20℃的储存温度下超过24个月的稳定性。将c-3部分中所述的“用于测定peg-adm的rp-hplc”用于peg-adm及其相关物质和降解产物的定量和鉴定。
[0850]
进行了如c-4部分中所述的冻融循环研究,以研究药物制剂在重复冻融循环后的稳定性。
[0851]
使用c-5部分中描述的方法分析雾化特性。
[0852]
c-1dsc方法
[0853]
分析实施例1和8(参见上文b-1部分)。使用带有通用分析软件的ta instruments q2000 dsc进行差示扫描量热法测量。为了区分导致氯化钠部分或完全结晶的慢速冷冻和阻止结晶的快速冷冻,应用了两种不同的温度曲线。
[0854]
慢速冷冻方法包括在室温下将装有样品的tzero盘和空的参照盘装入测量池中,然后以5.0℃/min将温度降低至-30℃。将温度保持在-30℃下保持15分钟,然后以10℃/min进一步降温至-80℃,并将样品在-80℃下保持10分钟。等温保持后,将温度以10℃/min升高至+10℃。
[0855]
快速冷冻方法包括在室温下将装有样品的tzero盘和空的参照盘装入测量池中,然后以10℃/min将温度降至-80℃,并将样品保持在-80℃下保持10分钟。等温保持后,将温度以10℃/min升高至+10℃。
[0856]
使用与上述程序相同的两种方法,通过dsc制备并分析实施例9-13的样品。
[0857]
c-2方法:用于peg-adm纯度的sec-hplc
[0858]
分析实施例1和8(参见上文b-1部分)以及实施例9-13。hplc、尺寸排阻色谱(sec-hplc),在280nm下进行紫外检测,通过100%方法比较峰面积进行分析。peg-adm(单体部分)以及二聚体和hmw聚集体(高分子量聚集体)的分离和定量通过sec-hplc在sec柱上使用100%面积法进行。(欧洲药典,2.2.29(2015),usp《621》(2011))。
[0859]
流动相由nah2po4一水合物、nacl分析纯、用于色谱的水、乙醇hplc级和25mm ph 4.0柠檬酸盐缓冲液制备。
[0860]
作为固定相,例如可使用长度为300mm、内径为7.8mm的wyatt sec蛋白质色谱柱wtc-030s5。在22℃的温度和30分钟的运行时间下应用流速为0.5ml/min的等度洗脱,进样体积为50μl。
[0861]
c-3方法:rp-hplc用于测定peg-adm
[0862]
分析实施例1和8(参见上文b-1部分)。peg-adm以及相关物质和降解产物的分离、定量和鉴定通过rp-hplc进行:在反相柱上,使用外标法或100%面积法,分别在280nm或210nm下进行紫外检测。(欧洲药典,2.2.29(2015),usp《621》(2011))。
[0863]
流动相由》99.0%三氟乙酸、用于色谱的乙腈、用于色谱的水和25mm柠檬酸盐缓冲液制备。应用介于用于色谱法的0.1% tfa水溶液和用于色谱法的溶于乙腈的0.1% tfa之间的梯度。作为固定相,例如可使用长度为150mm、内径为3.0mm的ymc-triart bio c4。柱温为40℃,运行时间为30分钟,进样体积为50μl。
[0864]
c-4方法:融化循环研究(冻融方案)
[0865]
将实施例8的样品在-70℃下冷冻并在室温下融化。将该循环重复五次。时间表如下表3-1所描述。
[0866]
表3-1:时间表
[0867][0868]
在各个冷冻步骤之前,取1.5ml样品并储存在2-8℃的冷冻小瓶中直至分析。
[0869]
将填充体积为2.28ml的实施例9至13的样品冷冻至-70℃并在室温下融化。将所述循环重复五次。时间表如下表3-2所描述。
[0870]
表3-2:时间表
[0871][0872]
c-5方法:测定雾化特性
[0873]
将实施例1冷冻并重新融化。使用三个不同的带有pro-x控制器的solo雾化器头雾化和测量所述溶液。使用sympatec helos激光衍射进行液滴尺寸测量。
[0874]
将实施例9
–
13冷冻并重新融化。使用三个不同的带有pro-x控制器的solo雾化器头雾化和测量所述溶液。使用sympatec helos激光衍射进行液滴尺寸测量。
[0875]
d结果
[0876]
d-1结果:dsc
[0877]
分析了实施例1和8。图1(实施例1)和图2(实施例8)中描绘了dsc。通过差示扫描量热法对溶液的热表征表明,非晶态溶质的玻璃转化温度相对较低,为-58℃,而完全结晶的氯化钠溶液的共晶温度为-22℃。这些热特性清楚地表明溶液是不稳定的,除非其在例如-58℃或更低的储存温度下以完全冷冻的状态存在。
[0878]
分析了实施例9
–
13。结果总体上与实施例1和8的结果均有很好的可比性。实施例9、10和11还显示了在-58℃冷冻期间的玻璃转化温度、约-52℃的小结晶峰和约-22℃的表明共晶的吸热峰。所应用的热处理方法的峰强度不同。
[0879]
含有较高浓度peg-adm的样品12和13在加热过程中显示不太明显的结晶和共晶峰,这可表明peg-adm含量部分抑制了制剂中nacl的结晶。
[0880]
与实施例1和8相同,这些热特性表明实施例9至13的溶液是不稳定的,除非其在例如-58℃或更低的储存温度下以完全冷冻的状态存在。
[0881]
d-2结果:稳定性分析
[0882]
在-20℃的储存温度下,在24个月的时间段内观察实施例1和实施例8(参见上文b-1部分)的稳定性。分析了两批次实施例1(实施例1-批次1;实施例1-批次2)和一批次实施例8。分别在0、2、3、6、9、12和24个月后,采用上述c-2和c-3部分中描述的方法采集并分析各批次的样品。
[0883]
实施例1-批次1、实施例1-批次2和实施例8的稳定性结果显示于下文的图3和4中。
[0884]
在图3中,显示了实施例1-批次1、实施例1-批次2和实施例8的聚集(方法如c-2部分“用于纯度的sec-hplc,单体部分”中所述)。从图3中可以看出,在24个月的时间段内,peg-adm的单体部分的量保持在多于99%。因此,在24个月期间仅生成了少量的hmw聚集体(高分子量聚集体)或二聚体。这表明药物制剂表现出极好的稳定性。
[0885]
在图4中,将c-3部分中所述的“用于测定peg-adm的rp-hplc”用于定量和鉴定peg-adm及其相关物质和降解产物。从图4可以看出,在24个月的时间段内,各个样品的peg-adm含量超过约96%或换句话说,各个样品显示peg-adm的含量损失仅为1%至3%。因此,在24个月的时间里,只生成了少量的相关物质和降解产物。这表明药物制剂表现出极好的稳定性。
[0886]
总之,药物制剂(实施例1和8)在24个月期间表现出非常好的稳定性。
[0887]
对于实施例9至13,在1个月期间观察稳定性。1个月期间的储存和样品的分析如上文实施例1和8所述的进行。结果如下表3-3所示:
[0888]
表3-3:实施例9至13在1个月期间的稳定性
[0889][0890][0891]
从表3-3可以看出,实施例9至13在1个月期间表现出非常好的稳定性。
[0892]
d-3结果:融化循环研究
[0893]
研究了实施例8和实施例9至13的融化循环稳定性。为了评估潜在的聚集和降解,进行了sec-和rp-hplc(方法描述于c-2和c-3部分)。五次冻融循环前后的结果显示于下表4-1(实施例8)和表4-2(实施例9至13)。
[0894]
表4-1:实施例8的5次冻融循环前后的测试方法和结果
[0895][0896]
在五次融化循环之前,实施例8的纯度为99.72%(rp-hplc;c-3部分)和99.34%(纯度,单体部分;sec-hplc;c-2部分)。在五次融化循环之前,实施例8的纯度为99.65%(rp-hplc;c-3部分;与“之前”差额0.07%)和99.30%(纯度,单体部分;sec-hplc;c-2部分;与“之前”差额0.04%)。
[0897]
因此,经过五次冷冻和融化循环后,几乎没有观察到降解或聚集。这些结果表明即使冷冻和重新融化实施例8也显示出极好的稳定性。
[0898]
表4-2:实施例9至13的5次冻融循环之前、期间和之后的测试方法和结果。
[0899][0900][0901]
结果证实,即使冷冻和重新融化数次,实施例9至13也具有极好的稳定性。
[0902]
d-4雾化实验
[0903]
实施例1的雾化特性结果如下表5所示。实施例1的样品用三个不同的带有pro-x控制器的solo雾化器头(参见表5中的雾化器批号1、2和3)进行雾化。
[0904]
表5实施例1(冷冻和重新融化制剂)的雾化特性,表示为体积中值直径(vmd,单位为微米(μm))。gsd意指几何标准偏差。以克每分钟(g/min)为单位的“输出速率”表示每分钟雾化的溶液克数(处理量)。以百分比(%)为单位的“fpf”表示细颗粒分数,其表示颗粒/液
滴的百分比小于5μm。
[0905][0906]
对于各个aerogen solo雾化器,可将peg-adm溶液雾化成具有预期液滴大小、窄几何标准偏差的液滴,并且溶液的输出速率使1ml溶液在4至5分钟内雾化。细颗粒分数在55%和59%之间,其与设备的预期输出一致。结果证实,冷冻和融化的peg-adm制剂可使用aerogen solo设备以合适的方式雾化,用于通过吸入递送peg-adm。
[0907]
实施例9-13的雾化特性结果如下表6所示。实施例9至13的样品的每个制剂使用三个不同的带有pro-x控制器的solo雾化器头进行雾化。
[0908]
表6实施例9至13(冷冻和重新融化的制剂)的雾化特性,表示为体积中值直径(vmd,单位为微米(μm))。gsd意指几何标准偏差。以克每分钟(g/min)为单位的“输出速率”表示每分钟雾化的溶液克数(处理量)。以百分比(%)为单位的“fpf”意指细颗粒分数,其表示颗粒/液滴的百分比小于5μm。
[0909][0910]
对于实施例9至11,可将peg-adm溶液多次雾化为具有预期液滴尺寸、窄几何标准偏差的液滴,并且溶液的输出速率能使1ml溶液在2-3分钟内雾化。细颗粒分数在47%和62%之间,这与设备的预期输出一致。结果证实,实施例9-11中描述的冷冻和融化的peg-adm制剂可使用solo设备以合适的方式雾化,用于通过吸入递送peg-adm。
[0911]
对于实施例12,可将peg-adm溶液雾化为液滴,但是液滴尺寸在雾化过程中显著增加,并且几何标准偏差高于实施例9-11的较低浓度的溶液。这也影响了减少的细颗粒分数,以及处理量。
[0912]
对于实施例13,不可能通过solo雾化器产生液滴,因为溶液太粘而无法通过雾化器膜。因此,无法测定雾化特性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1