降解性能和弹性可调控的单分散明胶壳聚糖复合栓塞微球及其制备方法
1.本发明属于生物医药技术领域,涉及栓塞微球及其制备工艺,更具体地,涉及降解性能和弹性可调控的单分散明胶壳聚糖复合栓塞微球及其制备方法。
背景技术:
2.实体瘤发展到中晚期,往往手术不可切除,栓塞治疗成为了一种可供选择的姑息治疗方法,栓塞治疗是指通过微创手术将栓塞材料注入肿瘤附近的血管中以阻断肿瘤的血供。相较于普通的化疗或放疗,栓塞治疗可减少副作用,提高患者依从性及治疗效率。
3.可用于栓塞治疗的固体栓塞材料有pva、弹簧项圈等等,但因其生物不可降解性,导致它们的应用受到了很多的限制,例如无法进行二次栓塞等。由于明胶和壳聚糖具有良好的生物相容性,材料无毒、价格低廉、来源丰富、可生物降解,因而二者在生物医学领域得到了广泛的应用。目前常采用乳化交联的方式制备明胶壳聚糖复合栓塞微球。乳化交联是将作为分散相的明胶壳聚糖溶液与连续相混合,在一定温度搅拌乳化一定时间后,加入交联剂和催化剂搅拌,交联固化即得明胶壳聚糖微球。该方法将水相与油相混合搅拌乳化形成的明胶壳聚糖液滴大小不均,且尺寸很难控制,交联固化得到的明胶壳聚糖微球的单分散性很差,形态也不规则。因为不规则的微球和乳化交联法的缺陷,导致明胶壳聚糖微球变得不可控,无法探讨和发挥其所具备的性质。
4.微流控液滴形成技术可在微流控通道内实现液滴生成和液滴操作,在微流控芯片上生成的液滴单分散性好,利用该技术有望改善微球的单分散性。但目前还没有研究者使用微流控技术制备明胶壳聚糖复合栓塞微球,其主要难点在于明胶在低于40℃的环境下会迅速凝固成凝胶态,堵塞装置,使得微球无法生产。对于利用微流控技术来改善明胶壳聚糖复合栓塞微球的球形度和单分散性而言,微流控体系的选择是至关重要的,若微流控体系选择不当,则容易造成交联剂难以与乳液中的组分无法充分接触并反应,导致微球单分散不佳。
5.现有技术在制备明胶壳聚糖复合微球时,采用的交联剂大多为戊二醛或甲醛,但这些交联剂交联制备得到的微球的生物相容性差、具有较大的生物毒性,无法用于栓塞治疗,而只能用于对生物相容性没有要求的领域,例如用作吸附材料等。陈朝晖(降解壳聚糖/明胶复合微球的制备及其对活性染料吸附性能研究[j].齐齐哈尔大学,2018.)以降解壳聚糖、明胶为原料,戊二醛为交联剂,采用反相悬浮交联法制备出一系列具有高效吸附解吸功能的球形复合吸附材料。一方面,该复合微球因具有生物毒性而无法用于栓塞治疗,另一方面,该方法制备的复合微球的粒径不均一且形貌较差。对于栓塞治疗而言,若栓塞微球的球形度和单分散性不佳,则无法准确预测栓塞微球的运动轨迹,容易造成栓塞微球的误栓。此外,该方法中交联剂会同时与壳聚糖和明胶发生交联反应,导致复合微球的弹性受限,且弹性与生物降解时间难以调控。
[0006]
因此,若能通过制备方法的改进来提高明胶壳聚糖复合栓塞微球的球形度和单分
散性,并实现连续无毒制备,同时实现明胶壳聚糖复合栓塞微球的降解时间可控以及弹性可控,对于改善现有明胶壳聚糖复合栓塞微球的品质,推进明胶壳聚糖复合栓塞微球在临床中更好地应用将产生积极的意义。
技术实现要素:
[0007]
针对现有明胶壳聚糖复合微球存在的球形度不佳、单分散性不好,生物相容性差以及降解性与弹性不可调控等问题,本发明提供了降解性能和弹性可调控的单分散明胶壳聚糖复合栓塞微球及其制备方法,以在实现复合栓塞微球连续无毒制备的同时提高复合栓塞微球的单分散性,减小误栓的可能性,并实现明胶壳聚糖复合栓塞微球降解时间和弹性的可控调节。
[0008]
为实现上述发明目的,本发明采用的技术方案如下:
[0009]
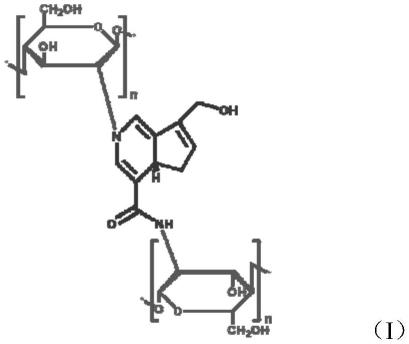
一种降解性能和弹性可调控的单分散明胶壳聚糖复合栓塞微球,该复合栓塞微球包括交联壳聚糖和明胶,交联壳聚糖的结构如式(i)所示;
[0010][0011]
该复合栓塞微球以交联壳聚糖为骨架,明胶分布于骨架的三维网络结构中,交联壳聚糖与明胶的质量比为(0.5~2):(1~10);该复合栓塞微球呈球形且粒径变异系数不超过5%。
[0012]
上述单分散明胶壳聚糖复合栓塞微球的技术方案中,交联壳聚糖是壳聚糖与交联剂京尼平经交联反应形成的,二者的交联反应的示意图如图1所示。
[0013]
上述单分散明胶壳聚糖复合栓塞微球的技术方案中,所述复合栓塞微球的降解性能、弹性和溶胀性能可通过调节该复合栓塞微球中交联壳聚糖与明胶的质量比、交联壳聚糖的交联密度进行调节。
[0014]
上述单分散明胶壳聚糖复合栓塞微球的技术方案中,所述复合栓塞微球的粒径可根据实际应用需求通过调节制备时的工艺参数进行调整,通常,所述复合栓塞微球的粒径为30~700μm,。
[0015]
上述单分散明胶壳聚糖复合栓塞微球的技术方案中,所述复合栓塞微球的粒径变异系数通常在1%~5%之间。
[0016]
本发明还提供了上述单分散明胶壳聚糖复合栓塞微球的制备方法,包括以下步骤:
[0017]
(1)配制内相、外相流体和收集液
[0018]
配制内相流体:将明胶和壳聚糖溶解于乙酸水溶液中,得到内相流体;内相流体中,乙酸水溶液、明胶、壳聚糖的质量比为1:(0.01~0.1):(0.005~0.02),乙酸水溶液的浓度为0.16~0.32mol/l;
[0019]
配制外相流体:将油溶性表面活性剂溶解于正辛醇中,得到外相流体;外相相流体中,正辛醇与油溶性表面活性剂的质量比为1:(0.01~0.2);
[0020]
配制收集液:将交联剂京尼平溶解于正辛醇中,得到收集液;收集液中,正辛醇与京尼平的质量比为1:(0.001~0.01);
[0021]
(2)制备单分散明胶壳聚糖复合栓塞微球
[0022]
将内相流体输入微流体装置的注射管中,将外相流体输入微流体装置的收集管中,在收集管中形成单分散的油包水乳液,采用盛有收集液的容器收集所述单分散油包水乳液,在收集液中,单分散油包水乳液液滴水相中的壳聚糖与收集液中的交联剂京尼平聚合反应形成交联壳聚糖,单分散油包水乳液液滴即转变为单分散明胶壳聚糖复合栓塞微球;
[0023]
该步骤中,将微流体装置置于温度控制在40~65℃的恒温环境中进行制备;
[0024]
(3)洗涤
[0025]
采用有机溶剂洗涤去除单分散明胶壳聚糖复合栓塞微球表面的收集液,然后去除单分散明胶壳聚糖复合栓塞微球表面的有机溶剂。
[0026]
上述单分散明胶壳聚糖复合栓塞微球的制备方法的步骤(2)中,优选将微流体装置置于温度控制在40~65℃的恒温恒湿箱中进行制备。
[0027]
上述单分散明胶壳聚糖复合栓塞微球的制备方法的步骤(2)中,优选控制内相流体的流量为50~700μl/h,优选外相流体的流量为1~10ml/h。
[0028]
上述单分散明胶壳聚糖复合栓塞微球的制备方法的步骤(2)中采用的微流体装置的注射管与收集管同轴设置,注射管的出口处的内径为40~250μm。一种可行的微流体装置的结构如图2所示,包括注射管、连接管和收集管,与注射泵配合使用;注射管由圆柱形玻璃毛细管制作,其尾部拉成圆锥形;收集管为圆柱形玻璃毛细管;连接管为方形玻璃管,其中心部位设置有正方形通孔;注射管的尾部插入收集管的头部并通过连接管连接;注射管、连接管和收集管同轴设置。
[0029]
上述单分散明胶壳聚糖复合栓塞微球的制备方法的步骤(2)中,通过调节微流体装置的通道尺寸,可对油包水乳液液滴的尺寸进行调整,通过调节内相流体和外相流体的流量,也可调整油包水乳液液滴的尺寸。通过调整油包水乳液液滴的尺寸,可调节明胶壳聚糖复合栓塞微球的尺寸。
[0030]
上述单分散明胶壳聚糖复合栓塞微球的制备方法的步骤(2)中,聚合反应的时间会受到油包水乳液液滴的尺寸的影响,随着油包水乳液液滴尺寸的增大,需要的聚合反应时间会增长。通常控制聚合反应的时间至少为1h,优选地,控制聚合反应的时间为1~12h。
[0031]
上述单分散明胶壳聚糖复合栓塞微球的制备方法中,所述油溶性表面活性剂为聚蓖麻酸甘油酯、油酸二乙醇酰胺、span20、span40、span60、span80或tween85。
[0032]
上述单分散明胶壳聚糖复合栓塞微球的制备方法的步骤(2)中,在满足上述限定的内相流体、外相流体和收集液组成,以及内相流体和外相流体的流量的基础上,通过调节内相流体中明胶和壳聚糖的含量,外相流体中京尼平的含量以及聚合反应的时间,可调节
复合栓塞微球的降解性能、弹性和溶胀性能。
[0033]
本发明中,单分散明胶壳聚糖复合栓塞微球的形成机理及其降解性能、弹性和溶胀性可调控的原因如下:
[0034]
如图1所示,京尼平可与壳聚糖交联反应形成交联壳聚糖但不与明胶反应,本发明以含有明胶和壳聚糖的溶液作为内相流体,将内相流体和外相流体输入微流体装置中,形成单分散的油包水乳液,以该油包水乳液作为模板,采用盛有收集液的容器收集该油包水乳液。收集液是将京尼平溶解于正辛醇中形成的,溶解于正辛醇中的京尼平可穿过油包水乳液的油相进入油包水乳液的水相,与油包水乳液的水相中的壳聚糖反应,由于收集液与外相流体都是以正辛醇为基础配制得到的,因而收集液中的京尼平只用跨越一层水油界面即可快速引发聚合反应,最终将单分散的油包水乳液转变成单分散明胶壳聚糖复合栓塞微球,避免了油包水中的水相难以接触到收集液中的京尼平或者的接触不充分而造成的栓塞微球的球形度和单分散性差的问题。
[0035]
明胶是一种降解速率较快的材料,最快降解时间只需15天,而壳聚糖是一种降解速率较慢的材料,其降解时间相对较长,壳聚糖最长需2年的时间才能实现完全降解。本发明采用明胶和壳聚糖作为原料,以京尼平作为交联剂与壳聚糖交联来制备复合栓塞微球,通过调节明胶与壳聚糖的比例,可实现栓塞微球降解时间的可控调节。由于明胶具有较好的弹性,而壳聚糖的弹性较差,将壳聚糖与京尼平交联后,以交联壳聚糖作为复合栓塞微球的骨架,以明胶作为填充物填充在骨架的三维网络结构中,能够赋予栓塞微球较好的弹性并实现弹性及溶胀性能的可控调节。较好的弹性意味着在栓塞治疗时候该复合栓塞微球具有较好的可压缩性和回弹性,在栓塞微球注射时候易于注射而不容易发生堵塞,较好的可压缩性意味着该复合栓塞微球可以栓塞到更小尺寸的血管处,形成完全栓塞。降解时间可控对于栓复合栓塞塞微球的不同应用提供了途径,在根据不同使用方法如化疗、放疗和多功能栓塞微球上,能提供相应的治疗方式所希望的的降解时间,实现高效栓塞和二次注射。
[0036]
与现有技术相比,本发明的技术方案产生了以下有益的技术效果:
[0037]
1.本发明提供了降解性能和弹性可调控的单分散明胶壳聚糖复合栓塞微球,该复合栓塞微球由交联壳聚糖和明胶组成,以交联壳聚糖为骨架,明胶分布于骨架的三维网络结构中,该复合栓塞微球具有良好的单分散性。由于明胶的降解速率较快而壳聚糖的降解速率较慢,本发明以明胶与壳聚糖作为原料,以京尼平作为交联剂与壳聚糖交联来制备复合栓塞微球,通过调节明胶和壳聚糖的比例,可实现栓塞微球降解性能的可控调节。同时,由于明胶具有较好的弹性,而壳聚糖的弹性较差,本发明以壳聚糖与京尼平交联后形成的交联壳聚糖作为复合栓塞微球的骨架,以明胶作为填充物填充在骨架的三维网络结构中,可赋予栓塞微球较好的弹性和实现弹性及溶胀性能的可控调节。栓塞微球良好的单分散性有利于预测其运动轨迹并减小误栓的可能性。以上特点有利于改善现有栓塞微球的栓塞效果并更好地用于不同治疗需求的栓塞方式,解决了现有明胶壳聚糖微球存在的单分散性差、具有生物毒性,弹性及降解性能不可调等问题,对于推进明胶壳聚糖复合栓塞微球在临床中更好地应用将产生积极的意义。
[0038]
2.本发明提供的单分散明胶壳聚糖复合栓塞微球,是以明胶和壳聚糖为基础制备得到的,明胶和壳聚糖为获得fda批准的材料,生物相容性良好,因而制成的栓塞微球具有生物相容性好的特点,同时,本发明提供的栓塞微球的形貌均一、球形度好,单分散性好,其
粒径的变异系数不超过5%,这是现有的明胶壳聚糖复合栓塞微球所无法达到的,可解决现有明胶壳聚糖复合栓塞微球因尺寸不均一而不利于预测微球的运动轨迹以及容易造成误栓的问题,有利于推进明胶壳聚糖复合栓塞微球在临床实践中更好地的应用,提高栓塞治疗的安全性。
[0039]
3.本发明构建了以微流控技术为基础的明胶壳聚糖复合栓塞微球的制备方法,该方法的制备过程简单可控,生产成本低,可实现连续生产,有利于实现明胶壳聚糖复合栓塞微球的批量化生产。同时,该方法制备的栓塞微球的尺寸均一可控,单分散性好,通过调节各相流体的流量和微流体装置的注射管的锥口尺寸和收集管的管径可精确控制栓塞微球的尺寸,通过改变内相中明胶和壳聚糖的含量、以及外相流体中京尼平的含量,可调节复合栓塞微球的降解性能及力学性能,具有可调可控性好的特点。
附图说明
[0040]
图1是本发明w/o乳液中的壳聚糖微球与收集液中的京尼平进行聚合反应的示意图。
[0041]
图2是本发明采用的一级毛细管微流体装置的结构示意图,图中,1-注射管、2-连接管、3-收集管。
[0042]
图3是实施例1制备的w/o乳液的光学显微镜照片。
[0043]
图4是实施例1制备的w/o乳液液滴的直径随内外相流体流量变化的曲线(a图)和w/o乳液液滴的直径变异系数(b图)。
[0044]
图5是实施例2制备的复合栓塞微球的光学显微镜照片。
[0045]
图6是实施例2中w/o乳液与复合栓塞微球的缩比关系曲线(a图)和复合栓塞微球的粒径变异系数(b图)。
[0046]
图7是实施例3以不同收集液为基础收集液制备的复合栓塞微球的溶胀性能曲线(a图)和弹性曲线(b图)。
[0047]
图8是实施例4制备的复合栓塞微球的溶胀特性曲线。
[0048]
图9是实施例5制备的w/o乳液和复合栓塞微球的光学图片。
[0049]
图10是实施例6制备的w/o乳液和复合栓塞微球的光学图片。
[0050]
图11是实施例7制备的不同配比w/o乳液和复合栓塞微球的光学图片。
[0051]
图12是实施例7制备的不同配比复合栓塞微球的力位移曲线和弹性模量。
具体实施方式
[0052]
以下通过实施例对本发明所述降解性能和弹性可调控的单分散明胶壳聚糖复合栓塞微球及其制备方法作进一步说明。有必要指出,以下实施例只用于对本发明作进一步说明,不能理解为对本发明保护范围的限制,所属领域技术人员根据上述发明内容,对本发明做出一些非本质的改进和调整进行具体实施,仍属于本发明的保护范围。
[0053]
以下各实施例和对比例中,采用的微流体装置为一级毛细管微流体装置,其结构示意图如图2所示,包括注射管1、连接管2和收集管3,与注射泵配合使用。注射管1由圆柱形玻璃毛细管制作,采用拉针仪将圆柱形玻璃毛细管的尾部拉成圆锥形,然后在砂纸上滚动打磨至锥口内径约为40~250μm的平口,其圆管部段的外径为960μm、内径为500μm;收集管3
由圆柱形玻璃毛细管制作,将圆柱形玻璃毛细管的两端打磨平整得到,收集管的外径为960μm、内径为300~700μm;连接管2为方形玻璃管,将方形玻璃管的两端打磨光滑平整得到,其中心部位设有正方形通孔,通孔尺寸为1.0
×
1.0mm。注射管1、连接管2和收集管3在制作好之后放入无水乙醇中超声清洗并吹干。注射管1的尾部插入收集管2的头部并通过连接管3连接。注射管1、连接管2和收集管3同轴设置并通过ab胶水固定在载玻片上。注射管1上可以套一个钢管,用ab胶水固定非进口端,以便于连接注射泵,连接管2的进口端通过ab胶水固定有平口针头,连接管2的非进口端通过ab胶水密封。各平口针头分别通过管件与注射泵连接。
[0054]
实施例1
[0055]
本实施例中,制备单分散明胶壳聚糖复合栓塞微球,步骤如下:
[0056]
(1)配制内相、外相流体和收集液
[0057]
配制内相流体:将明胶和壳聚糖加入浓度为0.32mol/l的乙酸水溶液中,在40℃的水浴中搅拌至完全溶解,然后冷却至室温,放入真空干燥箱中于室温抽真空以去除溶液中的气泡,得到内相流体;内相流体中,乙酸水溶液、明胶、壳聚糖的质量比为1:0.1:0.02;
[0058]
配制外相流体:将油溶性表面活性剂span80溶解于正辛醇中,得到外相流体;外相相流体中,正辛醇与span80的质量比为1:0.04。
[0059]
配制收集液:将交联剂京尼平(genipin)溶解于正辛醇中,得到收集液;收集液中,正辛醇与京尼平的质量比为1:0.005;
[0060]
(2)制备单分散明胶壳聚糖复合栓塞微球
[0061]
采用结构如图2所示的微流体装置,将微流体装置和注射泵,各相流体以及收集液均置于恒温恒湿箱中,控制恒温恒湿箱的温度为40℃。
[0062]
将内相流体用注射泵输入微流体装置的注射管1中,将外相流体用注射泵输入微流体装置的收集管2中,在收集管2中形成单分散油包水乳液(w/o乳液),采用盛有收集液的容器收集所述单分散w/o乳液,在收集液中,单分散w/o乳液液滴水相中的壳聚糖与收集液中的交联剂京尼平聚合反应1h形成交联壳聚糖,单分散w/o乳液液滴即转变为单分散明胶壳聚糖复合栓塞微球。
[0063]
该步骤中,采用的微流体装置的注射管和收集管具有以下四种不同的尺寸,分别采用这四种微流体装置进行制备:
[0064]
第一种尺寸:注射管的出口处的内径(即锥口内径)为60μm、收集管的内径为300μm;第二种尺寸:注射管的出口处的内径为100μm、收集管的内径为550μm;第三种尺寸:注射管的出口处的内径为150μm、收集管的内径为550μm;第四种尺寸:注射管的出口处的内径为250μm、收集管的内径为700μm。
[0065]
采用第一种尺寸的微流体装置制备时,控制内相流体的流量为100μl/h,分别控制外相流体的流量为0.6、1、1.5、2、2.3ml/h;采用第二种尺寸的微流体装置制备时,控制内相流体的流量为200μl/h,分别控制外相流体的流量为1.28、2、2.66、3、4、4.4ml/h;采用第三种尺寸的微流体装置制备时,控制内相流体的流量为300μl/h,分别控制外相流体的流量为1.5、2.1、3、4.5、6、6.9ml/h;采用第四种尺寸的微流体装置制备时,控制内相流体的流量为400μl/h,分别控制外相流体的流量为2、4、6、8、9.2ml/h。
[0066]
(3)洗涤
[0067]
用异丙醇洗涤去除明胶壳聚糖复合栓塞微球表面的收集液,然后用去离子洗涤去除明胶壳聚糖复合栓塞微球表面的异丙醇,在40℃真空干燥后保存。
[0068]
图3是本实施例制备的部分w/o乳液的光学显微镜照片,其中的a~d图分别代表在不同的流量条件下制备的w/o乳液的光学显微镜照片。由图3可清晰地看出本实施例制备的w/o乳液的尺寸均一性良好。
[0069]
图4的a图是本实施例制备的w/o乳液液滴的直径(de)随外相流体与内相流体流量之比(r
vo/vi
)变化的曲线,图4的b图是本实施例在不同的流量条件下制备的w/o乳液的直径变异系数(coefficient of variation,cv值)。由图4可知,本实施例在不同流量条件下制备的w/o乳液液滴直径的cv值都在0.5%~2.5%之间,均不超过3%,说明本发明的方法制备的w/o乳液液滴的尺寸、形貌均一,单分散性良好。
[0070]
实施例2
[0071]
本实施例中,制备单分散明胶壳聚糖复合栓塞微球,步骤如下:
[0072]
(1)配制内相、外相流体和收集液
[0073]
与实施例1中的内相流体、外相流体和收集液相同。
[0074]
(2)制备单分散明胶壳聚糖复合栓塞微球
[0075]
采用结构如图2所示的微流体装置,其注射管的出口处的内径为60μm、收集管的内径为300μm,将微流体装置和注射泵,各相流体以及收集液均置于恒温恒湿箱中,控制恒温恒湿箱的温度为40℃。
[0076]
将内相流体用注射泵输入微流体装置的注射管中,将外相流体用注射泵输入微流体装置的收集管中,在收集管中形成单分散的w/o乳液,采用盛有收集液的容器收集所述单分散w/o乳液,在收集液中,单分散w/o乳液液滴水相中的壳聚糖与收集液中的交联剂京尼平聚合反应1h形成交联壳聚糖,单分散w/o乳液液滴即转变为单分散明胶壳聚糖复合栓塞微球。
[0077]
该步骤在制备时控制内相流体的流量为100μl/h,控制外相流体的流量分别为0.6、1、1.5、2、2.3ml/h。
[0078]
(3)洗涤
[0079]
用异丙醇洗涤去除明胶壳聚糖复合栓塞微球表面的收集液,然后用去离子洗涤去除明胶壳聚糖复合栓塞微球表面的异丙醇,在40℃真空干燥后保存。
[0080]
图5是本实施例制备的部分明胶壳聚糖复合栓塞微球的光学显微镜照片,其中的a~d图分别为不同流量条件下制备的复合栓塞微球的光学显微镜照片。由图5可清晰地看出复合栓塞微球的球形度和尺寸均一性都非常好。
[0081]
图6的a图是本实施例制备的w/o乳液与栓塞微球的缩比关系曲线,即w/o乳液的直径(de)与由相应的w/o乳液固化形成的复合栓塞微球的直径(d
p
)之间的尺寸关系,图6的b图是在不同流量条件下制备的复合栓塞微球的粒径变异系数(cv值),由图6可知,w/o乳液在固化后,其直径会减小,但固化过程基本未对固化后形成的复合栓塞微球的单分散性造成影响。本实施例在不同外相流体流量条件下制备得到的复合栓塞微球的粒径cv值都在1%~5%之间,均不超过5%,说明发明所述方法制备的复合栓塞微球的尺寸、形貌均一,单分散性良好。
[0082]
实施例3
[0083]
本实施例中,考察收集液中京尼平的含量对制备明胶壳聚糖栓复合塞微球的影响,步骤如下:
[0084]
(1)配制内相、外相流体和收集液
[0085]
内相流体和外相流体与实施例1相同。配制以下四种京尼平含量不同的收集液:
[0086]
将不同量的京尼平溶解于相同量的正辛醇中,得到收集液a、b、c、d;收集液a中,正辛醇与京尼平溶的质量比为1:0.0025;收集液b中,正辛醇与京尼平溶的质量比为1:0.005;收集液c中,正辛醇与京尼平溶的质量比为1:0.0075;收集液d中,正辛醇与京尼平溶的质量比为1:0.01。
[0087]
(2)制备明胶壳聚糖复合栓塞微球
[0088]
分别以收集液a、收集液b、收集液c和收集液d替代实施例2的步骤(2)中的收集液,按照实施例2步骤(2)的方法制备明胶壳聚糖栓塞微球,以考察收集液中京尼平的含量对明胶壳聚糖复合栓塞微球的球形度和单分散性的影响。制备时控制内相流体的流量为100μl/h,控制外相流体的流量分别为1.5ml/h。
[0089]
(3)洗涤
[0090]
用异丙醇洗涤去除明胶壳聚糖复合栓塞微球表面的收集液,然后用去离子洗涤去除明胶壳聚糖复合栓塞微球表面的异丙醇,在40℃真空干燥后保存。
[0091]
图7是以收集液a、b、c、d作为收集液制备的明胶壳聚糖栓塞微球的溶胀性能曲线(a图)和弹性曲线(b图)。将明胶壳聚糖微球放入液相测试槽,在机械强度测试仪上选用10g的传感器,400μm的探针进行测试。由图可知,随着收集液中京尼平含量的增加,壳聚糖的交联密度增加,复合栓塞微球的弹性会降低,因交联壳聚糖作为复合栓塞微球的骨架,交联密度的增加会限制其溶胀性能,使其溶胀性能随着京尼平含量的增加而降低。通过在适当范围内调整收集液中京尼平的含量,可以调整复合栓塞微球的溶胀性。
[0092]
对比例1
[0093]
本对比例中,以京尼平水溶液作为收集液,考察收集液的组成对明胶壳聚糖复合栓塞微球制备的影响。
[0094]
本实施例中,内相流体和外相流体与实施例1相同。收集液是京尼平水溶液,收集液中去离子水与京尼平的质量比为1:0.005。以京尼平水溶液作为收集液替代实施例2的步骤(2)中的收集液,按照实施例2步骤(2)的方法制备明胶壳聚糖栓塞微球,以考察收集液的组成对明胶壳聚糖复合栓塞微球制备的影响。制备时控制内相流体的流量为100μl/h,控制外相流体的流量分别为1.5ml/h。
[0095]
结果发现,微流控装置形成的单分散w/o乳液进入收集液之后,w/o乳液液滴被油相包裹直接合并漂浮在收集液(水相)的表面,无法交联固化形成微球。
[0096]
对比例2
[0097]
本对比例中,以去离子水作为外相流体,考察外相流体的组成对明胶壳聚糖复合栓塞微球制备的影响。
[0098]
内相流体和收集液与实施例2相同。以去离子水作为外相流体替代实施例2的步骤(2)中的外相流体,按照实施例2步骤(2)的方法制备明胶壳聚糖栓塞微球,以考察外相流体的组成对明胶壳聚糖复合栓塞微球制备的影响。制备时控制内相流体的流量为100μl/h,控制外相流体的流量分别为1.5ml/h。
[0099]
结果发现,微流控装置无法剪切形成散w/o乳液液滴,因而后续的制备过程无法进行。
[0100]
结合以上实施例和对比例可知,收集液的组成与外相流体的组成是否匹配,收集液的组成及其中京尼平的含量对w/o乳液中壳聚糖的交联固化过程具有重要的影响,本发明通过研究发现,在收集液与外相流体组成匹配,以及收集液中京尼平含量适当的情况下,才能形成球形度和单分散性优异的明胶壳聚糖栓塞微球。
[0101]
实施例4
[0102]
本实施例中,制备单分散明胶壳聚糖复合栓塞微球,步骤如下:
[0103]
(1)配制内相、外相流体和收集液
[0104]
与实施例1中的内相流体、外相流体和收集液相同。
[0105]
(2)制备单分散明胶壳聚糖栓塞微球
[0106]
采用结构如图2所示的微流体装置,其注射管的出口处的内径为60μm、收集管的内径为300μm,将微流体装置和注射泵,各相流体以及收集液均置于恒温恒湿箱中,控制恒温恒湿箱的温度为40℃。
[0107]
将内相流体用注射泵输入微流体装置的注射管中,将外相流体用注射泵输入微流体装置的收集管中,在收集管中形成单分散的w/o乳液,采用盛有收集液的容器收集所述单分散w/o乳液,在收集液中,单分散w/o乳液液滴水相中的壳聚糖与收集液中的交联剂京尼平聚合反应1h形成交联壳聚糖,单分散w/o乳液液滴即转变为单分散明胶壳聚糖复合栓塞微球。
[0108]
该步骤在制备时控制内相流体的流量为100μl/h,控制外相流体的流量为1.5ml/h。
[0109]
(3)洗涤
[0110]
用异丙醇洗涤去除明胶壳聚糖复合栓塞微球表面的收集液,然后用去离子洗涤去除明胶壳聚糖复合栓塞微球表面的异丙醇,在40℃真空干燥12h。
[0111]
本实施例制备的复合栓塞微球的光学显微镜照片显示,复合栓塞微球的球形度和尺寸均一性都非常好。粒径测试表明,本实施例制备的复合栓塞微球的粒径变异系数(cv值)在1%~5%之间。
[0112]
以下通过实验测试栓塞微球的溶胀特性:
[0113]
将干燥后的复合栓塞微球放入培养皿中,向培养皿中加入去离子水,置于工业显微镜下进行观察,从加入去离子水时开始计时,分别在加入去离子水后0、5、20、40、60、80、120、180、240、300、360s观察其溶胀情况,然后按照下式计算复合栓塞微球的溶胀率:
[0114][0115]
其中,q为溶胀率,va为溶胀后的栓塞微球的体积,v0为初始栓塞微球的体积。
[0116]
复合栓塞微球的溶胀特性曲线如图8所示,由图8可知,本实施例制备的复合栓塞微球在去离子水中浸泡200s左右即达到溶胀平衡,溶胀平衡时的溶胀率为240%。说明本发明提供的复合栓塞微球在短时间内即可实现快速溶胀,可节约配液时间,临床使用时更加便捷和高效。若将该复合栓塞微球用于载药,其载药能力也会有所提升,因为栓塞微球的载药能力除了与带电吸引有关之外,就是靠栓塞微球本身的溶胀来实现载药。
[0117]
实施例5
[0118]
本实施例中,制备单分散明胶壳聚糖复合栓塞微球,步骤如下:
[0119]
(1)配制内相、外相流体和收集液
[0120]
配制内相流体:将明胶和壳聚糖加入浓度为0.32mol/l的乙酸水溶液中,在40℃的水浴中搅拌至完全溶解,然后冷却至室温,放入真空干燥箱中于室温抽真空以去除溶液中的气泡,得到内相流体;内相流体中,去离子水、明胶、壳聚糖的质量比为1:0.1:0.01;
[0121]
配制外相流体:将油溶性表面活性剂span80溶解于正辛醇中,得到外相流体;外相流体中,正辛醇与span80的质量比为1:0.2。
[0122]
配制收集液:将京尼平溶解于正辛醇中,得到收集液;收集液中,正辛醇与京尼平的质量比为1:0.005。
[0123]
(2)制备单分散明胶壳聚糖复合栓塞微球
[0124]
采用结构如图2所示的微流体装置,其注射管的出口处的内径为60μm、收集管的内径为300μm,将微流体装置和注射泵,各相流体以及收集液均置于恒温恒湿箱中,控制恒温恒湿箱的温度为40℃。
[0125]
将内相流体用注射泵输入微流体装置的注射管中,将外相流体用注射泵输入微流体装置的收集管中,在收集管中形成单分散的w/o乳液,采用盛有收集液的容器收集所述单分散w/o乳液,在收集液中,单分散w/o乳液液滴水相中的壳聚糖与收集液中的交联剂京尼平聚合反应1h形成交联壳聚糖,单分散w/o乳液液滴即转变为单分散明胶壳聚糖复合栓塞微球。
[0126]
该步骤在制备时控制内相流体的流量为100μl/h,控制外相流体的流量为2ml/h。
[0127]
(3)洗涤
[0128]
用异丙醇洗涤去除明胶壳聚糖复合栓塞微球表面的收集液,然后用去离子洗涤去除明胶壳聚糖复合栓塞微球表面的异丙醇,在40℃真空干燥保存。
[0129]
本实施例制备的w/o乳液液滴和复合栓塞微球的光学图片分别如图9的a、b两图所示。
[0130]
实施例6
[0131]
本实施例中,制备单分散明胶壳聚糖复合栓塞微球,步骤如下:
[0132]
(1)配制内相、外相流体和收集液
[0133]
配制内相流体:将明胶和壳聚糖加入浓度为0.32mol/l的乙酸水溶液中,在40℃的水浴中搅拌至完全溶解,然后冷却至室温,放入真空干燥箱中于室温抽真空以去除溶液中的气泡,得到内相流体;内相流体中,去离子水、明胶、壳聚糖的质量比为1:0.03:0.01。
[0134]
配制外相流体:将油溶性表面活性剂tween85溶解于正辛醇中,得到外相流体;外相流体中,正辛醇与tween85的质量比为1:0.01。
[0135]
配制收集液:将京尼平溶解于正辛醇中,得到收集液;收集液中,正辛醇与京尼平的质量比为1:0.005。
[0136]
(2)制备单分散明胶壳聚糖复合栓塞微球
[0137]
采用结构如图2所示的微流体装置,其注射管的出口处的内径为100μm、收集管的内径为550μm,将微流体装置和注射泵,各相流体以及收集液均置于恒温恒湿箱中,控制恒温恒湿箱的温度为40℃。
[0138]
将内相流体用注射泵输入微流体装置的注射管中,将外相流体用注射泵输入微流体装置的收集管中,在收集管中形成单分散的w/o乳液,采用盛有收集液的容器收集所述单分散w/o乳液,在收集液中,单分散w/o乳液液滴水相中的壳聚糖与收集液中的交联剂京尼平聚合反应12h形成交联壳聚糖,单分散w/o乳液液滴即转变为单分散明胶壳聚糖复合栓塞微球。
[0139]
该步骤在制备时控制内相流体的流量为200μl/h,控制外相流体的流量为4ml/h。
[0140]
(3)洗涤
[0141]
用异丙醇洗涤去除明胶壳聚糖栓塞微球表面的收集液,然后用去离子洗涤以去除明胶壳聚糖栓塞微球表面的异丙醇,在40℃真空干燥保存。
[0142]
本实施例制备的w/o乳液液滴和复合栓塞微球的光学图片分别如图10的a、b两图所示。
[0143]
实施例7
[0144]
本实施例中,制备单分散明胶壳聚糖复合栓塞微球,步骤如下:
[0145]
(1)配制内相、外相流体和收集液
[0146]
配制内相流体:将明胶和壳聚糖加入浓度为0.32mol/l的乙酸水溶液中,在40℃的水浴中搅拌至完全溶解,然后冷却至室温,放入真空干燥箱中于室温抽真空以去除溶液中的气泡,得到内相流体;本实施例中,配制了5种明胶含量不同的内相流体,各内相流体中,去离子水、明胶、壳聚糖的质量比分别为1:0.01:0.01、1:0.03:0.01、1:0.04:0.01、1:0.05:0.01以及1:0.1:0.01。
[0147]
配制外相流体:将油溶性表面活性剂tween85溶解于正辛醇中,得到外相流体;外相流体中,正辛醇与tween85的质量比为1:0.01。
[0148]
配制收集液:将京尼平溶解于正辛醇中,得到收集液;收集液中,正辛醇与京尼平的质量比为1:0.005。
[0149]
(2)制备单分散明胶壳聚糖复合栓塞微球
[0150]
采用结构如图2所示的微流体装置,其注射管的出口处的内径为100μm、收集管的内径为550μm,将微流体装置和注射泵,各相流体以及收集液均置于恒温恒湿箱中,控制恒温恒湿箱的温度为40℃。
[0151]
分别将5种明胶含量不同的内相流体用注射泵输入微流体装置的注射管中,将外相流体用注射泵输入微流体装置的收集管中,在收集管中形成单分散的w/o乳液,采用盛有收集液的容器收集所述单分散w/o乳液,在收集液中,单分散w/o乳液液滴水相中的壳聚糖与收集液中的交联剂京尼平聚合反应12h形成交联壳聚糖,单分散w/o乳液液滴即转变为单分散明胶壳聚糖复合栓塞微球。该步骤一共制备了5种明胶与交联壳聚糖质量比不同的复合栓塞微球。
[0152]
该步骤在制备时控制内相流体的流量为200μl/h,控制外相流体的流量为4ml/h。
[0153]
(3)洗涤
[0154]
用异丙醇洗涤去除明胶壳聚糖复合栓塞微球表面的收集液,然后用去离子洗涤去除明胶壳聚糖复合栓塞微球表面的异丙醇,在40℃真空干燥保存。
[0155]
本实施例以5种不同明胶含量的内相流体为基础制备得到的w/o乳液液滴和复合栓塞微球的光学图片分别如图11所示,其中的(a)(b)(c)(d)(e)5组图分别对应内相流体中
明胶含量由低到高的情况,图11的第一行图是w/o乳液液滴的光学图片,第二行图是复合栓塞微球的光学图片。
[0156]
对本实施例以5种不同明胶含量的内相流体为基础制备得到的复合栓塞微球进行弹性测量,并分析计算得到不同明胶交联壳聚糖配比下复合栓塞微球的力位移曲线和弹性模量。将明胶壳聚糖微球放入液相测试槽,在机械强度测试仪上选用10g的传感器,400μm的探针进行测试。结果分别如图12的(a)(b)两图所示。图12中的wgel/cs代表制备复合栓塞微球时采用的内相流体中明胶与壳聚糖的质量比。由图12可知,通过调节明胶与交联壳聚糖的比例关系,也可以调整复合栓塞微球的弹性。
[0157]
实施例8
[0158]
本实施例中,制备单分散明胶壳聚糖复合栓塞微球,步骤如下:
[0159]
(1)配制内相、外相流体和收集液
[0160]
配制内相流体:将明胶和壳聚糖加入浓度为0.16mol/l的乙酸水溶液中,在65℃的水浴中搅拌至完全溶解,然后冷却至室温,放入真空干燥箱中于室温抽真空以去除溶液中的气泡,得到内相流体;内相流体中,去离子水、明胶、壳聚糖的质量比为1:0.01:0.005。
[0161]
配制外相流体:将油溶性表面活性剂tween85溶解于正辛醇中,得到外相流体;外相流体中,正辛醇与span40的质量比为1:0.02。
[0162]
配制收集液:将京尼平溶解于正辛醇中,得到收集液;收集液中,正辛醇与京尼平的质量比为1:0.001。
[0163]
(2)制备单分散明胶壳聚糖复合栓塞微球
[0164]
采用结构如图2所示的微流体装置,其注射管的出口处的内径为100μm、收集管的内径为550μm,将微流体装置和注射泵,各相流体以及收集液均置于恒温恒湿箱中,控制恒温恒湿箱的温度为65℃。
[0165]
将内相流体用注射泵输入微流体装置的注射管中,将外相流体用注射泵输入微流体装置的收集管中,在收集管中形成单分散的w/o乳液,采用盛有收集液的容器收集所述单分散w/o乳液,在收集液中,单分散w/o乳液液滴水相中的壳聚糖与收集液中的交联剂京尼平聚合反应6h形成交联壳聚糖,单分散w/o乳液液滴即转变为单分散明胶壳聚糖复合栓塞微球。
[0166]
该步骤在制备时控制内相流体的流量为200μl/h,控制外相流体的流量为4ml/h。
[0167]
(3)洗涤
[0168]
用异丙醇洗涤去除明胶壳聚糖栓塞微球表面的收集液,然后用去离子洗涤以去除明胶壳聚糖栓塞微球表面的异丙醇,在40℃真空干燥保存。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1