一种硫酸阿托品注射液的制备方法与流程
1.本发明属于药物制剂制备工艺领域,具体涉及一种硫酸阿托品注射液的制备方法。
背景技术:
2.硫酸阿托品是一种拮抗胆碱受体的抗胆碱药,结构如下:
[0003][0004]
其能够抑制受节后胆碱能神经配的平滑肌与腺体活动,依赖剂量大小起到刺激或抑制中枢神经系统的作用。由于有机磷农药类是使胆碱酯酶失活,而使乙酰胆碱过剩积聚而出现中毒,而硫酸阿托品可通过直接拮抗积聚的乙酰胆碱实现解毒作用,因此,硫酸阿托品广泛用于有机磷农药中毒的治疗。除此之外,还可用于氨基甲酸酯类农药、拟除虫菊酯杀虫剂、毛果芸香碱、毒扁豆碱、新斯的明等中毒,锑剂中毒、洋地黄或吗啡引起的心律失常,化学性眼灼伤时扩瞳以治疗虹膜睫状体炎,内脏绞痛、麻醉前用药,或用于硫喷妥钠等麻醉药中毒所致喉痉挛、乙醚中毒所致呼吸道分泌物增多,对抗麻醉药中毒所致心率减慢或心跳停止。
[0005]
硫酸阿托品常通过口服或注射(皮下、肌肉或静脉注射)方式给药,故以片剂或注射剂剂型为主。现有的硫酸阿托品注射液由硫酸阿托品和注射用水,在等渗调节剂和/或ph调节剂配制而成,例如日本nipro的硫酸阿托品注射液(规格:1ml:0.5mg)公开的组成即为:主药硫酸阿托品0.5mg,等渗调节剂氯化钠9mg,加注射用水至1ml,且ph为4.0~6.0;又如美国hospira inc的硫酸阿托品注射液公开的组成为:每毫升含有0.1mg(成人浓度)或0.05mg(儿童浓度)硫酸阿托品一水合物,相当于0.083mg(成人浓度)或0.042mg(儿童浓度)阿托品,以及氯化钠9mg,渗透压0.308mosmol/ml,并可能含有氢氧化钠和/或硫酸,用于将ph值调整为3.0至6.5。
[0006]
然而,硫酸阿托品注射液在生产过程中,有引入金属离子的风险,导致产品中杂质含量高,特别是如下两种杂质和/或其对映异构体的含量偏高,导致注射液稳定性降低:
[0007]
杂质1:杂质2:
[0008]
目前,有通过在硫酸阿托品注射液中加入依地酸二钠来降低杂质含量,提高注射液稳定性的报道(中国专利申请cn114129511a),但依地酸二钠有导致恶心、呕吐、腹痛的风险;同时,依地酸二钠作为金属离子螯合剂,可能会螯合血液中的钙离子,导致血钙下降,引起肌肉震颤、抽搐。
[0009]
因此,如何制备更为安全、稳定的硫酸阿托品注射液,仍是目前亟待解决的问题。
技术实现要素:
[0010]
本发明的目的在于提供一种硫酸阿托品注射液的制备方法。
[0011]
本发明提供了一种硫酸阿托品注射液的制备方法,包括在配制硫酸阿托品注射液前,使用依地酸二钠溶液冲洗配液系统的步骤。
[0012]
进一步地,上述制备方法包括如下步骤:
[0013]
(1)使用依地酸二钠溶液冲洗配液系统;
[0014]
(2)使用注射用水冲洗配液系统;
[0015]
(3)用冲洗后的配液系统进行硫酸阿托品注射液的配制。
[0016]
更进一步地,步骤(1)所述依地酸二钠溶液的浓度为1~5wt
‰
,优选为1wt
‰
。
[0017]
更进一步地,步骤(1)所述冲洗的方法为:用40~60l依地酸二钠溶液循环冲洗20~60min;优选为用50l依地酸二钠溶液循环冲洗30min。
[0018]
更进一步地,步骤(2)所述注射用水的冲洗时间为5~20min,优选为10min。
[0019]
更进一步地,所述硫酸阿托品注射液为等渗注射液,ph值为4.4~4.6,其中硫酸阿托品含量为0.5~2mg/ml,优选为0.5mg/ml。
[0020]
更进一步地,所述硫酸阿托品注射液由如下组分组成:硫酸阿托品、渗透压调节剂、ph调节剂、注射用水;优选地,所述渗透压调节剂是氯化钠;所述ph调节剂是盐酸。
[0021]
更进一步地,所述硫酸阿托品注射液中渗透压调节剂的含量为8~10mg/ml,优选为9mg/ml;ph调节剂的浓度为0.05~0.1nmol/ml,优选为0.07nmol/ml。
[0022]
更进一步地,步骤(3)所述的配制期间持续通入氮气,配制过程包括如下步骤:
[0023]
1)取所需总体积85~95%的注射用水,冷却至30℃以下;
[0024]
2)加入硫酸阿托品、渗透压调节剂溶解;
[0025]
3)加入ph调节剂调节ph至4.4~4.6,补加余量注射用水混匀。
[0026]
更进一步地,还包括将配制好的硫酸阿托品注射液过滤除菌、灌装、湿热灭菌的步骤;
[0027]
优选地,所述过滤数均是用0.22μm的过滤器过滤除菌;
[0028]
所述灌装顶空氧不超过2%;
[0029]
所述湿热灭菌是121℃灭菌15min。
[0030]
本发明的有益效果:本发明无需额外在硫酸阿托品注射液中添加稳定剂,而是通过配液方法的改良,成功制得了杂质含量低、稳定性优异的硫酸阿托品注射液,具有推广应用价值。
[0031]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
[0032]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
具体实施方式
[0033]
本发明所用原料与设备均为已知产品,通过购买市售产品所得。
[0034]
实施例1、本发明硫酸阿托品注射液的制备
[0035]
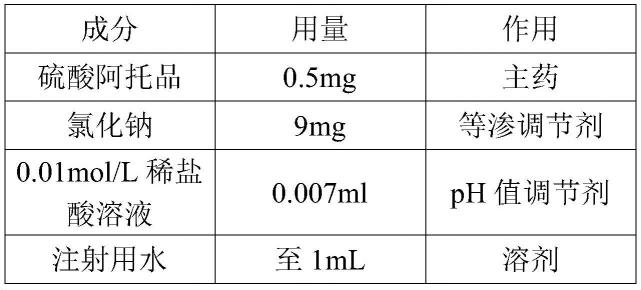
处方:
[0036][0037]
制备方法:
[0038]
(a)配制1
‰
的依地酸二钠溶液50l,循环处理整个配液系统30min,然后分段用新鲜的注射用水冲洗10min,除去配液系统中的金属离子及依地酸二钠。
[0039]
(b)量取配液总量90%的注射用水,冷却至30℃以下,期间持续通入氮气。
[0040]
(c)依次加入处方量的硫酸阿托品、氯化钠,持续通入氮气,并搅拌至完全溶解。
[0041]
(d)用0.01mol/l稀盐酸溶液,调节药液ph值至4.4-4.6,补加注射用水至全量,搅拌至均匀,停止通入氮气。
[0042]
(e)将药液用两级0.22微米的除菌过滤器进行过滤。
[0043]
(f)灌装于安瓿中,灌封全过程对安瓿瓶进行充氮,封口,检测产品顶空氧应≤2%。
[0044]
(g)121℃灭菌条件下湿热灭菌15min。
[0045]
(h)灯检、检漏、包装。
[0046]
对比例1、
[0047]
处方(参照中国专利申请cn114129511a):
[0048]
成分用量作用硫酸阿托品0.5mg主药氯化钠9mg等渗调节剂依地酸二钠0.1mg络合剂0.1%盐酸溶液0.02mlph值调节剂注射用水至1ml溶剂
[0049]
制备方法:
[0050]
量取80%注射用水(配制温度为40℃),依次加入处方量的依地酸二钠、硫酸阿托品、氯化钠,搅拌使溶解,采用0.1%(v/v)盐酸溶液,调节药液ph值至4.1
±
0.1,补加注射用水至全量,0.22μm滤膜过滤,灌装于安瓿中,封口,121℃、15min灭菌条件下灭菌。
[0051]
对比例2、
[0052]
国家药品监督管理局公布的参比制剂目录第二十八批,其中硫酸阿托品注射液(规格:1ml:0.5mg)的参比制剂持证商是田辺三菱製薬株式会社/
ニプロ
es
ファーマ
株式会
社,其公开的处方组如下,制备工艺未知:
[0053]
成分用量作用硫酸阿托品0.5mg主药氯化钠9mg等渗调节剂注射用水至1ml溶剂
[0054]
*ph为4.0~6.0,渗透压(与生理盐水的比率)约1。
[0055]
以下通过实验例证明本发明的有益效果。
[0056]
实验例1、稳定性考察
[0057]
1、实验方法
[0058]
加速稳定性考察:
[0059]
将实施例1制备的样品、对比例1制备的样品以及购买的市售的对比例2的样品放置于稳定性试验箱中,考察条件:40℃
±
2℃,75%rh
±
5%rh,分别于0月、1月、2月、3月、6月进行取样检测,采用药典方法对有关物质及含量进行检测。
[0060]
2、实验结果
[0061]
实施例1的加速稳定性实验结果如表1:
[0062]
表1
[0063][0064][0065]
对比例1的加速稳定性实验结果如表2:
[0066]
表2
[0067][0068]
对比例2的加速稳定性实验结果如表3:
[0069]
表3
[0070][0071]
由以上结果可以看出,本发明通过在配制硫酸阿托品注射液之前先使用依地酸二钠对配液系统进行冲洗制备得到的硫酸阿托品注射液,一方面相比于直接在制剂组成中添加依地酸二钠的对比例,杂质含量显著降低,且避免了依地酸二钠副作用的风险;另一方面相比于市售的硫酸阿托品注射液,也显著降低了杂质含量,提高了注射液稳定性。
[0072]
综上,本发明提供了一种硫酸阿托品注射液的制备方法,有效降低了注射液中杂质含量,提高了注射液的稳定性,具有推广应用价值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1