含有普那布林的组合物及其制备方法与流程
1.本公开属于制药领域,涉及一种含有普那布林的组合物及其制备方法。
背景技术:
2.普那布林是从海洋和陆生的曲霉属菌种中发现的二酮哌嗪苯基阿夕斯丁(phenylahistin)(月卞三甲氯铵)的合成类似物。普那布林在结构上不同于秋水仙碱及其康普瑞汀(combretastatin)样类似物(例如,康普瑞汀磷酸盐)并且在微管蛋白单体上的秋水仙碱结合位点处或其附近结合。先前的研究表明与秋水仙碱相比,在低浓度下的普那布林诱导血管内皮细胞微管蛋白解聚和单层透过性,并且表明普那布林诱导jurkat白血病细胞内的细胞凋亡。普那布林在患有晚期恶性肿瘤(肺癌、前列腺癌和结肠癌)的患者中作为单一试剂的研究表现出良好的药代动力学、药效学和安全特性。
3.cn105705148公开了一种普那布林制剂,其还包含40%聚乙二醇-15羟基硬脂酸酯hs-15和60%丙二醇,药物浓度为4mg/ml。但据了解,hs-15并非绝对安全的辅料。曾经的上市产品罗拉匹坦脂肪乳中hs-15用量为4.4%,按单剂量92.5ml/瓶计,单次用量4.07g,与cn105705148中公开的制剂接近。但脂肪乳已因上市后出现的严重过敏反应而撤市。
技术实现要素:
4.本公开涉及一种组合物,其包含普那布林或其药学上可接受的盐和至少一种脂质。
5.在一些实施方案中,所述脂质包含至少一种磷脂。
6.本公开涉及一种静脉注射用的药物,其为普那布林组合物,包含普那布林和脂质,所述脂质包含至少一种磷脂。
7.本公开的脂质还可包含其他中性脂质、阳离子脂质和/或阴离子脂质。
8.可用于本公开的其他中性脂质的示例包括:类固醇如胆固醇及其衍生物、脑磷脂、鞘磷脂、氢化大豆磷脂中的至少一种。
9.所述磷脂选自任意形式的磷脂酰胆碱、磷脂酰甘油、磷脂酰乙醇胺、磷脂酰肌醇、磷脂酰丝氨酸、磷脂酸、溶血磷脂、鞘磷脂、卵磷脂和心磷脂,所述任意形式包括盐化的或脱盐的、氢化的或部分氢化的、天然的、半合成的或合成的形式。本公开所述的脂质包括完全中性或带负电荷的磷脂。术语“磷脂”指含有至少一个磷基的疏水分子,其可是天然或合成的。例如,磷脂可包含含磷基团及任选被oh、cooh、氧代、胺或者取代或未取代的芳基取代的饱和或不饱和的烷基。磷脂在其无环(acylic)链的长度和不饱和度方面互相不同。术语“磷脂酰胆碱”指磷脂酰胆碱及其衍生物。
10.在一些实施方案中,适合用于本公开的磷脂的示例包括任意形式的二棕榈酰磷脂酰胆碱(dppc)、二硬脂酰磷脂酰胆碱(dspc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、1-棕榈酰-2-月桂酰-sn-甘油-3-磷脂酰胆碱(plpc)、磷酸胆碱(dopc)、蛋黄卵磷脂(epc)、二月桂酰磷脂
酰胆碱(dlpc)、氢化的大豆磷脂酰胆碱(hspc)、l-肉豆蔻酰-2-棕榈酰磷脂酰胆碱(mppc)、l-棕榈酰-2-肉豆蔻酰磷脂酰胆碱(pmpc)、l-棕榈酰-2-硬脂酰磷脂酰胆碱(pspc)、l-硬脂酰-2-棕榈酰磷脂酰胆碱(sppc)、棕榈酰油酰磷脂酰胆碱(popc)、溶血磷脂酰胆碱、二亚油酰磷脂酰胆碱、二硬脂酰磷脂酰乙醇胺(dspe)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(mpeg2000-dspe)、二肉豆蔻酰磷脂酰乙醇胺(dmpe)、二棕榈酰磷脂酰乙醇胺(dppe)、二油酰基磷脂酰甘油(dopg)、二肉豆蔻酰磷脂酰甘油(dmpg)、二硬脂酰基磷脂酰甘油(dspg)、二棕榈酰基甘油磷酸甘油(dppg)、二棕榈酰基磷脂酰丝氨酸(dpps)、1,2-二油酰基-sn-甘油-3-磷脂酰丝氨酸(dops)、二肉豆蔻酰基磷脂酰丝氨酸(dmps)、二硬脂酰基磷脂酰丝氨酸(dsps)、二棕榈酰基磷脂酸(dppa)、1,2-二油酰基-sn-甘油-3-磷脂酸(dopa)、二肉豆蔻酰基磷脂酸(dmpa)、二硬脂酰基磷脂酸(dspa)、二棕榈酰基磷脂酰肌醇(dppi)、1,2-二油酰基-sn-甘油-3-磷脂酰肌醇(dopi)、二肉豆蔻酰基磷脂酰肌醇(dmpi)、二硬脂酰基磷脂酰肌醇(dspi)、(2,3-二油酰基-丙基)-三甲胺(dotap)、大豆卵磷脂中的一种或多种,所述任意形式包括盐化的或脱盐的、氢化的或部分氢化的、天然的、半合成的或合成的形式。
11.在一些实施方案中,本公开中的磷脂选自dopc和蛋黄卵磷脂中的至少一种。
12.在某些实施方案中,所述的脂质包含至少一种磷脂和胆固醇。
13.在某些实施方案中,所述的脂质包含至少一种磷脂酰胆碱以及胆固醇。
14.在一些实施方案中,所述的组合物包含普那布林、胆固醇和至少一种磷脂酰胆碱。
15.在一些实施方案中,所述的脂质体组合物包含普那布林、胆固醇和dopc。
16.在一些实施方案中,所述组合物包含普那布林和磷脂。所述普那布林与磷脂的重量比选自1:10-200,优选1:10-150,更优选1:30-100。在一些实施方案中,所述普那布林与磷脂的重量比可以是1:30、1:31、1:32、1:33、1:34、1:35、1:36、1:37、1:38、1:39、1:40、1:41、1:42、1:43、1:44、1:45、1:46、1:47、1:48、1:49、1:50、1:51、1:52、1:53、1:54、1:55、1:56、1:57、1:58、1:59、1:60、1:61、1:62、1:63、1:64、1:65、1:66、1:67、1:68、1:69、1:70、1:71、1:72、1:73、1:74、1:75、1:76、1:77、1:78、1:79、1:80、1:81、1:82、1:83、1:84、1:85、1:86、1:87、1:88、1:89、1:90、1:91、1:92、1:93、1:94、1:95、1:96、1:97、1:98、1:99、1:100。
17.在一些实施方案中,所述组合物还包含类固醇。在一些实施方案中,所述类固醇选自胆固醇。
18.在一些实施方案中,所述胆固醇与磷脂的重量比例选自1:0.1-30。
19.在一些实施方案中,所述胆固醇与磷脂的重量比例选自1:1-20。
20.在一些实施方案中,所述胆固醇与磷脂的重量比例选自1:5-20,可以是1:5、1:6、1:7、1:8、1:9、1:10、1:11、1:12、1:13、1:14、1:15、1:16、1:17、1:18、1:19、1:20。
21.在一些实施方案中,如前所述的组合物,包含普那布林与磷脂的重量比选自1:30-100,胆固醇与磷脂的重量比例选自1:5-20。
22.在一些实施方案中,本公开所述的组合物还包含水或者水溶液。在某些实施方案中,所述水溶液包括但不限于等渗溶液或缓冲液。所述的等渗溶液具有与人血基本相同的渗透压的溶液,其可通过等渗剂和水制备而成。所述的等渗剂包括氯化钠、氯化钾、氯化镁、氯化钙、葡萄糖、木糖醇、山梨醇。所述的缓冲液是指经缓冲的溶液,其通过其酸-碱共轭成分的作用来阻止ph的变化。在一个实施方案中,本公开的缓冲液的ph范围为约4.5至约8.5。可将ph控制在该范围的缓冲液的实例包括乙酸盐(例如乙酸钠)、琥珀酸盐(如琥珀酸钠)、
葡糖酸盐、组氨酸、柠檬酸盐、碳酸盐、pbs、hepes或其它有机酸缓冲液。
23.本公开所述的组合物中,200nm聚碳脂膜过滤,其粒径小于500nm。在一些实施方案中,粒径小于400nm。在一些实施方案中,粒径小于300nm。在一些实施方案中,粒径小于250nm。在一些实施方案中,粒径小于200nm。
24.在一些实施方案中,所述的普那布林组合物为单位剂量形式,包含普那布林1-60mg。在一些实施方案中,所述的普那布林组合物为单位剂量形式,包含普那布林10-50mg。在一些实施方案中,所述的普那布林组合物为单位剂量形式,包含普那布林10mg、11mg、12mg、13mg、14mg、15mg、16mg、17mg、18mg、19mg、20mg、21mg、22mg、23mg、24mg、25mg、26mg、27mg、28mg、29mg、30mg、31mg、32mg、33mg、34mg、35mg、36mg、37mg、38mg、39mg、40mg、41mg、42mg、43mg、44mg、45mg、46mg、47mg、48mg、49mg、50mg。在一些实施方案中,所述的普那布林组合物为单位剂量形式,包含普那布林20mg、40mg。
25.在一些实施方案中,所述组合物中普那布林的浓度选自0.1-10mg/ml,可以是0.1mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml、0.6mg/ml、0.7mg/ml、0.8mg/ml、0.9mg/ml、1mg/ml、1.1mg/ml、1.2mg/ml、1.3mg/ml、1.4mg/ml、1.5mg/ml、1.6mg/ml、1.7mg/ml、1.8mg/ml、1.9mg/ml、2.0mg/ml。
26.在一些实施方案中,所述组合物中普那布林的浓度选自0.1-2mg/ml。
27.在一些实施方案中,所述组合物中普那布林的浓度选自0.1-1mg/ml。
28.本公开还提供了所述普那布林组合物或所述的方法制备的普那布林组合物在制备预防或治疗个体患有中性粒细胞减少症的疾病和病症的药物中的用途。
29.本公开提供一种预防或治疗个体患有中性粒细胞减少症的疾病和病症的方法,包括向受试者施用治疗有效量的普那布林组合物。
30.本公开提供一种预防或治疗需要的受试者的中性粒细胞减少症的疾病和病症的方法,包括向受试者施用治疗有效量的普那布林组合物。
31.在某些实施方案中,所述的普那布林组合物的给药剂量范围选自1-400mg、1-300mg、10-200mg、10-160mg、10-140mg、10-120mg、10-100mg、10-80mg、10-60mg或10-40mg。
32.在一些实施方案中,所述的普那布林组合物的每日给药剂量范围选自1-100mg。在一些实施方案中,所述的普那布林组合物的每日给药剂量范围选自1-80mg、1-60mg、1-40mg、10-40mg、10-30mg、10-20mg。
33.本公开所述普那布林组合物可以通过薄膜蒸发法、冷冻干燥法、主动载药法、ph梯度法、注入法和/或超声波分散法制备。在一些实施方案中,还可以进一步包含整粒(或者说是均质、匀化)的步骤,整粒方法可以但不限于用高压均质机、超声、挤出等方法。
34.在一些实施方案中,普那布林组合物通过注入法制备,具体包括:将磷脂和类固醇与普那布林溶于有机溶剂,再与水或水溶液混合,然后除去有机溶剂,整粒。
35.在某些实施方案中,所述水溶液包括但不限于等渗溶液或缓冲液。
36.在一些实施方案中,普那布林组合物通过薄膜蒸发法制备,具体包括:将普那布林、磷脂和类固醇溶于有机溶剂,除溶剂成膜,水化,在一些实施方案中,所述的制备方法还进一步包含对水合后得到的脂质体组合物进行挤出整粒。
37.本公开的普那布林组合物可以是任何形式的普那布林与脂质的混合物,包括脂质体的形式。
38.本公开的普那布林组合物可以进一步经干燥等方式除去体系中的液体介质,获得干燥的固体组合物。干燥所述组合物的方法包括但不限于蒸发、冷冻干燥或喷雾干燥等。
39.本公开的普那布林组合物可以以肠胃外注射形式给药,选自静脉注射、皮下注射、组织注射。使用标准方法和装置,例如,笔、注射器系统、针和注射器、皮下注射递送系统、导管等来完成本公开的脂质体组合物的施用。
40.术语“约”是指数量、尺寸、配方、参数、以及其他量和特性是不精确的并且不必是精确的,但可以是期望的近似值和/或较大值或较小值,由此反映公差、转换因子、四舍五入、测量误差等、以及本领域的技术人员已知的其他因子。其含义可包括
±
10%的变化,优选
±
5%的变化。
具体实施方式
41.以下将结合实施例更详细地解释本公开,本公开的实施例仅用于说明本公开的技术方案,并非限定本公开的实质和范围。
42.本公开所述的粒径采用malvern nano粒度仪,型号nano-zs,所述平均粒径为intensity mean diameter。本公开所述的含量测定采用高效液相色谱仪,型号为thermo u300(vwd+cad),来源美国thermo fisher scientific。对照品称量采用十万分之一电子天平,型号为225d-1cn,来源赛多利斯。测定中所用分离的色谱柱型号为waters xbridge c
18
5μm,4.6
×
150mm,来源美国waters公司。稀释剂为甲醇来源merk公司。流动相配制所用三乙胺为分析纯来源cnw公司,磷酸为分析纯来源国药试剂,纯化水为自制,乙腈来源merk公司。
43.实施例1:处方1 dopc体系下的普那布林组合物
44.组分处方用量普那布林40mgdopc3.144g胆固醇172mg乙醇10ml5%葡萄糖注射液200ml
45.通过乙醇注入法制备:取处方量的普那布林、dopc和胆固醇置于烧杯,搅拌溶解于无水乙醇(辅料级,南京化学试剂股份有限公司)。40℃条件下,将药物-脂质溶液缓慢滴入5%葡萄糖注射液(实验室自制),充分搅拌混合。将药液转移至圆底烧瓶,旋转蒸发去除乙醇。接着使药液在50℃下通过0.2μm的聚碳脂膜(ats nano homogenize machine,型号:ah100d),形成均匀透亮的脂质体溶液。
46.测试例1:处方1的相关指标
47.经观察,聚碳脂膜上几乎无普那布林api,取样经纳米粒度仪检测,药液粒度为56.90nm;载药量为89.8%。
48.详细的测定过程如下:
49.对照品溶液配制:取普那布林对照品约25.0mg,精密称定,置25ml容量瓶中,先加适量甲醇超声溶解,冷却至室温后,加甲醇稀释定容至刻度,摇匀后即得对照品储备液。精密移取对照品储备液1ml置25ml容量瓶中,加甲醇稀释定容至刻度即得普那布林对照品溶液。
50.含量测定供试液的配制:用移液枪量取本品溶液1ml,置10ml容量瓶中,加甲醇溶解定容至刻度,摇匀后即得。
51.含量测定色谱条件:流动相为三乙胺磷酸缓冲液-乙腈梯度洗脱,其中三乙胺磷酸缓冲液的配制方法为量取三乙胺7.5ml加水稀释至1000ml,用磷酸调ph至3.0
±
0.5。梯度洗脱程序如下表所示,检测波长240nm,柱温30℃,流速1.0ml/min,进样量10μl,运行时间15min。
52.time/min三乙胺磷酸缓冲液乙腈0752566040112080137525157525
53.实施例2:处方2蛋黄卵磷脂体系下的普那布林组合物
54.组分处方用量普那布林40mg蛋黄卵磷脂pl-100m3.6gchol0.54gapi40mg5%葡萄糖100ml二氯甲烷50ml
55.通过薄膜蒸发法制备:取处方量的普那布林、蛋黄卵磷脂和胆固醇置于圆底烧瓶,搅拌溶解于99.9%二氯甲烷(hplc级,damas-beta)。药液旋转蒸发去除二氯甲烷形成薄膜。将5%葡萄糖溶液倒入圆底烧瓶中50℃下对薄膜进行水化。接着使药液通过0.2μm的聚碳脂膜,形成均匀透亮的脂质体溶液。
56.测试例2:处方2的相关指标
57.经观察,聚碳酯膜上有一层普那布林api,取样经纳米粒度仪检测,药液粒度为37.55nm,载药量为16.7%(测定方法同测试例1)。
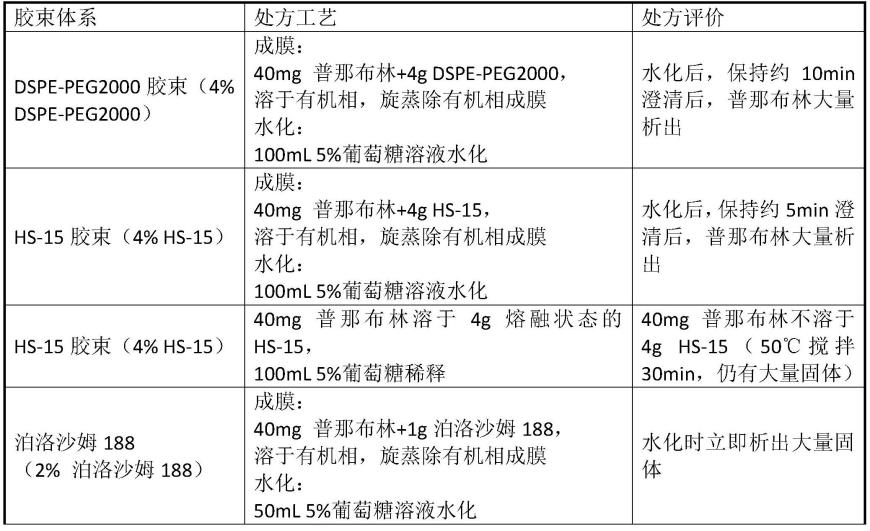
58.对比例1:胶束体系对普那布林增溶作用的考察结果
[0059][0060]
实验结果表明,胶束体系增溶效果不佳。
[0061]
对比例2:助溶剂对普那布林增溶作用的考察结果
[0062]
1)葡甲胺增溶效果:
[0063]
154mg葡甲胺溶于10ml 5%葡萄糖溶液,加入20mg普那布林,50℃搅拌30min,普那布林完全不溶解。
[0064]
2)羟丙基-β-环糊精增溶效果:
[0065]
1.26g羟丙基-β-环糊精溶于10ml纯化水,50℃条件下,将40mg普那布林加入其中,充分搅拌30min,溶液稍显黄色,存在大量普那布林固体,增溶效果不佳。
[0066]
对比例3:微乳对普那布林增溶作用的考察结果
[0067]
经检测,10mg普那布林在5ml精制蓖麻油、中链甘油酸三脂、肉豆蔻酸异丙酯中均不溶解。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1