一种用于治疗骨质疏松症的基于普鲁士蓝纳米酶的基因编辑平台的构建方法
1.本发明涉及基因编辑平台的构建方法,特别涉及一种用于治疗骨质疏松症的基于普鲁士蓝纳米酶的基因编辑平台的构建方法。
背景技术:
2.骨质疏松微环境的特点是炎症因子的浸润和活性氧(ros)的异常积累。最近的研究表明,线粒体源性ros的增加是诱导成骨细胞衰老的关键因素之一,导致成骨细胞衰老。成骨过程中的显着冗余。同时,骨质疏松微环境中成骨细胞分泌的核因子kappa-b配体(rankl)受体激活剂的分泌增加,刺激单核细胞前体形成成熟的破骨细胞,从而显着增强骨吸收活性。分泌的rankl导致骨吸收增加,从而导致骨质疏松过程中恶性成骨细胞-破骨细胞耦合机制。因此,靶向ros诱导的成骨细胞衰老和rankl的产生应该是挽救骨质疏松症的潜在方法。
3.纳米酶是一类具有与天然酶相似的催化活性的纳米材料,具有成本低、易于大规模制备、稳定性高和长期储存等优点。在各种纳米酶中,普鲁士蓝纳米酶(pbn)被发现是理想的ros清除剂,因为它们具有类过氧化物酶(pod)、类超氧化物歧化酶(sod)和类过氧化氢酶(cat)活性。清除能力使pbn具有挽救成骨细胞衰老和恢复成骨的潜力。然而,pbns的单一应用存在周期时间短、选择性差和生物相容性差的问题。此外,单独应用pbns可能无法完全逆转骨质疏松症,因为rankl的产生仍会激活破骨细胞。因此,中断成骨细胞-破骨细胞恶性耦合机制的rankl表达的降低是缓解骨质疏松症的另一个方面。据报道,crispr/cas9质粒能够进行靶向基因编辑,从而可以在体内有效地操纵rankl基因以减少其表达。传统的基因传递载体依赖于脂质体或病毒,但它们不可能同时携带pbns发挥抗ros作用。因此,需要一种高效的纳米酶/质粒递送平台。由于高比表面积、大孔体积和易于改性的特性,已知中空介孔二氧化硅纳米粒子(hmsn)可携带大量试剂。与传统的病毒基因载体相比,hmsns具有基因携带能力强、生物相容性好、成本低和降低癌症风险等优点。因此,hmsns是提高rankl敲除效率的理想基因载体。同时,hmsns的简单修饰使得pb在其表面生长后发挥纳米酶活性成为可能。最后,已经很好地证明了阿仑膦酸盐(aln)修饰的纳米材料对骨组织具有亲和力。因此,在体内由aln引导的基于纳米酶的基因传递系统应该更精确地发挥其功能。
技术实现要素:
4.发明目的:本发明提供一种用于治疗骨质疏松症的基于普鲁士蓝纳米酶的基因编辑平台。
5.技术方案:所述的用于治疗骨质疏松症的基于普鲁士蓝纳米酶的基因编辑平台的构建方法,包括如下步骤:
6.s1:合成中空介孔硅纳米粒hmsns;
7.s2:表面生长pb:将hmsns溶于去离子水中,加入pb后搅拌,离心,干燥,得到hpb;
8.s3:搭载crispr/cas9质粒:hpb和crispr/cas9质粒混合搅拌,离心得到的hpb@rc;
9.s4:结合peg-aln:将步骤s3得到的hpb与peg-aln混合,避光搅拌,最终形成hpb@rc-aln基因编辑平台。
10.进一步地,步骤s1中的hmsns的合成方法如下:
11.用反相微乳法制备hmsns,其中水相为aps水溶液,油相为溴化十六烷基三甲铵、环己烷、triton x-100和正辛醇的混合溶液,水相加入到油相中,形成油包水反相微乳体系,稳定后加入teos和nh4oh引发反应,加入丙酮终止反应,白色沉淀,清洗三遍,白色沉淀除去ctab,去离子水去除乙酸,得到中空介孔硅纳米粒hmsns。
12.进一步地,步骤s2中的pb的制备方法如下:将fecl3水溶液,和k4[fe(cn)6]3h2o溶液缓慢混合,连续搅拌,离心干燥得到pb。
[0013]
进一步地,步骤s3中的hpb与rc质粒的配比如下:每2mg hpb加入0.5mgrc质粒。
[0014]
进一步地,步骤s4中,所述基因编辑为细胞内基因编辑;细胞内基因编辑方法为:将制备的基因纳米颗粒用αmem细胞培养基重悬获得纳米颗粒重悬液,进行细胞培养,提取细胞的rna和蛋白进行检测其基因突变情况。
[0015]
所述的制备方法制备得到的基于普鲁士蓝纳米酶的基因编辑平台。
[0016]
所述的基于普鲁士蓝纳米酶的基因编辑平台在制备治疗骨质疏松的药物中的应用。
[0017]
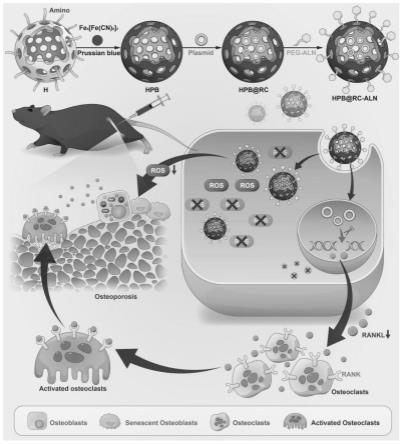
本发明首先构建aln修饰的pb-hmsns纳米酶并加载rankl-crispr/cas9(rc)基因编辑系统(hpb@rc-aln)。hpb-aln纳米酶可以清除ros,降低氧化应激水平并逆转骨质疏松微环境的异常代谢状态。同时,携带rc质粒的hpb-aln纳米酶将敲除rankl基因,切断成骨细胞-破骨细胞的恶性耦合机制。所构建的综合体可为骨质疏松症管理提供一个新颖而精确的平台。
[0018]
有益效果:与现有技术相比,本发明的优势是:本发明通过构建aln修饰的pb-hmsns纳米酶,并加载rankl-crispr/cas9(rc)基因编辑系统(hpb@rc-aln)。hpb-aln纳米酶清除ros,降低氧化应激水平,逆转骨质疏松微环境的异常代谢状态。同时,携带rc质粒的hpb-aln纳米酶将rankl基因敲除,切断成骨细胞-破骨细胞的恶性偶联机制。所构建的复合物可能为骨质疏松症的治疗提供一个新的和精确的平台。
附图说明
[0019]
图1为本发明的实施例的hpb@rc-aln的构建路线及其在骨质疏松治疗中的应用机制示意图;
[0020]
图2为本发明的实施例的基因纳米平台的表征结果图;
[0021]
图3为本发明的实施例的hpb@rc-aln的zeta电位图;
[0022]
图4为本发明的实施例的hpb@rc-aln的琼脂糖凝胶电泳图;
[0023]
图5为本发明的实施例的基因纳米平台的骨靶向性能;
[0024]
图6为本发明的实施例的基因纳米平台的清除活性氧和阻碍衰老图(标尺为200μm);
[0025]
图7为本发明的实施例的基因纳米平台的成骨诱导图;
[0026]
图8为本发明的实施例的基因纳米平台对细胞的转染和基因编辑效果图(标尺为
100μm);
[0027]
图9为本发明的实施例的基因纳米平台对破骨细胞形成的抑制图;
[0028]
图10为本发明的实施例的基因纳米平台对ovx小鼠骨质疏松症的逆转作用图。
具体实施方式
[0029]
本实施例提供基于普鲁士蓝纳米酶的基因纳米平台的制备方法,该基因编辑系统结构如图1所示,具体步骤如下:
[0030]
s1:合成hmsns
[0031]
用反相微乳法制备hmsns,其中水相为0.23%(v/v)的aps水溶液,油相为15mg溴化十六烷基三甲铵、72.6ml环己烷、17.88g triton x-100和17.6ml正辛醇的混合溶液。在磁力搅拌作用下将水相缓慢加入到油相中,形成油包水反相微乳体系,稳定后加入800ul teos和800ul nh4oh引发反应,室温搅拌24h后加入40ml丙酮终止反应,白色沉淀分别用乙醇和去离子水清洗三遍。白色沉淀在40ml乙酸中室温搅拌反应4h,除去ctab,去离子水清洗三遍去除乙酸,得到中空介孔硅纳米粒hmsns。
[0032]
s2:表面生长pb
[0033]
将hmsns(10.02mg)通过超声波溶于10.0ml去离子水中。加入16.22mlfecl3水溶液(6.43mg,0.40mmol),连续搅拌1小时,然后加入k4[fe(cn)6].3h2o溶液(8.45mg,0.20mmol)缓慢滴入混合物中,在25℃下连续搅拌0.5小时,离心干燥获得hpb;透射电镜(tem)图像显示,hmsns和hpb均为均匀分散的球形,平均尺寸分别为47和48nm(图2a,b)。与hmsns相比,能量色散x射线光谱(eds)证实了hpb中存在铁(fe)(图2c,d)。元素作图进一步表明,pb成功地与hmsn结合,c、o和si元素在纳米框架中均匀分布(图2e,f)。如图2g-h所示,对h、hmsns分别用x射线粉末衍射(xrd)和hpb进行了表征,发现两者均具有较好的结晶度,在hpb中具有显著的pb组分(jcpds卡no.73-0687)。此外,x射线光电子能谱(xps)也确定了fe分布在hpb纳米酶中(图2i,j)。
[0034]
s3:搭载crispr/cas9质粒
[0035]
2mghpb和crispr/cas9质粒(1000ng/ul、500ul)在4℃下轻轻搅拌过夜,离心得到的hpb@rc。hpb、hpb-aln和hpb@rc-aln的平均zeta电位分别为17.6、18.2和1.94mv。hpb@rc-aln中zeta电位显著降低,表明rc质粒已成功加载到hpb纳米酶上(图3)。将不同质量的hpb与质粒混合,通过琼脂糖凝胶电泳得到该材料与crispr/cas9质粒的最佳质量比。当纳米酶与质粒的质量比为20∶1时,没有观察到明显的质粒泄漏(图4)。
[0036]
s4:结合peg-aln
[0037]
将2mg步骤s3得到的hpb与0.1mgpeg-aln混合,避光缓慢搅拌6h,最终形成hpb@rc-aln基因编辑平台,4℃保存即可。使用羟基磷灰石(hap)作为体外模拟骨骼组织的材料,来测试hbp-aln的靶向效率。hpb或hpb-aln在hap上孵育不同时间后,用扫描电镜评价结合效率。数据显示,hpb和hpb-aln均以时间依赖的方式逐渐与hap结合。然而,与hpb组相比,在共培养24、48和72h后,在hap上观察到的hpb-aln纳米颗粒的数量显著增加(图5a-b)。结果表明,aln对hpb的修饰成功,并证实了aln修饰的hpb纳米颗粒的骨架靶向能力。
[0038]
本实施例对上述制备的hpb@rc-aln基因纳米平台在体外的抗ros和抗衰老的作用进行了验证。本实施例将不同浓度的h2o2溶液(0-400μm)与mc-3t3e1细胞共培养24小时,发
现细胞的ros积累和衰老呈浓度依赖性的增加(图6a-c)。当加入hpb、hpb-aln或hpn@rc-aln并与h2o2(400μm)溶液孵育时,细胞内ros和衰老水平显著下降(图6d-f)。值得注意的是,rc质粒的存在并不影响纳米酶的抗ros和抗衰老能力(图6d-f)。这些数据表明,hpb具有良好的抗ros和抗细胞衰老功能。
[0039]
本实施例评估hpb@rc-aln基因纳米平台对成骨诱导的影响。本实例将mc3t3-e1细胞与h2o2、h2o2+h、h2o2+hpb、h2o2+hpb-aln或h2o2+hpb@rc-aln在成骨诱导培养基中共培养。如图7a所示,过氧化氢溶液显著降低了mc-3t3e1细胞的alp活性和钙矿物沉积(ars染色),在纳米酶的存在下,这得到了很大程度的挽救。定量聚合酶链反应(qpcr)评价结果显示,hpb、hpb-aln和hpb@rc-aln组成骨标记基因(osx、runx2、氰酸盐和alp)表达上调,逆转了过氧化氢的促衰老作用(图7b-e)。以上数据表明,纳米酶可以通过抑制骨质疏松微环境中ros的生成来有效挽救受抑制的成骨作用。
[0040]
本实施例还对hpb@rc-aln基因纳米平台对细胞的转染和基因编辑效果进行了验证。将mc3t3-e1细胞与hpb@rc-aln孵育24、48和72小时。转染效率通过按设计从crispr/cas9质粒表达和翻译的绿色荧光蛋白(gfp)进行评估。结果表明,转染率呈时间依赖性,共孵育24h后出现绿色荧光,72h后显着增加(图8a)。通过流式细胞仪分析(图8b,c)进一步确认和量化了转染率,显示约80%的细胞成功携带rc质粒共培养72小时。数据表明合成的hpb@rc-aln具有优异的细胞转染能力。然后,western blot显示,当与h2o2和hpb@rc-aln共培养时,mc3t3e1细胞的rankl蛋白呈时间依赖性降低(图8d,e),表明hpb@rc-aln在骨质疏松微环境中有效抑制rankl的分泌。通过使用t7核酸内切酶i(t7ei)测定进一步证实了rc的基因编辑能力。值得注意的是,与其他组相比,与mc3t3-e1共孵育72h后,仅观察到hpb@rc-aln破坏了rankl基因,在t7e1切割后出现了三个条带(图8f)。通过定量聚合酶链反应(qpcr)和蛋白质印迹进一步分析不同组中ranklmrna的表达和蛋白质水平。h2o2刺激mc3t3-e1细胞后rankl表达增加,而添加hpb或hpb-aln后rankl表达降低,这可能与纳米酶的优异抗氧化作用有关。值得注意的是,hpb@rc-aln组的rankl表达进一步降低,表明hpb@rc-aln中携带的rc质粒对rankl的有效基因编辑功能(图8g和图i)。
[0041]
本实施例还对hpb@rc-aln基因纳米平台通过阻断衰老成骨细胞中的rankl分泌来抑制破骨细胞的生成进行了验证。用h2o2、h2o2+hpb处理的mc3t3-e1培养基中收集上清液,h2o2+hpb-aln或h2o2+hpb@rc-aln。然后,将来自不同组的上清液加入到含有降低水平的rankl(25ng/ml)的破骨细胞诱导培养基中。如图9a-b所示,对照组未能产生破骨细胞,而h2o2组的上清液由于h2o2刺激mc3t3-e1细胞分泌更多的rankl,显着诱导破骨细胞形成。然而,加入hpb或hpb-aln处理组的上清液后,破骨细胞生成过程部分缓解。此外,加入hpb@rc-aln处理组的上清液未观察到破骨细胞形成,表明从载体释放的rc具有有效的rankl基因编辑功能。破骨细胞生成相关标志物(trap、ctsk和oscar)的表达在hpb和hpb-aln上清液组的mrna水平上显着降低,在h2o2+hpb@rc-aln上清液组中甚至更低(图9c-e),这归因于纳米粒子的抗ros作用和rc质粒的rankl基因编辑作用。
[0042]
本实施例还对hpb@rc-aln基因纳米平台对ovx小鼠骨质疏松症的逆转作用进行了验证。本实施例通过去除小鼠双侧卵巢以建立骨质疏松模型,然后将复合物局部注射到股骨髓腔中,于治疗结束后6周处死小鼠,最终观察小鼠股骨的骨质情况确定纳米酶基因平台的抗骨质疏松作用,结果见附图10。通过微型计算机断层扫描(micro-ct)和3d重建观察各
组股骨的完整性。正如预期的那样,ovx小鼠发生了严重的骨质流失(图10a)。相反,hpb和hpb-aln处理的小鼠表现出升高的骨体积分数(bv/tv)、骨小梁数量(tb.n)、小梁厚度(tb.th)和减少的小梁分离(tb.sp)。由于aln的骨骼组织靶向特性,hpb-aln组的小鼠比hpb组的小鼠显示更多的骨量。值得注意的是,用hpb@rc-aln组治疗的小鼠表现出最大的bv/tv,tb。n和tb。th在所有组中,证明了hpb@rc-aln的最佳骨质疏松抢救能力(图10b-e)。在小鼠股骨中观察到的gfp和ocn的共定位表明rc质粒成功进入小鼠股骨的成骨细胞(图s3)。dhe、sa-β-gal、ocn和trap染色显示出与micro-ct中观察到的一致趋势,ovx小鼠中ocn表达显着降低,而hpb@rc-aln则呈相反趋势(图10f)。sa-β-gal染色显示,与对照组相比,用纳米酶(hpb、hpb-aln和hpb@rc-aln)处理的ovx小鼠成骨细胞衰老显着降低。此外,trap染色表明,用hpb@rc-aln处理的ovx小鼠的破骨细胞数量几乎恢复到与对照小鼠一样的物理水平(图10f)。这些结果表明,纳米酶基因平台有望成为挽救骨质疏松症的精确靶向策略。
[0043]
综上所述,本实施例成功构建aln修饰的pb-hmsns纳米酶,并装载rankl-crispr/cas9(rc)基因编辑系统(hpb@rc-aln)。hpb-aln纳米酶可以清除ros,降低氧化应激水平,逆转骨质疏松微环境的异常代谢状态。同时,携带rc质粒的hpb-aln纳米酶将敲除rankl基因,切断成骨细胞-破骨细胞的恶性偶联机制。所构建的复合物可能为骨质疏松症的治疗提供一个新而精确的平台。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1