梯度孔结构中空纤维超滤膜大规模纯化mRNA疫苗的工艺方法与流程
梯度孔结构中空纤维超滤膜大规模纯化mrna疫苗的工艺方法
技术领域
1.本发明属于疫苗生产纯化技术领域,具体涉及梯度孔结构中空纤维超滤膜大规模纯化mrna疫苗的工艺方法。
背景技术:
2.mrna疫苗是将含有编码抗原蛋白的rna导入人体,直接进行翻译,形成相应的抗原蛋白,从而诱导机体产生特异性免疫应答,达到预防免疫作用的一种疫苗,发展时间较短,2020年刚开始实现商业化产品上市。其只利用病毒的基因序列,不带有病毒成分,没有感染风险。人体以mrna为模板翻译形成抗原蛋白,激发免疫反应,从而使人体获得免疫保护,体外转录的mrna最终会被正常的细胞代谢过程自然降解。
3.mrna疫苗生产工艺步骤为:构建含有抗原蛋白dna的载体,转入菌株培养获得质粒dna,质粒dna体外转录、加帽加尾及核苷酸修饰后得到mrna,mrna利用聚合物或脂质纳米颗粒包封得到疫苗。在其生产过程中伴有蛋白质、内毒素、酶、游离核苷酸、核糖核苷三磷酸酯、dna小片段等杂质,是限制mrna疫苗纯度、造成临床使用后有较大副作用的关键因素。
4.目前主要采用以下方法进行mrna生产过程中杂质的去除:如质粒dna的纯化,可采用苯酚氯仿法进行抽提萃取,但过多有机溶剂的使用不利于疫苗整体质量的提高;亦可采用离心的方法分离质粒dna,但离心方法无法连续大规模操作,无法实现mrna疫苗的大规模纯化。
5.因此,减少使用有机溶剂,实现低成本连续化操作,对实现mrna疫苗大规模纯化有非常重要的意义。
技术实现要素:
6.本发明公开了梯度孔结构中空纤维超滤膜大规模纯化mrna疫苗的工艺方法,在减少有机试剂使用的同时有利于实现mrna疫苗的连续化大规模稳定纯化。
7.为了实现上述目的,本发明采用如下技术方案:
8.梯度孔结构中空纤维超滤膜大规模纯化mrna疫苗的工艺方法,包括如下步骤:
9.(1)质粒dna纯化:
10.取培养完成的菌液进行细胞裂解,裂解后采用沉淀和/或盐析处理配合梯度孔结构中空纤维超滤膜过滤,得到纯化质粒dna;
11.(2)mrna纯化:
12.纯化质粒dna经体外转录、加帽加尾核苷酸修饰得到目标mrna后,加入dna酶,采用沉淀和/或盐析处理配合梯度孔结构中空纤维超滤膜过滤,得到纯化mrna;
13.(3)mrna包封或装载后纯化:
14.纯化mrna包封或装载后,采用沉淀和/或盐析处理配合梯度孔结构中空纤维超滤膜过滤,得到mrna疫苗。
15.本发明采用沉淀和/或盐析处理配合梯度孔结构中空纤维超滤膜过滤的方法进行
mrna疫苗生产各阶段的纯化,沉淀和/或盐析处理试剂、参数以及梯度孔结构中空纤维超滤膜过滤参数可根据各步骤需要除去的杂质进行调整,适应性强,且相对于传统的纯化方法可减少有机试剂的使用,最终获得的产品纯度高,适于连续化大规模生产。
16.进一步地,步骤(1)-(3)中,
17.梯度孔结构中空纤维超滤膜材质分别为聚偏氟乙烯pvdf、聚醚砜pes、聚砜psf、磺化聚醚砜spes、磺化聚砜spsf、改性聚醚砜mpes、改性聚砜mpsf、聚丙烯腈pan中的至少一种,梯度孔结构中空纤维超滤膜切割分子量范围为50kda-750kda。
18.进一步地,步骤(1)-(3)中,
19.分别采用内压式中空纤维式膜组件进行过滤,组件中梯度孔结构中空纤维超滤膜直径为0.1-4mm,内外径之比为1.2-4;
20.过滤方法为切向流过滤或死端过滤;
21.死端过滤压力为0.05-0.3mpa,切向流过滤流速为15-150l/(h﹒m2);
22.步骤(1)-(3)任一步骤过滤后均通过试剂i进行反冲洗;
23.反冲洗所用试剂i,包括盐酸缓冲液tris-hcl、磷酸缓冲液tris-h3po4、乙二胺四乙酸缓冲液tris-edta、乙酸缓冲液tris-ch3cooh中的至少一种,试剂i的浓度范围0.1mol/l~1mol/l,ph范围7-10。
24.进一步地,步骤(1)中,采用沉淀和/或盐析处理配合梯度孔结构中空纤维超滤膜过滤去除细胞碎片、蛋白质、宿主基因组dna、rna和内毒素;
25.步骤(2)中,采用沉淀和/或盐析处理配合梯度孔结构中空纤维超滤膜过滤去除酶、游离核苷酸、核糖核苷三磷酸酯、反应体系中的免疫原性杂质、外源rna片段、dsrna及dna小片段;
26.步骤(3)中,采用沉淀和/或盐析处理配合梯度孔结构中空纤维超滤膜过滤去除未包封或未装载的mrna以及其他杂质。
27.进一步地,步骤(1)中,
28.细胞裂解后对蛋白质进行变性沉淀,抽取上清液采用梯度孔结构中空纤维超滤膜过滤除去细胞碎片和内毒素,获得浓缩液i;
29.对浓缩液i中的宿主基因组dna进行沉淀,抽取上清液采用梯度孔结构中空纤维超滤膜过滤,获得浓缩液ii;
30.对浓缩液ii中的rna进行沉淀,抽取上清液采用梯度孔结构中空纤维超滤膜过滤,获得浓缩液iii;
31.对浓缩液iii中的质粒dna进行沉淀,沉淀出的质粒dna复溶过滤2-3次,采用梯度孔结构中空纤维超滤膜过滤,取最终浓缩液得到纯化质粒dna。
32.进一步地,步骤(1)中,
33.细胞裂解所用试剂为试剂ii,包括氢氧化钾koh、氢氧化钠naoh、柠檬酸钠、甲醇钠ch3ona、乙醇钾ch3cook中的至少一种,试剂ii浓度为0.01-5mol/l,处理时间为5-200min;
34.沉淀蛋白质所用试剂包括试剂i,试剂i包括盐酸缓冲液tris-hcl、硫酸缓冲液tris-h2so4、磷酸缓冲液tris-h3po4、乙二胺四乙酸缓冲液tris-edta、乙酸缓冲液tris-ch3cooh中的至少一种,试剂i的ph范围7-10,处理时间5-120min;
35.沉淀宿主基因组dna所用试剂包括试剂iii,试剂iii包括kpvpk15、pvpk30、
pvpk60、pvpk90、pvpk120、聚乙烯醇pva、乙二醇中的至少一种,试剂iii浓度0.001-1mol/l,试剂iii处理时间10-60min;
36.沉淀rna所用试剂包括试剂iv,试剂iv包括氯化钙cacl2、氯化钠nacl、硝酸钠nano3、氯化钡bacl2、硝酸钾kno3、硝酸钙ca(no3)2的至少一种,试剂iv浓度为0.01-5mol/l,试剂iv处理时间为10-180min;
37.截留液i沉淀质粒dna所用试剂包括试剂v,试剂v包括peg200、peg400、peg800、peg1000、peg2000、peg4000、peg8000、peg10000、peg20000中的至少一种,试剂v浓度为0.01-5mol/l,试剂v处理时间10-60min。
38.进一步地,步骤(2)中,
39.目标mrna溶液直接采用梯度孔结构中空纤维超滤膜过滤除去游离核苷酸、核糖核苷三磷酸酯、反应体系中的免疫原性杂质,获得浓缩液iv;
40.获得浓缩液iv加入dna酶处理后,对酶及蛋白质进行盐析,盐析后取上清液采用梯度孔结构中空纤维超滤膜过滤,获得浓缩液v;
41.对浓缩液v中的外源rna进行沉淀,沉淀后取上清液采用梯度孔结构中空纤维超滤膜过滤,获得浓缩液vi;
42.对浓缩液vi中的dsrna进行沉淀,沉淀后取上清液采用梯度孔结构中空纤维超滤膜过滤,获得浓缩液vii;
43.对浓缩液vii中的mrna进行盐析,直接采用梯度孔结构中空纤维超滤膜过滤,获得浓缩液,浓缩液中的mrna复溶过滤2-3次,取最终浓缩液得到纯化mrna。
44.进一步地,步骤(2)中,
45.盐析酶所用试剂包括试剂vi,试剂vi包括十二烷基磺酸钠、十二烷基苯磺酸钠、十六烷基磺酸钠、十六烷基苯磺酸钠、木质素磺酸钠中的至少一种,试剂vi浓度为0.01-5mol/l,试剂vi处理时间为10-60min;
46.沉淀外源rna所用试剂包括试剂vii,试剂vii包括秋水仙碱、2-羟基乙胺、三异丙醇胺、叔丁胺、异丁胺中的至少一种,试剂vii浓度为0.01-2mol/l,试剂vii处理时间10-40min;
47.沉淀dsrna所用试剂包括试剂viii,试剂viii包括乙二醇、乙醇、正丁醇、丙三醇、丙酮、丙醇中的至少一种,试剂viii为浓度为0.01-5mol/l,试剂viii为处理时间10-100min;
48.盐析mrna所用试剂包括试剂ix,试剂ix包括氯化铵、硫酸铵、硝酸铵、醋酸铵、碳酸铵、碳酸氢铵中的至少一种,试剂ix为浓度为0.01-5mol/l,试剂ix处理时间为10-180min。
49.进一步地,步骤(3)中,
50.mrna包封或装载后的溶液直接采用梯度孔结构中空纤维超滤膜过滤除去其他小分子杂质,获得浓缩液viii;
51.对浓缩液viii未包封或未装载的mrna进行盐析,盐析后取上清液采用梯度孔结构中空纤维超滤膜过滤,获得浓缩液,即为纯化后的包封/转载mrna。
52.进一步地,步骤(3)中,
53.盐析未包封或未装载的mrna所用试剂包括试剂x,试剂x包括四甲基氯化铵、十二烷基三甲基溴化铵、十六烷基三甲氯化铵、十六烷基三甲基溴化铵、亚精胺中的至少一种,
试剂x浓度为0.01-5mol/l,试剂x处理时间为10-100min。
54.综上所述,本发明提供的方法可应用于mrna疫苗从菌种破裂开始到最终包封/转载的连续大规模长期稳定纯化操作,相对于传统mrna疫苗各阶段纯化工艺,本发明方法易于工业化实施,总体纯化成本低,mrna疫苗纯度高,为mrna疫苗纯化提供客观的前景。
附图说明
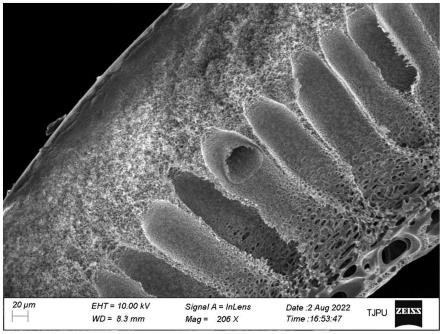
55.图1所示为切割分子量为750kda的pvdf材质梯度孔结构中空纤维超滤膜sem图像。
56.图2所示为切割分子量为300kda的mpes材质梯度孔结构中空纤维超滤膜sem图像。
具体实施方式
57.下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
58.实施例采用的梯度孔结构中空纤维超滤膜均由天津鼎芯膜科技有限公司生产制造。该产品依据该公司的专利cn115090134a制造的,其梯度孔结构如图1、2所示。
59.实施例中盐酸缓冲液为tris-hcl,硫酸缓冲液为tris-h2so4,磷酸缓冲液为tris-h3po4,乙酸缓冲液为tris-ch3cooh。
60.实施例1-9所用的大肠杆菌菌种原液为相同菌种均为dh5a菌株,浓度均为5~9*107cfu/ml,dna酶的型号均为d806930,上海麦克林生化科技有限公司。
61.实施例1:
62.步骤一:质粒dna的纯化
63.取1000g的大肠杆菌菌种原液,加入0.3mol/lkoh溶液5l,充分混合,使菌种细胞充分裂解,然后加入1mol/l,ph=6.5的盐酸缓冲液,调控溶液的ph为8.5-9.2,混合均匀30min使蛋白质变性沉淀完全、析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为1.8,型号uc-pvdf750)切向流过滤,膜材质为pvdf(图1),中空纤维超滤膜切割分子量为750kda,压力为0.05mpa,切向流过滤的通量为25l/(h
·
m2)。除去细胞碎片和内毒素,获得浓缩液i。每批料液处理完毕采用盐酸缓冲液与超纯水反冲洗超滤膜,用碱灭菌后备用。
64.向获得浓缩液i中加入试剂0.8mol/l pvpk302l,混合均匀,然后加入0.2mol/l,ph=7.5的磷酸缓冲液,调控溶液的ph为9.2-9.6,混合均匀20min使宿主基因组dna沉淀完全、析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为1.6,型号uc-pan500)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为500kda,压力为0.1mpa,切向流过滤的通量为35l/(h
·
m2),获得浓缩液ii。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
65.向获得浓缩液ii中加入4mol/lnano3溶液800ml,混合均匀,然后加入1mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.3-9.7,混合均匀25min使rna沉淀完全、析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1.5mm,内外径之比为2,型号uc-pvdf300)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为300kda,压力为
0.05mpa,切向流过滤的通量为20l/(h
·
m2)。获得浓缩液iii。每批料液处理完毕采用1mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
66.此时浓缩液iii中主要物质即为质粒dna,为进一步纯化,采用以下操作。向获得的浓缩液iii中加入0.9mol/l peg80002l,混合均匀,然后加入0.2mol/l,ph=7.5的磷酸缓冲液,调控溶液ph为7.7-7.9,混合均匀25min后,使质粒dna析出,采用梯度孔结构mpes中空纤维超滤膜(图2,直径1mm,内外径之比为2,型号uc-mpes300)死端过滤,中空纤维超滤膜切割分子量为300kda,压力为0.1mpa,死端过滤的通量为30l/(h
·
m2)获得浓缩液,依据以上参数重复操作3次,最后一次的浓缩液重新溶解后继续过滤,获得高纯度的质粒dna原液用于体外转录,并加帽、加尾生产目标mrna。
67.其中,以线性化质粒dna为模板,利用t7启动子或sp6启动子,以ntp为底物,使用rna聚合酶合成mrna再进行修饰;mrna的加帽过程主要是在mrna 5
′
端第一个核苷酸上添加7-甲基鸟苷(m7g),可保护mrna免于降解,增加可议性及调高剪接效率,是促进核糖体靶定到mrna进行翻译的关键因子,通过加帽酶、s-腺苷甲硫氨酸(sam)与gtp进行加帽,采用酶学法,利用牛痘病毒加帽系统,使用天然帽,系统内含rna三磷酸酶、鸟嘌呤甲基转移酶及鸟嘌呤转移酶、甲基供体sam、gtp和反应缓冲液。此反应将cap 0mrna转化为cap 1mrna,反应时间较短,帽结构以正确方向进行添加,加帽效率接近100%,效率较高;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能,通过在模板中设计编码固定长度的序列,在体外直接转录生成目标mrna。
68.每批料液处理完毕采用盐酸缓冲液与超纯水反冲洗超滤膜,用碱灭菌后备用。
69.测试质粒dna的纯度为96.8%。
70.步骤二:mrna的纯化
71.对目标mrna溶液,直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-mpes100)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为100kda,压力为0.05mpa,切向流过滤的通量为20l/h/m2,除去游离核苷酸、核糖核苷三磷酸酯、免疫原性杂质等分子尺寸较小的杂质,获得浓缩液iv。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
72.浓缩液iv加入5g dna酶,使残留的dna片段等充分降解,然后加入1mol/l十二烷基苯磺酸钠溶液2l,混合均匀20min后,加入0.2mol/l,ph=7.5的磷酸缓冲液,调控溶液ph为8.5-8.9,混合均匀30min溶液中的酶及其它蛋白质发生盐析完全沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes/spes150)切向流过滤,膜材质为pes/spes,中空纤维超滤膜切割分子量为150kda,压力为0.1mpa,切向流过滤的通量为20l/(h
·
m2)。获得浓缩液v。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
73.向浓缩液v中加入3mol/l的三异丙醇胺500ml,混合均匀,然后加入0.2mol/l,ph=7.5的磷酸缓冲液,调控溶液ph为8.5-8.8,混合均匀30min后,溶液中的外源rna析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpsf100)切向流过滤,膜材质为mpsf,中空纤维超滤膜切割分子量为100kda,压力为
0.09mpa,切向流过滤的通量为30l/(h
·
m2),获得浓缩液vi。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
74.向浓缩液vi中加入1mol/l的丙三醇1000ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为8.2-8.4,混合均匀20min后,使溶液中的dsrna析出完全。抽取上层清液,上清液采用采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes100)切向流过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.05mpa,切向流过滤的通量为20l/(h
·
m2)。获得浓缩液vii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
75.此时浓缩液vii中的主要物质即为mrna。为进一步纯化,采用以下操作。向获得的浓缩液vii中加入1mol/l的氯化铵400ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为7.8-8.1,混合均匀20min后,使mrna盐析析出。采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes100)死端过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.15mpa,死端过滤的通量为30l/(h
·
m2),获得浓缩液;依据上述参数重复操作4次,最后一次的浓缩液重新溶解后继续过滤,获得高纯度的目标mrna原液,进行lnp包封/装载。
76.其中,lnp的组装和形成由疏水力和静电力驱动,先将四种脂质(解离性脂类、饱和磷脂脂类、胆固醇脂类、聚乙二醇脂类)溶于乙醇,2体积含脂质乙醇溶液通常与5体积mrna在ph=4的醋酸盐水缓冲液中混合,当脂质与水缓冲液接触时,它们在3:4的水/乙醇溶剂中变得不溶,并且可电离脂质变得质子化并且带正电荷,然后驱动它与带负电荷的mrna磷酸骨架静电结合,同时脂质变得不溶,形成脂质颗粒,将mrna包裹在水悬浮液中。水相和脂质相混合当混合相ph接近5.8时,电离脂质质子化,当混合相ph接近6.9,mrna被包封,随后通过稀释或透析至ph=7.8时,形成了不带电的lnp纳米脂质颗粒。
77.每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
78.测试mrna的纯度为99.2%。
79.步骤三:mrna包封/装载后纯化(换液浓缩)
80.完成包封的溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.6,型号uc-pes100)切向流过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.2mpa,切向流过滤的通量为30l/(h
·
m2),除去edta、氯化钠、乙醇和醋酸钠等分子尺寸较小的杂质,获得浓缩液viii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
81.向浓缩液viii加入1mol/l的十二烷基三甲基溴化铵1000ml,混合均匀,然后加入1mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为8.2-8.5,混合均匀20min后,使未包封或未装载的mrna盐析析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为1.75,型号uc-pan150)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为150kda,压力为0.15mpa,切向流过滤的通量为20l/(h
·
m2,完成mrna包封/装载后的纯化。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
82.测试包封mrna的纯度为99.2%。
83.实施例2
84.步骤一:质粒dna的纯化
85.取1000g大肠杆菌菌种原液,加入1mol/l柠檬酸钠溶液3l,充分混合,使菌种细胞充分裂解,然后加入0.2mol/l,ph=7.5的磷酸缓冲液,调控溶液的ph为8.8-9.0,混合均匀30min使蛋白质变性沉淀析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pvdf750)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为750kda,压力为0.05mpa,切向流过滤的通量为35l/(h
·
m2)。除去细胞碎片和内毒素,获得浓缩液i。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
86.向获得浓缩液i中加入试剂200g pvpk90,混合均匀,然后加入0.2mol/l,ph=7.5的磷酸缓冲液,调控溶液的ph为10.2-10.5,混合均匀30min使宿主基因组dna沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为1.6,型号uc-pan500)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为500kda,压力为0.1mpa,切向流过滤的通量为15l/(h
·
m2),获得浓缩液ii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
87.向获得浓缩液ii中加入3mol/l cacl2溶液1l,混合均匀,然后加入1mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.2-9.8,混合均匀15min后,使rna沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1.5mm,内外径之比为2,型号uc-pvdf300)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为300kda,压力为0.08mpa,切向流过滤的流通量为25l/(h
·
m2)。获得浓缩液iii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
88.此时浓缩液iii中主要物质即为质粒dna,为进一步纯化,采用以下操作。向获得的浓缩液iii中加入500g peg2000,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为7.6-8.0,混合均匀15min后,使质粒dna盐析析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes300)切向流过滤,mpes中空纤维超滤膜切割分子量为300kda,压力为0.1mpa,切向流过滤的通量为50l/(h
·
m2),如此操作2次,最后一次的浓缩液重新溶解后继续过滤,获得高纯度的质粒dna原液用于体外转录,并加帽、加尾生产目标mrna。
89.其中,以线性化质粒dna为模板,利用t7启动子或sp6启动子,以ntp为底物,使用rna聚合酶合成mrna再进行修饰;mrna的加帽过程主要是在mrna 5
′
端第一个核苷酸上添加7-甲基鸟苷(m7g),可保护mrna免于降解,增加可议性及调高剪接效率,是促进核糖体靶定到mrna进行翻译的关键因子,通过加帽酶、s-腺苷甲硫氨酸(sam)与gtp进行加帽,采用酶学法,利用牛痘病毒加帽系统,使用天然帽,系统内含rna三磷酸酶、鸟嘌呤甲基转移酶及鸟嘌呤转移酶、甲基供体sam、gtp和反应缓冲液。此反应将cap 0mrna转化为cap 1mrna,反应时间较短,帽结构以正确方向进行添加;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能,通过在模板中设计编码固定长度的序列,在体外直接转录生成。
90.每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
91.测试质粒dna的纯度为97%。
92.步骤二:mrna的纯化
93.对目标mrna溶液,直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-mpes150)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为150kda,压力为0.05mpa,切向流过滤的通量为40l/(h
·
m2),除去游离核苷酸、核糖核苷三磷酸酯、免疫原性杂质等分子尺寸较小的杂质,获得浓缩液iv。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
94.向浓缩液iv中加入5g dna酶,使残留的dna片段等充分溶解,然后加入2mol/l十二烷基磺酸钠溶液2l,混合均匀30min后,加入0.2mol/l,ph=7.5的磷酸缓冲液,调控溶液ph为7.5-7.9,混合均匀20min使溶液中的酶及其它蛋白质发生盐析。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes/spes150)切向流过滤,膜材质为pes/spes,中空纤维超滤膜切割分子量为150kda,压力为0.05mpa,切向流过滤的通量为40l/(h
·
m2),获得浓缩液v。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
95.向浓缩液v中加入3mol/l的2-羟基乙胺500ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为8.2-8.8,混合均匀20min使溶液中的外源rna析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpsf100)切向流过滤,膜材质为mpsf,中空纤维超滤膜切割分子量为100kda,压力为0.05mpa,切向流过滤的通量为20l/(h
·
m2),获得浓缩液vi。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
96.向浓缩液vi中加入3mol/l的乙二醇500ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为9.2-9.5,混合均匀10min使溶液中的dsrna析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes100)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为100kda,压力为0.1mpa,切向流过滤的通量为30l/(h
·
m2),获得浓缩液vii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
97.此时浓缩液vii中的主要物质即为mrna。为进一步纯化,采用以下操作。向获得的浓缩液vii中加入1mol/l的硫酸铵500ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为8.8-8.9,混合均匀30min使mrna盐析析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes100)死端过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.05mpa,死端过滤的通量为20l/(h
·
m2),再次获得浓缩液;依据上述参数重复操作2次,最后一次浓缩液重新溶解后继续过滤,获得高纯度的目标mrna原液,进行lnp包封/装载。
98.其中,lnp的组装和形成由疏水力和静电力驱动,先将四种脂质(解离性脂类、饱和磷脂脂类、胆固醇脂类、聚乙二醇脂类)溶于乙醇,2体积含脂质乙醇溶液通常与5体积mrna在ph=4的醋酸盐水缓冲液中混合,当脂质与水缓冲液接触时,它们在3:4的水/乙醇溶剂中变得不溶,并且可电离脂质变得质子化并且带正电荷,然后驱动它与带负电荷的mrna磷酸骨架静电结合,同时脂质变得不溶,形成脂质颗粒,将mrna包裹在水悬浮液中。水相和脂质相混合当混合相ph接近5.8时,电离脂质质子化,当混合相ph接近6.9,mrna被包封,随后通过稀释或透析至ph=7.8时,形成了不带电的lnp纳米脂质颗粒。
99.每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
100.测试mrna的纯度为98%。
101.步骤三:mrna包封/装载后纯化(换液浓缩)
102.完成包封的溶液采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-pes100)切向流过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.2mpa,切向流过滤的通量为40l/(h
·
m2),除去edta、氯化钠、乙醇和醋酸钠等分子尺寸较小的杂质,获得浓缩液viii。。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
103.向浓缩液viii加入2mol/l的十二烷基三甲基氯化铵500ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为9.2-9.5,混合均匀30min后,使未包封或未装载的mrna盐析析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为2,型号uc-pan150)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为150kda,压力为0.2mpa,切向流过滤的通量为30l/(h
·
m2),获得高度纯化的包封mrna疫苗。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
104.测试包封mrna的纯度为99%。
105.实施例3:
106.步骤一:质粒dna的纯化
107.取1000g大肠杆菌菌种原液,加入3mol/l甲醇钠溶液2l,充分混合,使菌种细胞充分裂解,然后加入0.5mol/l,ph=5.5的tris-edta缓冲液,调控溶液的ph为9.8-10.0,混合均匀20min后,蛋白质变性沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pvdf750)切向流过滤,膜材质为pvdf(图1),中空纤维超滤膜切割分子量为750kda,压力为0.1mpa,切向流过滤的通量为25l/(h
·
m2),除去细胞碎片和内毒素,获得浓缩液i。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
108.向获得浓缩液i中加入试剂0.05mol/l pvpk904l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液的ph为10.3-10.6,混合均匀20min后,使宿主基因组dna沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为1.6,型号uc-pan500)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为500kda,压力为0.05mpa,切向流过滤的通量为26l/(h
·
m2),获得浓缩液ii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
109.向获得浓缩液ii中加入3mol/lbacl2溶液500ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.3-9.6,混合均匀25min后,使rna沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1.5mm,内外径之比为2,型号uc-pvdf300)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为300kda,压力为0.05mpa,切向流过滤的通量为30l/(h
·
m2),获得浓缩液iii。每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
110.此时浓缩液iii中主要物质即为质粒dna,为进一步纯化,采用以下操作。向获得的浓缩液iii加入0.5mol/l peg200001l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为7.6-8.0,混合均匀25min后,使质粒dna析出,采用梯度孔结构中空纤维超
滤膜(直径1mm,内外径之比为2,型号uc-mpes300)死端过滤,mpes中空纤维超滤膜切割分子量为300kda,压力为0.05mpa,死端过滤的通量为30l/(h
·
m2),再次获得浓缩液,依据上述参数重复操作3次,最后一次的截留液重新溶解后继续过滤,获得高纯度的质粒dna原液用于体外转录,并加帽、加尾生产目标mrna。
111.以线性化质粒dna为模板,利用t7启动子或sp6启动子,以ntp为底物,使用rna聚合酶合成mrna再进行修饰;mrna的加帽过程主要是在mrna 5
′
端第一个核苷酸上添加7-甲基鸟苷(m7g),可保护mrna免于降解,增加可议性及调高剪接效率,是促进核糖体靶定到mrna进行翻译的关键因子,通过加帽酶、s-腺苷甲硫氨酸(sam)与gtp进行加帽,采用酶学法,利用牛痘病毒加帽系统,使用天然帽,系统内含rna三磷酸酶、鸟嘌呤甲基转移酶及鸟嘌呤转移酶、甲基供体sam、gtp和反应缓冲液。此反应将cap 0mrna转化为cap 1mrna,反应时间较短,帽结构以正确方向进行添加;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能,通过在模板中设计编码固定长度的序列,在体外直接转录生成。
112.每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
113.测试质粒dna的纯度为97.5%。
114.步骤二:mrna的纯化
115.目标mrna溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-mpes150)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为150kda,压力为0.08mpa,切向流过滤的通量为30l/(h
·
m2),除去游离核苷酸、核糖核苷三磷酸酯、免疫原性杂质等分子尺寸较小的杂质,获得浓缩液iv。每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
116.向浓缩液iv加入5g dna酶,使残留的dna片段等充分降解,然后加入0.5mol/l木质素磺酸钠溶液2l,混合均匀20min后,加入0.2mol/l,ph=7.5的磷酸缓冲液,调控溶液ph为8.5-8.9,混合均匀30min后,溶液中的酶及其它蛋白质发生盐析。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes/spes100)切向流过滤,膜材质为pes/spes,中空纤维超滤膜切割分子量为100kda,压力为0.05mpa,切向流过滤的通量为30l/(h
·
m2),获得浓缩液v。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
117.向浓缩液v中加入2mol/l的叔丁胺500ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为8.4-8.9,混合均匀30min后,溶液中的外源rna析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes100)死端过滤,膜材质为mpsf,中空纤维超滤膜切割分子量为100kda,压力为0.1mpa,死端过滤的通量为15l/(h
·
m2),获得浓缩液vi。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
118.向浓缩液vi中加入1mol/l的丙醇1000ml,混合均匀,然后加入乙0.5mol/l,ph=3.5的酸缓冲液,调控溶液ph为9.3-9.8,混合均匀20min后,使溶液中的dsrna析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes100)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为100kda,压力为
0.1mpa,切向流过滤的通量为30l/(h
·
m2),获得浓缩液vii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
119.此时浓缩液vii中的主要物质即为mrna。为进一步纯化,采用以下操作。向浓缩液vii中加入1mol/l的硝酸铵1000ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为8.2-8.4,混合均匀20min后,使mrna析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes100)切向流过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.04mpa,切向流过滤的通量为30l/(h
·
m2),再次获得浓缩液;依据上述参数重复操作3次,最后一次浓缩液重新溶解后继续过滤,获得高纯度的目标mrna原液,进行lnp包封/装载。
120.lnp的组装和形成由疏水力和静电力驱动,先将四种脂质(解离性脂类、饱和磷脂脂类、胆固醇脂类、聚乙二醇脂类)溶于乙醇,2体积含脂质乙醇溶液通常与5体积mrna在ph=4的醋酸盐水缓冲液中混合,当脂质与水缓冲液接触时,它们在3:4的水/乙醇溶剂中变得不溶,并且可电离脂质变得质子化并且带正电荷,然后驱动它与带负电荷的mrna磷酸骨架静电结合,同时脂质变得不溶,形成脂质颗粒,将mrna包裹在水悬浮液中。水相和脂质相混合当混合相ph接近5.8时,电离脂质质子化,当混合相ph接近6.9,mrna被包封,随后通过稀释或透析至ph=7.8时,形成了不带电的lnp纳米脂质颗粒。
121.每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
122.测试mrna的纯度为98.6%。
123.步骤三:mrna包封/装载后纯化(换液浓缩)
124.完成包封的溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-mpes100)切向流过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.08mpa,切向流过滤的通量为20l/(h
·
m2),除去edta、氯化钠、乙醇和醋酸钠等分子尺寸较小的杂质,获得浓缩液viii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
125.向浓缩液viii加入1mol/l的四甲基氯化铵500ml,混合均匀,然后加入0.5mol/l,ph=5.5的tris-edta缓冲液,调控溶液ph为9.5-9.8,混合均匀30min后,使未包封或未装载的mrna盐析析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为2,型号uc-pan150)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为150kda,压力为0.1mpa,切向流过滤的通量为40l/(h
·
m2),获得高度纯化的包封mrna疫苗。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
126.测试包封mrna的纯度为99%。
127.实施例4:
128.步骤一:质粒dna的纯化
129.取1000g的菌种原液,加入1mol/l乙醇钾溶液2l,充分混合,使菌种细胞充分裂解,然后加入0.5mol/l,ph=5.5的tris-edta缓冲液,调控溶液的ph为9.8-10.0,混合均匀30min后,蛋白质变性沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pvdf750)切向流过滤,膜材质为pvdf(图1),中空纤维超滤膜切割分子量为750kda,压力为0.2mpa,切向流过滤的通量为35l/(h
·
m2)。除去细胞碎片和内毒素,获得浓缩液i。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水
反冲洗超滤膜。
130.向浓缩液i中加入试剂0.08mol/l pvpk1202l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液的ph为9.3-9.6,混合均匀20min后,使宿主基因组dna沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为1.6,型号uc-pan500)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为500kda,压力为0.1mpa,切向流过滤的通量为30l/(h
·
m2),获得浓缩液ii。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
131.向浓缩液ii中加入1mol/l kno3溶液1l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.4-9.7,混合均匀15min后,使rna沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1.5mm,内外径之比为2,型号uc-pvdf300)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为300kda,压力为0.1mpa,切向流过滤的通量为30l/(h
·
m2),获得浓缩液iii。每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
132.此时浓缩液iii中主要物质即为质粒dna,为进一步纯化,采用以下操作。向浓缩液iii中加入0.35mol/l peg8001l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为7.7-8.0,混合均匀25min后,使质粒dna析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes300)死端过滤,mpes中空纤维超滤膜切割分子量为300kda,压力为0.2mpa,死端过滤的通量为36l/(h
·
m2),再次获得浓缩液,依据上述参数如此操作3次,最后一次浓缩液重新溶解后继续过滤,获得高纯度的质粒dna原液用于体外转录,并加帽、加尾生产目标mrna。
133.以线性化质粒dna为模板,利用t7启动子或sp6启动子,以ntp为底物,使用rna聚合酶合成mrna再进行修饰;mrna的加帽过程主要是在mrna 5
′
端第一个核苷酸上添加7-甲基鸟苷(m7g),可保护mrna免于降解,增加可议性及调高剪接效率,是促进核糖体靶定到mrna进行翻译的关键因子,通过加帽酶、s-腺苷甲硫氨酸(sam)与gtp进行加帽,采用酶学法,利用牛痘病毒加帽系统,使用天然帽,系统内含rna三磷酸酶、鸟嘌呤甲基转移酶及鸟嘌呤转移酶、甲基供体sam、gtp和反应缓冲液。此反应将cap 0mrna转化为cap 1mrna,反应时间较短,帽结构以正确方向进行添加;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能,通过在模板中设计编码固定长度的序列,在体外直接转录生成。
134.每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
135.测试质粒dna的纯度为98.8%。
136.步骤二:mrna的纯化
137.目标mrna溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-mpes150)切向流过滤mrna溶液,膜材质为mpes,中空纤维超滤膜切割分子量为150kda,压力为0.06mpa,切向流过滤的通量为35l/(h
·
m2),除去游离核苷酸、核糖核苷三磷酸酯、免疫原性杂质等分子尺寸较小的杂质,获得浓缩液iv。每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
138.浓缩液iv加入5g dna酶,使残留的dna片段等充分降解,然后加入0.5mol/l十六烷
基磺酸钠溶液2l,混合均匀20min后,加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.5-9.8,混合均匀20min后,溶液中的酶及其它蛋白质盐析沉淀完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes/spes100)切向流过滤,膜材质为pes/spes,中空纤维超滤膜切割分子量为100kda,压力为0.1mpa,切向流过滤的通量为25l/(h
·
m2),获得浓缩液v。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
139.向浓缩液v中加入2mol/l的异丁胺1000ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为8.7-8.9,混合均匀30min后,溶液中的外源rna析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpsf100)死端过滤,膜材质为mpsf,中空纤维超滤膜切割分子量为100kda,压力为0.08mpa,死端过滤的通量为35l/(h
·
m2),获得浓缩液vi。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
140.向浓缩液vi中加入2mol/l的乙醇1000ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为9.3-9.8,混合均匀20min后,使溶液中的dsrna析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes100)切向流过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.1mpa,切向流过滤的通量为30l/(h
·
m2)除去析出的dsrna,获得浓缩液vii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
141.此时浓缩液vii中的主要物质即为mrna。为进一步纯化,采用以下操作。向浓缩液vii中加入2mol/l的醋酸铵1000ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为9.2-9.6,混合均匀20min后,使mrna盐析析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes100)死端过滤,膜材质为mpes,中空纤维超滤膜切割分子量为100kda,压力为0.05mpa,死端过滤的通量为30l/(h
·
m2),再次获得浓缩液;依据上述参数重复操作4次,最后浓缩液重新溶解后继续过滤,获得高纯度的目标mrna原液,进行lnp包封/装载。
142.lnp的组装和形成由疏水力和静电力驱动,先将四种脂质(解离性脂类、饱和磷脂脂类、胆固醇脂类、聚乙二醇脂类)溶于乙醇,2体积含脂质乙醇溶液通常与5体积mrna在ph=4的醋酸盐水缓冲液中混合,当脂质与水缓冲液接触时,它们在3:4的水/乙醇溶剂中变得不溶,并且可电离脂质变得质子化并且带正电荷,然后驱动它与带负电荷的mrna磷酸骨架静电结合,同时脂质变得不溶,形成脂质颗粒,将mrna包裹在水悬浮液中。水相和脂质相混合当混合相ph接近5.8时,电离脂质质子化,当混合相ph接近6.9,mrna被包封,随后通过稀释或透析至ph=7.8时,形成了不带电的lnp纳米脂质颗粒。
143.每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
144.测试mrna的纯度为97.6%。
145.步骤三:mrna包封/装载后纯化(换液浓缩)
146.完成包封的溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-pes100)切向流过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.03mpa,切向流过滤的通量为10l/(h
·
m2),除去edta、氯化钠、乙醇和醋酸钠等分子尺寸较小的杂质,获得浓缩液viii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲
液与超纯水反冲洗超滤膜。
147.向浓缩液viii加入1mol/l的亚精胺800ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为9.5-9.8,混合均匀20min后,使未包封或未装载的mrna盐析析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为2,型号uc-pan150)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为150kda,压力为0.1mpa,切向流过滤的通量为30l/(h
·
m2),获得高度纯化的包封mrna疫苗。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
148.测试包封mrna的纯度为99.3%。
149.实施例5:
150.步骤一:质粒dna的纯化
151.取1000g大肠杆菌菌种原液,加入1.5mol/l氢氧化钾溶液3l,充分混合,使菌种细胞充分裂解,然后加入0.5mol/l,ph=5.5的tris-edta缓冲液,调控溶液的ph为9.8-10.0,混合均匀40min后,蛋白质变性沉淀析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pvdf750)切向流过滤,膜材质为pvdf(图1),中空纤维超滤膜切割分子量为750kda,压力为0.3mpa,切向流过滤的通量为25l/(h
·
m2)。除去细胞碎片和内毒素,获得浓缩液i。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
152.向浓缩液i中加入试剂0.05mol/l pvpk602l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液的ph为9.3-9.5,混合均匀20min后,使宿主基因组dna沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为1.6,型号uc-pan500)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为500kda,压力为0.1mpa,切向流过滤的通量为30l/(h
·
m2),获得浓缩液ii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
153.向获得浓缩液ii中加入1mol/lkno3溶液800ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.3-9.7,混合均匀15min后,使rna沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1.5mm,内外径之比为2,型号uc-pvdf300)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为300kda,压力为0.05mpa,切向流过滤的通量为35l/(h
·
m2),获得浓缩液iii。每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
154.此时浓缩液iii中主要物质即为质粒dna,为进一步纯化,采用以下操作。向浓缩液iii中加入0.25mol/l peg10002l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为7.8-8.5,混合均匀45min后,使质粒dna析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes300)死端过滤,mpes中空纤维超滤膜切割分子量为300kda,压力为0.25mpa,死端过滤的通量为60l/(h
·
m2)再次获得浓缩液,依据上述参数重复操作3次,最后一次的浓缩液重新溶解后继续过滤,获得高纯度的质粒dna原液用于体外转录,并加帽、加尾生产目标mrna。
155.以线性化质粒dna为模板,利用t7启动子或sp6启动子,以ntp为底物,使用rna聚合酶合成mrna再进行修饰;mrna的加帽过程主要是在mrna 5
′
端第一个核苷酸上添加7-甲基鸟苷(m7g),可保护mrna免于降解,增加可议性及调高剪接效率,是促进核糖体靶定到mrna
进行翻译的关键因子,通过加帽酶、s-腺苷甲硫氨酸(sam)与gtp进行加帽,采用酶学法,利用牛痘病毒加帽系统,使用天然帽,系统内含rna三磷酸酶、鸟嘌呤甲基转移酶及鸟嘌呤转移酶、甲基供体sam、gtp和反应缓冲液。此反应将cap 0mrna转化为cap 1mrna,反应时间较短,帽结构以正确方向进行添加;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能,通过在模板中设计编码固定长度的序列,在体外直接转录生成。
156.每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
157.测试质粒dna的纯度为97.6%。
158.步骤二:mrna的纯化
159.目标mrna溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-mpes150)切向流过滤mrna溶液,膜材质为mpes,中空纤维超滤膜切割分子量为150kda,压力为0.05mpa,切向流过滤的通量为40l/(h
·
m2),除去游离核苷酸、核糖核苷三磷酸酯、免疫原性杂质等分子尺寸较小的杂质,获得浓缩液iv。每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
160.向浓缩液iv加入5g dna酶,使残留的dna片段等充分溶解,然后加入0.4mol/l十六烷基苯磺酸钠溶液4l,混合均匀30min后,加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.3-9.6,混合均匀30min后,溶液中的酶及其它蛋白质发生盐析。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes/spes100)切向流过滤,膜材质为pes/spes,中空纤维超滤膜切割分子量为100kda,压力为0.2mpa,切向流过滤的通量为15l/(h
·
m2),获得浓缩液v。每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
161.向浓缩液v中加入1mol/l的秋水仙碱2000ml,混合均匀,然后加入0.2mol/l,ph=7.5的磷酸缓冲液,调控溶液ph为8.0-8.3,混合均匀30min后,溶液中的外源rna析出完全。抽取上层清液,上清液然后采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpsf100)死端过滤,膜材质为mpsf,中空纤维超滤膜切割分子量为100kda,压力为0.06mpa,死端过滤的通量为25l/(h
·
m2),获得浓缩液vi。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
162.向浓缩液vi中加入1.5mol/l的正丁醇800ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为8.3-8.8,混合均匀20min后,使溶液中的dsrna析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes100)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为100kda,压力为0.1mpa,切向流过滤的通量为30l/(h
·
m2),获得浓缩液vii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
163.此时浓缩液vii中的主要物质即为mrna。为进一步纯化,采用以下操作。向浓缩液vii中加入1.5mol/l的碳酸铵2000ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为9.3-9.6,混合均匀20min后,使mrna盐析析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes100)死端过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.08mpa,死端过滤的通量为20l/(h
·
m2),再次获得浓缩
液;依据上述参数重复操作4次,最后一次的浓缩液重新溶解后继续过滤,获得高纯度的目标mrna原液,进行lnp包封/装载。
164.lnp的组装和形成由疏水力和静电力驱动,先将四种脂质(解离性脂类、饱和磷脂脂类、胆固醇脂类、聚乙二醇脂类)溶于乙醇,2体积含脂质乙醇溶液通常与5体积mrna在ph=4的醋酸盐水缓冲液中混合,当脂质与水缓冲液接触时,它们在3:4的水/乙醇溶剂中变得不溶,并且可电离脂质变得质子化并且带正电荷,然后驱动它与带负电荷的mrna磷酸骨架静电结合,同时脂质变得不溶,形成脂质颗粒,将mrna包裹在水悬浮液中。水相和脂质相混合当混合相ph接近5.8时,电离脂质质子化,当混合相ph接近6.9,mrna被包封,随后通过稀释或透析至ph=7.8时,形成了不带电的lnp纳米脂质颗粒。
165.每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
166.测试mrna的纯度为98.8%。
167.步骤三:mrna包封/装载后纯化(换液浓缩)
168.完成包封的溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-pes100)切向流过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.05mpa,切向流过滤的通量为10l/(h
·
m2),除去edta、氯化钠、乙醇和醋酸钠等分子尺寸较小的杂质,获得浓缩液viii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
169.向浓缩液viii中加入1.5mol/l的亚精胺800ml,混合均匀,然后加入0.5mol/l,ph=3.5的乙酸缓冲液,调控溶液ph为9.6-9.8,混合均匀40min后,使未包封或未装载的mrna盐析析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为2,型号uc-pan150)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为150kda,压力为0.1mpa,切向流过滤的通量为35l/(h
·
m2),获得高度纯化的包封mrna疫苗。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
170.测试包封mrna的纯度为99.2%。
171.实施例6:
172.步骤一:质粒dna的纯化
173.取1000g的菌种原液,加入1.2mol/l氢氧化钠溶液2l,充分混合,使菌种细胞充分裂解,然后加入0.5mol/l,ph=5.5的tris-edta缓冲液,调控溶液的ph为9.1-9.5,混合均匀30min后,蛋白质变性沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pvdf750)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为750kda,压力为0.25mpa,切向流过滤的通量为28l/(h
·
m2)。除去细胞碎片和内毒素,获得浓缩液i。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
174.向获得浓缩液i中加入试剂0.08mol/l pvpk601l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液的ph为9.4-9.8,混合均匀40min后,使宿主基因组dna沉淀析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为1.6,型号uc-pan500)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为500kda,压力为0.2mpa,切向流过滤的通量为35l/(h
·
m2),获得浓缩液ii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
175.向获得浓缩液ii中加入1.5mol/l硝酸钙溶液1l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.1-9.4,混合均匀25min后,使rna沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1.5mm,内外径之比为2,型号uc-pvdf300)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为300kda,压力为0.03mpa,切向流过滤的通量为36l/(h
·
m2),获得浓缩液iii。每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
176.此时浓缩液iii中主要物质即为质粒dna,为进一步纯化,采用以下操作。向浓缩液iii中加入0.35mol/l peg10002l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为7.9-8.4,混合均匀35min后,使质粒dna析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes300)死端过滤,mpes中空纤维超滤膜切割分子量为300kda,压力为0.15mpa,死端过滤的通量为32l/(h
·
m2),再次获得浓缩液,依据上述参数重复操作3次,最后一次的浓缩液重新溶解后继续过滤,获得高纯度的质粒dna原液用于体外转录,并加帽、加尾生产目标mrna。
177.以线性化质粒dna为模板,利用t7启动子或sp6启动子,以ntp为底物,使用rna聚合酶合成mrna再进行修饰;mrna的加帽过程主要是在mrna 5
′
端第一个核苷酸上添加7-甲基鸟苷(m7g),可保护mrna免于降解,增加可议性及调高剪接效率,是促进核糖体靶定到mrna进行翻译的关键因子,通过加帽酶、s-腺苷甲硫氨酸(sam)与gtp进行加帽,采用酶学法,利用牛痘病毒加帽系统,使用天然帽,系统内含rna三磷酸酶、鸟嘌呤甲基转移酶及鸟嘌呤转移酶、甲基供体sam、gtp和反应缓冲液。此反应将cap 0mrna转化为cap 1mrna,反应时间较短,帽结构以正确方向进行添加;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能,通过在模板中设计编码固定长度的序列,在体外直接转录生成。
178.每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
179.测试质粒dna的纯度为98.4%。
180.步骤二:mrna的纯化
181.目标mrna溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-mpes150)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为150kda,压力为0.04mpa,切向流过滤的通量为42l/(h
·
m2),除去游离核苷酸、核糖核苷三磷酸酯、免疫原性杂质等分子尺寸较小的杂质,获得浓缩液iv。每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
182.向浓缩液iv加入5g dna酶,使残留的dna片段等充分溶解,然后加入0.3mol/l十六烷基苯磺酸钠溶液1l,混合均匀44min后,加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.2-9.4,混合均匀20min后,溶液中的酶及其它蛋白质发生盐析。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes/spes100)切向流过滤,膜材质为pes/spes,中空纤维超滤膜切割分子量为100kda,压力为0.2mpa,切向流过滤的通量为28l/(h
·
m2),获得浓缩液v。每批料液处理完毕采用0.5mol/l,ph=7.8的盐酸缓冲液与超纯水反冲洗超滤膜。
183.向浓缩液v中加入1mol/l的秋水仙碱1000ml,混合均匀,然后加入0.5mol/l,ph=
7.8的盐酸缓冲液,调控溶液ph为8.1-8.3,混合均匀33min后,溶液中的外源rna析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-psf100)死端过滤,膜材质为mpsf,中空纤维超滤膜切割分子量为100kda,压力为0.07mpa,死端过滤的通量为35l/(h
·
m2),获得浓缩液vi。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
184.向浓缩液vi中加入1.7mol/l的正丁醇600ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为8.5-8.7,混合均匀20min后,使溶液中的dsrna析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes100)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为100kda,压力为0.1mpa,切向流过滤的通量为30l/(h
·
m2),获得浓缩液vii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
185.此时浓缩液vii中的主要物质即为mrna。为进一步纯化,采用以下操作。向获得的浓缩液vii中加入2.5mol/l的碳酸氢铵2000ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.3-9.6,混合均匀20min后,使mrna析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes100)死端过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.07mpa,死端过滤的通量为24l/(h
·
m2),再次获得浓缩液;依据上述参数重复操作3次,最后一次的浓缩液重新溶解后继续过滤,获得高纯度的目标mrna原液,进行lnp包封/装载。
186.lnp的组装和形成由疏水力和静电力驱动,先将四种脂质(解离性脂类、饱和磷脂脂类、胆固醇脂类、聚乙二醇脂类)溶于乙醇,2体积含脂质乙醇溶液通常与5体积mrna在ph=4的醋酸盐水缓冲液中混合,当脂质与水缓冲液接触时,它们在3:4的水/乙醇溶剂中变得不溶,并且可电离脂质变得质子化并且带正电荷,然后驱动它与带负电荷的mrna磷酸骨架静电结合,同时脂质变得不溶,形成脂质颗粒,将mrna包裹在水悬浮液中。水相和脂质相混合当混合相ph接近5.8时,电离脂质质子化,当混合相ph接近6.9,mrna被包封,随后通过稀释或透析至ph=7.8时,形成了不带电的lnp纳米脂质颗粒。
187.每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
188.测试mrna的纯度为98.5%。
189.步骤三:mrna包封/装载后纯化(换液浓缩)
190.完成包封的溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-pes100)切向流过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.05mpa,切向流过滤的通量为16l/(h
·
m2),除去edta、氯化钠、乙醇和醋酸钠等分子尺寸较小的杂质,获得浓缩液viii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
191.向浓缩液viii加入1.5mol/l的十二烷基三甲基溴化铵900ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.4-9.8,混合均匀40min后,使未包封或未装载的mrna盐析析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为2,型号uc-pan150)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为150kda,压力为0.08mpa,切向流过滤的通量为38l/(h
·
m2),获得高度纯化的包封mrna疫苗。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
192.测试包封mrna的纯度为99.3%。
193.实施例7:
194.步骤一:质粒dna的纯化
195.取1000g的菌种原液,加入1.4mol/l柠檬酸钠溶液1.5l,充分混合,使菌种细胞充分裂解,然后加入0.5mol/l,ph=5.5的tris-edta缓冲液,调控溶液的ph为8.2-8.4,混合均匀30min后,蛋白质变性沉淀析出完全。。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pvdf750)切向流过滤,膜材质为pvdf(图1),中空纤维超滤膜切割分子量为750kda,压力为0.35mpa,切向流过滤的通量为38l/(h
·
m2)。除去细胞碎片和内毒素,获得浓缩液i。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
196.向获得浓缩液i中加入试剂0.09mol/l pvp k901.5l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液的ph为9.3-9.6,混合均匀30min后,使宿主基因组dna沉淀析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为1.6,型号uc-pes/spes500)切向流过滤,膜材质为pes/spes,中空纤维超滤膜切割分子量为500kda,压力为0.3mpa,切向流过滤的通量为24l/(h
·
m2),获得浓缩液ii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
197.向获得浓缩液ii中加入2.5mol/l氯化钠溶液1l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.2-9.5,混合均匀35min后,使rna沉淀析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1.5mm,内外径之比为2,型号uc-pvdf300)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为300kda,压力为0.02mpa,切向流过滤的通量为30l/(h
·
m2),获得浓缩液iii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
198.此时浓缩液iii中主要物质即为质粒dna,为进一步纯化,采用以下操作。向浓缩液iii中加入0.36mol/l peg20003l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为7.8-8.4,混合均匀33min后,使质粒dna析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes300)死端过滤,mpes中空纤维超滤膜切割分子量为300kda,压力为0.15mpa,死端过滤的通量为36l/(h
·
m2)再次获得浓缩液,依据上述参数重复操作3次,最后一次的浓缩液重新溶解后继续过滤,获得高纯度的质粒dna原液用于体外转录,并加帽、加尾生产目标mrna。
199.以线性化质粒dna为模板,利用t7启动子或sp6启动子,以ntp为底物,使用rna聚合酶合成mrna再进行修饰;mrna的加帽过程主要是在mrna 5
′
端第一个核苷酸上添加7-甲基鸟苷(m7g),可保护mrna免于降解,增加可议性及调高剪接效率,是促进核糖体靶定到mrna进行翻译的关键因子,通过加帽酶、s-腺苷甲硫氨酸(sam)与gtp进行加帽,采用酶学法,利用牛痘病毒加帽系统,使用天然帽,系统内含rna三磷酸酶、鸟嘌呤甲基转移酶及鸟嘌呤转移酶、甲基供体sam、gtp和反应缓冲液。此反应将cap 0mrna转化为cap 1mrna,反应时间较短,帽结构以正确方向进行添加;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能,通过在模板中设计编码固定长度的序列,在体外直接转录生成。
200.每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
201.测试质粒dna的纯度为98.7%。
202.步骤二:mrna的纯化
203.目标mrna溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-mpes150)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为150kda,压力为0.03mpa,切向流过滤的通量为35l/(h
·
m2),除去游离核苷酸、核糖核苷三磷酸酯、免疫原性杂质等分子尺寸较小的杂质,获得浓缩液iv。每30每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
204.向浓缩液iv中加入5g dna酶,使残留的dna片段等充分溶解,然后加入0.3mol/l十二烷基磺酸钠溶液1l,混合均匀44min后,加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.1-9.4,混合均匀26min后,溶液中的酶及其它蛋白质发生盐析。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes/spes100)切向流过滤,膜材质为pes/spes,中空纤维超滤膜切割分子量为100kda,压力为0.25mpa,切向流过滤的通量为25l/(h
·
m2),获得浓缩液v。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
205.向浓缩液v中加入1mol/l的三异丙醇胺1000ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为8.4-8.7,混合均匀38min后,溶液中的外源rna析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpsf100)死端过滤,膜材质为mpsf,中空纤维超滤膜切割分子量为100kda,压力为0.05mpa,死端过滤的通量为45l/(h
·
m2),获得浓缩液vi。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
206.向浓缩液vi中加入1.7mol/l的乙二醇600ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为8.5-8.8,混合均匀30min后,使溶液中的dsrna析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes100)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为100kda,压力为0.15mpa,切向流过滤的通量为34l/(h
·
m2),获得浓缩液vii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
207.此时浓缩液vii中的主要物质即为mrna。为进一步纯化,采用以下操作。向浓缩液vii中加入2.5mol/l的碳酸氢铵1500ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.2-9.4,混合均匀30min后,使mrna盐析析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes100)死端过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.08mpa,死端过滤的通量为28l/(h
·
m2),再次获得浓缩液;依据上述参数重复操作4次,最后一次的浓缩液重新溶解后继续过滤,获得高纯度的目标mrna原液,进行lnp包封/装载。
208.lnp的组装和形成由疏水力和静电力驱动,先将四种脂质(解离性脂类、饱和磷脂脂类、胆固醇脂类、聚乙二醇脂类)溶于乙醇,2体积含脂质乙醇溶液通常与5体积mrna在ph=4的醋酸盐水缓冲液中混合,当脂质与水缓冲液接触时,它们在3:4的水/乙醇溶剂中变得不溶,并且可电离脂质变得质子化并且带正电荷,然后驱动它与带负电荷的mrna磷酸骨架静电结合,同时脂质变得不溶,形成脂质颗粒,将mrna包裹在水悬浮液中。水相和脂质相混
合当混合相ph接近5.8时,电离脂质质子化,当混合相ph接近6.9,mrna被包封,随后通过稀释或透析至ph=7.8时,形成了不带电的lnp纳米脂质颗粒。
209.每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
210.测试mrna的纯度为97.5%。
211.步骤三:mrna包封/装载后纯化(换液浓缩)
212.完成包封的溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-pes100)切向流过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.08mpa,切向流过滤的通量为30l/(h
·
m2),除去edta、氯化钠、乙醇和醋酸钠等分子尺寸较小的杂质,获得浓缩液viii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
213.向浓缩液viii加入1.5mol/l的十六烷基三甲基溴化铵1000ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.5-9.8,混合均匀30min后,使未包封或未装载的mrna盐析析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为2,型号uc-pan150)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为150kda,压力为0.06mpa,切向流过滤的通量为40l/(h
·
m2),获得高度纯化的包封mrna疫苗。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
214.测试包封mrna的纯度为99.1%。
215.实施例8:
216.步骤一:质粒dna的纯化
217.取1000g的菌种原液,加入1.3mol/l乙醇钾溶液1.5l,充分混合,使菌种细胞充分裂解,然后加入0.5mol/l,ph=5.5的tris-edta缓冲液,调控溶液的ph为8.3-8.8,混合均匀40min后,蛋白质变性沉淀析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pvdf750)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为750kda,压力为0.35mpa,切向流过滤的通量为50l/(h
·
m2)。除去细胞碎片和变性蛋白,获得浓缩液i。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
218.向获得浓缩液i中加入试剂0.08mol/l pvp k151.5l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液的ph为9.3-9.6,混合均匀30min后,使宿主基因组dna沉淀析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为1.6,型号uc-pan500)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为500kda,压力为0.8mpa,切向流过滤的通量为50l/(h
·
m2),获得浓缩液ii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
219.向获得浓缩液ii中加入3.3mol/l氯化钠溶液1l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.1-9.5,混合均匀35min后,使rna沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1.5mm,内外径之比为2,型号uc-mpsf300)切向流过滤,膜材质为mpsf,中空纤维超滤膜切割分子量为300kda,压力为0.03mpa,切向流过滤的通量为40l/(h
·
m2)。获得浓缩液iii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
220.此时浓缩液iii中主要物质即为质粒dna,为进一步纯化,采用以下操作。向浓缩液iii加入0.33mol/l peg60003l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为7.5-8.1,混合均匀38min后,使质粒dna析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes300)死端过滤,膜材质为mpes,中空纤维超滤膜切割分子量为300kda,压力为0.14mpa,死端过滤的通量为32l/(h
·
m2),再次获得浓缩液。依据上述参数重复操作3次,最后一次浓缩液重新溶解后继续过滤,获得高纯度的质粒dna原液用于体外转录,并加帽、加尾生产目标mrna。
221.以线性化质粒dna为模板,利用t7启动子或sp6启动子,以ntp为底物,使用rna聚合酶合成mrna再进行修饰;mrna的加帽过程主要是在mrna 5
′
端第一个核苷酸上添加7-甲基鸟苷(m7g),可保护mrna免于降解,增加可议性及调高剪接效率,是促进核糖体靶定到mrna进行翻译的关键因子,通过加帽酶、s-腺苷甲硫氨酸(sam)与gtp进行加帽,采用酶学法,利用牛痘病毒加帽系统,使用天然帽,系统内含rna三磷酸酶、鸟嘌呤甲基转移酶及鸟嘌呤转移酶、甲基供体sam、gtp和反应缓冲液。此反应将cap 0mrna转化为cap 1mrna,反应时间较短,帽结构以正确方向进行添加;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能,通过在模板中设计编码固定长度的序列,在体外直接转录生成。
222.每28每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
223.测试质粒dna的纯度为98.4%。
224.步骤二:mrna的纯化
225.目标mrna溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-mpes150)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为150kda,压力为0.02mpa,切向流过滤的流速为45l/(h
·
m2),除去游离核苷酸、核糖核苷三磷酸酯、免疫原性杂质等分子尺寸较小的杂质,获得浓缩液iv。每30每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
226.向浓缩液iv加入5g dna酶,使残留的dna片段等充分降解,然后加入0.2mol/l十六烷基磺酸钠溶液2l,混合均匀45min后,加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.2-9.6,混合均匀36min后,溶液中的酶及其它蛋白质发生盐析。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes/spes100)切向流过滤,膜材质为pes/spes,中空纤维超滤膜切割分子量为100kda,压力为0.25mpa,切向流过滤的通量为30l/(h
·
m2),获得浓缩液v。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
227.向浓缩液v中加入1mol/l的三异丙醇胺600ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为8.5-8.9,混合均匀48min后,溶液中的外源rna析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-psf100)死端过滤,膜材质为psf,中空纤维超滤膜切割分子量为100kda,压力为0.06mpa,死端过滤的通量为35l/(h
·
m2),获得浓缩液vi。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
228.向浓缩液vi中加入1.6mol/l的乙醇800ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为8.6-8.8,混合均匀40min后,使溶液中的dsrna析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes100)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为100kda,压力为0.28mpa,切向流过滤的通量为38l/(h
·
m2)除去dsrna,获得浓缩液vii。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
229.此时浓缩液vii中的主要物质即为mrna。为进一步纯化,采用以下操作。向获得的浓缩液vii中加入2.6mol/l的碳酸氢铵1000ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.1-9.4,混合均匀30min后,使mrna盐析析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes100)死端过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.08mpa,死端过滤的通量为42l/(h
·
m2),再次获得浓缩液;依据上述参数重复操作4次,最后一次的浓缩液重新溶解后继续过滤,获得高纯度的目标mrna原液,进行lnp包封/装载。
230.lnp的组装和形成由疏水力和静电力驱动,先将四种脂质(解离性脂类、饱和磷脂脂类、胆固醇脂类、聚乙二醇脂类)溶于乙醇,2体积含脂质乙醇溶液通常与5体积mrna在ph=4的醋酸盐水缓冲液中混合,当脂质与水缓冲液接触时,它们在3:4的水/乙醇溶剂中变得不溶,并且可电离脂质变得质子化并且带正电荷,然后驱动它与带负电荷的mrna磷酸骨架静电结合,同时脂质变得不溶,形成脂质颗粒,将mrna包裹在水悬浮液中。水相和脂质相混合当混合相ph接近5.8时,电离脂质质子化,当混合相ph接近6.9,mrna被包封,随后通过稀释或透析至ph=7.8时,形成了不带电的lnp纳米脂质颗粒。
231.每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
232.测试mrna的纯度为98.5%。
233.步骤三:mrna包封/装载后纯化(换液浓缩)
234.完成包封的溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-pes100)切向流过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.2mpa,切向流过滤的通量为30l/(h
·
m2),除去edta、氯化钠、乙醇和醋酸钠等分子尺寸较小的杂质,获得浓缩液viii。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
235.向浓缩液viii中加入1.8mol/l的十二烷基三甲基溴化铵2000ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.6-9.8,混合均匀30min后,使未包封或未装载的mrna盐析析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为2,型号uc-pan150)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为150kda,压力为0.08mpa,切向流过滤的通量为45l/(h
·
m2),获得高度纯化的包封mrna疫苗。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
236.测试包封mrna的纯度为99.2%。
237.实施例9:
238.步骤一:质粒dna的纯化
239.取1000g的菌种原液,加入1.8mol/l甲醇钠溶液2l,充分混合,使菌种细胞充分裂
解,然后加入0.5mol/l,ph=5.5的tris-edta缓冲液,调控溶液的ph为8.6-8.8,混合均匀40min后,蛋白质变性沉淀析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pvdf750)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为750kda,压力为0.25mpa,切向流过滤的通量为40l/(h
·
m2),除去细胞碎片和内毒素,获得浓缩液i。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
240.向获得浓缩液i中加入试剂0.06mol/l pvp k602.5l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液的ph为9.2-9.6,混合均匀50min后,使宿主基因组dna沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为1.6,型号uc-pan500)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为500kda,压力为0.6mpa,切向流过滤的通量为40l/(h
·
m2),获得浓缩液ii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
241.向获得浓缩液ii中加入3.4mol/l氯化钠溶液1l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.2-9.5,混合均匀25min后,使rna沉淀析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1.5mm,内外径之比为2,型号uc-pvdf300)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为300kda,压力为0.04mpa,切向流过滤的通量为50l/(h
·
m2),获得浓缩液iii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
242.此时浓缩液iii中主要物质即为质粒dna,为进一步纯化,采用以下操作。向浓缩液iii中加入0.43mol/l peg100001l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为7.8-8.1,混合均匀41min后,使质粒dna析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes300)死端过滤,膜材质为mpes,中空纤维超滤膜切割分子量为300kda,压力为0.15mpa,死端过滤的通量为30l/(h
·
m2),再次获得浓缩液,依据上述参数重复操作3次,最后一次的浓缩液重新溶解后继续过滤,获得高纯度的质粒dna原液用于体外转录,并加帽、加尾生产目标mrna。
243.以线性化质粒dna为模板,利用t7启动子或sp6启动子,以ntp为底物,使用rna聚合酶合成mrna再进行修饰;mrna的加帽过程主要是在mrna 5
′
端第一个核苷酸上添加7-甲基鸟苷(m7g),可保护mrna免于降解,增加可议性及调高剪接效率,是促进核糖体靶定到mrna进行翻译的关键因子,通过加帽酶、s-腺苷甲硫氨酸(sam)与gtp进行加帽,采用酶学法,利用牛痘病毒加帽系统,使用天然帽,系统内含rna三磷酸酶、鸟嘌呤甲基转移酶及鸟嘌呤转移酶、甲基供体sam、gtp和反应缓冲液。此反应将cap 0mrna转化为cap 1mrna,反应时间较短,帽结构以正确方向进行添加;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能,通过在模板中设计编码固定长度的序列,在体外直接转录生成。
244.每28每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
245.测试质粒dna的纯度为98.8%。
246.步骤二:mrna的纯化
247.目标mrna溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-mpes150)切向流过滤mrna溶液,膜材质为mpes,中空纤维超滤膜切割分子量为150kda,压力为0.03mpa,切向流过滤的通量为40l/(h
·
m2),除去游离核苷酸、核糖核苷三磷酸酯、免疫原性杂质等分子尺寸较小的杂质,获得浓缩液iv。每30每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
248.向浓缩液iv中加入5g dna酶,使残留的dna片段等充分降解,然后加入0.3mol/l十六烷基磺酸钠溶液3l,混合均匀45min后,加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.3-9.6,混合均匀36min后,溶液中的酶及其它蛋白质发生盐析。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes/spes100)切向流过滤,膜材质为pes/spes,中空纤维超滤膜切割分子量为100kda,压力为0.35mpa,切向流过滤的通量为40l/(h
·
m2),获得浓缩液v。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
249.向浓缩液v中加入1mol/l的三异丙醇胺600ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为8.5-8.8,混合均匀48min后,溶液中的外源rna析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpsf100)死端过滤,膜材质为mpsf,中空纤维超滤膜切割分子量为100kda,压力为0.08mpa,死端过滤的通量为35l/(h
·
m2),获得浓缩液vi。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
250.向浓缩液vi中加入2mol/l的乙二醇800ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为10.2-10.5,混合均匀30min后,使溶液中的dsrna析出。抽取上层清液,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes100)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为100kda,压力为0.18mpa,切向流过滤的通量为41l/(h
·
m2),获得浓缩液vii。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
251.此时浓缩液vii中的主要物质即为mrna。为进一步纯化,采用以下操作。向浓缩液vii中加入3.6mol/l的氯化铵1000ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.1-9.4,混合均匀40min后,使mrna盐析析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes100)死端过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.06mpa,死端过滤的通量为40l/(h
·
m2),再次获得浓缩液;依据上述参数重复操作4次,最后一次的浓缩液重新溶解后继续过滤,获得高纯度的目标mrna原液,进行lnp包封/装载。
252.lnp的组装和形成由疏水力和静电力驱动,先将四种脂质(解离性脂类、饱和磷脂脂类、胆固醇脂类、聚乙二醇脂类)溶于乙醇,2体积含脂质乙醇溶液通常与5体积mrna在ph=4的醋酸盐水缓冲液中混合,当脂质与水缓冲液接触时,它们在3:4的水/乙醇溶剂中变得不溶,并且可电离脂质变得质子化并且带正电荷,然后驱动它与带负电荷的mrna磷酸骨架静电结合,同时脂质变得不溶,形成脂质颗粒,将mrna包裹在水悬浮液中。水相和脂质相混合当混合相ph接近5.8时,电离脂质质子化,当混合相ph接近6.9,mrna被包封,随后通过稀释或透析至ph=7.8时,形成了不带电的lnp纳米脂质颗粒。
253.每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
254.测试mrna的纯度为99.3%。
255.步骤三:mrna包封/装载后纯化(换液浓缩)
256.完成包封的溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-pes100)切向流过滤,采用梯度孔结构中空纤维超滤膜切向流过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.2mpa,切向流过滤的通量为40l/(h
·
m2),除去edta、氯化钠、乙醇和醋酸钠等分子尺寸较小的杂质,获得浓缩液viii。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
257.向浓缩液viii中加入1.6mol/l的四甲基氯化铵1000ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.4-9.7,混合均匀30min后,使未包封或未装载的mrna盐析析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为2,型号uc-pan150)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为150kda,压力为0.07mpa,切向流过滤的通量为35l/(h
·
m2),获得高度纯化的包封mrna疫苗。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
258.测试包封mrna的纯度为99.2%。
259.实施例10:
260.步骤一:质粒dna的纯化
261.取1000g的菌种原液,加入1.8mol/l乙醇钾溶液4l,充分混合,使菌种细胞充分裂解,然后加入0.5mol/l,ph=5.5的tris-edta缓冲液,调控溶液的ph为8.3-8.5,混合均匀30min后,蛋白质变性沉淀析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pvdf750)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为750kda,压力为0.05mpa,切向流过滤的通量为26l/(h
·
m2)。除去细胞碎片和内毒素,获得浓缩液i。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
262.向浓缩液i中加入试剂0.04mol/l pvp k903l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液的ph为9.1-9.4,混合均匀50min后,使宿主基因组dna沉淀析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为1.6,型号uc-pan500)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为500kda,压力为0.4mpa,切向流过滤的通量为45l/(h
·
m2),获得浓缩液ii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
263.向获得浓缩液ii中加入3.5mol/l氯化钠溶液1l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.3-9.6,混合均匀35min后,使rna沉淀析出完全。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1.5mm,内外径之比为2,型号uc-pvdf300)切向流过滤,膜材质为pvdf,中空纤维超滤膜切割分子量为300kda,压力为0.03mpa,切向流过滤的通量为60l/(h
·
m2),获得浓缩液iii。每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
264.此时浓缩液iii中主要物质即为质粒dna,为进一步纯化,采用以下操作。向浓缩液iii中加入0.45mol/l peg200001l,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为7.8-8.3,混合均匀45min后,使质粒dna析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes300)死端过滤,膜材质为mpes,中空纤维超滤膜
切割分子量为300kda,压力为0.25mpa,死端过滤的通量为35l/(h
·
m2),再次获得浓缩液。依据上述参数重复操作3次,最后一次的浓缩液重新溶解后继续过滤,获得高纯度的质粒dna原液用于体外转录,并加帽、加尾生产目标mrna。
265.以线性化质粒dna为模板,利用t7启动子或sp6启动子,以ntp为底物,使用rna聚合酶合成mrna再进行修饰;mrna的加帽过程主要是在mrna 5
′
端第一个核苷酸上添加7-甲基鸟苷(m7g),可保护mrna免于降解,增加可议性及调高剪接效率,是促进核糖体靶定到mrna进行翻译的关键因子,通过加帽酶、s-腺苷甲硫氨酸(sam)与gtp进行加帽,采用酶学法,利用牛痘病毒加帽系统,使用天然帽,系统内含rna三磷酸酶、鸟嘌呤甲基转移酶及鸟嘌呤转移酶、甲基供体sam、gtp和反应缓冲液。此反应将cap 0mrna转化为cap 1mrna,反应时间较短,帽结构以正确方向进行添加;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能;mrna的polya尾具备可以助力mrna从核到细胞质的转运与降低mrna受到核酶的降解,增强mrna的稳定性等功能,通过在模板中设计编码固定长度的序列,在体外直接转录生成。
266.每28每批料液处理完毕采用0.5mol/l,ph=3.5的乙酸缓冲液与超纯水反冲洗超滤膜。
267.测试质粒dna的纯度为97.8%。
268.步骤二:mrna的纯化
269.目标mrna溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-mpes150)切向流过滤mrna溶液,膜材质为mpes,中空纤维超滤膜切割分子量为150kda,压力为0.02mpa,切向流过滤的通量为20l/(h
·
m2),除去游离核苷酸、核糖核苷三磷酸酯、免疫原性杂质等分子尺寸较小的杂质,获得浓缩液iv。每30每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
270.向浓缩液v液中加入5g dna酶,使残留的dna片段等充分溶解,然后加入0.2mol/l十二烷基磺酸钠溶液2l,混合均匀30min后,加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.1-9.4,混合均匀30min后,溶液中的酶及其它蛋白质发生盐析。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pan150)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为150kda,压力为0.25mpa,切向流过滤的通量为20l/(h
·
m2),获得浓缩液iv。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
271.向浓缩液v中加入1mol/l的叔丁胺600ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为8.5-8.8,混合均匀48min后,溶液中的外源rna析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc_mpsf100)死端过滤,膜材质为mpsf,中空纤维超滤膜切割分子量为100kda,压力为0.1mpa,死端过滤的通量为35l/(h
·
m2),获得浓缩液vi。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
272.向浓缩液vi中加入1mol/l的丙三醇1000ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为10.2-10.5,混合均匀30min后,使溶液中的dsrna析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-mpes100)切向流过滤,膜材质为mpes,中空纤维超滤膜切割分子量为100kda,压力为
0.2mpa,切向流过滤的通量为35l/(h
·
m2),获得浓缩液vii。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
273.此时浓缩液vii中的主要物质即为mrna。为进一步纯化,采用以下操作。向浓缩液vii中加入2.6mol/l的硝酸铵2000ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.2-9.4,混合均匀30min后,使mrna盐析析出,采用梯度孔结构中空纤维超滤膜(直径1mm,内外径之比为2,型号uc-pes100)死端过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.04mpa,死端过滤的通量为40l/(h
·
m2),再次获得浓缩液;依据上述参数重复操作4次,最后一次浓缩液重新溶解后继续过滤,获得高纯度的目标mrna原液,进行lnp包封/装载。
274.lnp的组装和形成由疏水力和静电力驱动,先将四种脂质(解离性脂类、饱和磷脂脂类、胆固醇脂类、聚乙二醇脂类)溶于乙醇,2体积含脂质乙醇溶液通常与5体积mrna在ph=4的醋酸盐水缓冲液中混合,当脂质与水缓冲液接触时,它们在3:4的水/乙醇溶剂中变得不溶,并且可电离脂质变得质子化并且带正电荷,然后驱动它与带负电荷的mrna磷酸骨架静电结合,同时脂质变得不溶,形成脂质颗粒,将mrna包裹在水悬浮液中。水相和脂质相混合当混合相ph接近5.8时,电离脂质质子化,当混合相ph接近6.9,mrna被包封,随后通过稀释或透析至ph=7.8时,形成了不带电的lnp纳米脂质颗粒。
275.每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
276.测试mrna的纯度为98.8%。
277.步骤三:mrna包封/装载后纯化(换液浓缩)
278.完成包封的溶液直接采用梯度孔结构中空纤维超滤膜(直径0.5mm,内外径之比为1.2,型号uc-pes100)切向流过滤,膜材质为pes,中空纤维超滤膜切割分子量为100kda,压力为0.3mpa,切向流过滤的通量为50l/(h
·
m2),除去edta、氯化钠、乙醇和醋酸钠等分子尺寸较小的杂质,获得浓缩液viii。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
279.向浓缩液viii加入1.8mol/l的亚精胺1000ml,混合均匀,然后加入0.5mol/l,ph=7.8的盐酸缓冲液,调控溶液ph为9.5-9.7,混合均匀20min后,使未包封或未装载的mrna盐析析出。抽取上层清液,上清液采用梯度孔结构中空纤维超滤膜(直径0.8mm,内外径之比为2,型号uc-pan150)切向流过滤,膜材质为pan,中空纤维超滤膜切割分子量为150kda,压力为0.08mpa,切向流过滤的通量为40l/(h
·
m2),获得高度纯化的包封mrna疫苗。每批料液处理完毕采用0.2mol/l,ph=7.5的磷酸缓冲液与超纯水反冲洗超滤膜。
280.测试包封mrna的纯度为99.4%。
281.本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
282.对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对上述实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1