一种盐酸贝西沙星原位凝胶滴眼液及其制备方法与流程
1.本发明涉及贝西沙星滴眼液技术领域,尤其涉及一种盐酸贝西沙星原位凝胶滴眼液及其制备方法。
背景技术:
2.贝西沙星(besifloxacin)是第四代氟喹诺酮类抗生素,具有抗菌谱广、抗菌活性高、毒性低的特点,涉及的抗菌谱包括革兰氏阴性菌、革兰氏阳性菌、厌氧菌、军团菌、支原体和衣原体。
3.盐酸贝西沙星滴眼液(besivance)是由美国博士伦公司(bausch&lomb inc.)开发并于2009年5月28日被美国fda批准的一种用于局部治疗细菌性结膜炎的氟喹诺酮类药物。
4.目前博士伦研发上市的盐酸贝西沙星滴眼液为混悬型滴眼液,用药周期为1日3次,1次1滴,连续用药7天,该混悬型滴眼液使用前需要将滴眼液摇匀,用药繁琐,从而导致用药舒适度差且药物的生物利用度较低。
技术实现要素:
5.有鉴于此,本发明的目的在于提供一种盐酸贝西沙星原位凝胶滴眼液及其制备方法。本发明提供的盐酸贝西沙星原位凝胶滴眼液在眼部生理条件下形成凝胶,用药舒适度好且药物的生物利用度高。
6.为了实现上述发明目的,本发明提供以下技术方案:
7.本发明提供了一种盐酸贝西沙星原位凝胶滴眼液,每100ml盐酸贝西沙星原位凝胶滴眼液包含以下成分:
8.以贝西沙星计,盐酸贝西沙星0.6g,ph敏感型凝胶0.4g~2.0g,氯化钠0.5g~0.8g,增稠剂1.0g~2.0g,ph调节剂,注射用水;
9.所述ph敏感型凝胶包括卡波姆和/或聚卡波非。
10.优选地,所述增稠剂包括羟丙甲纤维素、羟丙基纤维素、甲基纤维素和聚维酮k30中的一种或多种。
11.优选地,所述ph调节剂包括氢氧化钠。
12.优选地,所述盐酸贝西沙星原位凝胶滴眼液的ph值为5~5.5。
13.本发明还提供了上述技术方案所述的盐酸贝西沙星原位凝胶滴眼液的制备方法,包括以下步骤:
14.将ph敏感型凝胶溶解,得到第一体系;
15.将盐酸贝西沙星、氯化钠、增稠剂和ph调节剂溶解和分散,得到第二体系;
16.将所述第一体系和第二体系混合后,补加注射用水至全量,得到所述盐酸贝西沙星原位凝胶滴眼液。
17.优选地,所述ph敏感型凝胶溶解的溶剂为注射用水。
18.优选地,所述ph敏感型凝胶溶解在搅拌的条件下进行,所述搅拌的转速为400~
600rpm,时间为50~60min。
19.优选地,所述盐酸贝西沙星、氯化钠、增稠剂和ph调节剂溶解和分散的溶剂为注射用水。
20.优选地,所述盐酸贝西沙星、氯化钠、增稠剂和ph调节剂溶解和分散包括:将氯化钠、增稠剂和ph调节剂溶解后,再加入盐酸贝西沙星分散。
21.优选地,所述氯化钠、增稠剂和ph调节剂溶解在搅拌的条件下进行,所述搅拌的转速为400~700rpm,时间为5~10min;
22.所述加入盐酸贝西沙星分散在搅拌的条件下进行,所述搅拌的转速为400~700rpm,时间为30~60min。
23.本发明提供了一种盐酸贝西沙星原位凝胶滴眼液,每100ml盐酸贝西沙星原位凝胶滴眼液包含以下成分:以贝西沙星计,盐酸贝西沙星0.6g,ph敏感型凝胶0.4g~2.0g,氯化钠0.5g~0.8g,增稠剂1.0g~2.0g,ph调节剂,注射用水;所述ph敏感型凝胶包括卡波姆和/或聚卡波非。
24.有益效果:
25.1、本发明的盐酸贝西沙星原位凝胶滴眼液在非生理条件下为溶液状态,易于给药,且用药舒适度高;且方便灌装,适合进行工业化大批量生产。
26.2、本发明的盐酸贝西沙星原位凝胶滴眼液在眼部生理条件下形成凝胶,能够更好地控制药物的释放,提高药物的生物利用度。
27.3、本发明的盐酸贝西沙星原位凝胶滴眼液能够克服滴眼液随泪液流失的问题,用药后能较长时间与眼睛紧密接触,有较好的生物粘附性,提高了生物利用度。
28.4、本发明的盐酸贝西沙星原位凝胶滴眼液具有缓释效果,减少了给药频率,提高了患者的顺应性。
29.本发明还提供了上述技术方案所述的盐酸贝西沙星原位凝胶滴眼液的制备方法,本发明提供的制备方法操作简单,易于工业化。
具体实施方式
30.本发明提供了一种盐酸贝西沙星原位凝胶滴眼液,每100ml盐酸贝西沙星原位凝胶滴眼液包含以下成分:
31.以贝西沙星计,盐酸贝西沙星0.6g,ph敏感型凝胶0.4g~2.0g,氯化钠0.5g~0.8g,增稠剂1.0g~2.0g,ph调节剂,注射用水;
32.所述ph敏感型凝胶包括卡波姆和/或聚卡波非。
33.在本发明中,如无特殊说明,本发明所用原料均优选为市售产品。
34.以贝西沙星计,本发明提供的100ml盐酸贝西沙星原位凝胶滴眼液中包括盐酸贝西沙星0.6g。
35.本发明提供的100ml盐酸贝西沙星原位凝胶滴眼液中包括ph敏感型凝胶0.4g~2.0g,优选为0.5g~1.0g。在本发明中,所述ph敏感型凝胶包括卡波姆和/或聚卡波非,优选为卡波姆。在本发明中,ph敏感型凝胶能够在泪液中发生相变,形成凝胶,将药物固定在眼部,提高了药物的生物利用度,并且达到缓释的目的。
36.本发明提供的100ml盐酸贝西沙星原位凝胶滴眼液中包括氯化钠0.5g~0.8g,优
选为0.6g~0.7g。
37.本发明提供的100ml盐酸贝西沙星原位凝胶滴眼液中包括增稠剂1.0g~2.0g,优选为1.5g;在本发明中,所述增稠剂优选包括羟丙甲纤维素、羟丙基纤维素、甲基纤维素和聚维酮k30中的一种或多种,进一步优选为羟丙甲纤维素。
38.本发明提供的100ml盐酸贝西沙星原位凝胶滴眼液中包括ph调节剂。在本发明中,所述ph调节剂优选包括氢氧化钠。本发明对所述氢氧化钠的含量不做具体限定,只要能够使盐酸贝西沙星原位凝胶滴眼液的ph值为5~5.5即可。
39.本发明提供的100ml盐酸贝西沙星原位凝胶滴眼液中包括注射用水。
40.在本发明中,所述盐酸贝西沙星原位凝胶滴眼液的ph值优选为5~5.5。
41.本发明还提供了上述技术方案所述的盐酸贝西沙星原位凝胶滴眼液的制备方法,包括以下步骤:
42.将ph敏感型凝胶溶解,得到第一体系;
43.将盐酸贝西沙星、氯化钠、增稠剂和ph调节剂溶解和分散,得到第二体系;
44.将所述第一体系和第二体系混合后,补加注射用水至全量,得到所述盐酸贝西沙星原位凝胶滴眼液。
45.本发明将ph敏感型凝胶溶解,得到第一体系。在本发明中,所述ph敏感型凝胶溶解的溶剂优选为注射用水。在本发明中,所述注射用水的温度优选为40~45℃。在本发明中,所述ph敏感型凝胶溶解优选在搅拌的条件下进行;所述搅拌的转速优选为400~600rpm,进一步优选为500rpm,时间优选为50~60min。
46.本发明将盐酸贝西沙星、氯化钠、增稠剂和ph调节剂溶解和分散,得到第二体系。在本发明中,所述盐酸贝西沙星、氯化钠、增稠剂和ph调节剂溶解和分散的溶剂为注射用水。在本发明中,所述注射用水的温度优选为40~45℃。在本发明中,所述盐酸贝西沙星、氯化钠、增稠剂和ph调节剂溶解和分散包括:将氯化钠、增稠剂和ph调节剂溶解后,再加入盐酸贝西沙星分散。在本发明中,所述氯化钠、增稠剂和ph调节剂溶解优选在搅拌的条件下进行,所述搅拌的转速优选为400~700rpm,进一步优选为500~600rpm;时间为5~10min。在本发明中,所述加入盐酸贝西沙星分散优选在搅拌的条件下进行,所述搅拌的转速优选为400~700rpm,进一步优选为500~600rpm;时间优选为30~60min。
47.得到第一体系和第二体系后,本发明将所述第一体系和第二体系混合后,补加注射用水至全量,得到所述盐酸贝西沙星原位凝胶滴眼液。在本发明中,所述第一体系和第二体系混合优选在搅拌的条件下进行,所述搅拌的转速优选为500rpm,时间优选为20min。
48.本发明提供的制备方法操作简单,易于工业化。
49.下面结合实施例对本发明提供的盐酸贝西沙星原位凝胶滴眼液及其制备方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
50.实施例1
51.1、取0.5g卡波姆,加入42℃注射用水30ml,以500rpm搅拌60min,得到第一体系待用。
52.2、取42℃注射用水50ml,加入0.7g氯化钠、1.5g羟丙甲纤维素和0.1g氢氧化钠,于500rpm搅拌5min至完全溶解,然后加入0.6g盐酸贝西沙星(以贝西沙星计),于500rpm搅拌30min至混匀,得到第二体系待用。
53.3、在500rpm下,将第二体系加入第一体系中,搅拌20min至混匀,得到第三体系待用。
54.4、将第三体系补加注射用水至100ml,搅拌均匀,得到ph值为5.0的盐酸贝西沙星原位凝胶滴眼液。
55.实施例2
56.1、取1.0g卡波姆,加入42℃注射用水30ml,以500rpm搅拌60min,得到第一体系待用。
57.2、取42℃注射用水50ml,加入0.6g氯化钠、1.5g羟丙甲纤维素和0.15g氢氧化钠,于500rpm搅拌5min至完全溶解,然后加入0.6g盐酸贝西沙星(以贝西沙星计),于500rpm搅拌30min至混匀,得到第二体系待用。
58.3、在500rpm下,将第二体系加入第一体系中,搅拌20min至混匀,得到第三体系待用。
59.4、将第三体系补加注射用水至100ml,搅拌均匀,得到ph值为5.0的盐酸贝西沙星原位凝胶滴眼液。
60.实施例3
61.1、取2.0g卡波姆,加入42℃注射用水30ml,以500rpm搅拌60min,得到第一体系待用。
62.2、取42℃注射用水50ml,加入0.5g氯化钠、1.0g羟丙甲纤维素和0.2g氢氧化钠,于500rpm搅拌5min至完全溶解,然后加入0.6g盐酸贝西沙星(以贝西沙星计),于500rpm搅拌30min至混匀,得到第二体系待用。
63.3、在500rpm下,将第二体系加入第一体系中,搅拌20min至混匀,得到第三体系待用。
64.4、将第三体系补加注射用水至100ml,搅拌均匀,得到ph值为5.0的盐酸贝西沙星原位凝胶滴眼液。
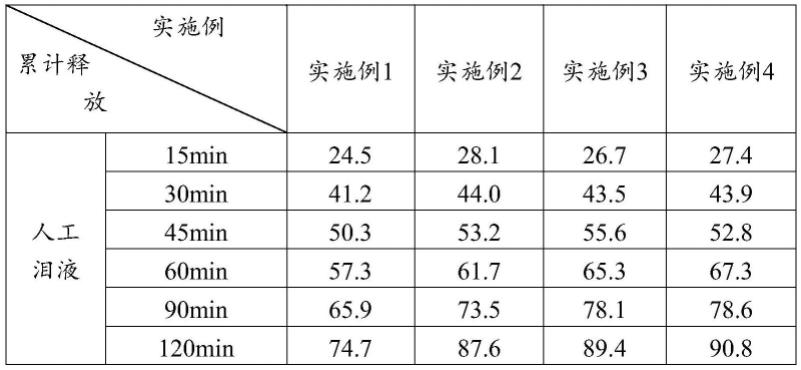
65.实施例4
66.1、取0.4g卡波姆,加入42℃注射用水30ml,以500rpm搅拌60min,得到第一体系待用。
67.2、取42℃注射用水50ml,加入0.7g氯化钠、2.0g羟丙甲纤维素和0.1g氢氧化钠,于500rpm搅拌5min至完全溶解,然后加入0.6g盐酸贝西沙星(以贝西沙星计),于500rpm搅拌30min至混匀,得到第二体系待用。
68.3、在500rpm下,将第二体系加入第一体系中,搅拌20min至混匀,得到第三体系待用。
69.4、将第三体系补加注射用水至100ml,搅拌均匀,得到ph值为5.0的盐酸贝西沙星原位凝胶滴眼液。
70.体外释放度实验
71.取实施例1~4得到的盐酸贝西沙星原位凝胶滴眼液进行体外释放度实验,方法:称取适量实施例1~4的盐酸贝西沙星原位凝胶滴眼液按照下列实验方法测定释放行为:溶出介质为:人工泪液(氯化钠0.67%,碳酸氢钠0.2%,二水氯化钙0.008%);介质体积为250ml,介质温度为37
±
0.5℃;装置为:改良小杯法,转速为150rpm。
72.体外释放度实验结果如表1所示。
73.表1体外释放度实验结果(%)
[0074][0075][0076]
从表1可知:本发明的盐酸贝西沙星原位凝胶滴眼液具有较好的缓释作用,且当卡波姆的百分比含量在0.4%~2.0%之间时,其缓释效果更为明显,可在人泪液中保持稳定的高浓度,有效提高药物的生物利用度,降低用药频率。
[0077]
表面张力测定实验
[0078]
通过上海衡平仪表厂bzy-i型全自动表面张力测定仪测定实施例1~4的盐酸贝西沙星原位凝胶滴眼液的表面张力,结果如表2所示。
[0079]
表2实施例1~4所得滴眼液的表面张力测定结果(mn/m)
[0080] 实施例1实施例2实施例3实施例4表面张力(mn/m)31.532.132.531.4
[0081]
从表2可知:盐酸贝西沙星原位凝胶滴眼液的表面张力为31.4~32.5mn/m,查阅文献可知,角膜黏液的临界表面张力为30~38mn/m,表明盐酸贝西沙星原位凝胶滴眼液具有很好的润湿性能,增强了角膜与凝胶之间的粘附性。
[0082]
黏度测定实验
[0083]
取实施例1~4所得盐酸贝西沙星原位凝胶滴眼液,在25
±
0.5℃条件下测定实施例1~4的盐酸贝西沙星原位凝胶滴眼液的黏度,测定条件为:2号转子,12r/min,结果如表3所示。
[0084]
表3实施例1~4所得滴眼液的黏度(mpa
·
s)
[0085] 实施例1实施例2实施例3实施例4黏度3.74.14.63.6
[0086]
从表3可以看出:盐酸贝西沙星滴眼液在非生理环境下为液体状态,黏度小,流动性较好。
[0087]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应
视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1