一种人参不定根总皂苷的制备方法与流程
1.本发明属于人参总皂苷制备技术领域,涉及一种人参不定根总皂苷的制备方法。
背景技术:
2.人参是名贵的中药材之一,具有大补元气,复脉固脱,补脾益肺,生津安神,益智等功效,在《神农本草经》中被列为上品,是常用的滋补强壮药。现代研究表明,人参中含有皂苷、多糖、黄酮、蛋白、氨基酸等多种有效成分,其中最主要的活性成分为人参皂苷,药理学研究表明人参皂苷具有抗氧化、抗衰老、降血糖、抗肿瘤等多种药理作用,并且能够作用于循环系统、免疫系统、心血管系统与内分泌系统等多个系统,进而如何高效与科学的提取人参皂苷成为现在广泛的研究课题。
3.人参分为地上和地下两部分,地上为茎、叶、人参花、果实。人参茎就是连接芦头和人参叶、人参籽的茎秆,一般参龄越高,人参茎就越长。人参的地下部分可以分为芦头、主体和不定根。人参不定根可以从人参种源诱导出、分化培养形成不定根,通过筛选获得工作种源,再经三级培养、清洗、干燥等步骤制得,可以不受土地、季节、环境的限制,而且生长迅速,周期短,这些是传统栽培所无法相比的,这将为植物药物生产开辟一条新途径。目前从人参不定根提取制备总皂苷的方法存在提取率低的问题。
4.申请号为202010867377.2的中国专利申请公开了一种人参茎叶总皂苷的提取工艺,包括以下步骤:步骤一:使用含水量0-20wt%的低碳醇溶液对人参茎叶原料进行脱残处理,得预处理人参茎叶原液;步骤二:对步骤一中的预处理人参茎叶原液里通入氮气,同时进行搅拌,得到含人参总皂苷的泡沫和残留液,将所述泡沫和所述残留液分离;步骤三:将步骤二中的泡沫溶解,获得人参总皂苷溶液,调节ph,将人参总皂苷溶液过大孔树脂柱,用乙醇或乙醇水溶液进行洗脱,收集洗脱液,蒸发,得人参总皂苷。该方案中通过脱残处理降低农药残留,需要使用氮气等,提取率有待提高。
5.申请号为200410011078.x的中国专利申请公开了一种人参皂苷超高压提取方法,首先将干燥人参粉碎过40目筛,再将干燥后的人参粉末按1g∶40ml的固液比加入三氯甲烷或乙醚溶剂,在索氏提取器中回流脱脂3h,过滤后将滤渣在常温下挥干,再将上述脱脂后的物料按1g∶10-100ml的固液比加入水或乙醇、甲醇、正丁醇有机溶剂,混合密封后在常温下浸泡0-24h,再将该混合物料置入高压容器中,在常温下施加100-6000mpa压力进行浸取,其保压时间为1-5min,卸压后过滤除去料渣,收集滤液,即获得含有人参皂苷的提取液。该方案采用超高压进行提取,但纯度不高。
6.因此,需要提供一种提取率高,纯度高,工艺相对简单的人参皂苷的制备方法。
7.有鉴于此特提出本发明。
技术实现要素:
8.本发明要解决的技术问题在于克服现有技术的不足,提供一种人参不定根总皂苷的制备方法。本发明的制备方法中,采用水作为提取溶剂,利用超高压均质设备进行细胞破
壁后再回流提取、大孔树脂吸附纯化、干燥,优化后的各种条件综合作用,得到含人参不定根总皂苷纯度大于60%的提取物,纯度高,提取率高。另外,本发明的方法简单易行,反应条件温和,使用耗材较少环境友好,对试剂设备要求低,适合大规模工业化生产。
9.为解决上述技术问题,本发明采用技术方案的基本构思是:
10.本发明的目的是提供一种人参不定根总皂苷的制备方法,包括以下步骤:
11.(1)破壁:取干燥的人参组培不定根进行粉碎,加入水浸泡,使用超高压均质设备进行细胞壁破碎;
12.(2)提取:将破壁后的料液回流提取,浓缩;
13.(3)纯化:浓缩液通过大孔吸附树脂吸附,依次采用水、除杂液冲洗大孔树脂,然后用洗脱液进行洗脱,收集含有总皂苷的洗脱液;
14.(4)干燥:将洗脱液蒸发浓缩,干燥,得到高纯度人参不定根总皂苷。
15.本发明中,先采用水对人参组培不定根进行浸泡,利用超高压均质设备进行细胞破壁后再回流提取、大孔树脂吸附纯化、干燥,优化后的各种条件综合作用,得到含人参不定根总皂苷纯度大于60%的提取物,纯度高,提取率高。
16.进一步的方案,步骤(1)中,加入水浸泡时,人参不定根与水的料水比为1:10-30,料水比的单位为g/ml,使干燥的人参组培不定根复水;
17.优选的,所述料水比为1:15-25;
18.优选的,浸泡时间为8-16h,更优的,浸泡时间为12h。
19.进一步的方案,步骤(1)中,使用超高压均质设备进行细胞破壁处理时,破壁压力为100-150mpa,流速为100-200ml/min,处理次数2-4次;
20.优选的,破壁压力130-140mpa,流速120-160ml/min,处理次数3-4次。
21.进一步的方案,步骤(2)中,将破壁后的料液,进行回流提取2-4次,每次提取后过滤收集滤液,滤渣加水进行后续提取,加水量与初次液体量相同,每次回流提取时间为1-3h,提取温度70-100℃;提取结束后合并提取液进行浓缩;
22.优选的,回流提取2-3次,每次1.5-2.5h,提取温度80-100℃;
23.优选的,浓缩后的提取液中含有的人参总皂苷的浓度为1-5mg/ml。
24.进一步的方案,步骤(3)中,所述大孔吸附树脂的型号选自hpd-100、hpd-400、dm-130、d101、x-5、ab-8中的一种;
25.优选的,所述的大孔吸附树脂的型号为:d101或ab-8。
26.进一步的方案,步骤(3)中,浓缩液上大孔吸附树脂时,上料浓度为2-6mg/ml,上料流速为2-5ml/min,上料体积为40-60ml;
27.优选的,上料浓度为3-5mg/ml,上料流速为3-4ml/min,上料体积为50-60ml。
28.进一步的方案,步骤(3)中,所述除杂液为体积百分数为30-50%的乙醇水溶液;所述的洗脱液为体积百分数为50-90%的乙醇水溶液;
29.优选的,所述除杂液为体积百分数为35-45%的乙醇水溶液;所述的洗脱液为体积百分数为60-80%的乙醇水溶液。
30.进一步的方案,步骤(3)中,采用洗脱液以1.0-3.0ml/min的流速进行洗脱;
31.优选的,以1.5-2.5ml/min的流速进行洗脱。
32.进一步的方案,步骤(4)中,将洗脱液进行旋转蒸发回收乙醇,得到浓缩液,然后在
50-100℃下干燥,得到含水量5%以下的高纯度人参组培不定根总皂苷;
33.优选的,干燥采用的设备选自热风循环烘箱、真空烘箱、电热鼓风干燥箱中的一种。
34.进一步的方案,得到的人参组培不定根总皂苷的纯度为30~80%;
35.优选的,得到的人参组培不定根总皂苷的纯度为65-80%。
36.需要说明的是,本发明中的人参不定根可以为自然生长的人参不定根,也可以为采用人工方法组织培养的人参不定根,并没有限定。作为一种具体的实施方式,人参不定根的培养可参照申请人在先申请的人参不定根培养方法的相关专利进行。例如参考申请号为2021100618659的专利申请中不定根的培养方案获得。
37.采用上述技术方案后,本发明与现有技术相比具有以下有益效果:
38.1、本发明的制备方法中,采用水作为提取溶剂,利用超高压均质设备进行细胞破壁后再回流提取、大孔树脂吸附纯化、干燥,优化后的各种条件综合作用,得到含人参不定根总皂苷纯度大于60%的提取物,纯度高,提取率高。
39.2、本发明的方法简单易行,反应条件温和,使用耗材较少环境友好,对试剂设备要求低,适合大规模工业化生产。
具体实施方式
40.以下用实施例对本发明的技术方案作进一步的说明,将有助于对本发明的技术方案的优点、效果有更进一步的了解。以下实施例用于说明本发明,但不用来限制本发明的范围。
41.本发明中采用的超高压均质设备为宁波新芝生物科技股份有限公司生产的scientz-207a。
42.实施例1
43.s110、破壁处理:
44.s111、取干燥的人参不定根160g,对其进行粉碎,细粉通过80目标准筛,按照料水比(g/ml)1:30加入纯化水浸泡,浸泡12h,使其复水。
45.s112、将s111中处理的物料,使用超高压均质设备对其进行细胞破壁处理,破壁压力110mpa,流速120ml/min,处理次数2次,收料量为4800ml。
46.s120、提取处理;
47.s121、将s112处理后的料液,回流提取4次,每次1.5h,每次提取后过滤收集滤液,滤渣加水进行后续提取,加水量与初次液体量相同,提取温度80℃,提取结束合并提取液进行浓缩,收料量为1200ml,浓缩后的提取液为每1ml中含有3mg人参总皂苷;
48.s130、纯化处理;
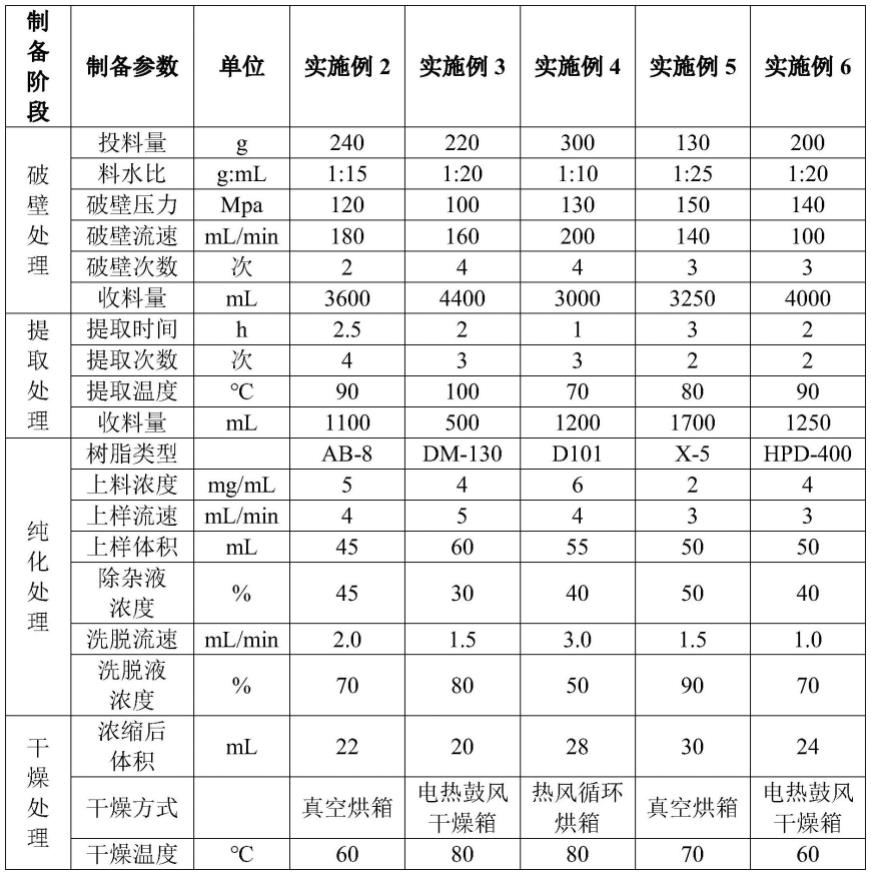
49.s131、将s121得到的产品通过大孔吸附树脂吸附,大孔树脂型号为:hpd-100;上料浓度为3mg/ml,上料流速为2ml/min,上料体积为40ml。
50.s132、待纯化物料装载完成后,分别用80ml的纯化水及80ml的35%乙醇水溶液(除杂液)冲洗大孔树脂,除去人参不定根提取物中的非皂苷成分,用60%乙醇水溶液(洗脱液)以2.5ml/min的流速进行洗脱,收集含有人参不定根总皂苷的洗脱液;
51.s140、干燥处理:
52.s141、将s132中含有人参不定根总皂苷的洗脱液使用旋转蒸发回收乙醇后,得到含有人参不定根总皂苷的浓缩液;浓缩液的体积为15ml;
53.s142、将s141中含有人参不定根总皂苷的浓缩液回收溶剂后,在热风循环烘箱中进行干燥,干燥温度为50℃,得到含水量5%以下高纯度人参不定根总皂苷。
54.实施例2-6
55.实施例2-6各提供一种人参不定根总皂苷的制备方法,步骤与实施例1相同,各实施例的参数如表1所示。
56.表1:实施例2-6的参数
[0057][0058]
检测实施例1-6制备的人参不定根总皂苷的含量,结果如下表2所示。
[0059]
表2制备的人参不定根总皂苷的收料量及含量
[0060]
[0061]
试验例1:破壁工艺优化
[0062]
(一)实验方法
[0063]
本试验对破壁工艺进行优化,各试验组参数如表3所示。
[0064]
表3:试验组1-6破壁处理参数
[0065][0066]
破壁处理后的物料依据《中国药典》2020年版“人参总皂苷”项下的人参总皂苷含量测定方法进行测定。
[0067]
1、对照品溶液的制备
[0068]
人参皂苷re对照品溶液:取人参皂苷re对照品适量,精密称定,加甲醇配制成每1ml含1.0mg re的溶液,即得。
[0069]
2、供试品溶液的制备
[0070]
将各试验组物料进行过滤,得到破壁后含有人参皂苷的料液,取20ml料液对其进行减压浓缩,回收溶剂,将浓缩液进行干燥,得到粗皂苷产物并对其重量进行称量。
[0071]
取20ml破壁后的料液,通过d101型大孔吸附树脂柱,水洗脱至无色,再用60%乙醇洗脱,洗脱至洗脱液无色,收集60%乙醇洗脱液,回收溶剂至近干,蒸干,残渣加甲醇溶解并转移至10ml容量瓶中,加甲醇稀释至刻度,摇匀。用0.45μm针式过滤器滤过,进行检测。
[0072]
3、标准曲线的制备
[0073]
精密吸取人参皂苷re对照品溶液40μl、60μl、80μl、100μl、120μl、140μl、160μl,分别置具塞试管中,加蒸馏水补足体积至200μl,精密加入1%香草醛高氯酸试液0.5ml,置60℃恒温水浴中充分混匀后加热15min,立即用冰水浴冷却2min,加入77%硫酸溶液5.0ml,摇匀;以相应试剂作空白,照紫外-可见分光光度法(《中国药典》2020版,第四部通则0401),在540nm波长处测定吸光度,吸光度结果见表3.1。以吸光度(a)为纵坐标、人参皂苷re质量(m)为横坐标,绘制标准曲线。
[0074]
4、样品含量测定
[0075]
精密量取供试品溶液50μl,照标准曲线制备项下的方法,自“置于具塞试管中”起依法操作,测定吸光度,从标准曲线上读出供试品溶液中人参皂苷re的量,计算结果乘以0.84,即为样品中人参总皂苷的含量。
[0076]
(二)实验结果
[0077]
各试验组粗皂苷产物重量及总皂苷含量结果如表4所示:
[0078]
表4:试验组1-6破壁处理结果
[0079]
[0080]
由上表中的试验数据可知,试验组1和试验组6在粗皂苷产物和总皂苷含量两个指标上,效果均不理想,经济性不佳。分析原因,实验组1可能是由于破壁压力较小、破壁次数较少,导致物料破壁不充分,破壁效果不佳;实验组6可能是由于破壁压力较大、破壁次数较多,导致物料中的功能成分发生损失,破壁效果不佳;因此本发明确定的破壁工艺参数为料水比(g:ml)1:10-1:30、破壁压力100-150mpa、流速100-200ml/min,处理次数2-4次;优选的,料水比(g:ml)1:15-1:25、破壁压力130-140mpa,流速120-160ml/min,处理次数3-4次。
[0081]
试验例2:提取工艺优化
[0082]
(一)实验方法
[0083]
本试验对提取工艺进行优化,先按照10g投料量,料液比(g:ml)1:25,破壁压力140mpa,破壁流速160ml/min,破壁次数4次,破壁处理后的物料进行提取处理,提取处理的各试验组参数如表5所示。
[0084]
表5:试验组7-12提取处理参数
[0085][0086][0087]
提取处理后的物料依据《中国药典》2020年版“人参总皂苷”项下的人参总皂苷含量测定方法进行测定。
[0088]
1、对照品溶液的制备
[0089]
人参皂苷re对照品溶液:取人参皂苷re对照品适量,精密称定,加甲醇配制成每1ml含1.0mg人参皂苷re的溶液,即得。
[0090]
2、供试品溶液的制备
[0091]
将各试验组物料进行过滤,得到提取后含有人参皂苷的料液,取100ml料液对其进行减压浓缩,回收溶剂,将浓缩液进行干燥,得到粗皂苷产物并对其重量进行称量。
[0092]
取100ml提取后的料液,通过d101型大孔吸附树脂柱,水洗脱至无色,再用60%乙醇洗脱,洗脱至洗脱液无色,收集60%乙醇洗脱液,回收溶剂至近干,蒸干,残渣加甲醇溶解并转移至10ml容量瓶中,加甲醇稀释至刻度,摇匀。用0.45μm针式过滤器滤过,进行检测。
[0093]
3、标准曲线的制备
[0094]
精密吸取人参皂苷re对照品溶液40μl、60μl、80μl、100μl、120μl、140μl、160μl,分别置具塞试管中,加蒸馏水补足体积至200μl,精密加入1%香草醛高氯酸试液0.5ml,置60℃恒温水浴中充分混匀后加热15min,立即用冰水浴冷却2min,加入77%硫酸溶液5.0ml,摇匀;以相应试剂作空白,照紫外-可见分光光度法(《中国药典》2020版,第四部通则0401),在540nm波长处测定吸光度,吸光度结果见表3.1。以吸光度(a)为纵坐标、人参皂苷re质量(m)为横坐标,绘制标准曲线。
[0095]
4、样品含量测定
[0096]
精密量取供试品溶液50μl,照标准曲线制备项下的方法,自“置于具塞试管中”起依法操作,测定吸光度,从标准曲线上读出供试品溶液中人参皂苷re的量,计算结果乘以
0.84,即为样品中人参总皂苷的含量。
[0097]
(二)实验结果
[0098]
各试验组粗皂苷产物重量及总皂苷含量结果如表6所示:
[0099]
表6:试验组7-12提取处理结果
[0100][0101]
由上表中的试验数据可知,试验组7和试验组12在粗皂苷产物和总皂苷含量两个指标上,效果均不理想,经济性不佳。分析原因,实验组7可能是由于提取时间较短、提取次数较少、提取温度较低,导致物料中功能成分提取不充分,提取效果不佳;实验组12可能是由于提取时间较长、提取次数较多、高温处理总时间较长,导致物料中的热敏性功能成分发生损失,破壁效果不佳;因此本发明确定的提取工艺参数为破壁处理后的料液,回流提取2-4次,每次1-3h,每次提取的料水比与初次提取的料水比相同,提取温度70-100℃,优选的,回流提取2-3次,每次1.5-2.5h,每次提取的料水比与初次提取的料水比相同,提取温度80-100℃。
[0102]
试验例3:纯化工艺优化
[0103]
(一)大孔吸附树脂型号验证
[0104]
1、大孔树脂预处理
[0105]
将上述选用的6种大孔吸附树脂分别置于无水乙醇中密封浸泡,在水浴恒温振荡器(45℃、110r/min条件下)中放置24h后,用无水乙醇冲洗,直到冲洗液为清澈、无白色浑浊的液体,然后用蒸馏水清洗至无醇味。滤出树脂,并吸干多余水分,备用。
[0106]
2、不同大孔树脂吸附试验
[0107]
分别称取6种预处理后的大孔吸附树脂各2.0g于具塞锥形瓶中,分别加入3.0mg/ml人参不定根总皂苷粗提液20ml,在45℃、110r/min条件下的震荡摇床中避光振荡24h后,取上清液测定其总皂苷浓度,并按以下公式分别计算吸附率和吸附量。
[0108]
树脂吸附量:q(mg/g)=(c
0-c1)v/m
[0109]
树脂吸附率:e(%)=[(c
0-c1)/c0]
×
100%
[0110]
式中:q为树脂吸附量(mg/g);
[0111]
e为树脂吸附率(%);
[0112]
c0为吸附前样品总皂苷浓度(mg/ml);
[0113]
c1为吸附平衡时上清液总皂苷浓度(mg/ml);
[0114]
v为提取液体积(ml);
[0115]
m为树脂质量(g)。
[0116]
3、不同大孔树脂解吸试验
[0117]
过滤吸附完全的6种大孔树脂,用蒸馏水冲洗,滤出树脂并吸干多余水分,于具塞锥形瓶中,加入洗脱液70%乙醇溶液30ml,在45℃、110r/min条件下的震荡摇床中避光振荡24h后,取上清液测定其总皂苷浓度,并按以下公式计算解吸率:
[0118]
树脂解吸率d(%)=[c2*v2/c0*v0]
×
100%
[0119]
式中:d为树脂解吸率(%)
[0120]
c0为吸附前样液中总皂苷浓度(mg/ml);
[0121]
c2为洗脱液中总皂苷浓度(mg/ml)。
[0122]v0
为吸附前样品液体积(ml)
[0123]v2
为洗脱液体积(ml)
[0124]
以大孔树脂对人参不定根总皂苷的吸附率和解吸率为考察指标,综合筛选出适宜的大孔树脂。
[0125]
4、试验结果
[0126]
以大孔吸附树脂的吸附率和解吸率为考察指标,对6种大孔吸附树脂类型进行筛选,结果如表7所示。
[0127]
表7 不同型号大孔树脂吸附及解析效果对比
[0128]
树脂类型吸附量(mg/g)吸附率(%)解吸率(%)hpd-10065.9454.9582.22hpd-40094.9979.1683.49dm-13090.5375.4479.98d-10197.9681.6385.53x-583.3469.4575.41ab-896.4680.3889.13
[0129]
由上表可知,d-101型吸附树脂的吸附率最高,达到81.63%,ab-8型吸附树脂的解吸率最高,达到89.13%,这说明在相同条件下,不同类型的大孔吸附树脂吸附程度不同,对人参不定根总皂苷的吸附具有选择性。吸附率越高,表明该树脂吸附程度越好,越适宜选作吸附剂。选择有利于人参总皂苷分离纯化的大孔树脂,不仅需要其对皂苷有较强的吸附性能,还要考虑对皂苷的解吸能力,因此,当大孔树脂对总皂苷的吸附和解吸性能均较强时,才是分离纯化人参总皂苷的最佳选择。由筛选结果可知,d-101型和ab-8型树脂有着较高的吸附和解吸性能,因此本发明确定更优的大孔树脂型号为d-101型和ab-8型大孔吸附树脂。
[0130]
(二)上料浓度对大孔吸附树脂吸附效果的影响
[0131]
1、试验方法
[0132]
准确称取预处理的d-101型大孔树脂各15g,湿法装柱,加入浓度分别为1、2、3、4、5、6、7mg/ml的人参不定根总皂苷粗提液,控制上样流速为3ml/min,上料体积为50ml,收集过柱后的样液,测定样液流出前后吸光度值,根据吸附量及吸附率公式计算不同上样质量浓度下d-101型大孔吸附树脂对人参不定根总皂苷的吸附量及吸附率,确定最佳上样液质量浓度。
[0133]
2、试验结果
[0134]
上料浓度对大孔吸附树脂吸附效果的影响如表8所示
[0135]
表8上料浓度对大孔吸附树脂吸附效果的影响
[0136]
[0137]
如上表所示,当上料总皂苷质量浓度从1mg/ml增长到4mg/ml时,d-101树脂的吸附量逐渐增大,吸附率逐渐降低,但降低不明显,此阶段树脂吸附能力未得到充分应用。上料浓度超过4mg/ml后,随着上料浓度的提高,吸附量及吸附率均出现下降,分析原因可能是由于树脂吸附达到饱和,会导致大量的皂苷类化合物流失浪费。因此本发明确定的上料浓度为2-6mg/ml,更优的上料浓度为3-5mg/ml。
[0138]
(三)上料流速对大孔吸附树脂吸附效果的影响
[0139]
1、试验方法
[0140]
准确称取预处理的d-101型大孔树脂各15g,湿法装柱,加入浓度为4mg/ml的人参不定根总皂苷粗提液,控制上样流速分别为1、2、3、4、5、6ml/min,上料体积为50ml,收集过柱后的样液,测定样液流出前后吸光度值,根据吸附率公式计算不同上料流速下d-101型大孔吸附树脂对人参不定根总皂苷的吸附率,确定最佳上样流速。
[0141]
2、试验结果
[0142]
上料流速对大孔吸附树脂吸附效果的影响如表9所示
[0143]
表9上料浓度对大孔吸附树脂吸附效果的影响
[0144][0145]
如上表所示,树脂的吸附率随着流速的增加而降低,分析原因可能是由于流速过大,样液中皂苷类化合物无法与树脂充分接触,还未被吸附,便流出树脂柱。流速较低时,总皂苷吸附率较高,但是工作时间长、效率低。因此本发明确定的上料流速为2-5ml/min,更优的上料流速为3-4ml/min。
[0146]
(四)上料体积对大孔吸附树脂吸附效果的影响
[0147]
1、试验方法
[0148]
准确称取预处理的d-101型大孔树脂15g,湿法装柱,加入浓度为4.0mg/ml的人参不定根总皂苷粗提液,控制上样流速为3ml/min,收集过柱后的样液,每10ml为一管,收集过柱后的样液,测定样液流出前后吸光度值,根据吸附率公式计算不同上料流速下d-101型大孔吸附树脂对人参不定根总皂苷的吸附率,当吸收率低于70%时停止进样。确定最大上样体积。
[0149]
2、试验结果
[0150]
上料体积对大孔吸附树脂吸附效果的影响如表10所示
[0151]
表10上料浓度对大孔吸附树脂吸附效果的影响
[0152][0153]
如上表所示,树脂的吸附率随着上料体积的增加而降低,分析原因可能是由于树脂对人参不定根总皂苷的吸附逐渐趋于饱和。因此本发明确定的上料体积为40-60ml,更优的上料体积为50-60ml。
[0154]
(五)除杂液乙醇浓度对洗脱效果的影响
[0155]
1、试验方法
[0156]
准确称取预处理的d-101型大孔树脂各15g,湿法装柱,加入浓度为4mg/ml的人参不定根总皂苷粗提液,控制上样流速为3ml/min,上样体积50ml。然后用80ml的纯化水冲洗吸附饱和后的大孔树脂柱,再用20%、30%、35%、45%、50%、60%的乙醇水溶液(除杂液)80ml进行洗脱,收集过柱后的样液,测定样液流出前后吸光度值,根据解吸率公式计算不同除杂乙醇溶液浓度下d-101型大孔吸附树脂对人参不定根总皂苷的解吸率,确定除杂乙醇溶液最佳浓度。
[0157]
2、试验结果
[0158]
除杂液乙醇浓度对洗脱效果的影响如表11所示
[0159]
表11除杂液乙醇浓度对洗脱效果的影响
[0160][0161]
此步骤的目的是为了去除吸附在色谱柱上的非总皂苷类成分。如上表所示,随除杂乙醇浓度的升高,树脂的解吸率随之升高,即皂苷类成分在除杂过程被洗脱,造成损失。因此本发明确定除杂乙醇溶液浓度为30-50%,更优的除杂乙醇溶液浓度为35-45%。
[0162]
(六)洗脱流速对洗脱效果的影响
[0163]
1、试验方法
[0164]
准确称取预处理的d-101型大孔树脂各15g,湿法装柱,加入浓度为4mg/ml的人参不定根总皂苷粗提液,控制上样流速为3ml/min,上样体积50ml。然后用80ml的纯化水冲洗吸附饱和后的大孔树脂柱,再用40%的乙醇水溶液80ml进行洗脱,以上溶液均不收集,再用70%乙醇溶液(洗脱液)分别以0.5、1.0、1.5、2.0、2.5、3.0、3.5ml/min流速进行洗脱,收集过柱后的样液,测定样液吸光度值,根据解吸率公式计算不同洗脱流速下d-101型大孔吸附树脂对人参不定根总皂苷的解吸率,确定最佳洗脱流速。
[0165]
2、试验结果
[0166]
洗脱流速对洗脱效果的影响如表12所示
[0167]
表12洗脱流速对洗脱效果的影响
[0168][0169]
如上表所示,当洗脱液流速增大时,总皂苷的解吸率逐渐降低。流速为0.5-2.5ml/min时,解吸率缓慢下降,但是解吸率仍保持在85%以上。当流速为2.5-3.5ml/min时,解吸率显著降低;当上样液流速为3.0ml/min时,解吸率仍能保持在80%以上。因为洗脱液流速过大时,洗脱剂无法与树脂上的皂苷类化合物充分作用,导致皂苷类化合物从大孔树脂的吸附位点置换效率变低。流速较低时,总皂苷解吸率较高,但是工作时间长、效率低。因此本发明确定洗脱流速为1.0-3.0ml/min,更优的洗脱流速为1.5-2.5ml/min。
[0170]
(七)洗脱液乙醇浓度对洗脱效果的影响
[0171]
1、试验方法
[0172]
准确称取预处理的d-101型大孔树脂各15g,湿法装柱,加入浓度为4mg/ml的人参不定根总皂苷粗提液,控制上样流速为3ml/min,上样体积50ml。然后用80ml的纯化水冲洗
吸附饱和后的大孔树脂柱,再用40%的乙醇水溶液80ml进行洗脱,以上溶液均不收集,再用40%、50%、60%、70%、80%、90%、100%乙醇溶液(洗脱液)以2.0ml/min流速进行洗脱,收集过柱后的样液,测定样液吸光度值,根据解吸率公式计算不同洗脱流速下d-101型大孔吸附树脂对人参不定根总皂苷的解吸率,确定最佳洗脱乙醇溶液浓度。
[0173]
2、试验结果
[0174]
洗脱液乙醇浓度对洗脱效果的影响如表13所示
[0175]
表13洗脱液乙醇浓度对洗脱效果的影响
[0176][0177]
人参不定根总皂苷经大孔吸附树脂吸附后,采用洗脱剂将皂苷类化合物从树脂上冲洗下来,可达到分离纯化的目的。皂苷类化合物一般应用在食品及医药保健行业中,考虑到安全问题。本实验选用乙醇作解吸剂,考察乙醇浓度对总皂苷解吸率的影响,结果如上表所示。
[0178]
当乙醇溶液浓度为40%时,总皂苷解吸率为67.28%。随着乙醇溶液浓度的增大,解吸率显著增大。因为皂苷类化合物能与大孔树脂产生氢键作用而吸附在大孔树脂上,所以皂苷类化合物不易被水洗脱下来。乙醇溶液浓度较低时,只有少量皂苷类化合物可以洗脱下来。随着乙醇溶液浓度增大,总皂苷解吸率显著升高。当乙醇浓度70%时,总皂苷洗脱效果最好,解吸率为90.62%。乙醇溶液浓度超过70%时,总皂苷解吸率出现下降,乙醇浓度为100%时,解吸率降为79.57%。可能是由于过高浓度的乙醇溶液将部分与色谱柱结合紧密的其他物质解吸出来导致的。因此本发明确定洗脱乙醇溶液浓度为50%-90%,更优的洗脱乙醇溶液浓度为60%-80%。
[0179]
试验例4
[0180]
本试验例对人参不定根粉末及人工种植人参粉中不同单体人参皂苷的含量参照《ny/t 1842人参皂苷的测定》中的方法略有修改后进行测定。
[0181]
1分析步骤
[0182]
1.1样品提取
[0183]
准确称取人参不定根的粉碎后的粉末及人工种植人参粉各2g(精确至0.001g),每个样品称取3份作为平行样,加人100ml乙醚于索氏提取器中,提取1h,弃去乙醚,待残渣中乙醚挥干后,再加入甲醇回馏8h。
[0184]
1.2样品净化
[0185]
1.2.1spe c
18
柱的预处理
[0186]
先用20ml去离子水淋洗spe c
18
柱,然后用20ml的甲醇进行活化,再用20ml去离子水平衡。待水与柱筛板近平时上样。
[0187]
1.2.2提取液的处理
[0188]
提取液在60℃水浴条件下,经旋转蒸发仪减压浓缩至近干,氮气吹干,加人4ml去离子水充分揺匀。取2ml注入预先活化好的spe c
18
柱中,待液面与柱筛板近平时,倒人10ml去离子水淋洗spe c
18
柱,弃去流出液,待淋洗液液面与柱筛板近平时,加人25ml70%的乙醇溶液洗脱spe c
18
柱,收集洗脱液于50ml刻度试管中,氮气吹至25ml以下,用甲醇定容至
25ml,混匀后,用0.2um滤膜过滤,待测。
[0189]
1.3测定
[0190]
1.3.1仪器参考条件
[0191]
1.3.1.1色谱柱:c
18
(4.6mm x 300mm x 0.5μm)或相当者。
[0192]
1.3.1.2流动相:乙腈(a)十0.05%磷酸水溶液(b)。
[0193]
1.3.1.3柱温:30℃。
[0194]
1.3.1.4流速:1.3ml/min。
[0195]
1.3.1.5检测波长:202nm。
[0196]
1.3.1.6进样量:10μl。
[0197]
1.3.1.7梯度洗脱程序见表14。
[0198]
表14梯度洗脱程序
[0199][0200][0201]
1.3.2标准曲线的绘制
[0202]
逐一称取0.2g的人参皂苷rg1、rg3、re、rb1、rb2、rc(精确至0.001g、含量98%)标准品,置于100ml容量瓶中,用甲醇定容,配制成质量浓度为2.0g/l的混合标准溶液,储存在-18℃以下冰箱中,有效期6个月。用上述混合皂苷标准工作液按着梯度洗脱程序进行分析。准确吸取0ml、2ml、4ml、6ml、8ml、10ml混合皂苷标准溶液,分别置于10ml容量瓶中,用甲醇稀释至刻度,准确吸取10μl各容量瓶中的标准溶液,分别注人液相色谱仪,记录峰面积。以各皂苷进样的质量浓度对其峰面积绘制标准曲线。
[0203]
1.3.3样品测定
[0204]
准确吸取10μl供试样品溶液注入液相色谱仪,以保留时间定性,以待测液峰面积与标准溶液峰面积比较定量。
[0205]
1.3.4空白实验
[0206]
除不称取试样外,采用与试样完全相同的测定步骤进行平行操作。
[0207]
2结果计算
[0208]
试样中人参皂苷的含量用质量分数ω表示,单位为毫克/克(mg/g),按公式(1)计算:
[0209][0210]
式中:m1——试样中某种人参皂苷的质量,单位为毫克(mg);
[0211]
m2——试样的质量,单位为克(g);
[0212]v1
——试样的进样体积,单位为毫升(ml);
[0213]v2
——试样的定容体积,单位为毫升(ml)。
[0214]
3精密度
[0215]
每种人参皂苷在重复性条件下获得的两次独立测试结果的绝对差值不大于这两个测定值算术平均值的5%。
[0216]
4试验结果
[0217]
相关检测结果如下表中所示。
[0218]
表15人参皂苷含量检测结果
[0219][0220]
通过上述表中数据可知,人参不定根冻干粉的各人参皂苷单体含量均优于人工种植人参粉中对应含量指标,其中人参不定根冻干粉中的稀有皂苷——人参皂苷rg3含量远高于人工种植人参粉,且差异极其明显。
[0221]
以上所述仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本发明的技术人员在不脱离本发明技术方案范围内,当可利用上述提示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1