一种诊疗一体化靶向超声爆破纳米泡及其制备方法和应用
本发明涉及生物医学纳米材料,特别是涉及一种诊疗一体化靶向超声爆破纳米泡及其制备方法和应用。
背景技术:
1、甲状腺癌是由于颈部甲状腺组织的改变和过度生长引起的,是最常见的内分泌恶性肿瘤。甲状腺癌可根据肿瘤中发现的细胞种类,分为以下四种类型:甲状腺乳头状癌、甲状腺滤泡性癌、甲状腺髓样癌以及未分化型甲状腺癌。绝大多数的甲状腺癌是乳头状和滤泡状甲状腺癌,由滤泡上皮细胞的分化形成。虽然大多数甲状腺癌的5年预后较好,但仍有部分患者确诊时已经局部晚期或有远处转移,且对碘放射治疗不敏感,这部分患者生存期短,临床上缺乏有效的治疗方法。因此,早期确诊对提高患者生存率和生存质量尤期重要。
2、目前,临床上可通过影像学检查(例如甲状腺超声检查和穿刺活检)初步判断甲状腺病变的情况,但对于小于10mm的甲状腺癌,诊断准确度一直很低。甲状腺癌的治疗方法有手术切除、放射性碘(131i)治疗、促甲状腺素(tsh)抑制治疗、化疗/放疗等,但生存率在过去的几十年没有得到明显改善。因此,开发新的治疗策略,显得尤为迫切。
3、化疗作为临床最常使用的治疗手段,但由于化学药物存在许多生理阻碍(非特异性分布、血液流动受限、内皮外渗、肿瘤细胞膜和组织传递障碍、多药耐药),抗肿瘤化学药物的疗效往往受到影响。为克服此类用药阻碍,纳米药物载体应运而生。与传统化疗药物相比,纳米药物载体具有可调节药物释放速度、增加药物的生物膜的渗透性和提高药物在病灶位置的保留率(epr)、提高药物的靶向性、降低药物的毒副作用等优势。
4、然而,单一化学疗法极易在体内产生多药耐药性(mdr)。mdr通过减少药物在细胞内的积累,增加了dna损伤的,大大影响了治疗的效果。因此,人们一直在探索更为理想的治疗模式,两种或两种以上具有不同作用机制的治疗策略的组合正逐渐成为一种有前景的治疗模式,多种治疗方式协同治疗已被证实能增强治疗效果
5、近年来随着纳米医学的发展以及精准医疗理念的推广,人们对疾病的诊断和治疗提出了更高的诉求。纳米载体不仅可以实现靶向药物在肿瘤环境的响应性释放,还可以将造影剂与纳米载体紧密结合,从而达到诊疗一体化的治疗目的。靶向载体因更高的用药效率被广泛关注,纳米药物载体在特定的靶向配体的作用下,可主动富集在肿瘤血管附近,药物更直接的作用在肿瘤部位。
6、转铁蛋白受体(tfr)在多种癌细胞表面过度表达,这些癌细胞包括胶质瘤,乳腺癌,肺癌,前列腺癌和甲状腺癌等。通过噬菌体展示系统筛选的七肽(haiyprh,t7)对tfr具有很强的结合亲和力,表明t7有望提高药物载体的递送效率,减少靶向药物递送系统中的脱靶效应。
7、若能针对甲状腺癌症的生物学特点,研究出肿瘤靶向性强、药物吸收率高、副作用小、舒适且有效的综合治疗方案,可极大的改善甲状腺癌患者的预后状况,提升患者幸福感和生活质量。
技术实现思路
1、针对上述问题,本发明提供一种向超声爆破纳米泡,其对甲状腺癌细胞靶向性强、药物吸收率高、副作用小。
2、本发明第一方面提供了一种诊疗一体化靶向超声爆破纳米泡,所述纳米泡为靶向药物-基因纳米泡mirna/fty720/pfp@pei-t7 nbs,其以dmg-peg2000/dspe-peg2000脂质体为壳,包载有fty720/pfp,且表面偶联有t7短肽,并吸附有基因mirna-34b-5p,其原料包括1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚-乙二醇(dmg-peg2000)、1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-聚乙二醇-马来酰亚胺(dspe-peg2000-mal)、聚乙烯亚胺(pei)、芬戈莫德(fty720)、全氟戊烷(pfp)、基因mirna-34b-5p、修饰巯基的t7短肽。
3、本发明中的纳米泡中,dmg-peg2000/dspe-peg2000脂质体在包载pfp后,整体载体的粒径控制在纳米尺度,具有epr效应,且其表面偶联t7短肽,可大大提高所制备的纳米泡对甲状腺癌细胞表面tfr的结合亲和力,提高了纳米泡的递送功能并减少脱靶效应,以此提高早期甲状腺癌的诊断精度。而且该纳米泡可利用utmd(超声定向微泡破裂)技术,精准在肿瘤部位爆破,释放治疗药物或/和基因,通过提高局部药物浓度,高效抑制癌细胞的增殖与转移。
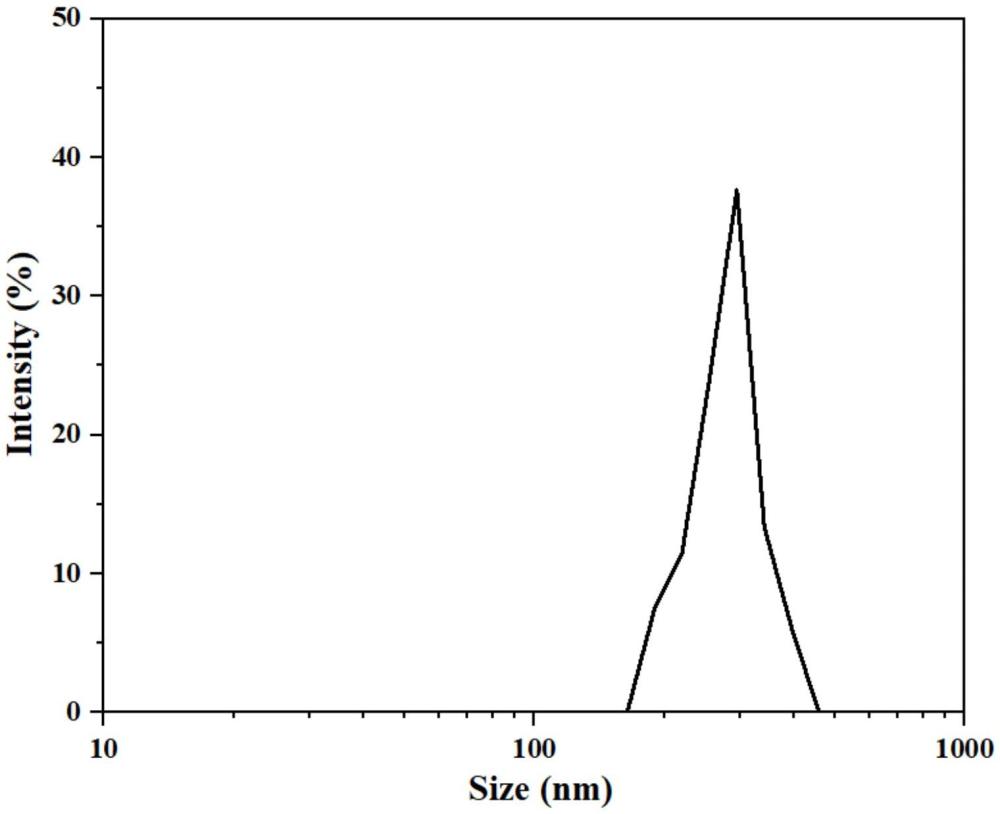
4、优选地,所述纳米泡的粒径为200-300nm。
5、本发明第二方面,还提供了上述的诊疗一体化靶向超声爆破纳米泡的制备方法,包括步骤:
6、s1以dmg-peg2000、dspe-peg2000-mal、pei和fty720、pfp为原料,采用薄膜水化法合成阳离子载药纳米泡fty720/pfp@pei nbs;
7、s2取fty720/pfp@pei nbs溶液,在室温条件下加入修饰了巯基的t7短肽,搅拌反应,透析得到靶向阳离子药物纳米泡fty720/pfp@pei-t7 nbs;
8、由于合成的阳离子载药纳米泡fty720/pfp@pei nbs表面具有马来酰亚胺基团,因此可利用迈克尔加成反应,与修饰了巯基的t7短肽反应得到靶向的阳离子药物纳米泡;
9、s3在步骤(2)得到的fty720@pfp@pei-t7 nbs溶液中加入mirna-34b-5p基因溶液,孵育得到所述的靶向超声爆破纳米泡mirna/fty720@pfp@pei-t7 nbs;
10、该步骤中利用静电吸附方法得到基因复合体,得到的产物可利用utmd技术定位爆破,精准在肿瘤部位爆破释放治疗药物与基因,实现精准化医疗。
11、进一步地,所述步骤s1包括::
12、s11将dmg-peg2000、dspe-peg2000-mal、pei和fty720用有机溶剂溶解,真空旋转蒸发;通过真空旋转蒸发可对试剂进行提纯;优选地,各原料的质量比为:dmg-peg2000:dspe-peg2000-mal:pei:fty720=30:15:5:10;有机溶剂为四氢呋喃、三氯甲烷、二氯甲烷、苯、甲苯、丙酮中的任意一种;
13、s12将pbs缓冲液添加到真空旋转蒸发后的产物中,超声震荡,获得脂质体乳化液;优选地,pbs溶液的ph为7.4,浓度为0.01m;
14、s13在所述的脂质体乳化液中添加pfp得到含pfp脂质体悬浮液,将该含pfp脂质体悬浮液超声乳化,即得到所述的阳离子载药纳米泡fty720/pfp@pei nbs;优选地,pfp与fty720/pfp@pei nbs的摩尔比为0.5;
15、进一步地,所述步骤s2中fty720/pfp@pei nbs溶液浓度为10mg/ml。
16、进一步地,所述步骤s3中,所述的基因溶液浓度为0.5~1nm,fty720/pfp@pei-t7nbs材料和基因mirna-34b-5p的量根据氮磷比n/p确定,所述n/p为:0,2,4,6,8,10,12,14,或16等。
17、本发明第三方面,还提供了上述的诊疗一体化靶向超声爆破纳米泡在制备甲状腺超声诊断药剂,或甲状腺癌治疗药物中的应用。
18、与现有技术相比,本发明具有以下有益效果:
19、临床上一般通过高频超声和穿刺活检诊断甲状腺结节,判断结节的性质,但对于小于5mm的甲状腺结节,高频超声显影精确度不高,导致诊断率降低。本发明中的诊疗一体化靶向超声爆破纳米泡,以dmg-peg2000/dspe-peg2000脂质体为壳,在包载pfp后,整体载体的粒径控制在纳米尺度,具有epr效应,并且药核表面偶联t7短肽,可大大提高所制备的纳米泡对甲状腺癌细胞表面tfr的结合亲和力,提高了纳米泡的递送功能并减少脱靶效应,以此提高早期甲状腺癌的诊断精度。
20、本发明的纳米泡是诊疗一体化平台,利用纳米技术将治疗药物与治疗基因同时包裹,在治疗中纳米泡可主动靶向聚集于肿瘤部位,基于超声显影判断肿瘤部位,并利用utmd技术定位爆破纳米泡,释放更多治疗药物与基因,减少用药副作用,以此实现甲状腺癌的精准治疗。在超声条件,具备空化和声孔效应,本发明的纳米泡比一般靶向基因载体具有更高的转染效率。
21、本发明制造工艺简单,可以应用于规模化生产。
- 还没有人留言评论。精彩留言会获得点赞!