沙库比曲氨丁三醇盐的一种新晶型及其制备方法和用途与流程
本发明涉及有机化学领域和药学领域,具体涉及沙库比曲氨丁三醇盐的一种新晶型及其制备方法,包含沙库比曲氨丁三醇盐该新晶型的药物组合物,以及该新晶型在制备用于预防或治疗慢性心力衰竭或高血压药物中的用途。
背景技术:
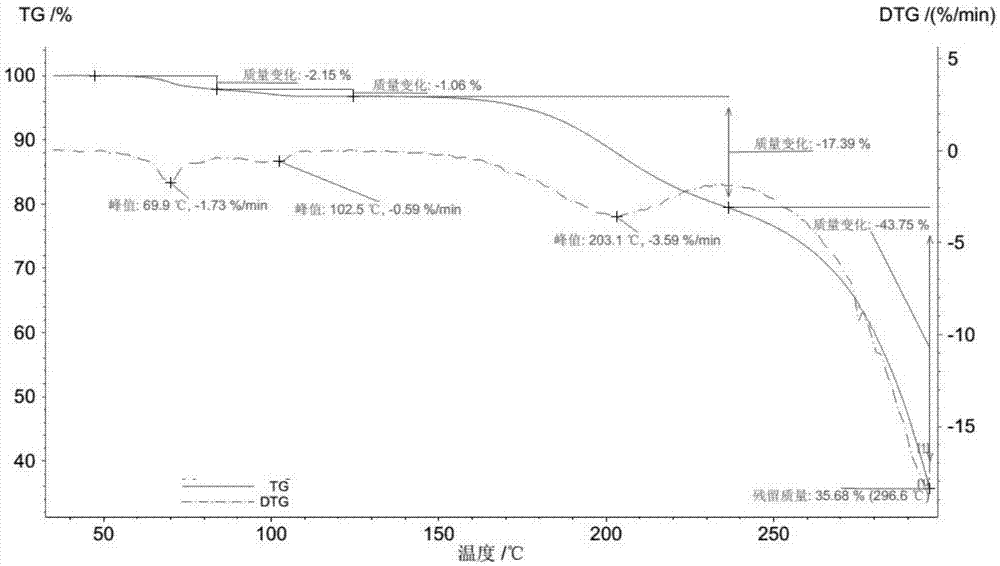
:沙库比曲,英文通用名:Sacubitril,又名:AHU-377,化学名:4-{[(2S,4R)-1-([1,1’-联二苯]-4-基)-5-乙氧基-4-甲基-5-氧代戊-2-基]氨基}-4-氧代丁酸,是一种脑啡肽酶抑制剂,结构如式a所示:当沙库比曲或其盐与血管紧张素IIAT1受体拮抗剂,如缬沙坦等,联合给药时,能够同时抑制脑啡肽酶和血管紧张素受体,即能同时作用于肾素-血管紧张素系统并促进脑钠肽循环,以多种方式作用于心脏的神经内分泌系统,阻断施加有害影响的受体,促进保护性机制。诺华公司开发的LCZ-696,即沙库比曲钠与缬沙坦二钠组成的如式b所示的共晶,用于治疗慢性心力衰竭或高血压,其效果显著,安全性良好。LCZ-696已在美国、欧盟获得上市批准,本品为近10年来获批用于慢性心力衰竭的首个新药。诺华公司将沙库比曲钠与缬沙坦二钠开发成共晶LCZ-696,其原因之一为LCZ-696的吸湿性低于沙库比曲钠,更利于生产和贮存。该LCZ-696共晶虽然在物理性质方面有所改善,但由于其中组成比例固定,限制了沙库比曲钠与不同比例缬沙坦或其他AT1受体拮抗剂的组合用药,不利于临床中根据不同情况的用药调整。式a所示的沙库比曲游离酸由于其熔点低、水溶性差,不适合用于制剂,特别是口服固体制剂。因此有必要进一步对沙库比曲盐的固态形式进行研究,以期获得吸湿性等物理性质改善的沙库比曲盐。专利CN03802268.0公开了一种沙库比曲氨丁三醇盐及其制备方法和熔点(114~115℃),但并未公开其粉末X-射线衍射等特征。为表述方便,我们将该晶型命名为沙库比曲氨丁三醇盐晶型α。我们按CN03802268.0中公开的方法制备了该沙库比曲氨丁三醇盐晶型α,测其熔点为约115℃;测其粉末X-射线衍射图谱(使用Cu-Kα辐射),在2θ值为10.7°、13.2°、17.2°、17.8°、20.2°、22.8°、23.5°等位置对应有特征衍射峰。在我们制备和测定沙库比曲氨丁三醇盐晶型α理化性质的过程中,发现该晶型存在制备周期长、晶型较不稳定等不足。专利CN201510552731.1公开了沙库比曲氨丁三醇盐的晶型I,测其熔点为约123℃;测其粉末X-射线衍射图谱(使用Cu-Kα辐射),在2θ值为3.4°±0.2°、10.8°±0.2°、13.2°±0.2°、17.1°±0.2°、17.9°±0.2°、18.7°±0.2°、21.9°±0.2°、23.6°±0.2°等位置对应有特征衍射峰。该新晶型熔点较高、吸湿性小、稳定性和溶解性良好,制备方法易于实施,适宜于制备多种制剂。在我们对沙库比曲氨丁三醇盐晶型进一步研究的过程中,惊喜的发现了沙库比曲氨丁三醇盐的另一种新晶型。技术实现要素:本发明的一个目的在于提供沙库比曲氨丁三醇盐的一种新晶型,该晶型纯度高、吸湿性小、溶解性良好,适宜于制备多种制剂。本发明的另一目的在于提供该沙库比曲氨丁三醇盐新晶型的制备方法。本发明的又一目的在于提供包含治疗有效量的该沙库比曲氨丁三醇盐新晶型的药物组合物。本发明的又一目的在于提供该沙库比曲氨丁三醇盐新晶型在制备用于预防或治疗慢性心力衰竭或高血压药物中的用途。本发明的上述发明目的通过以下方案实现:根据本发明的目的,本发明首先提供了具有一定粉末X-射线衍射图谱特征的式c所示的沙库比曲氨丁三醇盐的一种新晶型,将其定义为沙库比曲氨丁三醇盐晶型II,本发明提供的沙库比曲氨丁三醇盐晶型II的使用Cu-Kα辐射的粉末X-射线衍射图谱的特征为:在2θ值为3.1°±0.2°、12.5°±0.2°、17.1°±0.2°、18.4°±0.2°、19.2°±0.2°、23.5°±0.2°、23.9°±0.2°、24.7°±0.2°、26.1°±0.2°、27.7°±0.2°等位置对应有特征衍射峰。进一步的,本发明提供的沙库比曲氨丁三醇盐晶型II的使用Cu-Kα辐射的粉末X-射线衍射图谱的特征为:在2θ值为3.1°±0.2°、12.5°±0.2°、16.1°±0.2°、17.1°±0.2°、17.6°±0.2°、18.1°±0.2°、18.4°±0.2°、18.7°±0.2°、19.2°±0.2°、20.4°±0.2°、22.1°±0.2°、23.1°±0.2°、23.5°±0.2°、23.9°±0.2°、24.2°±0.2°、24.7°±0.2°、25.3°±0.2°、26.1°±0.2°、27.7°±0.2°等位置对应有特征衍射峰。更进一步地,本发明提供的沙库比曲氨丁三醇盐晶型II的使用Cu-Kα辐射的粉末X-射线衍射图谱,在以下2θ角位置具有特征衍射峰及相对应的相对强度:2θ相对强度3.1°±0.2°52.412.5°±0.2°100.016.1°±0.2°41.417.1°±0.2°77.817.6°±0.2°50.818.1°±0.2°76.318.4°±0.2°95.518.7°±0.2°72.619.2°±0.2°83.720.4°±0.2°37.022.1°±0.2°29.423.1°±0.2°32.523.5°±0.2°74.023.9°±0.2°76.124.2°±0.2°49.624.7°±0.2°61.825.3°±0.2°39.226.1°±0.2°52.027.7°±0.2°54.1更进一步的,本发明提供的沙库比曲氨丁三醇盐晶型II的使用Cu-Kα辐射的粉末X-射线衍射图谱基本上如图1所示。更进一步地,本发明提供的沙库比曲氨丁三醇盐晶型II是一种水合物,其升温速率10℃/分的热重分析(TGA)图谱的特征为:在温度小于110℃的范围,质量减少3%~4%。在一实施方案中,本发明提供的沙库比曲氨丁三醇盐晶型II的升温速率10℃/分的热重分析(TGA)图谱的特征为:在温度小于110℃的范围,质量减少3.1%~3.5%。例如,在温度低于85℃范围,质量减少约2.15%;温度在85~110℃范围,质量减少约1.06%。在一实施方案中,本发明提供的沙库比曲氨丁三醇盐晶型II的的升温速率10℃/分的热重分析(TGA)图谱基本上如图2所示。热重分析(TGA)图谱显示,沙库比曲氨丁三醇盐晶型II在TGA测试过程中,其中的结晶水通过两步释放:第一步发生在85℃以下,第二步发生在85~110℃。本发明提供的沙库比曲氨丁三醇盐晶型II晶型纯度一般大于90%,优选大于95%、96%或97%,更优选大于98%、99%或99.5%。所述晶型纯度是指由沙库比曲氨丁三醇盐晶型II和杂质所组成的混合物中沙库比曲氨丁三醇盐晶型II的质量百分含量。所述杂质,一方面包括:残留在沙库比曲氨丁三醇盐中的原料沙库比曲或氨丁三醇,工艺有机副产物杂质、有机降解杂质,溶剂残留,无机杂质等;另一方面还包括:沙库比曲氨丁三醇盐的除晶型II外的其他晶型或无定形。该晶型纯度可以通过粉末X-射线衍射法、差示扫描量热(DSC)法或HPLC法等测得。根据本发明的目的,本发明提供了一种沙库比曲氨丁三醇盐晶型II的制备方法,该方法包括:(1)、将沙库比曲氨丁三醇盐晶型I放置于相对湿度大于90%的环境中;(2)、可选地,将步骤(1)所得固体进行干燥。上述制备方法的步骤(1)中,所述沙库比曲氨丁三醇盐晶型I可以按照专利文献CN201510552731.1中公开的方法制得,这些文献通过引用的方式并入到本申请中。上述制备方法的步骤(1)中,所述相对湿度大于90%的环境可通过本领域常规方法制造。在一实施方案中,相对湿度大于90%的环境为放置水的密闭空间。在一实施方案中,相对湿度大于90%的环境为在一定温度下,放置有适合的盐的饱和水溶液的密闭空间,比如,在0℃、5℃、10℃、15℃、20℃、25℃、30℃或35℃下,放置有硝酸钾的饱和水溶液的密闭空间的气相相对湿度分别为96.3%、96.3%、96.0、95.4%、94.6%、93.6%、92.3%、90.8%;在5℃、10℃、15℃、20℃、25℃、30℃、35℃或40℃下,放置有硫酸钾的饱和水溶液的密闭空间的气相相对湿度分别为98.5%、98.2、97.9%、97.6%、97.3%、97.0%、97.7%、96.4%。上述制备方法的步骤(1)中,所述放置的时间一般为大于12小时,优选为12~24小时。上述制备方法的步骤(2)中,所述干燥温度一般为0~40℃,优选为20~30℃。可以常压干燥,也可以减压干燥。本发明提供的沙库比曲氨丁三醇盐晶型II的代表性的使用Cu-Kα辐射的粉末X-射线衍射图谱列于附图中(参见图1,即沙库比曲氨丁三醇盐晶型II的粉末X-射线衍射图谱基本上如图1所示)。所述“代表性的粉末X-射线衍射图谱”或“基本上”是指本晶型的粉末X-射线衍射特征符合本图谱显示的整体形貌,可以理解的是在测试过程中,由于受到多种因素(如测试样品的粒度、测试时样品的处理方法、仪器、测试参数、测试操作等)的影响,同一种晶型所测得的粉末X-射线衍射图谱的特征衍射峰的位置或强度会有一定的差异。一般情况下,粉末X-射线衍射图谱中特征衍射峰2θ值的实验误差可为±0.2°。根据本发明的目的,本发明提供了一种药物组合物,该药物组合物包含治疗有效量的沙库比曲氨丁三醇盐晶型II和药用辅料。其中所述沙库比曲氨丁三醇盐晶型II的日给药量或单位剂量(以沙库比曲计)一般为1mg至2g,优选5mg至300mg,更优选20mg至250mg。根据本发明的目的,本发明提供了一种上述药物组合物的制备方法,该制备方法包括:将沙库比曲氨丁三醇盐晶型II与一种或多种药用辅料混合或接触。在一实施方案中,本发明提供了一种含沙库比曲氨丁三醇盐晶型II的单位剂量药物组合物的制备方法,该制备方法包括:将沙库比曲氨丁三醇盐晶型II与一种或多种药用辅料混合或接触,然后配制成单位剂量形式,再制成所需的剂型。进一步的,本发明提供了一种药物组合物,该药物组合物包含治疗有效量沙库比曲氨丁三醇盐晶型II,治疗有效量的其他活性成分,和药用辅料。其中其他活性成分选自氯沙坦、依普沙坦、缬沙坦、厄贝沙坦、坎地沙坦、坎地沙坦酯、奥美沙坦、奥美沙坦酯、替米沙坦、阿齐沙坦、阿齐沙坦酯、非马沙坦等AT1受体拮抗剂或其可药用盐。在一实施方案中,所述沙库比曲氨丁三醇盐晶型II的日给药量或单位剂量一般为20mg至250mg(以沙库比曲计)。在一实施方案中,所述氯沙坦、依普沙坦、缬沙坦、厄贝沙坦、坎地沙坦、坎地沙坦酯、奥美沙坦、奥美沙坦酯、替米沙坦、阿齐沙坦、阿齐沙坦酯、非马沙坦等AT1受体拮抗剂或其可药用盐的日给药量或单位剂量一般为2mg至900mg(以AT1受体拮抗剂游离物计)。在一实施方案中,所述其他活性成分为氯沙坦或其药用盐,所述氯沙坦或其药用盐的日给药量或单位剂量一般为10mg至120mg(以氯沙坦计),所述氯沙坦的药用盐优选为钾盐。在一实施方案中,所述其他活性成分为依普沙坦或其药用盐,所述依普沙坦或其可药用盐的日给药量或单位剂量一般为200mg至900mg(以依普沙坦计)。在一实施方案中,所述其他活性成分为缬沙坦或其药用盐,所述缬沙坦或其可药用盐的日给药量或单位剂量一般为20mg至350mg(以缬沙坦计)。在一实施方案中,所述其他活性成分为厄贝沙坦或其药用盐,所述厄贝沙坦或其可药用盐的日给药量或单位剂量一般为30mg至350mg(以厄贝沙坦计)。在一实施方案中,所述其他活性成分为坎地沙坦或其药用盐,所述坎地沙坦或其可药用盐的日给药量或单位剂量一般为2mg至50mg(以坎地沙坦计)。在一实施方案中,所述其他活性成分为坎地沙坦酯或其药用盐,所述坎地沙坦酯或其可药用盐的日给药量或单位剂量一般为2mg至35mg(以坎地沙坦酯计)。在一实施方案中,所述其他活性成分为奥美沙坦或其药用盐,所述奥美沙坦或其可药用盐的日给药量或单位剂量一般为5mg至60mg(以奥美沙坦计)。在一实施方案中,所述其他活性成分为奥美沙坦酯或其药用盐,所述奥美沙坦酯或其可药用盐的日给药量或单位剂量一般为5mg至50mg(以奥美沙坦酯计)。在一实施方案中,所述其他活性成分为替米沙坦或其药用盐,所述替米沙坦或其可药用盐的日给药量或单位剂量一般为10mg至100mg(以替米沙坦计)。在一实施方案中,所述其他活性成分为阿齐沙坦或其药用盐,所述阿齐沙坦或其可药用盐的日给药量或单位剂量一般为5mg至100mg(以阿齐沙坦计)。在一实施方案中,所述其他活性成分为阿齐沙坦酯或其药用盐,所述阿齐沙坦酯或其可药用盐的日给药量或单位剂量一般为20mg至100mg(以阿齐沙坦酯计),所述阿齐沙坦酯药用盐优选为钾盐。在一实施方案中,所述其他活性成分为非马沙坦或其药用盐,所述非马沙坦或其可药用盐的日给药量或单位剂量一般为20mg至150mg(以非马沙坦计),所述非马沙坦药用盐优选为钾盐。在一实施方案中,本发明提供了一种药物组合物,该药物组合物包含沙库比曲氨丁三醇盐晶型II、缬沙坦和药用辅料。其中所述沙库比曲氨丁三醇盐晶型II的日给药量或单位剂量一般为20mg至250mg(以沙库比曲计),所述缬沙坦或其可药用盐的日给药量或单位剂量一般为20mg至350mg(以缬沙坦计)。在一具体实施方案中,该药物组合物一天给药两次。在一具体实施方案中,该药物组合物一天给药一次。在一实施方案中,本发明提供了一种药物组合物,该药物组合物包含沙库比曲氨丁三醇盐晶型II、氯沙坦和药用辅料。其中所述沙库比曲氨丁三醇盐晶型II的日给药量或单位剂量一般为20mg至250mg(以沙库比曲计),所述氯沙坦或其药用盐的日给药量或单位剂量一般为10mg至120mg(以氯沙坦计)。在一具体实施方案中,该药物组合物一天给药两次。在一具体实施方案中,该药物组合物一天给药一次。在一实施方案中,本发明提供了一种药物组合物,该药物组合物包含沙库比曲氨丁三醇盐晶型II、坎地沙坦酯和药用辅料。其中所述沙库比曲氨丁三醇盐晶型II的日给药量或单位剂量一般为20mg至250mg(以沙库比曲计),所述坎地沙坦酯的日给药量或单位剂量一般为2mg至35mg(以坎地沙坦酯计)。在一具体实施方案中,该药物组合物一天给药两次。在一具体实施方案中,该药物组合物一天给药一次。根据本发明的目的,本发明提供了一种上述药物组合物的制备方法,该制备方法包括:将沙库比曲氨丁三醇盐晶型II,和选自氯沙坦、依普沙坦、缬沙坦、厄贝沙坦、坎地沙坦、坎地沙坦酯、奥美沙坦、奥美沙坦酯、替米沙坦、阿齐沙坦、阿齐沙坦酯、非马沙坦等的AT1受体拮抗剂或其可药用盐,与一种或多种药用辅料混合或接触。在一实施方案中,本发明提供了一种上述单位剂量药物组合物的制备方法,该制备方法包括:将沙库比曲氨丁三醇盐晶型II,和选自氯沙坦、依普沙坦、缬沙坦、厄贝沙坦、坎地沙坦、坎地沙坦酯、奥美沙坦、奥美沙坦酯、替米沙坦、阿齐沙坦、阿齐沙坦酯、非马沙坦等的AT1受体拮抗剂或其可药用盐,与一种或多种药用辅料混合或接触,然后配制成单位剂量形式,再制成所需的剂型。上述药物组合物或制剂可经口或不经口给药。优选口服剂型,包括片剂、胶囊剂、丸剂、颗粒剂、溶液剂、糖浆剂、干混悬剂、混悬剂、散剂、缓释制剂或控释制剂等。其中优选片剂、胶囊剂、颗粒剂、干混悬剂以及缓释制剂或控释制剂等固体口服制剂,其中更优选片剂和胶囊剂。上述药物组合物的各种剂型可以按照药学领域的常规方法制备。在一实施方案中,本发明将沙库比曲氨丁三醇盐晶型II与一种或多种药用辅料混合或接触,然后将其制成口服剂型,优选片剂和胶囊剂。在该口服剂型中,药用辅料选自本领域常规的药用辅料,包括填充剂、崩解剂、粘合剂、分散剂、润滑剂或助留剂以及各类型的包衣材料等。所述填充剂一般包括预胶化淀粉、淀粉、乳糖、糊精、磷碱氢钙、碳碱钙、甘露醇、微晶纤维素、山梨醇、葡萄糖等,它们可以单独使用也可以混合使用,其中优选预胶化淀粉、乳糖、微晶纤维素、甘露醇。所述崩解剂一般包括交联羧甲纤维素钠、羧甲基纤维素钠、羧甲基淀粉钠、交联聚乙烯吡咯烷酮、淀粉、微晶纤维素、低取代羟丙基纤维素等,它们可以单独使用也可以混合使用,其中优选为交联羧甲纤维素钠、羧甲基淀粉钠、交联聚乙烯吡咯烷酮、微晶纤维素、低取代羟丙基纤维素。所述粘合剂一般包括微晶纤维素、预交化淀粉、羟丙基甲基纤维素、羟丙基纤维素、聚维酮、淀粉浆、阿拉伯胶、聚乙二醇4000、聚乙烯醇、藻碱盐、水、各种浓度的乙醇溶液,它们可以单独使用也可以混合使用,其中优选羟丙基甲基纤维素、羟丙纤维素、聚维酮、淀粉浆。所述润滑剂一般包括硬脂碱镁、硬脂碱、硬脂碱钙、硬脂碱富马碱钠、硬脂碱富马碱钾、棕榈碱、微分硅胶、硬脂酰胺、滑石粉、固体聚乙二醇、三乙碱甘油酯等。它们可以单独使用也可以混合使用,其中优选硬脂碱镁、硬脂碱、滑石粉、微分硅胶、三乙碱甘油酯。如果需要,还可以向上述组合物或制剂中添加其他辅料,如甜味剂(如阿司帕坦、甜菊素等)、着色剂(如柠檬黄、氧化铁等各种药用或食用色素)、表面活性剂(如吐温80、十二烷基硫碱钠等)包衣材料(如欧巴代,羟丙基甲基纤维素、羟丙基纤维素、丙烯碱树脂共聚物等。在一实施方案中,上述药物组合物或制剂中,所述沙库比曲氨丁三醇盐晶型II的粒径分布控制在90%小于100μm,优选小于50μm,更优选小于10μm。根据本发明的目的,本发明提供了沙库比曲氨丁三醇盐晶型II在制备用于预防或治疗慢性心力衰竭或高血压药物中的用途。其中所述心力衰竭包括射血分数减少的心力衰竭和射血分数保留的慢性心力衰竭等,高血压包括原发性高血压和继发性高血压等。进一步的,本发明提供了一种包含治疗有效量的沙库比曲氨丁三醇盐晶型II,和可选的治疗有效量的选自氯沙坦、依普沙坦、缬沙坦、厄贝沙坦、坎地沙坦、坎地沙坦酯、奥美沙坦、奥美沙坦酯、替米沙坦、阿齐沙坦、阿齐沙坦酯、非马沙坦等的AT1受体拮抗剂或其可药用盐的药物组合物或单位剂量药物组合物在制备用于预防或治疗心力衰竭或高血压的药物的用途。其中所述心力衰竭包括射血分数减少的心力衰竭和射血分数保留的慢性心力衰竭等,高血压包括原发性高血压和继发性高血压等。本发明提供的这种沙库比曲氨丁三醇盐晶型II经实验证明,具有如下优势:(1)、纯度高。比如晶型II的晶型纯度或含量可达99%或99.5%以上,有关物质可达1.0%、0.5%、0.3%或0.2%以下。(2)、吸湿性小。比如晶型II的吸湿性明显优于现有的沙库比曲钠盐。(3)、溶解性良好。(4)、药效和安全性良好。附图说明图1为沙库比曲氨丁三醇盐晶型II的粉末X-射线衍射图谱。图2为沙库比曲氨丁三醇盐晶型II的TGA图谱。具体实施方式以下通过实施例形式的具体实施方式,对本发明的上述
发明内容做进一步详细说明,但不应理解为本发明的
发明内容仅限于以下实施例,凡基于本发明上述内容所做出的发明均属于本发明的范围。以下实施例中的含量和有关物质是用HPLC法测定。以下实施例中的1HNMR测试是以氘代甲醇作为测试溶剂,以四甲基硅烷作内标,用BrukeAV-III400MHz核磁共振仪在室温下测定的。以下实施例中粉末X-射线衍射是由荷兰帕纳科XPERT-3型粉末X-射线衍射仪测定的,测试条件为以θ-θ构型、扫描范围为3°-40°,步长为0.0130°,连续扫描。测试光源为铜靶Kα(Cu-Kα)辐射(波长为),电压和电流分别为45kV和40mA。制样方法为:将约10毫克样品均匀平铺在单晶样品盘上,用以上描述参数进行XRPD测试。以下实施例中的热重分析(TGA)是在30℃至300℃的温度范围内进行的,升温速率10℃/分,经NETZSCHTGA209F3型热重分析仪测定的。实施例1:沙库比曲氨丁三醇盐晶型II的制备在20~25℃下,将沙库比曲氨丁三醇盐晶型I放置于装有硝酸钾饱和水溶液的密闭容器中(相对湿度约94%),放置24小时。将所得样品在20~25℃下减压干燥,得沙库比曲氨丁三醇盐晶型II。所测1HNMR结果为:1HNMR(400MHz)δ:1.046-1.064(d,3H),1.115-1.141(q,3H),1.382-1.417(m,1H),1.740-1.788(m,1H),2.229-2.296(m,4H),2.649-712(m,2H),3.339(s,6H),3.900-4.019(m,3H),7.248-7.269(d,2H),7.321-7.362(m,1H),7.433-7.471(m,2H),7.568-7.589(m,2H),7.640-7.663(m,2H),7.786-7.807(m,2H)。所测1HNMR结果中,化学位移在1.046-1.064(d,3H)处的信号峰分别归属为沙库比曲中手性位上的甲基H,3.339(s,6H)处的信号峰归属为氨丁三醇中的3个亚甲基H,从两组信号峰的积分面积比可判断该样品中沙库比曲和氨丁三醇的摩尔组成比为1:1。所测的粉末X-射线衍射图谱见附图1,其测量值如下(取2θ角3°-40°范围内相对强度大于2%的衍射峰对应的测量值,2θ和d的测量值按四舍五入取三位小数,相对强度测量值按四舍五入取一位小数):沙库比曲氨丁三醇盐晶型II的热重分析(TGA)图谱见附图2,其在温度低于85℃范围,质量减少约2.15%;温度在85~110℃范围,质量减少约1.06%。实施例2:沙库比曲氨丁三醇盐晶型II的制备在35~40℃下,将沙库比曲氨丁三醇盐晶型I放置于装有硝酸钾饱和水溶液的密闭容器中(相对湿度约90%),放置12小时,得沙库比曲氨丁三醇盐晶型II。实施例3:沙库比曲氨丁三醇盐晶型II的制备在0~5℃下,将沙库比曲氨丁三醇盐晶型I放置于装有硫酸钾饱和水溶液的密闭容器中(相对湿度99%),放置12小时,得沙库比曲氨丁三醇盐晶型II。实施例4:吸湿性研究沙库比曲钠盐(按下述制备例2的方法制备)与沙库比曲氨丁三醇盐晶型II(按实施例1的方法制备)的吸湿性对比如下:样品吸湿情况沙库比曲钠盐在相对湿度50%下,放置约3分钟变粘沙库比曲氨丁三醇盐晶型II在相对湿度50%下,无明显变化实施例5:含20mg沙库比曲氨丁三醇盐晶型II的片剂及其制备处方:组分含量(mg/片)沙库比曲氨丁三醇盐晶型II(按实施例1的方法制备)20mg(以沙库比曲计)微晶纤维素50.0一水乳糖20.0聚维酮5.0交联羧甲基纤维素钠4.0硬脂碱镁1.0制备:将上表组分中的沙库比曲氨丁三醇盐晶型II、微晶纤维素、一水乳糖、聚维酮和交联羧甲基纤维素钠混匀后,用水湿法制粒,干燥,整粒,与硬脂碱镁混匀,压片,即得。实施例6:沙库比曲氨丁三醇盐晶型II坎地沙坦酯片及其制备处方:制备:将沙库比曲氨丁三醇盐晶型II、坎地沙坦酯、微晶纤维素、低取代羟丙基纤维素混合均匀,用聚维酮K30水溶液制粒,干燥,用24目筛整理,外加硬脂酸镁、滑石粉以及微粉硅胶混合均匀后压片,即得。制备例1:沙库比曲氨丁三醇盐晶型I的制备在50~55℃下,将沙库比曲10.0g(24.3mmol)和氨丁三醇2.90g(24.3mmol)溶于乙醇50ml中,搅拌下滴加甲基叔丁醚,至有沉淀析出且该沉淀又迅速溶解时停止滴加(消耗甲基叔丁基醚约200ml),冷却至约25℃,在该温度下继续搅拌约1小时。过滤,滤饼经甲基叔丁基醚洗涤,在40~45℃下减压干燥,得沙库比曲氨丁三醇盐晶型I。制备例2:沙库比曲钠盐的制备室温下,将氢氧化钠0.04g(10.08mmol)溶于水10ml中,将沙库比曲4.15g(10.08mmol)溶于四氢呋喃40ml中。搅拌下,将上述氢氧化钠的水溶液滴加至沙库比曲的四氢呋喃溶液中,得到澄清溶液。浓缩除去溶剂,浓缩残余物溶于二氯甲烷40ml,加热至35℃,滴加正己烷25ml至有固体析出,冷却。过滤,滤饼经正己烷洗涤,减压干燥,得沙库比曲钠盐。以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本领域的技术人员在本发明所揭露的技术范围内,可不经过创造性劳动想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求书所限定的保护范围为准。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1