聚糖样品制备的制作方法
本申请案主张2014年4月30日申请的美国临时申请案第61/986736号和2015年4月21日申请的第62/150722号的优先权,所述两个申请案的内容以全文引用的方式并入本文中。
技术领域
本文中公开用于分析聚糖及/或糖结合物的方法、系统和试剂盒。在一些方面,本教示内容可实现自动化糖分析方案,所述方案展现相对于已知方法大体上减少的样品制备时间。
背景技术:
蛋白质糖基化通常是指转译后修饰,其中低聚糖或聚糖附接至蛋白质。鉴于糖基化在蛋白质折叠、传输和细胞-细胞相互作用上的重要性,例如已研发出许多研究工具来特性化和/或分析糖结合物和与之相关联的聚糖。所述工具在生物医学科学、生物医药行业(例如生物标记发现)中并且在关于调节机构的蛋白质疗法的功效/安全性评估中已变得至关重要。
虽然最常见的糖分析方法毛细管电泳法及亲水性相互作用液相色谱法可为有效的,但是这些方法可需要大量的样品制备,包括糖蛋白捕获、N-聚糖释放、荧光衍生、纯化和预浓缩步骤。当前所用方案满足这些工作,然而费时,并且需要例如多个离心和/或真空-离心步骤,由此减小产出量并且使自动化困难和/或昂贵。
因此,仍需要高效并且有效的方法以纯化聚糖和/或分析糖结合物或与之相关联的聚糖。
技术实现要素:
本教示内容涉及用于纯化和/或分析糖结合物或聚糖的方法、系统和试剂盒,且尤其涉及基于磁性珠粒的样品制备方法,其可实现完全自动化和/或相对于目前方案减少的样品制备时间。在一些方面,本文中所描述方法可提供糖蛋白分解、N-聚糖释放、荧光标记和聚糖纯化中的一或多种用于具有激光诱导萤光检测的后续毛细管电泳(CE-LIF)、液相色谱(LC)或其它分析方法(例如质谱(MS)、核磁共振(NMR))而无需耗时的样品制备步骤,如离心或真空-离心。
根据各个方面,申请人教示内容的某些实施例涉及一种纯化聚糖的方法,其包含使含有一或多种糖结合物(例如糖蛋白、糖肽、抗体、蛋白聚糖、鞘糖脂、硫酸软骨素、硫酸肝素、透明质酸、糖脂、糖胺聚糖、融合糖蛋白、抗体-药物结合物)的样品与去糖基化试剂(例如用于N-键联聚糖的内切糖苷酶、用于O-键联聚糖的β消除)反应,以使从糖结合物释放聚糖,使所释放聚糖与多个磁性粒子(例如羧基包经的磁性珠粒)关联,施加磁场以使关联有所释放聚糖的多个磁性粒子下移,从经下移磁性粒子去除上清液,以使去除去糖基化试剂(例如酶)和去糖基化样品,并且从磁性粒子解离或洗脱聚糖。在一些方面,所述方法可经由CE(例如具有LIF、具有UV标记)、LC(例如具有荧光或UV检测)、MS和NMR和其组合中的一种制备用于分析的聚糖。在一些方面,所述聚糖在无离心或真空离心步骤的情况下进行纯化。
根据各个方面,申请人教示内容的某些实施例涉及一种分析一或多种糖结合物(例如糖蛋白、糖肽、抗体、蛋白聚糖、鞘糖脂、硫酸软骨素、硫酸肝素、透明质酸、糖脂、糖胺聚糖、融合糖蛋白、抗体-药物结合物)的方法,其包含使含有一或多种糖结合物的样品与去糖基化试剂(例如内切糖苷酶)反应以从糖结合物释放聚糖,并且使聚糖与多个磁性粒子(例如羧基包经的磁性珠粒)关联。可施加磁场以使关联有聚糖的多个磁性粒子下移,并且可去除上清液以从经下移磁性粒子去除去糖基化酶和去糖基化结合物。聚糖可与标记试剂反应以使形成经标记聚糖,然后可对其进行分析(例如经由具有激光诱导荧光或UV检测的毛细管电泳)。根据本教示内容的各个方面,可在无离心或真空离心的情况下制备经标记聚糖用于分析。
所述方法可包括在标记聚糖之前或之后从磁性粒子洗脱聚糖。在一些方面,举例来说,所述方法可包括从磁性粒子洗脱聚糖,随后使所述聚糖与标记试剂反应。举例来说,可通过添加包含标记试剂及酸催化剂(例如乙酸)的混合物从磁性粒子溶离聚糖。在相关方面中,通过添加还原剂(例如NaBH3CN或pic-BH3)以引发聚糖与标记试剂的反应,聚糖可与标记试剂反应以使形成经标记聚糖。
在一些方面,所述方法还可包含使经标记聚糖与多个磁性粒子(例如磁性微粒、珠粒)关联,施加磁场以使关联有经标记聚糖的多个磁性粒子下移,从关联有经标记聚糖的经下移复数个磁性粒子去除上清液以去除过量标记试剂,并且从多个磁性粒子洗脱经标记聚糖。举例来说,经标记聚糖可通过添加乙腈与多个磁性粒子关联,并且经标记聚糖可通过添加水性介质(例如水)从多个磁性珠粒洗脱。
根据本教示内容的各个方面,去糖基化试剂可包含PNGase F酶,聚糖可通过添加乙腈与多个磁性粒子关联,并且经标记试剂可包含以下中的一种:1-氨基芘-3,6,8-三磺酸(APTS)、8-氨基萘-1,3,6-三磺酸(ANTS)、2-邻氨基苯甲酸(2-AA)、2-氨基苯甲酸(2-AB)(其可与聚糖反应,例如通过添加还原剂,如NaBH3CN或pic-BH3)。
根据各个方面,申请人教示内容的某些实施例涉及一种试剂盒,其用于纯化可包含多个羧基包经的磁性粒子的聚糖;用于从样品内含有的糖结合物释放聚糖的去糖基化试剂(例如一或多种内切糖苷酶、PNGase F、肼);并且用于使聚糖与多个羧基包经的磁性粒子关联的试剂。
在一些方面,所述试剂盒可进一步包含用于标记所释放聚糖,特别用于荧光标记所释放聚糖的试剂。举例来说,所述试剂盒可包括以下中的一或多种:APTS、ANTS、2-AA、2-AB、酸催化剂(例如乙酸)和还原剂,如NaBH3CN或pic-BH3。
在一些方面,用于使所释放聚糖与多个羧基包经的磁性粒子关联的试剂包含乙腈。
在一些方面,所述方法可进一步包含当使样品与去糖基化酶反应时维持等于或大于约37℃(例如等于或大于约50℃)的温度。
在各种方面中,所述试剂盒可进一步包含经由毛细管电泳(例如具有激光诱导荧光检测)、液相色谱、MS或NMR分析经标记聚糖的试剂。举例来说,所述试剂盒可包括用于CE-LIF分析经标记聚糖(例如APTS-、ANTS-、2-AA-或2-AB标记的麦芽糖)的荧光标记内标物。
根据各个方面,提供用于使用毛细管电泳分离聚糖的组合物,其包含乙酸锂缓冲剂、聚氧化乙烯、乙二醇和直链聚丙烯酰胺。
在不同实施例中,所述乙酸锂在所述组合物中的浓度在10mM与50mM之间,pH在4与5.5之间,所述聚氧化乙烯的分子量在100与1000kDa之间,并且在所述组合物中的浓度在0.5%与5%之间,所述乙二醇在所述组合物中的浓度小于60%和/或所述直链聚丙烯酰胺的分子量是约10kDa并且在所述组合物中的浓度在0.5%与5%之间。
在不同实施例中,所述组合物可包含乙酸锂缓冲剂,其在所述组合物中的浓度在25与30mM之间,pH是约4.75;聚氧化乙烯,其分子量是约900kDa,在所述组合物中的浓度是约1%;乙二醇,其在所述组合物中的浓度是约20%;直链聚丙烯酰胺,其分子量是约10kDa,在所述组合物中的浓度是约3%。
在本文中阐述申请人教示内容的这些和其它特征。
附图说明
所属领域技术人员将理解以下描述的附图仅出于说明的目的。附图并不希望以任何方式限制申请人教示内容的范围。
图1说明根据申请人教示内容的各个方面在PNGase F分解期间保温持续时间和温度的作用。
图2A-B展现根据申请人教示内容的各个方面对标记保温温度和时间的去唾液酸化的作用。
图3A-C说明根据本教示内容的各个方面使用示例性基于磁性珠粒的净化方案相对于习知样品净化方法的各种聚糖结构的示例性峰面积分布。
图4示意性地描绘根据本教示内容的各个方面用于N-糖基化分析的示例性基于磁性珠粒的样品制备工作流程。
图5展现根据申请人教示内容的各个方面温度和保温时间对APTS标记效率的影响。
图6展现根据申请人教示内容的各个方面APTS浓度对在各种保温温度下的标记效率的影响。
图7展现随着根据申请人教示内容的各个方面使用的磁性珠粒悬浮液量变化而变化的再现性。
图8示意性地描绘根据本教示内容的各个方面用于N-糖基化分析的示例性基于磁性珠粒的样品制备工作流程。
图9展示根据本教示内容的各个方面获自利用自动化液体操作装置的多个APTS标记IgG聚糖的CE-LIF分析结果。
图10展示根据本教示内容的各个方面来自个别聚糖和聚糖混合物的CE-LIF分析结果。
具体实施方式
应了解,为了清楚起见,以下讨论将阐明申请人教示内容的实施例的各个方面,同时每当省略某些具体细节是适宜或恰当的时便省略某些具体细节。举例来说,在替代性实施例中,相似或类似特征的讨论可以略微简化。众所周知的想法或概念为简洁起见也可以不进行任何详细论述。技术人员应认识到,申请人教示内容的一些实施例可能不需要每次实施中的某些具体描述的细节,所述细节仅在本文中阐述以彻底理解实施例。类似地,将显而易知可以根据公共常识,在不脱离本发明的范围的情况下,易于对所述实施例进行更改或改变。实施例的以下详细描述不应经视为以任何方式限制申请人教示内容的范围。
根据本教示内容的各个方面,本文中所描述的方法、系统和试剂盒可用于糖结合物或聚糖的纯化和/或分析,其可实现完全自动化和/或相对于当前方案减少的样品制备时间。在一些方面,本文中所描述的方法可提供糖结合物分解和/或聚糖释放、荧光标记和聚糖纯化中的一或多个用于后续分析而无需耗时的样品制备步骤,如离心或真空-离心。实现高产量糖基化分布和定序分析的完全自动化对例如满足生物医药行业(例如生物治疗药物研发、生物标记发现)的当代需要并且在调节机构的蛋白质疗法的功效/安全性评估中可为至关重要的,所述调节机构的蛋白质疗法的功效/安全性评估需要高产量和可高度再现的糖基化筛选方法。除此需要外,用于糖基化分析的当前所用样品制备方案的主要障碍之一是缺乏简单的自动化,其当前需要具有离心能力的高端(昂贵)机器人系统。
根据各个方面,本文中所描述的示例性基于磁性珠粒的样品制备可在几个小时内进行而无需任何离心和/或真空离心步骤,因此使得能够进行快速、可完全自动化的分析,其可在聚糖释放和标记期间利用例如较短的保温时间、使用用于样品制备的液体操作机器人和/或多毛细管方法。如下所述,相对于习知基于离心的样品制备方案,例示性方法可因此改良处理时间、效率、再现性和自动化简易性。
在一个实施例中,举例来说,例示性方法一般包含以下五个个别步骤,但应了解包括较多或较少步骤的方法在本教示内容的范围内:1)糖结合物的去糖基化;2)聚糖捕获;3)聚糖标记;4)净化;以及5)聚糖分析(例如通过CE、LC、MS、NMR)。
将进一步理解,任何含有或怀疑含有聚糖或糖结合物的样品都可根据本教示内容使用,包括血液、血浆、血清、尿液或唾液的样品。另外,样品可含有游离聚糖(例如先前去糖基化的样品)和/或糖结合物。
可根据本教示内容分析的示例性糖结合物包括糖蛋白,如胎球蛋白、RNase B和抗体(例如IgG),所有都借助于非限制性实例。可利用的其它示例性糖结合物包括蛋白聚糖、鞘糖脂、硫酸软骨素、硫酸肝素、透明质酸、糖脂、糖胺聚糖、融合糖蛋白和抗体-药物结合物。与糖结合物关联的聚糖一般包含经由例如糖苷键共价键结于基本分子的一或多个糖单元(例如葡萄糖、岩藻糖、甘露糖、木糖、唾液酸N-乙酰葡糖胺(GlcNAc)、N-乙酰半乳糖胺(GalNAc)和低聚糖)。如通过所属领域的技术人员将了解,聚糖可包含多种碳水化合物单元、具有各种键和位置的支链或非支链和/或可经由N-键联糖基化(例如键联到蛋白质的天冬酰胺(Asn)残基的酰胺基氮的聚糖)、O-键联糖基化(例如键联到如O-GalNAc或O-GlcNAc蛋白质中氨基酸残基的氧原子的聚糖)、C-键联糖基化(例如添加到氨基酸序列中色氨酸残基的甘露糖)和磷酸-丝氨酸糖基化(例如键联到磷酸-丝氨酸中磷酸酯的聚糖)附接至基本分子的具有各种长度的低聚糖,所有都借助于非限制性实例。
去糖基化
在一些方面,分析糖结合物或与之相关联的聚糖的方法可包括去糖基化步骤,其使糖苷键断裂以使从糖结合物去除聚糖。应了解可利用所属领域中已知并且根据本教示内容改性的任何去糖基化试剂。借助于非限制性实例,根据本教示内容的方法和系统可利用PNGase F(例如从糖蛋白去除N-键联低聚糖)、PNGase A、其它内切糖苷酶(如O-糖苷酶、内切糖苷酶H和内切糖苷酶F)和外切糖苷酶(例如神经氨酸苷酶)、化学药剂(如肼)和其混合物。
如下文所详细论述,虽然由于PNGase F的稳定性、特异性和简单的样品制备条件,其在常规上在37℃下在隔夜保温下用于N-聚糖的酶促去糖基化,但是申请人通过在高温(例如大于37℃,约50℃)下进行去糖基化已实现显著减少的去糖基化时间。实际上,发现所释放聚糖的最大峰强度在50℃下在一小时保温时间之后出现,然而N-去糖基化方法在常规的37℃下进行地显著更短。
应了解鉴于本教示内容,分析聚糖的方法还可在先前已经去糖基化的样品(例如含有已经从蛋白质或其它生物聚合物解离的聚糖的样品)或仅含有聚糖的样品(例如聚糖标准物)上进行,其使得不需要去糖基化或分解步骤。
聚糖捕获
在糖结合物已分解,使得从其释放至少一部分聚糖之后,所释放聚糖可自去糖基化试剂(例如酶)和例如任何经解离多肽分离。根据本教示内容的各个方面,举例来说,磁性粒子的悬浮液可与样品混合,使得聚糖可变得与磁性珠粒关联。在一些方面,磁性粒子的悬浮液可包含乙腈,其可促进捕获所释放聚糖。在关联后,可施加磁场到混合物,以使吸引(例如下移,分离)关联有聚糖的磁性粒子,使得例如通过倒掉或抽吸上清液,可去除含有未关联去糖基化试剂(如酶)和剩余多肽的上清液。
申请人已出人意料地发现聚合物包经的磁性粒子(例如羧基包经的磁性珠粒)的甲酸酯改性表面可在捕获所释放聚糖或糖结合物中特别地有效。虽然通常认为从磁性珠粒表面延伸的带负电羧基和带负电聚糖(例如经唾液酸化)将彼此排斥,并且防碍聚糖捕获,但是申请人已发现羧基包经的磁性珠粒可有效并且高效地引起带电和/或不带电聚糖分离。这种结果与直觉相反,尤其考虑到大多数聚糖相对较小的分子量(亦即使得聚糖应更加易受到排斥力)。在不受特定理论束缚的情况下,相信结合缓冲剂(例如乙腈)在羧化珠粒周围充当拥挤试剂(crowding reagent)以使形成对聚糖捕获有利的环境。虽然对于申请人的知识而言,根据本教示内容,尚未将磁性珠粒技术应用到聚糖分离,但是这种根据本教示内容可供使用的羧基包经磁性珠粒可商购实例包含购自贝克曼库尔特公司(Beckman Coulter,Inc.)(布瑞亚市,加利福尼亚州,美国)的Agencourt Cleanseq磁性珠粒。
聚糖标记
一些糖分析方法需要标记聚糖以使得能够进一步分析和/或检测。借助于实例,使用CE-LIF分析聚糖可利用糖的化学衍生作用以便为其提供足够电荷和UV活性或荧光特性。因此,在一些方面,可进行聚糖标记步骤。在一些方面,聚糖可经由基于还原胺化的反应,例如使用以下中的一个:1-氨基芘-3,6,8-三磺酸(APTS)、8-氨基萘-1,3,6-三磺酸(ANTS)、2-邻氨基苯甲酸(2-AA)、2-氨基苯甲酸(2-AB),使用一或多种还原剂、催化剂和一定量的染料进行标记,所有都借助于非限制性实例。用于引发与标记试剂的反应的示例性还原剂包括氰基硼氢化钠(NaBH3CN)和2-甲基吡啶-硼烷(pic-BH3)或其它还原剂。在一些方面,可最优化还原剂或所述还原剂的用途以减少唾液酸损失。还将理解,虽然可使用各种染料浓度以使增加标记效率,但还会需要更高效的净化步骤以确保过量染料移除。
申请人已发现当聚糖与磁性粒子关联时或例如在从磁性粒子解离(例如洗脱)之后,可出现与聚糖的标记反应。举例来说,在一些方面,标记试剂可添加到具有乙酸的磁性粒子中,所述乙酸可有效地从聚糖与磁性粒子的关联洗脱聚糖。洗脱之后,然后可添加还原剂以引发标记试剂(例如染料)与聚糖的反应。
净化和聚糖分析
在一些方面,在已标记聚糖之后,可经由一或多个净化步骤去除过量标记试剂(例如未结合的APTS)。如上文所论述,举例来说,游离的经标记聚糖可经由添加乙腈与磁性珠粒关联。关联之后,可施加磁场到混合物以使吸引关联有经标记聚糖的磁性粒子,使得例如通过倒掉或抽吸上清液,可去除含有过量标记试剂的上清液。在一些方面,可添加一或多次乙腈以洗涤磁性珠粒和与之相关联的经标记聚糖。
在过量标记药剂经去除的情况下,经标记聚糖可从磁性珠粒释放(例如通过添加洗脱液,如水)。虽然可利用各种体积的试剂用于关联并且释放来自磁性粒子的聚糖以充分纯化经标记聚糖,但是应了解,纯化的程度与样品损失可成反比,所以可最优化获得足够纯化所必需的洗脱液量以最小化可能的样品损失。
添加洗脱液以从磁性粒子释放经标记聚糖之后,可再次施加磁场以从含有游离的经标记聚糖的洗脱物分离磁性粒子。然后可去除洗脱物(例如关于经下移磁性粒子的上清液)以供例如经由CE-LIF、LC、MS及NMR中的一种进行进一步分析。
当使用基于毛细管电泳分析(例如CE-LIF)分析时,聚糖的CE中的分离可使用适用于分离聚糖的凝胶组合物进行。合适的凝胶组合物可包括例如使用浓度约10mM-50mM的乙酸锂缓冲剂,其中缓冲剂的pH在约4与5.5之间。组合物进一步包含Mv在约100kDa与1000kDa之间浓度在约0.5%与5%之间的聚氧化乙烯。组合物还可包括浓度小于约60%的乙二醇。组合物还可含有分子量约10kDa并且浓度在0.5%与5%之间的直链聚丙烯酰胺(LPA)。
优选地,组合物可包含浓度在25与30mM之间pH约4.75的乙酸锂缓冲剂、浓度1%的聚氧化乙烯(Mv是约900kDa)、浓度约20%的乙二醇和浓度约3%的直链聚丙烯酰胺(MW是约10kDa)。特别优选的是,组合物中的乙酸锂浓度是约30mM。
实例
以上教示内容现将使用以下实例展现,提供以下实例出于展现目的而非限制本教示内容。如下所述,提供基于磁性珠粒的示例性快速并且高产量样品制备工作流程用于基于CE-LIF的N-糖基化分析,其中所有制备步骤可使用简单的液体操作机器人经简易地自动化。应指出,在下文所述的示例性工作流程中,避免了离心步骤和隔夜保温,其原本是常规聚糖制备方法的一部分。
示例性样品制备方案已展现使用具有复合物的代表性糖蛋白标准物、唾液酸化和高甘露糖型糖基化。如下文所论述,最优化所有个别制备步骤,如聚糖释放、荧光标记和APTS净化以减少基于磁性珠粒方法的处理时间和效率。所属领域的技术人员应了解,可调节下文所述的体积、浓度和时间以例如获得根据本教示内容的最优结果。
化学物质
水和乙腈是Chromasolv HPLC级别。IgG、胎球蛋白、RNase B、人类血清、乙酸、氰基硼氢化钠(NaBH3CN)、2-甲基吡啶-硼烷(pic-BH3)获自西格玛奥德里奇公司(Sigma Aldrich)(圣路易斯,密苏里州)。1-氨基芘-3,6,8-三磺酸酯(APTS)、碳水化合物分离凝胶(NCHO)、麦芽低聚糖梯和Agencourt Cleanseq磁性珠粒购自贝克曼库尔特公司(布瑞亚市,加利福尼亚州,美国)。去糖基化试剂盒(10μL糖蛋白溶液,1μL 10×变性缓冲剂,8μL水,2.5μL 10×G7缓冲剂,2.5μL 10%NP40,1μL PNGase F)购自新英格兰生物实验室(New England Biolabs)(伊普斯维奇,马萨诸塞州)。
毛细管电泳
APTS标记N-聚糖的毛细管电泳分布分析在装备有固态激光诱导荧光检测器(激发488nm,发射520nm)的PA800+自动化CE仪器(贝克曼库尔特公司通过Sciex销售)中进行。所有分离都在用N-CHO碳水化合物分离凝胶缓冲剂填充的50cm有效长度(总共60cm)中性包经的50μm i.d.毛细管柱(都来自Sciex)中完成。施加电场强度是500V/cm,其中阴极在注入侧处并且阳极在检测侧处(反向极性)。通过在1psi(6.89kPa)下的压力注入样品5秒。出于移动时间校正和定量目的,APTS标记麦芽糖(G2)作为内标物与每个样品共同注射。Karat 32版本9.1软件包(Sciex)用于数据获取和分析。
实例1
最优化聚糖释放的保温时间
利用液体操作机器人友好开放式96孔板格式,分析温度对糖结合物去糖基化的影响。由于在大于60℃温度下蒸发可导致蛋白质沉淀或缓冲剂蒸发(尤其小体积(例如10-50μL)),所以比较在50℃和37℃下关于IgG和胎球蛋白糖蛋白标准物去糖基化使用0.5、1、2、4、8和16小时保温的分解效率。每个分解反应时间点混合物含有7.7mU PNGase F,并且遵循制造商的方案制备。用各个分解策略制作三次释放,并且用各个释放制作三次重复,产生九个数据点/分解时间和温度。所释放聚糖经APTS标记并且通过CE-LIF分析。
虽然在两个保温策略之间没有观测到峰分布的显著差异(如通过峰面积百分比测量),但RFU值展现所释放聚糖量的改变。现参考图1,在37℃下的峰强度相对于50℃增加显著更加缓慢,其中在约一小时保温时间之后达到最大水平。与隔夜分解相比的面积百分比相似性表明使用较短保温可释放相同的糖基化图案(无分解偏差),主要差异在于所释放糖的量。更高温度聚糖释放加速了反应,并且因此,PNGase F分解在以下步骤中在50℃下进行一小时。
APTS标记最优化
分析用于标记的条件,以使达成常规基于离心方法关于峰强度和面积分布的标记效率,同时然而调整简单的液体操作机器人和基于磁性珠粒自动化。根据本教示内容的各个方面,在无隔夜保温和基于真空-离心的样品浓缩的情况下达到了高标记效率。
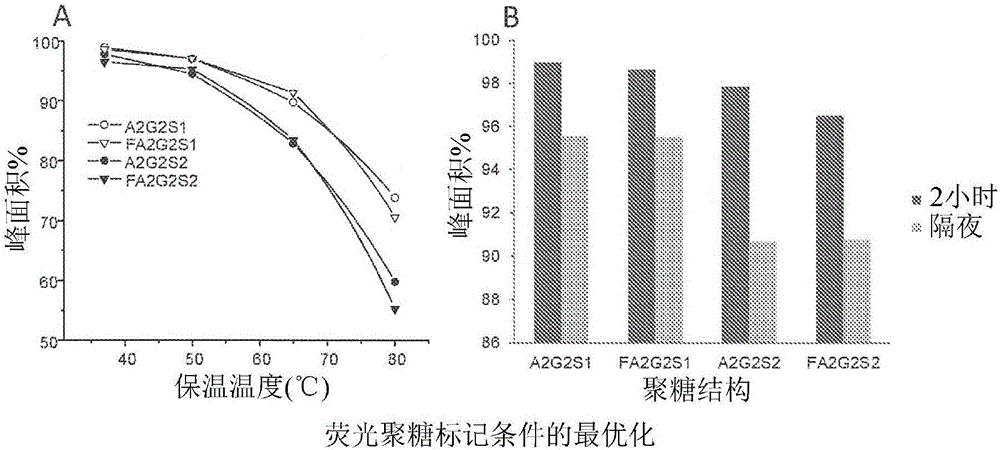
首先,将A2G2S2、A2G2S1、FA2G2S2和FA2G2S1的单和双唾液聚糖标准物用20mM APTS于15%乙酸中在37℃、50℃、65℃和80℃下一式两份地标记2小时。这些聚糖(A2G2和FA2G2)的未唾液酸化对应部分也经标记,并且用于掺加更高温度反应混合物以识别可能的温度诱导去唾液酸化。如图2A中展示,反应温度的增加显著升高了用于所有唾液酸化聚糖标准物的去唾液酸化方法。双唾液酸化标准物展现较大的唾液酸损失。平均起来,在50℃下观测到2%唾液酸损失,在65℃下是11%并且在80℃下是33%,其表明当在样品中预期唾液酸化结构时,谨慎选择的衍生温度在聚糖标记期间可为重要的。
如图2B中展示,在37℃下还检测到保温时间的影响,其中在隔夜保温和两个小时保温之间观测到一些差异。在隔夜保温的情况下,单唾液酸化结构展现3%酸损失,并且双唾液酸化结构展现6%唾液酸损失。
合并后,这些结果展现标记温度和保温时间在还原胺化反应中可为重要的。举例来说,虽然APTS标记较短的保温时间可降低信号强度,但图2B展现隔夜标记还可生成唾液酸损失。基于以上研究结果,这个示例性方法的其余部分利用在37℃下两小时的标记保温时间。
如表1(以下)中展示,为了补偿较短保温所降低的信号强度,分析催化剂浓度(乙酸)和APTS浓度对还原胺化反应的影响。使用20mM APTS于15、20和25%乙酸中标记单和双唾液酸化聚糖标准物(A2G2S2、A2G2S1、FA2G2S2和FA2G2S1),同时试图避免任何的唾液酸化损失。如表1(部分A)中展示,检查峰面积百分比展现并不存在可检测的唾液酸损失,同时获得了显著更高的峰强度,其中乙酸浓度增加(20%)。
表1(部分2)中描绘各种APTS浓度的影响以及图2和表1(部分A)的结果。使用20、40和80mM APTS于20%乙酸中在37℃下一式三份地标记麦芽低聚糖梯两小时。如表1(部分B)中展示,增加APTS浓度增加了标记效率。然而,因为下文所述的示例性基于磁性珠粒方法利用至少20μL的标记试剂,所以利用40mM APTS的更高体积,尽管80mM APTS展现了更高的标记效率。
利用更高的染料和催化剂浓度,使用40mM APTS于20%乙酸中在37℃下一式两份地标记来自100μg IgG、胎球蛋白和RNase B糖蛋白标准物的所释放聚糖两小时,并且与两小时和隔夜的初始标记策略(20mM APTS,15%乙酸,图2B)进行比较。如表1(部分C)中展示,与初始两小时标记相比,更高染料和催化剂浓度的组合导致~20%更高的标记效率而无任何唾液酸损失,然而小于隔夜标记的效率(其中检测到唾液酸损失)。总之,这些结果展现在37℃下用40mM APTS于20%乙酸中标记两小时可有效地增加标记效率,同时产生较少唾液酸损失。
表1.最优化标记条件以增加标记效率
基于磁性珠粒样品制备
如上所述,示例性方案利用用于样品制备的磁性珠粒以适应自动化,同时避免使难以自动化的离心步骤。
在这个示例性方案中,当复合碳水化合物从糖结合物释放后(亦即在聚糖释放之后纯化)并且当经萤光团标记(亦即在APTS标记之后纯化)时,羧基包经的磁性珠粒用于捕获所述复合碳水化合物。
为了清除APTS反应混合物(亦即为去除过量未结合的APTS),尝试测定获得足够纯化所必需的磁性珠粒悬浮液的最小量,同时最小化任何可能的样品损失。使用200μL磁性珠粒悬浮液一式三份地纯化APTS标记hIgG(复杂型)、胎球蛋白(高度唾液酸化)和RNase B(高甘露糖型)聚糖。结合和洗涤步骤是通过使用150μL 87.5%乙腈完成,同时洗脱步骤使用25μL水完成。大于150μL的磁性珠粒悬浮液和结合/洗脱溶液通过自动移液器可易于操控,并且可同样地通过简单的液体操作机器人使用常规移液管尖端或注射器调节。洗脱物通过CE-LIF在无任何进一步处理的情况下直接进行分析。还分析第二和第三洗脱份以评定首次洗脱的效率。发现当净化混合物经恰当地悬浮并且25μL水用于洗脱时,在珠粒上没有残余的可检测样品(亦即第二次和第三次洗脱产生负结果)。另一方面,当仅15μL水用于首次洗脱时,在后续洗脱中检测到剩余APTS标记聚糖的痕量。
重要的是,如图3A-C中展示,与文献中报道的常规样品净化方法相比,使用这个基于磁性珠粒净化方案观测到峰面积分布无差异,其表明针对珠粒的不同聚糖结构(中性、唾液酸化、高甘露糖)无明显偏差,同时大部分游离APTS在净化期间经去除。
在PNGase F分解之后,利用类似方法捕获所释放聚糖。在保温步骤以结合所释放聚糖之后,将含磁性珠粒的87.5%乙腈溶液添加到PNGase F反应混合物中。在这种情况下,然而,通过APTS水溶液(40mM于20%乙酸中)洗脱游离聚糖,接着添加还原剂(如1M pic-BH3于MeCN中或NaB3CN于THF中)以立刻引发标记反应而无任何中间步骤。此外,这个方法极其有效,并不需要任何基于真空离心样品预浓缩或任何其它纯化步骤以去除分解反应混合物中的剩余多肽链和PNGase F酶。
基于磁性珠粒样品制备方案
根据以上最优化和如图4中所示意性地描绘,进行以下示例性基于磁性珠粒聚糖样品制备方案。
现参考图4,示例性基于磁性珠粒聚糖样品制备方案以50℃下一小时PNGase F分解(步骤A)开始。然后,如步骤B中展示,示例性方法使用200μL磁性珠粒悬浮液于87.5%最终乙腈浓度中利用基于磁性珠粒分离从剩余多肽链和分解酶分离所释放聚糖。然后将管放在磁体上。在去除上清液之后,通过添加21μL 40mM APTS于20%乙酸中在同一管中从珠粒洗脱所捕获聚糖,并且还原胺化反应以添加7μL还原剂(如1M pic-BH3于MeCN中或NaB3CN于THF中)(步骤C)开始。在37℃下两个小时保温后,通过使用同一磁性珠粒和步骤B中的方法在步骤D中去除过量标记染料。在倒掉上清液之后,所捕获APTS-标记聚糖通过添加25μL HPLC水从珠粒洗脱,并且通过将管放在磁体上(步骤E)分离。去除洗脱物/上清液,并且通过CE-LIF(步骤F)对其分析。
方法的可靠性和再现性通过利用示例性基于磁性珠粒方案制备六个IgG、胎球蛋白和RNase B样品展现,并且与常规的隔夜培育和基于离心方案进行比较,其与如瓦拉第,C.(Varadi,C.)等人,通过毛细管电泳分析发炎性和恶性肺疾病中的结合球蛋白N-糖组改变(Analysis of haptoglobin N-glycome alterations in inflammatory and malignant lung diseases by capillary electrophoresis),电泳(Electrophoresis),2013.34(16):第2287页-第94页中所描述类似。三次重复与每次释放一起使用,产生54个数据集/制备平台。分析所有样品以呈现中性和稍微唾液酸化(组A)、高甘露糖(组B)和高度唾液酸化(组C)聚糖。曼-惠特尼成对比较(Mann-Whitney pairwise comparison)用于探索峰面积百分比的差异。
表2展现根据本教示内容的各个方面上述最优化方法的效率,其中除了使用较短保温的胎球蛋白的唾液酸化水平更高以外,方案之间的面积百分比无显著差异。通过使用基于完全磁性珠粒方案观测到极佳的再现性。曼-惠特尼成对比较用于探索峰面积百分比的差异。整合28个峰,在两种方法之间检测显著性(p)水平,其中仅4个峰展示显著差异(p<0.05)。所有不同的峰是高度唾液酸化胎球蛋白聚糖并且类似于关于标记最优化的先前论述,隔夜方法产生较低唾液酸化水平表明在还原胺化反应期间较短保温时间的重要性。通过基于磁性珠粒方案生成的峰1、2的显著更高面积百分比与峰5、7的较低值相关,其表明具有高唾液酸化率的去唾液酸化类型(四和三唾液酸化)增加了低唾液酸化类型(双和单唾液酸化)的量。
表2.检查28种N-聚糖的峰面积百分比的两种方法之间的测量差异
实例2
APTS标记最优化
分析用于标记的条件,以使达成常规基于离心方法关于峰强度和面积分布的标记效率,同时然而调整简单的液体操作机器人和基于磁性珠粒自动化。根据本教示内容的各个方面,在无隔夜保温和基于真空-离心的样品浓缩的情况下达到了高标记效率。
APTS标记的保温条件在37℃和50℃下使用0.5、1、2、4、8和16小时保温时间针对从三种IgG样品(100μg/样品)和三种胎球蛋白样品(100μg/样品)释放的聚糖进行测试。所应用标记条件与先前公布方案中的条件相同,亦即6μL的20mM APTS和2μL的1M NaBH3CN于THF中。如上,用各个释放制作三个复制品,产生九个数据点/标记条件。如图5所示,如在分解最优化期间,在50℃下观测到唾液酸化胎球蛋白聚糖的峰面积减少约2%,虽然还发现RFU值增加。在较长保温时间的情况下检测到增加的强度,其中在50℃下检测到显著更高强度。在此温度下,仅4小时的保温时间产生与37℃下隔夜反应的RFU值类似的RFU值。
为了进一步减少衍生时间,测定在两小时反应中仍获得高RFU值所要的最小APTS浓度。麦芽低聚糖梯样品在37℃、50℃和65℃下用20、40和80mM APTS标记,接着进行CE-LIF。现参考图6,标记温度的影响清楚地展示为,37℃标记方法揭示随着升高APTS浓度而稍微增加,同时检测到在50℃和65℃下显著更高的值。
这些结果展现标记温度在分析医药工业上重要的糖蛋白(如单克隆抗体)中可为至关重要的。举例来说,虽然在APTS标记期间较低的保温温度可降低RFU值,但是去唾液酸化的降低可有助于保存唾液酸化聚糖。基于以上研究结果,这个示例性方法的其余部分利用37℃标记保温温度。
用于液体操作机器人的基于磁性珠粒样品制备
为了最优化用于简单自动化的聚糖样品制备,避免包括真空离心在内的离心步骤。确切地说,如在本文中另外论述,申请人发现羧基包经的磁性珠粒可在捕获经释放和经标记聚糖中为有效的。最优化示例性APTS净化方案以提供足够磁性珠粒,同时最小化样品损失。一式三份地使用5、10、20、40、80、160和200μL磁性珠粒纯化APTS标记胎球蛋白和IgG聚糖。除基于磁性珠粒样品制备的简单操作以外,使用磁性珠粒的其它优点之一是其以小体积(例如20μL)的适用性。用150μL 87.5%乙腈进行结合和洗涤步骤,同时洗脱步骤仅利用25μL水,然后其直接通过CE-LIF分析。还评价第二和第三洗脱份以测定首次洗脱的效率。确定当在25μL中进行首次洗脱并且恰当地悬浮时,在珠粒上无残余样品,亦即第二次和第三次洗脱是负的。然而,当在仅15μL中进行首次洗脱时,检测到一些残余样品。
使用基于磁性珠粒净化方案在峰面积分布中没有发现差异,证明针对珠粒的不同聚糖无特定偏差。然而,如图7中展示,在基于磁性珠粒量的净化样品再现性中观测到显著差异。从重复三次基于磁性珠粒净化步骤计算RFU值的RSD%,揭示了在使用200μL磁性珠粒的情况下具有最高再现性。
PNGase F分解步骤之后,相同的基于磁性珠粒方法同样地用于聚糖捕获。在一小时PNGase F分解步骤之后,添加113μL乙腈到反应混合物(最终浓度87.5%)中。在用87.5%乙腈的一个洗涤步骤之后,通过21μL 40mM APTS于20%乙酸水溶液中洗脱聚糖。添加还原剂引发标记反应而不需要基于离心样品浓缩。
基于磁性珠粒样品制备方案
如图8中所示意性地描绘,进行以下示例性基于磁性珠粒聚糖样品制备方案。示例性基于磁性珠粒聚糖样品制备方案以50℃下一小时PNGase F分解开始,并且通过添加乙腈到反应混合物(最终浓度87.5%)中捕获所释放聚糖以使所释放聚糖与磁性珠粒关联。珠粒通过磁体下移并且去除上清液。聚糖通过21μL 40mM APTS于20%乙酸水溶液中洗脱。APTS标记反应以添加7μL还原剂(1M NaBH3CN于THF中)引发并且在37℃下保温两小时。再次添加150μL乙腈(最终浓度87.5%)以从磁性珠粒捕获经标记聚糖。去除上清液,并且珠粒和聚糖用乙腈(150μL,最终浓度87.5%)洗涤两次。然后添加25μL HPLC水以洗脱经标记聚糖,使含有经标记聚糖的洗脱物经受CE-LIF。
以上数据展现当与利用隔夜基于离心分解/标记的常规聚糖样品制备方案相比时,根据本教示内容的方法可提供在约四个小时内相当的结果。此外,在不需要如常规方法中任何离心和或真空离心步骤的情况下,完全自动化可利用用于高产量样品处理的简单液体操作机器人,例如在具有极佳产量和高再现性的96孔板中实现。
基于自动化磁性珠粒样品制备
在高产量样品处理系统中包括内切糖苷酶分解、快速萤光团标记和净化的全自动方案中利用在教示内容内的样品制备方法。液体操作机器人(Biomek FXp实验室自动化工作站(Biomek FXp Laboratory Automation Workstation),贝克曼库尔特公司,布瑞亚市,加利福尼亚州)与毛细管电泳激光诱导萤光(CE-LIF)装置(PA 800加上,贝克曼库尔特公司,通过Sciex销售,布瑞亚市,加利福尼亚州)一起利用。
自动化工作站是具有96孔板固持器、磁性表架、1000μL和25μL移液管尖端、四分之一贮存器和样品和试剂小瓶的设备。四分之一贮存器含有乙腈(西格玛奥德里奇公司,密苏里州)和Agencourt CleanSeq磁性珠粒(贝克曼库尔特公司,布瑞亚市,加利福尼亚州)。试剂小瓶含有用于PNGase F分解(Prozyme,加利福尼亚州)的试剂8-氨基芘-1,3,6-三磺酸酯(ATPS)(贝克曼库尔特公司,通过Sciex销售,布瑞亚市,加利福尼亚州)于20%乙酸中和1M氰基硼氢化钠(于THF中)。为了减少蒸发引起的体积损失,移液管盒盖用于遮盖四分之一贮存器。糖蛋白样品在Biomek涡流加热器部件中保温。为了更好的再悬浮,在样品板下施加额外板,在此情况下将磁体放在样品板下而非放在侧面。以这种方式磁体可使磁性珠粒下移到小瓶底部并且在快速抽吸/分配下,珠粒易于再悬浮。
使用PNGase F的酶促分解在50℃下进行1小时,接着在含磁性珠粒的87.5%乙腈介质上进行聚糖捕获。结合碳水化合物的APTS标记通过添加氰基硼氢化钠在珠粒上原位引发,并且在37℃下保温2小时。在酶促分解之后,聚糖通过添加100%乙腈再捕获,导致关于乙腈的浓度是87.5%。APTS标记反应通过添加21μl 40mM APTS于20%乙酸中和7μl 1M氰基硼氢化钠于THF中在37℃下在珠粒上原位开始持续2小时。随后,经标记聚糖通过添加100%乙腈以达到最终浓度87.5%再次在珠粒上再捕获。然后,珠粒反复地用87.5%乙腈介质洗涤以实现高效染料移除。萤光团标记聚糖通过添加25μL水从珠粒洗脱,并且准备CE-LIF(488nm激发,520nm发射)。为了分离,20cm有效长度NCHO毛细管(贝克曼库尔特公司通过Sciex销售)(30cm总长度,50μm ID)与含有1%聚氧化乙烯(Mv~900,000,西格玛-阿尔德里奇)的25mM乙酸锂(pH 4.75)先前技术电解质一起使用。施加电压是30kV,并且分离温度是20℃。通过3psi压力注射样品6秒。这个组合物发现允许在短时间段内快速分离聚糖。整个液体操作方案使用Biomek软件版本4.0编程。CE-LIF数据通过Karat 32软件包(贝克曼库尔特公司,通过Sciex销售,布瑞亚市,加利福尼亚州)获取并且分析。
实验室自动化工作站提供快速的样品制备选择方案、在原来生物样品基质上减少的流体诱导剪应变和减至最小的污染风险。为了更高精确性液体操作或未知的来源和样品的量,可使用导电移液管尖端,其能够进行高精度液体操作。由于在液体操作系统中可利用的大量平台位置,用于CE-LIF分析的缓冲剂制备也自动完成,包括分离筛分基质的溶解步骤。
所得萤光团标记聚糖经受CE-LIF分析,其针对快速分离最优化以适应全自动制备方法的高产量。图9中展示从由液体操作机器人产生的96孔板连续注射的APTS标记IgG聚糖的电泳图。在小于3分钟内获得主要IgG聚糖的基线分离。这个分离方法可易于应用于大规模方法,其中数百样品的快速分析是至关重要的,如在克隆选择中。
在本文中论述关于自动化方法更加特定的程序。
在快速抽吸并且分配珠粒再悬浮液之后,从四分之一贮存器添加200μl Agencourt Cleanseq磁性珠粒到样品板。一般来说,添加磁性粒子在方法第二部分的染料(标记)移除步骤,但在第一步骤添加珠粒使得能够使用用于样品的所有96孔板,从而不需要用于样品的单独孔和珠粒制备。从这一步骤到染料(标记)清洗步骤,珠粒通过磁性表架始终保持在壁上。已发现由于珠粒损失降低,使用这个可产生改良的结果。
在30秒等待之后,去除上清液(储存溶液)。液体去除始终从孔的底部以较低额抽吸速度进行。在这种情况下,在初始下移期间可捕获磁体不可下移的那些磁性珠粒,同时液位降低。
从样品货架或贮存器添加20μL糖蛋白样品/孔到样品板(96孔板,总共约960μL样品)。使用这个量的样品足以遮盖含液体珠粒,从而防止珠粒变干。
从试剂货架向每个样品添加1μL变性缓冲剂(NEB 10×变性缓冲剂)到样品板(96孔板,总共约96μL缓冲剂)。每个样品在65℃下在涡流振荡器(1000rpm)上保温10分钟。
在10分钟保温步骤的同时,在试剂板或贮存器上每个样品混合2.5μL NP-40(NEB10%NP-40)、2.5μL反应缓冲剂(NEB 10×G7反应缓冲剂)、3μL水和1μL PNgase F酶(NEB)(96孔板,总共约240μL NP-40和反应缓冲剂,总共约96μL PNgase F酶和约288μL水)。这个目前是分解混合物。与保温步骤并行的酶促分解的混合试剂使得样品制备步骤之间时间减少。节温器上温度降低到50℃。
添加19μL分解混合物到每个孔(96孔板,总共约1824μL分解混合物),全部样品体积是30μL。这个溶液添加在涡流上进行,不需要实验室器皿移动。
样品在50℃下在涡流振荡器(1000rpm)上保温60分钟。
添加210μL 100%乙腈/样品以获得87.5%乙腈最终浓度(96孔板,总共约20.16mL乙腈)。这个溶液添加在涡流单元上进行以防止珠粒由于磁体而强有力地粘住孔壁。在添加期间,使用不同的移液技术。由于乙腈从移液管尖端溢出,在溶液之后抽吸另外的空气。当分配时,超过样品水平推出空气,然后分配乙腈同时向上移动尖端。使用这个移液技术足以在水性样品中混合有机溶液而不会制造单独的层。
以1600rpm在室温(25℃)下使样品涡旋20秒。
材料在室温(25℃)下保温2分钟和40秒以允许聚糖再捕获(总共聚糖捕获时间是3分钟)。在3分钟聚糖捕获步骤的同时,在试剂板或贮存器上混合7μL 1M氰基硼氢化钠于THF中和21μl 20mM APTS(96孔板,总共约672μL 1M氰基硼氢化钠和2.016mL20mM APTS)。这个目前是染色/标记溶液。
样品板安放回到磁性表架上。在30秒暂停之后,珠粒用磁体捕获后,去除上清液。在上清液去除之后,每孔添加28μL标记染料溶液(96孔板,总共约2.668mL染色溶液)。材料在37℃下在涡流振荡器(1000rpm)上保温2小时。
在涡流单元上向每个样品添加196μL 100%乙腈(96孔板,约18.816mL乙腈)以使聚糖再粘结到珠粒。使样品以1600rpm在室温(25℃)下涡旋20秒,并且然后使得样品在室温(25℃)下培育2分钟和40秒以供聚糖捕获(全部聚糖捕获时间是3分钟)。
样品板安放回到磁性表架上。在30秒暂停之后,使得珠粒用磁体捕获,去除上清液。
通过保持磁性珠粒始终在壁上,使用如染料清洗步骤中的类似原理可进行聚糖捕获,效率可为较低的。因此,珠粒的再悬浮液是优选的。在有机介质中,当使用乙腈时,珠粒展现对孔壁的较强吸引力,并且即使用强涡旋也难以去除这些珠粒。另外,珠粒用87.5%乙腈反复地洗涤,但由于快速的乙腈蒸发,这个导致浓度随时间的推移而改变。
为了获得良好的再悬浮液,并且避免浓度改变,可利用以下程序,重复3次。
a.添加20μl水。在水溶液中,CleanSeq珠粒不大可能粘结到壁上,并且通过简单的涡旋步骤可易于再悬浮。
b.使样品在1600rpm下在室温(25℃)下涡旋10秒。
c.添加140μl 100%乙腈。在这种情况下在方案期间使用仅100%乙腈,因此即使其经蒸发,浓度仍保持相同。
d.使样品在1600rpm下在室温(25℃)下涡旋20秒。
e.在室温(25℃)下保温2分钟和40秒以供聚糖再捕获(全部聚糖捕获时间是2分钟)。
f.样品板安放回到磁性表架上。
e.在30秒暂停之后,珠粒用磁体捕获后,去除上清液。
通过使样品在1600rpm下涡旋30秒用20μl水洗脱样品,然后样品板安放回到磁性表架上,并且在30秒之后,转移样品到通用小瓶中,准备使用毛细管电泳分析。
在教示内容内使用CE-LIF完成个别聚糖(FA2G2、A2G2、FA2G1、A2G1、FA2和A2)以及个别聚糖混合物的分析。使用CE的分离用含有以下的凝胶组合物进行:浓度30mM pH 4.75的乙酸锂缓冲剂、浓度1%的聚氧化乙烯(Mv约900kDa)、浓度约20%的乙二醇和浓度约3%的直链聚丙烯酰胺(MW约10kDa)。分析结果展示于图10中。
参考文献
本文中所列举的所有参考文献都以其全文引用的方式并入。
1.博焦,M.(Bogyo,M.)和P.M.罗德(P.M.Rudd),新型技术和其对‘组学’研究的影响(New technologies and their impact on'omics'research).化学生物学的当前观点(Curr Opin Chem Biol.),2013.17(1):第1页-第3页.doi:10.1016/j.cbpa.2013.01.005。
2.前田,E.(Maeda,E.)等人,在重组单克隆抗体药物中非人类N-聚糖作为微小成分的分析(Analysis of Nonhuman N-Glycans as the Minor Constituents in Recombinant Monoclonal Antibody Pharmaceuticals).分析化学(Analytical Chemistry)(华盛顿特区,美国),2012.84(5):第2373页-第2379页。
3.马,S.(Ma,S.)和W.那莎贝(W.Nashabeh),通过具有激光诱导萤光检测的毛细管电泳对嵌合重组单克隆抗体的碳水化合物分析(Carbohydrate Analysis of a Chimeric Recombinant Monoclonal Antibody by Capillary Electrophoresis with Laser-Induced Fluorescence Detection).分析化学(Analytical Chemistry)(华盛顿特区,美国),1999.71(22):第5185页-第5192页。
4.罗伊,L.(Royle,L.)等人,在具有专用资料库软件的96孔板平台上对血清N-聚糖的基于HPLC分析(HPLC-based analysis of serum N-glycans on a 96-well plate platform with dedicated database software).分析生物化学(Analytical Biochemistry),2008.376(1):第1页-第12页。
5.伊万里斯塔,R.A.(Evangelista,R.A.),A.哥特曼(A.Guttman)和F.-T.A.陈(F.-T.A.Chen),具有8-氨基芘-1,3,6-磺酸酯的醛糖的酸催化还原胺化反应(Acid-catalyzed reductive amination of aldoses with 8-aminopyrene-1,3,6-trisulfonate).电泳(Electrophoresis),1996.17(2):第347页-第51页。
6.欧拉佳,M.(Olajos,M.)等人,用于通过具有发光二极管诱导萤光检测的多毛细管凝胶电泳对复合碳水化合物进行分析的样品制备(Sample Preparation for the Analysis of Complex Carbohydrates by Multicapillary Gel Electrophoresis with Light-Emitting Diode Induced Fluorescence Detection).分析化学(Analytical Chemistry)(华盛顿特区,美国),2008.80(11):第4241页-第4246页。
7.他恩替诺,A.L.(Tarentino,A.L.),C.M.勾美滋(C.M.Gomez)和T.H.普拉美(T.H.Plummer),通过肽:N-糖苷酶F对天冬酰胺键联聚糖的去糖基化(Deglycosylation of asparagine-linked glycans by peptide:N-glycosidase F).生物化学(Biochemistry),1985.24(17):第4665页-第4671页。
8.周,H.(Zhou,H.)等人,在家用微波中PNGase F催化去-N-糖基化(PNGase F catalyzes de-N-glycosylation in a domestic microwave).分析生物化学(Analytical Biochemistry),2012.427(1):第33页-第35页。
9.绍博,Z.(Szabo,Z.),A.哥特曼(A.Guttman)和B.L.卡吉尔(B.L.Karger),通过压力循环技术从糖蛋白快速释放N-键联聚糖(Rapid Release of N-Linked Glycans from Glycoproteins by Pressure-Cycling Technology).分析化学(Analytical Chemistry)(华盛顿特区,美国),2010.82(6):第2588页-第2593页。
10.帕慕,A.K.(Palm,A.K.)和M.V.诺瓦特尼(M.V.Novotny),通过质谱使得聚糖质量标测糖蛋白的整体式PNGase F酶微反应器(A monolithic PNGase F enzyme microreactor enabling glycan mass mapping of glycoproteins by mass spectrometry).快速通讯质谱(Rapid Commun Mass Spectrom).,2005.19(12):第1730页-第8页。
11.桑多瓦尔,W.N.(Sandoval,W.N.)等人,使用微波辅助酶催化去糖基化来快速去除N-键联低聚糖(Rapid removal of N-linked oligosaccharides using microwave assisted enzyme catalyzed deglycosylation).质谱分析国际期刊(International Journal of Mass Spectrometry),2007.259(1-3):第117页-第123页。
12.哥特曼,A.(Guttman,A.)等人,还原标记有1-氨基芘--3,6,8-磺酸酯的低聚糖的高分辨率毛细管凝胶电泳(High-resolution capillary gel electrophoresis of reducing oligosaccharides labeled with 1-aminopyrene-3,6,8-trisulfonate).分析生物化学(Anal Biochem.),1996.233(2):第234页-第42页。
13.哥特曼,A.,F.-T.A.陈和R.A.伊万里斯塔,通过毛细管凝胶电泳分离1-氨基芘-3,6,8-磺酸酯标记的天冬酰胺键联胎球蛋白聚糖(Separation of1-aminopyrene-3,6,8-trisulfonate-labeled asparagine-linked fetuin glycans by capillary gel electrophoresis).电泳(Electrophoresis),1996.17(2):第412页-第17页。
14.哥特曼,A和T.普利切特(T.Pritchett),对由1-氨基芘-3,6,8-三磺酸衍生的高甘露糖型低聚糖进行毛细管凝胶电泳分离(Capillary gel electrophoresis separation of high-mannose type oligosaccharides derivatized by 1-aminopyrene-3,6,8-trisulfonic acid).电泳(Electrophoresis),1995.16(10):第1906页-第11页。
15.如哈克,L.R.(Ruhaak,L.R.)等人,制备APTS标记N-聚糖的最优化工作流程,其允许使用48通道多路复用CGE-LIF对人类血浆糖组进行高产量分析(Optimized Workflow for Preparation of APTS-Labeled N-Glycans Allowing High-Throughput Analysis of Human Plasma Glycomes using 48-Channel Multiplexed CGE-LIF).蛋白质组研究期刊(Journal of Proteome Research),2010.9(12):第6655页-第6664页。
16.如哈克,L.R.等人,2-甲基吡啶-硼烷:用于通过还原胺化反应进行低聚糖标记的无毒还原剂(2-picoline-borane:a non-toxic reducing agent for oligosaccharide labeling by reductive amination).蛋白质组研究(Proteomics.),2010.10(12):第2330页-第6页。
17.绍博,Z.等人,通过CE-LIF和CE-MS对糖蛋白进行聚糖分析的改良样品制备方法(Improved sample preparation method for glycan analysis of glycoproteins by CE-LIF and CE-MS).电泳(Electrophoresis),2010.31(8):第1389页-第1395页。
18.苏,Y.H.(Su,Y.H.)等人,通过羧化磁性珠粒去除高分子量DNA促进检测尿液中的突变K-ras DNA(Removal of high-molecular-weight DNA by carboxylated magnetic beads enhances the detection of mutated K-ras DNA in urine).纽约科学院年鉴(Ann N Y Acad Sci.),2008.1137:82-91。
19.维拉,A.M.(Vila,A.M.)等人,用于蛋白质组研究分析的基于新型磁性珠粒免疫沉淀策略的发展(Development of a new magnetic beads-based immunoprecipitation strategy for proteomics analysis).蛋白质组研究期刊(J Proteomics.),2010.73(8):第1491页-第501页。
20.许,Y.(Xu,Y.)等人,用于纯化染料标记DNA定序片段的微流体芯片中固相可逆不移动性(Solid-Phase Reversible Immobilization in Microfluidic Chips for the Purification of Dye-Labeled DNA Sequencing Fragments).分析化学(Analytical Chemistry),2003.75(13):第2975页-第2984页。
21.博基曼,C.(Bergemann,C.)等人,用于医疗、生物化学和分子生物应用的磁性离子交换纳米粒子和微米粒子(Magnetic ion-exchange nano-and microparticles for medical,biochemical and molecular biological applications).磁性和磁性材料期刊(Journal of Magnetism and Magnetic Materials),1999.194(1-3):第45页-第52页。
22.叶,C.H.(Yeh,C.H.)等人,用于糖肽富集的基于磁性珠粒亲水性相互作用液相色谱法(Magnetic bead-based hydrophilic interaction liquid chromatography for glycopeptide enrichments).色谱法杂志A辑(J Chromatogr A.),2012.1224:70-8。
23.卢,D.(Loo,D.),A.琼斯(A.Jones)和M.M.希尔(M.M.Hill),用于生物标记发现的凝集素磁性珠粒阵列(Lectin magnetic bead array for biomarker discovery).蛋白质组研究期刊(J Proteome Res.),2010.9(10):第5496页-第500页。
24.瓦拉第,C.(Varadi,C.)等人,通过毛细管电泳分析发炎性和恶性肺疾病中的结合球蛋白N-糖组改变(Analysis of haptoglobin N-glycome alterations in inflammatory and malignant lung diseases by capillary electrophoresis),电泳(Electrophoresis),2013.34(16):第2287页-第94页。
本文所用的部分标题仅用于组织目的且不欲视为限制。虽然结合各种实施例来描述申请人的教示内容,但并不打算将申请人的教示内容限制为这些实施例。与其相反,本申请人的教示内容涵盖如所属领域的技术人员将了解的各种替代方案、修改方案以及等效物。
- 还没有人留言评论。精彩留言会获得点赞!