功能活性增强的龙眼果肉多糖及其基于内源蛋白质结合的绿色改性制备方法与流程
本发明属于功能食品加工技术领域,具体涉及一种功能活性增强的龙眼果肉多糖及其基于内源蛋白质结合的绿色改性制备方法。
背景技术:
龙眼(dimocarpuslonganlour.)是无患子科经济作物,在我国主要分布于广东、广西、福建和海南等省,其种植面积和产量远大于其他主产国。龙眼果肉是药典收录的药食兼用水果,不仅风味独特、营养丰富,还能治疗/改善气血不足、心悸怔忡、失眠健忘、贫血、脾虚泄泻等症状,在“价值驱动”的食品消费新常态下深受消费者喜爱。龙眼果实采收期短、上市集中、贮藏保鲜难度大,除鲜食外大部分加工为干果、果脯和果汁等产品,经济附加值较低,备受推崇的“高值”功能成分未得到有效开发。
特色果蔬资源的特异功能因子开发在食品、生物和医药领域引起广泛关注。多糖是龙眼干果肉免疫调节、抗肿瘤、抗氧化的重要物质基础,其含量高达35%,具有良好的开发利用潜质。动物实验研究发现,龙眼果肉多糖在体内产生显著有益效果的剂量较大(100~200mg·kg-1·d-1),即偏弱的生物活性成为其实际应用的瓶颈。龙眼果肉多糖的生物活性与其结构密切相关,有研究通过羧甲基化、乙酰化、硫酸酯化等结构修饰增强其功效,以此提高其应用价值。然而,上述传统的改性技术通常采用强酸、强碱和有毒害的有机试剂(如一氯乙酸、乙酸酐、正丁醇等)的反应体系,存在试剂残留的安全隐患。亦有研究物理方法对龙眼果肉多糖进行改性,如超声波法,但其生物活性反而降低。
前期研究发现,龙眼果肉多糖与蛋白质在湿热条件下产生美拉德反应,蛋白质氨基与多糖末端还原醛基的共价交联(希夫碱),且内源性蛋白质的共价结合能有效增强多糖的抗氧化活性、免疫调节活性和抗肿瘤活性。目前,涉及多糖与蛋白质美拉德反应"羰基化合物(还原糖类)和氨基化合物(氨基酸和蛋白质)间的反应,经过复杂的历程最终生成棕色甚至是黑色的大分子物质类黑精或称拟黑素,所以又称羰氨反应"的相关研究主要关注多糖共价结合对蛋白质结构和功能特性的影响,如:通过葡聚糖共价结合增强nisin的抑菌活性和抗氧化活性;通过阿拉伯半乳聚糖共价结合,减弱荞麦过敏蛋白的抗原性,并增强其溶解性和乳化能力。美拉德反应应用于多糖的蛋白质结合改性尚未见报道。
现有相关技术存在的问题归纳为以下三点:
(1)龙眼果肉多糖的生物活性整体偏弱,通常依靠活性追踪法筛选分离其高活性组分,但高活性组分的含量较低,不能满足开发利用的需求。
(2)传统的羧甲基化、乙酰化、硫酸酯化等化学改性法虽能增强龙眼果肉多糖的生物活性,但存在有毒有害试剂残留的安全隐患。超声波等物理改性法虽安全,但并不能有效提升龙眼果肉多糖的生物活性。
(3)美拉德反应在食品呈香、呈味和呈色方面引起广泛关注,并逐渐延伸至食品成分的功能修饰。多糖与蛋白质的美拉德反应在蛋白质结构和功能特性改良方面的应用方兴未艾,但对多糖结构和生物活性的影响却鲜见报道。关于龙眼果肉多糖的蛋白质结合改性方法及其效用尚未见报道。
技术实现要素:
为解决现有技术的不足,本发明提供了一种功能活性增强的龙眼果肉多糖及其基于内源蛋白质结合的绿色改性制备方法。
一种功能活性增强的龙眼果肉多糖的基于内源蛋白质结合的绿色改性制备方法,包括以下步骤:通过美拉德反应利用龙眼果肉蛋白质对龙眼果肉多糖进行共价结合改性,得到基于内源蛋白质结合的功能活性增强的龙眼果肉多糖。
具体的,功能活性增强的龙眼果肉多糖的基于内源蛋白质结合的绿色改性制备方法,包括以下步骤:
1)采用碱提酸沉法从鲜龙眼果肉中分离蛋白质,保留分离蛋白质后的浸提上清液。
具体的,步骤1)中:先以碱法对鲜龙眼果肉进行常温浸提,通过离心分离得到提取液,再在等电点所处的酸性条件下沉淀制备龙眼果肉蛋白,沉淀蛋白质后的浸提上清液待用于分离制备龙眼果肉多糖。
2)从步骤1)得到的浸提上清液中通过醇沉法制备龙眼果肉多糖。
具体的,将步骤1)中沉淀蛋白质后的浸提上清液进行真空浓缩后,再通过醇沉法分离制备龙眼果肉多糖。优选的,用乙醇进行醇沉。
3)通过美拉德反应诱导步骤1)得到的龙眼果肉蛋白质与步骤2)得到的龙眼果肉多糖进行共价结合,得到基于内源蛋白质结合的功能活性增强的龙眼果肉多糖。
优选的,步骤3)中,在温度为55~65℃、相对湿度为70%~80%的条件下加热反应4~6d。
具体的,本发明所提供的基于内源蛋白质结合的龙眼果肉多糖的绿色改性制备方法,包括以下步骤:
步骤1)为:取龙眼鲜果肉,加2~4倍质量的蒸馏水,在10000~12000r/min下间歇高速均质2~4次,每次2~4min;均质匀浆补加5~7倍质量的蒸馏水,调节匀浆ph值为8~9,常温搅拌浸提3~5h;浸提结束后,采用4000~5000r/min离心8~12min,过滤分离上清液a,调节其ph值为4.5~5.5,静置2~4h后采用4000~5000r/min离心8~12min,分离沉淀a和上清液b;沉淀a采用ph值为4.5~5.5的蒸馏水洗涤后冷冻干燥,得到龙眼果肉蛋白质。
采用高速均质进行果肉破碎的有益效果:原料粒度对目标物质提取率有显著影响,高速均质通过强的机械和液力剪切作用将龙眼果肉直接破碎,具有提取速度快、温度低、能耗低和提取得率高的特点。采用碱法进行常温浸提的有益效果:龙眼果肉多糖和蛋白质在弱碱性条件下的溶解度较高,碱法浸提能同时增大多糖和蛋白质的溶出,增加提取得率;常温浸提可防止蛋白质的热变性,有利于促进与多糖的美拉德共价结合。
步骤2)为:取步骤1)得到的所述上清液b调节至ph为中性,经真空浓缩至1/3~1/5体积后加入乙醇至体积浓度为70~80%,并置于3~5℃下静置10~14h沉淀多糖;采用4000~5000r/min离心8~12min分离沉淀b,以体积浓度为70~80%的乙醇溶液洗涤沉淀b,待乙醇挥发后加水复溶,冷冻干燥,得到龙眼果肉多糖。
采用连续分步法制备龙眼果肉蛋白质和多糖的有益效果:连续分步制备果肉蛋白质和多糖,不仅可以简化提取物制备步骤、节约时间和成本,还可以避免多糖醇沉过程中的蛋白质共沉淀,提高多糖的纯度,增强多糖和蛋白质美拉德反应的可控性。
步骤3)为:称取质量比为4:1~2:1的步骤1)得到的所述龙眼果肉蛋白质和步骤2)得到的所述龙眼果肉多糖,加水震荡至充分溶解,采用4000~5000r/min离心8~12min分离上清液c;所述上清液c经冷冻干燥,得到龙眼果肉多糖和龙眼果肉蛋白质的均一混合物,将所述均一混合物置于恒温恒湿干燥箱内,在温度60~70℃、相对湿度70%~80%的条件下加热反应4~6d;反应终止后,加入少量蒸馏水复溶混合物,冷冻干燥,得到功能活性增强的龙眼果肉多糖。
采用恒温恒湿法制备龙眼果肉多糖-蛋白质复合物的有益效果:通过恒温恒湿环境下的美拉德反应,促进多糖和蛋白质进行共价结合,能够增强多糖-蛋白质复合物的稳定性,并增加共轭产物的生成量。
本发明还提供了根据上述制备方法制备得到的基于内源蛋白质结合后功能活性增强的龙眼果肉多糖。
总体上,本发明所提供的制备方法可以分步提取获得高纯的龙眼果肉蛋白质和龙眼果肉多糖,并进一步以美拉德反应诱导的内源性蛋白质共价结合对龙眼果肉多糖进行绿色改性,其相比其他化学改性法,具有安全性高、操作简便、增效显著等优势。该方法得到的改性多糖的抗氧化活性、免疫调节活性和抗肿瘤活性相比改性前的多糖或蛋白质均显著增强。
附图说明
图1是本发明所提供的基于内源蛋白质结合的龙眼果肉多糖的绿色改性制备方法的流程图。
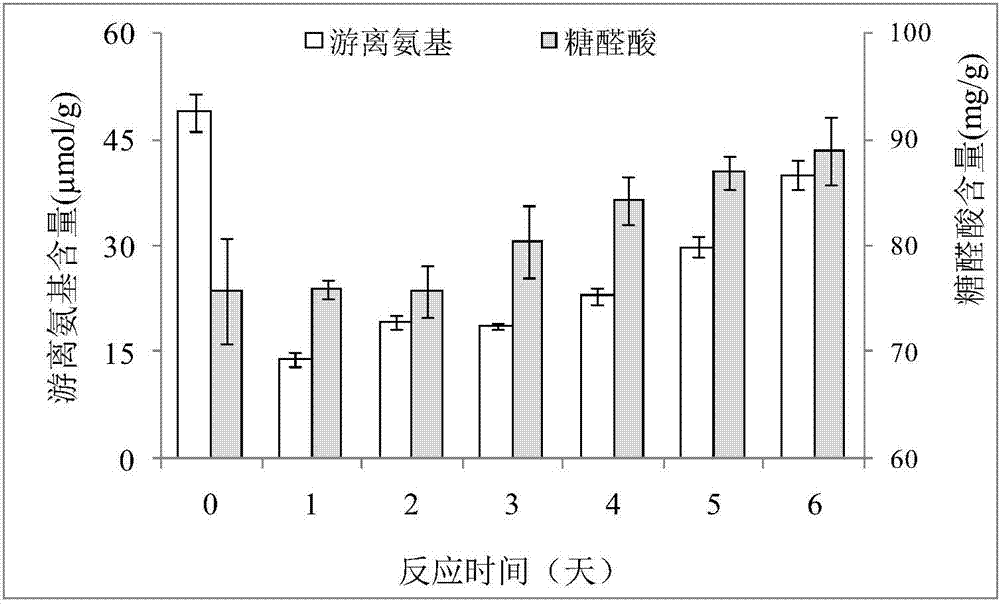
图2是为实施例1的制备过程中龙眼果肉多糖和蛋白质美拉德反应过程中的游离氨基和糖醛酸含量变化。
图3是为实施例1的制备过程中龙眼果肉多糖和蛋白质美拉德反应过程中的色泽变化趋势。
图4是为基于实施例1的制备过程中各时间段的产物的抗氧化活性。
图5是为基于实施例1的制备过程中各时间段的产物的抗肿瘤活性。
图6是为基于实施例1的制备过程中各时间段的产物的免疫调节活性。
具体实施方式
以下对本发明的原理和特征进行描述,所举实施例只用于解释本发明,并非用于限定本发明的范围。
实施例1
制备功能活性增强的龙眼果肉多糖,流程如图1所示。
步骤1):取龙眼鲜果肉,加3倍质量的蒸馏水,在11000r/min下间歇高速均质3次,每次3min;均质匀浆补加6倍质量的蒸馏水,调节匀浆ph值为8.5,常温搅拌浸提4h;浸提结束后,采用4500r/min离心10min,过滤分离上清液a,调节其ph值为5,静置3h后采用4500r/min离心10min,分离沉淀a和上清液b;沉淀a采用ph值为5的蒸馏水洗涤后冷冻干燥,得到龙眼果肉蛋白质。
步骤2):取步骤1)得到的上清液b调节至ph为中性,经真空浓缩至1/4体积后加入乙醇至体积浓度为75%,并置于4℃下静置12h沉淀多糖;采用4500r/min离心10min分离沉淀b,以体积浓度75%的乙醇溶液洗涤沉淀b,待乙醇挥发后加水复溶,冷冻干燥,得到龙眼果肉多糖。
步骤3):称取质量比为3:1的步骤1)得到的龙眼果肉蛋白质和步骤2)得到的龙眼果肉多糖,加水震荡至充分溶解,采用4500r/min离心10min分离上清液c;上清液c经冷冻干燥,得到龙眼果肉多糖和龙眼果肉蛋白质的均一混合物。将均一混合物置于恒温恒湿干燥箱内,在温度60℃、相对湿度75%的条件下加热反应5d;反应终止后,加入少量蒸馏水复溶混合物,冷冻干燥,制备得到基于内源蛋白质结合的功能活性增强的龙眼果肉多糖。
实施例2
制备功能活性增强的龙眼果肉多糖
步骤1):取龙眼鲜果肉,加2倍质量的蒸馏水,在12000r/min下间歇高速均质2次,每次4min;均质匀浆补加5倍质量的蒸馏水,调节匀浆ph值为9,常温搅拌浸提3h;浸提结束后,采用5000r/min离心8min,过滤分离上清液a,调节其ph值为5.5,静置2h后采用5000r/min离心8min,分离沉淀a和上清液b;沉淀a采用ph值为5.5的蒸馏水洗涤后冷冻干燥,得到龙眼果肉蛋白质。
步骤2):取步骤1)得到的上清液b调节至ph为中性,经真空浓缩至1/3体积后加入乙醇至体积浓度为80%,并置于3℃下静置14h沉淀多糖;采用4000r/min离心12min分离沉淀b,以体积浓度70%的乙醇溶液洗涤沉淀b,待乙醇挥发后加水复溶,冷冻干燥,得到龙眼果肉多糖。
步骤3):称取质量比为2:1的步骤1)得到的龙眼果肉蛋白质和步骤2)得到的龙眼果肉多糖,加水震荡至充分溶解,采用4000r/min离心12min分离上清液c;上清液c经冷冻干燥,得到龙眼果肉多糖和龙眼果肉蛋白质的均一混合物。将均一混合物置于恒温恒湿干燥箱内,在温度65℃、相对湿度80%的条件下加热反应4d;反应终止后,加入少量蒸馏水复溶混合物,冷冻干燥,制备得到基于内源蛋白质结合的功能活性增强的龙眼果肉多糖。
实施例3
制备功能活性增强的龙眼果肉多糖
步骤1):取龙眼鲜果肉,加4倍质量的蒸馏水,在10000r/min下间歇高速均质4次,每次2min;均质匀浆补加7倍质量的蒸馏水,调节匀浆ph值为8,常温搅拌浸提5h;浸提结束后,采用4000r/min离心12min,过滤分离上清液a,调节其ph值为4.5,静置4h后采用4000r/min离心12min,分离沉淀a和上清液b;沉淀a采用ph值为4.5的蒸馏水洗涤后冷冻干燥,得到龙眼果肉蛋白质。
步骤2):取步骤1)得到的上清液b调节至ph为中性,经真空浓缩至1/5体积后加入乙醇至体积浓度为70%,并置于5℃下静置10h沉淀多糖;采用5000r/min离心8min分离沉淀b,以体积浓度80%的乙醇溶液洗涤沉淀b,待乙醇挥发后加水复溶,冷冻干燥,得到龙眼果肉多糖。
步骤3):称取质量比为4:1的步骤1)得到的龙眼果肉蛋白质和步骤2)得到的龙眼果肉多糖,加水震荡至充分溶解,采用5000r/min离心8min分离上清液c;上清液c经冷冻干燥,得到龙眼果肉多糖和龙眼果肉蛋白质的均一混合物。将均一混合物置于恒温恒湿干燥箱内,在温度55℃、相对湿度70%的条件下加热反应6d;反应终止后,加入少量蒸馏水复溶混合物,冷冻干燥,制备得到基于内源蛋白质结合的功能活性增强的龙眼果肉多糖。
效果例
如图2所示,为实施例1的制备过程中龙眼果肉多糖和蛋白质美拉德反应过程中的游离氨基和糖醛酸含量变化。通过游离氨基和糖醛酸的含量变化可以验证龙眼果肉多糖和蛋白质的美拉德反应的进行。
如图3所示,为实施例1的制备过程中龙眼果肉多糖和蛋白质美拉德反应过程中的色泽变化趋势。通过在波长420nm的比色测定可以验证龙眼果肉多糖和蛋白质的美拉德反应的进行。
如图4所示,为基于实施例1的制备过程中各时间段的产物的抗氧化活性。通过dpph自由基清除ic50值及其变化趋势、frap抗氧化能力值及其变化趋势可以体现:随着时间的推进,产物抗氧化能力提升。
如图5所示,为基于实施例1的制备过程中各时间段的产物的抗肿瘤活性。通过胃癌细胞抑制率及其变化趋势可以体现:随着时间的推进,产物抗肿瘤活性提升。实验过程如下:
取对数生长期的人胃癌细胞(sgc7901),用含胎牛血清(10%)的dmem高糖培养液调整密度为4×104cells/ml,以100μl/孔加入96孔板中,置于培养箱(37℃,5%co2)中贴壁培养24h后,向培养板中加入100μl样品溶液(终浓度为400或800μg/ml),各样品的不同浓度均设5个复孔作为实验组。以完全培养液代替样品溶液作为对照组。另取5孔加入200μl完全培养液作为空白组。培养板置于培养箱(37℃,5%co2)继续培养24h后,弃去培养液,用预温pbs洗涤2次除去未贴壁细胞后,各孔加入200μl培养液和10μlcck-8,最后将培养板置于培养箱中培养3h。用酶标仪测定450nm处的od值。
胃癌细胞抑制率(%)=[1-(od实验组-od空白组)/(od对照组-od空白组)]×100。
如图6所示,为基于实施例1的制备过程中各时间段的产物的免疫调节活性。通过脾淋巴细胞增殖率及其变化趋势可以体现:随着时间的推进,产物免疫调节活性提升。实验过程如下:
小鼠经摘眼球放血处死后,按实验室常规制备单个脾细胞悬液。以含有10%胎牛血清的rpmi1640完全培养液调整细胞浓度为1×107cells/ml,50μl/孔加入96孔板中。样品经完全培养液溶解并过滤除菌后,以50μl/孔加入细胞孔内,随后每孔加入50μg/mlcona(多糖终浓度分别为200或400μg/ml)。各试验组均设6个复孔,另设100μl培养液孔用于调零。将培养板置37℃、5%co2培养箱中培养68h,每孔加入5mg/ml的mtt20μl。继续培养4h后,每孔加入100μl酸性异丙醇,放置过夜。于570nm下用酶标仪测各孔吸光值(a)。
淋巴细胞增殖率=(a刺激组-a空白组)/a空白组×100%。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!