一种芽胞杆菌高产普切明的发酵工艺的制作方法
本发明属于发酵工程技术领域,特别是涉及一种芽胞杆菌高产普切明的发酵工艺,该工艺高产、稳定表达且适用范围广。
背景技术:
普切明(pulcherrimin)是由两个L-亮氨酸以三价铁离子为载体脱水缩合形成的一种环二肽,即cyclo(L-Leu-L-Leu)衍生物,属于二酮哌嗪(Diketopiperazines,DKPs)家族中的一类化合物,其前体普切明酸分子式为C12H20N2O4,分子量256.2980,普切明分子式为C12H20N2O4Fe2/3,结构为(Kluyver et al,1953),二酮哌嗪衍生物具有稳定的六元环骨架结构,使其在药物化学中成为一个重要的药效团,表现出广泛的生物活性和药理学活性,如抗菌、抗病毒、抗肿瘤以及类似免疫抑制剂的活性。
普切明是微生物发酵中产生的一种红棕色物质,该物质最早在酵母中发现,之后陆续在枯草芽胞杆菌、蜡状芽胞杆菌、地衣芽胞杆菌以及梅奇酵母属等中发现该物质(Uffen et al,1972;Maria et al,2006;Kupfer et al,1967;Turkel and Ener,2009)。普切明结构为普切明作为二酮哌嗪衍生物的一种,也具有多种显著的生物活性和药理学活性,同时因其作为铁载体而形成的独特颜色,使得普切明也可作为一种天然色素,在医药、化妆品和印染等方面有很大的应用潜力。有研究表明普切明是由普切明酸与铁离子结合而成的网状结构,目前该物质最有效的鉴定方法之一是高纯度的普切明通过紫外光谱分析,其最大吸收波长为410nm,且有研究表明,242nm和280nm也是其特征吸收峰(Hong et al., 2003)。
普切明的特性而具有生物防治作用已经引起大量研究者的兴趣。Pranithanchai et al.(2009)发现其可以减缓苹果腐败;Turkel et al.(2009)发现美极梅奇酵母对某些人体病原菌具有强烈的敌对作用,例如变形杆菌、大肠杆菌、白色念珠菌、近平滑念珠菌、克柔念珠菌、毛孢子珠菌,除此之外,通过生防功能验证发现某些梅奇酵母属类菌对以下菌株也有敌对作用,例如黄曲霉、烟曲霉、黑曲霉、木霉菌、拟青霉、双极霉等。
技术实现要素:
有鉴于此,本发明提供了一种芽胞杆菌高产普切明的发酵工艺,该工艺通过特定的培养基成分与发酵条件配合,显著提高了普切明的产量。
本发明提供了一种芽胞杆菌高产普切明的发酵工艺,包括以下步骤:
(1)种子培养:将芽胞杆菌接至种子培养基中进行种子培养得到发酵菌种;
(2)发酵培养:将发酵菌种接至发酵培养基中进行发酵培养,所述发酵培养基配方为:葡萄糖10-50g/L、酵母粉0.1-2.0g/L、硫酸铵1-10g/L、二水合柠檬酸三钠1-18g/L、磷酸氢二钾0.10-2.00g/L、硫酸镁0.1-2.0g/L、氯化铁0.02-0.30g/L、硫酸锰0.005-0.50g/L、氯化钙0.1-1.0g/L、吐温-80 0.01%-1%,pH 7.0-7.5;所述发酵培养条件为:培养温度25-40℃,摇床转速180-240r/min,发酵时间24-40h;
(3)将发酵液离心,去除上清液后得到菌体沉淀,经强碱溶解强酸沉淀、提取纯化得到目标代谢产物。
本发明的有益效果是:本发明生产工艺简便、便于推广,特定的培养基成分与发酵条件配合能使芽胞杆菌代谢产物普切明含量大幅提升,便于后续的分离纯化。本发明工艺具有高稳定的特点,便于扩大规模生产。
附图说明
图1,不同吐温-80添加量对普切明产量影响
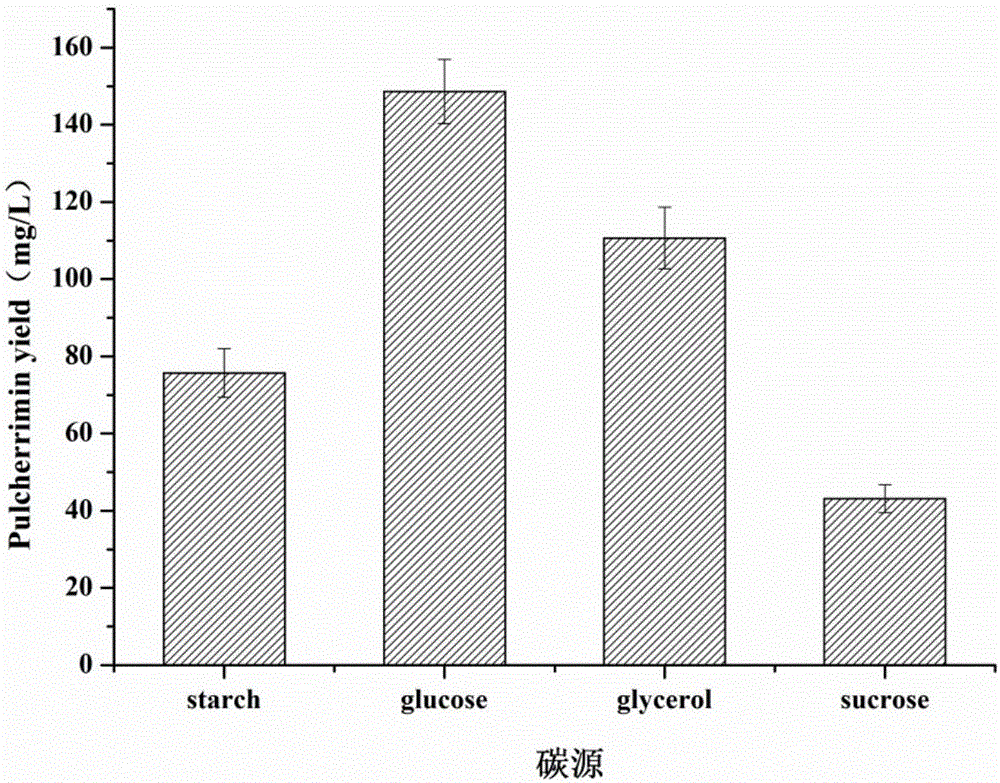
图2,碳源类型对普切明产量影响;
图3,不同葡萄糖浓度对普切明产量影响
图4,氮源类型对普切明产量影响;
图5,不同(NH4)2SO4浓度对普切明产量影响
图6,无机盐K2HPO4浓度对普切明产量影响;
图7,无机盐MgSO4浓度对普切明产量影响;
图8,无机盐CaCl2浓度对普切明产量影响;
图9,无机盐FeCl3浓度对普切明产量影响;
图10,无机盐MnSO4浓度对普切明产量影响;
图11,培养基中添加各浓度生长因子对普切明产量影响;
图12,碳源-氮源-生长因子组合情况对普切明产量影响;
图13,培养条件接种量对普切明产量影响;
图14,培养条件种龄对普切明产量影响;
图15,培养条件pH对普切明产量影响;
图16,培养基组成及条件对不同芽胞杆菌生产普切明产量影响。具体实施方式
本发明提供了一种芽胞杆菌高产普切明的发酵工艺,包括以下步骤:
(1)种子培养:将芽胞杆菌接至种子培养基中进行种子培养得到发酵菌种;
(2)发酵培养:将发酵菌种接至发酵培养基中进行发酵培养,所述发酵培养基配方为:葡萄糖10-50g/L、酵母粉0.1-2.0g/L、硫酸铵1-10g/L、二水合柠檬酸三钠1-18g/L、磷酸氢二钾0.10-2.00g/L、硫酸镁0.1-2.0g/L、氯化铁0.02-0.30g/L、硫酸锰0.005-0.50g/L、氯化钙0.1-1.0g/L、吐温-80 0.01%-1%,pH 7.0-7.5;所述发酵培养条件为:培养温度25-40℃,摇床转速180-240r/min,发酵时间24-40h;
(3)定量及检测:将发酵液离心,去除上清液后得到菌体沉淀,经将强碱溶解强酸沉淀、提取纯化得到目标代谢产物。并将上述提纯后的普切明加1mL NaOH溶解沉淀,使用紫外分光光度计在波长410nm下检测吸光度。
由于碳水化合物的存在是诱导普切明合成的必要条件,合适的氮源能有效提高普切明合成所需底物氨基酸(亮氨酸)的合成效率;吐温-80的添加对普切明的合成和运输均起到了显著的促进作用;由于高含量的普切明对菌株自身生长有抑制作用,而添加生长因子(酵母粉)能够有效提高细胞浓度,对普切明合成起到积极作用;合适的无机盐成分配比保证了细胞的生长和胞内生化反应的正常运行,同时铁元素还是普切明合成的底物之一。所以本工艺根据芽胞杆菌的生长特点和普切明合成的特殊需求,有针对性的优化了培养基的关键组分,并通过正交实验取得了最佳的成分配比,形成了完整的发酵工艺,清液的合成培养基也使后续的产物分离纯化变得简单。
优选的,步骤(1)所述芽胞杆菌包括枯草芽胞杆菌、解淀粉芽胞杆菌、地衣芽胞杆菌中的一种或几种。
更加优选的,步骤(1)所述芽胞杆菌包括:枯草芽胞杆菌(Bacillus subtilis)168,保藏编号为ATCC 23857;解淀粉芽胞杆菌(Bacillus amyloliquefaciens)LX-12,保藏编号为CCTCC No:M2015234,保藏日期:2015年4月15日,保藏中心:中国典型培养物保藏中心,保藏地址:中国武汉武汉大学;地衣芽胞杆菌(Bacillus licheniformis)DW2,保藏编号为CCTCC No:M 2011344,中的一种或几种,保藏日期:2011年10月12日,保藏中心:中国典型培养物保藏中心,保藏地址:中国武汉武汉大学。
在本发明的实施例中,以本发明提供的特定的培养基组成和培养条件对地衣芽胞杆菌DW2、枯草芽胞杆菌168、解淀粉芽胞杆菌LX-12进行发酵验证,均能得到普切明,且相对于原始培养基其普切明产量分别提高了883.8%、432.67%和694.15%,产量均显著提高。
优选的,步骤(2)所述发酵培养条件还包括:接种量为1%-5%,种龄为6-14h,发酵pH 6.5-8.0。
优选的,所述种子培养基配方为:8-12g/L蛋白胨,4-6g/L酵母浸出粉,8-12g/L氯化钠,,pH 7.0-7.2;所述种子培养条件为:培养温度25-40℃℃,摇床转速180-240r/min,培养时间为8-12h;
更加优选的,步骤(1)所述种子培养条件还包括:装瓶量为容器体积的12%-20%。
下面将结合具体实施例对本发明提供的一种芽胞杆菌高产普切明的发酵工艺予以进一步说明。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的实验材料如无特殊说明,均为市场购买得到。
实施例1
本实施例以地衣芽胞杆菌DW2为出发菌株,通过大量实验验证特定培养基组成及培养条件的配合可有效实现普切明的增产。
所述地衣芽胞杆菌(Bacillus licheniformis)DW2,保藏编号CCTCC No:M2011344。
本实施例中用到的即种子培养基组成:10g/L蛋白胨;5g/L酵母浸出粉;10g/L氯化钠;pH 7.0-7.2;固体培养基加琼脂18g/L。本实施例中普切明的检测方法及定量方法:地衣芽胞杆菌在普切明发酵培养基中发酵36h后,10000rpm离心收集菌体,菌体用甲醇洗三次,蒸馏水洗一次,然后10000rpm离心弃上清;将菌体溶于2mol/LNaOH,使菌体裂解,离心去除不溶物,加入少量FeCl3溶液使溶液至黄色澄清,随后加入2mol/L HCl调pH至1.0,100℃加热10min,离心,蒸馏水洗涤沉淀,溶于2~4ml NaOH溶液中,得到黄色溶解物,含普切明钠盐,4℃冷却,离心去除Fe(OH)3沉淀,取上清,用12mol/L HCl调pH至红棕色样沉淀出现,继续用2mol/L HCl调pH至3~5时,离心收集沉淀。加1mL NaOH溶解沉淀,使用紫外分光光度计在波长410nm下检测吸光度。
本实施例采用的初始培养基(即种子培养基)组成:10g/L蛋白胨;5g/L酵母浸出粉;10g/L氯化钠;pH 7.0-7.2;固体培养基加琼脂18g/L。
一、不同吐温-80添加量条件下的普切明产量对比
以初始发酵培养基为基础进行吐温-80添加量的优化。初始发酵培养基成分为(g/L):葡萄糖20,柠檬酸三纳12,NH4Cl 7,K2HPO4 0.5,MgSO4 0.5,FeCl30.04,CaCl2 0.15,MnSO4 0.10.保持初始发酵培养基成分不变,在不同组中分别添0%,0.05%,0.1%,0.15%,0.2%的吐温-80,进行摇瓶发酵实验,发酵结束后,测定普切明的产量。培养条件:37℃,240rpm,发酵36h。
不同吐温-80添加量所对应的普切明产量见图1,从图中可以看出吐温-80的添加能显著提高普切明的产量144.37mg/L,最佳吐温-80添加浓度为0.1%(W/V)。
二、不同碳源条件下的普切明产量对比
以步骤一中优化的添加0.1%吐温-80的培养基为基础,保持培养基中除碳源以外的其他成分浓度不变,选择20g/L的甘油、葡萄糖、蔗糖、和玉米淀粉作为待选碳源,进行摇瓶发酵实验,发酵结束后,测定普切明的产量。培养条件:37℃,240rpm,发酵36h。
不同的单独碳源所对应的普切明产量见图2。从图中可以看出,最佳碳源为葡萄糖,普切明产量可达到148.60mg/L。
三、不同葡萄糖浓度条件下的普切明产量对比以步骤二中最优培养基为基础,保持培养基中除葡萄糖以外的其他成分浓度不变,选择10g/L,20g/L,30g/L,40g/L,50g/L的葡萄糖作为碳源进行比较,发酵实验结束后测定普切明的产量。培养条件:37℃,240rpm,发酵36h。不同浓度的葡萄糖所对应的普切明产量见图3。最佳葡萄糖浓度为40g/L,普切明产量为180mg/L。
四、不同氮源条件下的普切明产量对比以步骤三中所得到的最优培养基为基础,保持培养基中除氮源外的的其他成分不变,分别以3种含氮无机盐NH4Cl、NH4NO3、(NH4)2SO4和3种含氮有机物玉米浆、牛肉浸膏、酵母浸出物为氮源,以初始培养基中7g/L NH4Cl的含氮量作为标准,其他氮源根据含氮量调整添加量,使最终氮添加量一致,进行摇瓶发酵实验。发酵结束后测定发酵液中的普切明含量。培养条件:37℃,240rpm,发酵36h测定发酵产物中普切明含量。
不同的单独氮源所对应的普切明产量见图4。从图中可以看出:氮源为(NH4)2SO4普切明产量为242mg/L。
五、不同(NH4)2SO4浓度条件下的普切明产量对比以步骤四中最优培养基为基础,保持培养基中除(NH4)2SO4以外的其他成分浓度不变,选择3.7g/L,6.2g/L,8.6g/L,11.1g/L,13.6g/L的(NH4)2SO4作为氮源进行比较,发酵实验结束后测定普切明的产量。培养条件:37℃,240rpm,发酵36h。
不同浓度的(NH4)2SO4所对应的普切明产量见图5。最佳(NH4)2SO4浓度为g/L,普切明产量为260.13mg/L。六、不同无机盐条件下的普切明产量对比
以步骤一中得到的最优培养基为基础,控制单个变量分别加入不同浓度的K2HPO4、MgSO4、MnSO4、FeCl3、CaCl2作为培养基中的无机盐,以去离子水溶解无机盐溶液,培养条件:37℃,240rpm,发酵36h测定发酵产物中普切明含量。发酵结果如图6-图10所示。
由图6可以看出,K2HPO4的最佳浓度为0.6g/L,普切明产量为263.13.mg/L。如图7所示,MgSO4的最佳浓度为0.5g/L,普切明产量255.45mg/L;图8显示,CaCl2的最佳浓度为0.4g/L,普切明产量为244.70mg/L;如图9所示,FeCl3的最佳浓度为0.15g/L,普切明产量270.15mg/L;由图10可以看出,MnSO4的最佳浓度为0.02g/L,普切明产量286.94mg/L。最佳无机盐类型及其浓度为:K2HPO4 0.6g/L、MgSO4 0.5g/L、CaCl2 0.1g/L、FeCl3 0.04g/L、MnSO4 0.02g/L。
七、不同酵母粉浓度条件下的普切明产量对比通过上述对于氮源的优化试验,由于添加有机氮源酵母浸出物,普切明产量为202.14mg/L,酵母浸出物可以作为一种生长因子供微生物生长所需,对于地衣芽胞杆菌自身生长以及合成普切明的重要作用,本实验选取酵母粉作为生长因子用于普切明的发酵合成,并对酵母粉的浓度进行优化。以步骤一中所得的最优培养基为基础,采用不同浓度的酵母粉(0g/L、0.5g/L、1g/L、2g/L、4g/L、6g/L)进行实验,考察生长因子酵母粉(Yeast Extract)的浓度对于普切明发酵的影响。
从图11可以看出,最优的酵母粉浓度为1.0g/L,普切明产量达到317.0mg/L,显著高于其他实验组。
八、培养基优化正交实验
通过上述单因素试验,结合地衣芽胞杆菌DW2的发酵特性,选择显著影普切明产量的三个因素:吐温-80、碳源(葡萄糖)和氮源((NH4)2SO4),并以误差作为一个影响因素设计四因素三水平的正交试验进一步优化发酵培养基并最终确定培养基的配比和浓度。正交试验因素水平见表1,具体试验设计及极差分析结果见表2。图12所示的是正交试验中的9个实验组的普切明产量,其中实验组2的普切明产量最高,达到354.45mg/L。
表1因素水平表
表2主要因素的正交试验结果
由表2的极差分析可知,在本试验所设定的实验因素水平下,吐温-80对地衣芽胞杆菌DW2发酵生产普切明的影响最为显著,其次是(NH4)2SO4。由均值分析可知,培养基的最佳组合为A2B2C2。为考察各个因素间是否存在交互作用,以及各个因素对于普切明的产量影响是否显著,以一般的线性模型对于正交试验的结果进行了方差分析,结果见表3。
表3主要因素的正交试验方差分析
aDF,degree of freedom
bAdj.SS,sum of squares
cAdj.MS,mean square
由表3可以看出吐温-80对Bacillus licheniformis DW2发酵生产普切明的影响显著,而葡萄糖和硫酸铵的对其影响较小,符合极差分析的结果。各个因素的交互系数均较高(P远大于0.05),表明各因素间的交互作用对普切明产量影响不明显。方差分析的结果表明原始多元相关系数R2=0.9701,修正后的多元相关系数R2=0.8805,说明只有11.95%实验没有被所建立的线性模型检验,该正交试验具备科学意义。
通过正交试验的结果分析表明,最佳的培养基的配比和浓度为葡萄糖40g/L,吐温-80 0.1%,(NH4)2SO4 6.2g/L。以该培养基的配比和浓度进行发酵验证,得到发酵液提纯的普切明产量为371.73mg/L,大于第2组对应的普切明产量354.45mg/L。
九、不同培养条件下的普切明产量对比在以上试验确定的最佳培养基组成的基础上,通过单因子实验设计对可能影响普切明产量的培养条件(如:接种量、种龄及培养基初始pH)进行优化对比实验。具体设定为接种量0.5%、1%、2%、3%、4%(v/v),初始pH 6.5、7.0、7.5、8.0。种龄为6、8、10、12、14(h)。优化后培养基组成为:葡萄糖40g/L、酵母粉1.0g/L、二水合柠檬酸三钠12g/L、吐温-80 0.1%、(NH4)2SO4 6.2g/L、K2HPO40.6g/L、MgSO4 0.5g/L、CaCl2 0.1g/L、FeCl3 0.04g/L、MnSO4 0.02g/L,培养基用去离子水定容。
从图13-图15的实验结果可以得出如下结论:1、接种量(2%,v/v)有利于普切明生产。2、种龄为10h,更有利于普切明生产。3、pH为7.0时,更有利于普切明生产。
通过上述实验,得到芽胞杆菌高产普切明的发酵工艺,本实施例中采用的芽胞杆菌为地衣芽胞杆菌DW2,采用的具体工艺包括以下步骤:
(1)出发菌株:地衣芽胞杆菌DW2;
(2)种子培养;
种子培养基为:10g/L蛋白胨;5g/L酵母浸出粉;10g/L氯化钠;pH 7.0-7.2;固体培养基加琼脂18g/L;
种子培养:培养温度为37℃,250mL三角瓶中装液量为50mL,摇床转速240r/min,培养时间为10h;
(3)发酵培养
发酵培养基组成:葡萄糖40g/L、酵母粉1.0g/L、二水合柠檬酸三钠12g/L、吐温-80 0.1%、(NH4)2SO4 6.2g/L、K2HPO4 0.6g/L、MgSO4 0.5g/L、CaCl2 0.1g/L、FeCl3 0.04g/L、MnSO4 0.02g/L,培养基用去离子水定容。发酵培养条件:培养温度37℃,摇床转速240r/min,发酵时间36h,接种量2%,种龄10h,pH7.0。
(4)收集菌体并提纯将发酵液离心后得到菌体与上清液,去除上清液后得到红色及菌体沉淀经强碱溶解、提取纯化得到目标代谢产物。具体步骤为:将发酵液于10000rpm离心收集菌体,菌体用甲醇洗三次,蒸馏水洗一次,然后10000rpm离心弃上清;将菌体溶于2mol/LNaOH,使菌体裂解,离心去除不溶物,加入少量FeCl3溶液使溶液至黄色澄清,随后加入2mol/L HCl调pH至1.0,100℃加热10min,离心,蒸馏水洗涤沉淀,溶于2~4ml NaOH溶液中,得到黄色溶解物,含普切明钠盐,4℃冷却,离心去除Fe(OH)3沉淀,取上清,用12mol/L HCl调pH至红棕色样沉淀出现,继续用2mol/L HCl调pH至3~5时,离心收集沉淀。加1mL NaOH溶解沉淀,使用紫外分光光度计在波长410nm下检测吸光度。
通过检测,地衣芽胞杆菌DW2在本实施例提供的特定的培养基和培养条件下,普切明的产量均大幅提高,普切明产量达到371.73mg/L,相比原始培养基提高了884%,见图16。
实施例2
本实施例以枯草芽胞杆菌(Bacillus subtilis)168为出发菌株,保藏编号ATCC 23857,通过特定培养基组成及培养条件的配合有效实现了普切明的增产。
采用的具体工艺包括以下步骤:
(1)出发菌株:枯草芽胞杆菌168;
(2)种子培养;
种子培养基为:10g/L蛋白胨;5g/L酵母浸出粉;10g/L氯化钠;pH 7.0-7.2;固体培养基加琼脂18g/L;
种子培养:培养温度为37℃,250mL三角瓶中装液量为50mL,摇床转速240r/min,培养时间为10h;
(3)发酵培养
发酵培养基组成:葡萄糖40g/L、酵母粉1.0g/L、二水合柠檬酸三钠12g/L、吐温-80 0.1%、(NH4)2SO46.2g/L、K2HPO4 0.6g/L、MgSO4 0.5g/L、CaCl2 0.1g/L、FeCl3 0.04g/L、MnSO4 0.02g/L,培养基用去离子水定容。发酵培养条件:培养温度37℃,摇床转速240r/min,发酵时间36h,接种量2%,装瓶量50mL(250mL锥形瓶),pH7.0。
(4)收集菌体并提纯将发酵液离心后得到菌体与上清液,去除上清液后得到红色及菌体沉淀经强碱溶解、提取纯化得到目标代谢产物。具体步骤为:将发酵液于10000rpm离心收集菌体,菌体用甲醇洗三次,蒸馏水洗一次,然后10000rpm离心弃上清;将菌体溶于2mol/LNaOH,使菌体裂解,离心去除不溶物,加入少量FeCl3溶液使溶液至黄色澄清,随后加入2mol/L HCl调pH至1.0,100℃加热10min,离心,蒸馏水洗涤沉淀,溶于2~4ml NaOH溶液中,得到黄色溶解物,含普切明钠盐,4℃冷却,离心去除Fe(OH)3沉淀,取上清,用12mol/L HCl调pH至红棕色样沉淀出现,继续用2mol/L HCl调pH至3~5时,离心收集沉淀。
加1mL NaOH溶解沉淀,使用紫外分光光度计在波长410nm下检测吸光度。
通过检测,枯草芽胞杆菌168在本实施例提供的特定的培养基和培养条件下,普切明的产量均大幅提高,普切明产量达到270.2mg/L,相比原始培养基提高了432.7%,见图16。
实施例3
本实施例以解淀粉芽胞杆菌(Bacillus amyloliquefaciens)LX-12为出发菌株,保藏编号CCTCC NO:M2015234,通过特定培养基组成及培养条件的配合有效实现了普切明的增产。
采用的具体工艺包括以下步骤:
(1)出发菌株:解淀粉芽胞杆菌LX-12;
(2)种子培养;
种子培养基为:10g/L蛋白胨;5g/L酵母浸出粉;10g/L氯化钠;pH 7.0-7.2;固体培养基加琼脂18g/L;
种子培养:培养温度为37℃,250mL三角瓶中装液量为50mL,摇床转速240r/min,培养时间为10h;
(3)发酵培养
发酵培养基组成:葡萄糖40g/L、酵母粉1.0g/L、二水合柠檬酸三钠12g/L、吐温-80 0.1%、(NH4)2SO46.2g/L、K2HPO4 0.6g/L、MgSO4 0.5g/L、CaCl2 0.1g/L、FeCl3 0.04g/L、MnSO4 0.02g/L,培养基用去离子水定容。发酵培养条件:培养温度37℃,摇床转速240r/min,发酵时间36h,接种量2%,装瓶量50mL(250mL锥形瓶),pH7.0。
(4)收集菌种将发酵液离心后得到菌体与上清液,去除上清液后得到红色及菌体沉淀经强碱溶解、提取纯化得到目标代谢产物。具体步骤为:将发酵液于10000rpm离心收集菌体,菌体用甲醇洗三次,蒸馏水洗一次,然后10000rpm离心弃上清;将菌体溶于2mol/LNaOH,使菌体裂解,离心去除不溶物,加入少量FeCl3溶液使溶液至黄色澄清,随后加入2mol/L HCl调pH至1.0,100℃加热10min,离心,蒸馏水洗涤沉淀,溶于2~4ml NaOH溶液中,得到黄色溶解物,含普切明钠盐,4℃冷却,离心去除Fe(OH)3沉淀,取上清,用12mol/L HCl调pH至红棕色样沉淀出现,继续用2mol/L HCl调pH至3~5时,离心收集沉淀。
加1mL NaOH溶解沉淀,使用紫外分光光度计在波长410nm下检测吸光度。
通过检测,解淀粉芽胞杆菌LX-12在本实施例提供的特定的培养基和培养条件下,普切明的产量均大幅提高,普切明产量达到335.55mg/L,相比原始培养基提高了694.14%,见图16。
实施例4
本实施例以枯草芽胞杆菌(Bacillus subtilis)168为出发菌株,保藏编号ATCC 23857,通过特定培养基组成及培养条件的配合有效实现了普切明的增产。
采用的具体工艺包括以下步骤:
(1)出发菌株:枯草芽胞杆菌168;
(2)种子培养;
种子培养基为:8g/L蛋白胨;6g/L酵母浸出粉;8g/L氯化钠;pH 7.0-7.2;固体培养基加琼脂20g/L;
种子培养:培养温度为35℃,250mL三角瓶中装液量为50mL,摇床转速240r/min,培养时间为8h;
(3)发酵培养
发酵培养基组成:葡萄糖40g/L、酵母粉1.5g/L、二水合柠檬酸三钠18g/L、吐温-80 0.8%、(NH4)2SO49.0g/L、K2HPO4 1.6g/L、MgSO4 1.5g/L、CaCl2 0.1g/L、FeCl3 0.30g/L、MnSO4 0.40g/L,培养基用去离子水定容。发酵培养条件:培养温度40℃,摇床转速200r/min,发酵时间24h,接种量4%,装瓶量50mL(250mL锥形瓶),pH8.0。
(4)收集菌体并提纯将发酵液离心后得到菌体与上清液,去除上清液后得到红色及菌体沉淀经强碱溶解、提取纯化得到目标代谢产物。具体步骤为:将发酵液于10000rpm离心收集菌体,菌体用甲醇洗三次,蒸馏水洗一次,然后10000rpm离心弃上清;将菌体溶于2mol/LNaOH,使菌体裂解,离心去除不溶物,加入少量FeCl3溶液使溶液至黄色澄清,随后加入2mol/L HCl调pH至1.0,100℃加热10min,离心,蒸馏水洗涤沉淀,溶于2~4ml NaOH溶液中,得到黄色溶解物,含普切明钠盐,4℃冷却,离心去除Fe(OH)3沉淀,取上清,用12mol/L HCl调pH至红棕色样沉淀出现,继续用2mol/L HCl调pH至3~5时,离心收集沉淀。
加1mL NaOH溶解沉淀,使用紫外分光光度计在波长410nm下检测吸光度。
通过检测,枯草芽胞杆菌168在本实施例提供的特定的培养基和培养条件下,普切明的产量均大幅提高,与实施例2结果基本一致。
实施例5
本实施例以解淀粉芽胞杆菌(Bacillus amyloliquefaciens)LX-12为出发菌株,保藏编号CCTCC NO:M2015234,通过特定培养基组成及培养条件的配合有效实现了普切明的增产。
采用的具体工艺包括以下步骤:
(1)出发菌株:解淀粉芽胞杆菌LX-12;
(2)种子培养;
种子培养基为:12g/L蛋白胨;4g/L酵母浸出粉;12g/L氯化钠;pH 7.0-7.2;固体培养基加琼脂15g/L;
种子培养:培养温度为25℃,250mL三角瓶中装液量为30mL,摇床转速180r/min,培养时间为12h;
(3)发酵培养
发酵培养基组成:葡萄糖15g/L、酵母粉0.1g/L、二水合柠檬酸三钠2g/L、吐温-80 0.03%、(NH4)2SO42.0g/L、K2HPO4 0.2g/L、MgSO4 1.0g/L、CaCl2 1.0g/L、FeCl3 0.02g/L、MnSO4 0.005g/L,培养基用去离子水定容。发酵培养条件:培养温度25℃,摇床转速180r/min,发酵时间40h,接种量1%,装瓶量50mL(250mL锥形瓶),pH6.5。
(4)收集菌体并提纯将发酵液离心后得到菌体与上清液,去除上清液后得到红色及菌体沉淀经强碱溶解、提取纯化得到目标代谢产物。具体步骤为:将发酵液于10000rpm离心收集菌体,菌体用甲醇洗三次,蒸馏水洗一次,然后10000rpm离心弃上清;将菌体溶于2mol/LNaOH,使菌体裂解,离心去除不溶物,加入少量FeCl3溶液使溶液至黄色澄清,随后加入2mol/L HCl调pH至1.0,100℃加热10min,离心,蒸馏水洗涤沉淀,溶于2~4ml NaOH溶液中,得到黄色溶解物,含普切明钠盐,4℃冷却,离心去除Fe(OH)3沉淀,取上清,用12mol/L HCl调pH至红棕色样沉淀出现,继续用2mol/L HCl调pH至3~5时,离心收集沉淀。
加1mL NaOH溶解沉淀,使用紫外分光光度计在波长410nm下检测吸光度。
通过检测,解淀粉芽胞杆菌LX-12在本实施例提供的特定的培养基和培养条件下,普切明的产量均大幅提高,与实施例3结果基本一致。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!