富含生物活性化合物的鳄梨提取物的抗微生物、抗菌及抑制芽孢萌发活性的制作方法
任何在先申请及在所述申请中或在其审查期间引用的所有文件(“申请引用的文件”)和在申请引用的文件中引用的或参考的所有文件、和本文引用的或参考的所有文件(“本文引用的文件”)、和本文引用的文件中引用的或参考的所有文件、以及本文或通过引用而结合于本文的任何文件中提及的任何产品的任何厂商说明书、指南、产品说明书和产品图表,特此通过引用结合于本文中,并可用于本发明的实施。发明背景1.
技术领域:
与本发明有关的某些技术定义包括“无芽孢形成型细菌”,该已知的术语用于不能形成细菌芽孢并且可通过热处理、冷冻厌氧贮藏、抗菌物质和其他本领域已知的方法单独或联合使用而消灭或控制的病原性细菌和酸败细菌。另一个相关术语是“芽孢形成型细菌”,其包括能形成被称为细菌芽孢(也被称为内生孢子)这一极具抗性结构的病原性细菌和酸败细菌,所述芽孢不一定能被本领域已知的用于控制无芽孢形成型细菌的常规方法消灭或控制,需要采用特定的处理来对其进行抑制和/或灭活。另外,两种类型的细菌均可在自然界以“营养状态”(也被称为活力细胞)存在;但是芽孢形成型细菌还可作为对化学和物理灭活处理更有抗性的“芽孢状态”存在。在食品
技术领域:
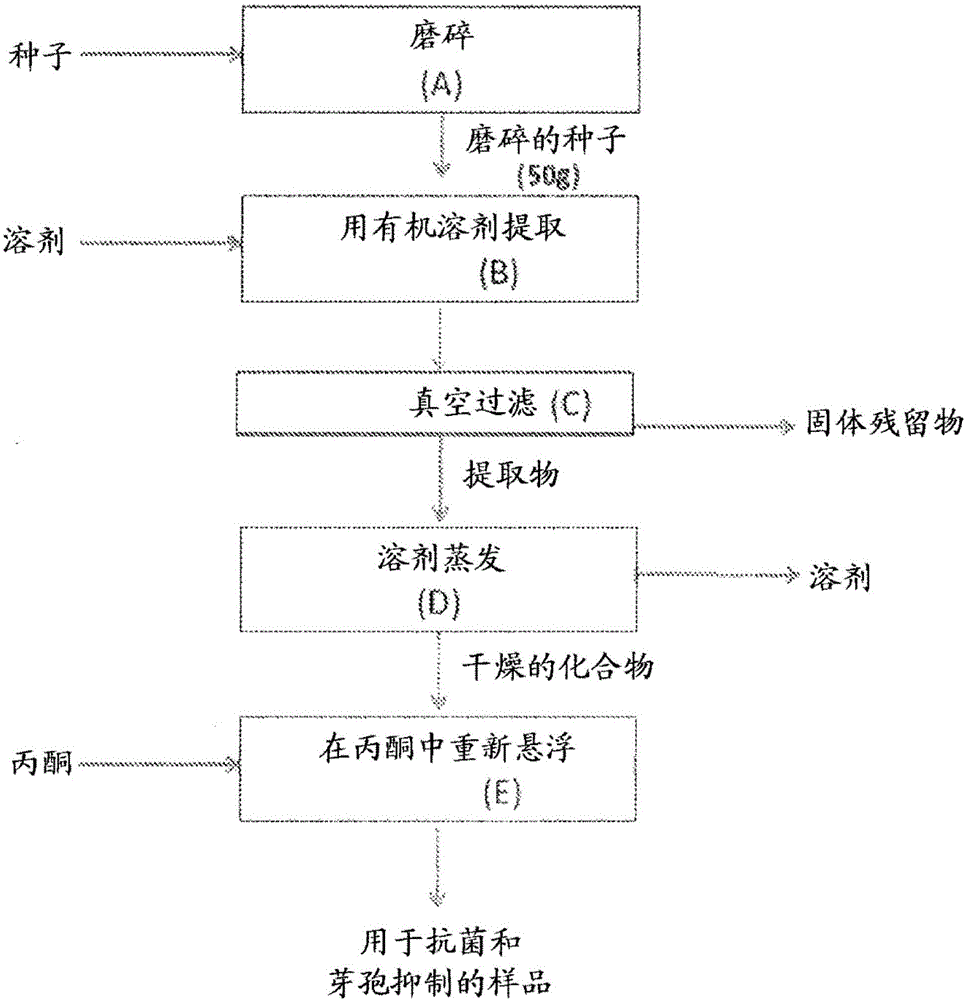
,芽孢形成型细菌有其他的细菌状态,所述状态通过使用热(称为“热激芽孢”)和/或压力(称为“压激芽孢”)而人工创造。产生于食品工业的人造状态导致了芽孢对化学和物理手段的灭活具有更高的抗性,并且在一些食品体系中需要受到控制从而抑制其萌发成芽孢形成型细菌的营养形式和随后带来的食品酸败和/或毒素产生。本发明涉及食品和药品领域。具体而言,本发明涉及通过使用天然存在于鳄梨(Perseaamericana)的化学化合物来抑制革兰氏阳性细菌的营养细胞、芽孢萌发和生长的方法。本发明还涉及到医学领域。具体而言,本发明涉及通过使用特异性针对病原性芽孢形成型细菌的抗菌提取物来抑制人或非人脊椎动物的体内(包括胃肠道内)该类型细菌生长的方法。在食品加工学科中众所周知的是,pH值>4.6的食品(在食品工业中一般被认为是低酸食品)可发生芽孢形成型细菌的萌发和生长。能够抑制病原性芽孢形成型微生物(例如肉毒梭菌(Clostridiumbotulinum)、产气荚膜梭菌(Clostridiumperfringens)和蜡状芽孢杆菌(Bacilluscereus)等)的芽孢萌发和营养细胞生长的食品添加剂的使用在食品工业中具有特殊的意义。在适当的食品环境下,例如封闭的容器或产生于食品基质中的厌氧条件下,这些病原性微生物的芽孢可萌发和生长成有害数量的细菌细胞,在某些情况下会产生毒素危害人类健康。特别地,肉毒梭菌的蛋白水解和非蛋白水解性菌株因其细菌芽孢可能在食品中萌发和产生有效的神经毒素而在食品工业中受到较大关注。亚硝酸盐是食品工业中最常用的食品添加剂用于在冷冻低酸食品中延缓/抑制芽孢形成型病原性细菌生长。然而,存在消费者和行业长期的关注以减少人工合成的食品添加剂的使用,尤其是亚硝酸盐化合物。用于相同目的的其他食品添加剂包括乳酸链球菌肽(Rayman,1981)、重组肽(Tang等,2008)、5-氨基水杨酸盐(Lin和Pimentel,2001)和月桂酰精氨酸乙酯(Beltran等,2011)。此外,已经有在先专利和文章涉及到针对细菌营养细胞起作用的天然抗菌化合物。已经报道许多自然资源含有主要是亲脂性的抗菌化合物,但也有一些亲水性化合物表现出活性。此类抗菌化合物的报道可以在文献中查到。本发明还涉及重要的公众健康问题,即病原性物种(特别是革兰氏阳性单核细胞增多性李斯特菌(Listeriamonocytogenes))在商业冷藏温度下生长的能力,加工过的食品在最终消费前通常在该温度下储藏。单核细胞增多性李斯特菌是一种无芽孢形成型病原性细菌,该细菌特别与速食肉类和乳制品有关,因为此类食品在消费者食用前经常没有经过加热处理。本领域熟知,被单核细胞增多性李斯特菌污染过的食品在食用后会增加感染的风险,特别是在婴儿、老年人、孕妇和任何缺乏免疫力的个体中。对本发明来说,杀芽孢剂为有能力杀死至少一些类型的细菌芽孢的物质,而抑芽孢剂为有能力抑制至少一些类型的细菌芽孢的生长和繁殖的物质。芽孢萌发抑制剂包括杀芽孢剂和抑芽孢剂两种。另外,除非另外指明,对下文所述的化合物的说明意旨包含其所有的立体异构形式,包括化合物的(R)和(S)形式和顺式(Z)和反式(E)形式。对本发明来说,反式(E)形式包括具有式-CH=CH2的末端烯烃(参见下文的例子,(2R,16E)-1-乙酰氧基-2-羟基-4-氧代-十九-16,18-二烯。2.相关技术描述1951年Jensen(美国专利2,550,254)从鳄梨(Perseagratissima)种子中获得丙酮提取物,该提取物对金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis)、灰绿曲霉(Aspergillusglaucus)、点青霉(Penicilliumnotatum)和Achromobacterperolens的营养型细胞有抗菌活性。发现该提取物对大肠杆菌、荧光假单胞菌(Pseudomonasfluorescens)和Penicilliuncamemberti无活性。1953年同一作者(加拿大专利494,110)提到鳄梨(Perseaamericana)种子作为可用于得到具有抗菌活性的提取物另一天然的来源。Valeri和Gimeno(1954)用石油醚提取鳄梨种子并报道得到的蜡状粗制品抑制化脓微球菌(Micrococcuspyogenes)和藤黄八叠球菌(Sarcinalutea)的生长,但不抑制枯草芽孢杆菌或大肠杆菌的生长。现有技术表明鳄梨种子包含抗菌化合物,但提取物对具体微生物的特异性生物活性明显依赖于提取方法,该提取方法最终影响提取物的化学组成。在相关技术中,已经从鳄梨种子提取物中分离得到了一些化合物,并检测了其抑制某些微生物(细菌、酵母和真菌)的生长。Kashman等(1969)从鳄梨果实和种子的己烷提取物中分离得到了八种化合物并阐明了其结构,并且制备了其大量的衍生物,其中种子比果实能获得更高的产率。Kashman(1969)展示的所有化合物属于同一类长链脂肪族化合物,其一端不饱和,另一端高度氧化。有趣的是,作者将这些化合物按对分开,区别仅在于链末端有双键或三键。这些化合物的分离是为了进行化学表征,而不是为了获得生物活性成分(非生物活性导向的分离)。之后进行了另外的研究用于评估这些化合物对枯草芽孢杆菌、蜡状芽孢杆菌、伤寒沙门氏菌(Salmonellatyphi)、痢疾志贺氏菌(Shigelladysenteriae)、金黄色葡萄球菌、白假丝酵母(Candidaalbicans)、酿酒酵母(Saccharomycescerevisiae)(ATCC7752和S288C)的抗菌活性(Néeman等,1970)。在用0.05mg化合物进行圆盘抑制抗菌测试中,经测试的十二种长链脂肪族化合物中仅有六种证实了针对一些微生物具有抑制作用,但只有1,2,4-三羟基-n-十七-16-烯有能力抑制包括在其研究中的所有微生物生长。作者得出结论,当化合物氧化部分上的羟基全部或部分被乙酰基化时,抗菌活性被极大地削弱(Néeman等1970)。因此,作为上述长链脂肪族化合物的乙酰化形式的acetogenins不能抑制先前提到的微生物的生长。Baratta等(1998年)最近进行研究评估植物精油提取物的抗菌和抗氧化性质,所述植物包括樟科的月桂(Laurusnobilis),但不包括鳄梨属。近期,Ugbogu和Akukwe(2009)报道了PerseagratissimaGaerthF及其他植物种子油对无芽孢形成型细菌的临床隔离物的抗菌效果,所述细菌包括大肠杆菌、奇异变形菌(Proteusmirabilis)、铜绿假单胞菌(Pseudomonasaeruginosa)、金黄色葡萄球菌和表皮葡萄球菌(Staphylococcusepidermis)。作者报道了鳄梨种子油在治疗伤口方面的潜在用途。Chia和Dykes(2010)也从鳄梨(PerseaAmericanaMill.)Hass,Shepard和Fuerte变种的外果皮和种子中制备了乙醇提取物。他们报道了提取物在104.2-416.7μg/ml浓度下表现出了对革兰氏阳性和革兰氏阴性细菌营养型细胞生长的抗菌活性;作者还制备了仅抑制单核细胞增多性李斯特菌(93.8-375μg/ml)和表皮葡萄球菌(354.2μg/ml)生长的水提取物。没有评估乙醇或水提取物对梭菌或芽孢杆菌属的活性。Rodríguez-Carpena等(2011)在试图分离抗菌活性分子的时候使用三种不同的溶剂(包括乙酸乙酯、丙酮(70%)和甲醇(70%)),从两种鳄梨栽培种(PerseaAmericanaMill.)的果皮、果肉和种子中制备了提取物。作者检测了提取物对一组来自无芽孢形成型细菌和芽孢形成型细菌的营养型细胞的抗菌性质,得出它们的抗菌活性为中等以及原因在于其提取物中存在酚类化合物的结论。因此,以上引用的研究并不能成功地完成对可能造成所观察到的生物活性(针对测试的细菌芽孢、热激芽孢或压激芽孢)原因的成分的分离或化学鉴定。类似地,其他作者已经测试了鳄梨植物对非细菌微生物的抗微生物性质。Prusky等(1982)描述了1-乙酰氧基-2-羟基-4-氧代-二十一-12,15-二烯(Persin)存在于未成熟的鳄梨果皮中,并认为该分子产生对盘长孢状刺盘孢(Colletotrichumgloeosporioides)(引发炭疽病的一种真菌,这是在鳄梨果实贮藏期间面临的一个公知的问题)的抗微生物活性。该化合物通过薄层色谱法从用二氯甲烷分配的乙醇提取物中分离。该化合物后来被称为“persin”(Oelrichs等,1995),其他作者证实该化合物为鳄梨组分,经体外测试证明对真菌盘长孢状刺盘孢营养生长具有最高抑制活性(Sivanathan和Adikaram,1989;Domergue等,2000),还具有抑制真菌孢子萌发和萌发管延长的能力(Prusky等,1991a)。Persin在790μg/ml完全抑制真菌孢子萌发,成熟期时该化合物在果皮中的浓度极大地降低(Prusky等,1982)。具有类似结构的单烯,1-乙酰氧基-2,4-二羟基-n-十七-16-烯,也证实有抗盘长孢状刺盘孢的生物活性,但其活性为persin活性的1/3。有趣地是,两种抗真菌化合物按1:1比例的混合物表现出协同活性,并且增加了抑制发芽的分生孢子萌发管延长的百分比(Prusky等,1991年b)。其他化合物例如1-乙酰氧基-2-羟基-4-氧代-二十一-5,12,15-三烯(Domergue等,2000)也被证实有抗真菌的生物活性。最后的这种化合物被称为“PersenoneA”(Kim等,2000a),然而所进行的分离无一基于它的生物活性,或者以发现具有增加的生物活性的新型化合物或混合物为目的。大多数现有技术出版物将重点放在发现分子来防止收获后的损害。已经报道的acetogenins的其他生物活性包括杀虫、抗肿瘤和驱虫性质。Persin已被表明具有杀虫活性,在人造饲料中含量为200μg/g或更高时抑制家蚕幼虫BombyxmoriL.的幼虫进食(Chang等,1975;Murakoshi等,1976)。最近,Rodriguez-Saona等(1997)证实了persin对Spodopteraexigua(一种进食广泛的昆虫,不以鳄梨为食,却是许多植物的主要害虫之一)的作用。在食物中的含量为200μg/g和400μg/g下分别观察到对幼虫生长和进食的抑制作用。Persin还被鉴定为存在于鳄梨叶中的有效成分,其在60-100mg/kg的剂量下能引起鼠分泌乳汁的乳腺坏死,在超过100mg/kg的剂量下会发生鼠心肌纤维坏死,并且在影响严重的动物体内会出现胸腔积水(Oelrichs等,1995)。因为这个效果,该化合物和从鳄梨叶中得到的其他化合物获得用于治疗哺乳动物卵巢癌和乳腺癌的专利权(Seawright等,2000)。以高达100mg/kg待治疗的哺乳动物的体重口服给予化合物,但优选以20-40mg/kg体重在连续数天内给药来避免先前报道的毒性作用。先前的研究表明,鳄梨果肉中这些化合物的含量在成熟期时将极大地降低到小于1500μg/g(Kobiler等,1993);因此,60千克的人每日需消耗超过0.8kg的鳄梨果肉才能实现抗癌效果,甚至更高的浓度才能达到细胞毒效应。Pollack等报道(2010),提议鳄梨用于癌症治疗的年治疗剂量是美国实际每人年消费鳄梨量(1.8千克或4.1英镑)的160倍。PersenoneA和它的类似物1-乙酰氧基-2-羟基-5-十九烯-4-酮(PersenoneB),同Persin一起被发现抑制细胞培养中过氧化物(O2-)和氧化一氮(NO)的产生,作者将该活性与在炎症有关的器官中作为癌症化学抑制剂的治疗用途相关联(Kim等,2000a、2000b和2000c)。体外实验结果证实它们与DHA(二十二碳六烯酸,天然的NO产生抑制剂)相比有相同或更好的活性。Acetogenins的IC50值在1.2-3.5μM范围内,DHA为4.5μM(Kim等,2000a)。另外,1-乙酰氧基-2,4-二羟基-n-十七-16-烯、persin和persenoneA显示了乙酰基辅酶A羧化酶(ACC)活性的抑制作用,IC50值范围为4.0-9.4μM(Hashimura,2001)。作者认为,由于ACC参与了脂肪酸的生物合成,因此这些化合物具有用作脂肪积聚抑制物来避免肥胖的潜在用途。长链脂肪酸衍生物的大多数提取方法需要回收油的预步骤,或者使用有机溶剂例如己烷。Kashman、Neeman和Lifshitz(1969)所使用的用于经鉴定的抗菌化合物的提取方法是在沸点温度利用己烷。Broutin等在2003年(美国专利6,582,688B1)开发了一种从鳄梨果实油中获得提取物的方法,该油富含某类长链脂肪族化合物,例如呋喃脂质化合物和多羟基化脂肪醇)。作者声称这些非极性的化合物的不同组合物可用于不同的治疗、美容和食品应用。然而通过他们的方法获得的提取物的化学组合物或者活性分子的含量并没有在作为抗菌剂的用途方面被详细说明。考虑到可能存在于粗提物中的一些化合物的毒性,确定得到设想效果所需的最小浓度就非常重要(参见美国专利申请公布2006-0099323和2009-0163590)。即使已经证实了某些acetogenins对细菌营养细胞具有抗菌活性,现有技术没有报道任何针对微生物(尤其是产芽孢形式的)的从鳄梨(Perseaamericana)中对抗菌化合物的生物分析导向的分离。本发明提供一系列方法步骤来获得分离的化合物和/或富含天然存在于鳄梨(Perseaamericana)中的抗菌化合物的组合物,所述化合物抑制芽孢形成型细菌的营养状态和芽孢状态的生长。基于产芽孢微生物抑制对化合物的分离没有构成现有技术教导的一部分。更重要的是,部分纯化的混合物中特定化合物的协同作用也是本发明的一部分。发明人惊奇地发现,部分纯化的提取物和/或分离化合物的混合物拥有芽孢萌发抑制性质,例如抑芽孢和/或杀芽孢特性,并且在某些情况中甚至具有比单独的分离化合物更好的效果。针对芽孢形成型微生物的活性化合物的化学特性和特异性先前从未报道过,生物活性化合物在商业应用加工条件下的热稳定性或压力稳定性也未报道过。Maseko(2006)提出一种简易方法来生产被称为(2R,4R)-1,2,4-三羟基十七-16-烯的非乙酰化脂肪酸衍生物,该方法使用(S)-苹果酸作为便宜的三元醇片段来源,通过Grignard反应来实现脂肪链的延长。该前体可用于鳄梨油中大多数acetogenins的合成。在Maseko(2006)中该分子被制备成分析标准物,在现有技术中Néeman等(1970)提出该化合物作为针对葡萄球菌(Staphylococcusspp.)(一种无芽孢形成型细菌)的抗菌剂的可能。参考现有技术中关于用于冷冻食品中单核细胞增多性李斯特菌的营养细胞的特异性控制的抗菌物质,美国专利号5,217,950提出了乳酸链球菌肽组合物作为革兰氏阳性细菌杀菌剂的用途。美国专利5,573,797、5,593,800和5,573,801公开了抗菌组合物,该组合物包括链球菌(Streptococcus)或片球菌(Pediococcus)来源的细菌素或合成的等效抗菌剂与螯合剂的组合。美国专利号5,458,876提出抗生物素(例如乳酸链球菌肽)与溶菌酶组合作为抗菌剂。在该例子中,溶菌酶降解细胞壁,削弱靶细胞的结构完整性,因此抗菌剂更高效地破坏或杀死细菌细胞。特别是,该组合被证明有效提高乳酸链球菌肽抗单核细胞增多性李斯特菌的抗菌功效,尽管李斯特菌(Listeria)没有完全消除,却明显减少到安全适当的使用水平。美国专利6,620,446B2描述了在食品应用中用于控制革兰氏阳性细菌的抗菌组合物,该组合物可以用作配料或用在食品表面。为了减少或消除革兰氏阳性酸败或病原性细菌,最特别地,有害病原体单核细胞增多性李斯特菌的所有菌株,该组合物包括乳酸链球菌肽、和/或溶菌酶和β蛇麻子酸(betahopsacid)。Perumalla和Hettiarachchy(2011)报道绿茶提取物和葡萄籽提取物(富含多酚和原花色素的化合物)对大多数在食品上生长的病原体,例如单核细胞增多性李斯特菌、鼠伤寒沙门氏菌(Salmonellatyphimurium)、大肠杆菌O157:H7和空肠弯曲杆菌(Campylobacterjejuni)有抗菌活性。此外,他们已经证实,在多种模型系统中,当与有机酸(苹果酸、酒石酸、苯甲酸等)、细菌素(例如乳酸链球菌肽)或螯合试剂(例如EDTA)联合使用时,在抗菌活性方面存在协同作用,所述模型系统包括新鲜产品(水果和蔬菜)、生肉和速食肉类以及禽类产品。考虑到获得有足够的抗菌、抗微生物或抑制芽孢萌发活性的提取物的困难性;细菌、微生物和芽孢对已知抗菌、抗微生物、抑制芽孢萌发的化合物和组合物的抵抗力提高;以及对天然食品和药品的需求,在本领域中仍然对其他抗菌、抗微生物或杀芽孢化合物和组合物存在需要,优选所述化合物和组合物获自经济适用的来源,例如植物加工副产品和废品。发明概述本发明涉及用作抗微生物剂、抗菌剂或芽孢萌发抑制剂的富含acetogenins或其分离分子的鳄梨(Perseaamericana)提取物。该富含acetogenins的提取物表现出芽孢萌发抑制活性,例如对天然细菌芽孢的杀芽孢和/或抑芽孢活性,所述细菌芽孢来自肉毒梭菌(蛋白水解性和非蛋白水解性)、艰难梭菌(Clostridiumdifficile)和生孢梭菌(Clostridiumsporogenes)、和芽孢杆菌(Bacillusspp.)及其他病原性和非病原性细菌。我们还发现富含acetogenin的提取物或其分离分子还表现出芽孢萌发抑制活性,例如针对热激和/或压激细菌芽孢的杀芽孢或抑芽孢活性,因此能用在食品、美容品和药物组合物中来抑制其生长。我们还发现在冷冻条件下,该富集提取物作为抗微生物剂对抑制其他无芽孢形成型革兰氏阳性细菌(例如单核细胞增多性李斯特菌)的活力细胞生长是有效的。保护富含acetogenins的提取物在经热处理、压力处理或通过其他热或非热保存技术稳定化的制剂中的用途也是本发明的一部分。附图简述图1:存在于鳄梨种子中的化合物的初步提取图示,用于评估所述化合物对革兰氏阳性细菌的营养细胞、天然芽孢和热激芽孢的抗菌活性。图2:提取溶剂类型对鳄梨果核粗提物针对生孢梭菌(ATCC7955)的营养细胞、天然芽孢和热激芽孢生长的抗菌活性的影响。提取物以12.5μg固体的终含量进行测试。数据用三次重复的平均值±平均值标准误差来表示。图3:振荡对用己烷从鳄梨果核提取物中提取抗菌化合物的影响,评估所述化合物对生孢梭菌(ATCC7955)营养细胞、天然芽孢和热激芽孢生长的抗菌活性。提取物以12.5μg固体的终含量进行测试。数据用三次重复的平均值±平均值标准误差来表示。具有相同字母的数值表示差异不显著(LSD检测,p<0.05)。图4:用丙酮或乙醇代替己烷从鳄梨果核中获得生物活性化合物的提取时间的效果比较,所述化合物抑制生孢梭菌(ATCC7955)营养细胞的生长。提取物以12.5μg固体的终含量进行测试。数据用三次重复的平均值±平均值标准误差来表示。具有相同字母的数值表示差异不显著(LSD检测,p<0.05)。图5:用丙酮或乙醇代替己烷从鳄梨果核中获得生物活性化合物的提取时间的效果比较,所述化合物抑制生孢梭菌(ATCC7955)天然芽孢的生长。提取物以12.5μg固体的终含量进行测试。数据用三次重复的平均值±平均值标准误差来表示。具有相同字母的数值表示差异不显著(LSD检测,p<0.05)。图6:用丙酮或乙醇代替己烷从鳄梨果核中获得生物活性化合物的提取时间的效果比较,所述化合物抑制生孢梭菌(ATCC7955)热激芽孢的生长。提取物以12.5μg固体的终含量进行测试。数据用三次重复的平均值±平均值标准误差来表示。具有相同字母的数值表示差异不显著(LSD检测,p<0.05)。图7:A)该图表示用丙酮对存在于鳄梨种子中的化合物进行初步提取,随后在己烷:甲醇体系中对初步提取物进行分配以在各相中分别获得F001和F002部分,随后用于评估它们针对革兰氏阳性细菌的营养细胞、天然芽孢和热激芽孢的抗菌活性。B)该图表示用己烷:甲醇体系对存在于鳄梨种子中的化合物进行同步提取和分配,分别获得F003和F004部分,随后用于评估其对革兰氏阳性细菌的营养细胞、天然芽孢和热激芽孢的抗菌活性。图8:如图7中描述获得的提取物F001-F004对生孢梭菌(ATCC7955)的营养细胞、天然芽孢和热激芽孢生长的抗菌活性评估。提取物以12.5μg固体的终含量进行测试。数据用三次重复的平均值±平均值标准误差来表示。具有相同字母的数值表示差异不显著(LSD检测,p<0.05)。图9:用于如图7A中描述获得的下相F002(甲醇)的第二次分配的双相体系(乙酸乙酯:水)的上相和下相对生孢梭菌(ATCC7955)的营养细胞、天然芽孢和热激芽孢生长的抗菌活性评估。提取物以12.5μg固体的终含量进行测试。数据用三次重复的平均值±平均值标准误差来表示。具有相同字母的数值表示差异不显著(LSD检测,p<0.05)。(字母c表示圆盘抑制区数值为0cm,因此在图表上没有竖条高度)图10:用于如实施例1中描述获得的丙酮粗提物分配的双相体系(己烷:甲醇)的上相和下相对生孢梭菌(ATCC7955)的营养细胞、天然芽孢和热激芽孢生长的抗菌活性评估。提取物以12.5μg固体的终含量进行测试。数据用三次重复的平均值±平均值标准误差来表示。具有相同字母的数值表示差异不显著(LSD检测,p<0.05)。图11:按实施例1中描述获得的丙酮粗提物的未皂化化合物(unsaponifiablescompounds)和从实施例5中描述的用于丙酮粗提物分配的双相体系(己烷:甲醇)的上相获得的未皂化化合物对生孢梭菌(ATCC7955)的营养细胞、天然芽孢和热激芽孢生长的抗菌活性评估。提取物以12.5μg固体的终含量进行测试。数据用三次重复的平均值±平均值标准误差来表示。具有相同字母的数值表示差异不显著(LSD检测,p<0.05)。(字母d表示圆盘抑制区数值为0cm,因此在图表上没有竖条高度)图12:通过反相快速离心分配色谱法(RP-FCPC)获得的流分对生孢梭菌(ATCC7955)的营养细胞和热激芽孢生长的抗菌活性评估,所述RP-FCPC对用于实施例5中描述的丙酮粗提物分配的双相体系(庚烷:甲醇)的上相(庚烷)来进行。用于进行RP-FCPC的溶剂体系为庚烷:甲醇(1:1),甲醇用作流动相。流分以12.5μg固体的终含量进行测试。图13:通过正相快速离心分配色谱法(NP-FCPC)获得流分对生孢梭菌(ATCC7955)的营养细胞、天然芽孢和热激芽孢生长的抗菌活性评估,所述NP-FCPC对用于实施例5中描述的丙酮粗提物分配的双相体系(庚烷:甲醇)的上相(庚烷)来进行。用于进行NP-FCPC的溶剂体系为庚烷:甲醇(1:1),庚烷用作流动相。流分以12.5μg固体的终含量进行测试。图14:通过正相快速离心分配色谱法(NP-FCPC)获得的流分对金黄色葡萄球菌和枯草芽孢杆菌的营养细胞生长的抗菌活性评估,所述NP-FCPC对用于实施例5中描述的丙酮粗提物分配的双相体系(庚烷:甲醇)的上相(庚烷)来进行。用于进行NP-FCPC的溶剂体系为庚烷:甲醇(1:1),庚烷用作流动相。流分以12.5μg固体的终含量进行测试。图15:如实施例5中描述获得的己烷和乙酸乙酯上相的温度(25-100℃/60分钟)处理对生孢梭菌(ATCC7955)的营养细胞生长的抑制活性的影响。图16:如实施例5中描述获得的己烷和乙酸乙酯上相的温度(25-100℃/60分钟)处理对生孢梭菌(ATCC7955)的天然芽孢细胞生长的抑制活性的影响。图17:实施例10中描述获得的活性物集合(activepool)中存在的流分的色谱图随其分配系数(Kd)增加的发展变化。流分通过高效液相色谱和二极管阵列检测仪在220nm下进行分析。编号表示不同流分的共有峰。图18:实施例10中描述的活性流分集合中存在的活性化合物浓度。详述本发明提供一系列步骤以从鳄梨(PerseaAmericana)中获得富含天然抗微生物、抗菌或抑制芽孢萌发的化合物的提取物,用于提供抗微生物、抗菌或芽孢萌发抑制作用。本发明的一方面,提取物来自鳄梨果实可食用部分的种子或肉质中果皮。本发明的一方面,对鳄梨组织(种子或中果皮)的提取通过极性溶剂或非极性溶剂提取来实现。本发明该方面的一个实施方案是一种方法,所述方法从鳄梨属(包括但不限于americana和gratissima(鳄梨))中制备天然抗微生物、抗菌或抑制芽孢萌发的化合物浓缩物,用于提供抗微生物、抗菌或芽孢萌发抑制作用(包括但不限于革兰氏阳性细菌的营养细胞和芽孢的生长),所述方法包括:(a)用极性溶剂对种子或其他鳄梨植物组织(例如中果皮(干的或肉质的)和/或叶)进行提取;(b)接着进行从鳄梨的极性溶剂提取物中或直接从磨碎的种子或其他鳄梨植物组织中富集acetogenins的纯化过程;或者(a1)用非极性溶剂对种子或其他鳄梨植物组织(例如中果皮(干的或肉质的)和/或叶)进行提取;(b1)接着进行从鳄梨的非极性溶剂提取物中或直接从磨碎的种子或其他鳄梨植物组织(例如中果皮(干的或肉质的)和/或叶)中富集acetogenins的纯化过程。在本发明该方面的一个实施方案中,用于提取或纯化的极性溶剂独立包括(单独或者作为混合物)但不限于C1-C4醇(例如甲醇、乙醇、异丙醇、丁醇)、二甲基亚砜、四氢呋喃、丙酮、乙腈或其混合物。在本发明该方面的一个实施方案中,用于提取或纯化的非极性溶剂独立包括(单独或者作为混合物)但不限于己烷、庚烷、乙醚、乙酸乙酯、石油醚、氯仿、甲苯、甲基叔丁基醚、甲基异丁酮或其混合物。本发明的另一方面为从极性或非极性溶剂提取物中富集acetogenins的纯化方法。在本发明的一个实施方案中,纯化包括两相分配体系。本发明的又一实施方案中,两相分配体系使用的极性溶剂(一种或作为组合)包括但不限于水、C1-C4醇(例如甲醇、乙醇、异丙醇、丁醇)、二甲基亚砜、四氢呋喃、丙酮、乙腈,和使用的非极性溶剂(一种或作为组合)包括但不限于例如己烷、庚烷、乙醚、乙酸乙酯、石油醚、氯仿、甲苯、甲基叔丁基醚、甲基异丁酮和其混合物。参考例如AlainP.Foucault,L.Chevolot.Counter-currentchromatography:instrumentation,solventselectionandsomerecentapplicationstonaturalproductpurification(逆流色谱法:仪器、溶剂选择和近期对天然产物纯化的应用).J.Chromatogr.A808(1998)3–22.本发明的另一实施方案中,双相分配体系的溶剂体系包括但不限于单独或并行(inparallel)的甲醇:庚烷和/或水:己烷和/或水:丁醇和/或甲基叔丁基醚:乙腈:水、和/或庚烷:乙酸乙酯:乙腈、庚烷:乙酸乙酯:甲醇:水(以不同比率)以富集某一相中的活性物(activity)。纯化方法的另一实施方案为包括快速或高效离心分配色谱法(FCPC或HPCPC)或逆流色谱法(CCC)在内的分配分离,以根据各化合物相应的分配系数为减少和/或消除提取过程中所得的杂质而对化合物进行分离。参考例如AlainP.Foucalt.CentrifugalPartitionChromatography(离心分配色谱法),ChromatographicSciencesSeries,vol.68,Marcel-Dekker(1995)。与在同样的固体浓度(2.5mg/mL)下评价的鳄梨种子的丙酮粗提物相比较,CPC纯化方法可增加来自鳄梨的抑制革兰氏阳性细菌营养细胞和芽孢生长的天然抗菌化合物的浓度(超过4倍),以提供至少1.2到2倍或更高的抗菌性质。本发明的另一方面,提取和纯化方法任选没有导致被富集或分离的化合物的皂化。在本发明该方面的另一实施方案中,提取和纯化过程任选没有导致被富集或分离的化合物的皂化。本发明的提取物包含m/z范围在329到381内的化合物,或者至少下列acetogenins之一:PersenoneA、PersenoneB或近期发现的(2R,5E,16E)-1-乙酰氧基-2-羟基-4-氧代-十九-5,16-二烯或也是最近发现的(2R,16E)-1-乙酰氧基-2-羟基-4-氧代-十九-16,18-二烯,所述化合物可从鳄梨(Perseaamericana)中纯化或者经化学合成来富集生物活性。本发明的另一方面是式(I)化合物其中R1为氢或乙酰基;R2为氢或羟基保护基;和R3为具有至少两个反式(E)构型碳-碳双键的烯基。羟基保护基可以是任何已知的羟基保护基,例如在Greene和Wuts,ProtectiveGroupsinOrganicSynthesis(ThirdEdition)(有机合成中的保护基团(第三版)),Wiley-Interscience(1999)中描述的那些基团。如上文所述,式(I)化合物包括所有立体异构体形式,其包括化合物(R)和(S)形式和顺式(Z)和反式(E)形式。对本发明来说,反式(E)形式包括具有式-CH=CH2的末端烯烃(参见例如下述的(2R,16E)-1-乙酰氧基-2-羟基-4-氧代-十九-16,18-二烯)。本发明该方面的一个实施方案是式(I)化合物,其中R1为氢或乙酰基;R2为氢或羟基保护基;和R3为具有两个碳-碳双键反式构型的C5-C22烯基。本发明该方面的另一实施方案是式(I)化合物,其中R1为氢或乙酰基;R2为氢;和R3为具有两个反式构型碳-碳双键的C5-C22烯基。本发明该方面的另一实施方案是式(I)化合物,其中R1为乙酰基;R2为氢;和R3为含有12到18个碳原子的烯基,该基团具有两个反式构型的碳-碳双键;并且与OR2键合的碳呈(R)构型。本发明该方面的另一实施方案是式(I)化合物,其中该化合物的C-16和C-17位置上有一个双键。本发明该方面的另一实施方案是具有下式的化合物(2R,16E)-1-乙酰氧基-2-羟基-4-氧代-十九-16,18-二烯或(2R,5E,16E)-1-乙酰氧基-2-羟基-4-氧代-十九-5,16-二烯式(I)化合物可通过使用Bull等(1994)描述的方法合成,该方法通过使卤化(例如氯化或溴化)二甲基-1,3-二氧杂环戊烷-乙基镁与式R3COX(其中R3如上文所限定,X为卤化物)的试剂反应,随后由二氧杂环戊烷环形成二醇来进行。或者,式(I)化合物可通过使用MacLeod等(1995)描述的方法合成,该方法通过获得不饱和脂肪酸并将其转化为其相应的甲酮,然后将该相应的甲酮与2-乙酰氧基乙醛反应来进行。形成式(I)化合物的方法是例述性的,并不旨在包括制备所述化合物的所有可能的方式。提取物或化合物可单独用于或与本领域熟知的其他抗菌物质联合用于食品或支持细菌生长的组合物中以提高对细菌的营养状态或芽孢状态的抗菌活性,所述其他抗菌物质包括但不限于亚硝酸盐化合物、乳酸链球菌肽、细菌素、月桂酰精氨酸乙酯、精油、乙二胺四乙酸(EDTA)和抗坏血酸衍生物、苯甲酸衍生物及其他物质。抑制细菌营养形式和芽孢形式生长的鳄梨提取物或从中获得的化合物或提取物可与载体、赋形剂、包囊剂和其他配制组分一起配制成固体形式以改进生物活性组分的应用和稳定性。制备本发明的提取物、化合物和组合物以使它们可通过口服、经皮肤、胃肠外、经鼻、经眼睛、经耳、舌下、经直肠或经阴道给药。经皮肤给药包括局部施用或透皮给药。胃肠外给药包括静脉内、关节内、肌肉内和皮下注射,还包括使用输液技术。一种或多种本发明化合物可与一种或多种非毒性药学上可接受的成分联合构成组合物。这些组合物可通过应用本领域已知技术制备,例如下列文献中教导的技术:Remington—TheScienceandPracticeofPharmacy(制药科学与实践)2005年第21版,Goodman和Gilman的ThePharmacologicalBasisofTherapeutics(治疗学的药理学基础)2005年第11版和Ansel的ParmaceuticalDosageFormsandDrugDeliverySystems(药物剂型和药物递送系统)2005年第8版Allen等编辑,LippincottWilliams&Wilkins。本发明的另一方面是含有本发明提取物或化合物的食品,包括但不限于鱼类、甲壳类、鱼类替代品、甲壳类替代品、肉类、肉类替代品、家禽产品、蔬菜、绿叶蔬菜、酱料、乳液、饮料、果汁、果酒、啤酒、乳制品、蛋制品、果酱、果冻、谷物制品、烘焙制品和糖果。本发明的另一方面是含有本发明提取物或化合物的美容产品,包括但不限于例如霜剂、凝胶、粉末、洗液、遮光剂、唇膏、沐浴露、药草提取物和支持细菌生长的制剂。本发明的另一方面是表面包含本发明提取物或化合物的产品,包括但不限于工作台面、门、窗户、把手、外科手术设备、医疗工具、能污染人类及动物等的接触表面。本发明的另一方面是本发明提取物或分离的化合物或包含所述提取物或化合物的组合物为有需要的患者提供抗菌、抗微生物或杀芽孢作用的用途。本发明的另一方面是本发明提取物或分离的化合物或包含所述提取物或化合物的组合物为食品或美容组合物提供抗菌、抗微生物或杀芽孢作用的用途。本发明的另一方面是本发明提取物或分离的化合物或包含所述提取物或化合物的组合物为表面提供抗菌、抗微生物或杀芽孢作用的用途。该作用可通过将表面暴露于本发明的提取物或分离化合物,或将本发明的提取物或分离化合物压制在或嵌入表面而产生。抗微生物、抗菌和/或杀芽孢的作用可用于微生物、细菌或其他芽孢形成型微生物,所述微生物属包括但不限于梭菌(Clostridium)、芽孢杆菌(Bacillus)、脂环酸杆菌(Alicyclobacillus)和李斯特菌.抗微生物、抗菌和/或杀芽孢的作用可用于微生物、细菌或芽孢,其来自下列种,包括但不限于肉毒梭菌、产气荚膜梭菌、艰难梭菌、炭疽芽孢杆菌(Bacillusanthracis)、蜡状芽孢杆菌、枯草芽孢杆菌、地衣芽孢杆菌(Bacilluslichniformis)、酸土脂环酸杆菌(Alicyclobacillusacidoterrestris)、嗜酸脂环酸杆菌(Alicyclobacillusacidiphilus)、单核细胞增多性李斯特菌。上述式(I)描述了从本发明提取物和纯化中得到的新型化合物。为了提供抗微生物、抗菌和/或杀芽孢的作用,式(I)化合物在R3上可具有少至一个碳-碳双键,该双键可为顺式(Z)或反式(E)构型。式(I)化合物在该范围的一个实施方案为,碳-碳双键是C-5/C-6、C-12/C-13、C-15/C-16、C-16/C-17或其任何组合,该双键为反式或顺式键。所述化合物的范围的另一实施方案为,碳-碳双键单独位于C-5和C-6、和/或C-16和C-17、和/或C-12和C-13、和/或C-15和C-16,作为反式或顺式键。式(I)化合物进一步范围的实例包括但不限于:(2R,5E,12Z,15Z)-1-乙酰氧基-2-羟基-4-氧代-二十一-5,12,15-三烯(PersenoneA)(5E)-1-乙酰氧基-2-羟基-5-十九烯-4-酮(PersenoneB)或(2R,12Z,15Z)-1-乙酰氧基-2-羟基-4-氧代-二十一-12,15-二烯(Persin)此外,为了提供抗微生物、抗菌和/或杀芽孢的作用,式(I)化合物可单独或与下述式(II)化合物联合使用:其中R1为氢或乙酰基;R2和R4为氢或羟基保护基;和R3为具有至少一个碳-碳双键的烯基。本发明该方面的一个实施方案是式(II)化合物,其中R1为氢或乙酰基;R2和R4为氢或羟基保护基;和R3为具有一个顺式和/或反式构型的碳-碳双键的C5-C22烯基。本发明该方面的另一实施方案是式(II)化合物,其中R1为氢或乙酰基;R2和R4为氢;和R3为具有两个反式构型碳-碳双键的C5-C22烯基。本发明该方面的另一实施方案是式(II)化合物,其中R1为乙酰基;R2和R4为氢;和R3为含有12到18个碳原子的烯基,该基团具有一个反式构型的碳-碳双键;并且与R2和R4键合的碳呈(S)构型。本发明该方面的另一实施方案是式(II)化合物,其中该化合物的C-16和C-17位置上具有双键。本发明该方面的另一实施方案是下述式(II)化合物的用途:(2S,4S)-1-乙酰氧基-2,4-二羟基-n-十七-16-烯式(II)化合物能通过还原式(I)化合物中的酮来进行合成,或通过使用Sugiyama等(1982)所公开的方法使二甲基-1,3-二氧杂环戊烷-4-乙醛与R3MgX(其中R3如上文所限定,X为卤化物)化合物反应而合成。本发明的另一方面,抗菌、抗微生物或抑芽孢/杀芽孢的作用至少与其他已知的抗菌、抗微生物或抑芽孢/杀芽孢试剂一样有效,例如LAE(月桂酰精氨酸乙酯单盐酸盐)、亚硝酸盐或乳酸链球菌肽(具有34个氨基酸的多环肽)。作为天然产物的或容易从中得到的本发明提取物或分离化合物的用途优于其他已知的非天然产物的或不容易获得的试剂。非天然产物使用在生产食品或美容品时特别有异议,这可能需要对其应用进行管理批准。本发明的实施方案可根据如下所述的项目中的任意一项或多项。项目1.从鳄梨属(Perseasp.)制备天然抗微生物、抗菌或抑制芽孢萌发的化合物浓缩物用于提供抗微生物、抗菌或抑制芽孢萌发作用的方法,所述方法包括:(a)用极性溶剂对种子或其他鳄梨植物组织(例如中果皮(干的或新鲜的)和/或叶)进行提取;(b)接着进行从极性溶剂鳄梨提取物中或直接从磨碎的种子或其他鳄梨植物组织中富集acetogenins的纯化过程;或者(a1)用非极性溶剂对种子或其他鳄梨植物组织(例如中果皮(干的或新鲜的)和/或叶)进行提取;(b1)接着进行从非极性溶剂鳄梨提取物中或直接从磨碎的种子或其他鳄梨植物组织中富集acetogenins的纯化过程。项目2.根据项目1所述的方法,其中所述极性溶剂包括但不限于C1-C4醇(例如乙醇、异丙醇、甲醇)、二甲基亚砜、四氢呋喃、丙酮、乙腈或其混合物。项目3.根据项目1或2所述的方法,其中纯化过程包括使用极性溶剂(一种或作为组合)和非极性溶剂(一种或作为组合)的双相分配体系,所述极性溶剂包括但不限于水、C1-C4醇(例如乙醇、异丙醇、甲醇)、二甲基亚砜、四氢呋喃、丙酮、乙腈,所述非极性溶剂包括但不限于己烷、庚烷、乙醚、乙酸乙酯、石油醚、丁醇、氯仿、甲苯、甲基叔丁基醚、甲基异丁酮及其混合物。项目4.根据项目1-3中任一项所述的方法,其中双相分配体系的溶剂体系包括但不限于单独或并行的甲醇:庚烷和/或水:己烷和/或水:丁醇和/或甲基叔丁基醚:乙腈:水、和/或庚烷:乙酸乙酯:乙腈、庚烷:乙酸乙酯:甲醇:水(以不同比率)以富集各相之一中的活性物。项目5.根据项目1-4中任一项所述的方法,其中所述纯化过程为包含快速或高效离心分配色谱法(FCPC或HPCPC)或逆流色谱法(CCC)的分配分离。项目6.根据项目1-5中任一项所述的方法,其中所述浓缩物包含以下化合物中的至少一种项目7.根据项目1-6中任一项所述的方法,其中浓缩物还包含:式(I)化合物其中R1为氢或乙酰基;R2为氢或羟基保护基;和R3为具有至少一个碳-碳双键的烯基;和/或式(II)化合物其中R1为氢或乙酰基;R2和R4为氢或羟基保护基;和R3为具有至少一个碳-碳双键的烯基。项目8.根据项目1-7中任一项所述的方法,其中任选提取和纯化过程不导致被富集或分离的化合物的皂化。项目9.抗微生物、抗菌或抑制芽孢萌发的组合物或产品,所述组合物或产品包含项目1-8中任一项所述的提取物。项目10.根据项目9所述的抗微生物、抗菌或抑制芽孢萌发的组合物或产品,其中所述组合物或产品选自:(a)药物组合物,所述药物组合物适于通过口服、经皮肤、胃肠外、经鼻、经眼睛、经耳、舌下、经直肠或经阴道给药;(b)食品,所述食品包括但不限于鱼类、甲壳类、鱼类替代品、甲壳类替代品、肉类、肉类替代品、家禽产品、蔬菜、绿叶蔬菜、酱料、乳液、饮料、果汁、果酒、啤酒、乳制品、蛋制品、果酱、果冻、谷物制品、烘焙制品和糖果;(c)美容品,所述美容品包括但不限于以下产品,例如霜剂、凝胶、粉末、洗液、遮光剂、唇膏、沐浴露、药草提取物和支持细菌生长的制剂;和(d)表面产品,所述表面产品包括但不限于工作台面、门、窗户、把手、外科手术设备、医疗工具、能污染人类、动物等的接触表面。项目11.式(I)化合物其中R1为氢或乙酰基;R2为氢或羟基保护基;和R3为具有至少两个反式构型碳-碳双键的烯基。项目12.根据项目11所述的化合物,其中所述化合物的C-16和C-17位置处存在双键。项目13.根据项目12所述的化合物,所述化合物具有下式项目14.根据项目1-8中任一项所述的提取物用于制备组合物或产品的用途,所述组合物或产品用于为有需要的患者或产品提供抗菌、抗微生物或抑制芽孢萌发作用。项目15.根据项目14所述的用途,其中所述抗菌、抗微生物或芽孢萌发抑制作用可适用于包括但不限于梭菌、芽孢杆菌、脂环酸杆菌和李斯特菌属的微生物、细菌或芽孢。项目16.根据项目15所述的用途,其中所述抗微生物、抗菌或芽孢萌发抑制作用可适用于包括但不限于以下种的微生物、细菌或芽孢:肉毒梭菌、产气荚膜梭菌、艰难梭菌、炭疽芽孢杆菌、蜡状芽孢杆菌、枯草芽孢杆菌、地衣芽孢杆菌、酸土脂环酸杆菌、嗜酸脂环酸杆菌、单核细胞增多性李斯特菌。本发明还由下面的非限制性实施例进行描述,这些实施例进一步阐述了本发明,并且既不意图也不应该被认为限制本发明的范围。实施例实施例1:鳄梨种子丙酮和己烷提取物的抗菌和杀芽孢活性使用胶体研磨机将鳄梨种子磨碎,获得平均半径为0.5-2毫米的颗粒。磨碎的鳄梨种子(50克)与丙酮或己烷以原料:溶剂=1:2(w/v)的比率混合。将混合物在25℃储存24小时以获得鳄梨种子粗提物。通过真空过滤法将种子从提取物中分离。粗提物在真空下通过旋转蒸发仪(35℃,22英寸汞柱(inHg))进行蒸发干燥,得到的干物质进行称重并重新溶解于丙酮中,得到的终浓度为2.5mg/ml。使用该调整过的样品进行抗菌和杀芽孢测试(见图1)。将调节过的溶液(5μL)转移到无菌的、由Whatman1号滤纸制成的、直径为6mm的圆盘上进行抗菌评估,由此在溶剂蒸发后每个圆盘含有12.5μg来自上述富集的鳄梨种子提取物的固体。在与提取物同样的条件下处理实验对照,含有5μL丙酮的圆盘用作阴性对照,5μL乳酸链球菌肽溶液(30mg/ml在无菌水中)加到圆盘中用作阳性对照,实现每个圆盘中乳酸链球菌肽剩余含量(residualconcentration)为150μg。所有测试圆盘置于生物安全柜中约1-2小时以蒸发溶剂。按照HealthCanada(FoodDirectorate,2010)官方操作手册中描述的方法,制备含有约1-2x108CFU/ml的生孢梭菌(ATCC7955)营养细胞、分离的天然芽孢或分离的热激芽孢的约0.1光密度(在600nm)的悬浮液。转移等份的悬浮液(100μL)到含有15ml固体培养基(TPGY培养基)的培养皿中,用无菌塑料棒涂抹均匀。四个圆盘(每个含12.5μg待测提取物)和两个额外的圆盘(一个溶剂空白对照和一个乳酸链球菌肽阳性对照)置于单个平皿中,在37℃厌氧条件下进行温育。36小时后测定圆盘周围的抑制区域的直径(厘米)。丙酮和己烷鳄梨种子提取物对芽孢形成型细菌生孢梭菌的营养细菌细胞、天然芽孢和热激芽孢表现出明显的抗菌活性(见图2)。除了己烷提取物对热激芽孢表现出比丙酮提取物高约20%的杀芽孢活性之外,丙酮和己烷提取物的活性没有显著区别。丙酮和己烷鳄梨种子提取物都比阳性对照(乳酸链球菌肽,150μg)表现出更高的抗菌活性。阳性对照处理(乳酸链球菌肽)对营养细菌细胞、芽孢和热激芽孢分别造成1.3、1.0和0.9cm的抑菌区域。用于获得粗提物的鳄梨种子一旦被磨碎,可在有氧或无氧并低于25℃的条件下贮藏至少14天而并不影响对芽孢形成型细菌的抗菌活性。因此在富含生物活性化合物的提取物制备前,鳄梨种子可作为整体或粗粉贮藏。实施例2:与其他植物来源相比较,鳄梨种子提取物对芽孢形成型细菌的营养细胞和热激细菌芽孢的特异活性本发明的功效可通过芒果果仁的抗菌粗提物制备物进行观测,所述制备物已经在现有技术中被报道为表现出对芽孢形成型细菌营养细胞的抗菌活性(Kabuki等,2000)。按照实施例1中所述的方法制备鳄梨(Perseaamericana)和芒果果仁(Mangiferaindica)的粗提物,并测试其对生孢梭菌的营养细胞和热激芽孢生长的抗菌活性(见表1)。表1:鳄梨种子和芒果果仁提取物对生孢梭菌(ATCC7955)的营养细胞和热激芽孢的抗菌活性。与所期望的相反,只有鳄梨种子提取物对所测试的两种细菌生理阶段(营养细胞和热激芽孢)表现出活性。芒果果仁提取物表现出对芽孢形成型细菌营养细胞的抗菌活性,但对细菌芽孢或热激芽孢的生长没有活性。因此,本实施例证实鳄梨植物化学物的化学性质对芽孢形成型细菌的营养细胞、芽孢和热激芽孢生长的抑制有显著作用。实施例3:振荡对鳄梨种子丙酮和己烷粗提物抗菌活性的影响类似于实施例1,通过胶体研磨机磨碎鳄梨种子获得平均半径为0.5-2mm的颗粒。磨碎的鳄梨种子(50克)与己烷按照原料:溶剂=1:2(m/v)的比率混合。在25℃下以200rpm振荡或浸泡混合物24小时以获得鳄梨种子粗提物。通过旋转蒸发仪(35℃,22英寸汞柱)将粗提物蒸发至干燥,并将得到的干物质称重。如实施例1中所述,在丙酮中重新溶解干物质至终浓度为2.5mg/ml用于抗菌评估。生孢梭菌(ATCC7955)因为是肉毒梭菌的已知代替性微生物而被用作测试微生物。对营养细菌细胞、天然芽孢和热激芽孢的抗菌活性按照实施例1中的方法进行测定。观察到振荡处理对鳄梨种子己烷提取物针对营养细菌细胞、天然芽孢和热激芽孢的抗菌活性具有显著效果(图3)。尽管振荡提取的干物质的收率更高,但与经过振荡获得的提取物相比较,未经过振荡获得的提取物显示出更高的抗菌活性。通过本实施例我们可以发现,振荡提高了对存于鳄梨种子中的其他非抗菌化合物的提取,因此稀释了抗菌活性化合物的浓度。因此抗菌的鳄梨种子提取物必须通过浸渍方式获得,最好不要振荡。由于化合物的稀释,经过振荡获得的提取物与阳性对照(乳酸链球菌肽,150μg)相比产生相同或更低的抑制区,所述阳性对照对营养细胞、芽孢和热激芽孢分别显示为1.3、1和0.9cm。实施例4:提取时间和提取溶剂类型(丙酮、乙醇和己烷)对鳄梨种子粗提物抗菌性质的影响用胶体研磨机磨碎鳄梨种子获得平均半径为0.5-2mm的颗粒。磨碎的鳄梨果核(50克)与丙酮或乙醇或己烷按原料:溶剂=1:2(m/v)的比率混合。在35℃下以200rpm摇动混合物24小时以获得鳄梨种子粗提物。提取过程中,分别在0.5、5和24小时从每种粗提物中收集等份试样。用旋转蒸发仪(35℃,22英寸汞柱)将不同提取时间获得的粗提物蒸发至干燥,并将得到的干物质称重。将干物质重新溶解于丙酮中至终浓度为2.5mg/ml。生孢梭菌(ATCC7955)用作抗菌测定中的测试微生物。对营养细胞、天然芽孢和热激芽孢的抗菌活性(使用圆盘抑制区测定法)按照实施例1中的方法进行测定。为了与在相同时间间隔内使用其他溶剂(丙酮和乙醇)进行比较,己烷提取物对营养细菌细胞、芽孢和热激芽孢的抗菌活性看作是100%的抑制作用。对营养细胞的抗菌活性的结果如图4所示,其表明30分钟的提取时间后得到的乙醇提取物与同样条件下用己烷获得的提取物相比有完全相同的活性。相反,在30分钟提取时间下丙酮提取物仅表现出己烷提取物所观测到的抗菌活性的70%,5小时提取时间之后数值达到己烷提取物所观测到的活性80%的最大抗菌活性。因此,本实施例证实,因为丙酮和乙醇是极性溶剂,在测试条件下增加提取时间稀释了生物活性化合物的浓度,和/或使该溶液饱和。此外并且与所期望的相反的是,针对芽孢形成型细菌营养细胞的抗菌化合物性质造成使用乙醇比丙酮有更好的回收率(图4)。提取物对天然芽孢的抗菌性质的结果如图5所示;其表明随提取时间(0.5-24小时)的增加,使用丙酮或乙醇作为提取溶剂没有表现出任何差异。乙醇还对针对天然芽孢有抗菌性质的化合物的提取更具有选择性。不同提取物对热激芽孢生长的抗菌活性结果如图6所示,其表明了不同的趋势,在提取时间为30分钟时两种溶剂(丙酮和乙醇)对抗菌分子的提取有相同的效率。然而,当使用丙酮作为溶剂时,观测到提取物中抗菌分子的浓度随时间变化明显下降,提取时间从0.5到5小时,细菌抑制作用分别从100%降到低于80%,之后活性保持稳定。乙醇不像丙酮提取物一样容易地在提取时间内使目标化合物饱和,因此对于该溶剂,在0.5到5小时的提取时间内没有观察到差异。因此本实施例证实了乙醇与己烷一样对抗菌化合物的提取有效,所述抗菌化合物对芽孢形成型细菌的营养细胞、天然芽孢和热激芽孢的生长具有抑制活性。实施例5:丙酮鳄梨种子提取物与磨碎的鳄梨种子在庚烷:甲醇双相不混溶溶剂体系中分级分离的比较本实施例中,按照实施例1所述制备鳄梨种子的丙酮粗提物,并蒸发至干。从50克磨碎的鳄梨种子中得到的干燥丙酮粗提物直接加到含有两种不混溶溶剂体系的分离漏斗中,该溶剂体系由100ml庚烷(上相F002)和100ml甲醇(下相F001)组成,用于提取物中含有的极性和非极性化合物的分配(图7A)。为了进行比较,将50克磨碎的鳄梨种子直接加入到还包含100ml庚烷(上相)和100ml甲醇(下相)的不混溶溶剂体系中来制备第二双相体系。为了在一步内选择性地提取和分配种子中存在的化合物,将该混合物在35℃下以200rpm振荡24小时。随后,用真空过滤法将种子从提取物中分离。使该体系的上相(F003)和下相(F004)在分离漏斗中形成,并分别收集,见图7B。分别用旋转蒸发仪(35℃,22英寸汞柱)将前述不同相(F001-F004)蒸发至干,并将得到的干物质称重。将干燥的分离物重新溶解于丙酮中至终浓度为2.5mg/ml,用于后面对生孢梭菌(ATCC7955)的抗菌活性的评估。按照实施例1所述的方法测定对营养细胞、天然芽孢和热激芽孢的抗菌活性(圆盘抑制区测定法)。对热激芽孢的圆盘抑制区结果显示,用两种不混溶溶剂直接提取磨碎的鳄梨种子减少了杂质量,杂质可移到上相并稀释活性化合物的作用(图8),因此这说明了对抑制芽孢萌发的化合物进行一步分离是一个更好的选择。然而根据对营养细胞抑制的抗菌结果,两种方法造成类似的结果,没有一种方法比另一种更有优势。因此本实施例证实,在所进行的对磨碎种子直接提取和对干燥的丙酮鳄梨种子提取物分配的两个评估中,抗菌物质都被富集于庚烷:甲醇双相体系的上相中。然而在下相(F002和F004)中也观测到残留的活性,表明上相被活性化合物饱和或所述化合物在两个体系的下相中有部分溶解性。因此建立后续的提取,对从甲醇下相F002中回收的蒸干的固体再提取;用来回收残留抗菌化合物的后续提取体系(第二双相不混溶溶剂体系)由乙酸乙酯(100ml)和水(100ml)构成。乙酸乙酯相和水相的抗菌活性如图9所示。上述第二个双相不混溶溶剂体系比之前使用的第一个体系更具极性,并且在下相(主要是水)中没有发现残留的抗菌活性。为进一步完成本实施例,作为上述庚烷:甲醇体系的选择,还评估了其他两个额外的不混溶溶剂体系如何分配干燥的丙酮鳄梨种子提取物并获得富含生物活性分子的制备物。通过使用己烷和甲醇双相体系,还在己烷上相中回收到抗菌化合物(图10)。然而,庚烷:甲醇双相体系被证明对上相中化合物的回收更有效率,因为它显示出迁移到下相的所述化合物更少。通过使用水双相体系(用水、盐和乙醇)进行了另外的测试,以从乙醇粗提物中分离抗菌化合物,并且在主要由乙醇组成的上相中回收到目标化合物。实施例6:皂化对鳄梨种子的丙酮和己烷提取物的抗菌活性的影响按照实施例5中所述的方法,使用己烷和甲醇分配鳄梨种子的丙酮粗提物。分离各相,用旋转蒸发仪(35℃,22英寸汞柱)将含有极性较小化合物的富含己烷的上相蒸发至干。根据Broutin等(2003),皂化是获得生物活性部分的必要步骤,所述生物活性部分包括脂肪醇或萜醇、固醇、生育酚、类胡萝卜素和叶黄素,它们保留在未皂化部分中并不溶于水。然而本实施例证实,本发明的抗菌化合物不能用同样的方法获得,这表明了不同的化学性质。按照Broutin等(2003)并且作了一些修改来进行对丙酮粗提物和被分配的己烷上相部分的皂化,以回收未皂化部分和选择性地提取在其中存在的呋喃脂质和多羟基化脂肪醇。分别将5克每份的提取物与2.5ml12N的氢氧化钾和10ml乙醇相混合,然后静置4小时。该水-乙醇混合物随后转移到分离漏斗中,加入17.5ml水,然后加入17.5ml二氯乙烷。振荡混合物30秒,然后让混合物分成两相。回收有机相(下相)。重复此操作6次,将有机相合并一起并用水洗涤。用旋转蒸发仪(35℃,22英寸汞柱)将二氯乙烷蒸发至干,并将得到的干物质称重。将干物质重新溶解于丙酮中至终浓度2.5mg/ml。按照实施例1所述进行抗菌和杀芽孢活性测试(圆盘抑制区检测法),生孢梭菌(ATCC7955)用作测试微生物。如图11所示,只有从丙酮粗提物中提取的未皂化物质表现出对芽孢的圆盘抑制作用,表明用己烷和甲醇对丙酮提取物的分配消除了未皂化的化合物。有趣地是,从丙酮粗提物中得到的这些未皂化部分比非碱性处理的丙酮粗提物活性更低(图2),特别是其针对细菌芽孢的抑制活性。丙酮粗提物中未皂化的化合物对营养细胞比对芽孢有更高的特异性。用己烷-甲醇进行分配减少了未皂化物质对营养细胞的活性,表明这些化合物中的一些可能在分配期间迁移到醇类相中。将己烷上相和甲醇下相(丙酮粗提物中的未皂化物质在该两相中分配)的抗菌性质与实施例1中所述的丙酮和己烷粗提物的活性相比较,两相的抗菌性质都明显较低。因此结果表明,活性化合物对碱性处理敏感,或者在皂化处理和随后的分配步骤期间改变或消除了某些期望的化学性质。因此,不应考虑通过以分离或增加抗菌和杀芽孢活性为目的的皂化步骤来获得鳄梨种子活性提取物。实施例7:鳄梨种子丙酮提取物的分配色谱按照实施例1所述获得鳄梨种子的丙酮粗提物并蒸发至干,然后按照实施例5所述在庚烷:甲醇双相体系中进行分配。用旋转蒸发仪(35℃,22英寸汞柱)将含有极性较小化合物的富含庚烷的上相(F001)蒸发至干,然后注入具有1000ml分离柱的快速离心分配色谱仪BenchScale中,用庚烷和甲醇对化合物进行分级分离。庚烷被泵入分离柱中并作为固定相(740ml)。随后将甲醇(移动相)以10mL/min的流速泵入分离柱。设置转速为800rpm。在体系达到流体动力平衡后,将从庚烷:甲醇双相体系(鳄梨种子丙酮提取物在其中分配)蒸干的上相中得到的浓缩提取物(65ml)注入FCPC中。在前170分钟内,使用甲醇来洗脱流分,之后用庚烷作为流动相洗脱100分钟。用流分收集器将来自分离柱出口的流出液按每管10ml收集在试管中。收集各流分的1ml等份试样用于抗菌和抑芽孢/杀芽孢活性测试。用高速真空浓缩器将等份试样蒸发至干,记录来自各流分的固体重量,形成70个连续流分集合,终浓度为2.5mg/ml集合。按照实施例1所述评定每个集合对生孢梭菌的营养细胞、天然芽孢和热激芽孢的抗菌性质。用高速真空浓缩器对各流分的剩余体积(9ml)进行蒸发至干,贮藏于-80℃,进一步用于化学鉴定评估。如图12所示,抗菌活性存在于分配系数(Kd)小于0.5(更精确地,Kd值为0.19到0.35之间)的流分中,表明活性化合物在庚烷中的溶解度是在甲醇中的至少2倍。此外,这些流分对营养细胞的活性与对芽孢的活性相比差异轻微,因为营养细胞生长的抑制物更多地扩散至极性较大的流分中。与之前使用纯度较低的提取物的实验相比,通过FCPC分配提取物增加了期望的抗菌活性(达到3cm的抑菌区直径),清楚表明有必要去除可能稀释抗菌化合物浓度的其他植物化学物(图12)。与图2所示的鳄梨种子的己烷和丙酮粗提物的数据相比较,一些FCPC流分的抗菌活性增加了至少50%。图12所示的结果还证实,如同图8,活性化合物对庚烷相比对甲醇相有更大的亲和力。为了进一步表征具有最高活性流分的抗菌活性,测定其最小抑制浓度(MIC)就非常重要,MIC定义为抑制过夜培养后的微生物可视化生长的抗菌剂的最低浓度。与乳酸链球菌肽相比,经FCPC获得的Kd为0.3和0.4的流分显示出对生孢梭菌的营养细胞的MIC比对天然芽孢或热激芽孢更低(表2)。Kd为0.4的流分对芽孢生长抑制的活性几乎是乳酸链球菌肽的2倍,但Kd为0.3的流分的活性是乳酸链球菌肽的约15倍。但在热激芽孢的情况中,乳酸链球菌肽与Kd为0.4的流分之间的差异较不明显,然而仍表现出期望的对芽孢萌发的抑制性质。表2:通过对固体的反相快速离心分配色谱法(RF-FCPC)获得的流分的最小抑制浓度(MIC),所述固体回收自按实施例5所述用于分配鳄梨的丙酮粗提物的双相体系(庚烷:甲醇)的上相(庚烷)中。*使用50mg/ml的初始母液对乳酸链球菌肽进行测定,鳄梨流分为2.5mg/ml。如本实施例所示,在上述(反相)条件下经FCPC分离(portion)的相同提取物还可用庚烷作为流动相(正相)进行分配,并且色谱分离的结果遵循相同的抗菌活性性能(图13)。因此,FCPC获得的最初流分比最后流分(更具极性)具有更好的活性,图13显示了抗菌活性一直保持存在到分配系数达到7.2,表明溶解度在庚烷中是在甲醇中的超过7.2倍的其他化合物不抑制生孢梭菌营养细胞或芽孢的生长。实施例8:从鳄梨种子的丙酮提取物获得对除了生孢梭菌外的其他微生物具有抑制活性的流分的分配色谱法按照实施例1所述获得鳄梨种子的丙酮粗提物并蒸发至干,然后按照实施例5所述在庚烷:甲醇双相体系中进行分配。用旋转蒸发仪(35℃,22英寸汞柱)将含有极性较小化合物的富含庚烷的上相蒸发至干,然后用实施例7中描述的正相条件将其注入快速离心分配色谱仪中。随后将从正相FCPC中获得的流分用于评价其对金黄色葡萄球菌和枯草芽孢杆菌营养细胞生长的抗菌活性。如图14所示,与极性非常低的抑制生孢梭菌化合物不同的化合物抑制金黄色葡萄球菌和枯草芽孢杆菌营养细胞的生长,因为与实施例7中显示的生孢梭菌的抑制结果相对比,当用分配系数高于7的流分接种圆盘时,观测到针对这些微生物的圆盘抑菌区。表3总结了前述实验的抗菌结果,这些结果获自对实施例1的粗提物、按实施例5所述分配的提取物和实施例6中的未皂化流分的评估。有趣地是,正如观测的那样,与图14所示富集的CPC流分所观察到的更强的抑制效果相比较,它们没有表现出任何对金黄色葡萄球菌生长的抑制效果,并且在对枯草芽孢杆菌测试时显示出非常低的圆盘抑制区。表3:不同粗提物对金黄色葡萄球菌和枯草芽孢杆菌营养细胞生长的抗菌活性的评估实施例9:高压和温度对抗菌活性稳定性的影响按实施例1所述获得鳄梨果核的丙酮粗提物并蒸发至干。然后如实施例5中所述使鳄梨经丙酮提取的固体在己烷-甲醇双相体系中分配,随后通过乙酸乙酯:水的第二分配体系来彻底回收存在于第一分配体系(也在实施例5中有所描述)的下相(甲醇)中的活性化合物。将己烷和乙酸乙酯相分别回收,用旋转蒸发仪(35℃,22英寸汞柱)蒸发至干。然后将两相装至小瓶中,置于300MPa和600MPa(分别为43,511和87,022psi)高液体静压(HHP)处理3分钟和6分钟。没有观测到高压处理后的提取物的抗菌性质有显著不同,表明观测到抗菌活性的化合物对HHP处理稳定。还通过在25到100℃的温度范围内持续60分钟来测试活性化合物的热稳定性。对生孢梭菌营养细胞生长有活性的化合物(图15)比对天然芽孢生长有抑制活性的化合物(图16)对热处理的敏感性较小。正如图15所示,参照保持在25℃下未经热处理的对照提取物的抑制活性,乙酸乙酯提取物和己烷提取物在经过100℃处理60分钟后对营养细胞的抑制活性分别降低了20%和23.5%。热激芽孢对经热处理的己烷粗提物和乙酸乙酯粗提物的作用更有抗性;参照保持在25℃下的对照提取物所观测到的抑制活性,上述提取物置于100℃下60分钟后,对热激芽孢的抑制活性降低了50%。实施例10:生物活性流分中发现的主要化合物的鉴定如实施例7中所述,将具有最高圆盘抑制区的(图12)、通过使用反相快速离心分配色谱法(RP-FCPC)获得的和Kd在0.19到0.35之间的流分混合在一起,构成“活性流分集合”。首先将这些流分(13)调整到同样的浓度(192.3mg/ml),取等体积(100μl)的各流分,并用乙醇调整到终浓度为50mg/ml。图17显示存于活性物集合中流分的色谱概况随其Kd增加的发展变化。用HPLC级甲醇将经过蒸发的各流分的等份试样调整到1mg/ml,取2μl注入。使用的分离柱为ZorbaxExtanded-C18(100x3mmd.i.,3.5μm)柱。移动相包括100%作为A相的水和100%作为B相的甲醇。所用溶剂梯度如表4所示,经6分钟的柱平衡时间后,以0.38ml/min流速泵入。检测仪波长设置为220nm。表4:用来完成经快速离心分配色谱法收集的流分色谱分离的溶剂梯度(A=水,B=甲醇)。时间(min)%A%B0307041585221090240100260100图17显示鳄梨抗菌化合物活性物集合的典型色谱图。色谱图上标示的数字表示在220nm下有吸收的共有峰,标记为化合物1到10,表5显示其分子量和分子式信息。一些所述化合物之前已经在鳄梨组织中报道过,可是其中还有一些化合物由于在抗菌流分中被发明人发现而作为新的化学化合物在本文中公开。在大多数生物活性流分中,诸如1、2、4和11的化合物与化合物7和9相比浓度更低(图17)。表5:抗菌流分中发现的化合物的化学性质。a共同名称,如果有的话实施例11:富含抗菌化合物的流分的抑芽孢和杀芽孢活性的评估为了证实实施例10中描述的活性流分集合(分配系数为0.19到0.35)有抑芽孢或杀芽孢的活性,有必要检测其最小抑制浓度(MIC)和最小杀菌浓度(MBC)。在一般术语中,MIC定义为抑制过夜培养后微生物可视化生长的抗菌剂的最低浓度。而MBC为阻止微生物在不含抗生素或抗菌剂的新鲜琼脂培养基上传代培养后生长的抗菌剂的最低浓度。在浓度为0.005到2.5mg/ml的范围内测试活性流分集合,乳酸链球菌肽用作对照。表6显示,由于活性流分集合的MIC几乎是乳酸链球菌肽MIC的十分之一,所以活性流分集合作为生孢梭菌芽孢生长抑制物比乳酸链球菌肽好得多。根据Smola(2007),如果MBC/MIC的比率≤4,则该化合物可被考虑用作杀芽孢剂,并且如果MBC/MIC的比率>4,则它只能作为抑芽孢剂。在本实施例中,乳酸链球菌肽和鳄梨活性流分集合都表现出杀芽孢作用。表6:乳酸链球菌肽和分离自鳄梨种子活性流分的集合对生孢梭菌热激芽孢生长的最小抑制浓度(MIC)、最小杀菌浓度(MBC)和MBC/MIC比率。样本MIC(μg/ml)MBC(μg/ml)MBC/MICa乳酸链球菌肽2341561.5活性流分集合19.519.51aMBC/MIC比率≤4显示杀芽孢活性。MBC/MIC比率>4显示抑芽孢活性。实施例12:从生物活性流分中分离的化学化合物的抗菌活性在本实施例中,按照先前在实施例1所述,测定实施例10(表5)中描述的相同的分离化合物在0.5mg/ml的浓度下对生孢梭菌营养细胞和热激芽孢生长以及对金黄色葡萄球菌、绿脓假单胞菌(P.aeuroginosa)、大肠杆菌和枯草芽孢杆菌营养细胞的抗菌活性。如表7所示,化合物6(峰6)和persenoneB(峰9A)在对生孢梭菌进行测试时,显示出更高的抗菌性质,然后是persenoneA(峰7)。另外,尽管作为已知抗菌剂的乳酸链球菌肽以100倍的更高浓度进行测试,但是在所有的生物活性化合物中,只有persin(峰9B)显示出比乳酸链球菌肽还低的活性。由于已经报道乳酸链球菌肽能抑制真菌孢子萌发(Prusky等,1982),并且在本实验中它似乎活性最低,因此可以认为其他生物活性化合物对真菌孢子具有更高的活性。表7:图17中分离的活性化合物对生孢梭菌(ATCC7955)营养细胞和热激芽孢生长的抗菌活性评估。特别要注意的是,所有对生孢梭菌营养细胞和热激芽孢表现出最高活性的化合物(表7中报告的从最高到最低抗菌活性中提及的化合物6、PersenoneB及PersenoneA)都含有C5-C6双键(参见表8),这让人意想不到。此外,如果比较persin(化合物9B)和persenoneA(化合物7)的结构,唯一的差别在于persin(化合物9B)中没有C5-C6双键,在本实施例中我们证实了其抗菌活性降低了37.5%。此外,persenoneB(化合物9A)和化合物6之间唯一的结构区别在于后者还具有C16-C17双键,但它们的抑制活性相同。该观察结果还支持以下发现,C5-C6双键是本文所述化合物能提高抗菌活性所需的结构特征,而且由于C16-C17双键是存在于化合物3中的唯一不饱和键,并且化合物3比persin(化合物9B,包含两个不饱和键,但在C16-C17之间没有)有更高的活性,因此C16-C17双键也是优选的结构特征。表8:鳄梨种子中具有抗菌活性的化合物的化学结构和共同名称。大多数对生孢梭菌的抗菌化合物(化合物6、PersenoneB和PersenoneA)没有表现出对金黄色葡萄球菌、绿脓假单胞菌或大肠杆菌的抑制活性(表9),但化合物6还显示出对枯草芽孢杆菌生长的最高抑制活性,其次是persenoneA。由于化合物6是新发现的化合物,其之前并没有作为鳄梨的成分被报道过,因此没有关于其抗菌或任何其他生物活性的在先报道。之前PersenoneA作为抗真菌剂被报道过,但根据表7的结果,其抗菌活性特异性针对芽孢形成型革兰氏阳性细菌。按实施例10所述获得的表现出对生孢梭菌具有抗菌性质(实施例10)的活性流分集合,在本实施例中仅产生对芽孢形成型细菌枯草芽孢杆菌的抑制性质。表9:生物活性化合物和活性流分集合对枯草芽孢杆菌、金黄色葡萄球菌、绿脓假单胞菌和大肠杆菌营养细胞的圆盘抑制区。按实施例11所述测定化合物6、PersenoneB(化合物9A)和PersenoneA(化合物7)对生孢梭菌热激芽孢萌发的MIC。如表10所示,上述三种化合物的MIC值为乳酸链球菌肽MIC值的1/15-1/30,证实了它们对细菌芽孢的功效。活性流分集合的MIC为19.5μg/ml(实施例11),而分离后persenoneA和persenoneB的MIC则降到7.8μg/ml,但是集合内PersenoneB的抗菌性质并不与其低浓度相对应,这是因为所述集合虽然含有较少μg的所述化合物但是当与其他生物活性分子联合时所述化合物活性有加强的表现。有趣地是,分离化合物仅表现出对生孢梭菌的抑制芽孢活性,并没有表现出活性流分集合所观察到的杀芽孢生物活性(表6)。表10:乳酸链球菌肽、化合物6、PersenoneB和A对生孢梭菌热激芽孢的最小抑制浓度(MIC)。实施例13:鳄梨种子提取物与用于控制单核细胞增多性李斯特菌的冷藏温度结合的抗菌活性实施例10所描述的活性流分集合还表现出对能在冷冻条件下生长的革兰氏阳性细菌的冷应激营养细胞(cold-stressedvegetativecell)的抗菌效果,例如单核细胞增多性李斯特菌。在最适宜单核细胞增多性李斯特菌生长的温度37℃下,富含生物活性acetogenins的鳄梨提取物集合对该测试的微生物营养细胞生长没有明显的抑制作用(表11)。与所期望的相反,我们发现鳄梨种子提取物集合在冷冻条件下特别有用于抑制单核细胞增多性李斯特菌的生长。而且,表12说明当测定本发明分离的鳄梨acetogenins对单核细胞增多性李斯特菌营养细胞生长的抗菌活性时,具有C5-C6双键这一期望特征的化合物可用于控制冷冻条件下贮藏的食品和生物基质中的单核细胞增多性李斯特菌。表11:鳄梨种子提取物与贮藏低温结合的对单核细胞增多性李斯特菌营养细胞生长的抗菌活性。表12:分离的鳄梨化合物与冷藏结合对单核细胞增多性李斯特菌营养细胞生长的抗菌活性。实施例14:富集的鳄梨提取物中抗菌化合物的定量表7所述的活性流分集合(实施例10)中存在的抗菌化合物浓度如图18所示。PersenoneA占活性流分集合干重的36.32%,persenoneB仅占0.20%,化合物6的量最低(0.05%)。似乎混合物中的其他组分没有影响PersenoneA的抑制活性,因此没有必要更进一步的纯化。表13显示针对生孢梭菌的大多数生物活性化合物(化合物6、PersenoneB和PersenoneA)在新鲜鳄梨果肉和种子中具有非常近似的浓度,PersenoneA浓度最高。本实施例的信息是有重大意义的,因为如果生物活性化合物也存在于果肉中,那么它们可容易地从果实的其他部分获得。本实施例还证实了人类在吃这种水果时就可按实现其抗菌活性所需要的浓度来获得生物活性分子;因此建立它们在食品、医学和美容领域的商业潜能。表13:新鲜鳄梨果肉和种子中化合物6、PersenoneB和PersenoneA的浓度(ug/g鲜重)。已经如上详细描述了本发明的各种实施方案,应理解的是,上文所说的发明不限于以上说明书中描述的具体内容,因为可能存在其许多显然的变化,而不脱离本发明的精神或范围。参考文献列表Adikaram,N.K.B.,Ewing,D.F.,Karunaratne,A.M.,Wijeratne,E.M.K.1992.Antifungalcompoundsfromimmatureavocadofruitpeel(不成熟鳄梨果皮中的抗真菌化合物).Phytochemistry.31:93-96.AOACOfficialMethod966.04SporicidalActivityofDesinfectants(消毒剂的杀芽孢活性).Revised2002.Barattaetal.1998.Chemicalcomposition,antimicrobialandantioxidantactivitiesoflaurel,sage,rosemary,oreganoandcorianderessentialoils(月桂、鼠尾草、艾菊、牛至和芫荽精油的化学组成、抗菌和抗氧化活性).J.Essent.OilRes.10(6):618-627.Beltran,J.B.U.andBonaventura,J.S.Useofcationicpreservativeinfoodproducts(阳离子防腐剂在食品中的应用).US7,862,842B2.Jan4,2011.Bevilacqua,A.,Sinigaglia,M.,Corbo,M.R.2008.Alicyclobacillusacidoterrestris:Newmethodsforinhibitingsporegermination.InternationalJournalofFoodMicrobiology(嗜酸耐热菌:抑制芽孢萌发的新方法).125:103-110.Bittner,S.,Gazit,S.,Blumenfeld,A.1971.Isolationandidentificationofaplantgrowthinhibitorfromavocado(来自鳄梨的植物生长抑制剂的分离和鉴定).Phytochemistry,10(7):1417-1421Blackburn,P;,Gusik,SA.,Polak,J.,Rubino,S.D.,Nisincompositionsforuseasenhanced,broadrangebactericides(用作增强的广泛杀菌剂的乳酸链球菌肽组合物).US5,217,950.June8,1993.Brown,B.I.1972.IsolationofUnpleasantFlavorCompoundsintheAvocado(Perseaamericana)(鳄梨中异味化合物的分离).J.Agr.FoodChem.20:753-757.Bull,S.DandCarman,R.M.SynthesisoftheAvocadoAntifungal,(Z,Z)-2-hydroxy-4-oxohenicosa-12,15-dien-1-ylacetate(鳄梨抗真菌剂乙酸(Z,Z)-2-羟基-4-氧代二十一-12,15-二烯-1-基酯的合成).Aust.J.Chem.,1994,47,pp.1661-1672.Burt.S.2004.Essentialoils:theirantibacterialpropertiesandpotentialapplicationsinfoods-areview(精油:其抗菌性质和在食品中的潜在应用——综述).InternationalJournalofFoodMicrobiology.94:223-253.Chang,C.F.,Isogai,A.,Kamikado,T.,Murakoshi,S.,Sakurai,A.,Tamura,S.Isolationandstructureelucidationofgrowthinhibitorsforsilkwormlarvaefromavocadoleaves(鳄梨叶中蚕幼虫生长抑制剂的分离和结构阐明).Agr.Biol.Chem,1975,39(5),pp.1167-1168.Chia,T.W.R.,Dykes,G.A.2010.Antimicrobialactivityofcrudeepicarpandseedextractsfrommatureavocadofruit(PerseaAmericana)ofthreecultivars(三个栽培种的成熟鳄梨果实的外果皮和种子粗提物的抗菌活性).PharmaceuticalBiology48(7):753-756.Deans,S.G.,Ritchie,G.1987.Antibacterialpropertiesofplantessentialoils(植物精油的抗菌活性).InternationalJournalofFoodMicrobiology.5:165-180.Domergue,F.,Helms,G.L.,Prusky,D.,Browse,J.2000.Antifungalcompoundsfromidioblastcellsisolatedfromavocadofruits(从鳄梨果实中分离的异细胞中的抗真菌化合物).Phytochemistry54:183-189.FoodDirectorate,2010.Clostridiumbotulinumchallengetestingofready-to-eatfoods(肉毒梭菌对速食食品检测的挑战).FoodDirectorateHealthProductsandFoodBranch.HealthCanada.VersionNumber1,Issue:November24,2010.HashimuraH,UedaC,KawabataJ,KasaiT.2001.Acetyl-CoAcarboxylaseinhibitorsfromavocado(PerseaamericanaMill.)fruits(鳄梨果实中的乙酰辅酶A碳酸酶抑制剂).BiosciBiotechnolBiochem.65:1656–1658.Jensen,LloydB.1951.Processforextractionofantibioticmaterial(抗生素原料的提取方法).US2,550,254.SWIFT&CO.UnitedStates.Kabuki,T.,Nakajima,H.,Arai,M.,Ueda,S.,Kuwabara,Y.,Dosako,S.2000.Characterizationofnovelantimicrobialcompoundsfrommango(MagniferaindicaL.)kernelseeds(芒果果仁中的新型抗菌化合物的表征).FoodChem.71:61-66.Kashman,Y.,Néeman,I.andLifshitz,A.1969.NewCompoundsfromAvocadoPear(鳄梨中的新型化合物).Tetrahedron.25:4617-4631.Kim,O.K.,Murakami,A.,Nakamura,Y.,Takeda,N.,Yoshizumi,H.,Ohigashi,H.2000a.Novelnitricoxideandsuperoxidegenerationinhibitors,persenoneAandB,fromavocadofruit(鳄梨果实中的新型氧化氮和过氧化物发生抑制剂,persenoneA和B).JournalofAgriculturalandFoodChemistry48(5),pp.1557-1563.Kim,O.K.,Murakami,A.,Nakamura,Y.,Kim,H.W.,Ohigashi,H.2000b.Inhibitionby(-)-PersenoneA-relatedCompoundsofNitricOxideandSuperoxideGenerationfromInflammatoryLeukocytes((-)-PersenoneA相关化合物对炎症白细胞中氧化氮和过氧化物发生的抑制作用).Bioscience,BiotechnologyandBiochemistry64(11),pp.2500-2503.Kim,O.K.,Murakami,A.,Takahashi,D.,Nakamura,Y.,Torikai,K.,Kim,H.W.,Ohigashi,H.2000c.AnAvocadoConstituent,PersenoneA,SuppressesExpressionofInducibleFormsofNitricOxideSynthaseandCyclooxygenaseinMacrophages,andHydrogenPeroxideGenerationinMouseSkin(鳄梨成分PersenoneA抑制巨噬细胞中氧化氮合成酶和环氧合酶可诱导形式的表达和鼠皮肤内过氧化氢的产生).Bioscience,BiotechnologyandBiochemistry64(11),pp.2504-2507.King,W.,Ming,X.Antibacterialcompositionforcontrolofgrampositivebacteriainfoodapplications(食品应用中的控制革兰氏阳性细菌的抗菌组合物).US6,620,446B2.Sep16,2003.Kobiler,I.,Prusky,D.,Midland,S.,Sims,J.J.,Keen,N.T.1993.CompartmentationofantifungalcompoundsinoilcellsofavocadofruitmesocarpanditseffectonsusceptibilitytoColletotrichumgloeosporioides(鳄梨果实中果皮的油细胞中的抗真菌化合物的区分及其对盘长孢状刺盘孢易感性的影响).Physiol.Mol.PlantPathol.43:319-328.Maseko,R.B.2006.Synthesisofauthenticorganicstandardsofantibacterialcompoundsisolatedfromavocados(自鳄梨中分离的抗菌化合物可靠的有机标准品的合成).MasterofScienceThesis.TshwaneUniversityofTechnology,SouthAfrica.MacLeod,J.K.andSchaeffler,L.AShortEnantioselectiveSynthesisofaBiologicallyActiveCompoundfromPerseaAmericana(PerseaAmericana中的生物活性化合物简短的对映选择性合成).J.Nat.Prod.,vol.58.,no.8,pp.1270-1273(August1995).Monticello,D.J.Controlofmicrobialgrowthwithlantibiotic/lysozymeformulations(羊毛硫抗生物/溶菌酶制剂对微生物生长的控制).US5,458,876.Oct17,1995.Murakoshi,S.,Isogai,A.,Chang,C.F.,Kamikado,T.,Sakurai,A.,Tamura,S.Theeffectsoftwocomponentsfromavocadoleaves(PerseaamericanaMill.)andrelatedcompoundsonthegrowthofsilkwormlarvae(鳄梨叶(PerseaamericanaMill.)中两种成分及相关化合物对蚕幼虫生长的影响).BombyxmoriL.NipponOyoDobutsuKonchuGakkaishi1976;20:87–91.NCCLSM100-S12:PerformanceStandardsforAntimicrobialSusceptibilityTesting(抗菌剂易感性测试的执行标准):TwelfthInformationalSupplement(ISN1-56238-454-6).Néeman,I.,Lifshitz,A.,Kashman,Y.1970.Newantibacterialagentisolatedfromtheavocadopear(鳄梨中分离的新型抗菌剂).Appliedmicrobiology,470-473.Oberlies,N.H.,Rogers,L.L.,Martin,J.M.andMcLaughlin,J.L.1998.CytotoxicandInsecticidalConstituentsoftheUnripeFruitofPerseaamericana(鳄梨未熟果实中的细胞毒素和杀虫成分).J.Nat.Prod.61:781-785.Oelrichs,P.B.,Ng,J.C.,Seawright,A.A.,Ward,A.,Schaffeler,L.,MacLeod,J.K.1995.Isolationandidentificationofacompoundfromavocado(Perseaamericana)leaveswhichcausesnecrosisoftheacinarepitheliumofthelactatingmammaryglandandthemyocardium(鳄梨(Perseaamericana)叶中引起分泌乳汁的乳腺腺泡上皮细胞和心肌层坏死的化合物的分离和鉴定).NaturalToxins,3(5):344-349Perumalla,A.V.S.,Hettiarachchy,N.S.2011.Greenteaandgrapeseedextracts-Potentialapplicationsinfoodsafetyandquality(绿茶和葡萄籽提取物——在食品安全和质量领域的潜在用途).FoodResearchInternational.44(4):827-839.Prusky,D.,Keen,N.T.,Sims,J.J.,Midland,S.L.,1982.PossibleinvolvementofanantifungaldieneinthelatencyofColletotrichumgloeosporioidesonunripeavocadofruits(抗真菌双烯可能与未成熟鳄梨果实中盘长孢状刺盘孢的潜伏期有关).Phytopathol.72(12),1578.Prusky,D.,Plumbley,R.A.,Koliber,I.,1991a.ModulationofnaturalresistanceofavocadofruitstoColletotrichumgloeosporioidesbyCO2(鳄梨果实对盘长孢状刺盘孢的天然抗性受CO2调节).PlantPathol.40,45.Prusky,D.,Koliber,I.,Fishman,Y.,Sims,J.J.,Midland,S.L.,Keen,N.T.,1991b.IdentificationofanAntifungalCompoundinUnripeAvocadoFruitsanditsPossibleInvolvementintheQuiescentInfectionsofColletotrichumgloeosporioides(未熟鳄梨果实中抗真菌化合物的鉴定及其可能涉及到盘长孢状刺盘孢的静止传染).J.Phytopathol.132,319.Ramos-Jerz,M.D.Phytochemicalanalysisofavocadoseeds(PerseaamericanaMill.,c.v.Hass)(鳄梨种子(PerseaamericanaMill.,c.v.Hass)的植物化学分析).[Ph.D.Dissertation],Alemania,2007.TechnishenBrauschweig.Rayman,M.K.1981.Nisin:apossiblealternativeoradjuncttonitriteinthepreservationofmeats(乳酸链球菌肽:在肉类保存中可能取代亚硝酸盐或与之联合使用).AppliedandEnvironmentalMicrobiology.41(2):375-380.Rodríguez-Carpena,J.G.,Morcuende,D.,Andrade,M.J.,Kylli,P.andEstévez,M.2011.Avocado(PerseaamericanaMill.)phenolics,invitroantioxidantandantimicrobialactivitiesandinhibitionoflipidandproteinoxidationinporcinepatties(鳄梨酚醛树脂,体外抗氧化和抗菌活性及猪肉饼中脂类和蛋白的氧化抑制).J.Agric.FoodChem.59:5625-5635.Rodriguez-Saona,C.,Millar,J.G.,Trumble,J.T.1997.Growthinhibitory,insecticidal,andfeedingdeterrenteffectsof(12Z,15Z)-1-acetoxy-2-hydroxy-4-oxo-heneicosa-12,15-diene,acompoundfromavocadofruit,toSpodopteraexigua(鳄梨果实中的化合物(12Z,15Z)-1-乙酰氧基-2-羟基-4-氧代-二十一-12,15-二烯对Spodopteraexigua的生长抑制、杀虫和禁食效果).JournalofChemicalEcology,23(7):1819-1831SeawrightA.A.,OelrichsP.B.,Ng,J.C.,MacLeodJ.K.,Ward,A.,Schaffeler,L.,Carman,R.M.1995.Methodoftreatmentofcanceraswellasmethodofinhibitionoflactationinmammals(癌症治疗方法及哺乳动物哺乳期的抑制方法).PatentCoop.TreatyInt.Appl.NoWO95/22969,AstralianNationalUniversity,Australia.Sivanathan,S.,Adikaram,N.K.B.,1989.BiologicalActivityofFourAntifungalCompoundsinImmatureAvocado(未成熟鳄梨中四种抗菌化合物的生物学活性).JournalofPhytopathology,125(2):97-109Smola,M.2007.Contributionàl’étudedelaformulationetdel’analysephysicochimiquedeformulationspédiatriquesmicroémulsionnées.[DocteurinSciencesPharmaceutiques].UniversiteLouisPasteurStrasbourg.France.Sugiyama,T.,Sato,A.andYamashita,K.Synthesisofallfourstereoisomersofantibacterialcomponentofavocado(鳄梨抗菌成分的所有四种立体异构体的合成).Agric.Biol.Chem.,46(2),481-485(1982).Tang,Y.,Shi,Y.,Zhao,W.,Hao,G.andLe,G.2008.InhibitionofFood-BornePathogensbyT1,aNovelAntimicrobialPeptideasaPotentialFoodPreservative(T1,一种新型的作为潜在食品防腐剂的抗菌肽,对食品耐受性病原体的抑制作用).InternationalJournalofFoodEngineering.Vol4,Iss.4,Art,14.p.1-19.Ugbogu,O.C.&Akukwe,A.R.2009.TheantimicrobialeffectofoilsfromPentaclethramacrophyllaBent,ChrysophyllumalbidumG.DonandPerseagratissimaGaerthFonsomelocalclinicalbacteriaisolates(PentaclethramacrophyllaBent、ChrysophyllumalbidumG.Don和PerseagratissimaGaerthF中的油对某些本地临床分离菌的抗菌效果).AfricanJournalofBiotechnology,8(2):285-287.PollackS,PerezA,PlattnerK.2010.Fruitandtreenutsoutlook(果实和树坚果展望).EconomicResearchService.UnitedStatesDepartmentofAgricultureUSDAFTS-341/March26,2010.Valeri,A.,andN.Gimeno.1954.Phytochemicalandtoxicologicalstudyofpericarpoftheavocadopear(鳄梨果皮的植物化学和毒理学研究).Rev.Med.Vet.Parasitol(Maracay)13:37.Wilhoit,D.Filmandmethodforsurfacetreatmentoffoodstuffswithantimicrobialcompositions(抗菌组合物用于食品表面处理的薄膜和方法).US5,573,797.Nov12,1996.Wilhoit,D.Antimicrobialcompositionforsurfacetreatmentoffoodstuffs(用于食品表面处理的抗菌组合物).US5,573,800.Nov12,1996.Wilhoit,D.Surfacetreatmentoffoodstuffswithantimicrobialcompositions(使用抗菌组合物的食品表面处理).US5,573,801.Nov12,1996.Yang,H.,Li,X.,Tang,Y.,Zhang,N.,Chen,J.andCai,B.2009.SupercriticalfluidCO2extractionandsimultaneousdeterminationofeightannonaceousacetogeninsinAnnonagenusplantseedsbyHPLC-DADmethod(超临界流体CO2提取法和通过HPLC-DAD方法同时对番茄枝属植物种子中的八种番茄枝科acetogenins的检测).JPharmBiomedAnal.49:140-144.当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1