一种基于手性自组装纳米传感器实现胞内端粒酶活性检测的方法与流程
本发明涉及一种基于手性自组装纳米传感器实现胞内端粒酶活性检测的方法,属于材料化学
技术领域:
。
背景技术:
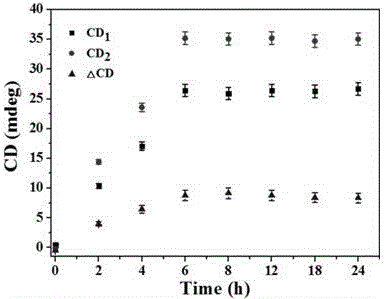
:端粒酶是由蛋白质和一段RNA链组成的核糖蛋白酶,它是一种能够在真核生物染色体末端的DNA重复序列并使DNA得以延长的逆转录酶。据研究表明,在正常组织细胞中端粒酶的活性很低甚至无活性,然而肿瘤细胞中端粒酶则大量表达且活性明显增强,这就使得端粒酶的检测对肿瘤诊断、预后判断及治疗具有重要意义。目前端粒酶的检测方法皆基于其自身带有一段模板RNA,利用这段RNA,端粒酶能够在端粒末端逆转录合成端粒DNA的重复序列,以此来维持端粒长度,目前荧光素标记的端粒重复序列扩增法和杂交保护法检测端粒酶得到广泛应用,但此方法检测时间长,所需样品量大,易污染环境,结果不可靠,并且灵敏度低。所以发明一种方便快捷、环境污染小、灵敏度高的检测端粒酶的方法势在必行。圆二色光谱(CD)是一种已被广泛应用于化学和生物传感的分析方法,利用自组装纳米材料构建圆二色传感器进行生物传感得到了广泛的关注。相比于荧光技术检测,CD能够通过纳米粒子之间的等离子体−等离子体耦合、激子−等离子体耦合、混合偶极−偶极之间的耦合等,收集到样品足够多的信息,并达到灵敏度低的检测水平,具有更大的潜在生物标志物分析应用能力。因此,将端粒酶作为诊断标识物,通过自组装的手性大小金二聚体的纳米传感器实现细胞内端粒酶活性的检测是首次报道。技术实现要素:本发明的目的在于克服上述不足之处,提供一种基于手性自组装纳米传感器实现胞内端粒酶活性检测的方法。按照本发明提供的技术方案,一种基于手性自组装纳米传感器实现胞内端粒酶活性检测的方法,步骤为:(1)端粒酶引物序列组装构建的手性大小金二聚体传感器:柠檬酸还原法合成的25nm金纳米粒子GNP离心重悬后修饰巯基TEprimer序列;15nm金纳米粒子GNP修饰与linkerDNA部分互补的巯基TECS1序列,将得到的GNP-primer及GNP-CS1复合体混匀,通过linkerDNA1组装得到适配体序列组装的手性大小金二聚体primer-dimer;(2)端粒酶引物错配序列组装构建的手性大小金二聚体传感器:柠檬酸还原法合成的25nm金纳米粒子GNP离心重悬后修饰巯基TEmismatch序列;15nm金纳米粒子GNP修饰与linkerDNA部分互补的巯基序列TECS2,将得到的GNP-mismatch及GNP-CS2复合体混匀,通过linkerDNA2组装得到错配序列组装的手性大小金二聚体mismatch-dimer;(3)两种大小金二聚体修饰穿膜肽:将步骤(1)及(2)得到大小金二聚体分别与SH-PEG-5000和穿膜肽TAT混匀,偶联12h分别得到表面修饰有穿膜肽的手性大小金二聚体TAT-primer-dimer及TAT-mismatch-dimer;(4)两种大小金二聚体传感器在细胞内手性信号随时间的变化:分别将步骤(3)得到的两种穿膜肽修饰的手性大小金二聚体与一定数量的细胞共同培养不同时间点后,用胰蛋白酶消化细胞,分别得到细胞内含有不同量的手性primer-dimer及mismatch-dimer的细胞悬液;将细胞悬液进行圆二色性表征,记录不同时间点的手性信号,绘制散点图,得到胞内最佳检测时间;(5)基于大小金二聚体的手性信号实现胞内端粒酶实时检测:将步骤(3)得到穿膜肽修饰的手性TAT-primer-dimer与添加不同抑制剂和促进剂的细胞及未处理的细胞共同孵育,当存在待测物端粒酶时,传感器组装体逐渐解散,导致手性信号的变化,进而进行检测,建立胞内端粒酶活性与手性信号的标准曲线。具体步骤如下:(1)端粒酶引物序列组装构建的手性大小金二聚体传感器:柠檬酸还原法合成的25nm金纳米粒子GNP离心重悬于5mMpH7.4的PB缓冲液中,取100μL2nM25nm金纳米粒子将其与巯基TEprimer序列以摩尔浓度1︰5的比例混匀;15nm金纳米粒子GNP离心重悬于5mMpH7.4的PB缓冲液中,取100μL2nM15nm金纳米粒子与适配体部分互补的巯基TECS1序列以摩尔浓度1︰5的比例混匀,分别加入终浓度为50mM的NaCl溶液,充分混合后,室温孵育过夜后,离心3次除去溶液中未反应的DNA,分别重悬于100μL的5mMPB缓冲液中;取100μLGNP-primer及50μLGNP-CS1复合体混匀,加入5μL10μMlinkerDNA1组装得到端粒酶引物序列组装的手性大小金二聚体primer-dimer,再加入终浓度为50mMNaCl溶液进行老化,室温下孵育12h,再将组装体通过梯度离心纯化;(2)端粒酶引物错配序列组装构建的手性大小金二聚体传感器:柠檬酸还原法合成的25nm金纳米粒子GNP离心重悬于5mMpH7.4的PB缓冲液中,取100μL2nM25nm金纳米粒子将其与巯基TEmismatch序列以摩尔浓度1︰5的比例混匀;柠檬酸还原法合成的15nm金纳米粒子GNP离心重悬于5mMpH7.4的PB缓冲液中,取100μL2nM15nm金纳米粒子与适配体部分互补的巯基TECS2序列以摩尔浓度1︰5的比例混匀,分别加入终浓度为50mM的NaCl溶液,充分混合后,室温孵育过夜后,离心3次除去溶液中未反应的DNA,分别重悬于100μL的5mMPB缓冲液中;取100μLGNP-mismatch及50μLGNP-CS2复合体混匀,加入5μL10μMlinkerDNA2组装得到端粒酶引物错配序列组装的手性大小金二聚体mismatch-dimer,再加入NaCl溶液至终浓度为50mM进行老化,室温下孵育12h,再将组装体通过梯度离心纯化;(3)两种大小金二聚体修饰穿膜肽:将步骤(1)及(2)得到大小金二聚体分别与SH-PEG5000和穿膜肽TAT以1︰1000︰100的摩尔浓度混匀,室温孵育12h后,7500rpm离心20min,去除上清液,沉淀重悬于细胞培养液中,得到稳定的表面修饰有穿膜肽的手性TAT-primer-dimer及TAT-mismatch-dimer;(4)两种大小金二聚体传感器在细胞内手性信号随时间的变化:将细胞接种于24孔培养板中,使每孔中的细胞数量为104个,培养24h后去掉培养液,取8个孔加入终浓度为5nM的穿膜肽修饰的手性TAT-primer-dimer分别与104个细胞共同培养0h、2h、4h、6h、8h、12h、16h、24h;取8个孔加入终浓度为5nM的穿膜肽修饰的手性TAT-mismatch-dimer分别与104个细胞共同培养0h、2h、4h、6h、8h、12h、16h、24h;之后分别用胰蛋白酶消化细胞,分别得到细胞内含有不同量的手性primer-dimer及mismatch-dimer的细胞悬液;将细胞悬液进行圆二色性表征,记录不同时间点的手性信号,绘制散点图,得到胞内最佳检测时间;(5)基于大小金二聚体的手性信号实现胞内ATP实时检测:将步骤(3)得到穿膜肽修饰的手性TAT-primer-dimer与不同量EGCG抑制端粒酶活性后的细胞及未经抑制的细胞分别共孵育6h后,当存在待测物端粒酶时,组装体逐渐解散,导致手性信号的变化,进而进行检测;然后用胰蛋白酶消化细胞,分别得到细胞内含有不同解离程度的手性primer-dimer的细胞悬液,将细胞悬液进行圆二色性表征,并建立胞内端粒酶与手性信号的标准曲线。所述TEprimer序列如SEQIDNO.1所示,TECS1序列如SEQIDNO.2所示,linkerDNA1序列如SEQIDNO.3所示,TEmismatch序列如SEQIDNO.4所示,TECS2序列如SEQIDNO.5所示,linkerDNA2序列如SEQIDNO.6所示,TAT多肽序列如SEQIDNO.7所示;具体如表1。表1编号序列(5’-3’)长度TEprimerTTTTTTAATCCGTCGAGCAGAGTT24TECS1ATAGGTATATTTTTT15LinkerDNA1CCCTAACTAACCAACTCTGCTCGACGGATT30TEmismatchTTTTTTTATCCGTAGAGCAGCGTC24TECS2ATAGGTATATTTTTT15LinkerDNA2CCCTAACCCTAAGACGCTGCTCTACGGATA30TATYGRKKRRQRRRC12本发明的有益效果:本发明制备出了组装产率高,性质稳定,生物相容性好的的金纳米粒子二聚体,提供了能够通过手性自组装纳米传感器的圆二色光谱检测胞内端粒酶活性的方法,建立了细胞内端粒酶活性与手性信号强度两者之间的标准曲线,具有灵敏度高、选择性好,省时省力的优点,具有非常好的实际应用前景。附图说明图1是本发明的金纳米粒子二聚体在细胞中的生物透射电镜图。图2是本发明中两种大小金二聚体传感器在细胞内手性信号随时间的变化,绘制散点图。图3是本发明中穿膜肽修饰的手性TAT-primer-dimer与添加不同抑制剂及未处理的细胞分别共同孵育后,手性信号的变化谱图。图4是本发明胞内端粒酶活性与手性信号的标准曲线。具体实施方式以下实施例所用序列材料均购自生工生物工程(上海)股份有限公司。实施例1所有的玻璃仪器都用王水浸泡24h,并用双蒸水清洗,晾干备用。实验中使用的水均为18.2MΩ的Milli-Q超纯水。(1)端粒酶引物序列组装构建的手性大小金二聚体传感器:柠檬酸还原法合成的25nm金纳米粒子GNP离心重悬于5mMpH7.4的PB缓冲液中,取100μL2nM25nm金纳米粒子将其与巯基TEprimer序列以摩尔浓度1︰5的比例混匀;15nm金纳米粒子GNP离心重悬于5mMpH7.4的PB缓冲液中,取100μL2nM15nm金纳米粒子与适配体部分互补的巯基TECS1序列以摩尔浓度1︰5的比例混匀,分别加入终浓度为50mM的NaCl溶液,充分混合后,室温孵育过夜后,离心3次除去溶液中未反应的DNA,分别重悬于100μL的5mMPB缓冲液中;取100μLGNP-primer及50μLGNP-CS1复合体混匀,加入5μL10μMlinkerDNA1组装得到端粒酶引物序列组装的手性大小金二聚体primer-dimer,再加入NaCl溶液至终浓度为50mM进行老化,室温下孵育12h,再将组装体通过梯度离心纯化;(2)端粒酶引物错配序列组装构建的手性大小金二聚体传感器:柠檬酸还原法合成的25nm金纳米粒子GNP离心重悬于5mMpH7.4的PB缓冲液中,取100μL2nM25nm金纳米粒子将其与巯基TEmismatch序列以摩尔浓度1︰5的比例混匀;15nm金纳米粒子GNP离心重悬于5mMpH7.4的PB缓冲液中,取100μL2nM15nm金纳米粒子与适配体部分互补的巯基TECS2序列以摩尔浓度1︰5的比例混匀,分别加入终浓度为50mM的NaCl溶液,充分混合后,室温孵育过夜后,离心3次除去溶液中未反应的DNA,分别重悬于100μL的5mMPB缓冲液中;取100μLGNP-mismatch及50μLGNP-CS2复合体混匀,加入5μL10μMlinkerDNA2组装得到端粒酶引物错配序列组装的手性大小金二聚体mismatch-dimer,再加入NaCl溶液至终浓度为50mM进行老化,室温下孵育12h,再将组装体通过梯度离心纯化;(3)两种大小金二聚体修饰穿膜肽:将步骤(1)及(2)得到大小金二聚体分别与SH-PEG5000和穿膜肽TAT以1︰1000︰100的摩尔浓度混匀,室温孵育12h后,7500rpm离心20min,去除上清液,沉淀重悬于细胞培养液中,得到稳定的表面修饰有穿膜肽的手性TAT-primer-dimer及TAT-mismatch-dimer,金纳米粒子二聚体在细胞中的生物透射电镜图如图1所示。(4)两种大小金二聚体传感器在细胞内手性信号随时间的变化:将细胞接种于24孔培养板中,使每孔中的细胞数量为104个,培养24h后去掉培养液,取8个孔加入终浓度为5nM的穿膜肽修饰的手性TAT-primer-dimer分别与104个细胞共同培养0h、2h、4h、6h、8h、12h、16h、24h;取8个孔加入终浓度为5nM的穿膜肽修饰的手性TAT-mismatch-dimer分别与104个细胞共同培养0h、2h、4h、6h、8h、12h、16h、24h;之后分别用胰蛋白酶消化细胞,分别得到细胞内含有不同量的手性primer-dimer及mismatch-dimer的细胞悬液。将细胞悬液进行圆二色性表征,记录不同时间点的手性信号,绘制散点图如图2所示,得到胞内最佳检测时间。(5)基于大小金二聚体的手性信号实现胞内端粒酶实时检测:在将步骤(3)得到穿膜肽修饰的手性TAT-primer-dimer与不同量EGCG抑制端粒酶活性后及未经抑制的细胞分别共孵育6h后,当存在待测物端粒酶时,组装体逐渐解散,导致手性信号的变化,进而进行检测,然后用胰蛋白酶消化细胞,分别得到细胞内含有不同解离程度的手性primer-dimer的细胞悬液;所述穿膜肽修饰的手性TAT-primer-dimer与添加不同抑制剂及未处理的细胞分别共同孵育后手性信号的变化谱图如图3所示;对细胞悬液进行圆二色性表征,并建立胞内端粒酶与手性信号的标准曲线如图4所示。SEQIDNO.1:TEprimer:5’-TTTTTTAATCCGTCGAGCAGAGTT’-3’;SEQIDNO.2:TECS1:5’-ATAGGTATATTTTTT’-3’;SEQIDNO.3:LinkerDNA1:5’-CCCTAACTAACCAACTCTGCTCGACGGATT’-3’;SEQIDNO.4:TEmismatch:5’-TTTTTTTATCCGTAGAGCAGCGTC’-3’;SEQIDNO.5:TECS2:5’-ATAGGTATATTTTTT’-3’;SEQIDNO.6:LinkerDNA2:5’-CCCTAACCCTAAGACGCTGCTCTACGGATA’-3’;SEQIDNO.7:TAT:5’-YGRKKRRQRRRC’-3’。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1