一种混菌体系发酵生产丙酸的方法与流程
本发明涉及微生物技术领域,具体的说是涉及一种混菌体系发酵生产丙酸的方法。
背景技术:
丙酸及丙酸盐是一种非常重要的化工品,可广泛地被用作食品、饲料、医药工业的原料。随着这些工业的不断发展,对丙酸的需求量也日益增加,但国内生产的丙酸量远远不足,每年都需要依赖大量进口,因此发展丙酸生产和开发新的丙酸生产工艺显得非常迫切。
丙酸主要来源于化学合成法和微生物发酵法,工业上主要通过从化石原料如乙烯和一氧化碳的羰基合成得到的醛液化,丙烷气化或丙腈氧化合成,但其面临效率低成本高等缺点,相比之下,采用微生物发酵生成液体的化学品更具吸引力:操作条件更加温和,产物利用速率快,减少化学合成过程对环境的破坏、对环境更加友好。
现有的微生物发酵法主要为纯菌发酵,用Propionibacterium acidipropionici(产丙酸杆菌)发酵可以达到较高的丙酸累积浓度40-100g/L,但乙酸和琥珀酸等副产物的累积使其纯度只有70-75%,采用单一纯菌发酵生产高纯度的丙酸在大规模的工业很难实现。
而混菌体系中加入对产丙酸菌有益的其他菌株发酵,虽然丙酸浓度不及纯菌发酵,但是在纯度上却能够显著优于纯菌发酵。如文献《新型混菌发酵制备丙酸工艺及其优化》(刘寅,孙浩等,食品工业科技,2013年第14期)就公开了丙酸菌和酵母菌混合发酵的技术方案,在最优发酵条件下,丙酸浓度达到24.16g/L,纯度达到98%以上。虽然,从丙酸浓度和纯度上该技术方案都达到了较高的水平,然而其所采用的丙酸菌株是经过保藏的特种菌株,而且需要单独加入酵母菌,避免其他杂菌的引入对该混菌体系的影响,不仅菌株来源受限,而且所耗费的成本是较大;此外产物仅是丙酸,投入产出比高,工业价值低。
大规模的工业化需要来源更加广泛以及性价比较高的原材料,而现有技术明显不能满足工业化的需求,只能是实验室阶段的理论研究。
技术实现要素:
有鉴于此,本发明的目的在于提供一种混菌体系发酵生产丙酸的方法,使得该方法以来源广泛的发酵原料为起始进行丙酸发酵生产,实现较高浓度和纯度的丙酸目标,同时能够生产副产物甲烷,更利于实现工业化。
为了实现上述目的,本发明提供如下技术方案:
一种混菌体系发酵生产丙酸的方法,包括:
将包含产甲烷古菌和产丙酸细菌的厌氧污泥以及厌氧发酵培养基组成发酵体系,通过序批模式进行厌氧发酵,在发酵过程中,逐渐提高发酵体系中的铵根离子浓度至1-2g/L并维持恒定;发酵过程中持续收集甲烷,发酵结束后收集发酵液提取丙酸,所剩包含菌群的固体物加入厌氧发酵培养基进行下一轮发酵。
针对现有的混菌发酵生产丙酸的方法在起始原料方面受到限制,且整体投入产出比较高的缺陷,本发明采用来源广泛的厌氧污泥作为菌种来源,如污水处理厂的厌氧污泥或养殖场废水中的厌氧污泥,其中包含了多种菌群,基本上都具有产甲烷古菌和产丙酸细菌,通过在厌氧发酵过程中控制铵根离子的手段来控制整个菌群的比例,实现抑制原有菌群中丙酸氧化菌的活性,提高产丙酸细菌的百分比,不影响产甲烷古菌的活性的目的,进一步提高了丙酸的浓度和纯度,同时收获较高产量的副产物甲烷。
其中,作为优选,所述产甲烷古菌包含甲烷丝菌(Methanosaeta)和甲烷杆菌(Methanobacterium);所述产丙酸细菌包含紫单胞菌(Porphyromonadaceae)和梭菌(Clostridiaceae)。
在本发明具体的实施方式中,本发明所采用的厌氧污泥为包含Methanosaeta 8-10%,Methanobacterium 0.4-2.5%,Clostridiaceae 2.5%,Porphyromonadaceae 1.7-1.9%的厌氧污泥。
更具体地,所述厌氧污泥为Methanosaeta 8%,Methanobacterium 0.4%,Dethiosulfovibrionaceae 9.1%,Anaerolinaceae 7.1%,Streptococcaceae 6.9%,Syntrophobacteraceae 4.2%,Cloacamonaceae 3.7%,Syntrophorhabdaceae 3.5%,SB-1 3.4%,Geobacteraceae 3.1%,Clostridiaceae 2.5%,Porphyromonadaceae 1.9%,Pseudomonadaceae 1.7%,Syntrophomonadaceae 1.6%,[Tissierellaceae]1.5%,Syntrophaceae 1.5%,Synergistaceae 1.3%,Lachnospiraceae 1.2%,[Mogibacteriaceae]1%,Peptococcaceae 0.6%,Thermotogaceae 0.5%,Carnobacteriaceae 0.5%,其他含量低于0.5%及未被分类菌群共34.8%;或
Methanosaeta10%,Methanobacterium 2.5%,Anaerolinaceae 15.5%,Streptococcaceae 12.8%,Cloacamonaceae 6.5%,Thermotogaceae 6.2%,Dethiosulfovibrionaceae 4.2%,Ruminococcaceae 3.6%,Enterobacteriaceae 2.7%,Clostridiaceae 2.5%,Peptococcaceae 2.3%,Syntrophomonadaceae 1.9%,Porphyromonadaceae 1.7%,Geobacteraceae 1.7%,Gracilibacteraceae 1.6%,Synergistaceae 0.9%,Pseudomonadaceae 0.6%,Sphaerochaetaceae 0.5%,其他含量低于0.5%及未被分类菌群共22.3%;
本发明所述厌氧培养基可采用本领域常规的厌氧培养基,在本发明中提供了更加适宜的培养基,包括:
NH4Cl,530mg/L;KH2PO4·2H2O,200mg/L;Na2SO4mg/L,40mg/L;KCl,50mg/L;CaCl2,10mg/L;MgCl2·6H2O,70mg/L;MnCl2·4H2O,0.8mg/L;CoCl2·2H2O,1.2mg/L;FeSO4·7H2O,3.2mg/L;AlCl3,0.5mg/L;NaMO4·2H2O,1mg/L;H3BO3,0.2mg/L;NiCl2·6H2O,0.5mg/L;CuCl2·2H2O,1.1mg/L;ZnSO4·2H2O,3.2mg/L;EDTA,3.0mg/L。
此外,还可以使用其他成分的厌氧培养基,例如包括如下成分的培养基:
NH4Cl,300mg/L;K2HPO4,150mg/L;NaHCO3,700mg/L;CaCl2,50mg/L;MgCl2·6H2O,12mg/L;FeCl2,12mg/L;NaCl,10mg/L;MnCl2·4H2O,5mg/L;CoCl2·6H2O,5mg/L;AlCl3·6H2O,4.5mg/L;H3BO3,5mg/L;(NH4)6Mo7O24·4H2O,5mg/L;NiCl2·6H2O,5mg/L;ZnCl2,5mg/L;CuSO4·5H2O,5mg/L;EDTA,3.0mg/L。
在逐渐提高发酵体系中的铵根离子浓度过程中,本发明优选按照0.3-0.5g/(L·d)提升速率提高铵根离子浓度,以及优选通过加入NH4Cl来调整铵根离子浓度。
作为优选,所述发酵体系的pH值为7.0-7.3,温度为35-37℃。
本发明所述序批模式是发酵方法中的一个术语,指每天定量向发酵体系中加入有机物使其维持一定浓度的模式,在本发明中,所述有机物为葡萄糖、甘油或蔗糖,所述加入有机物的量为5g/d,使发酵体系中有机物浓度维持在0.1-5g/L。
本发明发酵方法能够将起始的厌氧污泥中菌群进行调控,大幅增加产丙酸菌中紫单胞菌(Porphyromonadaceae)和梭菌(Clostridiaceae)百分比,增加幅度分别在5-10倍和20-25倍,同时不影响产甲烷古菌生产甲烷的活性,初次发酵丙酸即可达到8.6g/L左右的浓度,纯度为97.7%左右,后续发酵可达到18.3g/L左右的浓度,纯度为94%左右。
由以上技术方案可知,本发明通过调控铵根离子浓度的方式,控制包含产甲烷古菌和产丙酸细菌的厌氧污泥的菌群分布,使得发酵环境有利于产丙酸细菌的增殖,在生产高浓度和高纯度丙酸的同时可获得较多的甲烷,材料来源不受限制,投入产出比较低,利于工业化实施。
附图说明
图1所示与本发明所述方法配套使用的发酵装置;
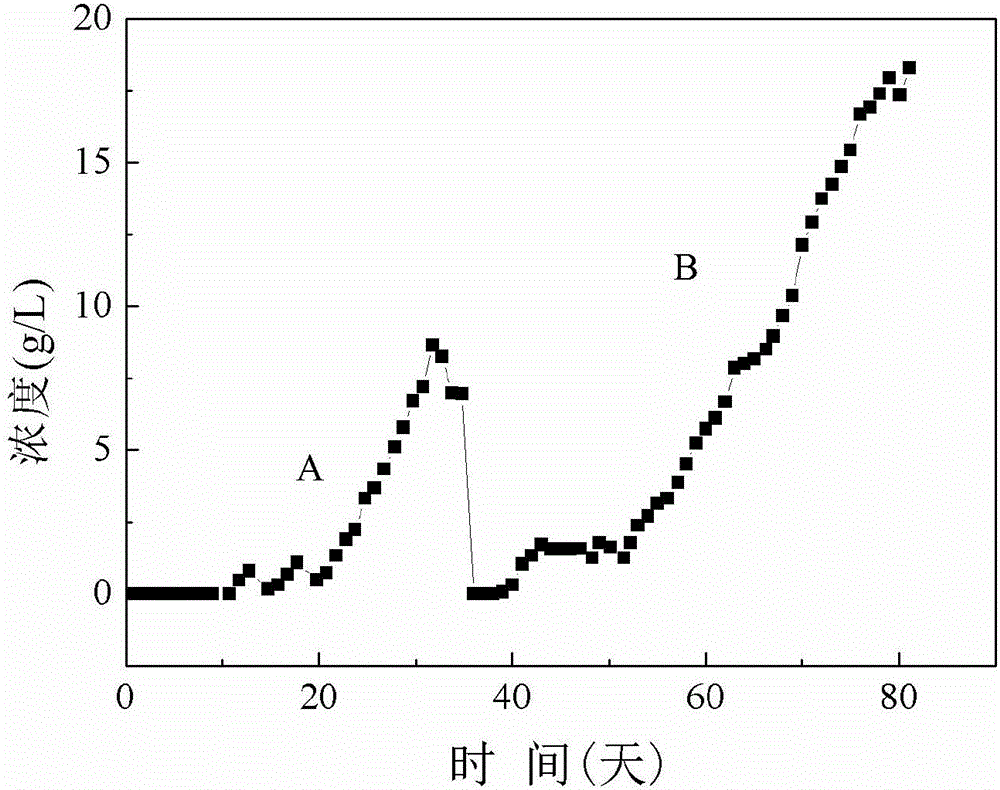
图2所示为实施例1和实施例2发酵时间和丙酸浓度的折线图,其中A表示实施例1的第一轮发酵折线,B表示实施例2的第二轮发酵的折线。
具体实施方式
本发明实施例公开了一种混菌体系发酵生产丙酸的方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。本发明所述方法已通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法进行改动或适当变更与组合,来实现和应用本发明技术。
为了配合本发明发酵方法的进行,本发明还提供了一种配套发酵设备,示意图见图1,包括主体反应器1,其侧壁设置有出水口7和8,循环水出水口9、循环水进水口10,顶部设置碱液进样口13,出气口12,内部固定有膜材料19;
其中,出水口7与泵16、pH值计14通过管道与主反应器1形成封闭循环系统,用于实时监测反应体系的pH值,同时为了实现反应器的内部循环;
出水口8通过管道与液相产物回收装置3相连,用于排除多余培养液,维持培养液体积恒定,其另外一个功能是作为反应器连续流的出水口,在连续流过程中实现收集丙酸的目的;
碱液进样口13与泵18、pH自动调节装置4通过管道相连,在检测到pH值需要调节后,通过pH值自动调节装置加入碱液调节;
循环水出水口9与、循环加热装置5、泵17、循环水进水口10以及主反应器1夹层形成封闭循环系统,用于控制主反应器1的反应温度;
出气口12和气相产物回收装置6通过管道相连,在管道上还设置气体取样口15,用于检测和收集甲烷气体;
此外,在主反应器下端还设置取样口11,用于随时检测液相产物的变化情况;膜材料19成分为复合纤维材料,其有效比表面积>2000m2/m3,有效长度为30cm,直径5cm,膜材料19缠绕于固定在主反应器顶部的铁丝上;
出水口7的位置应该低于出水口8的位置,因为出水口8位置为反应器最高液位位置,与内部循环联通的出水口7的位置应该低于出水口8。
在具体工作时,向上述反应装置中加入厌氧污泥和培养基,使液体位置达到出水口8。打开反应器装置所有管道和连通的装置,关闭出水口8,使厌氧污泥附着在膜材料上。期间,通过主反应器玻璃视窗可以观察到厌氧菌群附着在膜材料上,形成一层生物膜。
每天向发酵体系中加入有机物,使有机物的浓度在0.1-5g/L之间,逐步提高反应器中铵根离子的浓度,直至发酵体系中铵根离子浓度1-2g/L,该过程时间一般为7-20天。
每天从取样口11取液相产物,检测反应器中的铵根离子浓度,维持反应器内铵根离子浓度为1-2g/L,不足时向反应器内投加氯化铵。
每天从取样口取液相产物,检测反应器中的葡萄糖和丙酸的浓度,手动添加葡萄糖,使有机底物浓度在0.1-5g/L之间。同时通过气体取样口检测甲烷含量。
本发明所使用的厌氧污泥来自污水处理厂的厌氧发酵池以及养殖场的废水池。对于使用养殖场废水池的厌氧污泥,其本身含有较高浓度的铵根离子,可以视实际情况不加或少加铵根离子。
以下就本发明所提供的一种混菌体系发酵生产丙酸的方法做进一步说明。
实施例1:本发明所述发酵方法(首轮发酵)
本实施例采用的培养基成分为:
NH4Cl,530mg/L;KH2PO4·2H2O,200mg/L;Na2SO4,40mg/L;KCl,50mg/L;CaCl2,10mg/L;MgCl2·6H2O,70mg/L;MnCl2·4H2O,0.8mg/L;CoCl2·2H2O,1.2mg/L;FeSO4·7H2O,3.2mg/L;AlCl3,0.5mg/L;NaMO4·2H2O,1mg/L;H3BO3,0.2mg/L;NiCl2·6H2O,0.5mg/L;CuCl2·2H2O,1.1mg/L;ZnSO4·2H2O,3.2mg/L;EDTA(Na+型),3.0mg/L。
本实施例厌氧污泥菌群组成:
Methanosaeta 8%,Methanobacterium 0.4%,Dethiosulfovibrionaceae 9.1%,Anaerolinaceae 7.1%,Streptococcaceae 6.9%,Syntrophobacteraceae 4.2%,Cloacamonaceae 3.7%,Syntrophorhabdaceae 3.5%,SB-1 3.4%,Geobacteraceae 3.1%,Clostridiaceae 2.5%,Porphyromonadaceae 1.9%,Pseudomonadaceae 1.7%,Syntrophomonadaceae 1.6%,[Tissierellaceae]1.5%,Syntrophaceae 1.5%,Synergistaceae 1.3%,Lachnospiraceae 1.2%,[Mogibacteriaceae]1%,Peptococcaceae 0.6%,Thermotogaceae 0.5%,Carnobacteriaceae 0.5%,其他34.8%(含量低于0.5%及未被分类菌群)。
[Tissierellaceae]中括号是根据Greengene数据库该微生物命名而采用的书写方式,其他带有括号的微生物书写方式均采纳自Greengene数据库。
将上述厌氧污泥以及厌氧发酵培养基组成发酵体系,调节发酵体系的pH值介于7.0-7.3,温度介于35-37℃,每天向发酵体系中加入5g葡萄糖,使有机物的浓度在0.1-5g/L之间,按照0.5g/(L·d)提升速率逐步提高发酵体系中铵根离子的浓度,直至发酵体系中铵根离子浓度2g/L,该过程时间一般为7-20天。
待发酵体系中铵根离子浓度稳定在2g/L后,维持该离子浓度恒定,继续按照序批式模式向反应体系中加入有机物葡萄糖,使有机物浓度维持在0.1-5g/L之间。
发酵结束后(该过程时间一般为18-45天),收集气体获得甲烷,同时收集发酵液提取丙酸,所剩包含菌群的固体物加入厌氧发酵培养基进行下一轮发酵。
经过检测,反应器出水以丙酸为主,浓度达到8.6g/L(见图2),乙酸的浓度为0.2g/L。甲烷的产量为1.34L/(L-reacter·day),即每1L培养液每天产生1.34L甲烷。
在此模式运行条件下,丙酸占反应器液相代谢产物的含量为97.7%,反应器中葡萄糖的浓度低于0.1g/L。
发酵结束后后,包含菌群的固体物中各菌群的数量百分比为:Methanosaeta 0.5%,Methanobacterium 0.1%,Porphyromonadaceae 44.1%,Clostridiaceae 17.6%,Peptococcaceae 4.5%,[Tissierellaceae]4.3%,Thermotogaceae 3.6%,Dethiosulfovibrionaceae 2.7%,Carnobacteriaceae 0.3%,Anaerolinaceae 0.2%,其他22.1%(含量低于0.1%及未被分类菌群)。
需要指出的是,由于发酵菌群中发酵细菌的占比增加而使得产甲烷古菌(Methanosaeta与Methanobacterium)在发酵结束后占总菌群的比例减少,但发酵过程中甲烷每天的产量基本恒定,且甲烷占气相产物体积分数为50-55%,体系有正常稳定的产甲烷过程,两种微生物活性并未受到影响。
其中Porphyromonadaceae(紫单胞菌)和Clostridiaceae(梭菌)占比61.7%。说明通过调控铵根离子浓度这一环境因素,可以控制菌群分布,大幅度提高Porphyromonadaceae(紫单胞菌)和Clostridiaceae(梭菌)的占比,实现混菌体系下生产高纯度丙酸的目的。
实施例2:本发明所述发酵方法(第二轮发酵)
将实施例1包含菌群的固体物和厌氧发酵培养基(同实施例1)组成发酵体系,调节发酵体系的pH值介于7.0-7.3,温度介于35-37℃,每天向发酵体系中加入5g甘油,使有机物的浓度在0.1-5g/L之间,按照0.3g/(L·d)提升速率逐步提高发酵体系中铵根离子的浓度,直至发酵体系中铵根离子浓度1g/L,该过程时间一般为7-20天。
待发酵体系中铵根离子浓度稳定在1g/L后,维持该离子浓度恒定,继续按照序批式模式向反应体系中加入有机物甘油,使有机物浓度维持在0.1-5g/L之间。
发酵结束后(该过程时间一般为18-45天),收集气体获得甲烷,同时收集发酵液提取丙酸,所剩包含菌群的固体物加入厌氧发酵培养基进行下一轮发酵。
经过检测,丙酸在培养液中的最高浓度可达18.3g/L(见图2),乙酸浓度1.2g/L,发酵产物主要是丙酸、乙酸和甲烷,甲烷的产量为1.2L/(L-reacter·day),即每1L培养液每天产生1.2L甲烷,丙酸占反应器液相产物的94%。
根据第二轮发酵中甲烷产量也可侧面反映,产甲烷古菌的活性并未受到影响,甲烷产量较为稳定。
实施例3:本发明所述发酵方法(第一轮+第二轮发酵)
按照实施例1和实施例2的方法,以不同于实施例1的另一家污水处理厂的厌氧发酵池中的厌氧污泥为起始原料,菌群组成如下:
Methanosaeta 10%,Methanobacterium 2.5%,Anaerolinaceae 15.5%,Streptococcaceae 12.8%,Cloacamonaceae 6.5%,Thermotogaceae 6.2%,Dethiosulfovibrionaceae 4.2%,Ruminococcaceae 3.6%,Enterobacteriaceae 2.7%,Clostridiaceae 2.5%,Peptococcaceae 2.3%,Syntrophomonadaceae 1.9%,Porphyromonadaceae 1.7%,Geobacteraceae 1.7%,Gracilibacteraceae 1.6%,Synergistaceae 0.9%,Pseudomonadaceae 0.6%,Sphaerochaetaceae 0.5%,其他22.3%(含量低于0.5%及未被分类菌群未列出)。
第一轮发酵结束后经过检测,丙酸纯度为96%,浓度为7.6g/L,甲烷产量为1.24L/(L-reacter·day),菌群组成如下:
Methanosaeta 1.2%,Methanobacterium 0.4%,Porphyromonadaceae 37.7%,Clostridiaceae 16.4%,Streptococcaceae 8%Dethiosulfovibrionaceae 7%,,Thermotogaceae 5.6%,Sphaerochaetaceae 2.6%,Enterobacteriaceae 0.3%,Gracilibacteraceae 0.3%,Ruminococcaceae 0.2%,其他20.3%(含量低于0.1%及未被分类菌群未列出)。
对比实施例1中发酵前后菌群变化,实施例2发酵前后依然保持了大幅度提高Porphyromonadaceae(紫单胞菌)和Clostridiaceae(梭菌)的占比,同时对产甲烷古菌活性不影响的趋势。
此外,通过另外3次采集不同来源的厌氧污泥进行菌群分布发酵前后对比,虽然不同来源的菌群存在差别,但是每次发酵后,各来源的菌群分布均是大幅度提高Porphyromonadaceae(紫单胞菌)和Clostridiaceae(梭菌)的占比,提高幅度分别在5-10倍和20-25倍范围内,同时产甲烷古菌的活性未受到影响,表明本发明方法对于包含产甲烷古菌和产丙酸细菌的厌氧污泥具有稳定调控菌群分布的作用,非是由于厌氧污泥原料的偶然性。
第二轮发酵结束后经过检测,丙酸浓度为15.6g/L,占发酵液相产物93%,甲烷产量为1.16L/(L-reacter·day)。
实施例4:本发明所述发酵方法(第三轮发酵)
将实施例2和实施例3中第二轮发酵结束后的固体物分别加入另一种厌氧发酵培养基组成发酵体系,按照实施例2的方法进行第三轮发酵,该厌氧发酵培养基组成如下:
NH4Cl,300mg/L;K2HPO4,150mg/L;NaHCO3,700mg/L;CaCl2,50mg/L;MgCl2·6H2O,12mg/L;FeCl2,12mg/L;NaCl,10mg/L;MnCl2·4H2O,5mg/L;CoCl2·6H2O,5mg/L;AlCl3·6H2O,4.5mg/L;H3BO3,5mg/L;(NH4)6Mo7O24·4H2O,5mg/L;NiCl2·6H2O,5mg/L;ZnCl2,5mg/L;CuSO4·5H2O,5mg/L;EDTA,3.0mg/L。
实施例2固体物第三轮发酵结束后经过检测,反应器液相产物主要为丙酸,其浓度为17.9g/L,乙酸的浓度为1.3g/L,丙酸纯度为93%。甲烷的产量为1.3L/(L-reacter·day),即每1L培养液每天产生1.3L甲烷。
实施例3固体物第三轮发酵结束后经过检测,丙酸在培养液中的最高浓度可达17.9g/L,乙酸浓度1.2g/L,丙酸占液相产物93%,发酵产物主要是丙酸、乙酸和甲烷,甲烷的产量为1.1L/(L-reacter·day),即每1L培养液每天产生1.1L甲烷。
根据第三轮发酵的产量可知,本发明所述方法能够调控并稳定菌群分布,使其处于生产丙酸和甲烷的最佳水平,保证产量和纯度的基本恒定。
以上所述只是用于理解本发明的方法及其核心思想,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!