不饱和透明质酸奇数寡糖及其制备方法与流程
本发明属于生物医药领域,具体涉及不饱和透明质酸奇数寡糖(即还原端和非还原端为葡萄糖醛酸的不饱和透明质酸奇数寡糖)及其制备方法。
背景技术:
透明质酸(HA)是由D-葡萄糖醛酸(GlcA)和N-乙酰氨基葡萄糖(GlcNAc)二糖单位通过β-1,3和β-1,4糖苷键交替连接的一种线性大分子酸性粘多糖。HA广泛分布于细胞外基质、软结缔组织以及体液。HA通过调节细胞活动而参与到许多病理学和生理学过程。透明质酸具有良好的亲水性、粘弹性、和润滑性,被广泛应用于临床、化妆品、食品等领域。
据报道,不同分子量的HA具有不同的理化性质和生物活性,适用于不同的目的。低分子量HA,尤其是二糖、三糖、四糖、五糖因其表现出独特的理化性质,受到广泛关注。目前,HA常用的降解方法有化学降解、物理降解和酶降解。酶降解因降解过程可控,降解产物明确,而受到了广泛的应用。根据作用机制的不同,将透明质酸酶分为三种:一、哺乳动物透明质酸酶,切割β-1,4糖苷键,最终产生非还原端为GlcA的四糖,中国专利文件CN101283979A(申请号:200810038558.3)公开了用哺乳动物透明质酸酶-牛睾丸透明质酸酶制备一种促进伤口愈合的透明质酸小片段药膏的制备;二、水蛭透明质酸酶,切割β-1,3糖苷键,最终产生非还原端为GlcNAc的四糖和六糖;三、微生物透明质酸酶,切割β-1,4糖苷键,最终产生非还原端为不饱和葡萄糖醛酸(△UA)的四糖和六糖。将哺乳动物透明质酸酶降解产物用酸或者碱处理,还原端GlcNAc发生脱落,从而得到饱和奇数寡糖(Charles D.Blundell,Andrew Almond.Enzymatic and chemical methods for the generation of pure hyaluronan oligosaccharides with both odd and even numbers of monosaccharide units.Analytical Biochemistry,2006,353:236-247)。碱处理制备奇数寡糖:以CH3COONH4为酶解工作液,用牛睾丸透明质酸酶降解HA。通过反复冻干除CH3COONH4,将寡糖溶解在40mM NaOH,反应30min,用HCl终止反应,再通过阴离子交换柱(Sepharose-Q)进行纯化,以氯化钠为流动相62.5-205mM梯度洗脱58min。酸处理制备奇数寡糖:以CH3COONH4为酶解工作液,用牛睾丸透明质酸酶降解HA,在沸水中加热5min除酶,离心,取上清,在pH5.2的沸水浴中孵育3h,冷却至室温,再经阴离子交换柱分离纯化。
以上两种方法虽均能成功制备出HA奇数寡糖,但存在以下几个弊端:
1、这两种方法均选用CH3COONH4为酶解工作液,CH3COONH4对后续降解过程会产生影响,需要花时间将其去除;2、HA寡糖在酸性或碱性条件下还原端GlcNAc发生脱落,从而得到HA奇数寡糖,但反应效率较低;3、反应过程中还会出现降解副产物-异构体,且无法通过现有分离技术将其分开,反应产物结构不单一。因此整个制备HA奇数寡糖的过程耗时较长、过程较为复杂,且得率较低,没有得到广泛的应用和关注。因此,一种简便、高效、经济的制备透明质酸奇数寡糖方法显得尤为重要。
技术实现要素:
本发明目的是提供一种不饱和透明质酸奇数寡糖(即还原端和非还原端为葡萄糖醛酸的不饱和奇数寡糖)及其制备方法,该方法具有简便、高效、经济等优点,以弥补现有制备方法上的不足。
本发明的技术方案是:一种不饱和透明质酸奇数寡糖,其分子式为C6+14nH8+21nO6+11nNn,分子量为176.0320+(379.1146)n道尔顿,聚合度(dp)为2n+1,其结构式为:
其中,5≥n≥1。
不饱和透明质酸奇数寡糖的制备方法,主要将透明质酸经过酶解、分离纯化和脱盐三个步骤制得一系列不饱和透明质酸奇数寡糖,其特征在于,所述制备方法的具体步骤如下:
步骤1)将冻干粉末状透明质酸用纯水配成浓度为8-10mg/mL的透明质酸溶液,将冻干粉末状微生物透明质酸酶用酶解工作液配成150-200IU/mL的透明质酸酶溶液;
步骤2)取所述透明质酸溶液5-8份,在冰浴条件下加入所述透明质酸酶溶液1-2份,震荡混匀,在35-40℃水浴箱中孵育24-36h,制成样品;将所述样品移至95-100℃水浴锅中,加热5-7min,离心,去沉淀;
步骤3)利用低压层析色谱柱对去沉淀后的所述样品进行分离纯化,其中流动相浓度为0.1-0.2M,流速0.1-0.2mL/min,平衡后上样1mL,示差检测器检测,馏分收集器10-12min/管收集,合并收集,再通过旋转蒸发仪进行浓缩,获得一系列不饱和透明质酸奇数寡糖粗品;
步骤4)将获得的不饱和透明质酸奇数寡糖粗品利用体积排阻色谱柱分别进行除盐,纯水为流动相,流速0.1-0.2mL/min,平衡后上样1mL,示差检测器检测,馏分收集器10-12min/管收集,浓缩,冻干,即制得一系列不饱和透明质酸奇数寡糖纯品。
进一步的技术方案,步骤1)中,所述酶解工作液为纯水。
进一步的技术方案,步骤1)中,所述微生物透明质酸酶来源于Streptomyces hyalurolyticus。
进一步的技术方案,步骤3)中,所述低压色谱柱的填料为Bio-gel P4、Bio-gel P6或Bio-gel P 10。
进一步的技术方案,步骤3)中,所述低压色谱柱的流动相为氯化钠或氯化钾。
进一步的技术方案,步骤4)中,所述体积排阻色谱柱的填料为Sephadex G10、Sephadex G25或Sephadex G50。
本发明的优点是:
1.本发明的制备方法选用了一种具有独特降解方式的微生物透明质酸酶。经探索这种来源于Streptomyces hyalurolyticus透明质酸酶在特定酶解条件下能产生奇数寡糖;
2.本发明的制备方法选择在纯水中酶解,而没有采用缓冲盐,这样避免了后续脱盐以及缓冲盐对低压色谱分离的影响;
3.本发明的制备方法通过酶解最终得到了结构式为△UA(-GlcNAc-GlcA)n的一系列不饱和透明质酸奇数寡糖,收率较高;
4.上述寡糖混合物经高温除酶后直接使用简单的低压柱色谱分离,便可得到本发明所需制备的一系列不饱和透明质酸奇数寡糖纯品,相对于碱解和酸解,大大简化了不饱和透明质酸奇数寡糖的制备工艺,最终产物结构单一,纯度达到百分之百,并提高了制备效率;
5.本发明的制备方法克服了现有合成和降解技术难以快速制备大量一系列不饱和透明质酸奇数寡糖的困难,为进一步探索低聚合度寡糖构效关系,以及指导其在临床、食品和化妆品等方面的应用具有重要的现实意义。
附图说明
图1为本发明利用透明质酸酶酶解透明质酸的降解产物分析结果;
图2a为本发明所制备的△UA-GlcNAc-GlcA的质谱图;
图2b为本发明所制备的△UA(-GlcNAc-GlcA)2的质谱图;
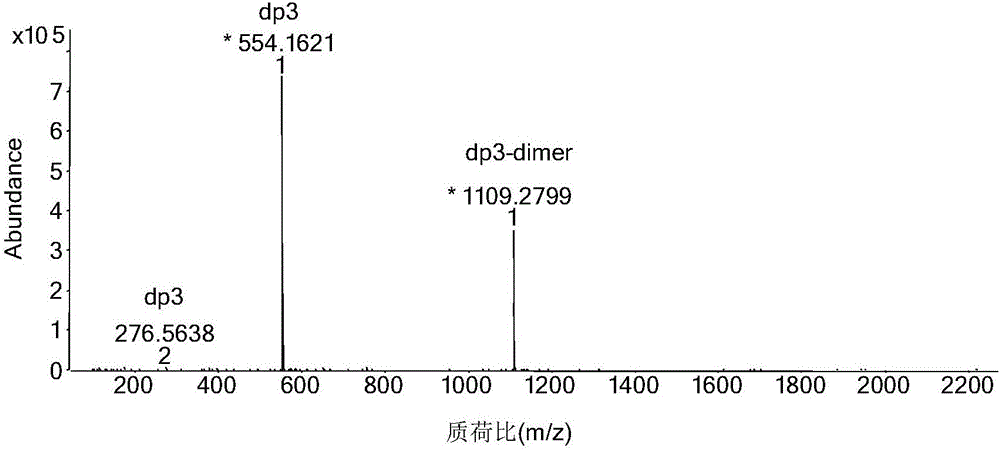
图2c为本发明所制备的△UA(-GlcNAc-GlcA)3的质谱图;
图2d为本发明所制备的△UA(-GlcNAc-GlcA)4的质谱图;
图2e为本发明所制备的△UA(-GlcNAc-GlcA)5的质谱图。
具体实施方式
下面结合附图及实施例对本发明作进一步描述:
一种不饱和透明质酸奇数寡糖,其分子式为C6+14nH8+21nO6+11nNn,分子量为176.0320+(379.1146)n道尔顿,聚合度(dp)为2n+1,其结构式为:
其中5≥n≥1。
一种制备上述不饱和透明质酸奇数寡糖的方法,主要将来源于动物组织提取、微生物发酵或化学合成的透明质酸(HA)经过酶解、分离纯化和脱盐三个步骤制得一系列不饱和透明质酸奇数寡糖,下面将通过以下实施例进行说明:
实施例1
步骤1)将冻干粉末状透明质酸(HA)用纯水配成浓度为10mg/mL的透明质酸(HA)溶液,将冻干粉末状微生物透明质酸酶用酶解工作液配成200IU/mL的透明质酸酶溶液;
进一步的,所述酶解工作液为纯水;
进一步的,所述微生物透明质酸酶来源于Streptomyces hyalurolyticus;
步骤2)取所述透明质酸(HA)溶液5份,在冰浴条件下加入所述透明质酸酶溶液1份,震荡混匀,在37℃水浴箱中孵育24h,制成样品;将所述样品移至100℃水浴锅中,加热5min,离心,去沉淀;
步骤3)利用填料为Bio-gel P 10的低压层析色谱柱(2.6×100cm)对去沉淀后的所述样品进行分离纯化,其中流动相浓度为0.2M氯化钠,流速0.15mL/min,平衡后上样1mL,示差检测器检测,馏分收集器12min/管收集,合并收集,再通过旋转蒸发仪进行浓缩,获得一系列不饱和透明质酸奇数寡糖粗品;
步骤4)将获得的不饱和透明质酸奇数寡糖粗品利用填料为Sephadex G10的体积排阻色谱柱(2.6×30cm)分别除盐,纯水为流动相,流速0.1mL/min,平衡后上样1mL,示差检测器检测,馏分收集器12min/管收集,浓缩,冻干,即制得一系列不饱和透明质酸奇数寡糖纯品。
实施例2
步骤1)将冻干粉末状透明质酸(HA)用纯水配成浓度为8mg/mL的透明质酸(HA)溶液,将冻干粉末状微生物透明质酸酶用酶解工作液配成150IU/mL的透明质酸酶溶液;
进一步的,所述酶解工作液为纯水;
进一步的,所述微生物透明质酸酶来源于Streptomyces hyalurolyticus;
步骤2)取所述透明质酸(HA)溶液8份,在冰浴条件下加入所述透明质酸酶溶液2份,震荡混匀,在37℃水浴箱中孵育30h,制成样品;将所述样品移至100℃水浴锅中,加热7min,离心,去沉淀;
步骤3)利用填料为Bio-gel P6的低压层析色谱柱(2.6×100cm)对去沉淀后的所述样品进行分离纯化,其中流动相浓度为0.1M氯化钾,流速0.2mL/min,平衡后上样1mL,示差检测器检测,馏分收集器10min/管收集,合并收集,再通过旋转蒸发仪进行浓缩,获得一系列不饱和透明质酸奇数寡糖粗品;
步骤4)将获得的不饱和透明质酸奇数寡糖粗品利用填料为Sephadex G25的体积排阻色谱柱(2.6×30cm)分别除盐,纯水为流动相,流速0.2mL/min,平衡后上样1mL,示差检测器检测,馏分收集器10min/管收集,浓缩,冻干,即制得一系列不饱和透明质酸奇数寡糖纯品。
参见图1所示,透明质酸酶可降解透明质酸(HA)产生一系列不饱和透明质酸奇数寡糖,图1表示利用透明质酸酶酶解透明质酸的降解产物分析结果。
参见图2a-2e所示,经分离纯化后,能得到单一的不饱和透明质酸奇数寡糖,结构为△UA(-GlcNAc-GlcA)n,其中:
图2a表示制备出的△UA-GlcNAc-GlcA的质谱图;
图2b表示制备出的△UA(-GlcNAc-GlcA)2的质谱图;
图2c表示制备出的△UA(-GlcNAc-GlcA)3的质谱图;
图2d表示制备出的△UA(-GlcNAc-GlcA)4的质谱图;
图2e表示制备出的△UA(-GlcNAc-GlcA)5的质谱图。
上述实施例只是为了说明本发明的技术构思及特点,其目的是在于让本领域内的普通技术人员能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡是根据本发明内容的实质所作出的等效的变化或修饰,都应涵盖在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!