一种多芳基取代咪唑荧光探针及其制备方法和在特异性检测G‑四链体中的应用与流程
本发明涉及一种新型荧光探针,更具体地,涉及一种多芳基取代咪唑荧光探针及其制备方法和在特异性检测G-四链体中的应用。
背景技术:
G-四链体(G-quadruplex)是一种特殊的DNA二级结构。人类基因组中很多富鸟嘌呤区域具有形成这一结构的能力,包括端粒末端鸟嘌呤重复序列,以及多种基因的启动子区域,如c-KIT、c-MYC、BCL-2、PDGF、KRAS、VEGF和胰岛素基因等。G-四链体结构具有多态性,链的数量和取向、loop的连接方式以及鸟嘌呤的糖苷扭转角以及与羰基负电中心配位的金属离子等多方面决定了G-四链体的类型和构象,这些差异性也为蛋白和小分子化合物提供了多个识别位点。根据链的取向不同,G-四链体分为正平行型,反平行型与混合型三种构象。
G-四链体结构的形成对于体内的一系列生理过程都存在调控作用。研究证明,c-MYC启动子区域的G-四链体结构会显著影响基因的转录和翻译水平,因此G-四链体结构被认为是起到分子开关的功能,其形成和拆散可能涉及到信号传导、细胞凋亡和细胞增殖等一系列体内重要的生理过程。所以,在体内或者体外试验中,能够特异性地检测出野生型c-MYC G-四链体结构的存在或者形成,对于研究G-四链体结构的相关生物学功能以及开发以G-四链体结构为靶点的抗癌药物等方面都具有非常重要的作用。
光致电子转移(PET)经常用于设计荧光增强或淬灭型的荧光探针。如果受体部分有一个和荧光团自身HOMO和LUMO轨道有能量差的轨道,就容易发生光致电子转移过程。光致电子转移过程可以从荧光团激发态的LUMO到空轨道。这主要取决于邻近合并的轨道的特点。无辐射的失活过程就是这样发生的,同时我们会看到荧光的淬灭。基于光致电子转移的荧光探针,探针和目标分析物反应后,不是增加就是移除了在荧光团HOMO和LUMO轨道之间的邻近轨道,这样就分别实现了荧光的淬灭或者增强。
目前,在体内和体外检测G-四链体结构的研究都取得了一些进展。由于体内大大过量的双螺旋DNA的存在,以及复杂的细胞内环境,使得体内的检测相对于体外检测需要解决更多的难题,目前已有一些荧光分子可以实现体内G-四链体结构的检测。但是,在体内外实现单一序列G-四链体(比如c-MYC)的检测暂未见报道。
技术实现要素:
本发明的目的在于针对现有技术的不足,提供一种多芳基取代咪唑荧光探针。
本发明的另一个目的在于提供上述探针的制备方法。
本发明的再一个目的在于提供上述探针在特异性检测G-四链体(野生型c-MYC)中的应用。
本发明通过以下技术方案实现上述目的:
本发明提供一种多芳基取代咪唑荧光探针,所述多芳基取代咪唑荧光探针的结构式如式(I)为:
式中,n=1,2,3,4,5;R1为氟,二乙胺,吗啡啉,哌啶或N-甲基哌嗪;R2为氟,二乙胺,吗啡啉,哌啶或N-甲基哌嗪。
优选地,所述R1与R2相同,R1为N-甲基哌嗪。
本发明另外提供所述的多芳基取代咪唑荧光探针的制备方法,包括以下步骤:
S1.将直接与炔基取代的苯甲醛发生缩合反应,
或,先将与二乙胺,吗啡啉,哌啶或N-甲基哌嗪反应,再与炔基取代的苯甲醛发生缩合反应得到
S2.将荧光素用浓硫酸酯化得然后通过取代反应引入二溴烷烃侧链得到化合物叠氮化后制得化合物
S3.将S1中与S2中进行点击反应,得到所述多芳基取代咪唑荧光探针。
以化合物F2为例,制备方法具体表示如下:
具体步骤为:先用4,4'-二氟苯偶酰(1a)与N-甲基哌嗪反应,得到化合物1b,再将1b与炔基取代的苯甲醛发生缩合反应,得到1c;将原料荧光素(2a)用浓硫酸酯化得2b;在这基础上,通过取代反应引入1,4-二溴丁烷侧链得到化合物2c,叠氮化后制得化合物2d;最后将1c与2d进行点击反应,得到最终探针化合物F-2。
本发明同时提供所述的多芳基取代咪唑荧光探针在检测G-四链体中的应用。
优选地,所述多芳基取代咪唑荧光探针用于特异性检测野生型c-MYC G-四链体结构。
更优选地,通过如下方法检测野生型c-MYC G-四链体结构:
S1.将待测DNA溶于pH值为7.2~7.4的缓冲液,得到溶液A;将所述多芳基取代咪唑探针溶解,再用pH值为7.2~7.4的缓冲液稀释,得到溶液B;
S2.将S1中的溶液A和溶液B混合,得到混合液,所述混合液中待测DNA与多芳基取代咪唑探针的摩尔比为10:1,混合后对混合液进行荧光光谱分析,或者在紫外灯下进行肉眼观察。
优选地,S2中判断待测DNA为野生型c-MYC G-四链体结构的方法如下:
当在紫外灯下进行肉眼观察时,与溶液B对比,若混合液在紫外灯下通过肉眼观察到荧光增强,则待测DNA为野生型c-MYC G-四链体结构;
若混合液的荧光强度与溶液B的荧光强度一样或者只有非常微弱的变化,既可以判断待测DNA不为野生型c-MYC G-四链体结构;
当对混合液进行荧光光谱分析时,与溶液B相比,若混合液的荧光发射强度增强,则待测DNA为野生型c-MYC G-四链体结构。
若混合液的荧光发射强度与溶液B相比,没有明显增强,则可以判断待测DNA不为野生型c-MYC G-四链体结构。
优选地,当对混合液进行荧光光谱分析时,与溶液B相比,若混合液的荧光发射强度增强5~20倍,则待测DNA为野生型c-MYC G-四链体结构。
优选地,所述缓冲液为Tris-盐酸缓冲液,所述多芳基取代咪唑用二甲基亚砜溶解。
优选地,S2中溶液A和溶液B的混合反应时间为1分钟。
申请人实验室前期的工作中合成了一系列的三芳基取代咪唑类的化合物,其对G-四链体具有较好的选择性和结合能力。申请人将本发明提供的荧光素结构通过点击反应融合到三芳基咪唑结构当中,得到了新型的G-四链体探针,该探针特异性识别野生型c-MYC G-四链体。其主要原理是光致电子转移(PET)。
本发明提供的探针由两部分组成,包括识别受体与荧光团,其主要识别原理是光致电子转移(PET)。PET经常用于设计荧光增强或淬灭型的荧光探针。如果受体部分有一个和荧光团自身HOMO和LUMO轨道有能量差的轨道,就容易发生光致电子转移过程。光致电子转移过程可以从荧光团激发态的LUMO到空轨道。这主要取决于邻近合并的轨道的特点。无辐射的失活过程就是这样发生的,同时我们会看到荧光的淬灭。基于光致电子转移的荧光探针,探针和目标分析物反应后,不是增加就是移除了在荧光团HOMO和LUMO轨道之间的邻近轨道,这样就分别实现了荧光的淬灭或者增强。只有当F-2与野生型c-MYC G-四链体相互作用后,受体的HOMO轨道下降,使得荧光团激发态LUMO轨道上的电子能够回到基态,从而产生荧光。当DNA的二级结构不为野生型c-MYC G-四链体结构时,荧光团激发态LUMO轨道上的电子不能够回到基态,这样则不会产生明显的信号变化。
与现有技术相比,本发明具有以下优点:
(1)本发明提供的探针制备简单,原料易得,并且结构稳定,便于储存。
(2)本发明提供的探针可以特异性地检测识别野生型c-MYC G-四链体结构,实现了单一序列的区分,用简单的荧光光谱就可以识别出野生型c-MYC G-四链体二级结构,操作快捷简便,成本低廉,并且可以实现实地检测,在细胞中单一检测野生型c-MYC G-四链体中具有潜在的应用价值,为研究c-MYC的转录调控提供有力的手段。
附图说明
图1为探针F-2滴定野生型c-MYC G-四链体DNA的荧光光谱。
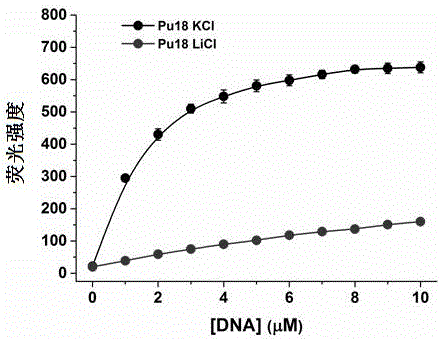
图2为探针F-2与Pu18(LiCl与KCl条件下)的荧光滴定曲线。
图3为探针F-2与不同DNA(包括G4与其他二级结构)作用后的荧光响应图,探针浓度为1μM,待测样品为10μM。
图4为探针F-2与不同突变c-MYC G-四链体相互作用后的荧光响应图,探针浓度为1μM,待测样品为10μM。
图5为探针F-2与野生型及突变型c-MYC G-四链体作用后的能级变化图。
具体实施方式
以下通过具体的实施例和附图进一步说明本发明的技术方案。本发明提供的探针由两部分组成,包括识别受体与荧光团。只有当F-2与野生型c-MYC G-四链体相互作用后,受体的HOMO轨道下降,使得荧光团激发态LUMO轨道上的电子能够回到基态,从而产生荧光。当DNA的二级结构不为野生型c-MYC G-四链体结构时,荧光团激发态LUMO轨道上的电子不能够回到基态,这样则不会产生明显的信号变化。
以其中化合物F-2为例来说明本发明的探针在荧光法检测野生型c-MYC G-四链体核酸二级结构的应用。
实施例1:化合物1b的合成
将原料4,4-二氟苯偶酰(2.5g,10mmol)溶于DMSO中,往其中加入5倍当量的N-甲基哌嗪及2倍当量的碳酸钾,80℃反应24小时。反应结束后,水洗除去DMSO及碳酸钾,得黄色固体(2.6g,60%)。1H NMR(400MHz,CDCl3)δ7.77(d,J=8.9Hz,4H),6.77(d,J=9.0Hz,4H),3.34(m,8H),2.40–2.52(m,8H),2.30(s,6H).13C NMR(100MHz,CDCl3)δ193.59,154.84,132.14,123.32,113.21,54.58,46.84,46.05.ESI-MS m/z:407.2[M+H]+.
实施例2:化合物1c的合成
将1b(0.8g,2mmol)与1.05倍当量的对炔丙基氧苯甲醛混合并溶于醋酸中,加入10倍当量的醋酸铵,于115℃回流20小时。氢氧化钠溶液调节Ph至弱碱性,乙酸乙酯萃取,硅胶拌样,用二氯甲烷:甲醇=20:1的洗脱剂过柱子,即可得到淡黄色固体(0.7g,65%)。1H NMR(400MHz,CDCl3)δ7.78(d,J=8.7Hz,2H),7.41(d,J=8.6Hz,4H),6.95(d,J=8.8Hz,2H),6.83(d,J=8.7Hz,4H),4.68(s,2H),3.41(s,1H),3.35–3.04(m,8H),2.73–2.47(m,8H),2.33(s,6H).13CNMR(101MHz,CDCl3)δ157.74,150.05,145.27,128.59,126.73,124.03,115.68,115.13,78.37,75.77,55.88,55.06,48.72,46.10.ESI-MSm/z:547.3[M+H]+.
实施例3:化合物2b的合成
将荧光素2a(3.3g,10mmol)分散在100mL乙醇中,往其中滴加2mL的浓硫酸,并回流20小时。然后旋蒸除去部分乙醇,加水,调节Ph=5,即有大量黄色固体析出。抽滤即可得到目标产物(3.0g,83%)。1H NMR(400MHz,DMSO)δ8.18(dd,J=7.8,1.1Hz,1H),7.86(td,J=7.5,1.3Hz,1H),7.77(td,J=7.7,1.3Hz,1H),7.49(dd,J=7.5,0.9Hz,1H),6.81(s,1H),6.79(s,1H),6.73–6.37(m,4H),3.96(q,J=7.1Hz,2H),0.86(t,J=7.1Hz,3H).13C NMR(101MHz,DMSO)δ165.48,150.82,134.07,133.43,131.10,131.04,130.50,130.38,103.77,61.32,13.77.ESI-MS m/z:361.1[M+H]+.
实施例4:化合物2c的合成
将2b(0.7g,2mmol)溶于乙腈中,往其中加入5倍当量的1,4-二溴丁烷和2倍当量的碳酸钾,回流10小时。结束后,除去乙腈并水洗,乙酸乙酯萃取,拌样过柱。洗脱剂为石油醚:乙酸乙酯=1:1,得橙红色油状物(0.5g,55%)。1H NMR(400MHz,DMSO)δ8.20(d,J=7.7Hz,1H),7.87(td,J=7.5,1.1Hz,1H),7.79(td,J=7.7,1.0Hz,1H),7.51(d,J=7.5Hz,1H),7.24(d,J=2.2Hz,1H),6.94–6.79(m,3H),6.40(dd,J=9.7,1.9Hz,1H),6.25(d,J=1.9Hz,1H),4.19(t,J=6.2Hz,2H),4.05–3.89(m,2H),3.62(t,J=6.5Hz,2H),2.05–1.93(m,2H),1.92–1.82(m,2H),0.88(t,J=7.1Hz,3H).13C NMR(101MHz,DMSO)δ184.28,165.40,163.66,158.80,154.04,150.46,133.95,133.52,131.18,131.04,130.85,130.45,129.83,129.39,117.19,114.79,114.44,105.02,101.35,68.29,61.35,35.16,29.38,27.54,13.81.ESI-MSm/z:495.1[M+H]+.
实施例5:化合物2d的合成
将2c(0.5g,1mmol)溶于乙腈当中,并往其中加入4倍当量的叠氮化钠,回流过夜。反应完成后,旋去部分乙腈,水洗除去固体盐,萃取,旋蒸即可得到橙红色目标产物(0.4g,87%)。1H NMR(400MHz,DMSO)δ8.19(d,J=7.8Hz,1H),7.87(td,J=7.5,1.2Hz,1H),7.79(td,J=7.7,1.1Hz,1H),7.50(d,J=7.5Hz,1H),7.23(d,J=2.2Hz,1H),6.95–6.76(m,3H),6.40(dd,J=9.7,1.9Hz,1H),6.24(d,J=1.9Hz,1H),4.18(t,J=6.2Hz,2H),4.05–3.87(m,2H),3.42(t,J=6.7Hz,2H),1.81(dt,J=11.4,6.2Hz,2H),1.69(dt,J=12.9,6.4Hz,2H),0.87(t,J=7.1Hz,3H).13C NMR(101MHz,DMSO)δ183.80,164.92,163.18,158.31,153.54,149.90,133.45,133.00,130.66,130.54,130.34,129.97,129.35,128.90,116.71,114.29,113.91,104.53,100.88,68.11,60.84,50.27,25.59,24.93,13.30.ESI-MS m/z:458.2[M+H]+.
实施例6:化合物F-2的合成
将1c(0.27g,0.5mmol)与2d(0.32g,0.7mmol)混合,分散于叔丁醇/水(3:1)当中,加入催化量的硫酸铜和抗坏血酸钠,并在80℃反应过夜。结束后,旋去溶剂,加入二氯甲烷溶解固体,拌样过柱。洗脱剂为二氯甲烷:甲醇=20:1,即可得到橙黄色固体(0.33g,66%)。1H NMR(400MHz,DMSO)δ12.20(s,1H),8.28(s,1H),8.19(d,J=7.7Hz,1H),7.97(d,J=8.6Hz,2H),7.85(t,J=7.4Hz,1H),7.78(t,J=7.5Hz,1H),7.48(d,J=7.4Hz,1H),7.37(d,J=22.0Hz,4H),7.22(s,1H),7.11(d,J=8.7Hz,2H),7.01–6.75(m,7H),6.40(d,J=9.7Hz,1H),6.24(s,1H),5.19(s,2H),4.47(t,J=6.6Hz,2H),4.16(t,J=5.8Hz,2H),3.99–3.93(m,2H),3.27–3.03(m,8H),2.48–2.33(m,8H),2.23(s,6H),2.06–1.92(m,2H),1.78–1.66(m,2H),0.86(t,J=7.1Hz,3H).13C NMR(101MHz,DMSO)δ184.34,165.40,163.64,158.81,158.34,154.03,150.48,145.02,143.07,133.94,133.49,131.18,131.01,130.85,130.43,129.83,129.37,126.90,125.04,124.29,117.19,115.30,114.78,114.39,105.05,101.35,68.44,61.67,61.36,55.05,49.50,48.23,46.20,26.90,25.86,13.81.ESI-MS m/z:1004.5[M+H]+.
实施例7:DNA样品的检测与作用方式研究
1.制备样品:
DNA样品:DNA样品购自上海捷瑞生物技术有限公司。将DNA适量溶于Tris-盐酸的缓冲液中(10mM Tris,pH=7.4,100mM KCl),超微量紫外测定浓度,在95℃下加热5min后缓慢冷却退火到室温作为储存液,4℃储存。
测试的DNA样品序列包括:
2.检测与作用方式研究:
检测野生型c-MYC G-四链体结构:用二甲基亚砜将化合物F-2配成1mM的储存液,再用Tris-盐酸的缓冲液中分别稀释成1μM的探针溶液用于测试。
2.1)荧光光谱检测
探针F-2的浓度为1μM,往探针溶液中滴加不同的待测样品溶液,吹匀后,稳定1分钟,用荧光光谱测定体系的荧光发射,将450nm设定为激发波长。如果体系的荧光强度急剧增强,增强范围为5~30,则可判断待测序列形成了G-四链体结构,且可判定是野生型c-MYC序列;如果体系只有微弱荧光增强,则可判断待测样品不是野生型c-MYC G-四链体结构。Pu18在LiCl条件下不形成G-四链体结构,所以F-2对其响应较弱。结果如图1,2,3所示。
2.2)c-MYC突变序列的荧光响应
探针F-2与c-MYC突变序列作用后的荧光响应如图4所示。首先,把第1、2、3、4个loop的碱基进行突变,结果显示第1、2个loop碱基的突变保留了其部分增强F-2荧光的性能,但是第3、4个loop碱基的突变却大大削弱了其增强F-2荧光的能力。这样,我们猜测,探针特异性地与Pu18G-四链体的第3、4个loop上的碱基相互作用。
2.3)探针与野生型及突变c-MYC G-四链体相互作用研究
从图5中可以看出,F-2在水溶液当中,荧光团激发态LUMO轨道上的电子可以跃迁到识别受体的HOMO轨道上,发生荧光的淬灭,在突变的c-MYC序列形成的G-四链体结构中也存在这种电子跃迁。而在野生型c-MYC G-四链体中由于其特殊的构象翻转,使得荧光团LUMO轨道上的电子不能转移到受体的HOMO轨道上,从而跃迁回荧光团的基态,这种情况就会产生荧光。
SEQUENCE LISTING
<110> 中山大学
<120> 一种多芳基取代咪唑荧光探针及其制备方法和在特异性检测
G-四链体中的应用
<130>
<160> 27
<170> PatentIn version 3.3
<210> 1
<211> 18
<212> DNA
<213> Pu18
<400> 1
agggtgggga gggtgggg 18
<210> 2
<211> 18
<212> DNA
<213> Pu18-1T
<400> 2
tgggtgggga gggtgggg 18
<210> 3
<211> 18
<212> DNA
<213> Pu18-1G
<400> 3
ggggtgggga gggtgggg 18
<210> 4
<211> 18
<212> DNA
<213> Pu18-1C
<400> 4
cgggtgggga gggtgggg 18
<210> 5
<211> 18
<212> DNA
<213> Pu18-2A
<400> 5
agggagggga gggtgggg 18
<210> 6
<211> 18
<212> DNA
<213> Pu18-2C
<400> 6
agggcgggga gggtgggg 18
<210> 7
<211> 18
<212> DNA
<213> Pu18-2U
<400> 7
agggugggga gggtgggg 18
<210> 8
<211> 18
<212> DNA
<213> Pu18-3T
<400> 8
agggtggggt gggtgggg 18
<210> 9
<211> 18
<212> DNA
<213> Pu18-3C
<400> 9
agggtggggc gggtgggg 18
<210> 10
<211> 18
<212> DNA
<213> Pu18-4A
<400> 10
agggtgggga gggagggg 18
<210> 11
<211> 18
<212> DNA
<213> Pu18-4C
<400> 11
agggtgggga gggcgggg 18
<210> 12
<211> 18
<212> DNA
<213> Pu18-4U
<400> 12
agggtgggga gggugggg 18
<210> 13
<211> 18
<212> DNA
<213> Pu18-1GA
<400> 13
agggtaggga gggtgggg 18
<210> 14
<211> 18
<212> DNA
<213> Pu18-1GC
<400> 14
agggtcggga gggtgggg 18
<210> 15
<211> 18
<212> DNA
<213> Pu18-1GT
<400> 15
agggttggga gggtgggg 18
<210> 16
<211> 18
<212> DNA
<213> Pu18-2GA
<400> 16
agggtgggaa gggtgggg 18
<210> 17
<211> 18
<212> DNA
<213> Pu18-2GC
<400> 17
agggtgggca gggtgggg 18
<210> 18
<211> 18
<212> DNA
<213> Pu18-2GT
<400> 18
agggtgggta gggtgggg 18
<210> 19
<211> 18
<212> DNA
<213> Pu18-3GA
<400> 19
agggtgggga gggtaggg 18
<210> 20
<211> 18
<212> DNA
<213> Pu18-3GC
<400> 20
agggtgggga gggtcggg 18
<210> 21
<211> 18
<212> DNA
<213> Pu18-3GT
<400> 21
agggtgggga gggttggg 18
<210> 22
<211> 18
<212> DNA
<213> Pu18-4GA
<400> 22
agggtgggga gggtggga 18
<210> 23
<211> 18
<212> DNA
<213> Pu18-4GC
<400> 23
agggtgggga gggtgggc 18
<210> 24
<211> 18
<212> DNA
<213> Pu18-4GT
<400> 24
agggtgggga gggtgggt 18
<210> 25
<211> 19
<212> DNA
<213> Pu18-p2T
<400> 25
agggttgggg agggtgggg 19
<210> 26
<211> 19
<212> DNA
<213> Pu18-p3T
<400> 26
agggtggggt agggtgggg 19
<210> 27
<211> 19
<212> DNA
<213> Pu18-p4T
<400> 27
agggtgggga gggttgggg 19
- 还没有人留言评论。精彩留言会获得点赞!
- 一种检测动物源食品中甲巯咪唑残留的酶联免疫试剂盒及其应用
- 咪唑[1,2-c]-噻吩[2,3-e]嘧啶-7(8H)酮杂环化合物及其合成方法
- 双咪唑磺酸基功能化离子液体选择性脱除油品中的氮化物的制作方法
- 一种6-芳基取代的咪唑并[4,5-c]吲哚并[2,3-a]咔唑衍生物及其制备方法
- 用作激酶活性调节剂的新颖的咪唑-哌啶基衍生物的制作方法
- 取代的咪唑并哒嗪的制作方法
- 一种菲并咪唑对称衍生物主体材料及电致发光器件的制作方法
- 8-甲氧基甲酸乙酯咪唑并[1,2a]吡啶-3-甲酸乙酯的合成方法
- 溴代β-1-咪唑-2,3,4,6-四羟基-D-吡喃葡萄糖的合成及用图
- 含二元吩噻嗪并咪唑类衍生物、制备方法及有机发光器件的制作方法
- 2-[5-(氮唑-1-基)噻唑-2-亚氨基]噻唑啉酮及其制备方法与应用与制造工艺
- 一种咪唑基多孔有机离子聚合物的制备方法
- 一种Co?双咪唑基金属框架化合物及其制备方法与应用
- Artalbic acid的O?(苯并咪唑基)乙基与O?(二羟乙胺基)乙基衍生物的组合物在抗病毒 ...的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗骨质疏松药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备防治胰腺纤维化药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗缺氧药物的制作方法
- 一种含咪唑基离子液体的纳米乳液缓蚀剂及其制备方法
- 一种用于硝基芳烃爆炸物荧光猝灭检测的苯并咪唑基化学传感器及其制备方法
- Salviskinone A的苯并咪唑基和二(2-甲硫基乙基)胺基衍生物的组合物在抗病毒药物中 ...的制作方法