一株高产β‑D‑呋喃果糖苷酶的黑曲霉菌株及其液态发酵产酶方法与流程
本发明属于微生物或酶领域,特别涉及一株高产β-D-呋喃果糖苷酶的黑曲霉菌株及其液态发酵产酶方法。
背景技术:
:
β-D-呋喃果糖苷酶(β-D-fructofuranosidase,EC 3.1.2.26,简写为FFase)又称蔗糖酶或转化酶,广泛存在与生物界中,不同微生物来源的β-呋喃果糖苷酶的性质不同,β-D-呋喃果糖苷酶可以催化水解β-D-果糖苷键,也可以催化转糖基反应,生成半乳糖基蔗糖即低聚乳果糖(Lactosucrose,LS)。低聚乳果糖低聚果糖不能被人体直接消化吸收,只能被肠道细菌吸收利用,摄入后不会引起体内血糖水平和胰岛素水平的波动,可供糖尿病人食用;
工业上生产低聚果糖方法主要有两种:一是以菊芋为原料提取菊粉,再经酶水解而得。第二种方法是以蔗糖为原料,采用FFase作为生物催化剂通过酶促催化一系列转糖基反应而获得低聚果糖。后一种方法中可以通过将FFase固定化而实现连续生产,具有自动化程度高、操作稳定性好、酶能反复使用、生产成本低等优点而受到青睐,国内外市场上的大多数低聚果糖产品都是采用这种方法生产出来的。
目前能产生FFase的微生物主要有黑曲霉、米曲霉、酵母以及节杆菌等,其中以黑曲霉为主,所产的FFase具有一定的耐酸性和耐热性,可广泛应用于酿酒、食品、医药等行业。微生物产FFase转糖基活力的高低和发酵制备的难易程度是决定酶转化法制备低聚果糖工艺是否经济的关键因素。
申请号201210545255.7的发明专利申请公开了“一种β-D-呋喃果糖苷酶的固态发酵生产方法”,其特点是,包括如下步骤:(1)黑曲霉孢子液的准备;(2)种子的扩大培养;(3)固态发酵产β-D-呋喃果糖苷酶;(4)后处理获得β-D-呋喃果糖苷酶。该发明方法克服了FFase液态发酵的缺点,提供一种FFase的固态发酵生产方法,用固态发酵的方法为低聚果糖的大规模工业生产提供优质酶源。优点是:(1)固态发酵培养基以甘蔗渣、稻壳、大豆饼等为原料,原料价格低廉;(2)发酵周期短,工艺设备简单,降低成本,益于工业化生产。但该发明制得的FFase酶活较低,仅为200-500U/mL。
申请号201610753885.1的发明专利申请公开了“一株产β呋喃果糖苷酶节杆菌及其应用”,其特点是利用一株节杆菌BLCY-004,发酵生产β呋喃果糖苷酶,其酶活为1100U/mL,可应用于低聚乳果糖生产中,显著提高蔗糖转化成低聚乳果糖的能力,显著降低生产成本。
申请号为200910115791.1的发明专利申请公开了“一种节杆菌产β-呋喃果糖苷酶的发酵培养基及发酵方法”,其特点是利用一株节杆菌经过液体发酵培养,发酵生产获得β呋喃果糖苷酶,酶活为200-370U/mL,发酵菌株生物量高,产酶量高,酶活性强。
但是综上发明专利,其酶活在不同pH,不同温度中较宽范围的适用性以及其耐热性均未公开。由于β-D-呋喃果糖苷酶的酶活易受酶适用条件的制约,目前现有技术FFase中难以满足工业生产的需求生产成本低廉,对于大规模生产有显著促进作用的发明创造。
技术实现要素:
:
本发明的目的是提供一株高产β-D-呋喃果糖苷酶的黑曲霉菌株及其液态发酵产酶方法。在确保黑曲霉菌株高产β-D-呋喃果糖苷酶稳定性的同时,缩短发酵周期,提高产量,提升发酵效率,并显著提高FFase良好的耐热性。
本发明的目的是通过如下技术方案实现的:
一株高产β-D-呋喃果糖苷酶的黑曲霉菌株,所述菌株具体为黑曲霉菌株(Aspergillus niger)QL-225,保藏编号为CGMCC No.13168。
进一步地,所述一株高产β-D-呋喃果糖苷酶的黑曲霉菌株,所述黑曲霉菌株QL-225液体发酵产β-果糖苷酶最适作用pH为4.0-7.0,最适作用温度范围是40℃-60℃。
本发明的另一目的在于提供上述高产β-D-呋喃果糖苷酶的黑曲霉菌株的液态发酵产酶方法,主要包括以下步骤:
斜面培养:取一环黑曲霉菌株QL-225接种于PDA斜面培养基,30℃下恒温培养72h,得到一级种子;
摇瓶培养:挑取一环一级种子接入种子培养基中,恒温34℃,摇床转速200rpm条件下培养72h,得到二级种子液;
种子罐培养:将所述二级种子液按照接种量5%(v/v)接入种子罐培养基,恒温34℃、转速200-800rpm条件下培养48h,得到三级种子液;
发酵罐培养:将所述三级种子液按照接种量5%(v/v)接入发酵罐培养基,恒温34℃,转速200-800rpm,通风量设置为:发酵第0h至24h为0.25vvm、发酵第24h至48h为0.5vvm、发酵第48h至发酵结束为1.0vvm,通过向培养基中流加补料培养基,发酵全程控制pH 4.5-5.5,发酵周期为120-140h,得到最终发酵液;
将所述最终发酵液通过提取与精制方法,获得β-D-呋喃果糖苷酶成品酶制剂。
进一步地,所述PDA斜面培养基如下:蔗糖25g,NaNO3 2g,MgSO4 0.5g,KCl 0.5g,FeSO4 0.01g,K2HPO4 1g,琼脂20g,蒸馏水1000mL,pH 4.5,121℃灭菌20min;
所述种子培养基:麦芽汁150mL,琼脂3g,调节pH至4.5,121℃灭菌20min;
所述种子罐培养基按质量分数组成:葡萄糖2%,酵母粉1.5%,KH2PO4 0.15%,CaCl2 0.005%,蒸馏水配置,调节pH 4.5,121-123℃灭菌30-35min;
所述发酵罐培养基按质量分数组成:玉米淀粉4%,玉米粉4%,豆饼粉4%,硫酸铵1%,KH2PO4 0.3%,玉米浆0.6%,CaCl2 0.5%,蒸馏水配置,调节pH 4.5,121-123℃灭菌30-35min;
所述补料培养基按质量分数组成:玉米淀粉10%,硫酸铵1%,KH2PO4 0.1%,玉米浆0.6%,CaCl2 0.5%,蒸馏水配置,调节pH 4.5,121-123℃灭菌30-35min。
所述β-D-呋喃果糖苷酶的提取与精制方法如下:
向所述最终发酵液中加入2-5%珍珠岩助滤剂,用板框80-200目、压力0.15-0.2MPa进行板框压滤,得到板框压滤液;
将所述板框压滤液用1%的20#硅藻土进行精滤1-3h,得到精滤酶液;
用5-20KD超滤膜对所述精滤酶液进行超滤浓缩,得到超滤浓缩液;
在所述超滤浓缩液中加入质量百分比为:0.1~0.4%(m/v)稳定剂、5%~10%(m/v)防腐剂;之后用1%~3%的20#硅藻土进行过滤除菌,即得到β-D-呋喃果糖苷酶液体成品酶制剂。
优选地,所述β-D-呋喃果糖苷酶的提取与精制方法如下:
向所述最终发酵液中加入3.5%珍珠岩助滤剂,用板100目、压力0.16MPa进行板框压滤,得到板框压滤液;
将所述板框压滤液用1%的20#硅藻土进行精滤2h,得到精滤酶液;
用10KD超滤膜对所述精滤酶液进行超滤浓缩,得到超滤浓缩液;
在所述超滤浓缩液中加入质量百分比为:0.3%(m/v)稳定剂、7.5%(m/v)防腐剂;之后用2%的20#硅藻土进行过滤除菌,即得到β-D-呋喃果糖苷酶液体成品酶制剂。
进一步地所述稳定剂为柠檬酸钠,所述防腐剂由质量比分别为(0.2~0.4):(3~7):(1~3)的山梨酸钾、苯甲酸钠,焦亚硫酸钠组成。
优选地,所述稳定剂为柠檬酸钠,所述防腐剂由质量比分别为0.3:5:2的山梨酸钾、苯甲酸钠,焦亚硫酸钠组成。
本发明中所述的高产FFase的黑曲霉菌株具体为黑曲霉(Aspergillus nig ger)QL-225,该菌株已于2016年10月26日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编100101,保藏编号为CGMCC No.13168。
本发明所述高产FFase的黑曲霉菌株QL-225是通过室温常压等离子体诱变选育获得,菌株形态特征如下:镜检该菌所产菌丝体由具有横隔的分支菌丝构成,菌丛白色,顶囊大球形,小梗双层,孢子量少。
黑曲霉菌株QL-225通过液态发酵后最高酶活为20445U/mL,发酵过程中孢子量多,菌丝结球,发酵液较为粘稠不利于传质,经诱变后孢子产量减少,菌丝不宜结球,种子罐培养周期由56h缩短至48h。发酵方法经过优化后黑曲霉菌株QL-225的最高平均发酵液酶活达到19000U/mL至20000U/mL之间,经过提取与精致后,酶活达到270000U/mL至280000U/mL之间。
有益效果:
本发明的黑曲霉菌株QL-225是通过对黑曲霉原始菌株进行常温常压等离子体诱变选育了一株高产FFase的突变菌株,并对菌株QL-225发酵过程进行补料条件优化使菌株最终发酵液酶活达到19000U/mL至20000U/mL之间,较原始菌株所产酶的酶活9890U/mL显著提高了1.92-2.0倍,大大提高了生产效率,显著降低了生产成本。
此外发酵周期大大缩短,种子罐培养周期由56h缩短至48h,显著地提高了发酵效率,大大降低了发酵生产耗能。
本发明菌株的发酵方法中培养基成分均来源于成本较低的原料,且在提高发酵产能、提升生产效率的同时,大大减少发酵成本,对生产具有极大帮助。
该突变菌株发酵得到的FFase最适pH范围4.0-7.0,应用pH范围较宽,显著地拓宽了β-D-呋喃果糖苷酶的应用范围。同时,其最适作用温度范围是40℃-60℃,70℃保温8h后剩余酶活为51.4%,具有显著的耐酸性和耐热性,可广泛用于食品,医药,酿酒等工业领域。
附图说明:
图1不同pH下的相对酶活;
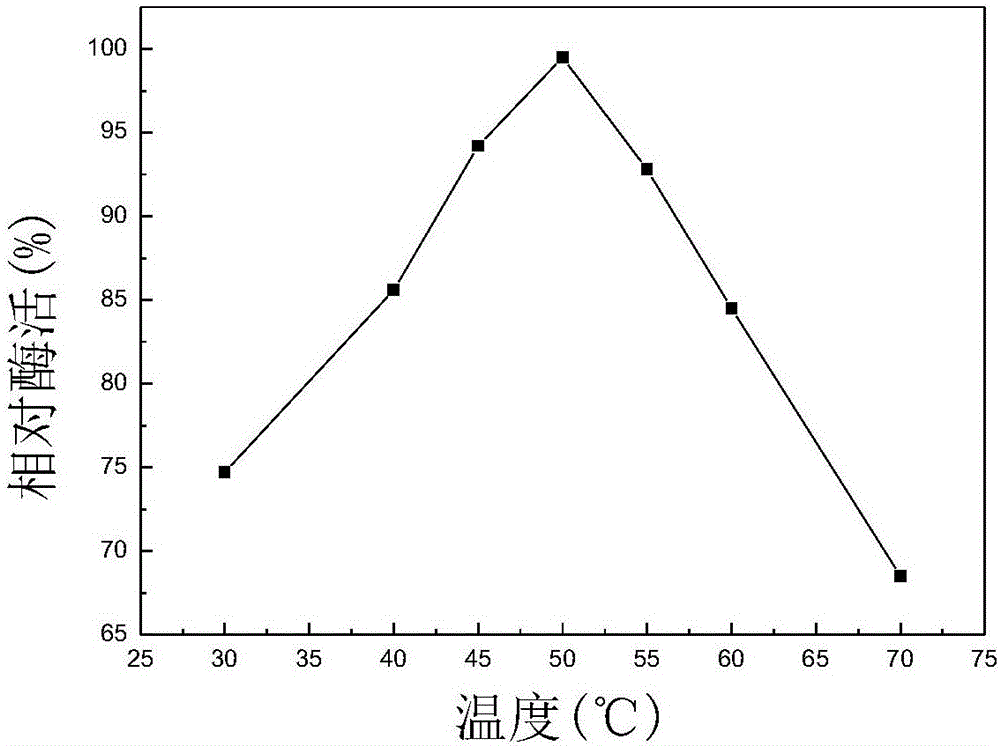
图2不同温度下的相对酶活;
图3 70℃下保温0-8h后的相对酶活。
具体实施方式:
下面通过具体的实施方案叙述本发明。除非特别说明,本发明中所用的技术手段均为本领域技术人员所公知的方法。另外,实施方案应理解为说明性的,而非限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改变或改动也属于本发明的保护范围。
实施例1培养基制备
PDA斜面培养基:蔗糖25g,NaNO3 2g,MgSO4 0.5g,KCl 0.5g,FeSO4 0.01g,K2HPO41g,琼脂20g,蒸馏水1000mL,pH 4.5,121℃灭菌20min;
种子培养基:麦芽汁150mL,琼脂3g,调节pH至4.5,121℃灭菌20min;
种子罐培养基按质量分数组成:葡萄糖2%,酵母粉1.5%,KH2PO4 0.15%,CaCl20.005%,蒸馏水配置,调节pH 4.5,121℃灭菌30min;
发酵罐培养基按质量分数组成:玉米淀粉4%,玉米粉4%,豆饼粉4%,硫酸铵1%,KH2PO4 0.3%,玉米浆0.6%,CaCl2 0.5%,蒸馏水配置,调节pH4.5,121℃灭菌30min;
补料培养基按质量分数组成:玉米淀粉10%,硫酸铵1%,KH2PO4 0.1%,玉米浆0.6%,CaCl2 0.5%,蒸馏水配置,调节pH 4.5,121℃灭菌30min。
以下实施例2-4所使用PDA斜面培养基、种子培养基、种子罐培养基、发酵罐培养基、补料培养基均为实施例1制备。
实施例2黑曲霉菌株QL-225发酵产酶及其所产FFase的提取精制方法
一株高产β-D-呋喃果糖苷酶的黑曲霉菌株,菌株具体为黑曲霉菌株(Aspergillus niger)QL-225,保藏编号为CGMCC No.13168。
黑曲霉菌株QL-225液体发酵产β-果糖苷酶最适作用pH为4.0-7.0,最适作用温度范围是40℃-60℃。
黑曲霉菌株QL-225的液态发酵产酶方法,主要包括以下步骤:
斜面培养:取一环黑曲霉菌株QL-225接种于PDA斜面培养基,30℃下恒温培养72h,得到一级种子;
摇瓶培养:挑取一环一级种子接入种子培养基中,恒温34℃,摇床转速200rpm条件下培养72h,得到二级种子液;
种子罐培养:将所述二级种子液按照接种量5%(v/v)接入种子罐培养基,恒温34℃、转速600rpm条件下培养48h,得到三级种子液;
发酵罐培养:将所述三级种子液按照接种量5%(v/v)接入50L发酵罐中,恒温34℃,转速600rpm,通风量设置为:发酵第0h至24h为0.25vvm、发酵第24h至48h为0.5vvm、发酵第48h至发酵结束为1.0vvm,通过向培养基中流加补料培养基,发酵全程控制pH 5.0,发酵周期为135h,得到最终发酵液;
将最终发酵液进行提取与精制:
向最终发酵液中加入3.5%珍珠岩助滤剂,用板框100目、压力0.16MPa进行板框压滤,得到板框压滤液;
将板框压滤液用1%的20#硅藻土进行精滤2h,得到精滤酶液;
用10KD超滤膜对所述精滤酶液进行超滤浓缩,得到超滤浓缩液;
在超滤浓缩液中加入质量百分比为:0.3%(m/v)稳定剂、7.5%(m/v)防腐剂;之后用2%的20#硅藻土进行过滤除菌。
稳定剂为柠檬酸钠,所述防腐剂由质量比分别为0.3:5:2的山梨酸钾、苯甲酸钠,焦亚硫酸钠组成。
最终发酵液中酶活为:21445U/mL,最终获得β-D-呋喃果糖苷酶成品酶制剂,其酶活为:282105U/mL
实施例3黑曲霉菌株QL-225发酵产酶及其所产FFase的提取精制方法
一株高产β-D-呋喃果糖苷酶的黑曲霉菌株,菌株具体为黑曲霉菌株(Aspergillus niger)QL-225,保藏编号为CGMCC No.13168。
黑曲霉菌株QL-225液体发酵产β-果糖苷酶最适作用pH为4.0-7.0,最适作用温度范围是40℃-60℃。
黑曲霉菌株QL-225的液态发酵产酶方法,主要包括以下步骤:
斜面培养:取一环黑曲霉菌株QL-225接种于PDA斜面培养基,30℃下恒温培养72h,得到一级种子;
摇瓶培养:挑取一环一级种子接入种子培养基中,恒温34℃,摇床转速200rpm条件下培养72h,得到二级种子液;
种子罐培养:将所述二级种子液按照接种量5%(v/v)接入种子罐培养基,恒温34℃、转速800rpm条件下培养48h,得到三级种子液;
发酵罐培养:将所述三级种子液按照接种量5%(v/v)接入50L发酵罐中,恒温34℃,转速800rpm,通风量设置为:发酵第0h至24h为0.25vvm、发酵第24h至48h为0.5vvm、发酵第48h至发酵结束为1.0vvm,通过向培养基中流加补料培养基,发酵全程控制pH 5.5,发酵周期为140h,得到最终发酵液;
将所述最终发酵液进行提取与精制:
向最终发酵液中加入5%珍珠岩助滤剂,用板框200目、压力0.2MPa进行板框压滤,得到板框压滤液;
将板框压滤液用1%的20#硅藻土进行精滤3h,得到精滤酶液;
用20KD超滤膜对所述精滤酶液进行超滤浓缩,得到超滤浓缩液;
在超滤浓缩液中加入质量百分比为:0.4%(m/v)稳定剂、10%(m/v)防腐剂;之后用3%的20#硅藻土进行过滤除菌。
稳定剂为柠檬酸钠,所述防腐剂由质量比分别为0.4:7:3的山梨酸钾、苯甲酸钠,焦亚硫酸钠组成。
最终发酵液中酶活为:21105U/mL,最终获得β-D-呋喃果糖苷酶成品酶制剂,其酶活为:281105U/mL。
实施例4黑曲霉菌株QL-225发酵产酶及其所产FFase的提取精制方法
黑曲霉菌株(Aspergillus niger)QL-225,保藏编号为CGMCC No.13168。
黑曲霉菌株QL-225液体发酵产β-果糖苷酶最适作用pH为4.0-7.0,最适作用温度范围是40℃-60℃。
黑曲霉菌株QL-225的液态发酵产酶方法,主要包括以下步骤:
斜面培养:取一环黑曲霉菌株QL-225接种于PDA斜面培养基,30℃下恒温培养72h,得到一级种子;
摇瓶培养:挑取一环一级种子接入种子培养基中,恒温34℃,摇床转速200rpm条件下培养72h,得到二级种子液;
种子罐培养:将二级种子液按照接种量5%(v/v)接入种子罐培养基,恒温34℃、转速200rpm条件下培养48h,得到三级种子液;
发酵罐培养:将三级种子液按照接种量5%(v/v)接入50L发酵罐中,恒温34℃,转速200rpm,通风量设置为:发酵第0h至24h为0.25vvm、发酵第24h至48h为0.5vvm、发酵第48h至发酵结束为1.0vvm,通过向培养基中流加补料培养基,发酵全程控制pH 4.5,发酵周期为120h,得到最终发酵液;
将最终发酵液通过提取与精制:向最终发酵液中加入2%珍珠岩助滤剂,用板框80目、压力0.15MPa进行板框压滤,得到板框压滤液;
将所述板框压滤液用1%的20#硅藻土进行精滤1h,得到精滤酶液;
用5KD超滤膜对所述精滤酶液进行超滤浓缩,得到超滤浓缩液;
在所述超滤浓缩液中加入质量百分比为:0.1%(m/v)稳定剂、5%(m/v)防腐剂;之后用1%的20#硅藻土进行过滤除菌。稳定剂为柠檬酸钠,所述防腐剂由质量比分别为0.2:3:1的山梨酸钾、苯甲酸钠,焦亚硫酸钠组成。
最终发酵液中酶活为:19869U/mL,最终获得β-D-呋喃果糖苷酶成品酶制剂,其酶活为:279105U/mL。
实施例5黑曲霉菌株QL-225的诱变选育
取两株出发菌株的新鲜斜面,用无菌水洗脱菌体,在有玻璃珠的试管振荡使菌体分散,离心收集菌体,以5%甘油重悬菌体,以血球计数板计数直至菌浓为107-108个/mL,以此作为出发菌悬液。
开启常温常压等离子系统,以酒精棉擦拭操作室内外,并开启紫外灯灭菌30min。灭菌结束后取10μL菌悬液点于载片的粗糙面,并在无菌条件下将载片以镊子转移至操作室台面上。开启氦气阀门,设定气流量和诱变时间进行诱变。诱变时间分别设定为90s、120s、150s、180s、210s。每次诱变结束后均将载片置于含990μL无菌生理盐水的EP管中,漩涡震荡1min。稀释涂布后,置于30℃培养箱内培养。
筛选培养基:酐酪素0.4%、KH2PO4 0.03%、MgSO4·7H2O 0.05%、FeSO4·7H2O 0.0002%、NaCl 0.1%、ZnSO4 0.003%、无水CaCl2 0.0002%、琼脂2%、pH4.5-5.5。
平板初筛:
初筛方法:将诱变后长出的菌落点种在筛选培养基平板上,30℃培养48h后,观察其周围透明圈大小,选取透明圈直径与菌落直径比值较大的菌落进行摇瓶复筛。
摇瓶复筛:
复筛方法:将诱变菌株接入摇瓶发酵培养基中进行发酵,30℃,220rpm,培养62h后以分光光度法测定各菌株发酵酶活。
摇瓶发酵培养基按质量分数组成:豆饼粉3.75%,玉米粉0.65%,鱼粉0.65%,氯化铵1.0%,氯化钙0.5%,磷酸二氢钠0.2%,蒸馏水配置,pH 5.5。
通过摇瓶复筛选出5株具有较高酶活的菌株列表如下:
表1 原始菌株与具有较高酶活的突变株的酶活对比
经再次的摇瓶发酵后选育出QL-225为稳定的最高酶活菌株。
形态特征观察:
黑曲霉菌株QL-225的形态特征为:镜检该菌所产菌丝体由具有横隔的分支菌丝构成,菌丛白色,顶囊大球形,小梗双层,孢子量少。
实施例6黑曲霉菌株QL-225的发酵性能验证
按照实施例2的黑曲霉菌株QL-225发酵产酶及其所产FFase的提取精制方法进行50L发酵罐验证实验,发酵周期130-140h,其6批次的发酵产酶情况,平均产酶水平,最终发酵液酶活为19380.8U/mL,表2说明菌株不仅高产β-D-呋喃果糖苷酶而且其发酵性能以及其所产FFase的酶活均具有显著的稳定性,在菌株的最终发酵液酶活中,较原始菌株所产酶的酶活9890U/mL显著提高了1.92-2.0倍,大大提高了生产效率,显著降低了生产成本。
表2 6批次高产FFase菌株的发酵产酶情况
实施例7β-D-呋喃果糖苷酶的酶活测定方法
1)酶活单位定义:1min内从蔗糖中释放出1umoL蔗果三糖所需的酶量,以U/mL计。
2)FFase转果糖基活力的测定,用50mM、pH 5.5的磷酸氢二钠-柠檬酸缓冲溶液配制25%(w/w)的蔗糖溶液作为底物,加入粗FFase酶液适量(使反应1小时后,体系中蔗果三糖的含量不超过总糖含量的10%(w/w)为宜),置于50℃水浴中振荡反应1小时,然后于沸水浴中加热10分钟,终止酶反应。用高效液相色谱法测定反应体系中的蔗果三糖,由蔗果三糖的量来计算转果糖基活力。
3)色谱条件:色谱柱,Hypersil-NH2(4.6×250×5,大连依利特公司);示差检测器的灵敏度,1/8;流动相,乙腈:水=68:32:流速,1mL/min;柱温,30℃。
实施例7FFase最适作用pH范围
以本发明所产的酶活力19840U/mL的FFase为基准,在50℃条件下,分别在不同pH值3.0、4.0、4.5、5.0、5.5、6.0、7.0、8.0条件下,测定酶活力,测定的相对酶活力变化曲线如图1所示,酶的最适作用pH范围为4.0-7.0,最适pH5.0。
实施例8β-D-呋喃果糖苷酶最适作用温度范围
以酶活力19840U/mL的FFase为基准,在pH值为5.0条件下,分别在不同温度(30、40、45、50、55、60、70℃下,测定酶活力,测定的相对酶活力变化曲线如图2所示,酶的最适作用温度范围为40℃-60℃,最适温度50℃。
实施例9酶的热稳定性
以酶活力19840U/mL的FFase为基准,在pH值为5.0条件下,70℃下保温8h测定剩余酶活力,如图3所示,70℃保温8h后剩余酶活为51.4%,具有良好的耐热保存活性,可广泛应用于高温工业生产中,显著地拓展了FFase的工业应用范围,提高了FFase的应用价值。
需要说明的是:本发明实施例2-4制备的混合益生菌片剂同样具有上述实验效果,各实施例之间及与上述实验效果差异性不大。
- 还没有人留言评论。精彩留言会获得点赞!