血清miR‑630的荧光实时定量PCR检测试剂盒以及miR‑630的应用的制作方法
本发明属于生物工程技术领域,涉及一种血清miR-630的荧光实时定量PCR检测试剂盒以及miR-630的应用。
背景技术:
microRNAs(miRNA,miR)是一种小分子、非编码、单链的RNA分子,其能够通过特定的碱基配对方式结合到相应靶基因mRNA的非翻译区(3'UTR),导致靶基因mRNA降解或抑制其稳定性,从而能够进一步调控相关靶基因的表达,参与相关细胞增殖、分化、凋亡等过程。
异位骨化(HO)作为一种临床创伤和手术后常见的并发症,一直是困扰临床骨科医生的一大难题,其预防和治疗一直没有得到比较好的解决方法。当HO开始启动形成,其成熟趋势几乎是不可能逆转。一旦异位骨的形成造成了肢体功能的障碍且影响到了日常生活的质量,再次手术难以避免,其造成了二次伤害和费用不可低估。
在以往的研究中,许多临床指标用来检验创伤性HO,如ALP,24h尿前列腺素水平,金属基质蛋白酶-9,用于早期去检测创伤性HO的发生。然而,这些现有的方法往往在敏感性和特异性上都比较局限,所以临床上预测创伤性HO能力是有限的。为了避免因为创伤性HO发生而再次手术,一些临床工作者试图将放射治疗应用于高危的患者中,主要集中在膝髋关节置换术后及脊柱损伤之后。但是对于放射治疗的副作用至今一直充满争议,Davis JA最新的临床研究发现通过Kocher-Langenbeck发的髋关节骨折内固定术后放射治疗,在预防创伤性HO的效果并无明显的统计学意义,且有导致肿瘤发生的并发症可能。McKeown SR通过其研究提出在良性疾病中,小剂量的放射治疗导致肿瘤的可能比较小,但也不可忽视,尤其对儿童和青少年的疾病的放射治疗的适用范围要尤其谨慎选择。
考虑到放射治疗的适应症和副作用,因此这种方法限制了它在创伤后HO预防的临床应用。本发明人经过研究表明,血清中的miR-630的表达水平与异位骨的生成密切相关,其在创伤性异位骨化(heterotopic ossification,HO)的发生过程中通过EndMT途径调控靶向Slug基因,因此,如何简单、快捷和准确地测定血清中的miR-630水平就成为一个亟待解决的问题。
技术实现要素:
本发明的主要目的在于提供一种血清miR-630的荧光实时定量PCR检测试剂盒,其能够快速并准确地检测出血清中miR-630的含量,以供操作人员判断其含量是否正常并且判断该血清的提供者是否发生异位骨化以及判断异位骨化所发生的阶段。
本发明的另一个目的在于提供一种miR-630的应用。
为达到上述目的,本发明采用了以下技术方案:
miR-630在用于获取早期创伤性异位骨化信息的试剂盒中的应用。
miR-630作为用于获取早期创伤性异位骨化信息的试剂盒中的检测反应物的应用。
一种血清miR-630的荧光实时定量PCR检测试剂盒,其包括:miR-630正向引物、miR-630反向引物、内参U6正向引物、内参U6反向引物和qPCR反应液;
miR-630正向引物的核苷酸序列如SEQ IDNo.1所示;
miR-630反向引物的核苷酸序列如SEQ IDNo.2所示;
内参U6正向引物的核苷酸序列如SEQ IDNo.3所示;
内参U6反向引物的核苷酸序列如SEQ IDNo.4所示。
其中,qPCR反应液的最终体积为20μL,包括:终浓度为1×的2xAll in OneTM qPCR Mix、终浓度为0.2μM的qPCR Primer、终浓度为0.2μM的Universal Adaptor PCR、2μL的1st strand cDNA、4μLddH2O。
在qPCR反应液中,2x All in One TM qPCR Mix的体积为10μL,qPCR Primer的浓度为2μM且其体积为2μL,Universal Adaptor PCR的浓度为2μM且其体积为2μL。
荧光实时定量PCR体系的反应步骤为:
(1)、按以下条件进行一次循环:先在95℃预变性10分钟再在95℃变性10秒;
(2)、按以下条件依次进行四十次循环:先在57℃退火20秒,再在72℃延伸10秒。
若miR-630的荧光实时定量PCR检测试剂盒所检测出血清中miR-630的相对含量为0.93±0.03,则判定该血清的供体处于异位骨化创伤早期。
若miR-630的荧光实时定量PCR检测试剂盒所检测出血清中miR-630的相对含量为2.49±0.11至2.82±0.16,则判定该血清的供体处于异位骨化创伤后三个月之后的时期。
上述技术方案所带来的有益效果是:
本发明的血清miR-630含量的荧光实时定量检测试剂盒采用特异性的miR-630引物检测出该血清样品中的miR-630的表达量,同时采用内参U6校正其表达量,从而得到血清miR-630相对表达量,因此,本发明的血清miR-630检测试剂盒不仅成分简单,而且能够快速并准确地检测出目标血液中的miR-630表达水平,有利于操作人员快速判断目标血液是否正常,从而进一步判断目标群体是否发生异位骨的生成以及异位骨化的发生阶段。
附图说明
为了更清楚地说明本发明实施方案或现有技术中的技术方案,下面将对实施方案或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施方案,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为实时定量PCR所检测的不同组中血清中miR-630的表达水平的图。
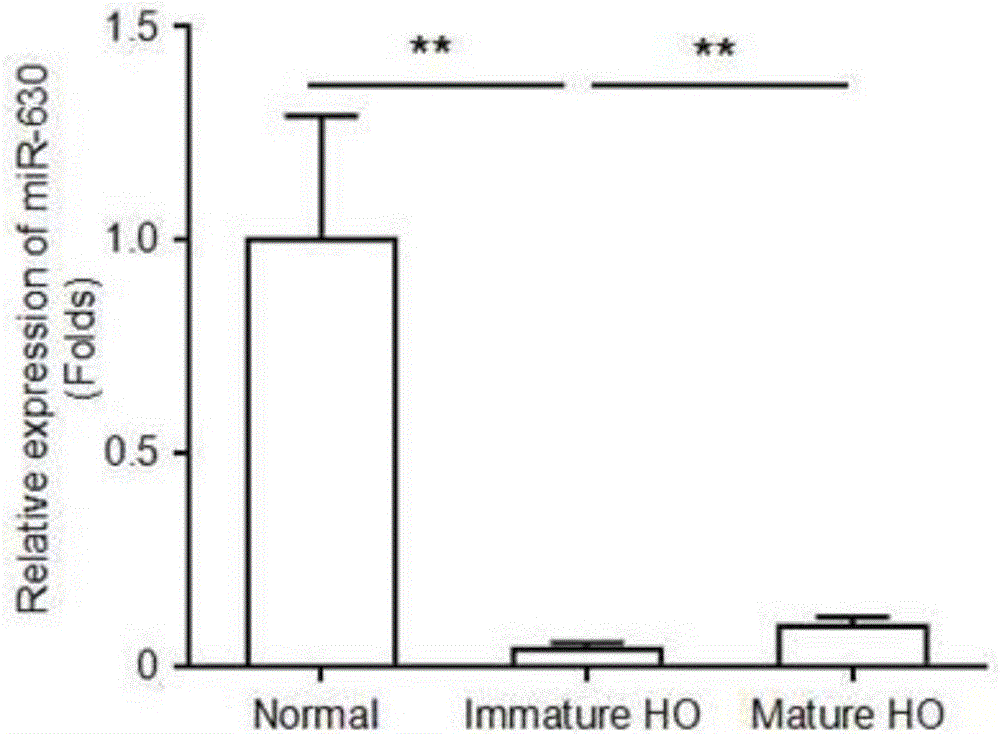
图2为本发明的试剂盒所测定的正常人和HO患者血清中的miRNA 630表达量的图;其中,纵坐标表示miRNA 630的相对表达量,正常人的血清中的miRNA 630表达量作为基准1;横坐标Normal组表示正常人,Immature HO组表示非成熟期的HO患者;Mature HO组表示成熟期的HO患者。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明公开了miR-630的应用以及用于检测血清中miR-630含量的荧光实时定量PCR检测试剂盒。
<1>miR-630的应用
本发明的发明人对创伤性HO患者血清中的miR-630的表达量进行了研究,同时通过年龄和性别匹配肘关节松懈术后未发生HO(heterotopic ossification)的患者(Ctrl1)和骨折愈合的患者(Ctrl2)作为两个对照组,并对这两个对照组血清中的miR-630的表达量进行了研究。
研究结果发现:在基准线,也即受伤(如进行肘关节松懈术)后8h,在HO患者的血清中,miR-630表达量为0.93±0.03,P<0.05;而在未发生HO的患者(Ctrl1)的血清中,miR-630表达量为2.58±0.12,P<0.05,并且在骨折愈合患者(Ctrl2)的血清中,miR-630表达量为2.51±0.09,P<0.05。由此可知,在受伤后8h,HO患者的血清中的miR-630表达量相对于未发生HO的患者(Ctrl1)和骨折愈合患者(Ctrl2)而言有了显著降低。
当HO中异位骨可见的时候,也即受伤/手术后三个月时,HO患者的血清中miR-630的表达量为2.09±0.09,P<0.05;此时,在未发生HO的患者(Ctrl1)的血清中,miR-630表达量为2.50±0.14,P<0.05;在骨折愈合患者(Ctrl2)的血清中,miR-630表达量为2.49±0.11,P<0.05;这说明:在受伤/手术后三个月时,HO患者的血清中miR-630的表达量相对于未发生HO的患者(Ctrl1)和骨折愈合患者(Ctrl2)而言并没有统计学上的显著差异。
在受伤/手术后一年后,三组受试者血清miR-630的表达量已经无明显差异。
在上述的实验中,miR-630的相对表达量(即相对含量)是通过log2|2DCt|来计算获得的,DCt的值是由血清miR-630的Ct和小核RNA U6的对比来获取。所有数值均采用均数±标准误表示,均有独立的三次实验来获取,由two-tail Student’s t test来检验,数据采用SPSS 15.0统计软件进行统计分析处理,p<0.05认为差异有统计学意义。
也可以构建接受者操作特性曲线(Receiver Operating Characteristic Curve,ROC),并采用ROC曲线下面积(Area under ROC curve,AUC)来验证创伤性HO患者和其他两组受试者之间的区别。
图1为实时定量的PCR检测血清中miR-630在创伤后HO患者中的表达水平。图1(A)为创伤性HO患者中进行了关节松懈术后未发生HO的患者(Ctrl1),图1(B)为创伤性HO患者中经过骨折愈合后的患者(Ctrl2)。其中,图1中的上端线表示受伤后8h的血清miR-630表达水平;中间线表示伤后/术后三个月的血清miR-630表达水平;下端线表示伤后/术后一年时的血清miR-630表达水平。
如图1所示,在受伤后的第一个8h中,miR-630用来区别HO患者和肘关节松懈术后未发生HO的患者(Ctrl1,图1A)的AUC面积为0.892(95%CI,0.863-0.921);且miR-630用来区别HO患者和骨折愈合患者(Ctrl2,图1B)的AUC面积为0.912(95%CI,0.885-0.938)。
为了区别肘关节松懈术后未发生HO的患者(Ctrl1),血清miR-630在AUC面积中的值为1.25,在这个判断点上敏感性(88.4%)加上特异性(81.2%)呈现最大值,且阳性准确预测率达到70.1%。以1.25为miR-630的判断点来鉴定骨折愈合患者(Ctrl2),其相对应的敏感性,特异性和阳性准确预测率分别为88.4%,80.8%和69.7%。
在伤后/术后三个月和一年的随访期中,miR-630在创伤性HO患者中相对于年龄和性别匹配肘关节松懈术后未发生HO的患者(Ctrl1)和患者经过骨折愈合的过程(Ctrl2)并无明显统计学差异。
血清miR-630的最佳切入点是约登指数(Youden index)来评价:是评价筛查试验真实性的方法,假设其假阴性(漏诊率)和假阳性(误诊率)的危害性同等意义时,即可应用约登指数。约登指数是灵敏度与特异度之和减去1。表示筛检方法发现真正的患者与非患者的总能力。指数越大说明筛查实验的效果越好,真实性越大。
上述研究表明,miR-630在异位骨化中具有预警作用,因此,可以通过比较血清中的miR-630的表达量来获取HO相关信息,例如,是否在创伤后发生异位骨化。
鉴于此,本发明公开了miR-630在制备用于获取创伤性异位骨化信息的试剂盒中的应用,该试剂盒能够获取创伤后异位骨化的发生情况。miR-630用于作为该试剂盒所检测的信标分子。
<2>血清miR-630的荧光实时定量PCR检测试剂盒
本发明还公开了一种血清miR-630的荧光实时定量PCR(Quantitative real-time PCR,qRT-PCR)检测试剂盒,其包括:miR-630正向引物、miR-630反向引物、内参U6正向引物、内参U6反向引物和qPCR反应液。
在采用本发明的检测试剂盒进行检测之前,需要采用血清分离体系从人或动物的血液中分离出血清样本,其包括如下步骤:从人或动物的四肢中抽取静脉血2-10mL,迅速转入EDTA抗凝管中,采用移液器混合均匀,在1h内进行下面的操作:先于820g、4℃离心10min,接着吸取约1mL的上清液转至洁净的1.5mL离心管(已灭菌)中,再于16000g、4℃离心10min,小心吸取该离心管中的上清液并将其转移至新的1.5mL离心管(已灭菌)中,最后置于-80℃保存备用,即得到所需的血清样本。
在本发明的血清miR-630的荧光实时定量PCR检测试剂盒中,miR-630正向引物的核苷酸序列(从5′端到3′端)为AGUAUUCUGUACCAGGGAAGGU,又如SEQ ID No.1所示。
miR-630反向引物的核苷酸序列(从5′端到3′端)为CUUCCCUGGUACAGAAUACUUU,又如SEQ ID No.2所示。
内参U6正向引物的核苷酸序列为GTGCTCGCTTCGGCAGCACATATAC,如SEQ ID No.3所示。
内参U6反向引物的核苷酸序列为AAAAATATGGAACGCTTCACGAATTTG,又如SEQ ID No.4所示。
qPCR反应液的最终体积为20μL,包括:终浓度为1×的2x All in One TMqPCR Mix(包括脱氧三磷酸核苷、MgCl2、RNA酶抑制剂、MMLV逆转录酶以及DNA聚合酶)、终浓度为0.2μM的qPCR Primer(包括miR-630正向引物、miR-630反向引物、内参U6正向引物和内参U6反向引物)、终浓度为0.2μM的Universal Adaptor PCR、2μL的1st strand cDNA(以1:5的比例稀释)、4μL ddH2O。
在上面的qPCR反应液中,2×All in One TM qPCR Mix的体积为10μL,qPCR Primer的浓度为0.2μM且其体积为2μL,Universal Adaptor PCR的浓度为0.2μM且其体积为2μL。
需要注意的是,2×All in OneTM qPCR Mix设定约为总反应体积的一半,其它组分请按最适比例进行调整。Rox Reference Dye使用在需要用Rox校正的ABI的定量PCR仪。引物终浓度试验中0.2μM的量达到理想的效果。1st Strand cDNA通常需要稀释后再使用,防止反转录体系对qPCR体系的影响。充分混匀qPCR反应液,添加至PCR反应管中,30s离心,确保所有试剂到反应管底部。
采用荧光qRT-PCR体系测定血清样品中miR-630含量的方法包括如下步骤:
(1)、提取血清样本中的总RNA;
(2)、充分混匀总RNA、qPCR反应液、正向引物(miR-630正向引物和内参U6正向引物)和反向引物(miR-630反向引物和内参U6反向引物),并添加入PCR反应管中,离心30秒以确保所有试剂沉积到PCR反应管的底部;
(3)、启动荧光qRT-PCR反应,其反应过程为:
a.在95℃预变性10分钟;
b.在95℃变性10秒;
c.按以下条件依次进行四十次循环:每次循环先在57℃退火20秒,然后在72℃延伸10秒,完毕后进行下一个循环;
(4)、对RT-PCR反应产物进行荧光检测,获取荧光检测的Ct值和荧光强度。
在步骤(4)中,采用小核RNA U6作为内参,miR-630的相对表达量是通过log2|2DCt|来计算获得的,DCt的值是由血清miR-630的Ct和小核RNA U6的对比来获取。所有数值均采用均数±标准误表示,均有独立的三次实验来获取,由two-tail Student’s t test来检验,数据采用SPSS 15.0统计软件进行统计分析处理,p<0.05认为差异有统计学意义。首先对所测得的结果进行正态性及方差齐性检验,若方差齐,采用单因素方差分析,方差不齐则采用非参数检验;p<0.05认为差异有统计学意义。
以下结合实验对本发明的效果作进一步的说明。
实验1
本实验同时采用microRNA基因芯片技术和本发明的血清miR-630的荧光实时定量PCR检测试剂盒来测定异位骨化患者在异位骨未成熟(如创伤后8h)时血清中的miR-630含量以及正常人群的血清中的miR-630含量,目的在于验证本发明的miR-630检测试剂盒的准确度。
本实验的血清miR-630的荧光实时定量检测试剂盒的操作步骤如下所示:
(1)、分别从正常人的任一肢体和HO患者(如创伤后8h)的患肢取外周血2mL,采血时间为上午,然后采用血清分离体系分离出血清样品;
(2)、提取上述血清样品中的总RNA;
(3)、采用本发明的血清miR-630的荧光实时定量检测试剂盒测定正常人总RNA和HO患者患肢的总RNA中的miR-630含量。
microRNA基因芯片技术采用安捷伦公司的miRNA检测芯片技术特异性地检测正常人血清样品和HO患者患肢(如创伤后8h)的血清中的miR-630含量。
microRNA基因芯片技术的检测方法包括下列步骤:
(1)、将血清样品中的总RNA通过逆转录反应得到cDNA样品;
(2)、将cDNA样品进行预扩增反应;
(3)、对预扩增反应产物进行基因芯片检测,得到miRNA的表达谱;
(4)、进行数据分析与处理。
其中,microRNA基因芯片技术结果显示:miR-630在HO患者异位骨化的未成熟期表达量(如创伤后8h)降低,并且相对于正常人而言其表达量降低了近20倍;miR-630在HO患者异位骨化的成熟期表达量也有降低,并且相对于正常人而言其表达量降低了近10倍。经过验证可知,表达量的降低具有显著的统计学意义。
如表1和图2所示,本发明的miR-630检测试剂盒所得到的结果也显示:血清中miR-630的含量在异位骨化患者创伤早期(未成熟期)下调显著(p<0.05),3个月之后(成熟期)有所上调,1年以后与正常人群的血清中miR-630的含量相差不大。因此,可以作如下判定:
1、若miR-630的荧光实时定量PCR检测试剂盒所检测出血清中miR-630的相对含量为0.93±0.03,则判定该血清的供体处于异位骨化创伤早期。
2、若miR-630的荧光实时定量PCR检测试剂盒所检测出血清中miR-630的相对含量为2.49±0.11至2.82±0.16,则判定该血清的供体处于异位骨化创伤后三个月之后的时期。
上述充分说明本发明的miR-630检测试剂盒具有较高的测试准确度,能够大规模产业化应用。
表1本发明的血清miR-630检测试剂盒的测试结果表
发明人的研究结果表明,创伤后异位骨化患者的异位骨早期来源于内皮细胞,并经过内皮间充质转过过程形成异位骨。MiR-630在异位骨发生的早期显著下调,抑制了Slug基因,对该疾病的发生起了重要的调控作用。匹配的临床对照研究表明:miR-630在异位骨化患者的创伤早期特异性下调,相对于骨折愈合患者和未形成异位骨化患者具有明显统计学意义。上述实验结果明确了miR-630在异位骨化早期的临床预警作用,故测定血清中的miR-630的表达量有助于获取异位骨化的发生时期等相关信息。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 上海交通大学医学院附属第九人民医院
<120> 血清miR-630的荧光实时定量PCR检测试剂盒以及miR-630的应用
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 22
<212> RNA
<213> 人工序列
<400> 1
aguauucugu accagggaag gu 22
<210> 2
<211> 22
<212> RNA
<213> 人工序列
<400> 2
cuucccuggu acagaauacu uu 22
<210> 3
<211> 25
<212> DNA
<213> 人工序列
<400> 3
gtgctcgctt cggcagcaca tatac 25
<210> 4
<211> 27
<212> DNA
<213> 人工序列
<400> 4
aaaaatatgg aacgcttcac gaatttg 27
- 还没有人留言评论。精彩留言会获得点赞!
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- 一种实时荧光定量PCR检测土壤西瓜枯萎病菌的方法及引物与制造工艺
- 一种基于反射镜的荧光定量PCR的检测系统的制造方法与工艺
- 一种基于荧光定量PCR鉴定啮齿类螺杆菌的引物、试剂盒及鉴定方法与流程
- 一种检测包含潜伏期结核感染的试剂盒及其引物对和探针的制造方法与工艺
- 用于甜瓜果实基因PCR表达分析的内参基因及该内参基因的稳定性验证方法与流程
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺
- TMEM209基因作为内参基因在定量检测稻螟赤眼蜂基因表达量中的应用的制作方法与工艺
- 蝗虫微孢子虫实时荧光定量PCR检测方法及试剂盒与流程
- ZFP基因作为内参基因在定量检测螟黄赤眼蜂基因表达量中的应用的制造方法与工艺
- 一种鸭新型腺病毒Eva Green实时荧光定量PCR检测的引物的制造方法与工艺
- 一种ampC基因的实时荧光定量PCR快速检测系统的制造方法与工艺
- RPS23基因作为内参基因在定量检测螟黄赤眼蜂基因表达量中的应用的制造方法与工艺
- 一种基于实时荧光PCR定量检测肉制品猪源性成分的方法与流程
- 一种用于基因测序的DNA荧光定量分析装置的制造方法
- 一种鲫鱼冠状病毒TaqMan实时荧光定量RT‑PCR检测引物及应用的制造方法与工艺
- 梨果实不同发育时期荧光定量内参基因的筛选及应用的制造方法与工艺