一种高效高密度培养生物饵料的方法与流程
本发明涉及发酵工程和水产养殖技术领域,特别是涉及一种高效高密度培养生物饵料的方法。
背景技术:
生物饵料是指经过人工筛选的、可进行人工培养的、适合水产养殖的优质饵料生物。微藻蛋白质含量较高可达40%以上,必需氨基酸含量与鱼粉相当甚至更优。大量的营养及毒理学研究证明,微藻是一种适宜的生物饵料。微藻饵料应用在水产养殖上主要有3种类型:(1)作为活体的生物饵料应用在水产养殖中,除了能被水产动物直接摄食之外,其另一作用还体现在对养殖水质改善、调控水体微生态环境平衡方面。在育苗水体中投放饵料微藻,不但可以直接吸收利用氨氮、亚硝酸盐等物质,同时光合作用放出的氧气还可促进微生物对氨氮、亚硝酸盐的硝化作用。(2)由于微藻具有热稳定性高(在制备藻粉过程中不易受损害)、耐胃酸和耐抗生素等优点,而且蛋白质含量很高,其作为高级饲料添加剂不仅可以增强动物的机体免疫力,而且可以促进幼体的生长发育。(3)利用微藻培养轮虫、卤虫等原生动物作为水产养殖的间接饵料。
目前,饵料微藻大规模化培养主要采用开放式户外大池培养,封闭式光生物反应器培养、发酵罐异养培养,现分述如下:
(1)开放式户外大池培养
饵料微藻的大规模培养主要采用开放式光生物反应器培养,包括跑道池、圆池以及其它各种非封闭式的培养系统。开放池培养具有设施简易、投资少、成本低等优点,目前仍是饵料微藻大规模生产的主要培养方式。
(2)封闭式光生物反应器培养
为克服开放式培养的这些缺点,一些封闭式光生物反应器被陆续开发出来。lee等利用玻璃管道光生物反应器培养蛋白核小球藻,产率为26~30g/m2/d。ogbonna等采用内置光源的搅拌式光生物反应器培养蛋白核小球藻,获得了高达2.20g/l的细胞量。与开放式培养比较,封闭式光生物反应器培养的藻细胞产率及培养液体积相对减少,藻细胞收获的成本大大降低,提高了生产效率和产品质量,避免受其他生物和非生物物质的污染。
(3)发酵罐异养培养
饵料微藻大多数可利用有机物作为碳源和能源进行异养培养,其具有投入成本相对低廉、可实现藻体高密度培养的优点。托马斯等用chlorellapyrenoidosauv101-158生产抗坏血酸,在营养充足的培养基中,藻细胞密度最高达40g/l左右。naotoyoshida等流加葡萄糖异养培养蛋白核小球藻,细胞密度达50g/l。
zhengyunwu等异养流加培养蛋白核小球藻的藻细胞密度达70.6g/l。
(4)两阶段培养
两阶段培养是指先实现微藻的高密度培养,然后再实现目标产物积累。该模式不仅具备高密度、有效固定co2、低成本的特点,同时在一定程度上还可克服高温季节封闭式光生物反应器降温成本高、敞开式反应器水蒸发量大的缺点。ogbonna等建立了光自养-异养串联循环培养系统,解决了chlorellapyrenoidosac-212生物量下降以及藻体组成成份变化的情况,培养结果表明生物量持续增长,藻体蛋白含量维持在52%左右。ogbonna等建立了2.5l生物反应器/3.0lu型管式光生物反应器串联培养系统,最终藻细胞密度为14g/l,获得的藻体的蛋白质和叶绿素含量分别可达60.1%和3.6%的高水平。
目前,现有的培养方式存在以下缺陷:
国内绝大部分水产养殖企业,在育苗生产中都是利用各自的藻池和天然水体开放式培养微藻。尽管低成本的开放式培养为微藻细胞常采用的大规模培养方式,但其存在以下缺点:(1)藻细胞密度低、占地面积大、易受原生动物、细菌、真菌、杂藻污染;(2)由于开放式培养受气候条件影响较大,导致饵料微藻质量不均一、营养成分不平衡、饵料效价低;(3)饵料供应不及时,常与育苗进度脱节,很难满足水产养殖育苗中对饵料的供应需求,由此导致育苗成活率低、种苗抗病能力差、育苗成本高。
微藻生物饵料除可采用开放式培养外,还可采用封闭式的反应器培养。封闭式光生物反应器培养的藻细胞产率有所提高,最高可达10g/l,培养液体积相对减少,藻细胞收获的成本大大降低,提高了生产效率,保证了产品质量的均一性,避免受其它敌害生物和非生物物质的污染。但由于封闭式光生物反应器一次性投资大,放大困难,许多技术问题尚未完全解决。
目前,利用工业化发酵系统培养饵料微藻,可克服开放式生物反应器和封闭式生物反应器的以上诸多缺陷,是实现饵料微藻高效高密度培养的有效途径。然而,饵料微藻异养培养仍存在以下缺陷:(1)藻细胞蛋白质含量低、叶绿素含量低;(2)藻细胞培养过程受高浓度底物的抑制,细胞密度偏低。
为解决上述诸多问题,当前研究者热衷于将饵料微藻细胞的培养分为2个阶段。第一阶段,以获取高密度细胞为主,促使细胞生物量大量积累;第二阶段,将第一阶段的藻细胞,转接于光自养培养环境,胁迫诱导叶绿素、蛋白质、油脂的积累。两阶段培养方式尽管综合了封闭式反应器高密度培养特点和开放式生物反应器高效诱导的特点,但也具备二者的缺点。该培养方式仍然无法解决采收成本高、产品品质不均一、敌害生物污染等问题。因此,如何实现生物饵料高密度高效培养仍是阻碍其工业化生产的技术难题。
技术实现要素:
本发明的目的是克服现有技术中的缺陷,提供一种培养效率高、一步式实现蛋白积累、采收成本低的高密度高效培养生物饵料的方法。
为了实现上述发明目的,本发明采用的技术方案是:一种高效高密度培养生物饵料的方法,其特征在于,包括以下几个步骤:
(1)分批培养阶段
将能生产生物饵料的细胞按1~10%的接种量接种至生物反应器,反应器装液系数为70~80%,气液比0.1~2.0vvm,培养温度15~45℃,ph控制在4~11,控制溶氧浓度在10~80%,细胞分批培养一定时间后流加补料培养基;
在发酵行业中,溶氧电极的od浓度单位通常采用空气饱和度%来表示,在同样的温度、罐压、通气搅拌下进行比较;一般在培养基灭菌后,发酵前,do电极需标定。方法是在一定的温度、罐压和通气搅拌下(即培养基被空气百分之一百饱和为基准)将电流输出调到100%,待其稳定后便接种,接种后遍不能再动,直到发酵结束;
(2)补料-饥饿循环培养阶段
当细胞密度达到80~100g/l时,开始流加补料培养基至ph为6~8(补料时,补料速度为1~3ml/s,控制周期为5~20s,工作时间1~5s,补料时间10~48h,控制周期是指补料蠕动泵从启动到停止然后再启动的时间,工作时间是指补料蠕动泵在一个控制周期内的工作时间,停止补料2~8h,调控细胞代谢处于饥饿状态,随后重新恢复流加补料培养基,调控细胞代谢恢复至营养代谢状态,如此循环往复;
(3)目标产物诱导阶段
当细胞密度达到100g/l以上时,转至诱导阶段,将步骤(3)中流加补料速率调整为步骤(2)中流加补料速率的0.1~0.9倍或缺失至少一种底物营养成分,底部营养成分为碳源、氮源、磷源、硫源、维生素、重金属离子的一种或几种,降低细胞生长速率,诱导目标产物合成。
所述的生物饵料指微藻中的一种或几种,微藻包括:chlorella小球藻,anacystis组囊藻,synechococcus聚球藻,synechocystis集胞藻,chlorococcum绿球藻,phaeodactylum三角褐指藻,spirulina螺旋藻,micractinium微星藻属,haematococcus雨生红球藻,nannochloropsis微绿球藻,brachiomonas咸胞藻属,chlamydobonas衣藻,scenedemus栅藻,tetraselmis鞭毛藻,cylindrotheca筒柱藻,navicula舟形藻,anabaena鱼腥藻,poterioochromonas金藻,amphidinium前沟藻属,crypthecodinium隐甲藻,euglena眼虫藻属。
所述的生物反应器包括但不限于机械搅拌式生物反应器、气升式生物反应器、鼓泡式生物反应器、摇瓶、波浪式生物反应器中的一种或几种。
步骤(1)中,细胞按5~10%的接种量接种至生物反应器,气液比0.5~2.0vvm,细胞分批培养24~48h后流加补料培养基;反应器的初始转速200~400rpm,当溶氧浓度do大于或等于30%时保持初始转速,当溶氧浓度do<30%时转速增加20~50rpm,最大转速为1000rpm。
在补料-饥饿循环培养阶段,每次的饥饿时间为2~8h,每次的补料时间为10~48h(更优选地,10~24h),补料-饥饿循环的次数依据饥饿时间和补料时间而定。
在补料-饥饿循环培养阶段,饥饿时间的确定依据ph、溶氧、尾气、cer(二氧化碳释放速率)、our(氧消耗速率)、氧化还原电位、培养基底物浓度的变化,所述的尾部包括o2、co2,所述的培养基底物包括碳源、氮源、磷源、硫源、维生素、重金属离子。
所述的产物诱导为诱导细胞内色素、油脂、碳水化合物、蛋白质的积累,色素包括叶绿素、虾青素、类胡萝卜素、叶黄素,油脂包括ω-3脂肪酸、ω-7脂肪酸;步骤(3)中控制流加补料速率1~2ml/min。
所述的ph采用流加酸、碱、补料的方式调节,使ph控制在5~9(指整个发酵过程中的ph控制在此范围)其中酸包括盐酸、硫酸、磷酸、硝酸的一种或几种,碱包括氨水、氢氧化钠、氢氧化钾的一种或几种。
所述的整个培养过程中溶氧通过调节通气、搅拌、调节罐压、补料联动的方式控制,使得溶氧处于20~60%范围内。
步骤(1)中,能生产生物饵料的细胞在接种前,于15~45℃,100~300rpm,50~500μmol/m2/s的光照条件下活化培养至指数生长期。
与现有技术相比,本发明的有益效果是:
(1)培养效率高。一般开放式生物反应器培养的细胞生物量<1.0g/l,生物量积累速率<0.15g/l/d。封闭式生物反应器培养的细胞生物量<10.0g/l,生物量积累速率<1.50g/l/d。本发明的细胞生物量>100.0g/l,生物量积累速率为25.0g/l/d。
(2)一步式实现蛋白积累。细胞高密度培养后,无需转移至其它生物反应器胁迫诱导,即可实现蛋白质含量大幅提升,蛋白质含量可达45%以上。
(3)采收成本低。传统的培养方式,藻细胞个体小、密度低,采收困难且其成本占整个生产成本的30%,严重阻碍了生物饵料的规模化进程。本发明培养的藻细胞密度大,无需离心浓缩即可干燥制粉,既简化了工艺流程,又降低了生产成本。
(4)不受季节限制。细胞培养不受户外天气、季节限制,可实现全年不间断培养。
(5)不受敌害生物(原生动物、细菌、真菌、杂藻)污染。由于本发明采用的是封闭式培养,整个培养过程为严格的无菌培养环境,不会感染敌害生物,保证了生物饵料品种的纯一性。
附图说明
图1是实施例1中分批培养工艺、补料培养工艺和补料-饥饿循环培养工艺的生物量和蛋白质积累情况(摇瓶)。
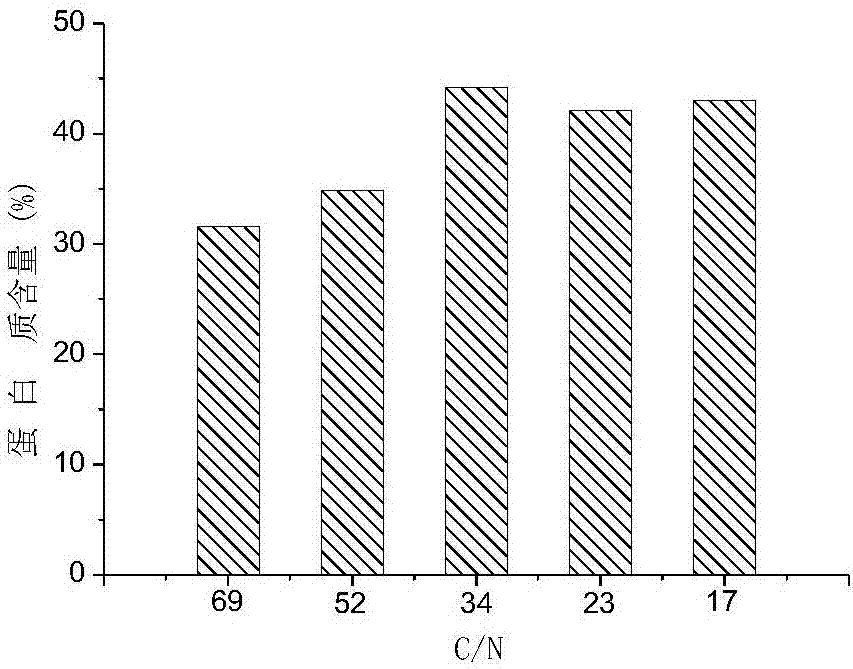
图2是实施例2中c/n比对蛋白质积累的影响(摇瓶)。
图3是实施例2中c/p比对蛋白质积累的影响(摇瓶)。
图4是实施例3中补料工艺和补料-饥饿循环培养工艺的生物量和蛋白质积累情况(生物反应器)。
图5是实施例3中补料工艺和补料-饥饿循环培养工艺的c/n变化情况(生物反应器)。
图6是实施例4中补料-饥饿循环培养工艺的生物量、蛋白质积累和c/n变化情况(生物反应器)。
图7是实施例5中补料-饥饿循环培养工艺的生物量、蛋白质积累和c/n变化情况(生物反应器)。
具体实施方式
以下通过实施例,对具体的实施方式进行说明。实施例所描述的内容仅用于说明本发明,但不构成对本发明的限制。
本发明提供了一种高密度高效培养生物饵料的新方法,该方法将饵料细胞的培养分为了3个阶段,具体的技术方案如下:
(1)分批培养阶段
将能生产生物饵料的细胞于15~45℃,100~300rpm,50~500μmol/m2/s的光照条件下活化培养至指数生长期(3~10d)。经过活化培养的细胞,能够在完全无光或光照的条件下生长,能够承受生物反应器内剧烈的搅拌和通气。活化后的细胞按1~10%的接种量接种至生物反应器,通气为0.1~2vvm,培养温度为15~45℃,ph控制在4~11,控制溶氧在10~80%,细胞分批培养24~48h后流加补料培养基。
(2)补料-饥饿循环培养阶段
当细胞密度达到80~100g/l时,开始流加补料培养基,培养10~24h后停止补料或降低补料速率为原来的0.1~0.9倍,继续培养2~8h,调控细胞代谢处于饥饿状态,随后重新恢复流加补料培养基速度,调控细胞代谢恢复至营养代谢状态,如此循环往复。其中,当饥饿敏感性指标发生异常变化时,记为饥饿时间的开始;当恢复补料后,饥饿敏感性指标再次变化时,记为饥饿时间的结束。
(3)目标产物诱导阶段
当细胞密度达到预期值时,转至诱导阶段,通过控制流加补料速率(补料速率为原来的0.1~0.9倍)或缺失某种底物营养成分(碳源、氮源、磷源、硫源、维生素、重金属离子),降低细胞生长速率,诱导目标产物合成。
在一个具体实施方式中,所述的生物饵料主要是指微藻中的一种或几种,包括:chlorella小球藻,anacystis组囊藻,synechococcus聚球藻,synechocystis集胞藻,chlorococcum绿球藻,phaeodactylum三角褐指藻,spirulina螺旋藻,micractinium微星藻属,haematococcus雨生红球藻,nannochloropsis微绿球藻,brachiomonas咸胞藻属,chlamydobonas衣藻,scenedemus栅藻,tetraselmis鞭毛藻,cylindrotheca筒柱藻,navicula舟形藻,anabaena鱼腥藻,poterioochromonas金藻,amphidinium前沟藻属,crypthecodinium隐甲藻,euglena眼虫藻属。
在优选的实施方式中,本发明优先选用绿藻实施。在更优选的实施方式中,本发明优先选用小球藻实施。
在一个具体的实施方式中,随着碳源的消耗和铵根离子的产生,ph会出现上升或下降的现象。ph调节采用流加酸、碱、补料的方式调节,使ph控制在4~11,较佳的ph为5~9。其中,酸包括盐酸、硫酸、磷酸、硝酸,碱包括氨水、氢氧化钠、氢氧化钾。
在一个具体实施方式中,所述的生物反应器包括机械搅拌式生物反应器、气升式生物反应器、鼓泡式生物反应器、摇瓶、波浪式生物反应器。在优选的实施例中,本发明优先选用机械搅拌式生物反应器和摇瓶。
在一个具体实施方式中,所述的饥饿工艺为限制流加培养基中碳源、氮源、磷源、硫源、重金属离子、重金属螯合剂等成分中的一种或几种。在优选的实施例中,本发明优先缺失碳源、重金属离子。
在一个具体实施方式中,在补料-饥饿循环培养阶段,每次的饥饿时间为2~8h,每次的补料时间为10~24h,补料-饥饿循环的次数依据饥饿时间和补料时间而定。
在一个具体实施方式中,在补料-饥饿循环培养阶段,饥饿时间的确定依据饥饿敏感性指标,包括ph、溶氧、尾气(o2、co2)、cer(二氧化碳释放速率)、our(氧消耗速率)、氧化还原电位、培养基底物(碳源、氮源、磷源、硫源、重金属离子)浓度的变化。在优选的实施例中,本发明优先选用ph、溶氧、培养基底物的变化判定饥饿时间。在更优选的实施例中,本发明优先选用培养基底物的变化判定饥饿时间。
在一个具体实施方式中,所述的产物诱导为诱导细胞内色素(叶绿素、虾青素、类胡萝卜素、叶黄素)、油脂(ω-3脂肪酸、ω-7脂肪酸)、碳水化合物、蛋白质积累。在优选的实施例中,本发明优先诱导蛋白质积累。
在一个具体实施方式中,所述的整个培养过程中溶氧通过调节通气、搅拌、罐压、补料联动的方式控制,使得溶氧处于10~80%范围内,更佳地处于20~60%范围内。
在一个具体实施方式中,最终获取的生物饵料可干燥制粉,用于鱼、虾、蟹水产养殖的高级藻粉饵料。
应理解,本发明专利所描述的任何一个或多个技术特征可相互组合构成新的技术方案。在此申请中,为节省篇幅,不一一列出。
实施例1
在500ml摇瓶中加入250ml基础培养基(配方见表1),将检查无菌、外观状态正常的藻细胞接入摇瓶中进行培养,培养条件为:完全避光培养,培养温度为30℃,初始转速150rpm。实验设计分为3组:
实验1(分批培养工艺):利用分批培养方式培养,不补加基础培养基浓缩液。
实验2(补料培养工艺):首先利用分批培养方式培养,培养第3d开始,每隔12h补加基础培养基浓缩液。
实验3(补料-饥饿循环培养工艺):首先利用分批培养方式培养,培养第3d开始,每隔24h补加基础培养基浓缩液。
每隔一定时间取样测定细胞干重、蛋白质含量、葡萄糖含量和硝酸根含量。
细胞干重测定时,取一定体积(v)的藻液于50ml离心管中,8000rpm离心5min,去除上清液,然后加入一定体积蒸馏水悬浮藻泥,再离心5min,弃上清,加入少量蒸馏水刮洗出藻泥,倒入已称重的洁净称量皿(m2)中。再将称量皿置于80℃烘箱中烘干24h。将该称量皿(m1)取出放于干燥箱中冷却再称量。并重复以上操作至前后两次质量差不超过2mg,即为恒重。藻液的干重按下列公式计算:x=(m1-m2)/v。蛋白质含量测定采用凯氏定氮法(宁正祥.食品成分分析手册[j].1998.)。葡萄糖含量和硝酸根含量分别采用dns法和浓硫酸-水杨酸法(张龙翔.生化实验方法和技术[j].1981.)。
表1基础培养基
piv1溶液配方:乙二胺四乙酸1.25g,硫酸亚铁2.00g,柠檬酸10.28g,氯化钙1.58g,水1000ml。
piv2溶液配方:硫酸锌0.222g,氯化锰1.81g,钼酸钠0.021g,硫酸铜0.07g,水1000ml。
结果分析(见图1):从细胞生物量和蛋白质积累速率看,实验3>实验2>实验1。不补加基础培养基浓缩液,培养基内的营养物质处于完全匮乏状态;每隔12h补加基础培养基浓缩液,培养基内的营养物质处于富营养状态;每隔24h补加基础培养基浓缩液,培养基内营养物质处于匮乏与营养状态切换,意味着细胞代谢处于饥饿与营养状态切换。实验3(补料-饥饿循环培养)促使细胞生物量比实验1和实验2分别增加了61.30%和31.48%。同时,实验3细胞的蛋白质含量可达41.22%,分别是实验1和实验2的1.16倍和1.33倍。
实施例2
在500ml摇瓶中加入250ml基础培养基(配方见表1),将检查无菌、外观状态正常的藻细胞接入摇瓶中进行饥饿培养16h,培养条件为:完全避光培养,培养温度为30℃,初始转速150rpm。c/n比设置为:69、52、34、23、17。c/p比设置为:∞、606、302、151、75。每隔一定时间取样测定细胞干重、蛋白质含量、葡萄糖含量、硝酸根含量和磷酸根含量。
磷酸根含量测定采用钼氨酸分光光度法(gb/t11893-1989水质总磷的测定钼酸铵分光光度法)。
结果分析:由图2可知,过低的氮浓度影响小球藻细胞胞内蛋白质积累,主要是因为硝酸还原酶的活性存在一定的阈值,氮浓度过低,酶活性也低;17~34的c/n比足以为细胞生长和蛋白质积累提供足够的氮源。由图3可知,磷浓度对小球藻蛋白质积累并无明显影响,这是由于小球藻细胞异养过程中本身具有磷源储存的功能,即使不添加磷源,小球藻仍可利用胞内储存的磷源维持细胞生长和蛋白质积累。随着胞内储存的磷源消耗,过低或过高的磷浓度均会影响蛋白质积累。本实验只是短暂(18h)的饥饿诱导,胞内储存的磷源足以维持细胞生长和蛋白质积累。
实施例3
在生物反应器中加入基础培养基(配方见表2),反应器装液系数为70%,将检查无菌、外观状态正常的藻细胞接入生物反应器进行培养,培养条件为:培养温度为30℃,气液比1.0vvm,初始转速200rpm。当do<20%时,转速增加50rpm,最大转速为1000rpm。实验设计分为2组:
实验1(补料工艺):首先利用分批培养方式培养小球藻,当细胞密度达到一定值时(即葡萄糖<20g/l),流加补料培养基(配方见表3)。
实验2(补料-饥饿循环培养工艺):首先利用分批培养方式培养小球藻,当细胞密度达到一定值时(即葡萄糖<20g/l),流加补料培养基(配方见表3),流加培养一定时间后停止补料5~8h,调控细胞代谢处于饥饿状态,随后重新恢复流加补料培养基速度,调控细胞代谢恢复至营养代谢状态,如此循环往复。
每隔一定时间取样测定细胞干重、蛋白质含量、葡萄糖含量和硝酸根含量。
表2基础培养基
表3补料培养基
补料工艺与补料饥饿循环培养工艺结果分析(见图4和图5):补料饥饿工艺具有无比的优越性(结合实例1的结果),主要表现在两个方面:
第一,从细胞生长情况看,补料饥饿循环培养工艺的细胞生长速率明显高于补料工艺的细胞生长速率。由于饥饿工艺可短时间内将补料工艺中的营养物质消耗殆尽,可有效避免底物浓度过高或过低,促使培养的c/n比维持在低水平;而纯粹的补料工艺的营养物质处于匮乏或富营养状态,促使培养的c/n比维持在高水平。由实例2的数据结果可知,细胞生长速率主要受控于不同的c/n水平,高水平的c/n比促进生物量积累,低水平则抑制。补料饥饿循环培养工艺的生物量积累速率是补料工艺的2.96倍。
第二,从蛋白质积累情况看,补料饥饿循环培养工艺的蛋白质积累速率明显高于补料工艺的蛋白质速率。由于藻细胞对碳源的消耗速率小于对氮源的消耗速率,导致培养基中的c/n比升高,重新流加补料培养基,导致培养基中c/n比降低。黑暗条件下,蛋白质是细胞氮源储存库之一,即在n源丰富的条件下,细胞内氮源合成蛋白质储存在胞内;在n源限制的条件下,胞内蛋白质合成受到抑制。培养基内n源水平决定了胞内n代谢流的流向,最终导致补料-饥饿培养工艺的蛋白质含量达37.23%,是补料工艺的1.23倍。
实施例4
在生物反应器中加入基础培养基(配方见表2),反应器装液系数为70%,将检查无菌、外观状态正常的藻细胞接入生物反应器进行培养,培养条件为:培养温度为30℃,气液比1.0vvm,初始转速200rpm。当do<20%时,转速增加50rpm,最大转速为1000rpm。首先利用分批培养方式培养小球藻,当细胞密度达到一定值时,流加补料培养基(配方见表4),流加培养一定时间后停止补料5~8h,调控细胞代谢处于饥饿状态,随后重新恢复流加补料培养基速度,调控细胞代谢恢复至营养代谢状态,如此循环往复。
每隔一定时间取样测定细胞干重、蛋白质含量、葡萄糖含量和硝酸根含量。
表4补料培养基
结果分析(见图6):通过调整补料培养基配方的c/n比例,促使细胞培养的中后期(24~96h)c/n比维持在10~40之间,而实例3中补料-饥饿循环培养工艺的c/n比维持在30~100之间。高c/n比,意味着培养基内的葡萄糖浓度过高或硝酸根浓度过低,不利于细胞生长,实例4的细胞生物量积累速率是实例3的1.09倍。低c/n比不仅能达到高细胞密度还能获得相同含量的蛋白质。
实施例5
在生物反应器中加入基础培养基(配方见表2),反应器装液系数为70%,将检查无菌、外观状态正常的藻细胞接入生物反应器进行培养,培养条件为:培养温度为30℃,气液比1.0vvm,初始转速200rpm。当do<20%时,转速增加50rpm,最大转速为1000rpm。首先利用分批培养方式培养小球藻,当细胞密度达到一定值时,流加补料培养基(配方见表4),流加培养一定时间后停止补料5~8h,调控细胞代谢处于饥饿状态,随后重新恢复流加补料培养基速度,调控细胞代谢恢复至营养代谢状态,如此循环往复。当细胞密度达到预定值后,更换补料培养基(配方见表5),诱导细胞内蛋白质合成。
每隔一定时间取样测定细胞干重、蛋白质含量、葡萄糖含量和硝酸根含量。
表5补料培养基
结果分析(见图7):当细胞密度达到100g/l时,更换补料培养基,促使培养环境处于碳缺乏氮磷富裕状态,藻细胞胞内蛋白质含量由28.94%增加至44.07%。
以上显示描述了本发明的基本原理、主要特征以及优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落进要求保护本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!