利用生物酶制备薯蓣皂苷元的方法及其所用生物材料与流程
本发明涉及利用生物酶制备薯蓣皂苷元的方法及其所用生物材料。
背景技术:
薯蓣皂苷元(diosgenin),工业上称之为薯蓣皂素,是薯蓣属(dioscoreal.)植物中的重要活性成分,作为合成甾体激素药物重要的医药中间体,被称为“药用黄金”。世界各国生产的60%以上甾体激素以薯蓣皂苷元为原料,市场需求巨大。目前,生产薯蓣皂苷元的方法是基于rothrock等人1957年提出的化学酸水解法,该工艺存在诸多问题。如何从源头根治污染是薯蓣皂苷元产业化持续发展亟待解决的问题。用生物酶制备薯蓣皂苷元,是无酸化生产薯蓣皂苷元的一个发展方向。
技术实现要素:
本发明所要解决的一个技术问题是如何制备薯蓣皂苷元。
为了解决以上技术问题,本发明提供了fbg1或与fbg1相关的生物材料在制备薯蓣皂苷元中的应用;所述fbg1可为a1)或a2)或a3)或a4)的蛋白质:
a1)氨基酸序列是seqidno.2的蛋白质;
a2)氨基酸序列是seqidno.2的第19-621位的蛋白质;
a3)在a1)或a2)所示的蛋白质的羧基端或/和氨基端融合蛋白标签得到的融合蛋白;
a4)将a1)或a2)所示的蛋白质经过一个以上氨基酸残基的取代和/或缺失和/或添加得到的与a1)或a2)所示的蛋白质具有90%以上的同一性且具有糖基水解酶活性的蛋白质;
所述与fbg1相关的生物材料可为下述b1)至b16)中的任一种:
b1)编码所述fbg1的核酸分子;
b2)含有b1)所述核酸分子的表达盒;
b3)含有b1)所述核酸分子的重组载体;
b4)含有b2)所述表达盒的重组载体;
b5)含有b1)所述核酸分子的重组微生物;
b6)含有b2)所述表达盒的重组微生物;
b7)含有b3)所述重组载体的重组微生物;
b8)含有b4)所述重组载体的重组微生物;
b9)含有b1)所述核酸分子的转基因动物细胞系;
b10)含有b2)所述表达盒的转基因动物细胞系;
b11)含有b3)所述重组载体的转基因动物细胞系;
b12)含有b4)所述重组载体的转基因动物细胞系;
b13)含有b1)所述核酸分子的转基因植物细胞系;
b14)含有b2)所述表达盒的转基因植物细胞系;
b15)含有b3)所述重组载体的转基因植物细胞系;
b16)含有b4)所述重组载体的转基因植物细胞系。
上述应用中,seqidno.2由621个氨基酸残基组成,第1-18位为信号肽序列,第19-621位为成熟的蛋白质的氨基酸序列。
上述应用中,所述标签蛋白(protein-tag)是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述标签蛋白可为flag标签蛋白、his标签蛋白、mbp标签蛋白、ha标签蛋白、myc标签蛋白、gst标签蛋白和/或sumo标签蛋白等。
上述应用中,同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gapexistencecost,perresiduegapcost和lambdaratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
上述应用中,所述90%以上的同一性可为至少91%、92%、95%、96%、98%或99%的同一性。
上述应用中,fbg1可来源于镰孢属菌种。
上述应用中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
上述应用中,b1)中编码所述fbg1的核酸分子可为fbg1基因。所述fbg1基因可为如下c1)-c3)中任一所述的dna分子:
c1)编码序列是seqidno.1的dna分子;
c2)编码序列是seqidno.1的第55-1866位核苷酸的dna分子;
c3)与c1)或c2)限定的dna分子具有90%以上的同一性且编码所述fbg1的dna分子。
其中,seqidno.1由1866个核苷酸组成,c1)编码a1)的蛋白质,c2)编码a2)的蛋白质。
上述应用中,90%以上的同一性可为至少91%、92%、95%、96%、98%或99%的同一性的dna分子。
上述应用中,b2)所述的表达盒,是指能够在宿主细胞中表达所述蛋白质的dna,该dna不但可包括启动所述蛋白质基因转录的启动子,还可包括终止所述蛋白质基因转录的终止子。进一步,所述表达盒还可包括增强子序列。可用现有的表达载体构建含有所述单克隆抗体基因表达盒的重组载体。
上述应用中,所述载体可为质粒、黏粒、噬菌体或病毒载体。
上述应用中,所述微生物可为酵母、细菌、藻或真菌。
上述应用中,所述转基因动物细胞系和转基因植物细胞系均可为非繁殖材料。
上述应用中,b3)或b4)所述的重组载体具体可为将pet30a(+)的ecori和noti识别位点间的片段替换为seqidno.1的第1-1866位所示的fbg1基因,保持pet30a(+)的其它序列不变得到的重组表达载体,命名为pet30a(+)-fbg1。该重组载体也可为将ppiczαa的ecori和noti识别位点间的片段替换为seqidno.1的第1-1863位所示的fbg1基因,保持ppiczαa的其它序列不变得到的重组表达载体,命名为ppiczαa-fbg1。
上述应用中,b5)至b8)的重组微生物具体可为将pet30a(+)-fbg1导入大肠杆菌中得到的表达氨基酸序列是seqidno.2的蛋白质的重组大肠杆菌。该重组微生物也可为将ppiczαa-fbg1导入酵母中得到的表达氨基酸序列是seqidno.2的蛋白质的重组酵母。
上述应用中,所述细菌可为大肠杆菌,如bl21(de3);所述酵母可为毕赤酵母,如巴氏毕赤酵母。
为了解决以上技术问题,本发明提供了所述fbg1或所述与fbg1相关的生物材料在将延龄草苷转化为薯蓣皂苷元中的应用。
上述应用中,所述将延龄草苷转化为薯蓣皂苷元可为利用酶将延龄草苷转化为薯蓣皂苷元,所述酶可为fbg1或所述酶包括fbg1。
为了解决以上技术问题,本发明提供了c和d在制备薯蓣皂苷元中的应用,所述c为所述fbg1或与fbg1相关的生物材料;所述d为frg1或与frg1相关的生物材料;所述frg1为r1)或r2)或r3)或r4)的蛋白质:
r1)氨基酸序列是seqidno.4的蛋白质;
r2)氨基酸序列是seqidno.4的第24-670位的蛋白质;
r3)在r1)或r2)所示的蛋白质的羧基端或/和氨基端融合蛋白标签得到的融合蛋白;
r4)将r1)或r2)所示的蛋白质经过一个以上氨基酸残基的取代和/或缺失和/或添加得到的与r1)或r2)所示的蛋白质具有90%以上的同一性且具有糖基水解酶活性的蛋白质;
所述与frg1相关的生物材料为下述s1)至s16)中的任一种:
s1)编码所述frg1的核酸分子;
s2)含有s1)所述核酸分子的表达盒;
s3)含有s1)所述核酸分子的重组载体;
s4)含有s2)所述表达盒的重组载体;
s5)含有s1)所述核酸分子的重组微生物;
s6)含有s2)所述表达盒的重组微生物;
s7)含有s3)所述重组载体的重组微生物;
s8)含有s4)所述重组载体的重组微生物;
s9)含有s1)所述核酸分子的转基因动物细胞系;
s10)含有s2)所述表达盒的转基因动物细胞系;
s11)含有s3)所述重组载体的转基因动物细胞系;
s12)含有s4)所述重组载体的转基因动物细胞系;
s13)含有s1)所述核酸分子的转基因植物细胞系;
s14)含有s2)所述表达盒的转基因植物细胞系;
s15)含有s3)所述重组载体的转基因植物细胞系;
s16)含有s4)所述重组载体的转基因植物细胞系。
上述应用中,seqidno.4由670个氨基酸残基组成,第1-23位为信号肽序列,第24-670位为成熟的蛋白质的氨基酸序列。
上述应用中,同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gapexistencecost,perresiduegapcost和lambdaratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算。然后即可获得同一性的值(%)。
上述应用中,所述90%以上的同一性可为至少91%、92%、95%、96%、98%或99%的同一性。
上述应用中,frg1可来源于镰孢属菌种。
上述应用中,所述标签蛋白(protein-tag)是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述标签蛋白可为flag标签蛋白、his标签蛋白、mbp标签蛋白、ha标签蛋白、myc标签蛋白、gst标签蛋白和/或sumo标签蛋白等。
上述应用中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
上述应用中,s1)中编码所述frg1的核酸分子可为frg1基因。所述frg1基因可为如下d1)-d3)中任一所述的dna分子:
d1)编码序列是seqidno.3的dna分子;
d2)编码序列是seqidno.3的第70-2013位核苷酸的dna分子;
d3)与d1)或d2)限定的dna分子具有90%以上的同一性且编码所述frg1的dna分子。
其中,seqidno.3由2013个核苷酸组成,d1)编码r1)的蛋白质,d2)编码r2)的蛋白质。
上述应用中,90%以上的同一性可为至少91%、92%、95%、96%、98%或99%的同一性的dna分子。
上述应用中,s2)所述的表达盒,是指能够在宿主细胞中表达所述蛋白质的dna,该dna不但可包括启动所述蛋白质基因转录的启动子,还可包括终止所述蛋白质基因转录的终止子。进一步,所述表达盒还可包括增强子序列。可用现有的表达载体构建含有所述单克隆抗体基因表达盒的重组载体。
上述应用中,所述载体可为质粒、黏粒、噬菌体或病毒载体。
上述应用中,所述微生物可为酵母、细菌、藻或真菌。
上述应用中,所述转基因动物细胞系和转基因植物细胞系均可为非繁殖材料。
上述应用中,s3)或s4)所述的重组载体具体可为将pet30a(+)的ecori和noti识别位点间的片段替换为seqidno.3的第1-2013位所示的frg1基因,保持pet30a(+)的其它序列不变得到的重组表达载体,命名为pet30a(+)-frg1。该重组载体也可为将ppic9k的ecori和noti识别位点间的片段替换为seqidno.3的第1-2010位所示的frg1基因,保持ppic9k的其它序列不变得到的重组表达载体,命名为ppic9k-frg1。
上述应用中,s5)至s8)的重组微生物具体可为将pet30a(+)-frg1导入大肠杆菌中得到的表达氨基酸序列是seqidno.4的蛋白质的重组大肠杆菌。该重组微生物也可为将ppic9k-frg1导入酵母中得到的表达氨基酸序列是seqidno.4的蛋白质的重组酵母。
上述应用中,所述细菌可为大肠杆菌,如bl21(de3);所述酵母可为毕赤酵母,如巴氏毕赤酵母。
上述应用中,利用酶制备薯蓣皂苷元,所述酶为所述fbg1和所述frg1,或所述酶包括所述fbg1和所述frg1。
上述应用中,所述应用包括:
1)用所述frg1将盾叶新苷转化为延龄草苷;
2)用所述fbg1将延龄草苷转化为薯蓣皂苷元。
上述fbg1和/或上述frg1也属于本发明的保护范围。
上述与fbg1相关的生物材料和/或上述与frg1相关的生物材料也属于本发明的保护范围。
上述fbg1和/或上述frg1在作为糖基水解酶中的应用也属于本发明的保护范围。
上述frg1在以盾叶新苷为底物制备延龄草苷、三角叶皂苷和/或薯蓣次苷a中的应用也属于本发明的保护范围。
上文中,所有应用的直接目的可以是非疾病治疗目的、非疾病预后目的和/或非疾病诊断目的。
本发明还提供了制备fbg1的方法,包括使fbg1的编码基因在生物中进行表达得到fbg1的步骤;所述生物为微生物、植物或非人动物。
上述方法中,所述表达包括将fbg1的编码基因导入受体微生物,得到表达fbg1的重组微生物,培养所述重组微生物,表达得到fbg1。
上述方法中,所述受体微生物可为原核微生物或真核微生物。所述原核微生物可为细菌,所述真核微生物可为真菌。所述细菌可为大肠杆菌。所述真菌可为酵母。所述酵母可为毕赤酵母,如巴氏毕赤酵母。
上述方法中,所述fbg1的编码基因可为上述c1)-c3)中任一所述的dna分子。
上述方法中,所述重组微生物可为上述b5)至b8)中的任一种重组微生物。
实验证明,frg1能水解盾叶新苷的β-1,3、β-1,4连接的葡萄糖和α-1,2连接的鼠李糖侧链,生成三角叶皂苷、薯蓣次苷a和延龄草苷,frg1是糖基水解酶。fbg1能水解延龄草苷的β-d-葡萄糖侧链,生成薯蓣皂苷元,是糖基水解酶,其将延龄草苷转化为薯蓣皂苷元的转化率为95%。fbg1和/或frg1可用于生产薯蓣皂苷元。
附图说明
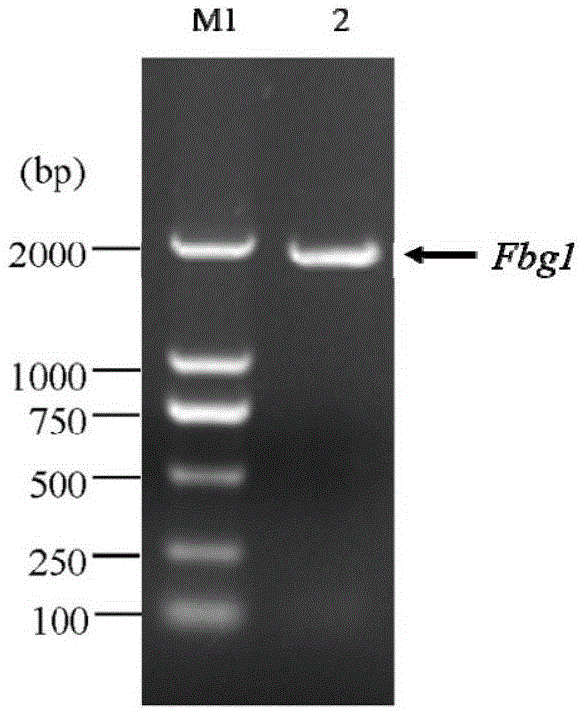
图1为fbg1基因的pcr扩增产物电泳结果。图中,m1为dna分子量标准;泳道2箭头所示pcr产物,条带大小和实际相符。
图2为ppiczαa-fbg1的ecori和noti酶切产物电泳图谱。图中,m1为dna分子量标准;泳道2为ppiczαa-fbg1的ecori和noti酶切产物,ppiczαa的箭头示酶切产物中的ppiczαa片段条带,fbg1的箭头示酶切产物中的fbg1基因条带。
图3为fbg1在毕赤酵母中重组表达的sds-page结果。图中,m3为蛋白质分子量标准;泳道1和2均为fbg1粗酶液2,箭头所示重组fbg1;泳道4和5分别为x33粗酶液和x33/ppiczαa粗酶液。
图4为frg1基因的pcr产物电泳结果。图中,m1为dna分子量标准;泳道2箭头所示frg1基因的pcr产物,条带大小和实际相符。
图5为ppic9k-frg1的ecorⅰ和notⅰ酶切产物电泳图谱。图中,m1为dna分子量标准;泳道2为ppic9k-frg1的ecorⅰ和notⅰ酶切产物,ppic9k和箭头示酶切产物中的ppic9k片段条带,frg1和箭头示酶切产物中的frg1基因条带。
图6为frg1在大肠杆菌中重组表达的sds-page结果。图中,m1为蛋白质分子量标准;泳道4和5分别为bl21(de3)/pet30a(+)-frg1粗酶液(frg1粗酶液1)和bl21(de3)/pet30a(+)-frg1菌体破碎离心所得沉淀,箭头所示重组frg1;泳道2和3分别为bl21(de3)/pet30a(+)粗酶液和bl21(de3)/pet30a(+)菌体破碎离心所得沉淀。
图7为frg1将盾叶新苷转化为三角叶皂苷、薯蓣次苷a和延龄草苷的tlc图。图中,a展开剂是氯仿/甲醇(70:26:6),b展开剂是石油醚/乙酸乙酯(2:1)。1为标准品薯蓣次苷a,2为标准品延龄草苷,3为标准品盾叶新苷,4和5为盾叶新苷的催化产物,6为薯蓣皂苷元标准品。箭头示盾叶新苷、三角叶皂苷、薯蓣次苷a、延龄草苷和薯蓣皂苷元。
图8为工程菌x33/ppiczαa-fbg1发酵所得粗酶液对延龄草苷的体外生物催化效率示意图。图中,箭头示反应结束后hplc图谱中的残留底物(延龄草苷)和新生成的催化产物(薯蓣皂苷元)。
图9为基于一锅法反应利用重组fbg1和frg1将盾叶新苷转化为三角叶皂苷、薯蓣次苷a、延龄草苷和薯蓣皂苷元的tlc图。图中,a展开剂是氯仿/甲醇(70:26:6),b展开剂是石油醚/乙酸乙酯(2:1)。1和5为标准品薯蓣皂苷元,2为标准品薯蓣次苷a,3和4为盾叶新苷的催化产物。箭头示盾叶新苷、三角叶皂苷、薯蓣次苷a、延龄草苷和薯蓣皂苷元。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的镰孢属菌种(fusariumsp.)cpcc400709已于2015年7月6日收藏于中国医学科学院医药生物技术研究所的中国药学微生物菌种保藏管理中心(chinapharmaceuticalculturecollection,简称cpcc,地址:北京天坛西里1号,中国医学科学院医药生物技术研究所,邮政编码:100050),自该收藏日起公众可从cpcc获得该菌株。
实施例1、糖基水解酶fbg1和frg1的发现和重组表达
一、糖基水解酶fbg1的发现和重组表达
1fbg1基因的发现
发现过程如下:粗酶的制备→酶的纯化→酶的鉴定→皂苷水解酶基因的克隆。具体如下:取活化好的镰孢菌属菌种(fusariumsp.)cpcc400709斜面,悬浮液接种到100ml三角瓶中,振荡培养4天;然后接种到5,000ml三角瓶中,振荡培养4天,离心分离得到菌丝体,超声破碎,离心分离得到上清,即为粗酶液。然后采用硫酸铵沉淀、q-sepharosefastflow阴离子交换柱层析、spfastflow阳离子交换柱层析和miniqtm4.6/50pe阴离子交换柱层析等方法进行酶的纯化;通过聚丙烯酰胺凝胶电泳、胶内酶解、lc-ms/ms分析和mascot蛋白检索比对鉴定fbg1,酶的鉴定主要由北京蛋白质组研究中心和军事医学科学院生物医学分析中心完成。
最后,采用trizol提取镰孢属菌种(fusariumsp.)cpcc400709的总rna,反转录合成第一链cdna,以之为模板,利用基因特异引物pcr扩增得到seqidno.1的第1位-1866位所示的fbg1基因(图1)。fbg1基因编码seqidno.2的第1位-621位所示的fbg1。seqidno.1由1866bp组成,包含完整的起始和终止密码子。seqidno.2是由621个氨基酸残基组成的蛋白质。
2fbg1的原核表达
用seqidno.1所示的dna替换pet30a(+)的ecorⅰ和notⅰ识别位点间的片段(小片段),保持pet30a(+)的其它序列不变,得到fbg1基因重组表达载体,命名为pet30a(+)-fbg1。pet30a-fbg1含有seqidno.1的第1-1866位所示的fbg1基因,该fbg1基因编码seqidno.2第1-621位所示的蛋白质fbg1。
将pet30a(+)-fbg1转化大肠杆菌bl21(de3)感受态细胞。将其均匀涂布于含卡那霉素的lb平板上,37℃培养16小时。单菌落振荡培养过夜,提取质粒进行测序,将测序结果表明含有pet30a(+)-fbg1的重组大肠杆菌命名为bl21(de3)/pet30a(+)-fbg1。
将pet30a(+)按照上述方法转化大肠杆菌bl21(de3)感受态细胞,得到含有pet30a(+)的重组大肠杆菌,命名为bl21(de3)/pet30a(+),作为空载体对照菌。
将bl21(de3)/pet30a(+)-fbg1、bl21(de3)/pet30a(+)和大肠杆菌bl21(de3)分别单独接种于含50μg/ml卡那霉素的10mllb液体培养基(在lb液体培养基中加入卡那霉素至卡那霉素的浓度为50μg/ml得到的培养基)中,37℃,采用thermomaxq6000型全温振荡器200rpm振荡培养至0d600值(以含50μg/ml卡那霉素的lb液体培养基为空白对照)达到0.6时,加入异丙基硫代-β-d-半乳糖苷(iptg)至iptg含量为0.4mm,20℃诱导表达8h后,4℃5000rpm离心发酵液6min。将所得菌体沉淀用1ml50mm磷酸缓冲液悬浮,4℃5000rpm离心3min,如此重复洗涤菌体三次。再将1ml50mm磷酸缓冲液加入菌体中,压力破碎细胞,然后4℃12000rpm离心15min,所得上清即为粗酶液。将由bl21(de3)/pet30a(+)-fbg1得到的粗酶液命名为fbg1粗酶液1,将由bl21(de3)/pet30a(+)得到的粗酶液命名为bl21(de3)/pet30a(+)粗酶液,将由大肠杆菌bl21(de3)得到的粗酶液命名为bl21(de3)粗酶液。
3fbg1的真核表达
将ppiczαa(invitrogen公司)的ecori和noti识别位点间的片段(小片段)替换为seqidno.1的第1-1863位所示的fbg1基因,保持ppiczαa的其它序列不变得到重组表达载体,命名为ppiczαa-fbg1。ppiczαa-fbg1含有seqidno.1的第1-1863位所示的fbg1基因,该fbg1基因编码seqidno.2第1-621位所示的蛋白质fbg1。
ppiczαa-fbg1经ecori和noti酶切进行电泳,结果如图2所示,得到了1863bp的fbg1基因。
将ppiczαa-fbg1用saci线性化后转化巴氏毕赤酵母(pichiapastoris)x33(invitrogen公司)感受态细胞,转化后菌液涂布在md平板上;再将md平板上长出的单菌落用牙签依次同时点种到含有1mg/ml、2mg/ml和4mg/mlg418的ypd平板上,挑选g418抗性强的高拷贝转化子,得到含有seqidno.1的第1-1863位所示的fbg1基因的重组巴氏毕赤酵母,将其命名为工程菌x33/ppiczαa-fbg1。工程菌x33/ppiczαa-fbg1能分泌表达seqidno.2第1-621位所示的蛋白质fbg1。
将ppiczαa按照上述方法转化巴氏毕赤酵母(pichiapastoris)x33,得到含有ppiczαa的重组巴氏毕赤酵母,将其命名为x33/ppiczαa,作为空载体对照菌。将工程菌x33/ppiczαa-fbg1、x33/ppiczαa和巴氏毕赤酵母(pichiapastoris)x33(简称受体菌)分别单独接种于bmgy培养基中,28-30℃、220rpm摇床培养20h后,无菌条件下5,000rpm离心发酵液10min,将所得菌体溶解于bmmy培养基中,以后每24h加甲醇至甲醇含量为1%(v/v)进行诱导,甲醇诱导3天停止培养,得到诱导培养后发酵液。取100ml诱导培养后发酵液,12,000rpm离心5min,收集上清液,将该上清液浓缩至2ml,即得粗酶液。将由工程菌x33/ppiczαa-fbg1得到的粗酶液命名为fbg1粗酶液2,将由x33/ppiczαa得到的粗酶液命名为x33/ppiczαa粗酶液,将由巴氏毕赤酵母(pichiapastoris)x33得到的粗酶液命名为x33粗酶液。
对粗酶液进行sds-page分析,结果如图3所示,x33/ppiczαa-fbg1的粗酶液(fbg1粗酶液2)中得到了97kda的fbg1蛋白,对照菌x33/ppiczαa和pichiapastorisx33的粗酶液中均未见该条带。
4fbg1是糖基水解酶
取2ml步骤3的诱导培养后发酵液,12,000rpm离心5min,取10μl上清液加入50μl5mm4-硝基苯-β-d-吡喃葡萄糖苷(pnp-glc)测活液至pnp-glc的含量为0.01mg/ml,50℃水浴反应20min后,加入1ml1m碳酸钠溶液终止反应,并检测405nm处紫外吸光度。其中,5mm4-硝基苯-β-d-吡喃葡萄糖苷(pnp-glc)测活液的配置方法如下:称取4-硝基苯-β-d-吡喃葡萄糖苷(pnp-glc)(底物)溶于ph5.0的50mm醋酸钠-醋酸缓冲液中,定容至10ml,配成50mm的储液,分装成1ml/管,–20℃保存,使用时取1ml融化,用上述ph5.0的50mm醋酸钠-醋酸缓冲液配成5mm4-硝基苯-β-d-吡喃葡萄糖苷(pnp-glc)测活液使用。将在50℃、ph5.0以4-硝基苯-β-d-吡喃葡萄糖苷为底物的条件下,每分钟产生1nm对硝基酚所需要的酶量定义为一个活性单位u。实验重复三次,结果表明甲醇诱导3天后,工程菌x33/ppiczαa-fbg1的发酵液对底物pnp-glc的糖基水解酶活性达到了9.6×104u/l,此时工程菌x33/ppiczαa-fbg1发酵液中的生物量以干细胞重量计为15g/l。甲醇诱导3天,x33/ppiczαa和巴氏毕赤酵母(pichiapastoris)x33的发酵液对底物pnp-glc没有糖基水解酶活性。工程菌x33/ppiczαa-fbg1表达了seqidno.2的第1-621位所示的蛋白质fbg1。fbg1是糖基水解酶。
二、糖基水解酶frg1的发现和重组表达
1frg1基因的发现
发现过程如下:粗酶的制备→酶的纯化→酶的鉴定→皂苷水解酶基因的克隆。具体如下:取活化好的镰孢属菌种(fusariumsp.)cpcc400709斜面,悬浮液接种到100ml三角瓶中,振荡培养4天;然后接种到5000ml三角瓶中,振荡培养4天,离心分离得到菌丝体,超声破碎,离心分离得到上清,即为粗酶液。然后采用硫酸铵沉淀、q-sepharosefastflow阴离子交换柱层析、spfastflow阳离子交换柱层析和miniqtm4.6/50pe阴离子交换柱层析等方法进行酶的纯化;通过聚丙烯酰胺凝胶电泳、胶内酶解、lc-ms/ms分析和mascot蛋白检索比对鉴定frg1,酶的鉴定主要由北京蛋白质组研究中心和军事医学科学院生物医学分析中心完成。
最后,采用trizol提取镰孢属菌种(fusariumsp.)cpcc400709的总rna,反转录合成第一链cdna,以之为模板,利用基因特异引物pcr扩增得到seqidno.3的第1-2013位所示的frg1基因(图4)。frg1基因编码seqidno.4的第1-670位所示的frg1。seqidno.3由2013bp组成,包含完整的起始和终止密码子。seqidno.4是由670个氨基酸残基组成的蛋白质。
2frg1的原核表达
用seqidno.3所示的dna替换pet30a(+)的ecorⅰ和notⅰ识别位点间的片段(小片段),保持pet30a(+)的其它序列不变,得到frg1基因重组表达载体,命名为pet30a(+)-frg1。pet30a(+)-frg1含有seqidno.1的第1-2013位所示的frg1基因,该frg1基因编码seqidno.4第1-670位所示的蛋白质frg1。
将pet30a(+)-frg1转化大肠杆菌bl21(de3)感受态细胞。将其均匀涂布于含卡那霉素的lb平板上,37℃培养16小时。单菌落振荡培养过夜,提取质粒进行测序,将测序结果表明含有pet30a(+)-frg1的重组大肠杆菌命名为bl21(de3)/pet30a(+)-frg1。
将pet30a(+)按照上述方法转化大肠杆菌bl21(de3)感受态细胞,得到含有pet30a(+)的重组大肠杆菌,命名为bl21(de3)/pet30a(+),作为空载体对照菌。
将bl21(de3)/pet30a(+)-frg1、bl21(de3)/pet30a(+)和大肠杆菌bl21(de3)分别单独接种于含50μg/ml卡那霉素的10mllb液体培养基(在lb液体培养基中加入卡那霉素至卡那霉素的浓度为50μg/ml得到的培养基)中,37℃,采用
thermomaxq6000型全温振荡器200rpm振荡培养至0d600值(以含50μg/ml卡那霉素的lb液体培养基为空白对照)达到0.6时,加入异丙基硫代-β-d-半乳糖苷(iptg)至iptg含量为0.4mm,20℃诱导表达8h后,4℃5000rpm离心发酵液6min。将所得菌体沉淀用1ml50mm磷酸缓冲液悬浮,4℃5000rpm离心3min,如此重复洗涤菌体三次。再将1ml50mm磷酸缓冲液加入菌体中,压力破碎细胞,然后4℃12000rpm离心15min,所得上清即为粗酶液。将由bl21(de3)/pet30a(+)-frg1得到的粗酶液命名为frg1粗酶液1,将由bl21(de3)/pet30a(+)得到的粗酶液命名为bl21(de3)/pet30a(+)粗酶液,将由大肠杆菌bl21(de3)得到的粗酶液命名为bl21(de3)粗酶液。
对粗酶液和bl21(de3)/pet30a(+)菌体破碎离心所得沉淀进行sds-page分析,结果如图6所示,frg1粗酶液1得到了70kda的frg1蛋白,对照菌bl21(de3)/pet30a(+)的粗酶液和沉淀中未见该条带。
3frg1的真核表达
将ppic9k(invitrogen公司)ecorⅰ和notⅰ识别位点间的片段(小片段)替换为seqidno.3的第1-2010位所示的frg1基因,保持ppic9k的其它序列不变得到重组表达载体,命名为ppic9k-frg1。ppic9k-frg1含有seqidno.3的第1-2010位所示的frg1基因,该frg1基因编码seqidno.4第1-670位所示的蛋白质frg1。
ppic9k-frg1经ecorⅰ和notⅰ酶切进行电泳,结果如图5所示,得到了2010bp的frg1基因。
将ppic9k-frg1用saci线性化后转化巴氏毕赤酵母(pichiapastoris)gs115(invitrogen公司)感受态细胞,转化后菌液涂布在md平板上;再将md平板上长出的单菌落用牙签依次同时点种到含有1mg/ml、2mg/ml和4mg/mlg418的ypd平板上,挑选g418抗性强的高拷贝转化子,得到含有seqidno.3的第1-2010位所示的frg1基因的重组巴氏毕赤酵母,将其命名为工程菌gs115/ppic9k-frg1。工程菌gs115/ppic9k-frg1能分泌表达seqidno.4第1-670位所示的蛋白质frg1。
将ppic9k按照上述方法转化巴氏毕赤酵母(pichiapastoris)gs115,得到含有ppic9k的重组巴氏毕赤酵母,将其命名为gs115/ppic9k,作为空载体对照菌。将工程菌gs115/ppic9k-frg1、gs115/ppic9k和巴氏毕赤酵母(pichiapastoris)gs115(简称受体菌)分别接种于bmgy培养基中,28-30℃、220rpm摇床培养20h后,无菌条件下5,000rpm离心发酵液10min,将所得菌体溶解于bmmy培养基中,以后每24h加甲醇至甲醇含量为1%(v/v)进行诱导,甲醇诱导8天停止培养,得到诱导培养后发酵液。取300ml诱导培养后发酵液12,000rpm离心5min,收集上清液,将该上清液浓缩至2ml,即得粗酶液。将由工程菌gs115/ppic9k-frg1得到的粗酶液命名为frg1粗酶液2,将由x33/ppiczαa得到的粗酶液命名为x33/ppiczαa粗酶液,将由巴氏毕赤酵母(pichiapastoris)x33得到的粗酶液命名为x33粗酶液。
4frg1是糖基水解酶
取2ml步骤3的诱导培养后发酵液,12,000rpm离心5min,取10μl上清液加入50μl5mm4-硝基苯-β-d-吡喃葡萄糖苷(pnp-glc)测活液至pnp-glc的含量为0.01mg/ml,50℃水浴反应20min后,加入1ml1m碳酸钠溶液终止反应,并检测405nm处紫外吸光度。其中,5mm4-硝基苯-β-d-吡喃葡萄糖苷(pnp-glc)测活液的配置方法如下:称取4-硝基苯-β-d-吡喃葡萄糖苷(pnp-glc)(底物)溶于ph5.0的50mm醋酸钠-醋酸缓冲液中,定容至10ml,配成50mm的储液,分装成1ml/管,-20℃保存,使用时取1ml融化,用上述ph5.0的50mm醋酸钠-醋酸缓冲液配成5mm4-硝基苯-β-d-吡喃葡萄糖苷(pnp-glc)测活液使用。将在50℃、ph5.0以4-硝基苯-β-d-吡喃葡萄糖苷为底物的条件下,每分钟产生1nm对硝基酚所需要的酶量定义为一个活性单位u。实验重复三次,结果表明甲醇诱导8天后,工程菌gs115/ppic9k-frg1的发酵液对底物pnp-glc的糖基水解酶活性达到了290u/l,此时工程菌gs115/ppic9k-frg1发酵液中的生物量以干细胞重量计为13g/l。甲醇诱导8天,gs115/ppic9k和巴氏毕赤酵母(pichiapastoris)gs115的发酵液对底物pnp-glc没有糖基水解酶活性。工程菌gs115/ppic9k-frg1表达了seqidno.4的第1-670位所示的蛋白质frg1。frg1是糖基水解酶。
实施例2、利用frg1和fbg1分步制备薯蓣皂苷元
一、利用frg1将盾叶新苷转化为延龄草苷、三角叶皂苷和薯蓣次苷a
取400μl实施例1的frg1粗酶液1,加入底物盾叶新苷,使其浓度为0.2mg/ml(1ml反应体系),50℃反应24h后,加入200μl水饱和正丁醇溶液终止反应并萃取三次,合并正丁醇层,得到盾叶新苷的催化产物。采用薄层色谱法(tlc)用硅胶板gf254,分别吸取5μl薯蓣次苷a、延龄草苷和薯蓣皂苷元的标准品以及5μl盾叶新苷的催化产物,分别以氯仿/甲醇/水(体积比为70:26:6,检测皂苷的生成)和石油醚/乙酸乙酯(体积比2:1,检测薯蓣皂苷元的生成)为展开剂,通过10%硫酸乙醇显色检测frg1粗酶液1对盾叶新苷的催化效率。bl21(de3)/pet30a(+)粗酶液作为对照进行同样的处理。如图7所示,结果表明,以盾叶新苷为底物,利用frg1可催化制备三角叶皂苷、薯蓣次苷a和延龄草苷。tlc图谱扫描的半定量结果显示,盾叶新苷的转化率是79.6%。bl21(de3)/pet30a(+)发酵所得粗酶液对盾叶新苷的催化产物中没有检测到三角叶皂苷、薯蓣次苷a和延龄草苷的生成。
取2ml实施例1中frg1粗酶液2,加入盾叶新苷(底物),使底物的终浓度均为2.5mg/ml(2ml反应体系),50℃反应24h,即得盾叶新苷的催化产物。取100μl催化产物,加入900μl甲醇,震荡5min后12,000rpm离心5min,取上清进行hplc分析,主要色谱条件如下:agilent1100,配有elsd检测器和chemstation色谱工作站;xdb-c18色谱柱(250×4.6mm,5μm);用90%乙腈-水溶液(由乙腈和水按照9:1的体积比混合得到的液体)进行洗脱,流速1ml/min;柱温30℃;进样量10μl。hplc分析中,分别以盾叶新苷、延龄草苷、三角叶皂苷和薯蓣次苷a为标准品根据标准品的保留时间定性和采用标准曲线法(外标法)进行定量分析延龄草苷、三角叶皂苷和薯蓣次苷a。实验重复三次。
结果表明,工程菌gs115/ppic9k-frg1发酵所得粗酶液对盾叶新苷的催化产物中含有延龄草苷、三角叶皂苷和薯蓣次苷a等目标产物。gs115/ppic9k和巴氏毕赤酵母(pichiapastoris)gs115发酵所得粗酶液的催化产物中均没有检测到延龄草苷、三角叶皂苷和薯蓣次苷a的生成。
上述结果说明frg1能水解盾叶新苷β-1,3、β-1,4连接的葡萄糖和α-1,2连接的鼠李糖侧链,生成三角叶皂苷、薯蓣次苷a和延龄草苷,frg1是糖基水解酶。
二、利用fbg1制备薯蓣皂苷元
取400μl实施例1的fbg1粗酶液1,加入底物延龄草苷,使其浓度为0.2mg/ml(1ml反应体系),50℃反应24h后,加入200μl水饱和正丁醇溶液终止反应并萃取三次,合并正丁醇层,得到延龄草苷的催化产物。采用薄层色谱法(tlc)用硅胶板gf254,分别吸取5μl延龄草苷和薯蓣皂苷元的标准品以及5μl延龄草苷的催化产物,以石油醚/乙酸乙酯(体积比2:1)为展开剂,通过10%硫酸乙醇显色检测fbg1粗酶液1对延龄草苷的催化效率。bl21(de3)/pet30a(+)粗酶液作为对照进行同样的处理。结果表明,以延龄草苷为底物,利用fbg1可催化制备三薯蓣皂苷元。tlc图谱扫描的半定量结果显示,延龄草苷的转化率是25.7%。bl21(de3)/pet30a(+)发酵所得粗酶液对延龄草苷的催化产物中没有检测到薯蓣皂苷元的生成。
取2ml实施例1中的fbg1粗酶液2,加入延龄草苷(底物),使底物的终浓度均为2.5mg/ml(2ml反应体系),50℃反应24h,即得延龄草苷的催化产物。取100μl催化产物,加入900μl甲醇,震荡5min后12,000rpm离心5min,取上清进行hplc分析,主要色谱条件如下:agilent1100,配有elsd检测器和chemstation色谱工作站;xdb-c18色谱柱(250×4.6mm,5μm);用90%乙腈-水溶液(由乙腈和水按照9:1的体积比混合得到的液体)进行洗脱,流速1ml/min;柱温30℃;进样量10μl。hplc分析中,分别以延龄草苷和薯蓣皂苷元为标准品根据标准品的保留时间定性和采用标准曲线法(外标法)进行定量分析延龄草苷和薯蓣皂苷元。实验重复三次。
结果表明,工程菌x33/ppiczαa-fbg1发酵所得粗酶液对延龄草苷的催化产物中含有目标产物薯蓣皂苷元(图8)。当底物延龄草苷的浓度为2.5mg/ml时,在2mlfbg1粗酶液的反应体积下,工程菌x33/ppiczαa-fbg1的反应产物中薯蓣皂苷元的产量是1.7mg/ml,单位体积(1ml)fbg1粗酶液中的重组fbg1能将1mg延龄草苷转化为680μg薯蓣皂苷元,重组fbg1将延龄草苷转化为薯蓣皂苷元的转化率为95%。x33/ppiczαa和巴氏毕赤酵母(pichiapastoris)x33发酵所得粗酶液的催化产物中均没有检测到薯蓣皂苷元的生成。
上述结果说明fbg1能水解延龄草苷的β-d葡萄糖侧链,生成薯蓣皂苷元,是糖基水解酶。
实施例3、利用frg1和fbg1一锅法催化制备薯蓣皂苷元
分别取400μl实施例1中的frg1粗酶液1和400μl实施例1中的fbg1粗酶液1混合,加入底物盾叶新苷,使其浓度为0.2mg/ml(1ml反应体系),50℃反应24h后,加入200μl水饱和正丁醇溶液终止反应并萃取三次,合并正丁醇层,得到盾叶新苷的催化产物。采用薄层色谱法(tlc)用硅胶板gf254,分别吸取5μl薯蓣次苷a、延龄草苷和薯蓣皂苷元的标准品以及5μl盾叶新苷的催化产物,分别以氯仿/甲醇/水(体积比为70:26:6,检测皂苷的生成)和石油醚/乙酸乙酯(体积比2:1,检测薯蓣皂苷元的生成)为展开剂,通过10%硫酸乙醇显色检测催化产物中是否有薯蓣皂苷元的生成。bl21(de3)/pet30a(+)粗酶液作为对照进行同样的处理。如图9所示,结果表明,以盾叶新苷为底物,利用frg1和fbg1一锅法反应可催化制备薯蓣皂苷元。同时,催化产物中也检测到了三角叶皂苷、薯蓣次苷a和延龄草苷的生成。tlc图谱扫描的半定量结果显示,盾叶新苷的转化率是4.1%。bl21(de3)/pet30a(+)发酵所得粗酶液对盾叶新苷的催化产物中没有检测到三角叶皂苷、薯蓣次苷a、延龄草苷和薯蓣皂苷元的生成。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
<110>中国医学科学院医药生物技术研究所
<120>利用生物酶制备薯蓣皂苷元的方法及其所用生物材料
<130>gncfh181849
<160>4
<170>patentinversion3.5
<210>1
<211>1866
<212>dna
<213>镰孢属菌种(fusariumsp.)
<400>1
atgacaccctcacacgctgtgatacaattcctctttgcgtctctggctgttggccagcag60
atctatcttgatgcaaagggtcctactgagcgtcctcaatgtaaggctacaaagacacat120
gagccgaaatatacacatacaccattcagttataccctctctgagactgtgagatacgct180
acttcggtgccatctcccactacaacaactacatatgcaaatccaccagagtcactcatc240
tctctcgtcccttcactctccttcacaacctggggaaagtgggatccaaatgccaccaca300
aaggcctcagatacagatgatccttatggacgggccgcatggactgctctttgggaacat360
gcaaacccgcccaacttcactgaaacgggaatcttcagcacaactgtatctcccactccc420
attcccagcagtgaactagtccttccgccacgagactactttggtccttcggattgctac480
aattttcctaagaacttcagcttcggagtagctagctctgcgagtcaaatcgagggcgcg540
actgcggaagagggcaaggcgccgtctctcatggatattctcgttcaagatggtcgtgtg600
aaggattatgttacaaatgagcactattactactacaagcaagatattgagcgcgttgct660
gctatgggcgctaagcatttctcgttcagtatcgcgtggacgagaatcttgccgtttgct720
ctacctggaacacctgtgaatcaggagggtattgatcattataacgatgtgatcaatttc780
atcctcgagaagggcatgactcctgaggtcacgcttcttcattttgatacacctcttcag840
ttctttggcagcaatctcaccaaggctgctgatcgacctgagatcggctacgtcaacggc900
ggttatcagaatgagactttccaagatgctttcgttcactatgcaaaggttgctatggcg960
cactacgctgatcgcgtccccgtttggttcaccttcaatgagcctcttctgtattcatac1020
aatgctctttcgatcaacaatgtggttaaggctcatgcgcgagtttatcactggtataag1080
gaggagcttggtgggaagggcaagattgctctcaagttcaacaacaactttggtgtacct1140
cgtgatcctaagagtgaagccgatgtctacgctgcggatcacttcaactctattcagctg1200
ggaccgttctgcaacccgatttaccttggcgaggattaccctgagtcgttcaagcagact1260
tttgacgattatgtcccgctgagtgaggatgatctcaagtacatcggcggtacagcggat1320
ttcctgggtattgatccatataccgccacagttattgcaccaccagtcccagacgacaaa1380
gacagtatcctcgaatgcgcctcaaactcctcctccaccttccgtccctactgtgtcaac1440
caaaccaccacaaccgtaaacgggtggaacatcggctaccgctcccaaagctacgtctac1500
ataaccccaacctatctccgcagctacctcaactacctgcacaacacatggaagactccc1560
gtagctctcacagaattcggtttccccgtttatgccgaagctgaaaaagatctatctgat1620
cagctttttgatacgccaagaagtatttactacttgagtttcttgtctgagacgcttaag1680
gcgatttgggaagatggtgttgaggttgtgggagcgtatgcgtggagctttgcggataat1740
tgggagtttggggattatgatcagcattttggaatacagactgttaataggacgacgcag1800
gagaggaggtataagaagagtttctttgatatggtggattttatgaaggcgcgtggtgtg1860
gagtaa1866
<210>2
<211>621
<212>prt
<213>镰孢属菌种(fusariumsp.)
<400>2
metthrproserhisalavalileglnpheleuphealaserleuala
151015
valglyglnglniletyrleuaspalalysglyprothrgluargpro
202530
glncyslysalathrlysthrhisgluprolystyrthrhisthrpro
354045
phesertyrthrleusergluthrvalargtyralathrservalpro
505560
serprothrthrthrthrthrtyralaasnproprogluserleuile
65707580
serleuvalproserleuserphethrthrtrpglylystrpasppro
859095
asnalathrthrlysalaseraspthraspaspprotyrglyargala
100105110
alatrpthralaleutrpgluhisalaasnproproasnphethrglu
115120125
thrglyilepheserthrthrvalserprothrproileproserser
130135140
gluleuvalleuproproargasptyrpheglyproseraspcystyr
145150155160
asnpheprolysasnpheserpheglyvalalaserseralasergln
165170175
ilegluglyalathralaglugluglylysalaproserleumetasp
180185190
ileleuvalglnaspglyargvallysasptyrvalthrasngluhis
195200205
tyrtyrtyrtyrlysglnaspilegluargvalalaalametglyala
210215220
lyshispheserpheserilealatrpthrargileleupropheala
225230235240
leuproglythrprovalasnglngluglyileasphistyrasnasp
245250255
valileasnpheileleuglulysglymetthrprogluvalthrleu
260265270
leuhispheaspthrproleuglnphepheglyserasnleuthrlys
275280285
alaalaaspargprogluileglytyrvalasnglyglytyrglnasn
290295300
gluthrpheglnaspalaphevalhistyralalysvalalametala
305310315320
histyralaaspargvalprovaltrpphethrpheasngluproleu
325330335
leutyrsertyrasnalaleuserileasnasnvalvallysalahis
340345350
alaargvaltyrhistrptyrlysglugluleuglyglylysglylys
355360365
ilealaleulyspheasnasnasnpheglyvalproargaspprolys
370375380
serglualaaspvaltyralaalaasphispheasnserileglnleu
385390395400
glyprophecysasnproiletyrleuglygluasptyrprogluser
405410415
phelysglnthrpheaspasptyrvalproleusergluaspaspleu
420425430
lystyrileglyglythralaasppheleuglyileaspprotyrthr
435440445
alathrvalilealaproprovalproaspasplysaspserileleu
450455460
glucysalaserasnserserserthrpheargprotyrcysvalasn
465470475480
glnthrthrthrthrvalasnglytrpasnileglytyrargsergln
485490495
sertyrvaltyrilethrprothrtyrleuargsertyrleuasntyr
500505510
leuhisasnthrtrplysthrprovalalaleuthrglupheglyphe
515520525
provaltyralaglualaglulysaspleuseraspglnleupheasp
530535540
thrproargseriletyrtyrleuserpheleusergluthrleulys
545550555560
alailetrpgluaspglyvalgluvalvalglyalatyralatrpser
565570575
phealaaspasntrpglupheglyasptyraspglnhispheglyile
580585590
glnthrvalasnargthrthrglngluargargtyrlyslysserphe
595600605
pheaspmetvalaspphemetlysalaargglyvalglu
610615620
<210>3
<211>2013
<212>dna
<213>镰孢属菌种(fusariumsp.)
<400>3
atgaagttccgcaagctttcggcagctttactcgtttatttgctccagggtcctcaattg60
gtagctgcggctctcaatgcgaccgagaccgatacacagctggtgatttcaaacgaccga120
ctatatgcggctgttcagaagaagggcggcgccatcgtaaagctcacccttgacggaacg180
aaccttctcggtagcccatctggttctacaggcattggaccttaccttgattgctactgc240
acgcccaagggattttggacgcctggctctgtgactcccaagtacaaattgttcaagggt300
aaagatgccaagggtaaggactatggcggtatcgtcatgtccgacacgtacaccgagaca360
ggtcaggttctggagcaatactggttcttgagagatggagaaactggcctccataccttc420
agtcgagtcgcgtaccataatgaggagcagcccttccttcgtaacctccaggagcttcga480
accctcttccgaccgaacaacgacatttggactcatctcctgaccaacaggaagcagtat540
gcgcctctcccgggcaaggaggcgaaagagaagcaggtcgtggtgcaagatgctacatgg600
taccttggaaacacacccaatgatccctatgttaagcaggaagcggattactttaccaag660
tatacgttccaagacagttggcgcgacattgatgcttacggactgttcgctgatggttcc720
aagaccgaagatggagatgcttatggtgcttggcttgtcatgaacaccaaagacacctac780
tttggtggacctctgcattccgatctggttgtggatggtattttgtacaactatatcagc840
tctaaccaccatggagaccaaacacctaatattaccaatggattcgaccgaacatttgga900
cctcaatacttccacttcaaccgcttccctggagagaccgacatcctgaaagcccagacc960
gatgcagctcaatacgctgatcccgaatggaatgccgacttctacgattcgattgcaaag1020
cacgtccctaactacataccaacgaaatcccgaggatccttcgaggtgaaggtcgatctt1080
cctaagggggcaaagaatgccattgctgttctcgcacagagcggcgtggacttccaagac1140
aatgacttcgacaccaaggcctaccagtactgggctaacctcgatgagagcggccgagct1200
actattcctcgagtcaagtccagaacatatcgtcttaccgtctatgccgataacatcttt1260
ggacaatacacccaggacaaggtcaaaatcaaggctggcaagactgagaacaagaatgat1320
cactggaaggaagagtccgcaggtaaggaactctggcgaattggtactcccgacaagacc1380
tctggcgaataccgccatggtttcgagcccgatacatccaagccactgcagccggaacag1440
tatcgtatctactgggccaactgggactttgtcaaggacttccctgacggtgtcaacttc1500
aaggttggcgagagcgatgtcggcagggatctcaactacgtccactggagtgtttttggc1560
ggaaagggtaactcagtacgcccagagcagtatgttggtgacggcaatgtcaacaactgg1620
actattgccttcgatcttaaggagtcacaggtcaagcgcaagaagcacgcgactttcaca1680
gttcaacttgcgggtgcgaagactgctgctggaaacacggatatctacaatgcttctgag1740
cctcactcgaacctgaagtataccgtgaacatcaatggcaaggatcttgagccttgggtt1800
attccttacgatcacagcagttcctgtgctgttcgctcctcagtgagctgctacaatatc1860
gctcacaagttcgagttcgatgccaagttgttgaagaagggcgagaatgagatcatcttg1920
agcttgccttataacgctacgaactatgagtctgctgtgctgccaacatcggtgtatgtc1980
cagtatgatgcactcaggttggagatcgagtag2013
<210>4
<211>670
<212>prt
<213>镰孢属菌种(fusariumsp.)
<400>4
metlysphearglysleuseralaalaleuleuvaltyrleuleugln
151015
glyproglnleuvalalaalaalaleuasnalathrgluthraspthr
202530
glnleuvalileserasnaspargleutyralaalavalglnlyslys
354045
glyglyalailevallysleuthrleuaspglythrasnleuleugly
505560
serproserglyserthrglyileglyprotyrleuaspcystyrcys
65707580
thrprolysglyphetrpthrproglyservalthrprolystyrlys
859095
leuphelysglylysaspalalysglylysasptyrglyglyileval
100105110
metseraspthrtyrthrgluthrglyglnvalleugluglntyrtrp
115120125
pheleuargaspglygluthrglyleuhisthrpheserargvalala
130135140
tyrhisasnglugluglnpropheleuargasnleuglngluleuarg
145150155160
thrleupheargproasnasnaspiletrpthrhisleuleuthrasn
165170175
arglysglntyralaproleuproglylysglualalysglulysgln
180185190
valvalvalglnaspalathrtrptyrleuglyasnthrproasnasp
195200205
protyrvallysglnglualaasptyrphethrlystyrthrphegln
210215220
aspsertrpargaspileaspalatyrglyleuphealaaspglyser
225230235240
lysthrgluaspglyaspalatyrglyalatrpleuvalmetasnthr
245250255
lysaspthrtyrpheglyglyproleuhisseraspleuvalvalasp
260265270
glyileleutyrasntyrileserserasnhishisglyaspglnthr
275280285
proasnilethrasnglypheaspargthrpheglyproglntyrphe
290295300
hispheasnargpheproglygluthraspileleulysalaglnthr
305310315320
aspalaalaglntyralaaspproglutrpasnalaaspphetyrasp
325330335
serilealalyshisvalproasntyrileprothrlysserarggly
340345350
serphegluvallysvalaspleuprolysglyalalysasnalaile
355360365
alavalleualaglnserglyvalasppheglnaspasnasppheasp
370375380
thrlysalatyrglntyrtrpalaasnleuaspgluserglyargala
385390395400
thrileproargvallysserargthrtyrargleuthrvaltyrala
405410415
aspasnilepheglyglntyrthrglnasplysvallysilelysala
420425430
glylysthrgluasnlysasnasphistrplysglugluseralagly
435440445
lysgluleutrpargileglythrproasplysthrserglyglutyr
450455460
arghisglyphegluproaspthrserlysproleuglnproglugln
465470475480
tyrargiletyrtrpalaasntrpaspphevallysasppheproasp
485490495
glyvalasnphelysvalglygluseraspvalglyargaspleuasn
500505510
tyrvalhistrpservalpheglyglylysglyasnservalargpro
515520525
gluglntyrvalglyaspglyasnvalasnasntrpthrilealaphe
530535540
aspleulysgluserglnvallysarglyslyshisalathrphethr
545550555560
valglnleualaglyalalysthralaalaglyasnthraspiletyr
565570575
asnalasergluprohisserasnleulystyrthrvalasnileasn
580585590
glylysaspleugluprotrpvalileprotyrasphisserserser
595600605
cysalavalargserservalsercystyrasnilealahislysphe
610615620
glupheaspalalysleuleulyslysglygluasngluileileleu
625630635640
serleuprotyrasnalathrasntyrgluseralavalleuprothr
645650655
servaltyrvalglntyraspalaleuargleugluileglu
660665670
- 还没有人留言评论。精彩留言会获得点赞!