一种以4-(4-甲基哌啶)-3-缩氨基硫脲为配体的金配合物及其合成方法和应用与流程
本发明涉及金属配合物的合成,具体是一种以4-(4-甲基哌啶)-3-缩氨基硫脲为配体的金配合物及其合成方法和应用。
背景技术:
金属配合物的抗肿瘤生物活性研究起始于20世纪60年代,起初源于铂配合物的良好抗肿瘤活性,这一研究发现引起人们对金属配合物抗肿瘤研究的重视。近年来,人们大量地合成有机金属配合物,其中就有研究发现金配合物具有很好的抗肿瘤活性,而且相对于铂配合物,其毒性相对较低。金配合物能够促进线粒体活性氧显著释放,进而调控肿瘤相关凋亡因子及蛋白的表达。
α-n-缩氨基硫脲作为抗肿瘤化合物的研究已有半个多世纪,其研究领域主要是围绕着缩氨基硫脲-金属配合物进行。4-(4-甲基哌啶)-3-氨基硫脲作为一种新型杂环氨基硫脲,目前尚未发现关于4-(4-甲基哌啶)-3-氨基硫脲与“金”及其他金属配合物的抗肿瘤研究报导,本研究合成了系列全新的4-(4-甲基哌啶)-3-缩氨基硫脲配体及其金配合物,并对其抗肿瘤活性进行了研究。
技术实现要素:
本发明的目的在于克服现有技术的不足,而提供一种以4-(4-甲基哌啶)-3-缩氨基硫脲为配体的金配合物及其合成方法和应用,这些金配合物具有比顺铂更好的体外抗肿瘤活性,能抑制肿瘤细胞迁移和繁殖,具有高活性低毒性的特点。
实现本发明目的的技术方案是:
一种以4-(4-甲基哌啶)-3-缩氨基硫脲为配体的金配合物,所述金配合物的结构式如下c1-c6所示:
上述式c1-c6所示金配合物的合成路线为:
上述式c1-c6所示的金配合物的合成方法,包括如下步骤:
1)将醛类衍生物溶于甲醇,溶解后,加入4-(4-甲基哌啶)-3-氨基硫脲混合均匀,得到混合溶液,将混合溶液回流、过滤,滤饼用甲醇洗涤2-3次,得化合物;
2)将步骤1)得到的化合物溶于甲醇后,再加入na[aucl4].2h2o,室温下搅拌12h,过滤,得黄绿色固体,将固体用正己烷洗涤2-3次,真空干燥,再用二氯甲烷和正己烷混合液重新结晶得黑色晶体,即为目标配合物。
所述的醛类衍生物,为2-羟基-1-奈甲醛、水杨醛、5-氯水杨醛、6-乙氧基水杨醛、3-甲氧基水杨醛和3-甲氧基-5-烯丙基-水杨醛中的一种。
步骤1)中,所述的醛类衍生物与4-(4-甲基哌啶)-3-氨基硫脲的物质的量之比为1:1;醛类衍生物与甲醇的物质之比为3:5000。
步骤1)中,所述的回流,回流温度为65℃,回流时间为4h。
步骤2)中,所述的化合物与na[aucl4].2h2o的物质的量之比为1:1;化合物与甲醇的物质的量之比为1:2500。
本发明进一步包括以金配合物c1-c6为活性成分制备的抗肿瘤药物。
有益效果:本发明提供的一种以4-(4-甲基哌啶)-3-缩氨基硫脲为配体的金配合物及其合成方法和应用,与现有技术相比,该配合物结构新颖,三齿配位增强了金配合物的稳定性,对肿瘤细胞抑制效果明显,细胞毒性较低。
附图说明
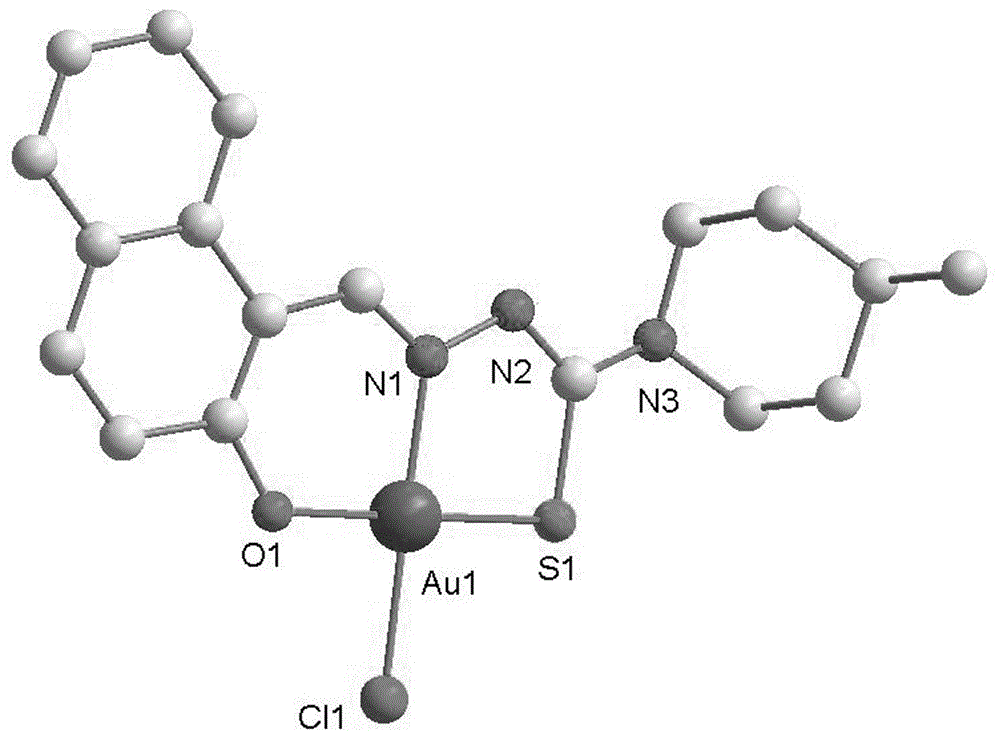
图1为实施例1合成的c1配合物的单晶结构图;
图2为实施例2合成的c2配合物的单晶结构图;
图3为实施例3合成的c3配合物的单晶结构图;
图4为实施例4合成的c4配合物的单晶结构图;
图5为实施例5合成的c5配合物的单晶结构图;
图6为实施例6合成的c6配合物的单晶结构图.
具体实施方式
下面结合附图和实施例对本发明做进一步阐述,但不是对本发明的限定。
实施例1:
c1配合物的合成方法为:
1)将3mmol(516mg)2-羟基-1-奈甲醛溶于20ml甲醇,溶解后,加入3mmol(519mg)4-(4-甲基哌啶)-3-氨基硫脲混合均匀,得到混合溶液,将混合溶液65℃回流4h、过滤,滤饼用甲醇洗涤2-3次,得化合物1,
yield:0.71g,72.5%,lightyellowsolid;rf=0.424(petroleumether:etoac=2:1).m.p.113-115℃.1hnmr(400mhz,dmso-d6)δ12.88(s,1h),11.42(s,1h),9.40(s,1h),8.08(d,j=8.5hz,1h),7.90-7.88(m,2h),7.61-7.57(m,1h),7.41-7.37(m,1h),7.21-7.19(m,1h),4.74(d,j=13.1hz,2h),3.18-3.11(m,2h),1.74-1.72(m,3h),1.26-1.08(m,2h),0.94(d,j=6.1hz,3h).13cnmr(100mhz,dmso-d6)δ178.05,156.97,143.68,131.84,131.50,128.88,127.64,127.40,123.27,120.13,119.13,108.59,48.60,33.56,30.22,21.34.esi+m/z:calcdforc18h20n3os,326[m-h]-。
2)将步骤1)得到的0.1mmol(32.7mg)化合物1溶于10ml甲醛后,再加入0.1mmol(39.7mg)na[aucl4].2h2o,室温下搅拌12h,过滤,得黄绿色固体,将固体用正己烷洗涤2-3次,真空干燥,再用二氯甲烷和正己烷混合液重新结晶得黑色晶体,即为目标配合物c1,其单晶结构如图1所示。
yield:0.04g,71.5%,ir,cm-1:ir,cm-1:3434(s,amide),2926(m,aromatichydrogen),1616(s),1524(s,-c=c-),1384(s),1262(s,thioamide),1186(s),823(s),743(s,ph-h).esi+m/z:calcdforc18h20aucln3os,558[m+h]+。
实施例2:
c2配合物的合成方法为:
1)将3mmol(366mg)水杨醛溶于20ml甲醇,溶解后,加入3mmol(519mg)4-(4-甲基哌啶)-3-氨基硫脲混合均匀,得到混合溶液,将混合溶液65℃回流4h、过滤,滤饼用甲醇洗涤2-3次,得化合物2,
yield:0.76g,91.4%,lightyellowsolid;rf=0.324(petroleumether:etoac=2:1).m.p.130-132℃.1hnmr(400mhz,dmso-d6)δ11.61(s,1h),11.36(s,1h),8.45(s,1h),7.38(dd,j=7.9,1.7hz,1h),7.28-7.24(m,1h),6.91-6.87(m,2h),4.69(d,j=13.2hz,2h),3.13-3.06(m,2h),1.74-1.66(m,3h),1.17-1.07(m,2h),0.92(d,j=6.1hz,3h).13cnmr(100mhz,dmso-d6)δ178.60,157.00,145.82,130.63,129.85,118.95,118.50,116.44,48.80,33.57,30.19,21.33.esi+m/z:calcdforc14h18n3os,276[m-h]-。
2)将步骤1)得到的0.1mmol(27.7mg)化合物2溶于10ml甲醛后,再加入0.1mmol(39.7mg)na[aucl4].2h2o,室温下搅拌12h,过滤,得黄绿色固体,将固体用正己烷洗涤2-3次,真空干燥,再用二氯甲烷和正己烷混合液重新结晶得黑色晶体,即为目标配合物c2,其单晶结构如图2所示。
yield:0.035g,68.7%,ir,cm-1:ir,cm-1:3435(s,amide),2927(m,aromatichydrogen),1627(s),1596(s),1525(s,-c=c-),1384(s),1265(s,thioamide),1061(s),847(s),749(s,ph-h),.esi+m/z:calcdforc14h18aucln3os,508[m+h]+。
实施例3:
c3配合物的合成方法为:
1)将3mmol(465mg)5-氯水杨醛溶于20ml甲醇,溶解后,加入3mmol(519mg)4-(4-甲基哌啶)-3-氨基硫脲混合均匀,得到混合溶液,将混合溶液65℃回流4h、过滤,滤饼用甲醇洗涤2-3次,得化合物3,
yield:0.85g,91.1%,lightyellowsolid;rf=0.356(petroleumether:etoac=2:1).m.p.120-122℃.1hnmr(400mhz,dmso-d6)δ11.70(s,1h),11.50(s,1h),8.40(s,1h),7.52(d,j=2.7hz,1h),7.27(dd,j=8.8,2.7hz,1h),6.91(d,j=8.8hz,1h),4.69(d,j=13.1hz,2h),3.22-2.93(m,2h),1.69(d,j=10.2hz,3h),1.16-1.07(m,2h),0.92(d,j=6.1hz,3h).13cnmr(100mhz,dmso-d6)δ178.70,155.67,143.83,130.03,128.47,122.47,120.19,118.27,48.94,33.58,30.17,21.31.esi+m/z:calcdforc14h17n3os,310[m-h]-。
2)将步骤1)得到的0.1mmol(31.1mg)化合物3溶于10ml甲醛后,再加入0.1mmol(39.7mg)na[aucl4].2h2o,室温下搅拌12h,过滤,得黄绿色固体,将固体用正己烷洗涤2-3次,真空干燥,再用二氯甲烷和正己烷混合液重新结晶得黑色晶体,即为目标配合物c3,其单晶结构如图3所示。
yield:0.038g,70.1%,ir,cm-1:ir,cm-1:3435(s,amide),2948(m,aromatichydrogen),1627(s),1596(s),1525(s,-c=c-),1450(s,-c=c-),1266(s,thioamide),1176(s),982(s),827(s),732(s,ph-h).esi+m/z:calcdforc14h17aucl2n3o2s,542[m+h]+。
实施例4:
c4配合物的合成方法为:
1)将3mmol(498mg)6-乙氧基水杨醛溶于20ml甲醇,溶解后,加入3mmol(519mg)4-(4-甲基哌啶)-3-氨基硫脲混合均匀,得到混合溶液,将混合溶液65℃回流4h、过滤,滤饼用甲醇洗涤2-3次,得化合物4,
yield:0.74g,76.8%,lightyellowsolid;rf=0.302(petroleumether:etoac=2:1).m.p.145-147℃.1hnmr(400mhz,dmso-d6)δ11.55(s,1h),11.35(s,1h),8.44(s,1h),6.98(s,1h),6.96(s,1h),6.83-6.79(m,1h),4.69(d,j=13.1hz,2h),4.03(q,j=7.0hz,2h),3.13-3.06(m,2h),1.73-1.66(m,3h),1.34(t,j=7.0hz,3h),1.18-1.07(m,2h),0.92(d,j=6.1hz,3h).13cnmr(100mhz,dmso-d6)δ178.59,147.18,147.07,145.91,121.63,118.66,118.56,114.95,64.00,48.81,33.57,30.19,21.33,14.77.esi+m/z:calcdforc16h22n3o2s,320[m-h]-。
2)将步骤1)得到的0.1mmol(30.7mg)化合物4溶于10ml甲醛后,再加入0.1mmol(39.7mg)na[aucl4].2h2o,室温下搅拌12h,过滤,得黄绿色固体,将固体用正己烷洗涤2-3次,真空干燥,再用二氯甲烷和正己烷混合液重新结晶得黑色晶体,即为目标配合物c4,其单晶结构如图4所示。
yield:0.03g,55.6%,ir,cm-1:ir,cm-1:3435(s,amide),2934(m,aromatichydrogen),1638(s),1593(s),1529(s,-c=c-),1438(s,-c=c-),1263(s,thioamide),1246(s,ethoxy),968(s),726(s,ph-h).esi+m/z:calcdforc16h22aucln3o2s,552[m+h]+。
实施例5:
c5配合物的合成方法为:
1)将3mmol(465mg)3-甲氧基水杨醛溶于20ml甲醇,溶解后,加入3mmol(519mg)4-(4-甲基哌啶)-3-氨基硫脲混合均匀,得到混合溶液,将混合溶液65℃回流4h、过滤,滤饼用甲醇洗涤2-3次,得化合物5,
yield:0.69g,74.9%,lightyellowsolid;rf=0.302(petroleumether:etoac=2:1).m.p.117-119℃.1hnmr(400mhz,dmso-d6)δ11.52(s,1h),11.21(s,1h),8.44(s,1h),7.00-6.97(m,2h),6.84-6.80(m,1h),4.69(d,j=11.9hz,2h),3.79(s,3h),3.17-3.05(m,2h),1.71-1.67(m,3h),1.17-1.07(m,2h),0.92(d,j=6.1hz,3h).13cnmr(100mhz,dmso-d6)δ178.67,147.97,146.92,145.71,121.43,118.62,118.56,113.55,55.80,48.85,33.60,30.22,21.35.esi+m/z:calcdforc15h20n3o2s,306[m-h]-。
2)将步骤1)得到的0.1mmol(32.1mg)化合物5溶于10ml甲醛后,再加入0.1mmol(39.7mg)na[aucl4].2h2o,室温下搅拌12h,过滤,得黄绿色固体,将固体用正己烷洗涤2-3次,真空干燥,再用二氯甲烷和正己烷混合液重新结晶得黑色晶体,即为目标配合物c5,其单晶结构如图5所示。
yield:0.033g,59.6%,ir,cm-1:ir,cm-1:3453(s,amide),2930(m,aromatichydrogen),1638(s),1592(s),1517(s,-c=c-),1439(s,-c=c-),1264(s,thioamide),1246(s,methoxy),971(s),729(s,ph-h).esi+m/z:calcdforc15h20aucln3o2s,538[m+h]+。
实施例6:
c6配合物的合成方法为:
1)将3mmol(576mg)3-甲氧基水杨醛溶于20ml甲醇,溶解后,加入3mmol(519mg)4-(4-甲基哌啶)-3-氨基硫脲混合均匀,得到混合溶液,将混合溶液65℃回流4h、过滤,滤饼用甲醇洗涤2-3次,得化合物6,
yield:0.73g,70.1%,lightyellowsolid;rf=0.322(petroleumether:etoac=2:1).m.p.121-122℃.1hnmr(400mhz,dmso-d6)δ11.31(s,1h),11.23(s,1h),8.39(s,1h),6.87-6.76(m,2h),5.96(d,j=40.4hz,1h),5.02(s,2h),4.68(d,j=15.8hz,2h),3.78(s,3h),3.30(d,j=6.7hz,2h),3.09(td,j=12.9,2.3hz,2h),1.70(d,j=17.8hz,3h),1.13(d,j=41.3hz,2h),0.93(d,j=6.1hz,3h).13cnmr(100mhz,dmso-d6)δ178.70,147.85,145.41,145.12,137.79,129.92,120.51,118.39,115.61,113.94,55.80,48.97,33.63,30.23,21.37.esi+m/z:calcdforc18h24n3o2s,346[m-h]-。
2)将步骤1)得到的0.1mmol(34.7mg)化合物6溶于10ml甲醛后,再加入0.1mmol(39.7mg)na[aucl4].2h2o,室温下搅拌12h,过滤,得黄绿色固体,将固体用正己烷洗涤2-3次,真空干燥,再用二氯甲烷和正己烷混合液重新结晶得黑色晶体,即为目标配合物c6,其单晶结构如图6所示。
yield:0.031g,55.6%,ir,cm-1:ir,cm-1:3468(s,amide),2925(m,aromatichydrogen),1639(s),1592(s),1521(s,-c=c-),1443(s,-c=c-),1264(s,thioamide),1248(m,methoxy),999(s),717(m,ph-h),652(m,ph-h).esi+m/z:calcdforc18h24aucln3o2s,578[m+h]+。
体外活性测试
对人宫颈癌细胞(hela)、人膀胱癌细胞(t24)、人非小肺癌细胞(a549)、人胃癌细胞(mgc-803)、人正常肝细胞(hl-7702)进行了增殖抑制活性实验:
1、细胞株与细胞培养
本实验选用人宫颈癌细胞、人膀胱癌细胞、人非小肺癌细胞、人胃癌细胞、人肝癌细胞、人正常肝细胞等人类细胞株。
所有细胞株均培养在含10%小牛血清、100u/ml链霉素的rpmi-1640/dmem培养液内,置37℃含体积浓度5%co2孵箱中培养。
2、待测化合物的配制所用的受试药物的纯度≥95%,将其dmso储液用生理缓冲液稀释后配置成5mmol/l的终溶液,其中助溶剂dmso的浓度≤1%,测试该浓度下化合物对各种肿瘤细胞生长得抑制程度。
3、细胞生长抑制实验(mtt法)
(1)取对数生长期的肿瘤细胞,经胰蛋白酶消化后,用含10%小牛血清的培养液配置成浓度为5000个/ml的细胞悬液,以没孔180μl接种于96孔培养板中,使待测细胞浓度至每孔1000~10000/孔(边缘孔用无菌pbs填充);
(2)5%co2,37℃孵育24h,至细胞单层铺满孔底,每孔加入一定浓度梯度的药物20μl,每个浓度梯度设3-5个复孔;
(3)5%co2,37℃孵育48h,至倒置显微镜下观察;
(4)每孔加入10μl的mtt溶液(5mg/mlpbs,即0.5%mtt),继续培养4h-6h;
(5)终止培养,小心吸去孔内培养液,每孔加入100-130μl的dmso充分溶解甲瓒沉淀,振荡器混匀后,在酶标仪用波长为570nm,参比波长为450nm测定各孔的光密度值;
(6)同时设置调零孔(培养基、mtt、dmso),对照孔(细胞、相同浓度的药物溶解介质、培养液、mtt、dmso)。
(7)根据测得的光密度值(od值),来判断活细胞数量,od值越大,细胞活性越强。利用公式:
肿瘤细胞生长抑制率(%)=[(1-实验组平均od值)/(对照组平均od值)]×%;
ic50测定:利用以上方法,每种化合物须设置浓度梯度,其中含多个(一般5~8个)浓度,每个浓度也须设置3~5个副孔,实验得到每个不同浓度的抑制率,然后在spss软件中计算化合物的ic50值。
表1各化合物对不同细胞株的ic50值(μm)
由表1中可以看出,氨基硫脲-金配合物对各株肿瘤细胞表现出较好的抑制活性,相比顺铂的ic50值要低。
- 还没有人留言评论。精彩留言会获得点赞!