嵌合抗原受体介导的细胞靶向的制作方法
相关申请的交叉引用
本申请要求2017年8月8日提交的美国临时申请号62/542,511;2017年11月3日提交的美国临时申请62/581,290;2018年1月3日提交的美国临时申请62/613,258和2018年4月4日提交的美国临时申请号62/652,672的权益,其公开内容通过引用其全文的方式纳入本文。
本公开内容属于人细胞(包括淋巴细胞和干细胞)的基因组修饰的领域。
背景技术:
基因治疗对于人类治疗学的新时代拥有巨大的潜能。这些方法将实现对于标准医疗实践尚未解决的病症的治疗。基因治疗可以包括基因编辑技术的许多变化形式,诸如基因座的破坏和修正,以及插入可表达的转基因,所述可表达的转基因可以通过融合于该转基因的特异性外源性启动子控制,或通过存在于插入基因组的位点处的内源性启动子控制,以及经由附加型载体系统表达转基因。
转基因的递送和插入是就该技术的任何实际实施而言必须解决的障碍的实例。例如,尽管许多基因递送方法对于治疗应用有潜在的可行性,但是它们全都涉及安全性、持久性和表达水平之间大量的权衡。以附加体(例如,基础腺病毒(ad)、腺相关病毒(aav)和基于质粒的系统)提供转基因的方法通常是安全的,并且可以实现高初始表达水平,然而,这些方法缺少稳健的附加型复制,而这可能会在有丝分裂活性组织中限制表达的持续时间。与之相反,导致所需转基因随机整合的递送方法(例如,整合慢病毒(lv))提供了更加持久的表达,但是由于随机插入的非靶向性,其可能会在受体细胞中引起不受调控的生长,可能经由随机整合的转基因盒附近致癌基因的活化导致恶性肿瘤。此外,尽管转基因整合避免了复制造成的损失,但是其并不能阻止与转基因融合的外源性启动子的最终沉默。随着时间推移,这样的沉默导致对于大部分非特异性插入事件的转基因表达减少。另外,转基因的整合极少发生在每个靶细胞中,从而可能难以使感兴趣的转基因以足够高水平表达来实现所需疗效。
近些年间,已经开发了针对转基因整合的新策略,其利用以位点特异性核酸酶(例如,锌指核酸酶(zfn)、转录激活因子样效应物结构域核酸酶(talen)、具有工程改造的crrna/tracrrna(“单向导rna”)的crisp/cas系统的切割来引导特异性切割等)来偏好(bias)插入所选基因组基因座。参见例如,美国专利号9,937,207;9,873,894;9,567,573;9,394,545;9,255,250;9,045,763;9,005,973;8,956,828;8,945,868;8,703,489;8,586,526;6,534,261;6,599,692;6,503,717;6,689,558;7,067,317;7,262,054;7,888,121;7,972,854;7,914,796;7,951,925;8,110,379;8,409,861;美国专利公开号2017/0211075;2003/0232410;2005/0208489;2005/0026157;2005/0064474;2006/0063231;2008/0159996;2010/00218264;2012/0017290;2011/0265198;2013/0137104;2013/0122591;2013/0177983和2013/0177960和2015/0056705。此外,靶向的核酸酶基于阿尔古(argonaute)系统(例如,来自嗜热栖热菌(t.thermophilus),称作‘ttago’,参见swarts等(2014)nature507(7491):258-261)开发,其也可具有用于基因组编辑和基因治疗的潜力。与经典的整合途径相比,该核酸酶介导的转基因整合途径提供了改善的转基因表达、增加的安全性和表达持久性的前景,因为其允许准确的转基因定位,从而使基因沉默或附近致癌基因激活的风险最小化。
actr(抗体偶联的t细胞受体)是经工程改造的t细胞组分,其能够结合至外来供给的抗体。抗体与actr组分的结合使得t细胞具有与通过抗体识别的抗原相互作用的能力,并且当遇到该抗原时,包含actr的t细胞被触发以与抗原相互作用(参见,美国专利公开号20150139943)。
t细胞受体(tcr)是t细胞选择性活化的必要部分。其具有与抗体的一些相似之处,tcr的抗原识别部分通常由α和β两条链构成,两者聚集形成异二聚体。其与抗体的相似之处在于,编码tcrα和β复合物的单个基因凑在一起。tcr阿尔法(tcrα)和tcr贝塔(tcrβ)链各自包含c-末端恒定区和n-末端可变区两个区域。编码tcrα和β链的基因组基因座与编码抗体的基因座类似之处在于tcrα基因除了恒定区(常常称之为trac)以外还包含v和j区段,而β链基因座除了v和j区段以外还包括d区段。对于tcrβ基因座,另外还存在选择过程期间选择的两个不同的恒定区。在t细胞发育过程中,各种区段重组,从而每个t细胞在α和β链中都包含独特的tcr可变部分,称为互补决定区(cdr),并且身体具有t细胞的大型储库(largerepertoire),它们因具有独特的cdr而能够与抗原呈递细胞展示的独特抗原相互作用。一旦tcrα或β基因重排发生,第二相应tcrα或tcrβ的表达就会被抑制,从而各t细胞在一种被称为“抗原受体等位基因排斥”的过程中仅表达一种独特的tcr结构(参见,brady等,(2010)jimmunol185:3801-3808)。
t细胞活化期间,tcr与抗原呈递细胞的主要组织相容性复合物(mhc)上以肽形式展示的抗原相互作用。通过tcr进行的抗原-mhc复合物识别导致t细胞刺激,这进而导致记忆和效应淋巴细胞中的t辅助细胞(cd4+)和细胞毒性t淋巴细胞(cd8+)的分化。然后,这些细胞可以克隆的方式扩增,以在整个t细胞群中产生能够与一种特定抗原反应的活化亚群。人mhc也称之为hla(人白细胞抗原)复合物。mhc基因家族分成3个亚组:i型、ii型和iii型。i型mhc分子具有β2亚基,所以只能被cd8共受体识别。mhci分子以α链出现,由α1、α2和α3三个结构域组成。α1依赖于非mhc分子β2免疫球蛋白(在人染色体15上编码,缩写为b2m)上的单元。α3结构域是跨膜的,锚定mhci型分子至细胞膜。呈递的肽被肽结合槽的底部固定,位于α1/α2异二聚体(由两个不同的亚基组成的分子)的中央区域。肽结合凹槽底部的遗传编码和表达的氨基酸序列(残基序列)决定了其结合的特定肽残基。
天然杀伤(nk)细胞是作为先天免疫系统的部分的特化细胞。它们是体内发现的3种淋巴细胞之一:t细胞、b细胞和nk细胞。这些细胞在杀死体内肿瘤细胞以及细菌和病毒感染的细胞中起主要作用。参见例如,美国公开号20140301990。它们的细胞毒性能力主要通过两种主要途径介导。胞吐作用会分泌破坏膜性蛋白,穿孔素,和一系列结构相关丝氨酸蛋白酶,颗粒酶,它们共同地诱导靶细胞的凋亡。在第二种途径中,发生半胱天冬酶依赖性细胞凋亡,涉及靶细胞上死亡受体(例如,fas/cd95)与其等效配体诸如fasl以及nk细胞上肿瘤坏死因子相关凋亡诱导配体(trail)的缔合,导致半胱天冬酶依赖性细胞凋亡。抗体依赖性细胞毒性(adcc)也可能是nk细胞杀死肿瘤细胞的一种机制,因为它们表达针对igg的低亲和力fc受体,fcγriii(cd16)((mandal和viswanathan(2015)hemat/oncstemcellther8(2):47-55)。
nk细胞的功能受到在细胞表面表达的多种受体的控制。这些受体本质上是抑制性或激活性的。抑制性受体家族由杀伤免疫球蛋白样受体(kir)或ig样受体(cd158),c型凝集素受体(cd94-nkg2a)和白细胞抑制受体(lir1,lair-1)组成。激活受体是天然细胞毒性受体(nkp46,nkp44),c型凝集素受体(nkg2d,cd94-nkg2c)和ig样受体(2b4)。nk细胞的细胞毒性受到激活和抑制信号之间的平衡的严格控制,尽管抑制性信号转导可能是激活后的主要信号。抑制性nk细胞受体识别自身i型mhc分子,而这阻止了nk细胞活化,从而解释了自身耐受性并防止了宿主细胞的杀伤。还已经显示,当nk细胞遇到缺少自身mhci型分子(“hla-i”)的细胞时,这些nk细胞可以被激活。hla-i结合型抑制性受体(例如kir、nkg2a/cd94、ilt2和lir1)的表达导致nk细胞对正常细胞的耐受性。nk细胞通常攻击表现出表面hla-i分子下调的异常细胞(称之为“缺乏自我识别”)。然而,“缺乏自我”导致对许可的(licensed)nk细胞的敏感性,其裂解缺乏hla-i的细胞(crux和elahi(2017)frontimmunol8:832)。
hla-e和hla-g属于非经典i型hla重链旁系同源物,也称之为hla-ib型。这样的i型分子是异二聚体,其由重链和轻链组成,所述重链分别由hla-e或hla-g基因编码,所述轻链由β-2微球蛋白-b2m编码。人hla-e是非经典mhci型分子,其特征是与经典的旁系同源物相比,具有有限的多态性和较低的细胞表面表达。hla-e单倍型包括hla-e*0101(也称之为er或hla-e0101),其仅在一个氨基酸位置与hla-e*0103不同(也称之为eg或hla-e0103),即hla-e0101中107位的精氨酸被hla-e0103中的甘氨酸替代(celik等(2016)immunogenetics68(1):29-41)。截至2017年,国际immunogenetics项目/人类主要组织相容性复合体(imgt/hla)数据库(3.23.0版)正式认可了52种hla-g等位基因/单倍型。hla-g编码区中的大多数单核苷酸多态性(snp)是编码同义突变或内含子变体。在imgt/hla正式认可的52个等位基因中,只有13个等位基因编码4个不同的hla-g全长分子,并且经常在世界各地被观察到(prakash等(2017)anthropolopenj.2(1):1-9.doi:10.17140/ant-poj-2-106)。hla-g*01:01等位基因是最常见的hla-g等位基因之一(通常称之为野生型)(metcalfe等(2013)intj.circumpolarhealth72.doi:10.3402/ijch.vy2i0.21350)。
hla-e在自然杀伤细胞(nk细胞)的细胞识别中具有非常专门的作用。nk细胞使用异二聚抑制受体cd94/nkg2a/b/c识别hla-e+肽复合物。当cd94/nkg2a或cd94/nkg2b结合时,其对nk细胞的细胞毒性活性产生抑制作用以防止细胞裂解,然而,hla-e与cd94/nkg2c的结合导致nk细胞活化。已经显示这种相互作用触发抗病毒应答中的nk细胞亚群的扩增。人白细胞抗原-e是具有广泛组织分布的非经典hla-ib,但在所有mhc-i型分子中具有最少的多态性。其被微环境压力如肿瘤中的缺氧和葡萄糖缺乏上调,但以低于hla-1a分子的速率转录(crux和elahi,同上)。
hla-g通常在来源于胎儿的胎盘细胞膜上表达,并可能在妊娠的免疫耐受中发挥作用。hla-g基因与hla-a、-b和-c基因非常相似,但是由hla-g编码的蛋白质与其他3个基因的产物不同,其缺少大部分胞内区段。通过使用hla-g基因座特异性探针和引物进行northern印迹和rt-pcr分析,证明了该基因在多种细胞和成年组织以及胎儿组织中转录(onno等(1994)hum.immun.41:79-86,1994)。在大多数组织中,mrna水平比相同组织中的经典i型基因的水平低几个数量级。hla-g初级转录本的替代性剪接因组织而异,并且可以组织特异性方式受到调控。hla-g是nk细胞抑制受体kir2dl4的配体,因此,通过滋养层表达这样的hla理论上可以防御nk细胞介导的死亡。
过继细胞治疗(act)是一种发展中形式的癌症疗法,其基于将肿瘤特异性免疫细胞递送至患者,以使递送的细胞攻击并清除患者的癌症。act可涉及肿瘤浸润性淋巴细胞(til)的应用,所述til是分离自患者自身的肿瘤肿块并经离体扩增以再灌注回该患者的t细胞。该方法在治疗转移性黑素瘤中具有前景,其中在一个研究中,观测到>50%的长期响应率(参见例如,rosenberg等(2011)clincancres17(13):4550)。til是有前景的细胞来源,因为它们是患者自身针对呈递在肿瘤上的肿瘤相关抗原(tta)具有t细胞受体(tcr)特异性的细胞的混合集合(wu等(2012)cancerj18(2):160)。其它方法涉及编辑分离自患者血液的t细胞,从而使其被工程改造为以一定方式对肿瘤具有响应性(kalos等(2011)scitranslmed3(95):95ra73)。
嵌合抗原受体(car)是经工程改造的分子,其被设计成使免疫细胞靶向细胞表面上表达的特定分子靶标。它们最基本的形式是被引入细胞的受体,所述细胞将细胞外侧表达的特异性结构域与细胞内侧的信号转导途径偶联,从而在特异性结构域与其靶标相互作用时,细胞被活化。car常常通过模仿t细胞受体(tcr)的功能结构域制得,其中抗原特异性结构域(诸如单链抗体片段(scfv)或一些其他类型的受体(例如,细胞因子受体))与信号转导结构域(诸如基于免疫受体酪氨酸的活化基序(itam)和其它共刺激结构域)融合。这些构建体被引入离体t细胞,从而在将t细胞重新引入患者时,其在表达靶抗原的细胞存在的情况下被激活,导致通过激活t细胞以非mhc依赖性的方式攻击靶细胞(参见,chicaybam等(2011)intrevimmunol30:294-311)。可以采用转移基因到t细胞的各种模式,从导致基因组永久修饰的逆转录病毒和慢病毒载体方法到导致瞬时基因表达的基于rna的方法。逆转录病毒或慢病毒方法具有长期表达基因的优势,因此,由单次输注工程改造的t细胞(如果这些t细胞持续存在),具有长期控制疾病的潜力。永久修饰的缺点是持续的中靶毒性以及如果基因插入导致附近癌基因失调所致的转化的理论风险。使用信使rna进行的基因转移在不整合到基因组中的情况下产生瞬时表达,从而消除了来自随机整合的转化的任何担忧。通过经由电穿孔插入rna工程改造的t细胞具有显著的复制能力,并且可以产生实质性肿瘤应答。然而,表达通常持续7天或更短,因此,尽管仍然可以进行长期疾病控制,但仍需要使用该方法进行多次输注(maude等(2015)blood125(26):4017–4023)。
使用由经工程改造的tcr或car离体改变的t细胞进行的过继细胞治疗对于多种类型的疾病而言是有前景的临床方法。例如,被靶向的癌症及其抗原包括滤泡性淋巴瘤(cd20或gd2)、成神经细胞瘤(cd171)、非霍奇金淋巴瘤(cd19和cd20)、淋巴瘤(cd19)、成胶质细胞瘤(il13rα2)、慢性淋巴白血病或cll和急性淋巴白血病或all(均为cd19)。还开发了病毒特异性car以攻击具有病毒(如hiv)的细胞。例如,启动了使用对gp100具有特异性的car治疗hiv的临床试验(chicaybam,同上),并且正在进行多个试验,使用cd19特异性car(maude(2015)同上)用于治疗cll(参见kalos等(2011)scitranslmed.3(95):95ra73,和kochenderferjn和rosenbergsa.(2013)natrevclinoncol.10(5):267–276),以及治疗all(参见maude等(2014)nengljmed.
371(16):1507–1517和lee等(2015)lancet385(9967):517–528)。
虽然最近已经有了过继细胞疗法的成功,但是在广泛采用该技术之前,仍然需要克服一些重要的障碍。例如,输注的同种异体(供体衍生的)经工程改造的t细胞上的内源性αβt细胞受体(tcr)可以识别受者中的主要和次要组织相容性抗原,从而导致移植物抗宿主病(gvhd)。因此,大多数当前的临床试验都依赖于免疫耐受来输注自体同源car+t细胞(包含表达的car编码序列的t细胞),以防止过继转移后tcr介导的正常组织的有害识别。该方法已经实现了靶向cd19+恶性肿瘤的初始临床成功,但是受到制造患者特异性t细胞产物的时间和费用的限制(torikai等(2012)blood119:5697-5705)。在使用这些工程改造的t细胞治疗患者时出现的另一个问题是复发,其中已经发现患者最初清除了该肿瘤,仅在下调靶抗原的肿瘤细胞中复发,即所谓的“免疫逃逸”(sotillo等(2015)cancerdis5(12):1282-1295和gardner等(2016)blood;127(20):2406–2410)。
因此,尽管通过使用过继细胞疗法已显示出潜力,但仍需要可用于增加武装t细胞的效率和特异性的方法和组合物。具体地,需要安全引入和维持抗原特异性复合物(包括car和工程改造的tcr)表达的方法。此外,需要开发通用工程改造的t细胞的方法,所述t细胞缺少通过患者免疫系统识别的标志物(例如,hla复合物),可用于治疗大量患者而无需为待治疗的每个患者开发修饰的细胞。
技术实现要素:
本文公开了用于将嵌合抗原受体引入工程改造的t细胞的方法。公开的方法包括将编码一种或多种供体转基因(例如,car)的基因靶向引入细胞,包括将一种或多种car靶向整合到一种或多种tcr基因和/或b2m基因中(也称之为car+细胞)。本发明所得细胞因此包含对所选抗原具有特异性的一种或多种car(例如,cd20、cd171、cd19)和/或il13rα2),并且还缺少功能性内源性tcr和/或hla复合物。在一些实施方式中,在另一基因座(例如,检查点基因,诸如cish或pd1)处进一步修饰细胞,从而使所得细胞包含tcr,b2m和任何数量的其他基因(例如,cish)处的编辑,产生缺少天然tcr,hla复合物的细胞和其他基因(诸如cish检查点基因)中的敲除,并包含供体转基因(例如,car)这些细胞能够用于消除具有靶抗原的其他细胞。在优选实施方式中,制备工程改造的car+t细胞用于过继细胞治疗。在一些实施方式中,工程改造的car+t细胞表达经修饰的hla-e和/或hla-g复合物,允许其逃脱nk介导的杀伤。此外,本文提供了用于在不相关的细胞类型上表达抗原的方法和组合物,用于分析体外工程改造的t细胞的活性。
在一方面中,本文提供了遗传修饰的t细胞(和包含多个这些遗传修饰的t细胞的t细胞群),所述遗传修饰的t细胞包含:编码嵌合抗原受体(car)的第一多核苷酸和包含编码融合蛋白的序列的第二多核苷酸,所述融合蛋白包含β-2-微球蛋白(b2m)蛋白和hla-e和/或hla-g蛋白,其中第一和第二多核苷酸被整合到t细胞受体-α(tcra)基因中。在某些实施方式中,细胞中的一种或多种其他基因失活,例如,b2m基因和/或一种或多种免疫检查点基因(例如,pd1、cish等)。在本文所述的任何t细胞中,第一和第二多核苷酸可以通过自切割肽(例如,2a肽也称之为“p2a”或“p2a肽”)连接。此外,在某些实施方式中,第二多肽还包含编码b2m和hla-e-或hla-g-编码序列之间的接头(例如,1、2、3、4、5、6或更多个拷贝的g4s接头)的序列。
本文还提供了制备遗传修饰的t细胞的方法,所述方法包括:使用核酸酶切割分离的t细胞中的tcr-α基因,所述核酸酶包含与tcr-α基因中靶位点结合的dna结合结构域;和将包含第一和第二多核苷酸的一种或多种供体引入t细胞,从而使第一和第二多核苷酸整合到切割的tcr-α基因中。在某些实施方式中,供体包含通过自切割2a肽连接的第一和第二多核苷酸。此外,在某些实施方式中,第二多肽还包含编码b2m和hla-e-或hla-g-编码序列之间的接头(例如,1、2、3、4、5、6或更多个拷贝的g4s接头)的序列。在本文所述的任何方法中,一种或多种供体还包含下述内容中的一种或多种:(1)侧接第一和第二多核苷酸的同源臂(针对tcr-α基因);(2)驱动第一和/或第二多核苷酸表达的一种或多种启动子;(3)一种或多种tcr-α增强子序列;(4)3’非翻译区(3’utr)和/或5’非翻译区(5’utr);(5)wpre序列(例如,在3’utr中);和/或(5)来自非洲爪蟾蜍(xenopus)β球蛋白基因的序列(例如,在5’utr中)。
在一个方面中,本文所述的是分离细胞(例如,真核细胞,诸如包括淋巴细胞、干细胞(例如,ipsc、胚胎干细胞、msc或hsc)或祖细胞的哺乳动物细胞),其中在将car基因位点特异性整合到细胞的基因组(包括例如内源性基因)中后,表达一种或多种外源性car。在一些实施方式中,使用如本文所述或本领域已知靶向这些基因的核酸酶,将car插入tcr基因(tcra和/或trbc),和/或任选地插入检查点基因(例如,cish,pd1等)和/或b2m基因中。在其他实施方式中,将car插入tcra基因,而在其他实施方式中,将car插入trbc基因。在一些实施方式中,将其插入b2m基因中,而在其他实施方式中,将其插入除tcr基因外的检查点基因(例如,cish,pd1等)中。在通过这种方法产生的细胞中,导入编码car的基因导致内源性tcr,检查点(例如,cish)和/或b2m基因的敲除,并导致敲除功能性内源性tcr或hla复合物的形成和/或敲除检查点基因(例如cish)。在本文所述的任何细胞中,如果将car整合到b2m基因中,那么可以使细胞中的一种或多种tcr基因在细胞中失活(例如,通过核酸酶介导的失活),以产生多种基因(例如,b2m基因和一种或多种tcr基因和检查点(例如,cish)基因)的敲除。相似地,如果将car导入tcr基因中,那么可以使一种或多种不同的tcr基因、检查点(例如,cish)和/或b2m基因在细胞中失活(例如,通过核酸酶介导的失活),以产生多种基因(例如,一种或多种tcr基因、cish基因和b2m基因)的敲除。
在其他实施方式中,本文所述的遗传修饰的细胞(t细胞)还包含改变的hla-e或hla-g基因(转基因),其插入编码car的细胞中,例如与car一起插入tcr(tcra)基因中。在一些实施方式中,将hla-e或hla-g基因(例如,外源性转基因)与car基因共引入到工程改造的细胞中。在一些实施方式中,在引入car基因之前或之后引入hla-e或hla-g转基因。在其他实施方式中,转基因包含hla-e或hla-g基因序列,其与编码接头的序列融合,然后接头与b2m基因序列融合(即,转基因包含hla-e或hla-g编码序列,接头和b2m编码序列),因此编码修饰型hla-e或hla-g复合物,其中b2m基因是包含hla-e或hla-g基因的开放阅读框的部分,因此在表达后,稳定的hla-e或hla-g复合物可由转基因表达的b2m形成。在该实施方式中,由于存在接头,b2m亚基可以仅与hla-e或hla-g蛋白缔合以在细胞表面上形成稳定的hla-e或hla-g复合物,而不能与任何其他hla复合物缔合。在其他实施方式中,hla-e或hla-g-接头-b2m转基因与编码感兴趣的car的序列连接,其中该构建体还包含car基因和hla-e或hla-g-接头-b2m构建体之间的2a自切割肽序列。在其他实施方式中,该car-hla-g或car-hla-e复合物还包含同源臂,从而使复合物可以在指定位点整合到基因组。在一些实施方式中,整合的位点导致由整合位点处的内源性启动子驱动的转录,或者car-hla-e或car-hla-g构建体可以与同样整合的启动子连接,从而使表达构建体整合到基因组中,但是由异源性启动子驱动。在一些实施方式中,将car-hla-e或car-hla-g复合物(转基因)可操作地连接到启动子,以允许从附加型(例如,cdna)核酸表达。供体构建体中还可包括其他序列,包括但不限于,wpre和/或tcra增强子序列。在其他实施方式中,启动子是组织特异性启动子。此外,这些表达构建体中的任一个可进一步包含aavitr,以允许包装成aav颗粒。在某些情况下,aav是aav5,aav6,aav9或任何其他类型的aav。
在一些方面中,通过修饰tcra基因的外显子c2来调节tcr基因。通过修饰b2m基因的外显子1来调节b2m基因。在某些实施方式中,修饰位于这样的序列内或其附近,所述序列包含表1的靶位点中所示的12-25(包括靶位点的12、13、14、15、16、17、18、19、20、21、22、23、24、25个)或更多个核苷酸,位于表1中所示靶位点内或其附近(seqidno:1和2;seqidno:3和4,seqidno:5和6;seqidno:39和40;seqidno:50和51);位于表1中所示靶位点(seqidno:1-6、39、40、50或51)任一侧(侧接基因组序列)上的1-5个碱基对内,1-10个碱基对内或1-20个碱基对内;或位于tcrazfn对的ttgaaa内,或b2mzfn的gcctta内。替代地或者另外地,还可以对本文所述成对的靶位点之间的序列(例如,基因组序列)进行修饰(例如,表1中所示核酸酶对的靶位点,包括tcra基因中55266和53853(seqidno:1和seqidno:2之间)或68813和68812(seqidno:39和seqidno:40)的靶位点之间;和/或b2m基因中57071和57531(seqidno:3和seqidno:4之间)的靶位点之间;cish基因中59488和59489的靶位点之间(seqidno:50和seqidno:51)。在其他实施方式中,在hprt基因中37706和48407的靶位点之间(seqidno:5和6)进行其他遗传修饰。可以通过将外源性融合分子引入细胞进行遗传修饰,所述外源性融合分子包含功能性结构域(例如,转录调节结构域,核酸酶结构域)和dna结合结构域,包括但不限于crispr/cas系统的sgrnadna结合结构域,zfpdna结合结构域和taledna结合结构域。修饰的细胞可以包括但不限于:(i)包含外源性转录因子的细胞,所述外源性转录因子包含与表1中所示靶位点结合的dna结合结构域和转录调节结构域,其中转录因子调节b2m和/或tcra基因表达和/或(ii)包含插入和/或缺失的细胞,所述插入和/或缺失位于表1中所示的一个或多个靶位点或其附近(之内、之间或邻近);位于表1中所示靶位点任一侧(侧接基因组序列)上的1-5个碱基对内,1-10个碱基对内或1-20个碱基对内;或位于tcra的ttgaaa内,或b2m的gccttq内;和/或本文所述成对的靶位点之间(例如,表1中所示核酸酶对的靶位点)。细胞可以包括进一步的修饰,例如其他失活的tcr或b2m基因,失活的hla基因,cish,pd1和/或ctla4基因和/或编码抗体偶联的t细胞受体(actr)的转基因和/或编码car的转基因和/或编码抗体的转基因。还可以包括针对修饰的hla-e或hla-g复合物的表达构建体。还提供了包括本文所述任何细胞的药物组合物,以及在离体治疗中使用所述细胞和药物组合物治疗对象的病症(例如,癌症)的方法。
因此,在一个方面中,本文描述了遗传修饰的细胞,其中除了整合了car编码基因外,tcr和/或b2m基因的表达也被调节(例如,激活,抑制或失活)。在一些实施方式中,细胞还包含修饰的hla-e或hla-g复合物。在优选的实施方式中,调节tcra基因的外显子c2和/或调节b2m基因的外显子1。调控可以通过结合tcr和/或b2m基因并调节tcr和/或b2m表达的外源性分子(例如,工程改造的转录因子,其包括dna结合结构域和转录激活或抑制结构域)和/或经由tcr和/或b2m基因的序列修饰(例如,使用切割tcr或b2m基因并通过插入和/或缺失修饰基因序列的核酸酶)。在一些实施方式中,描述了这样的细胞,其包含工程改造的核酸酶(例如,zfn,talen,crispr/cas核酸酶)以导致敲除tcr和/或b2m基因和任选地其他基因诸如免疫检查点基因(例如,cish(表1的核酸酶)),pd1(美国专利号8,563,314),ctla-4等)。在其它实施方式中,描述了这样的细胞,其包含一种或多种经工程改造的转录因子(tf),从而调节tcr和/或b2m基因的表达。在一些实施方式中,所述细胞是t细胞。还描述了这样的细胞,其中tcr和/或b2m基因的表达被调节,并且其中所述细胞被进一步工程改造以包含至少一种外源性转基因和/或至少一种内源基因(例如,β2微球蛋白(b2m)或tcr基因,和/或免疫检查点基因诸如pd1和/或ctla4)的附加敲除,或其组合。外源性转基因可以被整合到tcr或b2m基因(例如,当tcr或b2m基因被敲除时),并且也可以被整合到一种或多种基因,包括但不限于,非tcr或非b2m基因,诸如检查点基因(例如,cish,pd1)或安全港基因。在某些实施方式中,将一种或多种car转基因(例如,cd19特异性car)整合入trac基因,cish基因和/或b2m基因,以及安全港基因(例如,aavs1,rosa,白蛋白,hprt等)。可以将相同或不同的car转基因整合到相同或不同的基因座内。在一种或多种car除了整合入trac基因之外还被整合到一个或多个安全港基因中的实施方式中,也优选失活cish和/或b2m(例如,通过经由插入和/或缺失的核酸酶介导的失活)。在一些情况中,外源性转基因编码actr。转基因构建体可通过hdr或nhej驱动的方法插入。在一些方面中,具有调节的tcr和/或b2m表达的含car细胞至少包含外源性actr。包含tcr和/或b2m调节物的一些细胞还包含一个或多个检查点抑制基因的敲除。在一些实施方式中,检查点抑制基因是cish(参见,下表1和美国临时专利申请号62/583,724),同时在其他实施方式中,检查点抑制基因是pd1(参见美国专利号8,563,314)。在其它实施方式中,检查点抑制物是ctla4。参见例如,美国专利号9,597,357。在其它方面中,包含car的tcr和/或b2m调节的细胞还包含pd1敲除和/或ctla4敲除和/或cish敲除(下表1)。在一些实施方式中,调节的tcr基因是编码tcrβ的基因(tcrb)。在一些实施方式中,这通过对该基因的恒定区(tcrβ恒定区,或trbc)进行靶向切割来实现。在某些实施方式中,调节的tcr基因是编码tcrα的基因(tcra)。在其它实施方式中,插入通过对tcrα基因的恒定区进行靶向切割来实现,包括对tcrα基因的恒定区(本文称之为“trac”序列)的靶向切割。在一些实施方式中,tcr基因经修饰的细胞在b2m基因,cish基因(表1所公开的靶向位点),pd1和/或ctla4基因,hla-a、-b、-c基因或tap基因或其任何组合处被进一步修饰。在其它实施方式中,还修饰对于hlaii类的调节物,ciita(参见美国专利号8,945,868)。
在某些实施方式中,本文所述包含car的细胞还包含对tcra基因的修饰(例如,缺失和/或插入,经工程改造的tf的结合以阻遏tcr表达)(例如,外显子c2的修饰)。在某些实施方式中,修饰位于表1所示的任何tcra基因靶位点(seqidno1或2)内和/或其附近和/或位于成对的靶位点(例如,表1所示的核酸酶对的靶位点)之间,包括通过结合至、切割、插入和/或删除这些序列中任一者内的一个或多个核苷酸修饰和/或侧接tcra基因中这些序列的基因(基因组)序列的1-50个碱基对(包括其间任何值,例如1-5、1-10或1-20个碱基对)内的一个或多个核苷酸进行的修饰。在某些实施方式中,细胞在以下序列之一或多者内包含修饰(结合至,切割,插入和/或缺失):tcra基因内的ttgaaa(例如,外显子c2)或b2m基因内的gcctta(例如,外显子1)。在某些实施方式中,修饰包括本文所述的经工程改造的tf的结合,从而tcra基因表达被调节,例如,遏制或活化。在其它实施方式中,修饰是位于(一个或多个)核酸酶结合(靶)位点和/或切割位点处或附近的遗传修饰(核苷酸序列改变),包括但不限于,对于所述切割和/或结合位点中一个或多个位点的上游、下游和/或包括所述位点的一个或多个碱基对的1-300个碱基对(或其间任何数量的碱基对)内序列的修饰;包括一个或多个结合和/或切割位点或位于其任一侧的1-100个碱基对(或其间任何数量的碱基对)内的修饰;包括一个或多个结合和/或切割位点和/或位于其任一侧的1-50个碱基对((或其间任何数量的碱基对,例如,1-5、1-10、1-20或更多碱基对)内的修饰;和/或,对于核酸酶结合位点和/或切割位点内的一个或多个碱基对的修饰。在某些实施方式中,修饰位于seqidno:1和seqidno:2和/或seqidno:39和40中任一者之内、周围或之间的tcra基因序列处或附近(例如,1-300个碱基对、1-50、1-20、1-10或1-5个碱基对,或其间任何数量的碱基对)和/或上述tcra基因序列的成对的靶位点(例如,表1)之间。在某些实施方式中,修饰包括seqidno:1和seqidno:2,seqidno:39和40中所示一个或多个序列附近的tcra基因修饰或tcra基因的ttgaaa(例如,外显子c2)内的tcra基因的修饰,例如,对这些序列中的一个或多个序列的1个或多个碱基对的修饰。在某些实施方式中,核酸酶介导的遗传修饰位于成对的靶位点之间(使用二聚体切割靶标的情况)。核酸酶介导的遗传修饰可以包括任何数量碱基对的插入和/或缺失,包括插入任何长度的非编码序列和/或任何长度的转基因和/或删除1个碱基对至超过1000kb(或其间的任何值,包括但不限于1-100个碱基对、1-50个碱基对、1-30个碱基对、1-20个碱基对、1-10个碱基对或1-5个碱基对)。
在某些实施方式中,修饰位于表1所示的任何b2m基因靶位点(seqidno3或4)内和/或其附近和/或位于b2m基因成对的靶位点(例如,表1所示的核酸酶对的靶位点)之间(例如,外显子1的修饰),包括通过结合至、切割、插入和/或删除这些序列中任一者内的一个或多个核苷酸和/或侧接b2m基因中这些序列的基因(基因组)序列的1-50个碱基对(包括其间任何值,例如1-5、1-10或1-20个碱基对)内的一个或多个核苷酸进行的修饰。在某些实施方式中,细胞在b2m基因外显子1内的gcctta内包含修饰(结合至,切割,插入和/或缺失)。在某些实施方式中,修饰包括如本文所述的经工程改造的tf的结合,从而b2m基因表达被调节,例如被遏制或活化。在其它实施方式中,修饰位于(一个或多个)核酸酶结合(靶)位点和/或切割位点处或附近的遗传修饰(核苷酸序列改变),包括但不限于,对于所述切割和/或结合位点中一个或多个位点的上游、下游和/或包括所述位点的一个或多个碱基对的1-300个碱基对(或其间任何数量的碱基对)内序列的修饰;包括一个或多个结合和/或切割位点或位于其任一侧的1-100个碱基对(或其间任何数量的碱基对)内的修饰;包括一个或多个结合和/或切割位点和/或位于其任一侧的1-50个碱基对(或其间任何数量的碱基对,例如,1-5、1-10、1-20或更多碱基对)内的修饰;和/或,对于核酸酶结合位点和/或切割位点内的一个或多个碱基对的修饰。在某些实施方式中,修饰位于seqidno:3和seqidno:4中任一者之内、周围或之间的b2m基因序列处或附近(例如,1-300个碱基对、1-50、1-20、1-10或1-5个碱基对,或其间任何数量的碱基对)和/或上述b2m基因序列的成对的靶位点(例如,表1)之间。在某些实施方式中,修饰包括seqidno:3和seqidno:4中所示一个或多个序列中内或b2m基因外显子1中gcctta内的b2m基因的修饰,例如,对这些序列中的一个或多个序列的1个或多个碱基对的修饰。在某些实施方式中,核酸酶介导的遗传修饰位于成对的靶位点之间(使用二聚体切割靶标的情况)。核酸酶介导的遗传修饰可以包括任何数量碱基对的插入和/或缺失,包括插入任何长度的非编码序列和/或任何长度的转基因和/或删除1个碱基对至超过1000kb(或其间的任何值,包括但不限于1-100个碱基对、1-50个碱基对、1-30个碱基对、1-20个碱基对、1-10个碱基对或1-5个碱基对)。
在某些实施方式中,修饰位于表1所示的任何hprt基因靶位点(seqidno5或6)内和/或其附近和/或位于hprt基因成对的靶位点(例如,表1所示的核酸酶对的靶位点)之间(例如,内含子1的修饰),包括通过结合至、切割、插入和/或删除这些序列中任一者内和/或侧接b2m基因中这些序列的基因(基因组)序列的1-50个碱基对(包括其间任何值,例如1-5、1-10或1-20个碱基对)内的一个或多个核苷酸进行的修饰。在某些实施方式中,细胞包含插入内含子1的插入,从而使hprt基因不会被转录。插入hprt基因的转基因的表达可以通过内源性hprt启动子驱动或者可以包含外源性启动子。在其它实施方式中,修饰是位于(一个或多个)核酸酶结合(靶)位点和/或切割位点处或附近的遗传修饰(核苷酸序列改变),包括但不限于,对于所述切割和/或结合位点中一个或多个位点的上游、下游和/或包括所述位点的一个或多个碱基对的1-300个碱基对(或其间任何数量的碱基对)内序列的修饰;包括一个或多个结合和/或切割位点或位于其任一侧的1-100个碱基对(或其间任何数量的碱基对)内的修饰;包括一个或多个结合和/或切割位点和/或位于其任一侧的1-50个碱基对(例如,1-5、1-10、1-20或更多碱基对)内的修饰;和/或,对于核酸酶结合位点和/或切割位点内的一个或多个碱基对的修饰。在某些实施方式中,修饰位于seqidno:1和seqidno:4中任一者之内、周围或之间的b2m基因序列处或附近(例如,1-300个碱基对、1-50、1-20、1-10或1-5个碱基对,或其间任何数量的碱基对)和/或上述b2m基因序列的成对的靶位点(例如,表1)之间。在某些实施方式中,修饰包括seqidno:3和seqidno:4中所示一个或多个序列内或b2m基因外显子1中gcctta内的b2m基因的修饰,例如,对这些序列中的一个或多个序列的1个或多个碱基对的修饰。在某些实施方式中,核酸酶介导的遗传修饰位于成对的靶位点之间(使用二聚体切割靶标的情况)。核酸酶介导的遗传修饰可以包括任何数量碱基对的插入和/或缺失,包括插入任何长度的非编码序列和/或任何长度的转基因和/或删除1个碱基对至超过1000kb(或其间的任何值,包括但不限于1-100个碱基对、1-50个碱基对、1-30个碱基对、1-20个碱基对、1-10个碱基对或1-5个碱基对)。
在某些实施方式中,cish基因也经修饰(例如,使用或不使用整合的灭活),使用结合表1中所示任何cish靶位点(seqidno:50和seqidno:51)的核酸酶。在某些实施方式中,修饰包括插入和/或缺失,从而使cish基因不被转录或者从而使突变转录物经历无义介导的衰变。已经插入cish基因的一个或多个转基因的表达可以通过内源性cish启动子驱动或者可以包含外源性启动子。在其它实施方式中,修饰位于(一个或多个)核酸酶结合(靶)位点和/或切割位点处或附近的遗传修饰(核苷酸序列改变),包括但不限于,对于所述切割和/或结合位点中一个或多个位点的上游、下游和/或包括所述位点的一个或多个碱基对的1-300个碱基对(或其间任何数量的碱基对)内序列的修饰;包括一个或多个结合和/或切割位点或位于其任一侧的1-100个碱基对(或其间任何数量的碱基对)内的修饰;包括一个或多个结合和/或切割位点和/或位于其任一侧的1-50个碱基对(或其间任何数量的碱基对,例如,1-5、1-10、1-20或更多碱基对)内的修饰;和/或,对于核酸酶结合位点和/或切割位点内的一个或多个碱基对的修饰。在某些实施方式中,修饰位于seqidno:50和seqidno:51中任一者之内、周围或之间的cish基因序列处或附近(例如,1-300个碱基对、1-50、1-20、1-10或1-5个碱基对,或其间任何数量的碱基对)和/或上述cish基因序列的成对的靶位点(例如,表1)之间。在某些实施方式中,核酸酶介导的遗传修饰位于成对的靶位点之间(使用二聚体切割靶标的情况)。核酸酶介导的遗传修饰可以包括任何数量碱基对的插入和/或缺失,包括插入任何长度的非编码序列和/或任何长度的转基因和/或删除1个碱基对至超过1000kb(或其间的任何值,包括但不限于1-100个碱基对、1-50个碱基对、1-30个碱基对、1-20个碱基对、1-10个碱基对或1-5个碱基对)。
本发明car+修饰的细胞可以是真核细胞,包括非人哺乳动物和人细胞,诸如淋巴细胞(例如,t细胞)、干细胞/祖细胞(例如,诱导多能干细胞(ipsc)、胚胎干细胞(例如,人es)、间充质干细胞(msc)或造血干细胞(hsc))。任选地,car+修饰的细胞还经修饰以表达修饰的hla-e或hla-g复合物。干细胞可以是全能的或多能的(例如,部分分化的,如hsc,其是多能髓样或淋巴样干细胞)。在其它实施方式中,本发明提供了用于产生具有对tcr和/或b2m表达无效基因型(nullgenotype)的car+细胞的方法。然后,可以使本文所述的任何car+修饰的干细胞(在tcra和/或b2m基因座处修饰,任选地表达修饰的hla-e或hla-g)分化,以产生源自本文所述干细胞的、具有修饰的tcra和/或b2m基因表达的、分化的(体内或体外)细胞。在某些实施方式中,本文描述了如本文所述的car+修饰的细胞群,其中至少20%(或20%至100%之间的任何百分比),优选至少50%(或50%至100%之间的任何百分比),甚至更优选至少60%(或60%至100%之间的任何百分比)和甚至更优选至少70%至100%(其间的任何百分比)的细胞经car+修饰。
在另一方面中,本文所述的组合物(car+修饰的细胞,任选地表达修饰的hla-e或hla-g复合物)和方法可被用于例如治疗或预防或改善病症。所述方法通常包括(a)整合编码car的转基因到细胞中,通过使用核酸酶(例如,zfn或talen)或核酸酶系统(例如具有工程改造的crrna/tracrrna的crispr/cas系统)切割或分离的细胞(例如,t细胞或淋巴细胞)中的内源性tcr和/或b2m基因,从而使tcr基因失活或下调;和(b)向对象引入所述细胞,由此治疗或预防病症。在一些实施方式中,编码car或car-hla-e或car-hla-g表达构建体的基因被特异性地整合到tcrβ(tcrb)中,从而使tcrb的表达失活。在一些实施方式中,失活经由靶向切割该基因的恒定区(tcrβ恒定区,或trbc)和整合car来实现。在优选实施方式中,编码car或car-hla-e或car-hla-g表达构建体的基因被整合到tcrα(tcra)中,从而使tcra失活。在进一步优选的实施方式中,失活通过对该基因的恒定区(tcrα恒定区,或缩写为trac)进行靶向切割来实现。在一些实施方式中,编码car的基因被特异性地整合到b2m中,从而使b2m的表达失活。在一些实施方式中,car+细胞还包含下调基因的工程改造的转录因子。在其他实施方式中,转录因子是zfp-tf、tale-tf或crispr/dcas-tf。在一些实施方式中,进一步调节基因,包括但不限于b2m、cish、pd1和/或ctla4。
在一些实施方式中,调控(敲除)其它基因,例如,b2m、pd1、cish和/或ctla4,和/或细胞中存在一个或多个转基因(经由靶向整合(诸如核酸酶介导的整合)的整合、随机整合或附加)。治疗性转基因的性质可以是促进car+t细胞的杀伤活性,或作为对于修饰的t细胞自身的杀伤开关(产生所谓的“聪明”cart细胞,参见hartmann等(2017)embomolmedicine,doi10.15252/emmm.201607485)。在一些实施方式中,转基因是自杀基因,从而该基因的激活导致cart细胞的死亡。在一些实施方式中,自杀基因是编码胸苷激酶的hsv-tk基因,其能够使更昔洛韦(ganciclovir)(通常没有抗肿瘤作用的抗病毒药物)代谢成毒性化合物,所述毒性化合物干扰dna复制并导致细胞凋亡;胞嘧啶脱氨酶基因(还与尿嘧啶转磷酸核糖基酶基因偶联),其将5-氟胞嘧啶(具有抗真菌特性)转化成5-氟尿嘧啶;硝基还原酶基因转化cb1954(针对[5-(吖丙因(aziridin)-1-基)-2,4-二硝基苯甲酰胺])为毒性化合物4-羟胺;和细胞色素p450基因,其转化异环磷酰胺成丙烯醛(氮芥)(rouanet等(2017),intjmolsci,18(6):1231)或诱导型半胱天冬酶-9(jones等(2014)frontpharmacol.5:254)。在其他实施方式中,转基因编码的因子使炎症的副作用和/或毒性(诸如细胞因子释放综合征(crs)和/或神经毒性)平息(例如,靶向il6的scfv构建体或可分泌的il-12构建体-例如,第四代“truck”(chmielewski等,(2014)immunolrev.257(1):83-90)。
一种或多种转录因子和/或一种或多种核酸酶可以mrna形式、以蛋白质形式和/或以编码所述一种或多种核酸酶的核酸序列形式引入细胞或周围培养基。在某些实施方式中,向对象导入分离的car+细胞进一步包括其它遗传修饰例如整合外源性序列(至切割的tcr和/或b2m基因或不同的基因,例如,安全港基因或基因座)和/或灭活(例如,核酸酶介导的)其它基因,例如,一个或多个hla基因。在一些实施方式中,将一个car基因插入tcr基因,且将第二(相同或不相同的)car基因插入b2m基因。在这些实施方式中,car基因可以是car-hla-e或car-hla-g表达构建体的部分。外源性序列或蛋白质可以经由载体(例如,ad、aav、lv)导入,或通过使用诸如电穿孔的技术导入。在一些实施方式中,蛋白质通过细胞挤压(cellsqueezing)导入细胞(参见kollmannsperger等(2016)natcomm7,10372doi:10.1038/ncomms10372)。在一些方面中,组合物可包括分离的细胞片段和/或(部分或完全)分化的细胞。
在一些方面中,car+细胞可以被用于细胞治疗,例如,用于过继细胞转移。在其它实施方式中,car+细胞可以用于t细胞移植并且可以包含感兴趣的其它基因修饰。在一个方面中,car+t细胞包含对癌症标志物具有特异性的car。在另一方面中,插入的car对b细胞(包括b细胞恶性肿瘤)的cd19标志物特征具有特异性。将car靶向整合到b2m基因中将产生“通用”细胞,其能够用于治疗性组合物,用于治疗患者而不需要匹配hla,并且因此能够被用作针对任何有需要的患者的“现成的”治疗剂。car-hla-e或car-hla-g表达构建体的靶向整合可以产生“现成的”通用细胞,其在治疗的患者中不会经历nk介导的杀伤,并且因此可以在体内存活更长的时间。
在一些实施方式中,car编码序列通过靶向整合插入,其中car供体序列包括侧接同源臂,其对侧接经工程改造的核酸酶的切割位点的序列具有同源性。在一些实施方式中,car供体序列或car-hla-e或car-hla-g供体序列还包括启动子和/或其它转录调节序列。在其他实施方式中,car或car-hla-e或car-hla-g供体序列缺少启动子。在其他实施方式中,car或car-hla-e或car-hla-g供体序列包含开关,由此可以组装分离的胞外抗原结合结构域和胞内信号转导组分,例如,通过fkbp-frb模块,只有在存在异二聚化小分子(雷帕霉素类似物ap21967)的情况下(参见wu等(2015)science.350(6258):aab4077)。本文所述的任何供体构建体还可以包括其他序列,包括但不限于,同源臂(任何长度);wpre序列和/或tcra增强子序列。
另一方面中,car+或car+,修饰的hla-g+或修饰的hlae+tcr-或b2m-调节的(修饰的)t细胞还包含插入的抗体偶联的t细胞受体(actr)供体序列。在一些实施方式中,将actr供体序列插入tcr和/或基因中以在核酸酶诱导的切割之后破坏tcr和/或b2m基因的表达。在其它实施方式中,供体序列被插入“安全港”基因座中,例如aavs1、hprt、白蛋白和ccr5基因。
还提供了包含如本文所述的经修饰的细胞((例如,car+,或car+,修饰的hla-e+或hla-g+t细胞或干细胞,其具有失活的tcr和/或b2m基因)的药物组合物,或包含本文所述的一种或多种tcr和/或b2m基因结合分子(例如,经工程改造的转录因子和/或核酸酶)的药物组合物。在某些实施方式中,药物组合物还可包含一种或多种药学上可接受的赋形剂。经修饰的细胞,tcr和/或b2m基因结合分子(或编码这些分子的多核苷酸)和/或包含这些细胞或分子的药物组合物通过本领域已知的方法,例如通过静脉内输注、输注进入特定血管(例如肝动脉),或通过直接组织注射(例如,肌肉)来引入对象。在一些实施方式中,对象是患有可采用该组合物治疗或缓解的疾病或病症的成人。在其它实施方式中,对象是给予该组合物以预防、治疗或缓解疾病和病症(例如,癌症、移植物抗宿主疾病等)的儿科对象。
在一些方面中,组合物(包含car或car和修饰的hla-e或hla-g的调节的细胞)可以包含含有抗体抗原结合结构域的car。在一些方面中,car可用于武装工程改造的t细胞,以预防或治疗病症。在一些实施方式中,car识别与肿瘤细胞相关联或与癌症相关过程的抗原,诸如bcma,epcam,cea(胰腺癌,乳腺癌,结直肠癌),gpa33,粘蛋白,tag-72,caix(肾细胞癌(rcc)),叶酸-结合抗体,cd19(b细胞恶性肿瘤),cd20,cd22,egfr(上皮癌,神经胶质瘤),egfrviii(恶性胶质瘤),epcam,epha2,erbb2/her2(乳腺、卵巢、结肠癌;骨肉瘤,髓母细胞瘤)erbb3,fap(恶性胸膜间皮瘤),met,msln(间皮瘤,卵巢癌,胰腺腺癌),igκ,il-1rap,igf1r,epha3,lewisy,nkg2d配体,ror1,fr-a(卵巢癌),gd2(神经母细胞瘤,黑色素瘤),gpc3(肝细胞癌),il-13rα2(神经胶质瘤),l1-cam(神经母细胞瘤,黑色素瘤,卵巢腺癌),muc1(精囊癌),ca125(上皮性卵巢癌),pd-l1,psca,ctag1b(黑色素瘤和卵巢癌),psma(前列腺癌),vegfr2,c-met,cd133(胶质母细胞瘤,胆管癌(cca)),trailr1,trailr2,rankl,fap,vegf,vegfr,αvβ3和α5β1整联蛋白,cd30,cd33,cd52,cd70,cd123,cd138,cd16v,ctla4和固生蛋白(enascin)(scott等(2012)natrevcancer12:278;hartmann等(2017)embomolmed;doi10.15252/emmm.201607485,yu等(2017)jhematoloncol10:78)。在其它实施方式中,car识别与感染性疾病(如hiv、hcv等)相关联的抗原(参见例如,carillo等(2017)translres.pii:s1931-5244(17)30233-5.doi:
10.1016/j.trsl.2017.07.002)。在一些实施方式中,工程改造的t细胞可以包含整合到基因组中的2中或多种不相同的car序列(例如,对cd19和cd20具有特异性)。在某些实施方式中,car包含car设计的fmc63-cd8bbz,其中fmc63是抗-cd19scfv序列(参见,美国专利号9,701,758)且cd8bbz指排除scfv(cd8铰链/跨膜结构域(cd8),来自41bb基因的共刺激结构域(bb),来自cd3z基因的刺激结构域(z))的car的部分。
转录因子或核酸酶的dna结合结构域(例如,zfp,tale,sgrna)可结合至tcra或b2m基因中的靶位点,其包含本文所示的任何靶位点(例如表1,如seqidno:1-4所示)的9、10、11、12或更多个(例如,13、14、15、16、17、18、19、20或更多个)核苷酸。锌指蛋白可包括1、2、3、4、5、6或更多个锌指,各锌指具有识别螺旋,其与靶基因中的亚靶位点(targetsubsite)特异性地接触。在某些实施方式中,锌指蛋白包括4或5或6个指(将其命名为f1、f2、f3、f4、f5和f6,并且从n末端至c末端排列f1至f4或f5或f6),例如表1所示。本文所述的zfp还可包括锌指蛋白的磷酸接触残基(phosphatecontactresidue)的一个或多个突变,例如,美国临时专利申请号62/378,978和62/443,981中描述的nr-5qabc突变体。在其它实施方式中,单向导rna或tal-效应物dna结合结构域可结合至本文所述的靶位点(例如,表1的靶位点,示于seqidno:1-4中任一者)或这些靶位点中任一者内或成对靶位点之间的12或更多个碱基对。本文所述的核酸酶(包含zfp、tale或sgrnadna结合结构域)能够在包含seqidno:1-4中任一者的tcra基因或b2m基因内产生遗传修饰,包括这些序列(seqidno:1-4)中任一者内的修饰(插入和/或缺失)和/或对于侧接seqidno:1-4中所示靶位点序列的tcra和/或b2m基因序列的修饰,例如,ttgaaa内tcra基因外显子c2中的修饰。
本文所述其它蛋白质可以进一步包括切割结构域和/或切割半结构域(例如,野生型或工程改造的foki切割半结构域)。因此,在本文所述的任何核酸酶(例如,zfn,talen,crispr/cas系统)中,核酸酶结构域可包含野生型核酸酶结构域或核酸酶半结构域(例如,foki切割半结构域)。在其它实施方式中,核酸酶(例如,zfn,talen,crispr/cas核酸酶)包含经工程改造的核酸酶结构域或半结构域,例如形成专性异二聚体(obligateheterodimers)的经工程改造的foki切割半结构域。参见例如,美国专利号7,914,796和8,034,598。在某些实施方式中,本文描述的核酸酶的一个或多个foki核酸内切酶结构域还可包含如美国专利公开号20180087072中所述的磷酸接触突变体(例如r416s和/或k525s)。
在另一个方面中,本公开提供了编码本文所述的任何蛋白质、融合分子和/或其组分(例如,sgrna或其它dna结合结构域)的多核苷酸。多核苷酸可以是病毒载体、非病毒载体(例如,质粒)的部分,或是mrna形式。本文所述任何多核苷酸还可以包括用于靶向插入靶基因(例如,tcra,tcrb,检查点和/或b2m基因)的序列(供体,同源性臂或补丁(patch)序列)。而在另一个方面中,提供包含本文所述的任何多核苷酸的基因递送载体。在某些实施方式中,载体是腺病毒载体(例如,ad5/f35载体),或慢病毒载体(lv),包括有整合能力的或整合缺陷型慢病毒载体,或腺相关的载体(aav)。因此,本文还提供了病毒载体,其包括编码核酸酶(例如,zfn或talen)和/或核酸酶系统(crispr/cas或ttago)的序列和/或用于靶向整合入靶基因内的供体序列。在一些实施方式中,供体序列和编码核酸酶的序列位于不同的载体。在其它实施方式中,核酸酶以多肽形式提供。在优选的实施方式中,多核苷酸是mrna。在一些方面中,该mrna可经化学修饰(参见例如kormann等,(2011)naturebiotechnology29(2):154-157)。在其它方面中,该mrna可包含arca帽(参见美国专利7,074,596和8,153,773)。在一些方面中,mrna可包括通过酶促修饰引入的帽。酶导入的帽可以包括:帽0、帽1或帽2(参见例如,smietanski等,(2014)naturecommunications5:3004)。在其它方面中,mrna可通过化学修饰封端。在其它实施方式中,该mrna可包括未经修饰的和经修饰的核苷酸的组合(参见美国专利公开2012-0195936)。在另一个实施方式中,mrna可包含wpre元件(参见美国专利公开号20160326548)。在一些实施方式中,wpre元件可以包含一个或多个突变(参见美国专利号7,419,829)。在一些实施方式中,mrna是双链的(参见例如,kariko等(2011)nuclacidres39:e142)。
而在另一方面中,本公开提供了分离细胞,其包含本文所述的任何蛋白质、多核苷酸和/或载体。在某些实施方式中,细胞选自下组:干细胞/祖细胞或t细胞(例如,cd4+t细胞)。在其他方面中,本公开提供了car+或car+,修饰的hla-e+和/或hla-g+细胞或细胞系,其源自包含本文所述蛋白质、多核苷酸和/或载体中任一者的细胞或系,即源自(例如,培养中)其中tcr和/或b2m已经通过一种或多种zfn失活和/或其中供体多核苷酸(例如,actr和/或car)已经稳定纳入细胞基因组中的细胞的细胞或细胞系。因此,本文所述细胞的衍生后代本身可能不包含本文所述蛋白质,多核苷酸和/或载体,但在这些细胞中,tcr和/或b2m基因失活和/或供体多核苷酸整合到基因组中且/或表达。
在另一方面中,本文所述的是使细胞(例如,t细胞)中至少一种tcr基因失活并提供在细胞中表达外源性car的方法,其通过将本文所述一种或多种蛋白质、多核苷酸和/或载体导入如本文所述的细胞。在本文所述任何方法中,核酸酶可诱导定向诱变,细胞dna序列的缺失,和/或促进预定染色体基因座处的靶向重组。因此,在某些实施方式中,核酸酶将一个或多个核苷酸从靶基因删除和/或将其插入靶基因。在一些实施方式中,tcr和/或hla基因通过核酸酶切割随后非同源末端连接而失活。在其他实施方式中,靶基因中的基因组序列被替换,例如,使用本文所述核酸酶(或编码所述核酸酶的载体)和在用核酸酶的靶向切割后插入该基因的“供体”序列(例如,car)。供体序列可以存在于核酸酶载体,存在于单独载体(例如,aav、ad或lv载体),或者另选地,可以使用不同的核酸递送机制将其导入该细胞。在本文所述的任何方法中,核酸酶和供体可以任何顺序共同给予或顺序给予。可以重复核酸酶和/或一种或多种供体的给药,例如可以在单一核酸酶(靶向不同基因的1、2、3、4或多种核酸酶)之前、之时和/或之后给予一种或多种供体(例如,一种或多种car);单次核酸酶给药之前、之时和/或之后可以重复给予一种或多种供体;或者可以在重复的核酸酶给药之前,之时和/或之后重复给予一种或多种供体。在某些实施方式中,共给予trac、cish和/或b2m特异性核酸酶以及一种或多种car供体,以在单一编辑步骤方法中提供多敲除表达car的细胞。在一些实施方式中,所述方法还包括使一种或多种其它基因(例如,免疫检查点,诸如cish、pd1或ctla4)失活和/或将一种或多种转基因整合进入细胞的基因组,包括但不限于,将一种或多种转基因整合进入失活的tcr(和任选地其他基因b2m基因等)和/或整合进入一个或多个安全港基因。在某些实施方式中,本文描述的方法产生细胞群,其中至少80-100%(或其间任何值),包括至少90-100%(或其间任何值)的细胞包括敲除和/或整合的转基因。
此外,本文所述的任何方法可体外、体内和/或离体实施。在某些实施方式中,离体实施该方法,例如,以修饰t细胞,从而使其在自体同源或同种异体设置中能够用作治疗剂,以治疗对象(例如,患有癌症的对象)。可被治疗和/或预防的癌症的非限制示例包括:肺癌、胰腺癌、肝癌、骨癌、乳腺癌、结肠直肠癌、白血病、卵巢癌、淋巴瘤、脑癌等。
在另一方面中,本文描述了将一种或多种转基因整合进入分离细胞的基因组的方法,所述方法包括:向细胞中引入,(a)一种或多种供体载体(例如,aav,质粒,ad,mrna等),所述供体载体包含所述一种或多种转基因,和(b)以mrna形式存在的至少一种非天然产生的核酸酶,其中至少一种核酸酶切割所述细胞的基因组,从而使所述一种或多种转基因整合进入所述细胞的基因组(例如,一种或多种car基因或car-hla-e或car-hla-g表达构建体进入tcr或hla受体),其中所述供体载体在核酸酶电穿孔进入细胞之前立即或之后立即被引入包含所述分离细胞和所述mrna的电穿孔缓冲液。在某些实施方式中,在电穿孔之后且在将细胞转移至培养基之前将供体载体引入电穿孔缓冲液中。参见例如,美国专利公开号20150174169和20150110762。所述方法可用于将car转基因或car-hla-e或car-hla-g表达构建体引入任何基因组位置,包括但不限于,tcr基因,b2m基因和/或安全港基因。
附图说明
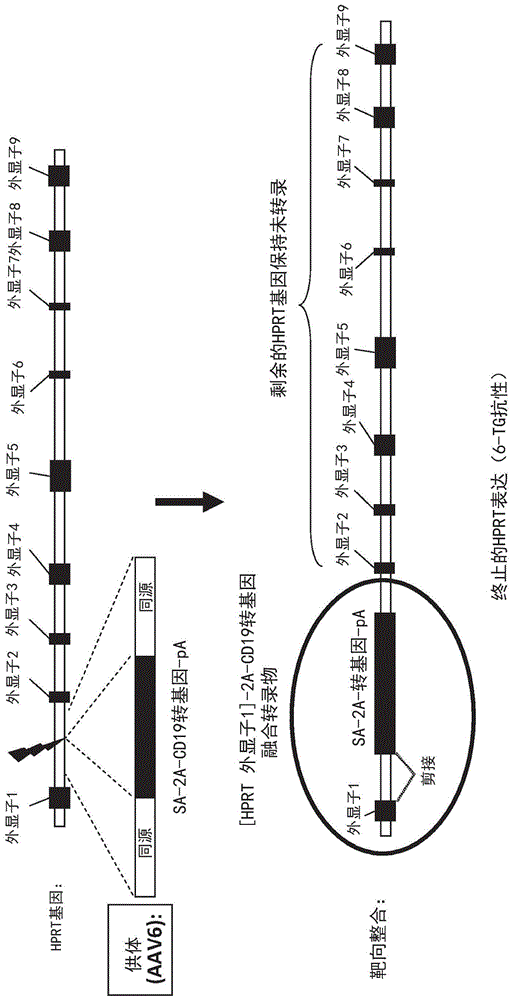
图1是hprt基因的示意图,其显示了基因的基因组形式上内含子和外显子的组织以及用于插入内含子1的表达cd19的转基因的设计。该转基因供体构建体具有侧接cd19转基因的同源臂(“同源性”)并还具有剪接受体(sa),从而转录物成熟时,hprt的外显子1将与cd19基因连接。该构建体还包含位于hprt外显子1和cd19之间的2a自切割位点。在cd19编码序列的末端还存在多聚a序列。当转录并成熟时,该构建体将最终仅翻译cd19编码序列。包含插入的cd19转基因盒的细胞将不表达hprt基因,并因此将对6-硫鸟嘌呤(“6-tg”)具有抗性,从而在存在6-tg的情况下实现仅选择具有插入的盒的细胞。
图2a和2b是描述使用图1所示的cd19表达盒转染的k562细胞中的cd19表达的图表。为了评估cd19表达,使用靶向人cd19胞外域的pe-cy7偶联的抗体对细胞进行染色。对未修饰的(“原初”)k562细胞进行类似处理并染色(图2a)作为阴性对照。图2b显示了6-tg选择后转染的k562细胞,并表明几乎所有细胞(98.3%)对cd19表达都呈阳性。
图3a-3c是描述了用于分析t细胞对靶细胞作用的facs试验的结果的图表。将cd19+k562(如图2所示)与未修饰的正常k562细胞按1:1比例混合。使用celltracetm增殖染料标记细胞,然后与t细胞共培养。将细胞共培养3小时,洗涤,用cd19抗体染色,然后通过facs评估cd19+k562的百分比。在没有t细胞的情况下,celltracetm阳性群(即,cd19+k562和正常(cd19-)k562)如所预期展现出50%:50%的比例(图3a)。在与t细胞共培养时,未观察到k562细胞毒性,所述t细胞已经通过没有cd19-car供体的tcra特异性zfn编辑(图3c,“对照-trac+靶标”)或未经处理(图3b,“对照-靶标ut”)。
图4a和4b是一系列组图,其显示了在一系列效应细胞与靶细胞(“e:t”比)上包含cd19抗原的细胞的有效杀死。如前所述,靶细胞是携带cd19的k562细胞和原初k562细胞的50:50混合物。图4a描述了使用具有将cd19-car整合到b2m基因中的t细胞的结果,而图4b描述了其中将cd19-car整合到tcra基因中的结果。针对两个数据集的最左侧组图显示了e:t比率为2:1,其中相较于靶细胞,存在两倍的t细胞的数量;而最右侧组图描述了来自e:t比率为0.125:1的结构;和中间的组图显示了来自介于两者之间的e:t比率的中值的结果。数据表明,原初(cd19-)k562细胞不会被携带cd19-car的t细胞杀死,而具有cd19抗原的k562细胞的杀伤与所用效应细胞的数量相关联。
图5是描述cd19+k562细胞杀死百分数与效应物:靶细胞比率的关系的图表。图表上显示的是包含整合到tcra或b2m基因中的cd19-car的t细胞的结果。该数据证明了整合到这两种基因种的任一基因中均会导致有效的car功能和t细胞活化。
图6a-6f是描述细胞表面标志物或cd19-car表达的fac分析的图。图6a和6b显示了未经zfn处理(图6a)或未经cd19-car供体处理(图6b)的细胞扫描。图6c和6d显示了当使用针对b2m和tcra的核酸酶处理但未使用car供体处理细胞时的结果。图6c显示了核酸酶切割后的结果,并证明了80%的细胞表现出双重敲除表型。图6e和6f显示了当使用核酸酶和包含trac同源性臂的cd19-car供体两者处理细胞时的结果。图6f显示了63.4%的细胞表达cd19-car。
图7是显示了核酸酶介导的trac失活(敲除)后细胞基因型和表型的图表。如图所示,超过95%的细胞显示出基因型和表型失活。
图8a和8b显示了相较于未处理的细胞(图8a),使用靶向trac的核酸酶处理的t细胞(图8b)中表面cd3受体表达的facs分析结果。如图所示,相较于0.2%未处理的细胞,至少99.5%核酸酶处理的细胞不表达表面tcr。
图9a-图9c是显示使用靶向trac(图9b)或b2m(图9c)的核酸酶处理的t细胞中转基因表达(gfp)的facs分析的图表。还显示了缺少供体转基因但使用trac和b2m特异性试剂处理的细胞(图9c)。如图所示,至少93%使用trac特异性核酸酶处理的细胞中表达转基因,这表明核酸酶介导有效整合入trac。相似地,至少90%使用b2m特异性核酸酶处理的细胞中表达转基因,这表明核酸酶介导有效整合入b2m。
图10a-10c显示了细胞的facs分析,显示了使用trac靶向核酸酶(图10a)和b2m核酸酶(图10b)以及car供体(图10c)处理的健康供体t细胞的facs分析结果。图10a显示了超过94%的双敲除,car转基因细胞呈cd3阴性(是trac敲除);图10b显示了超过88%的经处理的细胞呈hla阴性(是b2m敲除);和图10c显示了超过76%双敲除细胞(trac和b2m)表达了car供体。
图11是描述了来自多重(多重敲除和/或多重靶向整合)实验结果的图表。在该实验中,t细胞用trac和b2m特异性zfn试剂处理,并还用zfn和两种aav供体构建体处理:包含trac同源臂的gfp供体和包含b2m同源臂的cd19car供体。数据表明,两个zfn对以>90%的效率切割其靶标,且gfp供体的供体整合率为90%,cd19car供体的供体整合率为77%。对于用zfn对和两个供体构建体处理的细胞,超过62%的细胞包含所有四种编辑(tcrk/o、b2mk/o、gfp+和cd19car+0)。
图12a和12b是描述了在具有多重基因编辑的细胞中转基因供体的整合结果的图表。在图12a中,已经使用zfn处理t细胞以特异性地敲除b2m、trac和cish,以及表达gfp的转基因整合进行trac基因座的结果,图12b显示了使用表达cd19car的转基因类似地处理t细胞的假设结果。
图13描述了trac基因座中外显子c3(seqidno:62)的“d”插入位点处的b2m-hla-g融合转基因的整合位点(参见pct公开号wo2017106528)。供体构建体包含右(r-ha)和左(l-ha)同源臂,其对侧接trac-zfn切割位点的序列具有的同源性。融合转基因的表达由pgk启动子驱动,并且供体也包含牛生长激素(bgh)多聚a序列。
图14a-14c是描述将b2m-hla-g融合转基因插入trac基因的图。图14a显示了使用trac特异性zfn对sbs#68877/sbs#68876切割的结果,并证明了trac基因以97%的频率被敲除,如通过tcr的cd3亚基存在与否所测定(左组图)。相似地,b2m以81%的频率被sbs#57071/sbs#57531zfn对敲除,如通过细胞表面上hla复合物的损失送测定(右组图)。图14b和14c描述了hla-g和b2m的胞内(图14b)和表面(图14c)染色(分别为左组图和右组图)。如图所示,hla-g以高水平胞内表达,并在胞内和细胞表面上都检测到表达自hla-b2m构建体的b2m。
图15a和15b显示了使用所示的b2m供体构建体(gfp转基因)和靶向b2m的核酸酶处理的cd4和cd8细胞的facs和misseq分析。图15a显示了facs分析;最左侧的组图仅显示了供体(无核酸酶);左侧第二组图显示了使用pgk启动子驱动的gfp供体构建体处理的细胞,所述pgk启动子驱动的gfp供体构建体含有长同源臂(每个臂约1kb)且没有分子标签以经由下一代测序(即“miseq标签”)和靶向b2m的核酸酶评估靶向的整合效率;中间组图显示了使用pgk启动子驱动的gfp供体构建体处理的细胞,所述pgk启动子驱动的gfp供体构建体包含短同源臂(每个臂250bp)和miseq标签和靶向b2m的核酸酶;右侧第二组图显示了使用供体构建体处理的细胞,所述供体构建体包含短同源臂和wpre序列;和最右侧的组图显示了使用供体构建体处理的细胞,所述供体构建体包含短同源臂和tcra增强子序列。图15b显示了来自15a的流式细胞术表达结果的定量和miseq分子分析的结果。
图16是描述了用于转基因递送的示例性供体的示意图,其包含侧接启动子序列的同源臂(例如,对于trac或b2m),转基因(例如,car,b2m,hla-e和/或hla-g等)。可以包含的其他组件是增强子序列,wpre序列,5'和3'utr,多聚a序列等。
图17显示了转染所示的zfn和/或供体后,trac和b2m靶基因处的靶向整合和插入缺失的miseq分子分析的结果。样品“01_模拟”(“1”)指模拟转染;样品“02_trac+b2m”(“2”)指仅使用trac和b2mzfn转染的细胞;样品3“03_位点_e_423_493_hpgk_gfp-miseq”(“3”)指使用这样的供体转染的细胞,所述供体包含423bp的左臂和393bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的gfp转基因。供体还包含“miseq标签”,其允许通过miseq来定量进入trac基因座的ti。在样品3中,单独添加该供体,不添加zfn。样品“04trac+b2m位点_e_423_493_hpgk_gfp-miseq”包含来自样品3的zfn以及来自样品4的供体。样品“05trac+b2m位点_e_aav_hpgk_gfp”包含来自样品3的zfn以及供体,所述供体具有1000bp的左臂和992bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的gfp转基因。供体不包含“miseq标签”。样品“06trac+b2m位点_e_350-393_hpgk_gfp-wpre-miseq”包含来自样品3的zfn和供体,所述供体包含350bp的左臂和393bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动并后跟突变的wpre元件的gfp转基因。供体还包含“miseq标签”。样品“07trac+b2m位点_e_423-393_hpgk_fmc63-cd8bbz-miseq”包含来自样品3的zfn和供体,所述供体包含423bp的左臂和393bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的fmc63-cd8bbzcar转基因。供体还包含“miseq标签”。样品“08trac+b2m位点_e_423-393_hpgk_fmc63-cd8bbz-miseq”包含来自样品3的zfn和供体,所述供体包含423bp的左臂和393bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动并后接突变wpre元件的fmc63-cd8bbzcar转基因。供体还包含“miseq标签”。样品“09trac+b2m位点_e_350-393_hpgk_fmc63-cd8bbz-p2a-b2m-hla-e-wprem-miseq”包含来自样品3的zfn和供体,所述供体包含360bp的左臂和393bp的右臂,其对侧接fmc63-cd8bbzcar转基因的trac位点e具有同源性,所述fmc63-cd8bbzcar转基因通过自切割p2a肽与表达b2m和hla-3的融合蛋白连接。所述转基因通过hpgk启动子驱动并后跟突变的wpre元件。供体还包含“miseq标签”。样品“10trac+b2msite_e_350-393_hpgk_fmc63-cd8bbz-p2a-b2m-hla-g-wprem-miseq”包含来自样品3的zfn和供体,所述供体包含360bp的左臂和393bp的右臂,其对侧接fmc63-cd8bbzcar转基因的trac位点e具有同源性,所述fmc63-cd8bbzcar转基因通过自切割p2a肽与表达b2m和hla-g的融合蛋白连接。所述转基因通过hpgk启动子驱动并后跟突变的wpre元件。供体还包含“miseq标签”。
图18a-18d显示了靶向整合进入使用trac-和b2m靶向的核酸酶(双敲除称之为“dko”)以及供体处理的健康供体t细胞的facs分析的结果。图18a显示了下述的表达结果:模拟转染后(上组图);使用包含长同源臂的gfp供体进行靶向整合的dko细胞(图17中的样品5)(中组图);和使用具有短同源臂和wpre序列的gfp供体进行靶向整合的dko细胞(图17中的样品6)(下组图)。图18b显示了下述的表达结果:模拟转染后(上组图);使用具有短同源臂的car供体进行靶向整合的dko细胞(图17中的样品7)(中组图);和使用具有包含wpre序列的带短同源臂的car供体进行靶向整合的dko细胞(图17中的样品8)(下组图)。图18c显示了下述的表达结果:使用car和hla-e供体进行靶向整合的dko细胞(图17中的样品9)(上组图);和使用car和hla-g供体进行靶向整合的dko细胞(图17中的样品10)(下组图)。图18d显示了下述的结果:模拟转染后(图17的样品1,上组图);不存在供体情况下的dko细胞(图17的样品2)(中间图);和存在car和hla-e或hla-g供体情况下的dko细胞(图17的左侧两个组图的样本9或右侧两个组图的样本10)(下组图)。
图19显示了转染所示的zfn和/或供体后,插入缺失(indels)的miseq分子分析的结果。使用trac和b2mzfn处理的细胞产生双敲除(称之为dko)。样品“01_模拟”(“1”)指模拟转染;样品“02_trac+b2m”(“2”)指仅使用trac和b2mzfn转染的细胞;样品3“_paav_trac_e_1000_992_hpgk_hla_g仅”(“3”)指使用这样的供体转染的细胞,所述供体包含1000bp的左臂和992bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的hla-g转基因。样品4“_paav_trac_e_1000_992_hpgk_hla_e0101仅”(“4”)指使用这样的供体转染的细胞,所述供体包含1000bp的左臂和992bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的hla-e0101转基因。样品5“_paav_trac_e_1000_992_hpgk_hla_e0103仅”(“5”)指使用这样的供体转染的细胞,所述供体包含1000bp的左臂和992bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的hla-e0103转基因。样品6“_paav_trac_e_1000_992_hpgk_hla_g”(“6”)指使用来自样品2的zfn和这样的供体转染的细胞,所述供体包含1000bp的左臂和992bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的hla-g转基因。样品7“_paav_trac_e_1000_992_hpgk_b2m_g4s_2_无sp_hla_g”(“7”)指使用来自样品2的zfn和这样的供体转染的细胞,所述供体包含1000bp的左臂和992bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的连接的b2mhla-g转基因。b2m和hla-g之间的接头包含2个拷贝的g4s肽。hla-g不包含信号肽。样品8“_paav_trac_e_1000_992_hpgk_b2m_g4s_2_无sp_hla_g”(“8”)指使用来自样品2的zfn和这样的供体转染的细胞,所述供体包含1000bp的左臂和992bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的连接的b2mhla-g转基因。b2m和hla-g之间的接头包含4个拷贝的g4s肽。hla-g不包含信号肽。样品9“_paav_trac_e_1000_992_hpgk_b2m_g4s_2_无sp_hla_g”(“9”)指使用来自样品2的zfn和这样的供体转染的细胞,所述供体包含1000bp的左臂和992bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的连接的b2mhla-g转基因。b2m和hla-g之间的接头包含6个拷贝的g4s肽。hla-g不包含信号肽。样品10“_paav_trac_e_1000_992_hpgk_hla_e0101”(“10”)指使用来自样品2的zfn和这样的供体转染的细胞,所述供体包含1000bp的左臂和992bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的hla-e0101转基因。样品11“_paav_trac_e_1000_992_hpgk_hla_e0101”(“11”)指使用来自样品2的zfn和这样的供体转染的细胞,所述供体包含1000bp的左臂和992bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的hla-e0103转基因。样品12“_paav_trac_e_1000_992_hpgk_b2m_无sp_hla_e0101”(“12”)指使用来自样品2的zfn和这样的供体转染的细胞,所述供体包含1000bp的左臂和992bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的连接的b2mhla-e0101转基因。b2m和hla-e0101之间的接头包含4个拷贝的g4s肽。hla-e0101不包含信号肽。样品13“_paav_trac_e_1000_992_hpgk_b2m无sp_hla_e0103”(“13”)指使用来自样品2的zfn和这样的供体转染的细胞,所述供体包含1000bp的左臂和992bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的连接的b2mhla-e0101转基因。b2m和hla-e0101之间的接头包含4个拷贝的g4s肽。hla-e0103不包含信号肽。样品14“paav_trac_e_1000_992_pgk_gfp”(“14”)指使用来自样品2的zfn和这样的供体转染的细胞,所述供体包含1000bp的左臂和992bp的右臂,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的gfp转基因。样品15“paav_trac_e_350_393_hpgk_car_b2m_hla_g_wprem_miseq”(“15”)指使用来自样品2的zfn和这样的供体转染的细胞,所述供体包含360bp的左臂和393bp的右臂,其对侧接fmc63-cd8bbzcar转基因的trac位点e具有同源性,所述fmc63-cd8bbzcar转基因通过自切割p2a肽与表达b2m和hla-g的融合蛋白连接。该转基因通过hpgk启动子驱动并后跟突变的wpre元件。供体还包含“miseq标签”。
图20显示了靶向整合进入如所指示处理的健康供体t细胞的facs分析的结果。使用trac和b2mzfn处理的细胞称之为“dko”(表示双敲除)。上组图显示了模拟转染后的cd3、hla-abc和gfp表达(图19中的样品1);中组图显示了dko细胞中且无供体时相同蛋白质的表达(图19中的样品2);和下组图显示了dko细胞且还经gfp供体处理中的表达(图19中的样品14)。
图21显示了靶向整合进入如所指示处理的健康供体t细胞的facs分析的结果。使用trac和b2mzfn处理的细胞称之为“dko(表示双敲除)”。上组图显示了模拟转染后所示的蛋白质(cd3、hla-abc、b2m和hla-g)的表达(图19中的样品1);中组图显示了trac/b2mdko细胞种无供体时相同蛋白质的表达(图19中的样品2);和下组图显示了仅使用hla-g供体处理的细胞中的表达(图19中的样品3)。
图22显示了靶向整合进入如所指示处理的健康供体t细胞的facs分析的结果。使用trac和b2mzfn处理的细胞称之为“dko(表示双敲除)”。上组图显示了转染hla-g供体进入dko细胞后所示的蛋白质(cd3、hla-abc、b2m和hla-g)的表达(图19中的样品6);顶部的第二组图显示了转染包含b2m和hla-g转基因的供体进入dko细胞后相同蛋白质的表达(图19中的样品7);底部的第二组图显示了转染包含b2m和hla-g转基因进入dko细胞后相同蛋白的表达(图19中的样品8);和下组图显示了转染包含b2m和hla-g转基因进入dko细胞后相同蛋白的表达(图19中的样品9)。
图23显示了靶向整合进入如所指示处理的健康供体t细胞的facs分析的结果。使用trac和b2mzfn处理的细胞称之为“dko(表示双敲除)”。上组图显示了模拟转染(无供体或zfn,图19中的样品1);顶部的第二组图显示了dko细胞中所示的蛋白质(cd3、hla-abc、b2m和hla-e)的表达(图19中的样品2);底部的第二组图显示了仅转染hla-e供体后相同蛋白质的表达(图19中的样品4);和下组图显示了仅转染hla供体后相同蛋白质的表达(图19中的样品5)。
图24显示了靶向整合进入如所指示处理的健康供体t细胞的facs分析的结果。使用trac和b2mzfn处理的细胞称之为“dko(表示双敲除)”。上组图显示了具有hla-e0101供体构建体的dko细胞中所示的蛋白质(cd3,hla-abc,b2m和hla-e)的表达(图19中的样品10);顶部的第二组图显示了具有hla-e0103供体构建体的dko细胞中所示的蛋白质的表达(图19中的样品11);底部的第二组图显示了dko细胞中转染b2m和hla-e供体后相同蛋白质的表达(图19中的样品12);和下组图显示了dko细胞中转染b2m和hla-e供体后相同蛋白质的表达(图19中的样品13)。
图25显示了靶向整合进入如所指示处理的健康供体t细胞的facs分析的结果。使用trac和b2mzfn处理的细胞称之为“dko(表示双敲除)”。上组图显示了模拟转染后所示的蛋白质(cd3、hla-abc和蛋白质l=car)的表达(图19中的样品1);中组图显示了trac/b2mdko细胞(图19中的样品2)中无供体时相同蛋白质的表达;和下组图显示了使用car-b2m-hla-供体处理的dko细胞中的表达(图19中的样品15)。
图26显示了facs分析的结果,其评估了具有car-b2m-hlag供体的dko细胞(图19中的样本15)中细胞表面上(标记为ecs的上组图)和胞内(标记为ics的下组图)所示的蛋白质(cd3、hla-abc、b2m和hla-g)的表达。
具体实施方式
本文公开了用于产生t细胞的组合物和方法,所述t细胞中一种或多种car或car和修饰的hla-e或hla-g的表达可有效杀伤表达car靶向抗原的细胞。此外,当将car或car-hla-e或car-hla-g表达构建体整合到tcr基因和/或b2m基因中时,杀伤是有效的。以此方式修饰的细胞可用作治疗剂,例如,用于过继细胞疗法,因为由于car整合进入tcr基因中导致缺乏tcr复合体阻止了这些t细胞靶向其他非抗原携带的细胞,而通过将car整合到b2m中来敲减hla复合物消除或减少针对引入的武装t细胞的基于hla的免疫应答。进一步修饰以表达修饰的hla-e或hla-g复合物的细胞也可以逃避宿主nk细胞的杀伤。此外,可以将其他感兴趣的基因插入携带car以及任选地修饰的hla-e或hla-g的细胞中,和/或敲除其他感兴趣的基因。
概述
除非另有说明,本方法的实施以及本文所述组合物的制备与应用采用本领域技术范围内的分子生物学、生物化学、染色质结构与分析、计算化学、细胞培养、重组dna与相关领域的常规技术。这些技术在文献中已有充分描述。参见例如,sambrook等,molecularcloning:alaboratorymanual(《分子克隆:实验室手册》)第2版,冷泉港实验室出版社(coldspringharborlaboratorypress),1989以及第3版,2001;ausubel等,current方案inmolecularbiology(《新编分子生物学实验指南》),纽约约翰韦利父子公司(johnwiley&sons,newyork)1987及定期更新;methodsinenzymology(《酶学方法》)丛书,圣迭戈学术出版社(academicpress,sandiego);wolffe,chromatinstructureandfunction(《染色质结构与功能》),第3版,学术出版社,圣迭戈,1998;methodsinenzymology(《酶学方法》),第304卷,“chromatin(染色质)”(p.m.wassarman和a.p.wolffe编),学术出版社,圣迭戈,1999;和methodsinmolecularbiology(《分子生物学方法》),第119卷,“chromatin方案(染色质方法)”(p.b.becker编),托托瓦的休玛纳出版社(humanapress,totowa),1999。
定义
术语"核酸","多核苷酸"和"寡核苷酸"互换使用并指脱氧核糖核苷酸或核糖核甘酸聚合物,可以是直链或环状构型的,是单链或双链形式的。出于本公开目的,这些术语不意在限制聚合物的长度。所述术语可涵盖天然核苷酸的已知类似物,以及在碱基、糖和/或磷酸部分(例如,硫逐磷酸酯主链)经修饰的核苷酸。一般而言,具体核苷酸的类似物具有相同的碱基配对特异性;即,a的类似物将与t碱基配对。
术语“多肽”、“肽”和“蛋白质”在本文中可互换使用,指氨基酸残基的聚合物。该术语还应用于其中一种或多种氨基酸是对应的天然产生的氨基酸的化学类似物或经修饰的衍生物的氨基酸聚合物。
"结合"指大分子之间(例如蛋白质与核酸之间)的序列特异性、非共价相互作用。只要相互作用作为整体为序列特异性的,则不要求结合相互作用的所有组分都是序列特异性的(例如,与dna主链中的磷酸残基接触)。这样的相互作用通常表征为解离常数(kd)是10-6m-1或更低。“亲和性”指结合的强度:增加的结合亲和性与较低的kd关联。“非特异性结合”指不依赖于靶序列的发生在大分子(例如,dna)和感兴趣的任何分子(例如,工程改造的核酸酶)之间的非共价相互作用。
“dna结合分子”是能够结合dna的分子。这样的dna结合分子可以是多肽,蛋白质的结构域,较大蛋白质内的结构域,或多核苷酸。在一些实施方式中,多核苷酸是dna,而在其它实施方式中,多核苷酸是rna。在一些实施方式中,dna结合分子是核酸酶的蛋白质结构域(例如,foki结构域),而在其他实施方式中,dna结合分子是rna引导的核酸酶的向导rna成分(例如,cas9或cfp1)。
"结合蛋白"是能与另一分子非共价结合的蛋白质。结合蛋白能够结合至,例如,dna分子(dna结合蛋白)、rna分子(rna结合蛋白)和/或蛋白质分子(蛋白质结合蛋白)。在蛋白质结合蛋白的情况中,其可与自身结合(形成同型二聚体、同型三聚体等)和/或其可与一种或多种不同蛋白的一个或多个分子结合。结合蛋白可具有多于一种类型的结合活性。例如,锌指蛋白具有dna结合、rna结合和蛋白结合活性。
"锌指dna结合蛋白"(或结合结构域)是能以序列特异性方式通过一个或多个锌指结合dna的蛋白质或较大蛋白质内的结构域,锌指是通过锌离子配位稳定其结构的结合结构域内氨基酸序列的区域。术语锌指dna结合蛋白常缩写为锌指蛋白或zfp。术语“锌指核酸酶”包括一个zfn以及一对zfn(该对成员称为“左和右”或“第一和第二”或“对”),其二聚化以切割靶基因。
“taledna结合结构域”或“tale”是包含一种或多种tale重复结构域/单元的多肽。各自包含重复可变双残基(rvd)的重复结构域参与tale与其关联靶dna序列的结合。单个“重复单元”(也称作“重复”)通常长33-35个氨基酸,并且与天然产生的tale蛋白中的其它tale重复序列显示至少一些序列同源性。tale蛋白可经设计以利用重复单元内典型或非典型rvd来结合靶位点。参见例如,美国专利号8,586,526和9,458,205。术语“talen”包括一个talen以及一对talen(所述对的成员称为“左和右”或“第一和第二”或“对”),其二聚化以切割靶基因。
锌指和taledna结合结构域可以“经工程改造”以结合至预定的核苷酸序列,例如,通过对天然产生的锌指蛋白的识别螺旋区进行工程改造(改变一个或多个氨基酸)或通过对参与dna结合的氨基酸(重复可变双残基或rvd区)进行工程改造。因此,经工程改造的锌指蛋白或tale蛋白是非天然产生的蛋白质。用于工程改造锌指蛋白和tale的方法的非限制性示例是设计和选择。经设计的蛋白质是非天然产生的蛋白质,其设计/组成主要来自于合理标准。设计的合理标准包括应用替换规则和计算机算法来处理储存现有zfp或tale设计物(规范和非规范rvd)信息和结合数据的数据库中的信息。参见例如,美国专利号9,458,205;8,586,526;6,140,081;6,453,242;和6,534,261;也参见wo98/53058;wo98/53059;wo98/53060;wo02/016536和wo03/016496。
“选择的”锌指蛋白、tale蛋白或crispr/cas系统不存在于自然界中,其产生的结果主要来自经验过程,例如噬菌体展示、相互作用阱或杂交选择。参见例如,u.s.5,789,538;u.s.5,925,523;u.s.6,007,988;u.s.6,013,453;u.s.6,200,759;wo95/19431;wo96/06166;wo98/53057;wo98/54311;wo00/27878;wo01/60970;wo01/88197和wo02/099084。此外,crispr/cas系统的sgrna和tale蛋白(其在靶位点中结合的核苷酸和rvd之间通常展示一一对应)可以容易地设计成zfp结合的zfp靶位点。参见例如,美国专利号9,873,894和8,586,526。
“ttago”是原核阿尔古(argonaute)蛋白质,认为其参与基因沉默。ttago源自嗜热细菌(thermusthermophilus)。参见例如,swarts等,同上,g.sheng等,(2013)proc.natl.acad.sci.u.s.a.111,652)。“ttago系统”是所需的全部组分,包括例如,用于通过ttago酶切割的向导dna。
“重组”指两个多核苷酸之间交换遗传信息的过程。就本公开的目的而言,“同源重组(hr)”指发生这种交换的特定形式,例如在修复细胞内双链断裂期间通过同源导向修复机制发生。该过程要求核苷酸序列同源性,利用“供体”分子模板修复“靶”分子(即,经历双链断裂的分子),该过程也称作“非交叉基因转化”或“短道基因转化”,因为其导致遗传信息从供体向靶转移。不希望受限于任何特定理论,这种转移可以涉及断裂的靶与供体间形成的异双链体dna的错配校正,和/或采用供体再合成将成为部分靶的遗传信息的“合成依赖性链退火”,和/或相关过程。这种专门的hr通常导致靶分子序列的改变,从而供体多核苷酸的部分或全部序列被纳入靶多核苷酸中。
在本公开的方法中,本文所述的一种或多种靶向核酸酶在靶序列(例如,细胞染色质)中的预定位点(例如,感兴趣的基因或基因座)产生双链断裂(dsb),并且可以将与所述断裂区域中的核苷酸序列具有同源性的“供体”多核苷酸导入该细胞。已显示dsb的存在有助于供体序列的整合。任选地,该构建体与该断裂区域内的核苷酸序列具有同源性。供体序列可被物理整合(physicallyintegrated),或者,供体多核苷酸被用作模板用于通过同源重组进行的断裂修复,导致将供体中的全部或部分核苷酸序列引入细胞染色质。因此,细胞染色质中的第一序列可改变,并且在某些实施方式中,可转化成供体多核苷酸中存在的序列。因此,使用术语“替换”或“置换”可理解为表示一种核苷酸序列被另一种核苷酸序列替换(即,信息意义上序列的替换),而不一定要求一种多核苷酸被另一种多核苷酸物理或化学替换。
在本文描述的任何方法中,其它锌指蛋白对可用于细胞内其它靶位点的另外的双链切割。
在用于靶向重组和/或替代和/或改变细胞染色质内感兴趣区域的序列的方法的某些实施方式中,通过采用外源性“供体”核苷酸序列的同源重组来改变染色体序列。如果存在与断裂的区域同源的序列,那么所述同源重组被细胞染色质中存在的双链断裂的刺激。
在本文所述的任何方法中,第一核苷酸序列(“供体序列”可包含与感兴趣区域中的基因组序列同源但不相同的序列,由此刺激同源重组以在感兴趣区域插入非相同序列。因此,在某些实施方式中,供体序列中与感兴趣区域序列同源的部分呈现与待替换的基因组序列有约80-99%(或其间任意整数)的序列相同性。在其它实施方式中,供体和基因组序列间的同源性超过99%,例如,超过100个连续碱基对的基因组序列与供体之间相差仅1个核苷酸。在某些情况中,供体序列的非同源部分可包含不存在于感兴趣区域的序列,从而将新序列引入感兴趣区域。在这些情况中,非同源序列一般侧接50-1,000个碱基对(或其间的任何整数值)或大于1,000的任何数量个碱基对的序列,其与感兴趣区域中的序列同源或相同。在其它实施方式中,供体序列与第一序列非同源,并且通过非同源重组机制插入基因组。
本文所述的任意方法可用于通过能破坏感兴趣基因表达的供体序列的靶向整合来使细胞内的一种或多种靶序列部分或完全失活。还提供具有部分或完全失活基因的细胞系。
此外,本文所述的靶向整合方法也可用于整合一种或多种外源性序列。外源性核酸序列可包含,例如,一种或多种基因或cdna分子,或任何类型的编码或非编码序列,以及一种或多种控制元件(例如,启动子)。此外,外源性核酸序列可产生一种或多种rna分子(例如,小发夹rna(shrna),抑制性rna(rnai),微小rna(mirna)等)。
“切割”指dna分子共价主链的断裂。切割可以由多种方法引发,包括但不限于,磷酸二酯键的酶促或化学水解。单链切割和双链切割均可采用,并且双链切割可由不同的单链切割事件所致。dna切割可导致产生钝端或交错末端。在某些实施方式中,将融合多肽用于靶向双链dna切割。
“切割半结构域”是能与第二多肽(两者相同或不同)形成具有切割活性(优选双链切割活性)的复合物的多肽序列。术语“第一和第二切割半结构域”、“+和–切割半结构域”和“右和左切割半结构域”可互换使用,指二聚化的切割半结构域的对。
“工程改造的切割半结构域”是经修饰以与另一切割半结构域(例如,另一工程改造的切割半结构域)形成专性异二聚体的切割半结构域。还参见美国专利号7,888,121;7,914,796;8,034,598;8,623,618和美国专利公开号2011/0201055,其全文通过引用方式纳入本文。
术语“序列”指任意长度的核苷酸序列,可以是dna或rna;可以是直链、环状或支链且可以是单链或双链。术语“供体序列”指插入基因组的核苷酸序列。供体序列可以是任意长度,例如长度为2-10,000个核苷酸(或其间或其上的任意整数值),优选长度为100-1,000个核苷酸(或其间的任意整数),更优选长度为200-500个核苷酸。
“染色质”是包含细胞基因组的核蛋白结构。细胞染色质包含核酸和蛋白,核酸主要为dna,蛋白包括组蛋白和非组蛋白染色体蛋白。真核细胞染色质主要以核小体形式存在,其中核小体核心包含约150碱基对的dna与八聚体关联,所述八聚体包含组蛋白h2a、h2b、h3和h4各两份;以及在核小体核心之间延伸的接头dna(长度根据生物体而各有不同)。组蛋白h1分子通常与接头dna关联。就本公开的目的而言,术语“染色质”意在涵盖所有类型的细胞核蛋白,包括原核与真核的。细胞染色质包括染色体和附加体染色质。
“染色体”是包含细胞的全部或部分基因组的染色质复合物。细胞基因组通常由其核型表征,其为包含该细胞基因组的全部染色体的集合。细胞基因组可包含一条或多条染色体。
“附加体”是复制的核酸、核蛋白复合物或其它包含并非细胞染色体核型部分的核酸的结构。附加体的示例包括质粒和某些病毒基因组。
"靶位点"或"靶序列"是限定结合分子将结合的核酸部分的核酸序列,前提是存在结合的充分条件。例如,序列5'gaattc3'是ecori限制性内切核酸酶的靶位点。该术语包括任何序列的连续或非连续碱基对以及“配对的”靶位点(例如,针对zfn和/或talen的配对的靶位点,如本文所述)。核酸酶的一个或多个dna结合结构域(例如,zfp,tale,单向导rna)与其相应的靶位点结合后,可以在靶位点处或其附近的任何位置进行切割和修饰(例如,供体整合和/或插入缺失修饰),所述靶位点包括但不限于,位于通过dna结合结构域结合的序列内,配对的靶位点之间,和/或任何靶位点3'或5'的(例如,1-50个(包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25或更多个内)或多个碱基对附近。
“外源性”分子是通常不存在于细胞内的分子,但可通过一种或多种遗传、生化或其它方法导入细胞。“正常存在于细胞中”相对于细胞的具体发育阶段和环境条件确定。因此,例如,仅在肌肉的胚胎发育期间存在的分子对于成体肌肉细胞是外源性分子。类似地,相对于非热激的细胞,通过热激诱导的分子是外源性分子。例如,外源性分子可以包括功能失常的内源性分子的功能性形式或者正常功能的内源性分子的功能失常形式。
外源性分子可以是小分子或大分子等,小分子如由组合化学方法所产生,大分子如蛋白质、核酸、碳水化合物、脂质、糖蛋白、脂蛋白、多糖、上述分子的任何经修饰衍生物,或者是包含一种或多种上述分子的任何复合物。核酸包括dna和rna,其可以是单链或双链的;可以是直链、支链或环状的;并且可以具有任何长度。参见例如美国专利号no.8,703,489和9,255,259。核酸包括能够形成双链体的那些,以及形成三链体的核酸。参见,例如美国专利号5,176,996和5,422,251。蛋白质可包括但不限于,dna结合蛋白、转录因子、染色质重构因子、甲基化dna结合蛋白、聚合酶、甲基化酶、脱甲基酶、乙酰基转移酶、脱乙酰酶、激酶、磷酸酶、整合酶、重组酶、连接酶、拓扑异构酶、旋转酶和解旋酶。
外源性分子可以是与内源性分子同一类型的分子,例如外源性蛋白质或核酸。例如,外源性核酸可以包括感染性病毒基因组、引入细胞内的质粒或附加体,或包含通常不存在于细胞内的染色体。本领域技术人员已知将外源性分子导入细胞内的方法,包括但不限于脂质介导的转移(即脂质体,包括中性和阳离子脂质)、电转导、直接注射、细胞融合、粒子轰击、磷酸钙共沉淀、deae-葡聚糖介导的转移和病毒载体介导的转移。外源性分子也可以是与内源性分子相同类型但源自与该细胞来源不同物种的分子。例如,可将人核酸序列引入原始源自小鼠或仓鼠的细胞系。
相反,“内源性”分子是通常存在于特定环境条件下特定发育阶段的特定细胞中的分子。例如,内源性核酸可以包括染色体、线粒体基因组、叶绿体或其它细胞器,或天然产生的附加型核酸。其它内源性分子可包括蛋白质,例如,转录因子和酶。
“融合”分子是其中两个或更多个亚基分子相连(优选共价相连)的分子。亚基分子可以是相同化学类型的分子,也可以是不同化学类型的分子。第一类型的融合分子的示例可包括但不限于,融合蛋白(例如,zfp或taledna结合结构域与一种或多种活化结构域之间的融合)和融合核酸(例如,编码上文所述的融合蛋白的核酸)。第二类融合分子的示例包括但不限于:形成三链体的核酸与多肽之间的融合体,以及小沟结合子与核酸之间的融合体。该术语还包括其中多核苷酸组分与多肽组分相关联以形成功能性分子(例如,crispr/cas系统,其中单一向导rna与功能结构域相关联以调节基因表达)。
细胞内融合蛋白的表达可由融合蛋白递送入细胞造成或通过向细胞递送编码融合蛋白的多核苷酸而引起,其中所述多核苷酸被转录,转录本经翻译产生所述融合蛋白。细胞中蛋白质的表达也可涉及反式剪接、多肽切割和多肽连接。用于将多核苷酸和多肽递送至细胞的方法在本公开内容中的他处呈现。
就本公开的目的而言,“基因”包括编码基因产物(见前文)的dna区域,以及调节基因产物生成的dna区域,不论这类调节序列是否毗邻编码和/或转录序列。因此,基因包括但不必限于,启动子序列、终止子、翻译调节序列,例如核糖体结合位点和内部核糖体进入位点、增强子、沉默子、绝缘子、边界元件、复制起点、基质连接位点和基因座控制区域。
“安全港”基因座是基因组内的基因座,其中,可插入基因且对宿主细胞没有任何有害影响。其中插入的基因序列的表达没有被来自相邻基因的任何通读表达所扰乱的安全港基因座是最有益的。由核酸酶靶向的安全港基因座的非限制性示例包括:ccr5、ccr5、hprt、aavs1、rosa和白蛋白。参见例如,美国专利号8,771,985;8,110,379;7,951,925;美国专利公开号20100218264;20110265198;20130137104;20130122591;20130177983;20130177960;20150056705和20150159172)。
“基因表达”指将基因所含信息转化成基因产物。基因产物可以是基因的直接转录产物(例如,mrna、trna、rrna、反义rna、核糖酶、结构rna或任何其它类型的rna)或通过mrna翻译产生的蛋白质。基因产物还包括经修饰的rna,通过如下加工修饰,例如加帽、聚腺苷酸化、甲基化,和编辑,以及通过如下加工修饰的蛋白质,例如,甲基化、乙酰化、磷酸化、泛素化、adp-核糖基化、豆蔻酰化和糖基化。
基因表达的“调控”或“修饰”指基因活性的改变。表达的调控可包括但不限于:基因活化和基因遏制,包括通过结合外源性分子(例如,经工程改造的转录因子)进行基因修饰来实现。调节可通过基因组编辑(例如,切割、改变、失活、随机突变)对基因序列进行修饰来实现。基因失活(或灭活)指,相较于未经本文所述修饰的细胞,基因表达的任何减少。因此,基因失活可以是部分或完全的。
“感兴趣的区域”是需要结合外源性分子的细胞染色质的任意区域,例如,基因或者基因内或与之毗邻的非编码序列。结合可以是出于靶向dna切割和/或靶向重组的目的。感兴趣区域可以存在于例如染色体,附加体,细胞器基因组(例如,线粒体、叶绿体),或感染性病毒基因组中。感兴趣的区域可处于基因的编码区中,转录的非编码区域例如前导序列、尾随序列或内含子中,或非转录区域中编码区的上游或下游。感兴趣的区域可如单一核苷酸对一样小,或长达2,000个核苷酸对,或任意整数值的核苷酸对。
“真核”细胞可包括但不限于,真菌细胞(例如酵母)、植物细胞、动物细胞、哺乳动物细胞和人细胞(例如,t细胞)。
涉及两个或多个组件(例如序列元件)的并置,所述组件设置成组件都可正常发挥作用并允许组件中至少一种能介导施加于至少一种其它组件上的作用时,术语“操作性相连”和“操作性连接的”(或“操作地连接”)互换使用。例如,若转录调节序列控制编码序列响应一种或多种转录调节因子存在与否时的转录水平,则所述转录调节序列如启动子与所述编码序列操作性连接。转录调节序列一般与编码序列以顺式操作性地连接,但无需紧邻该序列。例如,增强子是操作性地连接编码序列的转录调节序列,尽管它们是不连续的。
对于融合多肽,术语“操作性连接”可指各组件在与其它组件的连接中所发挥的功能与其在未连接时的功能相同。例如,对于其中dna结合结构域(例如,zfp、tale)与活化结构域融合的融合多肽,如果在该融合多肽中,dna结合结构域部分能够结合其靶位点和/或其结合位点,同时所述活化结构域能够上调基因表达,那么所述dna结合结构域和活化结构域是操作性连接的。在其中dna结合结构域与切割结构域融合的融合多肽的情况中,如果在所述融合多肽中,dna结合结构域部分能结合其靶位点和/或其结合位点,同时切割结构域能切割靶位点附近的dna,那么所述dna结合结构域和切割结构域是操作性连接的。同理,对于其中dna结合结构域与活化或遏制结构域融合的融合多肽,如果在所述融合多肽中,dna结合结构域部分能够结合其靶位点和/或其结合位点,同时活化结构域能上调基因表达或遏制结构域能下调基因表达,那么所述dna结合结构域和活化或遏制结构域是操作性连接的。
蛋白质、多肽或核酸的“功能性片段(或功能片段)”是序列与全长蛋白质、多肽或核酸不相同但保留全长蛋白质、多肽或核酸的相同功能的蛋白质、多肽或核酸。功能性片段可具有比相应的天然分子更多、更少或相同数量的残基,和/或可含有1个或多个氨基酸或核苷酸取代。用于确定核酸功能(例如,编码功能、与另一核酸杂交的能力)的方法是本领域熟知的。类似地,用于确定蛋白质功能的方法也是为本领域熟知的。例如,可测定多肽的dna结合功能,例如通过滤膜结合、电泳迁移率改变或免疫沉淀试验。dna切割可通过凝胶电泳分析。参见ausubel等,同上。可测定蛋白质与另一蛋白质相互作用的能力,例如,通过共免疫沉淀、双杂交试验或互补分析,既可以是遗传的也可以是生化的。参见例如,fields等,(1989)nature340:245-246;美国专利号5,585,245和pctwo98/44350。
“载体”能将基因序列转移至靶细胞。“载体构建体”、“表达载体”和“基因转移载体”通常指能指导感兴趣基因表达并能将基因序列转移至靶细胞的核酸构建体。因此,该术语包括克隆和表达载体,以及整合载体。
“报告基因”或“报告序列”指的是产生这样蛋白质产物的任何序列,所述蛋白质产物容易被检测,其在常规试验中并非必需但是优选的。合适的报告基因包括但不限于,编码介导抗生素抗性(例如氨苄青霉素抗性,新霉素抗性,g418抗性,嘌呤霉素抗性)的蛋白质的序列,编码有色或荧光或发光蛋白(例如绿色荧光蛋白,增强型绿色荧光蛋白,红色荧光蛋白,荧光素酶)的序列,和介导增强的细胞生长和/或基因扩增的蛋白质(例如,二氢叶酸还原酶)。表位标签包括,例如,一个或多个拷贝的flag、his、myc、tap、ha或任何可检测的氨基酸序列。“表达标签”包括编码可操作性地连接至所需基因序列以监测感兴趣的基因的表达的报告物的序列。
术语“对象”和“患者”可以互换使用,并且表示哺乳动物例如人类患者和非人类灵长类,以及实验室动物例如兔、狗、猫、大鼠、小鼠和其他动物。因此,本文所用术语“对象”或“患者”表示可给予本发明表达盒的任何哺乳动物患者或对象。本发明的对象包括患有病症的那些或处于发展病症的风险中的那些。
本文所用的术语“治疗”和“处理”指减少症状的严重性和/或频率、消除症状和/或根本原因、预防症状的发生和/或它们的根本原因、以及改善或消除损伤。癌症和移植物抗宿主疾病是可以使用本文所述组合物和方法治疗的病症的非限制性示例。因此,“处理”和“治疗”包括:
(i)预防所述疾病或病症在哺乳动物中发生,具体是在所述哺乳动物倾向于患上该病症但尚未诊断患有该病症时;
(ii)抑制该疾病或病症,即阻止其发展;
(iii)减轻该疾病或病症,即,使该疾病或病症消退;或
(iv)减轻由该疾病或病症所致的症状,即,减轻痛苦但不解决潜在的疾病或病症。
本文中所用术语“疾病”和“病症”可互换使用,或可不同,其中具体的疾病或病症可不具有已知的致病物(从而病因尚不知晓),因此其尚未被视作疾病而仅仅是作用不希望的病症或综合征,其中由临床医师或多或少地鉴定出了具体的一组症状。
“药物组合物”指一种制剂,其具有本发明的化合物和本领域通常接受的用于将生物活性化合物递送到哺乳动物(例如,人)的介质。这样的介质包括药学上可接受的运载体、稀释剂或赋形剂等等。
“有效量”或“治疗有效量”指:本发明化合物的一定量,当将其给予哺乳动物,优选人类时,足以提供对于该哺乳动物(优选人类)的有效治疗。构成“治疗有效量”的本发明化合物的量将根据化合物、病症及其严重性、给予方式,以及待治疗的哺乳动物的年龄而变化,但可由本领域技术人员根据其所掌握的知识和本发明内容来常规地确定。
dna结合结构域
本文描述包含dna结合结构域的组合物,所述dna结合结构域特异性地结合包含hla基因或hla调控子的任何基因,或tcr基因,免疫检查点基因(例如,cish,pd1,ctla-4等)和/或其他基因(例如,安全港)中的靶位点。本文公开的方法和组合物中可以使用任何dna结合结构域,包括但不限于,锌指dna结合结构域,taledna结合结构域,crispr/cas核酸酶的dna结合部分(sgrna),或来自兆核酸酶(meganuclease)的dna结合结构域。dna结合结构域可结合基因内的任何靶序列,包括但不限于,本文公开的任何靶位点所示的12或更多个核苷酸的靶序列(例如,表1所述12-20或更多个连续或非连续碱基对的靶位点)。在某些实施方式中,dna结合结构域(以序列特异性方式)结合tcr基因或tcr调节基因中的靶位点并调节tcr基因的表达。在一些实施方式中,dna结合结构域结合至tcra中的靶位点,而在其它实施方式中,锌指结合至trbc中的靶位点。在其它实施方式中,dna结合结构域以序列特异性方式结合至b2m基因中的靶位点并调节b2m基因的表达。在其他实施方式中,dna结合结构域以序列特异性方法结合至免疫检查点基因,如cish(例如,表1所示的靶位点)或pd1基因(例如,美国专利号8,563,314中所示的靶位点)。多个dna结合结构域(结合至相同或不同基因)可以一起使用,用于同时修饰多个基因(例如,经由多个核酸酶介导的敲除和/或供体的靶向整合的多重化)。
在某些实施方式中,dna结合结构域包含锌指蛋白。优选地,该锌指蛋白是非天然产生的,其中它经工程改造以结合至所选的靶位点。参见例如,beerli等(2002)naturebiotechnol.20:135-141;pabo等(2001)ann.rev.biochem.70:313-340;isalan等(2001)naturebiotechnol.19:656-660;segal等(2001)curr.opin.biotechnol.12:632-637;choo等(2000)curr.opin.struct.biol.10:411-416;美国专利号6,453,242;6,534,261;6,599,692;6,503,717;6,689,558;7,030,215;6,794,136;7,067,317;7,262,054;7,070,934;7,361,635;7,253,273;和美国专利公开号2005/0064474;2007/0218528;2005/0267061,其均通过引用其全文纳入本文。
与天然产生的锌指蛋白相比,经工程改造的锌指结合结构域可具有新结合特异性。工程改造方法包括但不限于合理设计和不同选择类型。例如,合理设计包括利用包含三体(或四体)核苷酸序列和单独锌指氨基酸序列的数据库,其中各三体或四体核苷酸序列与一种或多种结合该特定三体或四体序列的锌指氨基酸序列相关联。参见,例如,美国专利6,453,242和6,534,261,通过引用其全文纳入本文。
示例性选择方法包括噬菌体展示和双杂交系统,公开于美国专利5,789,538、5,925,523、6,007,988、6,013,453、6,410,248、6,140,466、6,200,759和6,242,568;以及wo98/37186、wo98/53057、wo00/27878、wo01/88197和gb2,338,237。此外,例如在美国专利号6,794,136中描述了对锌指结合结构域的结合特异性的增强。
此外,如这些及其它参考文献中所公开的,锌指结构域和/或多指的锌指蛋白可利用任何合适的接头序列连接在一起,包括例如长度为5个或更多个氨基酸的接头。长度为6或更多个氨基酸的示例性接头序列还参见例如美国专利号6,479,626、6,903,185和7,153,949。本文所述的蛋白质可包括蛋白质的个体锌指之间的合适接头的任何组合。此外,例如在美国专利号6,794,136中描述了对锌指结合结构域的结合特异性的增强。
靶位点选择;用于设计和构建融合蛋白(及其编码多核苷酸)的zfp和方法是本领域技术人员已知的,并且详细描述于美国专利号6,140,081;5,789,538;6,453,242;6,534,261;5,925,523;6,007,988;6,013,453;6,200,759;wo95/19431;wo96/06166;wo98/53057;wo98/54311;wo00/27878;wo01/60970wo01/88197;wo02/099084;wo98/53058;wo98/53059;wo98/53060;wo02/016536和wo03/016496。
在某些实施方式中,dna结合结构域是经工程改造的锌指蛋白,其(以序列特异性方式)结合tcr基因或tcr调控基因中的靶位点并调控tcr基因表达。在一些实施方式中,锌指蛋白结合至tcra中的靶位点,而在其它实施方式中,锌指结合至trbc中的靶位点。在其它实施方式中,dna结合结构域是经工程改造的锌指蛋白,其以序列特异性方式结合至b2m基因中的靶位点并调节b2m基因的表达。在其他实施方式中,dna结合结构域以序列特异性方式结合至免疫检查点基因,如cish或pd1基因。
zfp通常包括至少三个指。某些zfp包括四个、五个或六个指。包括三个指的zfp通常识别包括9或10个核苷酸的靶位点;包括四个指的zfp通常识别包括12-14个核苷酸的靶位点;而具有六个指的zfp能识别包括18-21个核苷酸的靶位点。zfp也可以是包括一个或多个调节结构域的融合蛋白,所述结构域可以是转录活化或阻遏结构域。zfp还可以包含对主链区的修饰,如美国专利公开号20180087072中所述。
在一些实施方式中,dna结合结构域可衍生自核酸酶。例如,归巢内切核酸酶和兆核酸酶的识别序列例如i-scei、i-ceui、pi-pspi、pi-sce、i-sceiv、i-csmi、i-pani、i-sceii、i-ppoi、i-sceiii、i-crei、i-tevi、i-tevii和i-teviii是已知的。还可参见美国专利号5,420,032;美国专利号6,833,252;belfort等.(1997)nucleicacidsres.25:3379-3388;dujon等.(1989)gene82:115-118;perler等.(1994)nucleicacidsres.22,1125-1127;jasin(1996)trendsgenet.12:224-228;gimble等.(1996)j.mol.biol.263:163-180;argast等.(1998)j.mol.biol.280:345-353和新英格兰生物实验室公司(newenglandbiolabs)产品目录。此外,归巢内切核酸酶和兆核酸酶的dna结合特异性可被工程改造以结合非天然靶位点。参见例如,chevalier等(2002)molec.cell10:895-905;epinat等(2003)nucleicacidsres.31:2952-2962;ashworth等(2006)nature441:656-659;paques等(2007)currentgenetherapy7:49-66;美国专利公开号20070117128。
在其它实施方式中,dna结合结构域包括来自tal效应物的工程改造的结构域,其类似于源自植物病原体黄单胞菌(xanthomonas)的那些(参见boch等,(2009)science326:1509-1512和moscou与bogdanove,(2009)science326:1501)和ralstonia(参见heuer等(2007)appliedandenvironmentalmicrobiology73(13):4379-4384);美国专利公开号20110301073和20110145940。已知黄单胞菌属(xanthomonas)的植物病原菌在重要农作物中导致很多疾病。黄单胞菌属的病原性取决于保守的iii型分泌(t3s)系统,该系统向植物细胞内注入超过25种不同的效应物蛋白。这些注射的蛋白质包括模仿植物转录活化剂并操纵植物转录组的转录活化剂样效应物(tale)(参见kay等,(2007)science318:648-651)。这些蛋白质含有dna结合结构域和转录活化结构域。最为充分表征的tale之一是来自野油菜黄单胞菌辣椒斑点病致病变种(xanthomonascampestrispv.vesicatoria)的avrbs3(参见bonas等(1989)molgengenet218:127-136和wo2010079430)。tale含有串联重复的集中化结构域,各重复含有约34个氨基酸,它们是这些蛋白质的dna结合特异性的关键。此外,它们含有核定位序列和酸性转录激活结构域(综述参见schornacks等(2006)jplantphysiol163(3):256-272)。此外,已发现在致植物病细菌烟草青枯菌(ralstoniasolanacearum)中称为brg11和hpx17的两个基因与烟草青枯菌生物变型(biovar)1菌株gmi1000和生物变型4菌株rs1000中的avrbs3家族同源(参见heuer等(2007)applandenvirmicro73(13):4379-4384)。这些基因在核苷酸序列上彼此具有98.9%的同一性,但区别为hpx17重复结构域中的1,575bp缺失。然而,两种基因产物均与黄单胞菌属的avrbs3家族蛋白质具有低于40%序列相同性。
这些tal效应物的特异性取决于串联重复中存在的序列。重复序列包含约102个碱基对,且重复彼此间通常91-100%同源(bonas等,同上)。重复的多态性通常位于12和13位,并且似乎在位置12和13的高可变双残基(重复可变双残基或rvd区域)的种类与tal效应物靶序列中连续核苷酸的种类之间存在一一对应(参见moscou和bogdanove,(2009)science326:1501以及boch等(2009)science326:1509-1512)。实验上,已确定用于这些tal效应物dna识别的天然编码,因此位于位置12与13的hd序列(重复可变双残基或rvd)导致对于胞嘧啶(c)的结合,ng结合至t,ni结合至a、c、g或t,nn结合至a或g,且ing结合至t。这些dna结合重复已被装配在具有新的重复组合与数量的蛋白质中,产生能在植物细胞中与新序列相互作用并激活非内源性报告基因的表达的人工转录因子(boch等,同上)。已将经工程改造的tal蛋白连接至foki切割半结构域,以产生tal效应物结构域核酸酶融合体(talen),包括具有非典型rvd的talen。参见例如,美国专利号8,586,526。
在一些实施方式中,talen包括内切核酸酶(例如,foki)切割结构域或切割半结构域。在其它实施方式中,tale-核酸酶是兆tal。这些兆tal核酸酶是包含taledna结合结构域和兆核酸酶切割结构域的融合蛋白。兆核酸酶切割结构域作为单体具有活性,且不需要二聚化获得活性。(参见boissel等,(2013)nuclacidres:1-13,doi:10.1093/nar/gkt1224)。
在另一实施方式中,核酸酶包括紧凑型(compact)talen。存在单链融合蛋白,其将taledna结合结构域与tevi核酸酶结构域相连。该融合蛋白可以作为通过tale区域定位的切口酶,或可以产生双链断裂,这取决于该taledna结合结构域相对于tevi核酸酶结构域所位于的位置(参见beurdeley等(2013)natcomm:41762doi:10.1038/ncomms2782)。此外,核酸酶结构域还可显示dna结合功能性。任何talen都可与其它talen联用,例如,一种或多种talen(ctalen或foki-talen)与一种或多种兆tale。
此外,如这些及其它参考文献中所公开的,锌指结构域和/或多指的锌指蛋白或tale可利用任何合适的接头序列(包括例如长度为5或更多个氨基酸的接头)连接在一起。长度为6或更多个氨基酸的示例性接头序列还参见例如美国专利号6,479,626、6,903,185和7,153,949。本文所述的蛋白质可包括蛋白质的个体锌指之间的合适接头的任何组合。此外,例如在美国专利号6,794,136中描述了对锌指结合结构域的结合特异性的增强。
在某些实施方式中,dna结合结构域是crispr/cas核酸酶系统的部分,包括与dna结合的单向导rna(sgrna)。参见例如,美国专利号9,873,894;和8,697,359美国专利公开号20150159172。编码该系统rna组分的crispr(规律成簇的间隔短回文重复)基因座以及编码蛋白质的cas(crispr-相关)基因座(jansen等,2002.mol.microbiol.43:1565-1575;makarova等,2002.nucleicacidsres.30:482-496;makarova等,2006.biol.direct1:7;haft等,2005.ploscomput.biol.1:e60)组成了crispr/cas核酸酶系统的基因序列。微生物宿主中的crispr基因座包含crispr-相关(cas)基因以及能够对crispr介导的核酸切割的特异性进行编程的非编码rna元件的组合。
ii型crispr是最充分表征的系统之一,并且以4个连续步骤进行靶向dna双链断裂。首先,从crispr基因座转录两个非编码rna:前-crrna阵列和tracrrna。第二,tracrrna杂交至前-crrna的重复区域,并且介导从前-crrna到含个体间隔子序列的成熟crrna的过程。第三,成熟的crrna:tracrrna复合物通过沃森-克里克碱基配对将功能结构域(例如,核酸酶,如cas)引导至靶dna,其位于crrna上的间隔子和靶dna上的原型间隔子之间,所述靶dna在原型间隔子邻近基序(protospaceradjacentmotif,pam)旁,其为靶向识别的附加要求。最后,cas9介导靶dna的切割,以在原型间隔子内产生双链断裂。crispr/cas系统活性包括3步:(i)通过称作“适应(adaptation)”的过程将外来dna序列插入crispr阵列,以防止未来的攻击,(ii)表达相关蛋白质,以及表达和处理所述阵列,然后(iii)采用外来(alien)核酸进行rna介导的干扰。因此,在细菌细胞中,多个所谓的“cas”蛋白参与crispr/cas系统的自然功能,并且在多种功能中发挥作用(例如外来dna的插入等)。
在某些实施方式中,cas蛋白可为天然产生的cas蛋白的“功能性衍生物”。天然序列多肽的“功能性衍生物”是与天然序列多肽具有共同定性生物性质的化合物。“功能性衍生物”包括但不限于天然序列的片段或天然序列多肽的衍生物及其片段,前提是它们与相应的天然序列多肽具有共同的生物活性。本文设想的生物活性是功能性衍生物将dna底物水解成片段的能力。术语“衍生物”包括多肽的氨基酸序列变体,共价修饰物,和其融合体,例如衍生的cas蛋白。cas多肽的合适衍生物或其片段包括但不限于cas蛋白的突变体、融合体、共价修饰形式或其片段。包括cas蛋白或其片段的cas蛋白以及cas蛋白或其片段的衍生物可获自细胞或通过化学合成或通过这两种方法的组合获得。所述细胞可以是天然产生cas蛋白的细胞,或天然产生cas蛋白并经遗传工程改造的细胞,所述遗传工程改造使所述细胞以较高表达水平产生内源性cas蛋白或从外源引入的核酸产生cas蛋白,其中所述核酸编码与内源性cas相同或不同的cas。在一些情况中,细胞天然不产生cas蛋白,但是经遗传工程改造以产生cas蛋白。在一些实施方式中,cas蛋白是小cas9直向同源物,用于经aav载体的递送(ran等(2015)nature510,p.186)。因此,dna结合结构域可以包含sgrna,其结合靶向位点或表1中所示的至少9个核苷酸。
在一些实施方式中,dna结合结构域是ttago系统的部分(参见,swarts等,如上;sheng等,如上)。在真核细胞中,基因沉默通过阿尔古(argonaute,ago)家族的蛋白介导。在该范例中,ago与小(19-31nt)rna结合。该蛋白质-rna沉默复合物通过小rna与靶标之间的沃森-克里克碱基配对识别靶rna,并且通过内切核酸裂解活性切割靶rna(vogel(2014)science344:972-973)。相反,原核ago蛋白与小单链dna片段结合,并且可能作用于检测并移除外源(通常是病毒)dna(yuan等,(2005)mol.cell19,405;olovnikov,等(2013)mol.cell51,594;swarts等,同上)。示例性的原核ago蛋白包括:来自超嗜热菌(aquifexaeolicus)、类球红细菌(rhodobactersphaeroides)和嗜热栖热菌(thermusthermophilus)的那些。
最为充分表征的原核ago蛋白之一是来自嗜热栖热菌(t.thermophilus)的其中一种(ttago;swarts等,同上)。ttago与具有5'磷酸基团的15nt或13-25nt单链dna片段关联。被ttago结合的该“向导dna”可用于引导该蛋白质-dna复合物结合第三方(third-party)dna分子中的沃森-克里克互补dna序列。一旦这些向导dna中的序列信息允许鉴定靶dna,ttago-向导dna复合物即能切割该靶dna。在与其靶dna结合时,这样的机制还被ttago-向导dna复合物的结构支持(g.sheng等,同上)。来自类球红细菌的ago(rsago)具有相似的性质(olivnikov等,同上)。
任意dna序列的外源性向导dna可以被加载到ttago蛋白上(swarts等,同上)。因为ttago切割的特异性由向导dna引导,所以与外源性研究物特异性的(investigator-specified)向导dna形成的ttago-dna复合物将引导ttago靶dna切割至互补性研究物特异性的靶dna。由此,人们可在dna中生成靶向的双链断裂。ttago-向导dna系统(或来自其它生物体的直系同源ago-向导dna系统)的应用允许细胞内基因组dna的靶向切割。这样的切割可以是单链的或双链的。对于哺乳动物基因组dna的切割,优选应用针对哺乳动物细胞中表达进行优化的ttago密码子形式。此外,可优选用体外形成的ttago-dna复合物处理细胞,其中ttago蛋白融合至细胞穿透肽。并且,可优选应用已通过诱变而被改变的tgago蛋白的形式以在37℃具有增强的活性。ago-rna介导的dna切割可用于影响结果的全面多重性(panopoly),包括基因敲除,靶向基因添加,基因校正,靶向基因缺失,使用本领域标准的利用dna断裂的技术。因此,任何dna结合结构域可以用于结合和/或修饰(例如,经由插入和/或缺失调节表达和/或遗传修饰)本文所述的细胞。在某些实施方式中,导致靶基因修饰的分子的dna结合结构域结合至靶位点,所述靶位点包含表1中所示靶位点的至少9个核苷酸。
融合分子
还提供融合分子,所述融合分子包含与异源性调节(功能)结构域(或其功能性片段)相关联的本文所述的dna结合结构域(例如,zfp或tale,crispr/cas组分,例如单向导rna)。常见结构域包括,例如,转录因子结构域(活化剂,阻遏物,共活化剂,共阻遏物),沉默子,癌基因(例如myc,jun,fos,myb,max,mad,rel,ets,bcl,myb,mos家族成员等);dna修复酶及其相关因子和修饰物;dna重排酶及其相关因子和修饰物;染色质相关蛋白质及其修饰物(例如激酶,乙酰酶和脱乙酰酶);和dna修饰酶(例如甲基转移酶,拓扑异构酶,解旋酶,连接酶,激酶,磷酸酶,聚合酶,核酸内切酶)及其相关因子和修饰物。此类融合分子包括转录因子,其包含本文所述dna结合结构域和转录调节结构域,以及核酸酶,其包含dna结合结构域和一个或多个核酸酶结构域。
用于实现活化的合适结构域(转录激活结构域)包括hsvvp16活化结构域(参见例如,hagmann等,j.virol.71,5952-5962(1997)),核激素受体(参见例如,torchia等,curr.opin.cell.biol.10:373-383(1998));核因子κb的p65亚基(bitko和barik,j.virol.72:5610-5618(1998)和doyle与hunt,neuroreport8:2937-2942(1997));liu等,cancergenether.5:3-28(1998)),或人工嵌合功能结构域,例如vp64(beerli等,(1998)proc.natl.acad.sci.usa95:14623-33),和降解决定子(degron)(molinari等,(1999)emboj.18,6439-6447)。额外的示例性活化结构域包括,oct1,oct-2a,sp1,ap-2和ctf1(seipel等.,emboj.11,4961-4968(1992)以及p300,cbp,pcaf,src1pvalf,athd2a和erf-2。参见例如robyr等.(2000)mol.endocrinol.14:329-347;collingwood等.(1999)j.mol.endocrinol.23:255-275;leo等.(2000)gene245:1-11;manteuffel-cymborowska(1999)actabiochim.pol.46:77-89;mckenna等.(1999)j.steroidbiochem.mol.biol.69:3-12;malik等.(2000)trendsbiochem.sci.25:277-283;和lemon等.(1999)curr.opin.genet.dev.9:499-504。其它示例性活化结构域包括但不限于,osgai,half-1,c1,ap1,arf-5,-6,-7和-8,cprf1,cprf4,myc-rp/gp,和trab1。参见例如,ogawa等.(2000)gene245:21-29;okanami等.(1996)genescells1:87-99;goff等.(1991)genesdev.5:298-309;cho等.(1999)plantmol.biol.40:419-429;ulmason等.(1999)proc.natl.acad.sci.usa96:5844-5849;sprenger-haussels等.(2000)plantj.22:1-8;gong等.(1999)plantmol.biol.41:33-44;和hobo等.(1999)proc.natl.acad.sci.usa96:15,348-15,353。
本领域技术人员应明了,在dna结合结构域与功能结构域之间的融合蛋白(或编码相同内容的核酸)的形成中,活化结构域或与活化结构域相互作用的分子适于作为功能结构域。基本上,能够招募活化复合物和/或活化活性(例如,组蛋白乙酰化)至靶基因的任何分子均可用作融合蛋白的活化结构域。适用作融合分子中的功能结构域的绝缘子结构域、定位结构域和染色质重构蛋白(如含iswi的结构域和/或甲基结合结构域的蛋白质)描述于,例如,美国专利号7,053,264。
示例性的阻遏结构域包括但不限于,kraba/b,kox,tgf-β-诱导型早期基因(tieg),v-erba,sid,mbd2,mbd3,dnmt家族成员(例如,dnmt1,dnmt3a,dnmt3b),rb和mecp2。参见例如,bird等.(1999)cell99:451-454;tyler等.(1999)cell99:443-446;knoepfler等.(1999)cell99:447-450;和robertson等.(2000)naturegenet.25:338-342。其它示例性阻遏结构域包括但不限于rom2和athd2a。参见例如,chem等.(1996)plantcell8:305-321;和wu等.(2000)plantj.22:19-27。
通过本领域技术人员熟知的克隆和生物化学偶联方法构建融合分子。融合分子包括dna结合结构域(例如,zfp、tale、sgrna),其与功能结构域(例如,转录活化或遏制结构域)相关联。融合分子还任选地包含核定位信号(例如,来自sv40介质t-抗原)和表位标签(例如,flag和血细胞凝集素)。设计融合蛋白(及其编码核酸),从而翻译阅读框保留于融合体的组分间。
一方面的功能结构域(或其功能性片段)的多肽组分与另一方面的非蛋白质dna结合结构域(例如抗生素,嵌入剂,小沟结合物,核酸)之间的融合体通过本领域技术人员已知的生化偶联方法来构建。参见例如,皮尔斯化学公司(piercechemicalcompan)(伊利诺伊州罗克福德)产品目录。已描述用于生成小沟结合剂与多肽之间的融合的方法和组合物。mapp等.(2000)proc.natl.acad.sci.usa97:3930-3935。此外,crispr/cas系统的单一向导rna与功能结构域相关联,以形成活性转录调节剂和核酸酶。
在某些实施方式中,靶位点存在于细胞染色质的可及区域中。可及区域可以如例如美国专利号7,217,509和7,923,542所述确定。如果靶位点不存在于细胞染色质的可及区域中,则可按美国专利号7,785,792和8,071,370所述产生一个或多个可及区域。在其它实施方式中,融合分子的dna结合结构域能够结合至细胞染色质,无论其靶位点是否位于可及区域中。例如,所述dna结合结构域能够结合至接头dna和/或核小体dna。该类型的“先驱”dna结合结构域的示例可见于某些类固醇受体和肝细胞核因子3(hnf3)(cordingley等(1987)cell48:261-270;pina等(1990)cell60:719-731;和cirillo等(1998)emboj.17:244-254)。
融合分子可用药学上可接受的运载体/载剂配制,如本领域技术人员已知。参见例如《雷明顿药物科学》(remington'spharmaceuticalsciences),第17版,1985;和美国专利号6,453,242和6,534,261。
融合分子的功能性组分/结构域可选自任何多种不同的组分,一旦该融合分子通过其dna结合结构域结合至靶序列,所述组分即能影响基因转录。因此,功能性组分可包括但不限于,各种转录因子结构域,例如活化物、阻遏物、共活化物、共阻遏物,和沉默子。
例如,美国专利号6,534,261和6,933,113中公开了其它示例性功能结构域。
还可选择通过外源性小分子或配体调节的功能结构域。例如,可采用
核酸酶
在某些实施方式中,融合分子包括与切割(核酸酶)结构域相关联的dna结合型结合结构域。如此,基因修饰可采用核酸酶,例如经工程改造的核酸酶来实现。经工程改造的核酸酶技术基于对天然产生的dna结合蛋白的工程改造。例如,已描述了具有调整的dna结合特异性的归巢内切核酸酶的工程改造。chames等.(2005)nucleicacidsres33(20):e178;arnould等.(2006)j.mol.biol.355:443-458。此外,zfp的工程改造已有描述。例如,参见美国专利号6,534,261;6,607,882;6,824,978;6,979,539;6,933,113;7,163,824;和7,013,219。
此外,zfp和/或tale可融合至核酸酶结构域,以产生zfn和talen,其为一种功能性实体,该功能性实体能够通过其经工程改造的(zfp或tale)dna结合结构域识别其意图针对的核酸靶标,并通过核酸酶活性在dna结合位点附近切割该dna。
因此,本文所述的方法和组合物应用面广,并且可涉及任何感兴趣的核酸酶。核酸酶的非限制性示例包括兆核酸酶、talen和锌指核酸酶。核酸酶可包含异源性dna结合结构域和切割结构域(例如,锌指核酸酶;具有异源性切割结构域的兆核酸酶dna结合结构域),或者替代地,天然产生的核酸酶的dna结合结构域可被改变以结合至选择的靶位点(例如,已经工程改造以结合不同于关联结合位点的位点的兆核酸酶)。
在本文所述的任何核酸酶中,核酸酶可包含经工程改造的taledna结合结构域和核酸酶结构域(例如,内切核酸酶和/或兆核酸酶结构域),也称为talen。已经公开了用于工程改造这些talen蛋白从而与用户选择的靶序列稳健且位点特异性地相互作用的方法和组合物(参见,美国专利号8,586,526)。在一些实施方式中,talen包括内切核酸酶(例如,foki)切割结构域或切割半结构域。在其它实施方式中,tale-核酸酶是兆tal。这些兆tal核酸酶包含taledna结合结构域和兆核酸酶切割结构域的融合蛋白。兆核酸酶切割结构域作为单体具有活性,且不需要二聚化获得活性。(参见boissel等,(2013)nuclacidres:1-13,doi:10.1093/nar/gkt1224)。此外,核酸酶结构域还可具有dna结合功能性。
在另一实施方式中,核酸酶包括紧凑型talen(ctalen)。存在单链融合蛋白,其将taledna结合结构域与tevi核酸酶结构域相连。该融合蛋白可以作为通过tale区域定位的切口酶,或可以产生双链断裂,这取决于该taledna结合结构域相对于tevi核酸酶结构域所位于的位置(参见beurdeley等(2013)natcomm:1-8doi:10.1038/ncomms2782)。任何talen都可与其它talen(例如,一种或多种talen(ctalen或foki-talen)和一种或多种兆tal)或其它dna切割酶联用。
在其它实施方式中,核酸酶包括显示切割活性的兆核酸酶(归巢内切核酸酶)或其部分。天然产生的兆核酸酶识别15-40碱基对的切割位点,并且通常分为四个家族:laglidadg家族(“laglidadg”,公开为seqidno:63)、giy-yig家族、his-cyst盒家族和hnh家族。示例性归巢核酸内切酶包括i-scei、i-ceui、pi-pspi、pi-sce、i-sceiv、i-csmi、i-pani、i-sceii、i-ppoi、i-sceiii、i-crei、i-tevi、i-tevii和i-teviii。其识别序列是已知的。还可参见美国专利号5,420,032;美国专利号6,833,252;belfort等.(1997)nucleicacidsres.25:3379-3388;dujon等.(1989)gene82:115-118;perler等.(1994)nucleicacidsres.22,1125-1127;jasin(1996)trendsgenet.12:224-228;gimble等.(1996)j.mol.biol.263:163-180;argast等.(1998)j.mol.biol.280:345-353和新英格兰生物实验室公司(newenglandbiolabs)产品目录。
来自天然产生的兆核酸酶、主要来自laglidadg家族(“laglidadg”,公开为seqidno:63)的dna结合结构域已被用于在植物、酵母、果蝇、哺乳动物细胞和小鼠中促进位点特异性基因组修饰,但该方法仅限于保留兆核酸酶识别序列的同源基因的修饰(monet等(1999),biochem.biophysics.res.common.255:88-93)或限于其中已引入识别序列的经预先工程改造的基因组(route等(1994),mol.cell.biol.14:8096-106;chilton等(2003),plantphysiology.133:956-65;puchta等(1996),proc.natl.acad.sci.usa93:5055-60;rong等(2002),genesdev.16:1568-81;gouble等(2006),j.genemed.8(5):616-622)。因此,人们已尝试工程改造兆核酸酶,使其在医学或生物技术相关位点显示新结合特异性(porteus等(2005),nat.biotechnol.23:967-73;sussman等(2004),j.mol.biol.342:31-41;epinat等(2003),nucleicacidsres.31:2952-62;chevalier等(2002)molec.cell10:895-905;epinat等(2003)nucleicacidsres.31:2952-2962;ashworth等(2006)nature441:656-659;paques等(2007)currentgenetherapy7:49-66;美国专利公开号20070117128;20060206949;20060153826;20060078552;和20040002092)。此外,天然产生或经工程改造的来自兆核酸酶的dna结合结构域可以操作性地连接来自异源性核酸酶(例如,foki)的切割结构域,和/或,来自兆核酸酶的切割结构域可操作性地连接异源性dna结合结构域(例如,zfp或tale)。
在其它实施方式中,核酸酶是锌指核酸酶(zfn)或taledna结合结构域-核酸酶融合体(talen)。zfn和talen包括dna结合结构域(锌指蛋白或taledna结合结构域),其经工程改造以结合至所选基因和切割结构域或切割半结构域(例如,来自如本文所述的限制和/或兆核酸酶)中的靶位点。
如上详述,锌指结合结构域和taledna结合结构域可经工程改造以结合所选序列。参见例如,beerli等(2002)naturebiotechnol.20:135-141;pabo等(2001)ann.rev.biochem.70:313-340;isalan等(2001)naturebiotechnol.19:656-660;segal等(2001)curr.opin.biotechnol.12:632-637;choo等(2000)curr.opin.struct.biol.10:411-416。与天然产生的锌指蛋白相比,经工程改造的锌指结合结构域或tale蛋白可具有新结合特异性。工程改造方法包括但不限于合理设计和不同选择类型。合理设计包括,例如,利用包含三体(或四体)核苷酸序列和个体锌指或tale氨基酸序列的数据库,其中各三体或四体核苷酸序列与结合该特定三体或四体序列的锌指或tale重复单元的一个或多个氨基酸序列相关联。参见,例如,美国专利6,453,242和6,534,261,通过引用其全文纳入本文。
靶位点的选择;和用于设计和构建融合蛋白(以及编码相同内容的多核苷酸)的方法是本领域技术人员已知的并详述于美国专利号7,888,121和8,409,861中,两者通过引用其全文的方式纳入本文。
此外,如这些和其它参考文献中所公开的,锌指结构域、tale和/或多指的锌指蛋白可利用任何合适的接头序列(包括例如长度为5或更多个氨基酸的接头)连接在一起。长度为6或更多个氨基酸的示例性接头序列参见例如美国专利号6,479,626、6,903,185和7,153,949。本文所述的蛋白质可包括蛋白质的个体锌指之间的合适接头的任何组合。还可参见美国专利号8,772,453。
因此,核酸酶(如zfn、talen和/或兆核酸酶)可包括任何dna结合结构域和任何核酸酶(切割)结构域(切割结构域,切割半结构域)。如上所述,切割结构域相对于dna结合结构域可以是异源的,例如,锌指或tal效应物dna结合结构域和来自某一核酸酶的切割结构域,或兆核酸酶dna结合域和来自另一不同核酸酶的切割结构域。异源切割结构域可获自任何内切核酸酶或外切核酸酶。可衍生出切割结构域的示范性核酸内切核酸酶,包括但不限于限制性内切核酸酶和归巢内切核酸酶。参见例如,马萨诸塞州贝弗利(beverly,ma)的neb公司的2002-2003产品目录;和belfort等(1997)nucleicacidsres.25:3379-338。已知切割dna的其它酶(例如,s1核酸酶、绿豆核酸酶、胰dna酶i、微球菌核酸酶、酵母ho核酸内切酶;还参见linn等编,nucleases(《核酸酶》),冷泉港实验室出版社(coldspringharborlaboratorypress),1993)。可将一种或多种这些酶(或其功能性片段)用作切割结构域和切割半结构域的来源。
类似地,切割半结构域可衍生自如上所述的任何核酸酶或其部分,其需要二聚化以用于切割活性。一般而言,若融合蛋白包含切割半结构域,则需要两种融合蛋白供于切割。或者,可使用包含两个切割半结构域的单个蛋白。这两个切割半结构域可衍生自同一核酸内切核酸酶(或其功能性片段),或各切割半结构域可衍生自不同的核酸内切核酸酶(或其功能性片段)。此外,优选两种融合蛋白的靶位点相对彼此布置,从而这两种融合蛋白与其各自靶位点的结合使切割半结构域彼此处于允许切割半结构域形成功能性切割结构域(例如,通过二聚化)的空间定位。因此,在某些实施方式中,这些靶位点的邻近边缘间隔有5-8个核苷酸或15-18个核苷酸。然而,可在两个靶位点之间介入任何整数个核苷酸或核苷酸对(例如,2-50个核苷酸对或更多)。一般而言,切割的位点位于靶位点之间,但可能位于距离该切割位点一或多个千碱基的位置,包括距离该切割位点1-50个碱基对(或其间的任何值,包括1-5个、1-10个和1-20个碱基对)之间、1-100个碱基对(或其间的任何值)之间、100-500个碱基对(或其间的任何值)之间、500-1000个碱基对(或其间的任何值)之间或甚至超过1kb之间。
限制性内切核酸酶(限制性酶)存在于许多物种中,其能够序列特异性结合dna(在识别位点处),并在结合位点处或其附近切割dna。某些限制性酶(例如,iis型)在从识别位点移除的位点处切割dna并具有可分开的结合与切割结构域。例如,iis型酶foki催化dna的双链切割,其中一条链在距离其识别位点9个核苷酸处被切割,另一条链在距离其识别位点13个核苷酸处被切割。参见例如,美国专利5,356,802、5,436,150和5,487,994;以及li等,(1992)proc.natl.acad.sci.usa89:4275-4279;li等,(1993)proc.natl.acad.sci.usa90:2764-2768;kim等(1994a)proc.natl.acad.sci.usa91:883-887;kim等(1994b)j.biol.chem.269:31,978-31,982。因此,在一个实施方式中,融合蛋白包括来自至少一种iis型限制性酶的切割结构域(或切割半结构域)和一种或多种经或未经工程改造的锌指结合域。
foki是示例性iis型限制性酶,其切割结构域可与结合域分离。该具体酶作为二聚体具有活性。bitinaite等,(1998)proc.natl.acad.sci.usa95:10,570-10,575。因此,就本公开的目的而言,认为所述融合蛋白所用foki酶的部分是切割半结构域。因此,对于利用锌指-foki融合体的靶向双链切割和/或靶向细胞序列置换,可使用各自含有一个foki切割半结构域的两种融合蛋白重建催化活性的切割结构域。或者,也可使用包含锌指结合结构域和两个foki切割半结构域的单个多肽分子。采用锌指-foki融合的靶向切割和靶向序列变化的参数在本申请他处提供。
切割结构域或切割半结构域可以是蛋白质的任何部分,其保留了切割活性,或保留了多聚化(例如,二聚化)以形成功能性切割结构域的能力。
通过引用全文纳入本文的国际公开wo07/014275中描述了示例性iis型限制性酶。其它限制性酶也包含可分开的结合和切割结构域,并且这些是本发明所设想的。参见例如roberts等.(2003)nucleicacidsres.31:418-420。
在某些实施方式中,切割结构域包含一个或多个经工程改造的切割半结构域(也称作二聚化结构域突变体),其同二聚作用降至最小或被阻止,例如,如美国专利号7,914,796;8,034,598和8,623,618;和美国专利公开号20110201055所述,所有公开通过引用全文纳入本文。位于foki位置446、447、479、483、484、486、487、490、491、496、498、499、500、531、534、537和538的氨基酸残基都是影响foki切割半结构域二聚化的靶标。
能形成专性异二聚体的示例性工程改造foki切割半结构域包括这样的对:第一切割半结构域包括foki位置490和538处氨基酸残基的突变,和第二切割半结构域包括氨基酸残基486和499处的突变。
因此,在一实施方式中,490位的突变将glu(e)替换为lys(k);538位的突变将iso(i)替换为lys(k);486位的突变将gln(q)替换为glu(e);而499位的突变将iso(i)替换为lys(k)。具体地,制备本文所述经工程改造的切割半结构域是通过在一个切割半结构域中对位置490(e→k)和538(i→k)进行突变来产生名为“e490k:i538k”的经工程改造的切割半结构域,并通过另一切割半结构域中对位置486(q→e)和499(i→l)进行突变来产生名为“q486e:i499l”的经工程改造的切割半结构域。本文所述的经工程改造的切割半结构域是专性杂二聚体突变体,其中异常切割被最小化或废除。参见例如,美国专利号7,914,796和8,034,598,其公开内容通过引用其全文的方式纳入本文用于所有目的。在某些实施方式中,经工程改造的切割半结构域包括486、499和496位(根据野生型foki编号)的突变,例如突变将486位的野生型gln(q)残基替换为glu(e)残基,将499位的野生型iso(i)残基替换为leu(l)残基,以及将496位的野生型asn(n)残基替换为asp(d)或glu(e)残基(也分别称作“eld”和“ele”结构域)。在其它实施方式中,经工程改造的切割半结构域包括490、538和537位(相对于野生型foki编号)的突变,例如突变将490位的野生型glu(e)残基替换为lys(k)残基,将538位的野生型iso(i)残基替换为lys(k)残基,并且将537位的野生型his(h)残基替换为lys(k)或arg(r)残基(也分别称作“kkk”和“kkr”结构域)。在其它实施方式中,经工程改造的切割半结构域包括在490和537位(相对于野生型foki编号)的突变,例如突变将490位的野生型glu(e)残基替换为lys(k)残基,并且将537位的野生型his(h)残基替换为lys(k)残基或arg(r)残基(也分别被称作“kik”和“kir”结构域)。参见例如美国专利号7,914,796;8,034,598和8,623,618,其公开内容通过引用其全文纳入本文用于所有目的。在其他实施方式中,工程改造的切割结构域包括“sharkey”和/或“sharkey”突变(参见guo等,(2010)j.mol.biol.400(1):96-107)。
或者,核酸酶可利用称为“分裂-酶(split-enzyme)”的技术(参见例如,美国专利公开号20090068164)在核酸靶位点处体内组装。这类分裂酶的组件可在另外的表达构建物上表达,或者可以连接于单独的组件相互分开的某一开放读框中,例如,组件由自切割2a肽或ires序列分开。组件可以是单独的锌指结合结构域或兆核酸酶核酸结合结构域的结构域。
核酸酶(例如,zfn和/或talen)可在使用前针对活性进行筛选,例如,在如美国专利号8,563,314中所述的基于酵母的染色体系统中。
在某些实施方式中,核酸酶包括crispr/cas系统。编码该系统rna组分的crispr(规律成簇的间隔短回文重复)基因座以及编码蛋白质的cas(crispr相关的)基因座(jansen等,2002.mol.microbiol.43:1565-1575;makarova等,2002.nucleicacidsres.30:482-496;makarova等,2006.biol.direct1:7;haft等,2005.ploscomput.biol.1:e60)组成了crispr/cas核酸酶系统的基因序列。微生物宿主中的crispr基因座包含crispr-相关(cas)基因以及能够对crispr介导的核酸切割的特异性进行编程的非编码rna元件的组合。
ii型crispr是最充分表征的系统之一,并且以4个连续步骤进行靶向dna双链断裂。首先,从crispr基因座转录两个非编码rna:前-crrna阵列和tracrrna。第二,tracrrna杂交至前-crrna的重复序列区域,并且介导从前-crrna到含个体间隔子序列的成熟crrna的过程。第三,成熟的crrna:tracrrna复合物经由沃森-克里克碱基配对指导cas至靶dna,其位于crrna上的间隔子和原型间隔子邻近基序(pam)旁边的靶dna上的原型间隔子之间,所述pam是靶标识别的额外要求。最后,cas9介导靶dna的切割,以在原型间隔子内产生双链断裂。crispr/cas系统活性包括3步:(i)通过称作“适应”的过程将外来dna序列插入crispr阵列,以防止未来的攻击,(ii)表达相关蛋白质,以及表达和处理所述阵列,然后(iii)采用外来核酸进行rna介导的干扰。因此,在细菌细胞中,多个所谓的“cas”蛋白参与crispr/cas系统的自然功能,并且在多种功能中发挥作用(例如外来dna的插入等)。
在某些实施方式中,cas蛋白可为天然产生的cas蛋白的“功能性衍生物”。天然序列多肽的“功能性衍生物”是与天然序列多肽具有共同定性生物性质的化合物。“功能性衍生物”包括但不限于天然序列的片段或天然序列多肽的衍生物及其片段,前提是它们与相应的天然序列多肽具有共同的生物活性。本文设想的生物活性是功能性衍生物将dna底物水解成片段的能力。术语“衍生物”涵盖多肽的氨基酸序列变体,共价修饰形式,和其融合体。cas多肽的合适衍生物或其片段包括但不限于cas蛋白的突变体、融合体、共价修饰形式或其片段。包括cas蛋白或其片段的cas蛋白以及cas蛋白或其片段的衍生物可获自细胞或通过化学合成或通过这两种方法的组合获得。所述细胞可以是天然产生cas蛋白的细胞,或天然产生cas蛋白并经遗传工程改造的细胞,所述遗传工程改造使所述细胞以较高表达水平产生内源性cas蛋白或从外源引入的核酸产生cas蛋白,其中所述核酸编码与内源性cas相同或不同的cas。在一些情况中,细胞天然不产生cas蛋白,但是经遗传工程改造以产生cas蛋白。
靶向tcr基因的示例性crispr/cas核酸酶系统以及其它基因公开在例如美国专利公开号20150056705中。
核酸酶可在靶位点中产生一个或多个双链和/或单链切割。在某些实施方式中,核酸酶包含催化失活的切割结构域(例如,foki和/或cas蛋白)。参见例如,美国专利号9,200,266;8,703,489,以及guillinger等(2014)naturebiotech.32(6):577-582。催化失活的切割结构域可与具有催化活性的结构域组合,作为切口酶以产生单链切割。因此,可将两种切口酶联用以在特定区域产生双链切割。本领域已知其它切口酶,例如,mccaffery等(2016)nucleicacidsres.44(2):e11.doi:10.1093/nar/gkv878.电子出版于2015年10月19日。
靶位点
如上详述,dna结合结构域可经工程改造以结合任何所选序列。与天然产生的dna结合结构域相比,经工程改造的dna结合结构域可具有新型结合特异性。
本文所述的核酸酶靶向tcr或b2m基因,例如,表1中所示的至少9个核苷酸(例如,9、10、11、12、13、14、15、16、17、19、20、21或更多个连续或连续的)的靶位点中的。因此,本文所述的组合物包括细胞,其中:tcr基因经修饰(例如,经由插入和/或缺失,包括插入car或car-hla-e或car-hla-g转基因)于tcra基因的外显子c2中;b2m基因经修饰(例如,经由插入和/或缺失,包括插入car转基因)b2m基因的外显子1;和/或hprt基因经修饰(例如,经由插入和/或缺失,包括插入car或car-hla-e或car-hla-g转基因)。修饰可以位于靶位点内,或者,靶位点3'或5'边缘附近(例如,1-5、1-10或1-20核苷酸内)。在其它实施方式中,修饰可以在表1的成对的靶位点之间。
供体
如本文所述,核酸酶介导的切割后,可以将任何供体插入整合进入基因组。供体可以包含一种或多种编码序列(例如,car);一种或多种rna(rnai、shrna等);一种或多种非编码序列;和/或其他序列。供体构建体可以mrna形式或使用本文所述的病毒或非病毒dna载体递送至细胞或对象。在某些实施方式中,供体以mrna形式递送或携带于一种或多种aav载体,包括但不限于,aav1,aav3,aav4,aav5,aav6,aav8,aav8.2,aav9和aavrh10和/或假型化aav,诸如aav2/8,aav2/5和aav2/6。
在某些实施方式中,供体包含一种或多种转基因,包括但不限于,一种或多种car编码序列;以及一种或多种b2m编码序列;一种或多种hla-g和/或hla-e编码序列;一个或多个报告物(例如,gfp)等。
car编码序列(以产生car阳性(+)t细胞)可以包含对特定肿瘤抗原具有特异性的胞外单链可变片段(scfv),其与包含共刺激结构域和激活结构域的胞内信号传导部分连接。共刺激结构域可以源自,例如,cd28,而激活域可以源自,例如,cd3-ζ。car转基因可以包含2、3、4或更多个共刺激结构域。例如,可以设计carscfv以靶向cd19,其是由b细胞谱系中的细胞所表达的跨膜蛋白,包括所有正常b细胞和b细胞恶性肿瘤,包括但不限于,nhl、cll和非t细胞all。参见例如,美国专利号9,855,298。在某些实施方式中,car包含car设计的fmc63-cd8bbz,其中fmc63是抗-cd19scfv序列(参见,美国专利号9,701,758)且cd8bbz指排除scfv的car部分(cd8铰链/跨膜结构域(cd8),来自41bb基因的共刺激结构域(bb),来自cd3z基因的刺激结构域(z))。
任何hla-e和/或hla-g编码序列可用于本文所述的组合物和方法,包括但不限于,等位基因变体和/或其功能性片段在某些实施方式中,使用这样的转基因,其包含编码两种主要hla-e等位基因变体之一的序列:hla-e*0101(在本文也称之为er或hla-e0101)或hla-e*0103(在本文也称之为eg或hla-e0103)。hla-e0101和hla-e0103的差异仅在于一个氨基酸位置,其中位于hla-e0101中位置107的精氨酸被hla-e0103中的甘氨酸替代(celik等,同上)。在另一实施方式中,供体包含融合蛋白,例如,b2m-hla-g和/或hla-e融合蛋白。编码融合蛋白的转基因的组件可以任何顺序包括但不限于:hla-g和/或hla-e基因序列之前的b2m基因序列;或b2m基因序列之前的hla-g和/或hla-e基因序列。
可以使用一种或多种供体以引入转基因,包括,例如,针对car序列,b2m序列,hla-e和/或hla-g序列(例如,具有位于一个或多个序列之间的接头和/或自切割2a肽)的供体。在某些实施方式中,供体包含2a序列,其位于car编码序列和编码b2m/hla-g或e的序列(编码b2m-hla-g/e融合蛋白的序列)之间。或者,可以使用针对car序列的一个供体以及针对b2m、hla-e和/或hla-g基因的一个或多个单独供体,例如,第一car供体和针对b2m/hla-e/g融合蛋白的第二供体(其还可以包含一种或多种car序列)。在某些实施方式中,供体包含转基因,其编码car和b2m-hla-e和/或g融合蛋白,其具有位于car和融合蛋白之间的自切割2a肽,以及任选地,位于融合蛋白的蛋白质编码序列之间的一个或多个接头(例如,1、2、3、4、5、6或多个gs4接头)。
本文所述的任何供体可以包含任何长度的同源臂(对于核酸酶靶向的基因)。参见例如,美国专利号8,822,221;7,972.854。“长同源臂”的长度为约1kb,而“短同源臂”的长度为约250bp至750bp的长度。
此外,供体中的任意一个可以包含组件的任何组合,所述组件包括但不限于,同源臂;一种或多种转基因(其表达通过相同或不同控制元件驱动),诸如报告物,b2m,hla-g,hla-e和/或一种或多种car;以及其他序列,诸如一种或多种组成型或诱导型启动子(例如,pgk),一种或多种增强子序列(例如,tcr增强子序列);2a序列;聚腺苷酸化信号;ires序列,5’utr和/或3’utr区域;和/或一个或多个(g4s)4接头。在某些实施方式中,非洲爪蟾蜍(xenopus)β球蛋白基因(例如,在5’utr中)。
供体中的任一个可以包含wpre序列。任何wpre序列均可以用于本发明的实践。合适的序列的非限制性实例公开于美国专利公开号20160326548和美国专利号6,136,597;6,284,469;6,312,912;和6,287,814。在某些实施方式中,wpre序列相较于野生型包含突变。参见例如,美国专利号7,419,829和zanta-boussif等(2009)genetherapy16:605-619或截短(choi等,同上)。还可以使用相同或不同的wpre序列中的一种或多种。wpre可以在供体的3’utr和/或5’utr中。在某些实施方式中,wpre序列包含:
aatcaacctctggattacaaaatttgtgaaagattgactggtattcttaactatgttgctccttttacgctatgtggatacgctgctttaatgcctttgtatcatgctattgcttcccgtatggctttcattttctcctccttgtataaatcctggttgctgtctctttatgaggagttgtggcccgttgtcaggcaacgtggcgtggtgtgcactgtgtttgctgacgcaacccccactggttggggcattgccaccacctgtcagctcctttccgggactttcgctttccccctccctattgccacggcggaactcatcgccgcctgccttgcccgctgctggacaggggctcggctgttgggcactgacaattccgtggtgttgtcggggaagctgacgtcctttccatggctgctcgcctgtgttgccacctggattctgcgcgggacgtccttctgctacgtcccttcggccctcaatccagcggaccttccttcccgcggcctgctgccggctctgcggcctcttccgcgtcttcgccttcgccctcagacgagtcggatctccctttgggccgcctccccgcctg(seqidno:64)
此外,供体可以包含一种或多种t细胞受体增强子,包括tcra增强子序列。参见例如,ho和leiden(1990)mol.cell.biol.10(9):4720-4727;kappes等(1991)proc.nat’l.acad.sci.usa88:2204-2208。在某些实施方式中,t细胞受体增强子包含序列:
gatatcattggtcaattgcagcagacatgtctcttgtggtgtaaagcctcatagcatcttcctgctggagtccacctggcagcccaaagcctcagcaagtgctggggacagagagatagaaaggctttgctgtggctcaactcagttgtactttctcaagctccttttggttatctgctctgtctatgtagttgcttcctggaaaatggttaaagtcaaacctcctctgtttggggcagcacaaaatgttgctaaggcgttagaagacaacataggagcagttaaaccacagccagtttttgctcgctttcgaaagaccacagctattagacagaaaacctcctgtactggaagtggccctgaaacagcatctgtgctgacagacactgggcttgctatggttgctgctcatcatgctcagctg(seqidno:65).在其他实施方式中,tcrα增强子序列如下所示:
ctcccatttccatgacgtcatggttaaacctcttttacctgctttaaccctttgaagctctcccgcagaagccacatcctctg(seqidno:66)。
因此,供体的非限制性实例包括:
(1)具有长同源臂(长臂)的供体,其包含下述序列:pgk启动子序列,其可操作地连接至侧接大小各自为约1kb的同源臂(对于b2m)的转基因(gfp、car等);
(2)具有短同源臂(短臂)的供体,其包含下述序列:pgk启动子序列,其可操作地连接至侧接大小各自为约250bp的同源臂(对于b2m)的转基因;
(3)(2)中所述的供体还包含3’utr中的wpre序列,例如,包含下述内容的wpre:
aatcaacctctggattacaaaatttgtgaaagattgactggtattcttaactatgttgctccttttacgctatgtggatacgctgctttaatgcctttgtatcatgctattgcttcccgtatggctttcattttctcctccttgtataaatcctggttgctgtctctttatgaggagttgtggcccgttgtcaggcaacgtggcgtggtgtgcactgtgtttgctgacgcaacccccactggttggggcattgccaccacctgtcagctcctttccgggactttcgctttccccctccctattgccacggcggaactcatcgccgcctgccttgcccgctgctggacaggggctcggctgttgggcactgacaattccgtggtgttgtcggggaagctgacgtcctttccatggctgctcgcctgtgttgccacctggattctgcgcgggacgtccttctgctacgtcccttcggccctcaatccagcggaccttccttcccgcggcctgctgccggctctgcggcctcttccgcgtcttcgccttcgccctcagacgagtcggatctccctttgggccgcctccccgcctg(seqidno:64);
(4)(2)中所述的供体还包含pgk启动子上游的t细胞增强子序列,例如,如下所示的序列:
gatatcattggtcaattgcagcagacatgtctcttgtggtgtaaagcctcatagcatcttcctgctggagtccacctggcagcccaaagcctcagcaagtgctggggacagagagatagaaaggctttgctgtggctcaactcagttgtactttctcaagctccttttggttatctgctctgtctatgtagttgcttcctggaaaatggttaaagtcaaacctcctctgtttggggcagcacaaaatgttgctaaggcgttagaagacaacataggagcagttaaaccacagccagtttttgctcgctttcgaaagaccacagctattagacagaaaacctcctgtactggaagtggccctgaaacagcatctgtgctgacagacactgggcttgctatggttgctgctcatcatgctcagctg(seqidno:65);或
(5)(2)中所述的供体还包含tcrα增强子序列,例如,如下所示的序列:ctcccatttccatgacgtcatggttaaacctcttttacctgctttaaccctttgaagctctcccgcagaagccacatcctctg(seqidno:66);
(6)(2)中所述的供体还包括来自非洲爪蟾蜍(xenopus)β球蛋白基因5'非翻译区的序列,任选地,如下所示的序列:
tgcttgttctttttgcagaagctcagaataaacgctcaactttggcagat(seqidno:67)
(7)包含有对trac位点e的短同源臂(423bp的左臂和393bp的右臂)的供体,所述trac位点e侧接通过hpgk启动子驱动的转基因(例如,gfp、car、b2m、hla-e和/或hla-g)。供体还任选地包含“miseq标签”,其允许通过miseq将进入trac基因座的ti定量;
(8)具有对trac位点e的长同源臂(1000bp的左臂和992bp的右臂)的供体,所述trac位点e侧接通过hpgk启动子驱动的转基因(例如,gfp、car、b2m、hla-e和/或hla-g)。供体不包含“miseq标签”;
(9)具有对trac位点e的短同源臂(350bp的左臂和393bp的右臂)和突变的wpre元件(在转基因之后)的供体,所述trac位点e侧接通过hpgk启动子驱动的转基因(例如,gfp、car、b2m、hla-e和/或hla-g)。供体还任选地包含“miseq标签”;
(10)包含有对trac位点e的短同源臂(423bp的左臂和393bp的右臂)的供体,所述trac位点e侧接通过hpgk启动子驱动的fmc63-cd8bbzcar转基因。供体还任选地包含“miseq标签”,其允许通过miseq将进入trac基因座的ti定量;
(11)(10)所述的供体还包含转基因序列后的wpre序列;
(12)具有对trac位点e的短同源臂(360bp和393bp的右臂)的供体,所述trac位点e侧接fmc63-cd8bbzcar转基因,其通过自切割p2a肽与表达b2m和hla-e的融合蛋白连接。所述转基因通过hpgk启动子驱动并后跟突变的wpre元件。供体还任选地包含“miseq标签”;
(13)(12)所述的供体,其中hla-e被hla-g替换;
(14)(13)所述的供体,其中包含hla-e和hla-g;
(15)具有对trac位点e的长同源臂(例如,1000bp的左臂和992bp的右臂)的供体,所述trac位点e侧接通过hpgk启动子驱动的hla-g转基因;
(16)(15)所述的供体,其中hla-g转基因被hla-e转基因替换(例如,hlae0101或e0103(celik等,同上));
(17)(15)所述的供体还包含hla-g转基因;
(18)(15)-(17)中任一项所述的供体还包含b2m编码序列,其与hla-e和/或hla-g转基因连接,任选地,经由位于任何所述转基因之间(例如,b2m和hla-g之间;b2m和hla-e之间;b2m,hla-g和hla-e之间;hla-g和hla-e之间等)具有1、2、3、4、5、6或更多个拷贝g4s肽的接头;
(19)(15)-(18)中任一项所述的供体,任选地,其还包含一种或多种转基因(例如,b2m和hla-e/g或仅b2m,例如,其中不包含针对hla-g的单肽的供体)之前的信号肽;
(20)(15)-(19)中任一项的供体,其还包含car转基因(例如,fmc63-cd8bbz),任选地,通过自切割p2a肽与表达b2m和hla-g和/或hla-e的融合蛋白连接;和
(21)(20)所述的供体还包含突变的wpre元件,和任选地miseq标签。
递送
蛋白质(例如,转录因子、核酸酶、tcr和car分子)、多核苷酸和/或包含本文所述的蛋白质和/或多核苷酸的组合物,可通过任何合适的手段递送至靶细胞,包括例如,通过注射蛋白质和/或mrna组分。在一些方面中,核酸酶和/或供体以mrna递送,而转基因经由其他方式递送,诸如病毒载体,小环dna,质粒dna,单链dna,线性dna,脂质体,纳米颗粒等。参见例如,美国专利号20140335063。在一些实施方式中,蛋白质通过细胞挤压(cellsqueezing)导入细胞(参见kollmannsperger等(2016)natcomm7,10372doi:10.1038/ncomms10372)。
合适的细胞包括但不限于真核和原核细胞和/或细胞系。由此类细胞产生的此类细胞或细胞系的非限制性示例包括t细胞、cos、cho(例如,cho-s、cho-k1、cho-dg44、cho-duxb11、cho-dukx、chok1sv)、vero、mdck、wi38、v79、b14af28-g3、bhk、hak、ns0、sp2/0-ag14、hela、hek293(例如,hek293-f、hek293-h、hek293-t)和perc6细胞,以及昆虫细胞例如草地贪夜蛾(spodopterafugiperda)(sf),或真菌细胞例如酵母(saccharomyces)、毕赤酵母(pichia)和裂殖酵母(schizosaccharomyces)。在某些实施方式中,细胞系是cho-k1、mdck或hek293细胞系。合适的细胞还包括干细胞,例如,胚胎干细胞、诱导型多能干细胞(ips细胞)、造血干细胞、神经元干细胞和间充质干细胞。
递送含本文所述dna结合结构域的蛋白质的方法见述于,例如,美国专利号6,453,242;6,503,717;6,534,261;6,599,692;6,607,882;6,689,558;6,824,978;6,933,113;6,979,539;7,013,219和7,163,824,其全部公开内容通过引用其全文的方式纳入本文。
dna结合结构域和含本文所述这些dna结合结构域的融合蛋白还可采用包含编码一种或多种dna结合蛋白的序列的载体递送。此外,还可通过这些载体递送其它核酸(例如,供体)。可采用任何载体系统,包括但不限于,质粒载体、逆转录病毒载体、慢病毒载体、腺病毒载体、痘病毒载体、疱疹病毒载体和腺相关病毒载体等。还参见例如,美国专利号6,534,261、6,607,882、6,824,978、6,933,113、6,979,539、7,013,219;和7,163,824,其通过引用其全文的方式纳入本文。此外,应明了,这些载体中的任一种可包括一种或多种dna结合蛋白-编码序列和/或其它合适的核酸。因此,当本文所述的一种或多种dna结合蛋白被引入细胞时,可与其它合适的dna被相同载体或不同载体携载。当采用多重载体时,各载体可以包含编码一种或多种dna结合蛋白的序列,以及所需的其它核酸。
可采用传统的基于病毒和非病毒的转基因方法来将编码经工程改造的dna结合蛋白的核酸引入细胞(例如,哺乳动物细胞)和靶组织,并且共同引入所需的其它核苷酸序列。此类方法也可用于将核酸(例如,编码dna结合蛋白和/或供体的核酸)体外给予细胞。在某些实施方式中,给予的核酸用于体内或离体基因治疗应用。非病毒载体递送系统包括dna质粒、裸核酸和与递送载剂(例如脂质体、脂质纳米颗粒或泊洛沙姆(poloxamer))复合的核酸。病毒载体递送系统包括dna和rna病毒,其在递送至细胞后具有附加型或整合的基因组。对于基因治疗法的综述,参见anderson,science256:808-813(1992);nabel和felgner,tibtech11:211-217(1993);mitani和caskey,tibtech11:162-166(1993);dillon.tibtech11:167-175(1993);miller,nature357:455-460(1992);vanbrunt,biotechnology6(10):1149-1154(1988);vigne,restorativeneurologyandneuroscience8:35-36(1995);kremer和perricaudet,britishmedicalbulletin51(1):31-44(1995);haddada等,刊于《微生物与免疫学热门主题》(currenttopicsinmicrobiologyandimmunology)doerfler和
核酸的非病毒递送方法包括电穿孔、脂质转染、显微注射、基因枪、病毒颗粒、脂质体、免疫脂质体、聚阳离子或脂质:核酸偶联物、裸dna、mrna、人工病毒粒,和试剂增强的dna摄取。利用例如sonitron2000系统(rich-mar)的声孔效应也可用于递送核酸。在一个优选实施方式中,一种或多种核酸以mrna形式递送。还优选采用加帽的mrna来增加翻译效率和/或mrna稳定性。尤其优选arca(防倒转帽类似物)帽或其变化形式。参见美国专利号7,074,596和8,153,773,其通过引用纳入本文。
其它示例性的核酸递送系统包括amaxa生物系统公司(德国科隆)、迈克赛特公司(maxcyte,inc.)(马里兰州罗克韦尔)、btx分子递送系统公司(马萨诸塞州霍利斯顿)和哥白尼治疗公司(copernicustherapeuticsinc.)(参见例如us6008336)提供的那些。脂质转染描述于例如,美国专利号5,049,386、4,946,787和4,897,355,并且脂质转染试剂市售可得(例如,transfectamtm,lipofectintm,和lipofectaminetmrnaimax)。适于多核苷酸的高效受体-识别脂质转染的阳离子和中性脂质包括那些felgner、wo91/17424、wo91/16024的那些。可以递送至细胞(离体给予)或靶组织(体内给予)。
脂质:核酸复合物(包括靶向的脂质体,例如免疫脂质复合物)的制备是本领域技术人员熟知的(参见例如,crystal,science270:404-410(1995);blaese等,cancergenether.2:291-297(1995);behr等,bioconjugatechem.5:382-389(1994);remy等,bioconjugatechem.5:647-654(1994);gao等,genetherapy2:710-722(1995);ahmad等,cancerres.52:4817-4820(1992);美国专利号4,186,183、4,217,344、4,235,871、4,261,975、4,485,054、4,501,728、4,774,085、4,837,028和4,946,787)。
递送的其它方法包括将待被递送的核酸包装到engeneic递送载体(edv)中。采用双特异性抗体将这些edv被特异性递送至靶组织,其中,所述抗体的一个臂对靶组织具有特异性,而另一个臂对edv具有特异性。抗体将edv带至靶细胞表面,然后edv通过内吞作用进入细胞。一旦进入细胞,即释放内容物(参见macdiarmid等(2009)naturebiotechnology27(7):643页)。
使用基于rna或dna病毒的系统递送编码经工程改造的dna结合蛋白的核酸和/或所需要的供体(例如,car或actr)利用高度演化的过程来将病毒靶向身体中特定的细胞并且将该病毒负荷运输至核。病毒载体可直接给予患者(体内)或其可用于体外处理细胞,并将经修饰的细胞给予患者(离体)。用于递送核酸的常规的基于病毒的系统包括但不限于,用于基因传递的逆转录病毒、慢病毒、腺病毒、腺相关、牛痘和单纯性疱疹病毒载体。宿主基因组中的整合可采用逆转录病毒、慢病毒和腺相关病毒基因传递方法进行,通常导致插入的转基因的长期表达。此外,已在许多不同的细胞类型和靶组织中观察到了高转导功效。
逆转录病毒的趋性可通过引入外来包膜蛋白、扩大靶细胞的潜在靶群体来改变。慢病毒载体是能够转导或感染非分裂细胞的逆转录病毒载体,并且通常产生高病毒效价。逆转录病毒转基因系统的选择取决于靶组织。逆转录病毒载体包含顺式作用的长末端重复,其具有包装长达6-10kb的外来序列的能力。最小的顺式作用的ltr足以用于载体的复制和包装,其随后用于将治疗基因整合进入靶细胞,以提供永久的转基因表达。广泛使用的逆转录病毒载体包括基于鼠白血病病毒(mulv)、长臂猿白血病病毒(galv)、类人猿免疫缺陷型病毒(siv)、人类免疫缺陷型病毒(hiv),及其组合的那些(参见例如,buchscher等.,j.virol.66:2731-2739(1992);johann等.,j.virol.66:1635-1640(1992);sommerfelt等.,virol.176:58-59(1990);wilson等.,j.virol.63:2374-2378(1989);miller等.,j.virol.65:2220-2224(1991);pct/us94/05700)。
在其中优选瞬时表达的应用中,可采用基于腺病毒的系统。基于腺病毒的载体能够在许多细胞类型中获得极高的转导效率,并且不需要细胞分裂。采用这种载体,已获得了高效价和高水平的表达。该载体可在相对简单的系统中大量产生。腺相关病毒(“aav”载体也用于用靶核酸转导细胞,例如,用于核酸和肽的体外生成,以及用于体内和离体基因治疗法(参见例如,west等.,virology160:38-47(1987);美国专利号4,797,368;wo93/24641;kotin,humangenetherapy5:793-801(1994);muzyczka,j.clin.invest.94:1351(1994)。重组aav载体的构建描述于多个公开文本中,包括美国专利号5,173,414;tratschin等.,mol.cell.biol.5:3251-3260(1985);tratschin等.,mol.cell.biol.4:2072-2081(1984);hermonat和muzyczka,pnasusa81:6466-6470(1984);和samulski等.,j.virol.63:03822-3828(1989)。
目前有至少六种病毒载体法可用于临床试验中的基因传递,其采用通过将基因插入辅助细胞系来产生转导剂进行涉及缺陷型载体的互补的方法。
plasn和mfg-s是已用于临床试验的逆病毒载体的示例(dunbar等.,blood85:3048-305(1995);kohn等.,nat.med.1:1017-102(1995);malech等.,pnasusa94:2212133-12138(1997))。pa317/plasn是用于基因治疗试验的第一治疗载体。(blaese等.,science270:475-480(1995))。已在mfg-s包装的载体中观察到50%或更高的转导功效。(ellem等.,immunolimmunother.44(1):10-20(1997);dranoff等.,hum.genether.1:111-2(1997)。
重组腺相关病毒载体(raav)是一种具有前景的替代性基因递送系统,其基于缺陷型和非病原性细小病毒腺相关2型病毒。全部载体源自仅保留侧接转基因表达盒的aav145bp反向末端重复序列的质粒。高效的基因转移和稳定的转基因递送是该载体系统的关键特征,这归因于向转导的细胞的基因组的整合。(wagner等.,lancet351:91171702-3(1998),kearns等.,genether.9:748-55(1996))。根据本发明也可使用其它aav血清型,包括aav1、aav3、aav4、aav5、aav6、aav8、aav8.2、aav9和aavrh10和假型aav,如aav2/8、aav2/5和aav2/6。
复制缺陷型重组腺病毒载体(ad)可以高效价生成,并且容易地感染多种不同的细胞类型。大多数腺病毒载体是经工程改造的,从而转基因替代了ade1a、e1b和/或e3基因;随后该复制缺陷型载体在提供缺失反式基因功能的人293细胞中传播。ad载体可体内转导多种类型的组织,包括不分裂的、分化的细胞,例如发现于肝、肾和肌肉中的那些。传统的ad载体具有较大携载能力。临床试验中ad载体应用的一个示例涉及用于采用肌内注射进行抗肿瘤免疫的多核苷酸治疗(sterman等.,hum.7:1083-9(1998))。临床试验中腺病毒载体用于转基因的应用的其它示例包括rosenecker等.,infection24:15-10(1996);sterman等.,hum.genether.9:71083-1089(1998);welsh等.,hum.genether.2:205-18(1995);alvarez等.,hum.genether.5:597-613(1997);topf等.,genether.5:507-513(1998);sterman等.,hum.genether.7:1083-1089(1998)。
采用包装细胞来形成能够感染宿主细胞的病毒颗粒。所述细胞包括293细胞,其包装腺病毒,和ψ2细胞或pa317细胞,其包装逆病毒。用于基因治疗的病毒载体通常由将核酸载体包装成病毒颗粒的生产细胞系产生。所述载体通常包含包装和后续整合进入宿主(若可行)所需的最小病毒序列,其它病毒序列被编码待表达的蛋白质的表达盒所替代。失去的病毒功能通过包装细胞系以反式提供。例如,用于基因治疗的aav载体通常仅加工来自aav基因组的反向末端重复(itr)序列,其为包装和整合进入宿主基因组所需。病毒dna被包装进入细胞系,其包含编码其它aav基因(即rep和cap)但缺乏itr序列的辅助质粒。所述细胞系也用腺病毒(作为辅助物)感染。辅助病毒促进aav载体的复制和aav基因从辅助质粒的表达。因为缺乏itr序列,辅助质粒不以显著的量包装。腺病毒的污染可通过,例如,热处理(相比aav,腺病毒对热处理更为敏感)来减少。此外,可以使用杆状病毒系统生产avv(参见例如,美国专利号6,723,551和7,271,002)。
来自293或杆状病毒系统的aav颗粒的纯化通常涉及使产生病毒的细胞生长,然后由细胞上清液收集病毒颗粒,或裂解细胞并从粗裂解物收集病毒。然后通过本领域技术人员已知的方法纯化aav,包括离子交换色谱(例如,参见美国专利号7,419,817和6,989,264),离子交换色谱和cscl密度离心(例如,pct公开wo2011094198a10),免疫亲和力色谱(例如,wo2016128408)或使用avb琼脂糖的纯化(例如,ge医疗生命科学公司(gehealthcarelifesciences))。
在许多基因治疗应用中,希望将基因治疗载体以高度特异性递送至特定组织类型。因此,病毒载体可经修饰以通过将配体表达成与病毒包衣蛋白融合的位于病毒外表面上的蛋白来具有针对给定细胞类型的特异性。选择对于已知存在于感兴趣的细胞类型上的受体具有亲和性的配体。例如,han等.,proc.natl.acad.sci.usa92:9747-9751(1995),报道了莫洛尼鼠白血病病毒可经修饰以表达融合至gp70的人调蛋白,并且该重组病毒感染表达人表皮生长因子受体的某些人乳腺癌细胞。该原理可延伸至其它病毒-靶细胞对,其中靶细胞表达受体,并且病毒表达包含针对该细胞表面受体的配体的融合蛋白。例如,丝状噬菌体可经工程改造以显示对于几乎任何所选细胞受体具有特异性结合亲和力的抗体片段(例如,fab或fv)。尽管上文描述主要应用至病毒载体,相同的原理可应用至非病毒载体。所述载体可经工程改造以包含特定的摄取序列,其有利于被特定靶细胞摄取。
基因治疗载体可通过给予个体患者来体内递送,通常通过全身性给予(例如,静脉内、腹膜内、肌内、皮下,或颅内输注)或局部施用,如下所述。或者,载体可离体递送至细胞,例如来自个体患者的外植的细胞(例如,淋巴细胞、骨髓抽出物、组织活检物)或通用供体造血干细胞,然后将所述细胞再植入患者,通常在选择已引入载体的细胞之后进行。
用于诊断、研究、抑制或用于基因治疗(例如,通过重新输注转染的细胞进入宿主生物体)的离体细胞转染是本领域技术人员熟知的。在一个优选实施方式中,细胞从对象机体分离,用dna结合蛋白核酸(基因或cdna)转染,并重新输注回对象机体(例如,患者)。合适于离体转染的多种细胞类型是本领域技术人员熟知的(参见例如,freshney等.,《动物细胞培养,基础技术手册》(cultureofanimalcells,amanualofbasictechnique)(第三版.1994))本文所引的参考内容是关于讨论如何分离和培养来自患者的细胞)。
在一个实施方式中,细胞转染和基因治疗的离体方案中采用干细胞。采用干细胞的好处是,它们可以体外分化成其它细胞类型,或可被导入哺乳动物(例如细胞的供体),在此其将接植入骨髓。采用细胞因子例如gm-csf、ifn-γ和tnf-α将cd34+细胞体外分化成临床上重要的免疫细胞类型的方法是已知的(参见inaba等.,j.exp.med.176:1693-1702(1992))。
采用已知方法分离干细胞用于转导和分化。例如,干细胞也可通过骨髓细胞用结合不需要细胞的抗体筛选而从骨髓细胞中分离,所述细胞例如cd4+和cd8+(t细胞)、cd45+(panb细胞)、gr-1(粒细胞)和iad(分化抗原呈递细胞)(参见inaba等.,j.exp.med.176:1693-1702(1992))。
在一些实施方式中,可采用已经修饰的干细胞。例如,可将被制成抗凋亡的神经元干细胞用作治疗性组合物,其中所述干细胞还包含本发明的zfptf。对于凋亡的抗性可来自于,例如,通过采用bax-或bak特异性zfn敲除干细胞中的bax和/或bak(参见,美国专利公开号20100003756),或干扰胱冬酶的那些,同样采用例如胱冬酶6特异性zfn。可以用已知调节tcr的zfptf转染这些细胞。
也可将包含治疗性dna结合蛋白(或编码这些蛋白质的核酸)的载体(例如,逆转录病毒、腺病毒、脂质体等)直接给予机体用于体内细胞转导。或者,可给予裸dna。给予通过常用于引入分子并最终与血液或组织细胞接触的任何常规途径进行,包括但不限于,注射、输注、局部施用和电穿孔。合适的给予所述核酸的方法可得且为本领域技术人员熟知,并且,尽管可利用超过一种途径给予特定组合物,某特定途径通常能提供比另一途径更直接和更有效的反应。
用于将dna导入造血干细胞的方法公开于,例如,美国专利号5,928,638。可用于将转基因引入造血干细胞(例如,cd34+细胞)的载体包括腺病毒35型。
合适于将转基因引入免疫细胞(例如,t细胞)的载体包括非整合型慢病毒载体。参见例如ory等.(1996)proc.natl.acad.sci.usa93:11382-11388;dull等.(1998)j.virol.72:8463-8471;zuffery等.(1998)j.virol.72:9873-9880;follenzi等.(2000)naturegenetics25:217-222。
药学上可接受的运载体部分地由所给予的特定组合物以及用于给予组合物的特定方法确定。因此,有多种合适的药物组合物制剂可用,如下所述(参见例如,《雷明顿药物科学》(remington’spharmaceuticalsciences);第17版,1989)。
如上所述,公开的方法和组合物可用于任何类型的细胞,包括但不限于,原核细胞、真菌细胞、古细菌细胞、植物细胞、昆虫细胞、动物细胞、脊椎动物细胞、哺乳动物细胞和人细胞,包括任何类型的t细胞和干细胞。用于蛋白质表达的合适的细胞系是本领域技术人员已知的,并且可包括但不限于cos、cho(例如,cho-s、cho-k1、cho-dg44、cho-duxb11)、vero、mdck、wi38、v79、b14af28-g3、bhk、hak、ns0、sp2/0-ag14、hela、hek293(例如,hek293-f、hek293-h、hek293-t)、perc6、昆虫细胞例如草地贪夜蛾(spodopterafugiperda)(sf),和真菌细胞例如酵母(saccharomyces)、毕赤酵母(pichia)和裂殖酵母(schizosaccharomyces)。也可采用这些细胞系的子代、变体和衍生物。
应用
公开的组合物和方法可以用于其中需要产生响应细胞上特定表面抗原的t细胞(武装的t细胞)的任何应用,包括但不限于治疗和研究应用。
例如,公开的组合物可体内和/或离体(细胞治疗)使用,以破坏t细胞中内源性tcr和/或hla复合物的功能性表达,所述t细胞经修饰以用于过继细胞治疗以表达一种或多种外源car,外源tcr,或其它癌症特异性受体分子,由此治疗和/或预防癌症。另外,在这种情况下,细胞内功能性tcr表达和/或hla表达的废除可消除或显著降低与健康的非靶向组织的不希望的交叉反应(即,移植物抗宿主反应)的风险。此外,包含修饰的hla-e或hla-g转基因,以使细胞表达修饰的hla-e或hla-g复合物可以帮助避免被宿主nk细胞杀伤。因此,可以产生包含car的通用供体t细胞,任选地,具有修饰的hla-e或hla-g复合物,以使得这些通用细胞可以给予有此需要的任何患者。
此外,工程改造的包含car的t细胞可以包含其他转基因,所述其他转基因可以用于过继细胞疗法。例如,这些细胞可以包含通过外源性信号调控的自杀基因,以在激活自杀基因的表达后导致工程改造的t细胞细胞凋亡(wang等(2017)j.hematoloncol10:53)。也已经证明car-t细胞中cd40l的过表达有利于car-t的效力(参见curran等(2015)molther.23:769–78)。现在已经有几个小组设计了结合了il-12分泌和car表达的“第四代”cart细胞。koneru及其同事(oncoimmunology(2015);4:e994446)在正交异性卵巢肿瘤移植模型中使用了所谓的“通用细胞因子介导杀伤的重定向t细胞(truck)”来治疗卵巢癌。
其他转基因可以包含其他car序列,其对其他感兴趣的抗原或表达修饰的hla-e或hla-g的转基因具有特异性。已经证明了表达抗cd19嵌合抗原受体(car)的t细胞的过继转移针对晚期b细胞恶性肿瘤具有显著的治愈潜力,但多项试验也报告了由于cd19阴性白血病细胞的出现而使患者复发。因此,使用两个car,并且任选地,其表达修饰的hla-e或hla-g复合物,其中一个car对cd19具有特异性,而另一个对cd20具有特异性,这样可以防止复发。此外,并不使用两种单独的car构建体,car转基因本身可以编码双特异性car,其能够识别cd19和cd20(zah等(2016)cancerimmunolres,4(6):498-508)。使用cd19特异性car武装并任选地包含修饰的hla-e或hla-g复合物的t细胞可以具有治疗性用途,用于治疗b细胞恶性肿瘤如b细胞淋巴瘤和其他血液癌症如all,aml和nhl(scheuermann和racila(1995)leuklymphoma.18(5-6):385-97)。使用car武装t细胞可以靶向的其他癌症包括:恶性神经胶质瘤(参见临床试验标识符:nct01454596),头颈部鳞状细胞癌(scchn)(参见临床试验标识符:nct01818323),神经母细胞瘤(参见临床试验标识符:nct01822652),恶性胸膜间皮瘤(参见临床试验标识符:nct01722149),晚期肉瘤(参见临床试验标识符:nct00902044),肾癌,(kakarla和gottschalk,(2014)cancerj20(2):151-155)。因此,本文所述的组合物和方法可以用于治疗任何癌症,包括但不限于,卵巢癌,脑癌,前列腺癌,肝癌,肾癌,白血病,淋巴瘤,脊髓和cns等。
具有潜在的car靶向治疗价值的其他抗原包括与肿瘤细胞或与癌症相关过程相关的抗原,诸如bcma,epcam,cea,her-2,gpa33,粘蛋白,tag-72,caix,psma,叶酸-结合抗体,叶酸受体fr-α,cd19,cd20,cd22,egfr,egfrviii,epcam,epha2,erbb2/her2,erbb3,fap,met,igκ,il-1rap,igf1r,epha3,lewisy,nkg2d配体,ror1,fr-a,gd2,gpc3,il-13ra2,l1-cam,muc1,pd-l1,psca,psma,vegfr2,c-met,cd133,trailr1,trailr2,rankl,fap,vegf,vegfr,αvβ3和α5β1整合素,cd30,cd33,cd52,cd70,cd123,cd138,cd171,cd16v,ctla4,和细胞粘合素(enascin)。.
本文所公开的方法和组合物的其他潜在应用包括其他工程改造方法,如调节其他感兴趣的基因。这些其他基因包括检查点抑制剂基因,如pd1和/或ctla4,其中敲除这些基因可能会阻止肿瘤介导的t细胞应答抑制。此外,可以进一步工程改造t细胞以敲除b2m基因,所述t细胞包含进入tcr相关基因中的感兴趣的car的插入,并且可以进一步工程改造包含整合到b2m基因中的car的t细胞,以敲除tcr相关基因。这些修饰的t细胞还可以包含修饰的hla-e或hla-g复合物,从而使工程改造的t细胞能够逃避宿主nk细胞的杀伤。这些其他突变可能对于创建用于“现成(offtheshelf)”应用的通用t细胞很有用。
方法和组合物还包括干细胞组合物,其中,该干细胞内的tcra和/或tcrb和/或b2m基因已经调控(修饰),并且细胞还包含一种或多种car。例如,可在骨髓消融后将tcr基因敲除或基因敲减调节的同种异体造血干细胞引入hla匹配的患者中。这些改变的包含car的hsc将允许患者的再定殖(re-colonization),但将不会引起潜在的gvhd。引入的细胞还可能具有其它改变以在后续治疗(例如,化疗耐药性)过程中协助治疗潜在的疾病。tcr和/或hla空细胞(任选地包含修饰的hla-e或hla-g复合物)还具有作为创伤患者急诊情况下的“现成”疗法的应用。
本发明的方法和组合物也可用于设计和实施体外和体内模型,例如,tcr或相关病症的动物模型,其允许研究这些病症。
本文中提及的所有专利、专利申请和出版物均以参考的方式用全文纳入本文。
尽管出于理解和清楚的目的,本发明通过说明和示例的方式提供了一些细节,但本领域技术人员可理解在不偏离本发明的精神或范围的情况下可实施各种改变和改进。因此,上述说明和实施例不应理解为是限制性的。具体地,虽然使用锌指蛋白dna结合结构域为示例,任何dna结合结构域可以用于靶向修饰,包括但不限于,tal效应物结构域dna结合结构域,sgrna(crispr/cas系统的)和/或ttagodna结合结构域,包括任何dna结合结构域,其结合下文详述的靶位点的12-25个核苷酸。
实施例
实施例1:核酸酶的设计
设计并构建tcra特异性、b2m特异性、cish特异性、pd1特异性、ctla-4和hprt特异性zfn,以能够位点特异性引入双链dna断裂,基本上如urnov等(2005)nature435(7042):646-651,lombardo等(2007)natbiotechnol.11月;25(11):1298-306,和美国专利公开号20150164954、20140301990和美国专利号8,563,314、8,956,828、9,402,879和9,597,357;和美国专利申请号62/583,724所述。对于用于结合和修饰这些和其他基因的crispr/cas系统的sgrna,还参见美国专利号9,873,894。此外,示例性zfn对的识别螺旋以及靶序列示于下表1。锌指设计的靶位点如第一栏所示。被zfp识别螺旋靶向的靶位点中的核苷酸以大写字母表示;未被靶向的核苷酸以小写字母指示。对于trac特异性zfn,也参见美国专利申请号16/009,975。对于b2m特异性zfn,也参见美国专利公开号20170173080。对于cish特异性zfn,参见美国临时专利申请号62/583,724。
用于连接foki核酸酶结构域和zfpdna结合结构域的接头也同样示出(参见,美国专利公开号20150132269)。例如,结构域接头l0的氨基酸序列是dna结合结构域-qlvks-foki核酸酶结构域(seqidno:5)。类似地,结构域接头n7a的氨基酸序列是foki核酸酶结构域-sgtphevgvytl-dna结合结构域(seqidno:37),并且n7c是foki核酸酶结构域-sgairchdefwf-dna结合结构域(seqidno:38)。在适当情况下,还指出对锌指骨架的修饰,如美国专利公开号20180087072中所述。表1中使用的表示法中,“qm5”表示在指示的指的-5位(相对于编号为-1至+6的螺旋),该位置的精氨酸已被谷氨酰胺(q)替代,而“qm14”表示正常存在于-14位的精氨酸(r)已被谷氨酰胺(q)替代。nqm5中的缩写“n”表示突变位于用于构建5或6指蛋白质的二指模块的n末端指中。“无”表示在识别螺旋区之外没有变化。
表1:锌指设计
测试所有的zfn,且发现它们结合至它们的靶位点,并发现具有核酸酶活性。
本文所述的zfp还可包含锌指蛋白和/或foki结构域的磷酸接触残基的一个或多个突变,例如,nr-5qabc突变体(至zfp主链)和/或r416s和/或k525s突变体(至foki),描述于美国专利公开号20180087072。例如,zfnsbs#68812和sbs#68813包含zfp主链中和foki结构域中的突变,以减少与dna主链的非特异性磷酸接触,并在表1中指示突变。
因此,本文所述的核酸酶(例如,包含zfp的核酸酶)结合其靶位点并切割tcra基因,因此在包含seqidno:1-2中任一者的tcra基因内进行遗传修饰,包括这些序列中任一者内和/或其附近(例如,seqidno:1-2中任一者所示的靶序列;和/或成对的靶位点之间)的修饰(插入和/或缺失);和/或外显子2的ttgaaa内的修饰。本文所述的核酸酶(例如,包含zfp的核酸酶)结合其靶位点并切割b2m基因,因此在包含seqidno:3-4中任一者的b2m基因内进行遗传修饰,包括这些序列中任一者内和/或其附近(例如,seqidno:3-4中任一者所示的靶序列;和/或成对的靶位点之间)的修饰(插入和/或缺失);和/或外显子1的gcctta内的修饰。本文所述的核酸酶(例如,包含zfp的核酸酶)结合其靶位点并切割hprt基因,因此在包含seqidno:5-6中任一者的hprt基因内进行遗传修饰(例如,插入编码car的转基因),包括这些序列中任一者内和/或其附近(例如,seqidno:5或6中任一者所示的靶序列;和/或成对的靶位点之间)的修饰(插入和/或缺失)和/或外显子1内的修饰,包括其中由内源性hprt启动子表达转基因(但是不表达hprt基因)的修饰。参见图1。
此外,当与一个或多个转录调节结构域相关联时,所有与其靶位点结合的dna结合结构域(zfp)以及识别这些靶位点(长度为表1所示靶序列的12或更多个核苷酸的靶位点)的zfp、tale和srnadna结合结构域还形成有活性的经工程改造的转录因子。
实施例2:构建具有cd19的k562细胞
简而言之,将正常k562细胞在含10%fbs的rpmi培养基中培养,然后在amaxa电穿孔装置中电穿孔,存在40ug/ml编码hprt特异性zfn的mrna(37706/48407),其靶向人hprt基因内含子1,还有50ug/ml质粒,其包含由ef1a启动子驱动的人cd19表达盒(ncbi基因id:930,经密码子优化)和侧接hprt基因中zfn切割位点的同源臂。电穿孔后,允许细胞在培养基中过夜恢复,然后以6um的浓度添加6-硫鸟嘌呤(6-tg),并将细胞培养27天。为了评估cd19表达,使用靶向人cd19胞外域的pe-cy7偶联的抗体对细胞进行染色。对未修饰的(“原初”)k562细胞进行类似培养并染色作为阴性对照。该结果(图2)显示只有接受了cd19转基因的细胞才被抗体染色。
实施例3:通过cd19-cart细胞的抗原特异性细胞杀伤
接下来,进行实验以产生这样的细胞,所述细胞具有靶向插入tcra或b2m基因座中的gfp或cd19car表达盒(kochenderfer等(2009)jimmunother32(7):689-702)。通过电穿孔,将tcra特异性zfn对sbs#55266/sbs#53853或b2m对sbs#57071/sbs#57531(所有均示于表1)以mrna形式引入t细胞或k562细胞,以及编码转基因表达盒(gfp或cd19-car)的aav6载体,所述转基因表达盒通过同源臂侧接trac或b2m切割基因座,以实现同源定向的靶向插入。
简言之,在x-vivo15t细胞培养基中,将1:1比例的cd4:cd8人t细胞解冻并用cd3/28
(a)未转染:未添加zfnmrna或aav供体的电穿孔细胞;
(b)仅使用b2mzfnmrna的电穿孔细胞,无aav6供体;
(c)仅使用tcrazfnmrna的电穿孔细胞,无aav6供体;
(d)使用b2mzfnmrna和aav6b2mha;hpgk-egfp-bgh多聚a供体的电穿孔细胞;
(e)使用tcrazfnmrna和aav6tcraha;hpgk-egfp-bgh多聚a供体的电穿孔细胞;
(f)使用b2mzfnmrna和aav6b2mha;hpgk-fmc63-cd8bbz(cd19car)-bgh多聚a供体的电穿孔细胞;
(e)使用tcrazfnmrna和aav6tcraha;hpgk-fmc63-cd8bbz(cd19car)-bgh多聚a供体的电穿孔细胞;
如上所注释,上述缩写指代:ha=同源臂;b2m=b2m基因;pgk=pgk启动子;bgh=来自牛生长激素(bgh)基因的多聚a序列;fmc63是来自nci的抗cd19scfv序列(参见美国专利号9,701,758);cd8bbz指不含scfv的car部分=cd8铰链/跨膜结构域(cd8),来自41bb基因的共刺激结构域(bb),来自cd3z基因的激活结构域(z)。
所有实验在电穿孔其间以3e7个细胞/ml的细胞密度进行。接下来的一天(第4天),将细胞稀释至0.5e6个细胞/ml,并且在37℃转移至培养物。3天后(第7天),再次将细胞稀释至0.5e6个细胞/ml。另培养3和7天后(分别为第10天和14天),收获细胞用于facs和miseq分析(稀释至0.5e6个细胞/ml)。数据示于下表2。
表2:zfn的活性
然后,测量功能活性。首先,使用原初k562细胞与实施例2中表达cd19的k562细胞混合,制备50:50的混合物。使用未转染的t细胞或tcra敲除的t细胞处理该混合物。结果示于图3,其中图3a-3c显示了单独的,使用原初t细胞处理的,或使用tcra敲除的t细胞处理的混合物。使用cd19特异性抗体对细胞染色,添加t细胞并不影响任一k562细胞群。
然后,使用携带插入b2m或tcra基因座中的car转基因的t细胞处理类似的50:50混合的靶细胞。原初和cd19+k562靶标的群体经一系列效应物:靶细胞比例处理,从2:1效应物:靶标至0.125效应物:靶标。该结果表明,car插入进入b2m或tcra基因导致功能性car的表达(比较4a与4b)。对于两个car-t细胞群,在效应物:靶标比率为2:1时,几乎所有cd19+k562细胞都被杀死(使用在b2m或tcra基因处具有插入的car的t细胞进行处理后,剩下的cd19+k562细胞分别为0.4%和0.1%)。
最后,绘制剩余的cd19+k562细胞百分比与效应物:靶细胞比例的关系图(图5),这证明了两种类型的car-t细胞在杀伤表达靶向的抗原的细胞方面均具有活性和作用。
如上所示进行第二个实验,其中实验条件相同,除了同时使用tcra和b2m特异性zfn(双敲除)和包含tcra特异性同源臂的cd19car转基因供体来处理细胞。数据显示于下表3和图6。
表3:tcra和b2m的双重切割,zfn介导的cd19car插入tcra基因座
如上所述进行第三个实验,其中在给予不同剂量的trac核酸酶后,还评估了使用trac特异性核酸酶处理的t细胞的基因型和表型。如图7和表4所示,核酸酶介导的trac修饰可产生>95%的具有trac敲除基因型(trac插入缺失)和表型(cd3阴性)的细胞。
表4:trac敲除剂量滴定
此外,如图8所示,facs分析显示,在不进行选择的情况下,trac的核酸酶介导的失活(敲除)始终实现了至少99.5%的表面tcr(cd3)损失。同样,如图9所示,经由这些基因的特异性核酸酶切割整合到trac(左组图)或b2m(右组图)中的转基因(gfp)导致高效的转基因表达(trac为93%,而b2m为91%),如通过facs分析确定。在该实验中,在没有供体的情况下,93%的细胞在trac和b2m基因座处都已敲除。
还使用trac和b2m核酸酶(以使这些基因失活)联合包含靶向trac基因(同源臂)的car(cd19)转基因的aav供体在单一步骤中(共给予trac和b2m和供体)处理健康供体t细胞。如图10所示,在单一编辑步骤中实现高效的car表达(>75%的细胞)和trac/b2m敲除(分别为>94%和>88%)。
进行第四组实验,以评估“多重”敲除t细胞中多个遗传基因座联合插入gfp供体和/或cd19car的效率。第一个实验通过在trac(使用sbs68812/sbs68813)和b2m(使用sbs57071/sbs57531)处切割测试了整合两个供体转基因的效率。在该实验中,cd19car供体包含trac同源臂,并且经由aav转导引入细胞。gfp供体包含b2m同源臂,并且经由aav转导引入细胞。
如图11所示,靶基因以高于90%的效率切割,并且当供体添加后,gfp供体的靶向整合发生率为90%,而cd19car供体的靶向整合发生率为77%。cd19car整合的结果与仅使用cd19car转基因的图10c所示的结果一致。因此,cd19car在切割的trac基因座处的整合效率不受在切割的b2m基因座处同时整合的gfp转基因的影响,反之亦然。
在另一个实验中,使用sbs68812/sbs68813trac试剂和sbs57071/sbs57531b2mzfn试剂。如上文表1所示,还使用了靶向cish基因座(检查点基因,参见美国临时申请号62/583,724)的第三组zfn试剂(sbs59488/sbs59489)。
在上述方法中,cish特异性试剂与trac-和b2m-特异性zfn联用。除了各种zfn对以外,还使用aav-gfp供体处理了细胞,并将所得的敲除和整合数据示于图12a。对于使用包含trac同源臂的gfp供体和多种不同核酸酶处理的细胞,敲除和供体整合数据如下表5所示。使用先前实验中产生的cd19car转基因供体效率数据(如图11所示),估算了cd19car转基因整合进入trac基因座的预计效率,并将该估算数据示于图12b和表5。
表5:多重基因编辑和靶向整合
*基于先前cd19car靶向整合进入trac的预计效率使用cd19car的预测效率,如图11所示。
因此,如本文所示,使用本文所述的方法以高速率获得car+修饰的细胞。
实施例4:工程改造细胞以表达car和修饰的hla-e和/或hla-g
按照实施例3中所述方法产生表达cd19car和修饰的hla-e和/或hla-g复合物的细胞。简言之,将tcra特异性zfn对sbs#55266/sbs#53853或b2m对sbs#57071/sbs#57531(均示于表1)通过电穿孔作为mrna与编码转基因表达盒(gfp或cd19-car或cd19-hla-e和cd19-hla-g中的一种或两种)的aav6载体一起引入t细胞,所述转基因表达盒通过同源臂侧接trac或b2m切割基因座,以实现同源定向的靶向插入。
使用fac分析以及对两种细胞表面蛋白具有特异性的标记抗体,对细胞进行cd19特异性car表达和hla-e或hla-g表达表征。fac分析证明细胞同时表达cd19特异性car和修饰的hla-e和/或hla-g复合物。如上所述测定cd19特异性car的活性,并发现细胞能够进行cd19car介导的杀伤。使用本领域已知的方法对细胞进一步进行试验以监测通过nk细胞的细胞杀伤(例如,铬释放试验等)。包含cd19car和修饰的hla-e或hla-g复合物的细胞比缺少修饰的hla-e或hla-g复合物的细胞对于nk介导的杀伤更耐受。
使用靶向trac和b2m基因座的蛋白质编码区的zfn对(对于trac使用sbs#68877/sbs#68876,而对于b2m使用sbs#57071/sbs#57531)。简言之,在x-vivo15t细胞培养基中,将1:1比例的cd4:cd8人t细胞解冻并用cd3/28dynabead(1:3细胞:珠比例)活化(第0天)。培养3天后(第3天),在存在zfnmrna的maxcyte电穿孔缓冲液中将细胞浓缩至3e7个细胞/ml,然后使用maxcyte装置电穿孔。然后将浓缩的电穿孔的细胞置于组织培养孔中,然后将包含转基因供体的aav6加入浓缩的细胞中,允许其恢复并在37℃孵育20分钟。然后将细胞在培养基中稀释至3e6个细胞/ml,并在30℃下培养过夜。次日早晨,在另外的培养基中将细胞稀释至0.5e6个细胞/ml。
下述为各组的说明(所有zfn均以每种zfn60ug/mlmrna电穿孔,并以1e5个病毒基因组/细胞添加aav6供体)。aavb2m-hla-g融合转基因由pgk启动子驱动,trac同源臂表达b2m-hla-g融合转基因。简言之,b2m-hla-g转基因包括全长b2m基因,其包括前导信号肽序列,但末端缺少终止密码子,其后是(g4s)4接头,后跟全长hla-g*01:01序列,减去前导信号肽。在合成之前,对整个b2m-hla-g融合盒进行了密码子优化(图13)。
实验以3e7个细胞/ml的细胞密度使用如美国专利公开号20170137845中所述的方案进行,并且在电穿孔后在30℃过夜培养以冷激。接下来的一天(第4天),将细胞稀释至0.5e6个细胞/ml,并且在37℃转移至培养物。3天后(第7天),再次将细胞稀释至0.5e6个细胞/ml。在第10天,收获细胞用于facs分析(稀释至0.5e6个细胞/ml)。
对于facs分析,在100μl染色缓冲液(含1%bsa和0.02%nan3的pbs)中进行细胞表面染色,该染色缓冲液含有对正在研究的各种细胞表面抗原具有特异性的荧光染料偶联的抗体。根据下表6中详述的第1组或第2组规格制备抗体混合物。重悬于任一抗体混合物中的细胞在黑暗中孵育30分钟,并用pbs洗涤两次,然后在流式细胞仪上采集数据。
对于胞内染色,首先将细胞重悬于100μl的cytofix/cytopermtm溶液中,并在4℃下孵育20分钟。使用1xperm/wash溶液洗涤细胞两次后,将固定的细胞重悬于任一抗体混合物中,黑暗中30分钟。使用1xperm/washtm溶液洗涤细胞两次,然后在流式细胞仪上采集数据。
表6:使用的抗体混合物
如图14所示,b2m-hla-g融合蛋白在缺乏内源性b2m和trac基因座表达的t细胞的胞内和表面上阳性表达。图14a通过流式细胞术显示了,zfn介导的tracko实现了97%表面cd3表达的损失(左组图)且b2mko实现了81%表面hlai型分子(hla-abc,右组图)的损失。浅灰色峰对应模拟或未处理的t细胞,而深灰色峰对应zfn处理的细胞。通过表达上述b2m-hla-g转基因的aav6供体转导双重kot细胞。图14b和14c显示了双重kot细胞中b2m和hla-g的成功表达,所述双重kot细胞使用表达融合b2m-hla-g转基因的aav6供体转导,用于靶向整合到trac基因座中。具体来说,因为hla-g不是在t细胞上自然表达的,因此14b和14c中的hla-g深灰色峰证明了b2m-hla-g转基因的阳性整合及其在胞内和在细胞表面上的表达(左组图)。浅灰色的峰对应这样的细胞,所述细胞对于cd3和b2m为双重ko,但未用aav供体转导。b2m-hla-g转基因的表达进一步通过14b和14c右组图中阳性b2m浅灰色峰支持,其中b2m的表达是由于b2m-hla-g构建体整合进入缺乏内源性b2m的细胞中,并在胞内和细胞表面都检测到信号。较深的灰色峰是缺少b2m表达的细胞。
因此,实现了有效的核酸酶介导的细胞修饰。
实施例5:靶向整合
a.b2m
靶向b2m基因座的蛋白质编码区的靶向b2m的zfn对sbs#57071/sbs#57531用于各种供体构建体的靶向整合,如下所述。简言之,在包含il2的x-vivotm15t-细胞培养基中,将1:1比例的cd4:cd8人t细胞解冻并用cd3/28dynabead(1:3细胞:珠比例)活化(第0天,lonzabiowhittaker)。培养3天后(第3天),在存在zfnmrna的maxcyte电穿孔缓冲液中将细胞浓缩至3e7个细胞/ml,然后使用maxcyte装置电穿孔。然后将浓缩的电穿孔的细胞置于组织培养孔中,然后将包含转基因供体的aav6加入浓缩的细胞中,允许其恢复并在37℃孵育20分钟。使用的供体构建体如下:
(1)具有长同源臂(长臂)的供体,其包含下述序列:pgk启动子序列,其可操作地连接至侧接大小各自为约1kb的同源臂(对于b2m)的gfp转基因;
(2)具有短同源臂(短臂)的供体,其包含下述序列:pgk启动子序列,其可操作地连接至侧接大小各自为约250bp的同源臂(对于b2m)的gfp转基因;
(3)(2)中所述的供体还包含3’utr中的wpre序列,所述wpre序列包含
aatcaacctctggattacaaaatttgtgaaagattgactggtattcttaactatgttgctccttttacgctatgtggatacgctgctttaatgcctttgtatcatgctattgcttcccgtatggctttcattttctcctccttgtataaatcctggttgctgtctctttatgaggagttgtggcccgttgtcaggcaacgtggcgtggtgtgcactgtgtttgctgacgcaacccccactggttggggcattgccaccacctgtcagctcctttccgggactttcgctttccccctccctattgccacggcggaactcatcgccgcctgccttgcccgctgctggacaggggctcggctgttgggcactgacaattccgtggtgttgtcggggaagctgacgtcctttccatggctgctcgcctgtgttgccacctggattctgcgcgggacgtccttctgctacgtcccttcggccctcaatccagcggaccttccttcccgcggcctgctgccggctctgcggcctcttccgcgtcttcgccttcgccctcagacgagtcggatctccctttgggccgcctccccgcctg(seqidno:64);
(4)(2)中所述的供体还包含pgk启动子上游的t细胞增强子序列,如下所示:
gatatcattggtcaattgcagcagacatgtctcttgtggtgtaaagcctcatagcatcttcctgctggagtccacctggcagcccaaagcctcagcaagtgctggggacagagagatagaaaggctttgctgtggctcaactcagttgtactttctcaagctccttttggttatctgctctgtctatgtagttgcttcctggaaaatggttaaagtcaaacctcctctgtttggggcagcacaaaatgttgctaaggcgttagaagacaacataggagcagttaaaccacagccagtttttgctcgctttcgaaagaccacagctattagacagaaaacctcctgtactggaagtggccctgaaacagcatctgtgctgacagacactgggcttgctatggttgctgctcatcatgctcagctg(seqidno:65);或
(5)(2)中所述的供体还包含tcrα增强子序列,如下所示
ctcccatttccatgacgtcatggttaaacctcttttacctgctttaaccctttgaagctctcccgcagaagccacatcctctg(seqidno:66);
(6)(2)中所述的供体还包括来自非洲爪蟾蜍(xenopus)β球蛋白基因5'非翻译区的序列:
tgcttgttctttttgcagaagctcagaataaacgctcaactttggcagat(seqidno:67)
然后将细胞在培养基中稀释至3e6个细胞/ml,并在30℃下培养过夜。
所有zfn均以每种zfn60ug/mlmrna电穿孔,并以1e5个病毒基因组/细胞添加所有aav6供体。所有的实验都以3e7个细胞/ml的细胞密度使用如美国专利公开号20170137845所述方案(极端冷激)进行,并且在电穿孔后在30℃过夜培养以冷激。
接下来的一天(第4天),将细胞稀释至0.5e6个细胞/ml,并转移至37℃培养物。3天后(第7天),再次将细胞稀释至0.5e6个细胞/ml。另培养3和7天后(分别为第10天和14天),收获细胞用于facs和miseq分析(稀释至0.5e6个细胞/ml)。
如图15a和b所示,gfp表达指示靶向整合成功并获得在zfn靶位点内b2m基因组修饰(插入缺失和t1)的经遗传修饰的细胞,如本文所述。
最高平均荧光强度(mfi)存在于含增强子的构建体中,相较于包含短同源臂的标准构建体,其显示出65%的改善。
b.靶向将供体整合入b2m/trac双重敲除细胞
此外,还使用b2m和traczfn和各种供体如上所述进行了实验(除了使用含10%人血清和il-2的rpmi作为培养基)以生成trac/b2m双重敲除(dko)和整合的转基因,包括整合的hla-e或hla-g转基因。上文图17和19的描述中详细描述了供体,如下所示:
(1)包含423bp的左臂和393bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的gfp转基因。供体还包含“miseq标签”,其允许通过miseq对进入trac基因座的ti定量。
(2)具有1000bp的左臂和992bp的右臂的供体,其对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的gfp转基因。供体不包含“miseq标签”;
(3)包含350bp的左臂和393bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动并后跟突变的wpre元件的gfp转基因。供体还包含“miseq标签”;
(4)包含423bp的左臂和393bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的fmc63-cd8bbzcar转基因。供体还包含“miseq标签”;
(5)包含423bp的左臂和393bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动并后跟突变的wpre元件的fmc63-cd8bbzcar转基因。供体还包含“miseq标签”;
(6)供体包含360bp的左臂和393bp的右臂,所述臂对侧接fmc63-cd8bbzcar转基因的trac位点e具有同源性,所述fmc63-cd8bbzcar转基因通过自切割p2a肽与表达b2m和hla-e的融合蛋白连接。该转基因通过hpgk启动子驱动并后跟突变的wpre元件。供体还包含“miseq标签”;
(7)供体包含360bp的左臂和393bp的右臂,所述臂对侧接fmc63-cd8bbzcar转基因的trac位点e具有同源性,所述fmc63-cd8bbzcar转基因通过自切割p2a肽与表达b2m和hla-g的融合蛋白连接。该转基因通过hpgk启动子驱动并后跟突变的wpre元件。供体还包含“miseq标签”;
(8)包含1000bp的左臂和992bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的hla-g转基因;
(9)包含1000bp的左臂和992bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的hla-e0101转基因;
(10)包含1000bp的左臂和992bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的hla-e0103转基因;
(11)包含1000bp的左臂和992bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的hla-g转基因;
(12)包含1000bp的左臂和992bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的连接的b2mhla-g转基因。b2m和hla-g之间的接头包含2个拷贝的g4s肽。hla-g不包含信号肽;包含1000bp的左臂和992bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的连接的b2mhla-g转基因。b2m和hla-g之间的接头包含4个拷贝的g4s肽。hla-g不包含信号肽;
(13)包含1000bp的左臂和992bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的连接的b2mhla-g转基因。b2m和hla-g之间的接头包含6个拷贝的g4s肽。hla-g不包含信号肽;
(14)包含1000bp的左臂和992bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的hla-e0101转基因;
(15)包含1000bp的左臂和992bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的hla-e0103转基因;
(16)包含1000bp的左臂和992bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的连接的b2mhla-e0101转基因。b2m和hla-e0101之间的接头包含4个拷贝的g4s肽。hla-e0101不包含信号肽(celik等,同上);
(17)包含1000bp的左臂和992bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的连接的b2mhla-e0101转基因;b2m和hla-e0101之间的接头包含4个拷贝的g4s肽。hla-e0103不包含信号肽;
(18)包含1000bp的左臂和992bp的右臂的供体,所述臂对trac位点e具有同源性,所述trac位点e侧接通过hpgk启动子驱动的gfp转基因;
(19)供体包含360bp的左臂和393bp的右臂,所述臂对侧接fmc63-cd8bbzcar转基因的trac位点e具有同源性,所述fmc63-cd8bbzcar转基因通过自切割p2a肽与表达b2m和hla-g的融合蛋白连接。该转基因通过hpgk启动子驱动并后跟突变的wpre元件。供体还包含“miseq标签”。
使用所示的示例性供体的结果示于图17和19中,其中,核酸酶介导的靶向整合有效地整合供体的转基因。图18显示了图17所示样品的流式细胞术结果。图20-26显示了所示供体(图19)的结果。
如所示,靶向整合导致表达,包括car+细胞(靶向tcr基因)也表达b2m-hla-e或hla-g融合蛋白。
本文中提及的所有专利、专利申请和出版物均以参考的方式用全文纳入本文。
尽管出于理解清楚的目的,本发明通过说明和示例的方式提供了一些细节,但本领域技术人员可理解在不偏离本发明的精神或范围的情况下可实施各种改变和改进。因此,上述说明和实施例不应理解为是限制性的。
- 还没有人留言评论。精彩留言会获得点赞!