端到端细胞治疗自动化的制作方法
本公开提供了利用完全封闭的细胞工程系统生产包括嵌合抗原受体t(cart)细胞的基因修饰的免疫细胞的自动化方法。
背景技术:
随着对先进细胞疗法的临床加速采用的期望增加,越来越多的注意力转向使这些疗法惠及全世界的患者的基本制造策略。尽管细胞疗法在临床上具有广阔的前景,但相对于报销而言,制造高成本给实现商业化带来了巨大的障碍。因此,对成本效率、过程效率和产品一致性的需求推动了许多细胞治疗领域对于自动化的投入,尤其是t细胞免疫疗法中自动化的投入。(参见,例如,wang2016)。
使用嵌合抗原受体(car)t细胞的免疫疗法试验的近期成功临床结果为患有先前无法治愈的癌症的患者带来了新的希望(参见,例如,lu2017;berdeja2017;kebriaei2016)。随着这些新颖的疗法从临床试验阶段发展到商业规模化,与细胞制造相关的挑战出现了(参见,例如,morrissey2017)。
由于患者特异性产品,这些细胞的产生可能需要大量的人工干预。由于多种敏感的单位操作(包括细胞活化、转导和扩增),cart细胞培养的自动化尤其具有挑战性。活化可能特别重要,因为此过程的效率会影响转导和扩展。
将细胞活化、转导和扩增整合到商业生产平台中对于将这些重要的免疫疗法转化为广大患者群体至关重要。为了使这些挽救生命的治疗方法适用于全球患者,必须改变制造技术以支持个性化医疗。先前已经描述了自动化的好处(例如,参见trainor2014;mahdavi2015)。这些好处包括节省与使用自动化相关的劳力时间,以及改进的产品一致性,减少的房间分类,减少的洁净室占地面积,减少的培训复杂性以及改进的扩增规模和跟踪物流。此外,可以使用软件通过使用自动生成的电子批次记录来简化所有记录过程,以提供所有处理设备、试剂、患者标识、操作员标识、过程中传感器数据等的历史记录。
技术实现要素:
在本文提供的一些实施例中,是用于自动产生基因修饰的免疫细胞培养物的方法,该方法包括:用活化剂活化免疫细胞培养物以产生活化的免疫细胞培养物;用载体转导活化的免疫细胞培养物以产生转导的免疫细胞培养物;扩增转导的免疫细胞培养;浓缩(c)中的扩增的免疫细胞培养物;收获(d)中的浓缩免疫细胞培养物以产生基因修饰的的免疫细胞培养物,进一步包括洗涤扩增的免疫细胞培养物和浓缩的免疫细胞培养物之一或两者,其中(a)至(e)由完全封闭的细胞工程系统进行,并且(a)至(e)通过产生基因修饰的免疫细胞培养物的方法进行优化。
在进一步的实施例中,本文提供了用于促进基因修饰的免疫细胞培养物的优选表型的方法,该方法包括:用活化剂活化免疫细胞培养物以产生活化的免疫细胞培养物,其中活化剂和活化条件促进了基因修饰的免疫细胞培养物的表型;用载体转导活化的免疫细胞培养物以产生转导的免疫细胞培养物;扩增转导的免疫细胞培养;浓缩(c)中的扩增的免疫细胞培养物;收获(d)中的浓缩免疫细胞培养物以产生基因修饰的的免疫细胞培养物,其中(a)至(e)由完全封闭的自动化细胞工程系统进行。
在另外的实施例中,本文提供了用于自动产生基因修饰的免疫细胞培养物的方法,该方法包括:用活化剂活化免疫细胞培养物以产生活化的免疫细胞培养物;用载体转导活化的免疫细胞培养物以产生转导的免疫细胞培养物;扩增转导的免疫细胞培养;浓缩(c)中的扩增的免疫细胞培养物;收获(d)中的浓缩免疫细胞培养物以产生基因修饰的的免疫细胞培养物,其中(a)至(e)由完全封闭的自动化细胞工程系统执行,和其中(a)至(e)中的每一个都是用具有优化的细胞密度(细胞/ml)和优化的细胞融合度(细胞/cm2)的免疫细胞培养物进行的。
在另外的实施例中,本文提供了用于自动产生基因修饰的免疫细胞培养物的方法,该方法包括:用活化剂活化免疫细胞培养物以产生活化的免疫细胞培养物;用载体转导活化的免疫细胞培养物以产生转导的免疫细胞培养物;扩增转导的免疫细胞培养,其中转导的细胞培养物在扩增过程中不摇动;浓缩(c)中的扩增的免疫细胞培养物;收获(d)中的浓缩免疫细胞培养物以产生基因修饰的的免疫细胞培养物,其中(a)至(e)由完全封闭的自动化细胞工程系统进行。
在另外的实施例中,本文提供了一种用于自动产生基因修饰的免疫细胞培养物的方法,该方法由细胞工程系统执行,包括:用活化剂活化免疫细胞培养物以在细胞工程系统的第一室中产生活化的免疫细胞培养物;转导活化的免疫细胞培养物,转导包括:将活化的免疫细胞培养物从第一室转移到电穿孔单元;用载体电穿孔活化的免疫细胞培养物,以产生转导的免疫细胞培养物;将转导的免疫细胞培养物转移至细胞工程系统的第二室;扩增转导的免疫细胞培养;浓缩(c)中的扩增的免疫细胞培养物;收获(d)中的浓缩免疫细胞培养物以产生基因修饰的的细胞培养物。
在另外的实施例中,本文提供一种用于自动化细胞工程系统中的盒(cassette),其包括:低温室,用于储存细胞培养基;进行免疫细胞培养的活化、转导和扩增的高温室,其中高温室通过热障与低温室隔开,该高温室包括细胞培养室;和连接到细胞培养室的一条或多条流体通路,其中流体通路提供再循环,废物的去除以及均匀的气体交换以及营养物向细胞培养室的分配,而不会干扰细胞培养室内的细胞。
在其他实施例中,本文提供了一种用于自动化细胞工程系统的盒,其包括:细胞培养室,用于进行免疫细胞培养物的活化、转导和/或扩增,其具有用于容纳免疫细胞培养物的室容积,卫星容积(satellitevolume),通过在不容纳免疫细胞培养物的情况下为培养基和其他工作流体提供额外的容积来增加室的工作容积,其中,卫星容积通过一个或多个流体通道与细胞培养室流体连接,使得培养基与培养室交换而不会干扰免疫细胞培养。
附图说明
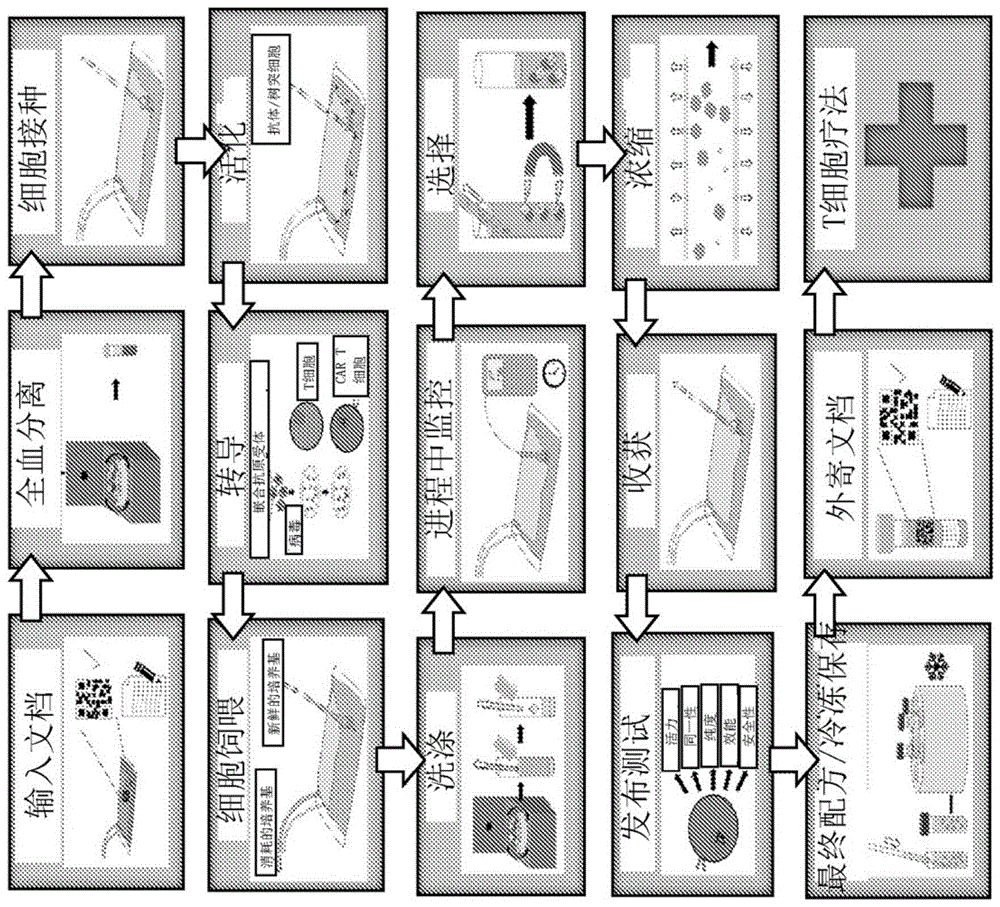
图1示出了嵌合抗原受体(car)t细胞的通用制造过程。
图2示出了包含如本文的实施例中所描述的示例性细胞工程系统的实验室空间。
图3示出了可以在如本文的实施例中所述的细胞工程系统中执行的cart细胞产生过程。
图4示出了cocoon系统和用于维持cd8+和cd4+细胞群体的控制方法之间的比较。
图5示出了cocoon系统与cd8+和cd4+细胞群体中cart细胞数量的控制方法之间的比较。
图6a-6c示出了示例1中所使用的cocoon系统的概况。图6a示出了处于闭合构造的cocoon系统。图6b示出了可以插入到cocoon中的盒。图6c示出了处于打开配置的cocoon系统。
图6d-6e示出了在cocoon系统中使用的细胞培养室的位置和方向。
图6f示出了在cocoon系统中使用的细胞培养室的更详细的视图。
图6g示出了用于cocoon系统的工艺流程图例。
图6h示出了使用cocoon系统的气体传输数据。
图7a-7c示出了实施例1中描述的实验结果,比较了cocoon系统中的gfp转导和手动操作。图7a示出了平均收获量的比较。图7b示出了平均收获能力的比较。图7c示出了平均转导效率的比较。
图8a-8b示出了实施例1中描述的实验结果,比较了cocoon系统和permalife袋中的her-2cart转导。图8a示出了活细胞产量的比较。图8b示出了活力和转导效率的比较。
图9a-9d示出了实施例1中描述的实验结果,比较了cocoon系统和permalife袋。图9a示出了相对cart纯度的比较。图9b示出了cd8+细胞百分比的比较。图9c和9d分别示出了tnfα和infγ的产生。
图10a-10b示出了实施例1中描述的实验结果,比较了在cocoon系统(图10a)和permalife袋(图10b)中培养的cart细胞对靶肿瘤细胞的杀伤力。
图11a-11e示出了如本文的实施例中所描述的cocoon系统的另一种配置。图11a示出了可以被装载到cocoon系统中的一次性t细胞盒。图11b示出了处于打开配置的cocoon系统。图11c示出了被装载到cocoon中的盒。图11d示出了处于闭合构造的cocoon。图11e示出了与cocoon一起使用的盒的详细视图。
图11f示出了使用注射器和袋来从盒中取样。
图12a示出了cart细胞生产过程的过程概述。图12b示出了正在进行cart细胞培养的cocoon盒细胞增殖室。图12c示出了在培养箱中使用细胞培养袋的手动操纵的cart细胞产生过程。
图13a-13h示出了实施例2中描述的实验结果,比较了permalife袋和cocoon系统以及通过免疫磁珠或okt3活化的t细胞。图13a比较了活细胞的产量。图13b比较了群体倍增水平(pdl)。图13c比较了存活的cd3+t细胞产量。图13d比较了cd3+细胞群体倍增水平。图13e比较了cd3+子集(cd4+和cd8+)的百分比。图13f比较了通过抗pd-1测量的细胞衰竭。图13g和13h分别示出了用免疫磁珠或okt3活化的cd8+cd3+t细胞的细胞计数图。
图14a-14f示出了实施例2中描述的实验结果,比较了permalife袋和cocoon系统。图14a比较了cd3+细胞的转导效率。图14b比较了存活的cart细胞的总数。图14c比较了t细胞群体(cd4+和cd8+)的转导效率。图14d按子集比较了总cart细胞。图14e和14f分别示出了在cocoon和permalife袋中的cd3+okt3活化的细胞的细胞计数图。
图15a-15f示出了实施例2中描述的实验结果,比较了permalife袋和cocoon系统。图15a比较了产生tnfα的细胞的百分比。图15b比较了产生ifnγ的细胞的百分比。图15c和15d分别示出了免疫磁珠活化的cocoon产生的分泌tnfα和ifnγ的细胞的细胞计数图。图15e和15f分别示出了从permalife袋或cocoon系统产生的cart细胞的肿瘤杀死效率。
图16示出了在cocoon和permalife之间的比较以及通过免疫磁珠或okt3活化的总结。
图17示出了根据本文的实施例的电穿孔单元与细胞工程系统的结合。
图18显示免疫细胞培养物从细胞工程系统流向电穿孔单元并再次返回的流程。
图19-20示出了如本文所述的人类干细胞实验的结果。
具体实施例
本公开提供了产生嵌合抗原受体t(cart)细胞的自动化方法。由于患者特异性的产品,cart细胞的生产通常需要人工参与。由于多种敏感的单位操作(包括细胞活化、转导和扩增),cart细胞培养的自动化尤其具有挑战性。因此,本文公开了利用完全封闭的细胞工程系统的cart细胞生产的自动化方法。
自动化细胞处理
对于自体细胞治疗,例如t细胞治疗,成本效益、过程效率和产品一致性的需求尤其迫切,因为批量生产(每批一名患者)缺乏同种异体(每批多个患者)过程可以利用的规模经济(例如,参见jones2012;trainor2014)。小批量生产所需要的更大、更本地化的劳动力和设施对物流,手工生产的gmp合规性提出了相当大的要求,尤其是在人员的可用性和培训方面。此外,操作者之间技术差异的潜在可能会给持续满足发布标准并确保安全可靠的产品带来不希望的风险。
如本文所述,自动化制造的安装和全面验证为这些后勤和操作挑战提供了解决方案。将自动化引入生产过程的一种重要方法是确定关键的模块化步骤,在该步骤中,操作员对生产物料进行物理或化学更改,称为“单元操作”。对于细胞制造,这包括细胞分离,基因操作,增殖,洗涤,浓缩和细胞收获等步骤。制造商通常将重点过程瓶颈视为引入自动化的直接机会。这反映在大多数市售生物反应器的技术操作范围内,这些反应器往往侧重于离散的工艺步骤。本文通过端到端自动化解决了细胞制造过程中的过程挑战(从无菌维护到样品跟踪),该过程可产生一致的细胞输出,同时减轻不可避免的过程可变性。本文描述的方法还提供了简化,并且相关的电子记录有助于遵守gmp标准(例如,参见trainor2014)。
单元操作的自动化和关键过程的敏感性
修饰的自体t细胞用于癌症免疫治疗的临床开发的最新快速进展,带来了相关转化和扩大/缩小含义的规划。
尽管针对t细胞生产的特定方案可能有所不同,但图1中示出了一种通用的嵌合抗原受体t细胞(cart)过程。图1描述了cart细胞制造的单位操作,从患者血液样本的初始处理到配制用于自体t细胞治疗的输出细胞。
如本文所述,为了实现细胞制造自动化,本文所述的方法用于理解每个过渡点处的细胞状态以及特定单元操作如何影响细胞状态。针对特定患者的疗法的小批量生产应尊重影响自动化可行性的关键过程敏感性。本文所述的自动化成功地包含了各种处理步骤。
下表1突出示出了t细胞自动化确定的某些工艺步骤所面临的挑战,并指出了敏感性对自动化策略的影响。请注意,对于所有单元操作,由于存在污染风险,因此在各个设备之间进行单元的开放式传输是关键的敏感性。
表1:自动化的挑战和收益
针对表1中列出的敏感度定制手动过程的自动化可以支持成功地转化、维护或改善细胞疗法的性能。
自动化单元操作的整合
在考虑gmp物流,自动化的经济性和患者安全性的同时,还可以在每个单位操作的典型劳动时间(包括操作员和质量保证监控器的工作时间)的背景下评估单位操作。表2列出了cart自动化中代表性步骤的名义手动处理时间表。下表突出显示了通用cart单元流程中每个单元操作所需的资源投入。对于每个步骤,都将确定自动化过程的估计剩余人工时间,以及减少的理由。
表2:减少工时的自动化
基于本文描述的方法,单元操作的自动化可以将名义上的手动过程减少近40小时,减少到原始时间的大约四分之一。
离散与完全集成自动化
尽管有令人信服的证据表明自动化的价值(参见,例如trainor2014;levine2017),需要对将这些自动化步骤以端到端的顺序与自动转移相集成的价值和实用性进行后续分析。关于离散过程自动化的优势与端对端集成的优势有不同的观点。
离散自动化的主要好处是灵活性。这涉及以下领域:
1)维护独特的流程操作
2)加快基于单位操作验证的转化活动
3)能够修改处理步骤以适应供体之间的差异
与增加的灵活性有关的第一点为操作员提供了对过程的更多控制。在过程具有可能影响最终产品的高度敏感步骤的情况下,这一点很重要。切换到多合一系统可能会施加影响产品结果的约束。离散方法提供了选择如何执行每个步骤的灵活性,这对于高度敏感的单元操作可能尤其重要。离散方法还允许从手动处理逐步转换为自动化,如果每个单元操作都可以独立测试,则有助于证明其等效性。此外,特定单元操作的自动化为基于细胞性能的决策提供了灵活性。例如,如果细胞迅速生长,则可能需要从一个细胞培养袋扩展到两个。最后,使用离散系统实现自动化的方法还使小组能够选择用于每个单元操作的设备。
设备利用率是离散自动化的另一个论点。某些单元操作可能需要比其他单元更多的时间。端到端处理系统要求所有多个单元操作都在单个系统上运行,因此在培养过程中会占用设备。
虽然离散自动化有好处,但是端到端方法提供了不同的、同样引人注目的好处。首先,完全集成的系统大大降低了污染的风险。由于离散方法需要增加处理量,因此由于操作员的干预,产品变化的可能性更大。其次,如前面所述,这不可避免地导致更高的劳动力成本。
离散方法提供的灵活性很重要。在过程对定义产品很重要的情况下,端到端系统应具有灵活性,可以集成独特的灵敏度。这可能包括某些饲喂策略,氧气水平,表面处理等。这种方法要求软件和一次性组件都具有灵活性。系统应提供在过程中各个点提取细胞和培养基样品的选项,以确认特定单元的操作符合产品规格检查点。如果需要进行修改,那么软件应能够实现这些更改以提供理想的条件。尽管易于使用和灵活的软件对于转化目的非常有用,但重要的是,可以轻松锁定该软件以符合临床标准(fda21cfr第11部分)。一旦锁定,操作员更改协议的能力将受到限制。但是,要解决供体固有的可变性问题,应该有选择权,可以根据细胞生长速率从一系列经过验证的方案中进行选择。例如,如果细胞生长迅速,则系统应能够对此做出响应并相应地调整饲料或收获时间点。
端对端集成与离散自动化的选择还取决于临床过程的远景。单一的多合一系统可以显着提高空间效率,以最大限度地减少昂贵的gmp洁净室中所需的占地面积。例如,如图2所示,完全集成的自动化系统被设计为最大化所需的占地面积,以减少昂贵的gmp洁净室空间。图2示出了在标准实验室空间中运行的96个特定于患者的端对端单元。
单个系统还提供了更大的数据跟踪便利性,而离散系统可能不提供将所有电子数据文件链接在一起的兼容软件。vineti(vinetiltd)和trakcel(trakcelltd)等软件平台可进行电子监控和组织供应链物流。但是,通过将与每个单元操作相关的处理事件和生物监控培养条件的历史记录合并到批记录中,单个多合一培养系统可以走得更远。因此,端到端集成的好处提供了显着的竞争优势。
单位运营整合的商业平台
在许多自体细胞疗法,特别是针对基于血液的癌症的免疫疗法中,临床试验的成功凸显了使新的临床方案转化成稳健的生产平台以满足预期的临床需求的重要性(参见,例如,levine2017;locke2017)。对于自体疗法,对每种患者特定的细胞疗法进行处理都适当地利用了全面的制造活动和运营管理。本文中的方法将交钥匙自动化系统中的单元操作链接在一起,以实现过程优化,安全性和经济性。
设计自体过程的挑战是双重的。首先,与异体制造不同,异体(allogeneic)制造可以在物理上独立且经过优化的设备中进行单独的处理,而横向扩展的自体平台则可以在一个封闭的,自包含的自动化环境中适当地执行所有必要的步骤。其次,与异体过程不同,异体过程理论上是从细胞库中的高质量小瓶开始的,具有已知的质量和可预测的过程行为,而自体过程中的起始原料则变化很大,并且通常来自健康状况不佳的个体。
因此,本文提供了能够通过控制诸如物理搅动,ph,饲喂和气体处理等因素来感测培养条件并相应地作为精密的生物反应器做出反应的方法。此外,与同种异体治疗相比,与自体治疗有关的技术转让面临着显着不同的挑战。自体产品可能对制造过程和患者治疗之间的稳定性有更大的限制。站点可以位于全球而不是单个中心。具有锁定(例如,全封闭)的多合一系统可以显着改善站点之间的技术转移过程。
虽然不能消除源变异性,但是自动化通过标准化和可再现性帮助消除了最终自体产品的变异性。领先的细胞系统提供商采用了这种做法,以通过生物传感器获取细胞性能参考点,该传感器可监测活跃细胞培养物的状态。在端到端集成中,过程中任何特定阶段的输出都应在可接受的参数范围内,以使过程继续进行。
如本文所述,在实施例中,提供的方法利用cocoon平台(octanebiotech(金斯敦,安大略省)),该平台将多个单元操作集成在一个交钥匙平台中。多个单元协议提供非常具体的单元处理目标。为了提供有效且高效的自动化转化,所描述的方法利用了结合了多个单元操作的特定于应用/特定于赞助者的一次性盒的概念-所有的方法都集中在最终细胞治疗产品的核心需求上。
本文描述的方法已经用于在完全集成的封闭自动化系统中扩增cart细胞(包括活化,病毒转导和扩增,浓缩和洗涤)(图3)。
在进行的实验中,在10-14天的培养中,cart细胞的扩增倍数达到40至60。成功的cart治疗需要cd4+和cd8+t细胞群体。因此,通过流式细胞术评估了运行和相关对照保持两种t细胞群体培养的能力。图4显示所有运行以及所有对照均能够维持两个t细胞群体。还评估了每个t细胞群体中存在的cart细胞的百分比(图5)。在所有样本中,与所有cd8+样本相比,cd4+样本中的ngfr(指示car构建体)的检测率更高,尽管在所有样本中,cd8+部分中的ngfr+比例是成对cd4+群体中的比例的50%以上。总之,使用本文所述方法的自动cart过程产生健康的t细胞群体。
自动化的优势
细胞疗法生产中单元操作的自动化为异体和自体细胞疗法应用中的普遍利益提供了机会。在特定于患者的自体细胞产品的独特场景中,以及这些疗法的最新临床成功日益强调,由于小批量gmp的依从性,经济性,患者的可追溯性和过程偏差的早期识别性都具有显著的微批复杂性,自动化的优势尤其引人注目。随之而来的是复杂的制造协议的出现,引起了人们的关注,即在微批次细胞生产中自动化单元操作的端到端集成的价值尚未成为重要的研究重点。但是,这些疗法在即将获得批准后,对这些疗法的预期需求表明,完全封闭的端到端系统的实施可以为制造瓶颈(如动手时间和占地面积)提供急需的解决方案。
鼓励高级疗法的开发者在临床转化的推出和临床试验方案的扩大中尽早考虑自动化。早期的自动化可以影响协议的开发,避免在以后从手动过程切换到自动化过程时进行可比性研究,并且可以更好地了解长期的商业化途径。
产生包括cart细胞在内的基因修饰的免疫细胞的方法
在实施例中,本文提供了用于自动产生基因修饰的免疫细胞培养物的方法。如本文所用,“基因修饰的免疫细胞培养物”(或基因修饰的免疫细胞)是指经修饰或引发(例如,通过与抗原呈递细胞共培养)的免疫系统的细胞,导致具有期望表型的细胞可用于治疗,预防或改善动物(包括人)中的一种或多种疾病。如本文所用,“免疫细胞培养物”是指通过本文所述的方法制备的细胞的集合,并且可以包括用于研究或临床试验以及向包括人患者在内的哺乳动物给药的细胞群,进行药物治疗。可以使用本文所述方法产生的经基因修饰的免疫细胞培养物可以包括肥大细胞,树突细胞,自然杀伤细胞,b细胞,t细胞等。
本文所述的各种方法也可以扩展至其他基因修饰的细胞培养物,包括例如基因修饰的人类干细胞培养物的生成,包括造血干细胞。
在示例性实施例中,该方法包括用活化剂活化免疫细胞培养物以产生活化的免疫细胞培养物,用载体转导活化的免疫细胞培养物以产生转导的免疫细胞培养物,扩增转导的免疫细胞培养,浓缩扩增的免疫细胞培养物并收获浓缩的免疫细胞培养物以产生基因修饰的的免疫细胞培养物。适当地,该方法进一步包括扩增的免疫细胞培养物和浓缩的免疫细胞培养物之一或两者。在实施例中,该方法的各个步骤由完全封闭的细胞工程系统执行,并通过产生基因修饰的免疫细胞培养物的方法进行优化。
用于优化产生遗传修饰的免疫细胞的过程的方法包括在开始自动化方法之前优化细胞培养条件,以及使用来自各种传感器等的反馈,以帮助实时修改生长条件(例如,气体浓度,培养基条件,温度,ph,废物和营养物浓度等)。
在实施例中,优化过程是自调节过程,即不需要外部(人类)用户输入的过程,并且能够经由各种计算机程序和条件来确定对细胞培养物的所需修饰或其他特征来优化自动化流程。在实施例中,自调节过程包括用温度传感器、ph传感器、葡萄糖传感器、氧气传感器、二氧化碳传感器和光密度传感器中的一个或多个进行监测。如本文所述,在完全封闭的细胞工程系统中使用这些各种传感器发生在系统中的不同时间和位置,并且一起工作以提供优化。例如,基于监测,自调节过程可以调节(例如,升高或降低)温度、ph值、葡萄糖水平、氧气水平、二氧化碳水平和转导的t细胞培养物的光密度中的一种或多种。
优化过程也可以基于起始细胞群的独特特征,包括例如总细胞数,细胞来源,细胞密度,细胞年龄等。这些开始的细胞种群特征可以在开始自动化方法之前输入到计算机控制系统中,然后系统将对其进行各种初始修改以优化方法,例如氧气和二氧化碳的浓度,流速,孵育时间,ph,等等,或者,对细胞过程的监控能够自动表征从起始种群开始的细胞培养序列的进程,从而能够逐案调整条件以优化最终的细胞培养特性。
在示例性实施例中,本文描述的方法产生至少约5,000万个存活的基因修饰的免疫细胞。在合适的实施例中,所描述的方法产生至少约1亿个存活的基因修饰的免疫细胞,或至少约2亿个细胞,至少约3亿个细胞,至少约4亿个细胞,至少约5亿个细胞,至少约6亿个细胞,至少约7亿个细胞,至少约8亿个细胞,至少约10亿个细胞,至少约11亿个细胞,至少约12亿个细胞,至少约13亿个细胞,至少约14亿个细胞,至少约15亿个细胞,至少约16亿个细胞,至少约17亿个细胞,至少约18亿个细胞,至少约19亿个细胞,至少约20亿个细胞,至少约21亿,至少约22亿,至少约23亿,至少约24亿,至少约25亿,至少约26亿,至少约27亿,至少约28亿,至少约29亿或至少约30亿个基因修饰的免疫细胞。
如本文所述,通过所述方法产生的经基因修饰的免疫细胞培养物适当地是t细胞培养物,包括嵌合抗原受体t(cart)细胞培养物。在此类实施例中,用于产生此类cart细胞的载体是编码嵌合抗原受体的载体。适当地,免疫细胞培养物包含外周血单核细胞和/或纯化的t细胞。在实施例中,免疫细胞培养物包含至少一种佐细胞,适当地是单核细胞或单核细胞衍生的细胞。如本文所述,在实施例中,佐细胞包含t细胞受体的抗原,包括cd28、cd40、cd2、cd40l和/或icos。
适当地,活化剂包括抗体或树突细胞。在实施例中,抗体被固定在表面上,该表面可以包括聚苯乙烯塑料,硅树脂或其他表面,包括例如珠的表面。
在其他实施例中,活化剂包含为可溶性抗体的抗体,包括抗cd3抗体和抗cd28抗体中的至少一种。示例性抗体包括okt3。
可以在自动化方法中使用各种转导细胞的方法,包括例如病毒感染、电穿孔、膜破坏或其组合。
在示例性实施例中,在该方法中使用的载体是慢病毒载体或逆转录病毒。适当地,转导包括将载体在细胞培养基中混合并将载体在培养基中均匀地递送至活化的免疫细胞培养物。如本文所述,以均一的方式将载体均匀地递送至细胞,这种传递提供了对高产量的期望的基因修饰的免疫细胞的各种细胞特性的优化。
如本文所述,扩增细胞的方法适当地包括转导的免疫细胞培养物的饲喂、洗涤、监测和选择中的至少一种或多种。
本文所述的各种方法以使得针对免疫细胞培养物优化转导的免疫细胞培养物的氧水平的方式进行。该优化允许产生具有所需表型特征的大量活细胞,包括如本文所述的促进所需细胞表型。在实施例中,在步骤(a)至(e)中的一个或多个步骤中,通过细胞工程系统通过氧合组分再循环细胞培养基来优化氧水平或浓度。如本文所述,充氧适当地通过一种或多种流体通路发生,包括硅基管部件。
在进一步的实施例中,细胞工程系统在各种方法过程中再循环营养物、废物、释放的细胞因子和/或溶解的气体。这种再循环有助于产生具有所需表型的大量活细胞。适当地,由细胞工程系统提供的二氧化碳水平在扩增步骤的步骤中降低,从而优化细胞生长等。在其他实施例中,例如,如果利用完整的介质交换,则可以提高co2水平。
用于优化细胞生长条件的其他机制包括改变和控制提供给细胞的培养基的流速。随着细胞开始生长,所提供的培养基的循环速率会增加,这会改善气体交换,并使氧气和二氧化碳进入或离开细胞培养物,具体取决于细胞的状况和当时的要求。
在实施例中,细胞工程系统被配置为执行饲喂,洗涤和监测中的一个或多个的几轮,并且在实施例中,选择转导的免疫细胞培养物。这些各种活动可以以任何顺序执行,并且可以单独执行或与其他活动组合执行。在实施例中,细胞的浓缩包括离心、沉淀后除去上清液或过滤。适当地,优化过程还包括适当地在自调节过程中调节离心或过滤的参数。转导细胞的选择可以通过例如磁分离,过滤,粘附到塑料或其他基底等来进行。
在本文所述的实施例中,细胞工程系统包括多个室,并且其中所述方法的每个步骤在细胞工程系统的多个室中的不同室中进行。
适当地,该方法进一步包括在步骤(a)之后从活化的免疫细胞培养物中除去活化剂,并且可以包括在转导步骤之后除去载体。通过洗涤,沥干或物理去除细胞或活化剂,可以适当地从免疫细胞培养物中除去活化剂。可以通过洗涤或通过将载体结合至表面(例如,反粘连蛋白或纤连蛋白包被的表面)上,然后将细胞转移至不同的室中来除去载体。
在示例性实施例中,细胞工程系统在开始该方法之前包含细胞培养物、活化剂、载体和细胞培养基。在其他实施例中,活化剂和/或载体可以在生产方法开始之后或在过程中的任何合适时间分别添加。
在另外的实施例中,本文提供了用于促进基因修饰的免疫细胞培养物的优选表型的方法,该方法包括用活化剂活化免疫细胞培养物以产生活化的免疫细胞培养物,其中活化剂和活化条件促进基因修饰的免疫细胞培养物的表型,用载体转导活化的免疫细胞培养物,产生转导的免疫细胞培养物,扩增转导的免疫细胞培养物,浓缩扩增的免疫细胞培养物,收获(d)中的浓缩免疫细胞培养物以产生基因修饰的的免疫细胞培养物。如本文所述,所述方法由完全封闭的自动化细胞工程系统适当地进行。
如本文所述,适当的活化剂和适当的活化条件的选择为基因修饰的免疫细胞培养物的理想表型的促进作了准备。即,可以特异性地选择和促进免疫细胞培养物的表型,使得通过所述方法产生的合适的大多数细胞具有所需的优选表型。在其他实施例中,可以控制和促进一种细胞表型与另一种表型的期望比率,从而提供理想的,优选的表型平衡。
如本文所述,已经发现通过使用活化剂,所述活化剂是抗体,特别是可溶性抗体,可以促进基因修饰的免疫细胞的期望表型。适当地,所使用的抗体是抗cd3抗体、抗cd28抗体和抗cd2抗体中的至少一种,包括可溶性抗体okt3。
在实施例中,活化条件提供了基本上不受干扰的免疫细胞培养物,从而允许活化剂和免疫细胞培养物之间的稳定接触。如本文所述,已经发现允许细胞在基本上不受干扰的条件下并通过使用平坦且基本上非柔性的细胞培养室来活化。这提供了一种环境,在该环境中,细胞可以与活化剂均匀接触,并与必需的营养素,溶解气体等相互作用,以实现所需的表型。
本文所述的方法可以通过选择合适的活化方法以提供优选的表型来影响最终免疫细胞培养产物的特性。例如,如本文所述,利用基于珠的过程的活化促进了更平衡的cd4:cd8比率,而可溶性抗cd3的使用促进了比cd4更高的cd8群体。也可以使用本文描述的方法提供其他水平的cd8和cd4。在示例性实施例中,如本文所述,所述方法可用于制备cart细胞。适当地,该方法可用于促进具有cd8+细胞与cd4+之比约为0.1:1至约10:1的cart细胞表型,包括cd8+细胞与cd4+细胞的比例为约0.5:1至约5:1,约0.8:至约3:1或约1:1,约2:1等。
在另外的实施例中,提供了用于自动产生基因修饰的免疫细胞培养物的方法,该方法包括:用活化剂活化免疫细胞培养物以产生活化的免疫细胞培养物,用载体转导活化的免疫细胞培养物,以产生转导的免疫细胞培养物,扩增转导的免疫细胞培养,浓缩(c)中的扩增免疫细胞培养物,收获(d)中的浓缩免疫细胞培养物以产生基因修饰的免疫细胞培养物。如本文所述,该方法由完全封闭的自动化细胞工程系统适当地进行。在实施例中,用具有优化的细胞密度(细胞/ml)和优化的细胞融合度(细胞/cm2)的免疫细胞培养物进行所述方法的每个步骤。
如本文所述,已经确定利用优化的细胞密度(每毫升细胞培养基中的细胞)和/或细胞融合度(细胞在其上作用并生长的细胞培养室的每单位面积(cm2)的细胞),提供增加的活细胞产量,以及更好地控制细胞表型等。
在实施例中,针对的最佳细胞密度为约0.05×106个细胞/ml至约60×106个细胞/ml,约0.05×106个细胞/ml至约40×106个细胞/ml或约0.05×106个细胞/ml至约20×106个细胞/ml。优化的细胞密度可以在生产方法的过程中变化,从而在方法的每个阶段(即例如,活化,转导,扩增,浓缩),控制或操纵细胞密度以为该方法的特定步骤提供最佳细胞密度。可以通过例如选择最佳的起始细胞密度,增加或减少氧气和/或二氧化碳的浓度,调节ph值,温度,营养物质,去除废物等来优化细胞密度。示例性细胞密度包括约0.05×106个细胞/ml,约0.08×106个细胞/ml,约1×106个细胞/ml,约5×106个细胞/ml,约10×106个细胞/ml,约20×106个细胞/ml,约30×106个细胞/ml,约40×106个细胞/ml,约50×106个细胞/ml或约60×106个细胞/ml等。
在实施例中,针对的最佳细胞融合度为约0.1×106个细胞/cm2至约60×106个细胞/cm2,或约0.1×106个细胞/cm2至约40×106个细胞/cm2,或约0.1×106个细胞/cm2至约20×106个细胞/cm2。优化的细胞融合度可以在生产方法的整个过程中变化,从而在方法的每个阶段(即例如,活化,转导,扩增,浓缩),控制或操纵细胞融合以为该方法的特定步骤提供最佳的细胞融合。细胞融合度可以通过例如选择最佳的起始细胞融合度,细胞培养室的材料选择,增加或降低氧气和/或二氧化碳的浓度,调节ph,温度,营养,废物的去除等来优化。示例性细胞融合度包括约0.1×106个细胞/cm2,约0.5×106个细胞/cm2,约1×106个细胞/cm2,约0.5×106个细胞/cm2,约10×106个细胞/cm2,约20×106个细胞/cm2,约30×106个细胞/cm2,约40×106个细胞/cm2,约50×106个细胞/cm2或约60×106个细胞/cm2等。
在实施例中,所述方法包括将营养物、废物、释放的细胞因子和/或溶解的气体均匀地提供给密度为约0.05×106个细胞/ml至约20×106个细胞/ml的细胞和约0.1×106个细胞/cm2至约20×106个细胞/cm2的融合度。
在进一步的实施例中,提供了用于自动产生基因修饰的免疫细胞培养物的方法,该方法包括用活化剂活化免疫细胞培养物以产生活化的免疫细胞培养物,用载体转导活化的免疫细胞培养物产生转导的免疫细胞培养物,扩增转导的免疫细胞培养物,其中转导的细胞培养物在扩增,浓缩扩增的免疫细胞培养物和收获浓缩的免疫细胞培养物期间不摇动,以产生基因修饰的的免疫细胞培养物。如本文所述,适当地,该方法由完全封闭的自动化细胞工程系统执行。
如本文所述,令人惊讶地发现,允许细胞在不摇动的条件下扩增(即不旋转或摇动以使细胞彼此重叠),这些方法可提供最佳的细胞特性,包括高活细胞产量和所需表型。已经确定,一个大的,无晃动的细胞培养室可以使细胞同质地进入必要的试剂,营养物,气体交换等,同时去除细胞废物,而无需摇动或打扰细胞即可达到理想的效果。已经发现,与利用细胞摇动的方法相比,这种用于自动产生基因修饰的免疫细胞的方法产生的活细胞数量更多,所需细胞类型的数量更多/比率更高,细胞特性更稳定,例如,如miltenyi等人的“sampleprocessingsystemandmethods”,美国专利号8,727,132中所述。
适当地,所述方法的扩展步骤包括在不摇动免疫细胞培养物的情况下饲喂、洗涤、监测和选择转导的免疫细胞培养物中的至少一种或多种。
本文还提供了用于自动产生基因修饰的免疫细胞培养物的方法,该方法由细胞工程系统执行,包括用活化剂活化免疫细胞培养物以在细胞工程系统的第一室中产生活化的免疫细胞培养物,转导活化的免疫细胞培养物。在示例性方法中,转导包括将活化的免疫细胞培养物从第一室转移至电穿孔单元,用载体电穿孔活化的免疫细胞培养物,以产生转导的免疫细胞培养物,以及将转导的免疫细胞培养物转移至第二细胞工程系统室。所述方法还包括扩增(d)中的转导的免疫细胞培养物,浓缩经扩增的免疫细胞培养物,以及收获(d)中的浓缩的免疫细胞培养物以产生基因修饰的细胞培养物。
例如,如图17所示,例如通过连接管1704将活化的免疫细胞培养物从细胞工程系统600的盒602转移到电穿孔单元1706。电穿孔单元1706适当地包括电穿孔盒1708,其在电穿孔过程中保持细胞培养物。在电穿孔过程之后,将经转导的免疫细胞培养物通过连接管1704传回细胞工程系统600。图17还显示了使用两个可选的容器1710和1712,由于不同的泵速、所需的压力和流速,它们用于在电穿孔之前和之后保存细胞培养物,有助于细胞工程系统和电穿孔单元之间的转移。然而,可以去除这样的容器,并将细胞培养物直接从细胞工程系统1702转移到电穿孔单元1706。
图18示出了细胞培养物的流程图:1)从细胞工程系统到第一容器,2)到电穿孔单元,3)到第二容器,最后是4)回到细胞工程系统。
在示例性实施例中,如图17和18所示,电穿孔单元1706位于细胞工程系统1702的外部。在这样的实施例中,转导包括经由第一无菌、闭合的连接(例如,连接管1704)进行传递,从第一个室到电穿孔单元的活化免疫细胞培养物,用载体电穿孔激活的免疫细胞培养物,以产生转导的免疫细胞培养物,然后,通过第二无菌、封闭的连接(例如,连接管1704)将转导的免疫细胞培养物转移至细胞工程系统的第二室。
还应理解,多个单独的细胞工程系统600(参见,例如,图2)可以连接至单个电穿孔单元,并以适当的顺序运行,从而从细胞工程系统转移细胞培养物,到电穿孔单元,然后回到适当的细胞工程系统。
在其他实施例中,电穿孔单元1706可以位于细胞工程系统600内,使得整个系统是封闭的,独立的系统。用于将电穿孔单元1706包括在细胞工程系统600内部的方法是本领域普通技术人员已知的,并且利用各种小型化策略等。
本文所述的各种方法允许生产经基因修饰的免疫细胞培养物,其中该方法的转导效率比利用柔性、透气袋进行细胞培养的方法的转导效率高至少20%。如本文所述和如实施例所示,如本文所述利用细胞工程系统的方法优于依赖于使用柔性、透气袋进行细胞培养的传统方法。在进一步的实施例中,该方法的转导效率比利用柔性、透气袋进行细胞培养的方法的转导效率高至少10%,更合适的是高至少20%,高至少25%,高至少30%,高至少35%,或者在实施例中,高至少40%。
适当地,本文描述的方法产生的遗传修饰免疫细胞比利用带有柔性、透气袋的人工细胞培养的方法多出至少20%。更适当地,该方法产生至少25%的转基因免疫细胞,至少30%的转基因免疫细胞,至少35%的转基因免疫细胞,或比使用带有柔性,透气袋的手动细胞培养的方法多至少40%的基因修饰免疫细胞。
在示例性实施例中,本文所述的细胞工程系统包括多个室,并且其中本文所述的各种方法的每个步骤均在细胞工程系统的多个室中的不同室中执行,在开始该方法之前,每种活化剂、载体和细胞培养基均包含在多个室的不同室中,并且其中多个室中的至少一个保持在用于细胞生长的温度下(例如,在约37℃),并且多个室中的至少一个保持在冷藏温度下(例如,在大约4-8℃下)。
在一些实施例中,本公开提供了产生嵌合抗原受体t细胞的方法,该方法包括:(a)适当地用包含抗cd3抗体和抗cd28抗体中的至少一种的培养基活化外周血单核细胞培养物以产生活化的t细胞培养物;(b)用慢病毒载体转导活化的t细胞培养物,该载体编码嵌合抗原受体,以产生转导的t细胞培养物;(c)将转导的t细胞培养物扩增到预定的培养物大小;(d)将(c)中的扩增的t细胞培养物浓缩至约20ml至约500ml,适当地约50ml至约200ml的体积;(e)收获(d)中的浓缩t细胞培养物以产生嵌合抗原受体t(cart)细胞培养物,其中活化的t细胞培养物在步骤(a)至(b)期间基本不受干扰;其中该方法由完全封闭的细胞工程系统执行,该系统上适当地具有用于执行步骤(a)至(e)的指令。适当地,步骤(a)至(e)在细胞工程系统的一个或多个室中进行。如本文所述,在实施例中,该方法产生的cart细胞比利用柔性、透气袋进行细胞培养的方法多出至少20%。在示例性实施例中,该方法产生至少20亿个存活的cart细胞。
嵌合抗原受体t细胞或“cart细胞”是经嵌合抗原受体(car)修饰以更具体地靶向癌细胞的t细胞。通常,car包括三个部分:胞外域,跨膜域和内域。胞外域是受体的暴露于细胞外液的区域,包括三个部分:信号肽,抗原识别区和间隔区。信号肽引导新生蛋白进入内质网。在car中,信号肽是单链可变片段(scfv)。scfv包括与短接头肽连接的免疫球蛋白的轻链(vl)和重链(vh)。在一些实施例中,接头包括甘氨酸和丝氨酸。在一些实施例中,接头包括谷氨酸和赖氨酸。
car的跨膜结构域是跨膜的疏水性α-螺旋。在一些实施例中,car的跨膜结构域是cd28跨膜结构域。在一些实施例中,cd28跨膜结构域导致高度表达的car。在一些实施例中,car的跨膜结构域是cd3-ζ跨膜结构域。在一些实施例中,cd3-ζ跨膜结构域产生并入天然t细胞受体的car。
car的内结构域通常被认为是受体的“功能性”末端。通过胞外域的抗原识别区域识别抗原后,cars聚集,信号被传递至细胞。在一些实施例中,内结构域是cd3-ζ内结构域,其包含3个基于免疫受体酪氨酸的活化基序(itam)。在这种情况下,itam在抗原结合后将活化信号传输到t细胞,从而触发t细胞免疫反应。
在产生cart细胞的过程中,从人类受试者中取出t细胞,进行基因修饰,然后重新引入患者体内以攻击癌细胞。cart细胞可以源自患者自身的血液(自体),也可以源自其他健康的供体(同种异体)。通常,将cart细胞发展为对在健康细胞中未表达的肿瘤上表达的抗原具有特异性。
t细胞的活化。在一些实施例中,通过本文描述的方法产生的免疫细胞培养物是cart细胞培养物。可以活化cart细胞以形成活化的t细胞培养物。在体内,抗原呈递细胞(apc),例如树突细胞,通过t细胞受体(tcr)与apc主要组蛋白相容性复合物(mhc)的相互作用,充当t细胞活化的刺激物。tcr与cd3结合,cd3是一种t细胞共受体,有助于活化细胞毒性t细胞(例如cd8+幼稚t细胞)和t佐细胞(例如cd4+幼稚t细胞)。通常,t细胞活化遵循两个信号的模型,需要刺激tcr/cd3复合物以及共刺激受体。t细胞的活化进一步描述于例如kochenderfer2015;kalos2011中。
如果没有共刺激信号,则细胞易受无反应性作用而变得无反应。因此,t细胞共刺激对于t细胞增殖,分化和存活可能是重要的。t细胞的共刺激分子的非限制性实例包括cd28,其是apc膜上的cd80和cd86的受体;以及cd278或icos(诱导性t细胞costimulator),其是在活化的t细胞上表达的与icos-l相互作用的cd28超家族分子。因此,在一些实施例中,共刺激分子是cd28。在其他实施例中,共刺激分子是icos。在体内,共刺激信号可以由apc上的b7分子提供,该b7分子与t细胞上的cd28受体结合。b7是在活化的apc上发现的一种外周跨膜蛋白,可以与t细胞上的cd28或cd152表面蛋白相互作用,产生共刺激信号。因此,在一些实施例中,共刺激分子是b7。共刺激受体进一步描述于,例如,lafferty1975;harding1992;clavreul2000;charron2015;fathman2007;greenwald2005。共刺激进一步描述于例如carpenter2000;andris2004。b7分子进一步描述于,例如,fleischer1996;schwartz2003。
在体外利用各种活化方法来模拟t细胞活化。在实施例中,用活化剂活化t细胞培养物。在进一步的实施例中,活化剂是抗原呈递细胞(apc)。在其他实施例中,活化剂是树突细胞。树突细胞是处理抗原并将其在细胞表面呈递给t细胞的apc。在一些实施例中,活化剂与t细胞培养物共培养。共培养可能需要分别纯化和培养第二种细胞类型,这可能会增加劳动力需求和可变性来源。因此,在一些实施例中,使用替代的活化方法。
在实施例中,细胞在活化步骤期间保持与活化剂的稳定接触。维持细胞与活化剂之间稳定接触的一种方法是通过防止细胞不必要或过度的移动。因此,在实施例中,细胞培养在活化步骤期间基本不受干扰。“基本上不受干扰”是指细胞在更换细胞培养基时通常保留在细胞培养室的相同区域,例如室的底部。如果细胞在不同容器之间移动(例如,从一个培养瓶转移到另一个培养瓶),则细胞可能会受到干扰;如果容器是柔性的,则细胞可能会受到干扰。诸如培养袋之类的柔性容器在处理袋时会导致细胞移动。如本文所述,所述方法适当地利用基本上平坦且低的细胞培养室,以允许细胞均匀地接触各种营养物和气体,还允许容易地去除废物和培养基转移。基本上平坦的细胞培养室还允许细胞在方法的各个阶段期间彼此接触,这可以增强细胞生长和所需细胞表型的产生。
在一些实施例中,活化剂是抗体。在一些实施例中,细胞培养物用结合至包括聚合物表面(包括珠)的表面的抗体活化。在进一步的实施例中,一种或多种抗体是抗cd3和/或抗cd28抗体。例如,珠可以是涂覆有抗cd3和抗cd28的珠,例如免疫磁珠。抗cd3和抗cd28珠可以适当地提供刺激信号以支持t细胞活化。参见,例如,riddell1990;trickett2003。
在其他实施例中,用可溶性抗体活化细胞培养物。在其他实施例中,可溶性抗体是可溶性抗cd3抗体。okt3是免疫球蛋白igg2a同种型的鼠单克隆抗体,靶向cd3。因此,在一些实施例中,可溶性抗cd3抗体是okt3。okt3在例如dudley2003;manger1985;ceuppens1985;vanwauwe1980;norman1995中进一步描述。
在一些实施例中,由佐细胞提供用于t细胞活化的共刺激信号。佐细胞可以包括例如fc受体,其使cd3抗体与t细胞上的tcr/cd3复合物交联。在一些实施例中,细胞培养物是外周血单核细胞(pbmc)的混合群体。pbmc可包括能够支持t细胞活化的佐细胞。例如,可以由pbmc中单核细胞上存在的b7分子提供cd28共刺激信号。因此,在一些实施例中,佐细胞包括单核细胞或单核细胞衍生的细胞(例如树突细胞)。在另外的实施例中,佐细胞包括b7,cd28和/或icos。佐细胞进一步描述于例如wolf1994;chai1997;verwilghen1991;schwartz1990;ju2003;baroja1989;austyn1987;tax1983。
如本文所述,活化剂可以确定所产生的cart细胞的表型,从而促进期望的表型。在一些实施例中,活化剂确定t细胞群体的比例,即,cd4+辅助性t细胞和cd8+细胞毒性t细胞。具有细胞毒性的cd8+t细胞通常负责杀死癌细胞(即,抗肿瘤反应),感染(例如感染病毒)的细胞或以其他方式损坏的细胞。cd4+t细胞通常会产生细胞因子并帮助调节免疫反应,在某些情况下可能会支持细胞裂解。cd4+细胞活化apc,apcs随后会引发纯净的cd8+t细胞产生抗肿瘤反应。因此,在实施例中,本公开的方法进一步包括产生预定表型(即,促进具有所需表型的细胞)。预定表型可以是例如cd8+细胞与cd4+细胞的预定比率。在一些实施例中,在cart细胞群中cd8+细胞与cd4+细胞的比率为约1:1,约0.25:1或约0.5:1。在其他实施例中,cart细胞群中cd8+细胞与cd4+细胞的比率为约2:1,约3:1,约4:1或约5:1。
在实施例中,在活化步骤之后从活化的t细胞培养物中除去活化剂。活化剂,例如抗cd3抗体和/或抗cd28抗体可以存在于细胞培养基中。因此,在一些实施例中,在活化步骤之后,从活化的t细胞培养物中除去含有活化剂例如抗cd3抗体和/或抗cd28抗体的细胞培养基。在一些实施例中,去除活化剂包括去除可溶性抗体。例如,可通过交换细胞培养基除去可溶性抗体。可溶性抗体也可以通过对可溶性抗体特异的亲和力方法除去。在其他实施例中,去除活化剂包括去除含有抗体的珠。去除珠可以包括例如过滤珠或通过磁体去除。
活化的t细胞的转导。在一些实施例中,基因修饰的免疫细胞培养物是活化的t细胞培养物,其被编码嵌合抗原受体的载体转导以产生转导的t细胞培养物。在一些实施例中,转导包括病毒感染,转座子,mrna转染,电穿孔或其组合。在一些实施例中,转导包括电穿孔。因此,在实施例中,细胞工程系统包括电穿孔系统或电穿孔单元,如本文所述。在另外的实施例中,转导包括病毒感染。载体可以是病毒载体,例如慢病毒载体,γ逆转录病毒载体,腺相关病毒载体或腺病毒载体。在实施例中,转导包括将病毒载体引入细胞培养物的活化的t细胞中。在另外的实施例中,载体作为病毒颗粒被递送。
在一些实施例中,转导步骤包括用慢病毒载体转导活化的t细胞,其中以约0.5至约50,约0.5至约30或约0.5至约20的感染复数(moi)引入慢病毒载体。在一些实施例中,以约0.5至约50的moi引入慢病毒载体。在一些实施例中,以约0.5至约6的moi引入慢病毒载体。在一些实施例中,以约0.5至约4的moi引入慢病毒载体。在一些实施例中,以约0.5至约2的moi引入慢病毒载体。在一些实施例中,以moi引入慢病毒载体。约0.6至约1.5。在一些实施例中,以约0.7至约1.3的moi引入慢病毒载体。在一些实施例中,以约0.8至约1.1的moi引入慢病毒载体。在一些实施方案中,以约0.5,大约0.6,大约0.7,大约0.8,大约0.9,大约1,大约1.1,大约1.2,大约1.3,大约1.4,大约1.5,大约1.6,大约1.7,大约1.8,大约1.9或大约2的moi引入慢病毒载体。
在一些实施例中,在活化步骤之后,从t细胞培养物中去除细胞培养基,然后将培养基与载体(例如慢病毒载体)混合并均匀地分布到细胞中。在一些实施例中,去除的细胞培养基用于稀释并将载体均匀地递送至活化的t细胞培养物。t细胞培养物中载体(例如慢病毒载体)的均匀分布和因此的均匀暴露提高了转导效率。在一些实施例中,细胞培养物的体积在活化后和添加载体之前减少。体积减小可以实现更高程度的细胞-载体接触。在一些实施例中,活化的t细胞培养物在转导过程中基本上不受干扰。在一些实施例中,细胞培养在活化和转导步骤期间基本上不受干扰,即当将活化剂或载体提供给细胞时,细胞通常保留在室的相同区域(例如,细胞培养室的底部)中。这可以促进活化剂和/或载体向细胞的均匀分布和均匀暴露,并因此可以改善活化和/或转导效率。
因此,在一些实施例中,使用细胞工程系统的方法的转导效率高于使用使用柔性、透气袋进行细胞培养的方法的转导效率。在一些实施例中,本文所述的用于自动产生cart细胞的方法的转导效率与使用柔性透气袋的方法的转换效率相比高至少10%,高至少15%,高至少20%,高至少25%,高至少30%,高至少35%,高至少40%,高至少45%,高至少50%,高至少55%,高至少60%,高至少65%,高至少70%,高至少75%,高至少80%,高至少85%,高至少90%,高至少95%或高至少100%。
转导的t细胞的扩增。在一些实施例中,将转导的t细胞培养物(或其他免疫细胞培养物)扩增至预定的培养物大小(即,单元数)。预定的培养物大小可以包括足够数量的适合临床使用的细胞,即,向患者输血,研发工作等。在一些实施例中,用于施用于患者的cart细胞的临床或治疗剂量为约105个细胞,约106个细胞,约107个细胞,约108个细胞,约109个细胞或约1010个细胞。在一些实施例中,该方法产生至少1,至少2,至少3,至少4,至少5,至少10,至少15,至少20,至少25,至少30,至少35,至少40,至少45,至少50,至少60,至少70,至少80,至少90或至少100临床剂量的cart细胞。在一些实施例中,将转导的t细胞培养物扩增至总体积为约0.1l至约5l,约0.1l至约2l或约0.2l至约2l。t细胞培养物扩增至约0.1l,约0.2l,约0.3l,约0.4l,约0.5l,约0.6l,约0.7l,约0.8l,约0.9l或约1.0l的总体积。根据细胞生产过程的阶段要求,体积也可以在整个过程中变化。在一些实施例中,预定培养物大小由细胞工程系统的用户输入。用户可以输入预定的培养物大小作为要产生的所需细胞数(例如1010个cart细胞),或者,可以输入预定的培养物大小作为所需的要产生的临床或治疗剂量(例如10个临床或治疗剂量的cart细胞)。在实施例中,通过本文描述的方法产生的cart细胞的数量为至少约1亿(即1×106)个细胞,或至少约3亿,至少约5亿,至少约6亿,至少约7亿,至少约8亿,至少约9亿,至少约10亿(即1×109),至少约11亿,至少约12亿,至少约13亿,至少约14亿,至少约15亿,至少约16亿,至少约17亿,至少约18亿,至少约19亿,至少约20亿(即2×109)个细胞,包括至少约21亿,至少约22亿,至少约23亿,至少约24亿,至少约25亿,至少约26亿,至少约27亿,至少约28亿,至少约29亿或至少约30亿个cart细胞。
在一些实施例中,转导的t细胞培养物的扩增包括转导的t细胞培养物的至少一轮饲喂、洗涤、监测和选择。饲喂细胞培养物可以包括用培养基和/或其他营养物补充细胞培养物。洗涤细胞培养物可包括去除用过的培养基(即,富含营养和/或含有细胞废物的培养基),并用新鲜培养基补充细胞培养物。监测细胞培养物可以包括监测细胞培养物的温度,ph,葡萄糖,氧气水平,二氧化碳水平和/或光密度。选择细胞培养物可以包括选择具有期望的特性,例如生存力,类型和/或形态的细胞,以及去除不具有期望的特性的细胞。在一些实施例中,细胞工程系统被配置为进行转导的t细胞培养物的几轮饲喂、洗涤、监测和/或选择,以达到预定的培养物大小。在一些实施例中,细胞工程系统执行至少2,至少3,至少4,至少5,至少6,至少7,至少8,至少9,至少10,至少15,至少20,至少25,至少30,至少35,至少40,至少45,至少50或至少100轮饲喂、洗涤、监测和/或选择转导的t细胞培养以达到预定的培养规模。
在实施例中,可以去除饲喂,洗涤和监测中的一项或多项,或者可以根据所需的细胞表型或细胞数量等改变事件的顺序。
在实施例中,监测包括利用温度传感器、ph传感器、葡萄糖传感器、氧气传感器、二氧化碳传感器和/或光密度传感器进行监测。因此,在一些实施例中,细胞工程系统包括温度传感器,ph传感器、葡萄糖传感器、氧传感器、二氧化碳传感器和/或光密度传感器中的一个或多个。在另外的实施例中,细胞工程系统被配置为基于预定的培养物大小来调节细胞培养物的温度,ph,葡萄糖,氧气水平,二氧化碳水平和/或光密度。例如,如果细胞工程系统检测到细胞培养物中的当前氧气水平太低而无法实现所需细胞培养物大小的必要生长,细胞工程系统会自动增加细胞培养物中的氧气水平,例如通过用含氧细胞培养基代替细胞培养基,或使细胞培养基流过含氧组分(即硅树脂管)来引入含氧细胞培养基。在另一个示例中,如果细胞工程系统检测到细胞培养物的当前温度过高并且细胞生长过快(例如,细胞可能过度拥挤,可能会导致不良特性),则细胞工程系统将自动降低细胞培养物的温度以维持细胞的稳定生长速率(或期望的指数生长速率)。在其他实施例中,细胞工程系统自动调整细胞饲喂的时间表(即根据细胞生长速率和/或细胞计数或其他监测因素(例如ph,氧气,葡萄糖等)向细胞培养物中提供新鲜培养基和/或营养)。细胞工程系统可以配置为在低温室(例如4℃或-20℃)中存储培养基(和其他试剂,例如洗液等),在将温热的培养基引入细胞培养之前,先在室温室或高温室(例如分别为25℃或37℃)中加热培养基。
在实施例中,洗涤包括通过过滤或沉淀洗涤细胞。在一些实施例中,洗涤步骤不需要移动细胞培养容器或烧瓶,即,可以在同一细胞培养容器或烧瓶中洗涤细胞。在进一步的实施例中,细胞在洗涤步骤中保持基本不受干扰。在实施例中,选择包括将细胞培养物与一种或多种选择试剂混合。选择试剂可以是特定于所需细胞类型的珠,例如磁性珠,然后例如通过穿过磁性室,使与珠结合的细胞与未结合的细胞分离。例如,选择珠包括对所需细胞类型具有特异性的抗体,例如抗cd8抗体或抗cd4抗体。选择也可以通过过滤进行,以根据大小去除或选择某些细胞类型。通过塑料粘合选择细胞(即细胞可以在一个室中开始,不需要的细胞粘在表面上,然后仍处于悬浮状态的所需细胞移到另一个室中。
适当地,在扩增阶段,细胞不摇动或旋转。已经确定在扩增过程中将细胞保持在相对静止的位置有助于整个细胞的生产,以及提供所需的细胞表型。
扩展培养物的集中。在一些实施例中,将扩增的t细胞培养物(或其他免疫细胞培养物)浓缩至预定浓度。预定浓度是可以适当注入患者体内的体积。例如,可以将扩增的t细胞培养物浓缩至约1ml,约2ml,约5ml,约10ml,约15ml,约20ml,约25ml,约30ml,约35ml,约40ml,约45ml,约50ml,约55ml,约60ml,约65ml,约70ml,约75ml,约80ml,约85ml,约90ml,约95ml或约100ml。在一些实施例中,通过离心进行浓缩。在一些实施例中,通过过滤进行浓缩。在一些实施例中,过滤是超滤和/或渗滤。在一些实施例中,预定浓度由细胞工程系统的用户输入。在其他实施例中,预定浓度由细胞工程系统基于用户输入的不同参数来确定,例如,要产生的临床或治疗剂量的数量或体积;或要生产的细胞数量。在一些实施例中,细胞工程系统基于输入参数自动调节产生的临床或治疗剂量的体积或数量。在一些实施例中,细胞工程系统基于预定浓度自动调节离心的参数(例如,速度,离心的持续时间)或过滤的参数(例如,过滤器的尺寸,体积,持续时间)。
基于端口位置和室设计的沉降也可以被利用。即,可以在不去除细胞的情况下将室中的流体体积减小至大约0.5ml。
cart细胞培养物收获。在一些实施例中,适当地收获浓缩的t细胞培养物(或其他免疫细胞培养物)以产生嵌合抗原受体(car)t细胞培养物。在一些实施例中,收获包括搅动,流体流动和cart细胞的洗涤。在一些实施方案中,收获包括将细胞与不期望的产物分离,所述不期望的产物包括例如细胞废物,选择试剂例如珠(例如,含有抗体的珠和/或用于分离细胞的珠)或过量的病毒载体。在一些实施例中,收获包括将cart细胞均匀分布到一个或多个烧瓶,小瓶或容器中。在一些实施例中,收获包括将cart细胞重悬于配制试剂,例如使cart细胞稳定以长期保存的溶液中。在一些实施例中,收获(harvesting)包括cart细胞的冷冻保存。
进一步的下游过程。在一些实施例中,cart细胞在用于患者中治疗之前经历进一步的下游加工。例如,可以通过无菌过滤来过滤冷冻保存的cart细胞,以去除潜在的病毒颗粒残留物。无菌过滤后,cart细胞在包装到一个或多个小瓶,烧瓶,容器或容箱中之前,可能还要经历至少一个浓缩步骤。所包装的cart细胞可以进行质量评估和/或质量控制测试。在一些实施例中,cart细胞在施用于患者之前经历最少的下游加工。例如,在一些实施例中,收获的cart细胞不是冷冻保存的,而是在收获后的短时间内转移给患者。避免冷冻保存步骤可以增加细胞的活力。
细胞工程系统。在一些实施例中,本文描述的方法由完全封闭的细胞工程系统600(参见图6a,6b)执行,适当地在其上具有用于执行活化,转导,扩增,浓缩和收获步骤的指令。本文描述了用于自动产生包括cart细胞的基因修饰的免疫细胞的细胞工程系统,并且在整个过程中也称为自动化细胞工程系统,cocoon或cocoon系统。例如,用户可以提供预先装有细胞培养物和试剂(例如,活化剂,载体,细胞培养基,营养物,选择试剂等)和细胞生产参数的细胞工程系统(例如,细胞的起始数量,培养基的类型,活化剂的类型,载体的类型,要产生的细胞数量或剂量等),细胞工程系统能够执行产生经基因修饰的免疫的方法细胞培养,包括cart细胞,无需用户进一步输入。在自动化生产过程结束时,单元工程系统可以警告用户(例如,通过播放警报消息或发送移动应用程序警报)以收获所产生的单元。在一些实施例中,完全封闭的细胞工程系统包括无菌细胞培养室。在一些实施例中,完全封闭的细胞工程系统通过减少细胞培养物暴露于非无菌环境而使细胞培养物的污染最小化。在另外的实施例中,完全封闭的细胞工程系统通过减少用户对细胞的处理而使细胞培养物的污染最小化。
如本文所用,所述细胞工程系统适当地包括一个盒602。因此,在本文提供了用于自动化细胞工程系统的盒。“盒”是指细胞工程系统的很大程度上独立的,可移除和可更换的元件,其包括一个或多个用于执行本文所述方法的各种元件的室,并且适当地还包括细胞介质,活化试剂,载体等中的一种或多种。
图6b示出了根据本文的实施例的盒602的实施例。在实施例中,盒602包括适合用于细胞培养基的储存的低温室604,以及适合于进行免疫细胞培养物的活化、转导和/或扩增的高温室606。适当地,高温室606通过热障1102与低温室606分开(见图11b)。如本文所用,“低温室”是指适当地保持在室温以下,并且更合适地从约4℃至约8℃的室,用于将细胞培养基等维持在冷藏温度下。低温室可包括用于介质的袋或其他保持器,该介质包括大约1l,大约2l,大约3l,大约4l或大约5l的流体。可以将其他介质袋或其他流体源从外部连接到盒,并通过检修口连接到盒。
如本文所用,“高温室”是指室,其适当地维持在室温以上,并且更适当地维持在允许细胞增殖和生长的温度,即在约35-40℃之间,更适当地在约37℃之间。
在实施例中,高温室606适当地包括细胞培养室610(在整个说明书中也称为增殖室或细胞增殖室),如图6d和图6e所示。
盒还包括连接至细胞培养室的一个或多个流体通道,其中流体通路提供再循环,废物的去除以及均匀的气体交换以及营养物向细胞培养室的分配,而不会干扰细胞培养室内的细胞。盒602还进一步包括一个或多个泵605,包括蠕动泵,用于驱动流体通过盒,如本文所述,以及一个或多个阀607,用于控制通过各种流体通路的流量。
在示例性实施例中,如图6d所示,细胞培养室610是平坦且非柔性的室,即由不易弯曲或挠曲的基本上非挠性的材料(例如塑料)制成。非柔性室的使用允许细胞保持在基本不受干扰的状态。如图6e所示,对细胞培养室610进行定向,以允许免疫细胞培养物在细胞培养室的底部612上扩散。如图6e所示,将细胞培养室610适当地保持在与地板或桌子平行的位置,将细胞培养物保持在不受干扰的状态,使细胞培养物在细胞培养室底部612的大面积上扩散。在实施方式中,细胞培养室610的总厚度(即室高度642)低,大约为0.5cm至大约5cm。合适地,细胞培养室的体积在约0.50ml至约300ml之间,更合适地在约50ml至约200ml之间,或者细胞培养室具有约180ml的体积。低室高度642的使用(小于5cm,适当地小于4cm,小于3cm,或小于2cm)允许紧密靠近细胞的有效介质和气体交换。端口配置为允许通过流体的再循环进行混合而不会干扰细胞。较大高度的静态容器会产生浓度梯度,导致细胞附近的区域受到氧气和新鲜营养物质的限制。通过受控的流动动力学,可以进行培养基交换而不会引起细胞干扰。可以从其他室中取出培养基(不存在细胞),而没有细胞丢失的风险。
如本文所述,在示例性实施例中,盒中预先填充有细胞培养物,培养基,活化剂和/或载体中的一种或多种,包括这些的任何组合。在其他实施例中,这些各种元素可以稍后通过合适的注入口等添加。
如本文所述,在实施方式中,盒适当地进一步包括ph传感器、葡萄糖传感器、氧气传感器、二氧化碳传感器,乳酸传感器/监测器和/或光密度传感器中的一个或多个。盒还可以包括一个或多个采样口和/或注入口。这种采样端口和注入端口(1104)的示例在图11a中示出,并且可以包括用于将药筒连接到诸如电穿孔单元或附加介质源的外部设备的进入端口。图11a还示出了细胞输入口1105,可用于加热细胞培养基的试剂加热袋1106等的位置,以及培养区1107,其中包含用于培养基的各种组件,包括例如细胞培养基,载体,营养物质和废物等。
图11b示出了去除了盒602的cocoon细胞工程系统。在图11b中可见的是细胞工程系统的组件,包括气体控制密封件1120,加热区1121,致动器1122,用于根据需要摇动或倾斜细胞工程系统的枢轴1123和用于保持低温室606的低温区1124。还示出了示例性用户界面1130,其可以包括条形码读取器,并且具有通过触摸板或其他类似设备使用输入进行接收的能力。图11e示出了盒602的另外的详细视图,包括第二室1150的位置,其可以用于需要额外的细胞培养体积的情况,以及收获室1152,其可以用于在这里回收所产生的最终细胞培养物。
在示例性实施例中,如图6f所示,细胞培养室610还包括以下至少之一:远端端口620,其构造成允许从细胞培养室和/或作为再循环端口去除气泡;中间端口622,其构造成用作再循环入口;近端端口624被配置为用作用于细胞去除的排放端口。
在另外的实施例中,本文提供了用于自动化细胞工程系统600中的盒602,其包括细胞培养室610,该细胞培养室610用于实施具有配置的室容积的免疫细胞培养物的活化、转导和/或扩增。容纳免疫细胞培养物和附属体积630,以通过提供培养基和其他工作流体的额外体积而不容纳免疫细胞培养物来增加细胞培养室的工作容积(即,卫星容积不包含任何细胞。适当地,将卫星容积流体地连接至细胞培养室,以使培养基与培养室交换而不会干扰免疫细胞培养。在示例性实施例中,卫星容积是袋,在其他实施例中,卫星容积是非屈服室(non-yieldingchamber)。在实施例中,卫星容积在大约0.50ml至约300ml之间,更适当地在约50ml至约200ml之间。图6d-6e示出了盒602中的卫星容积630的位置。
图6g示出了图示细胞培养室610和附属体积630之间的连接的示意图。在图6g中还示出了各种传感器(例如,ph传感器650,溶解氧传感器651)以及采样/样本端口652和各种阀(控制阀653,旁通止回阀654)的定位,以及一个或多个流体通道640,该流体通道640适当地包括连接这些部件的硅基管部件。如本文所述,硅基管部件的使用允许通过管部件的充氧,以促进气体转移和用于细胞培养的最佳充氧。在图6g中还示出了在盒的流动路径中与泵管657和袋/阀模块658一起使用一个或多个疏水性过滤器655或亲水性过滤器656。
图6h示出了与传统袋相比,使用cocoon系统的气体交换数据。
在实施例中,卫星容积630进一步被配置为允许去除培养基而不损失免疫细胞培养物的细胞。即,以不干扰细胞且不从细胞培养室移出细胞的方式进行卫星容积与细胞培养室之间的培养基交换。
在另外的实施例中,如图6g所示,盒602适当地还包括用于容纳另外的介质等的错流储存器(crossflowreservoir)632。如所须,适当地,错流储存器的体积在约0.50ml至约300ml之间,更适当地在约100ml至约150ml之间。
本文所述的细胞工程系统适当地具有三个相关体积,细胞培养室体积、工作容积和总体积。适当地,基于处理步骤,盒中使用的工作容积为180ml至460ml,并且可以增加至约500ml,约600ml,约700ml,约800ml,约900ml或约1l。在实施例中,盒可以容易地获得4×109个细胞至10×109个细胞。在此过程中细胞浓度从0.3×106个细胞/ml至约10×106个细胞/ml变化。细胞位于细胞培养室中,但是如本文所述,培养基通过另外的室(例如,错流贮存器和卫星容积)连续再循环以增加工作容积。
如本文所述,与柔性袋不同,柔性袋当在液体中(例如,细胞培养物)充满液体时并且在拾取或移动时形状发生改变,“基本非屈服室”(例如,示例性细胞培养室610)填充液体后,在典型的处理条件下拾取或移动时不会改变形状(例如,弯曲,弯折或变形)。因此,在一些实施例中,即使当拾取或移动室时,基本非屈服室也允许细胞基本上保持在室的相同区域中。基本非屈服室也不具有与袋相关的曲率。因此,在一些实施例中,与袋相比,细胞在基本非屈服室中更均匀地分布。在一些实施例中,与袋相比,活化剂和/或载体在基本非屈服的室中更均匀地分布。
在一些实施例中,细胞工程系统包括多个室。在进一步的实施例中,本文所述的细胞方法的每个活化,转导,扩增,浓缩和收获步骤在细胞工程系统的多个室中的不同室中进行。在一些实施例中,在从一个室到另一个室的转移期间,细胞基本上不受干扰。在其他实施例中,该方法的步骤在细胞工程系统的同一室中执行,并且细胞工程系统根据方法的每个步骤自动根据需要调整室环境。因此进一步允许在各个步骤期间不干扰细胞。
在一些实施例中,与用于细胞培养的柔性、透气袋相比,细胞工程系统具有改善的气体交换。在一些实施例中,细胞工程系统包括气体交换管线。气体交换管线可以由诸如硅树脂的气体可渗透材料制成。在一些实施例中,气体交换管线的气体渗透系数高于在柔性的气体可渗透袋中使用的材料的渗透系数。在一些实施例中,细胞工程系统在细胞生产方法期间使氧气循环通过基本上不屈服的室。因此,在一些实施例中,细胞工程系统中细胞培养物的氧水平高于柔性、透气袋中细胞培养物的氧水平。较高的氧水平可能在细胞培养扩增步骤中很重要,因为增加的氧水平可以支持细胞的生长和增殖。
在一些实施例中,细胞工程系统连续地循环整个室中的培养基而不干扰细胞。例如,细胞工程系统可以连续补充营养,清除废物,并使释放的细胞因子和溶解的气体通过小室循环,而细胞仍留在小室的同一区域。连续循环可以改善正因子的均匀分布和负因子的均匀去除,从而减少了分布不均引起的局部效应,而不会干扰细胞。
在一些实施例中,细胞工程系统在细胞生产方法(包括cart生产)期间在整个室中提供二氧化碳。二氧化碳可以帮助维持细胞培养物中的目标ph值,这对于细胞生长和增殖很重要。在一些实施例中,细胞工程系统监测细胞培养物的co2水平,并基于测得的co2水平调节所提供的co2量。例如,随着细胞培养物的增加,细胞产生的co2量也相应增加,并且细胞工程系统会减少所提供的co2量。细胞培养物的所需co2水平可以由使用者定义,例如,约1%,约2%,约3%,约4%,约5%,约6%,约7%,约8%,约9%或约10%的二氧化碳。由于细胞工程系统根据所测得的细胞培养物中的co2水平不断调整提供的co2量,因此细胞工程系统能够在整个生产过程中保持所需的co2水平。细胞培养物中co2的量也可能影响培养物的ph,因为溶解的co2通常会酸化溶液(通过与水反应形成碳酸)。因此,在细胞培养物中维持稳定的co2水平可导致更稳定的ph。因此,在实施例中,细胞培养物的ph水平在生产过程中保持基本恒定。在其他实施例中,在扩增步骤期间,转导的细胞培养物的ph水平保持基本恒定。
来自基因修饰的免疫细胞产生(包括cart细胞产生)的产量可能受到活化和转导效率以及细胞生长条件的影响。通过细胞与活化剂之间更稳定的接触,可以提高活化效率。细胞在整个培养容器中的移动可能会导致细胞分布不均,从而在将活化试剂添加到细胞培养室中时产生局部效应。与柔性培养袋相比,在非屈服室中生长的细胞在活化过程中保持不受干扰,这可能有助于提高活化效率。
提高活化效率也可以导致更高的载体转导效率。如果细胞被活化并正在活跃分裂,则载体(例如慢病毒载体)可以更有效地整合到细胞中。细胞在细胞培养室610中的均匀分布可以促进载体向细胞的均匀暴露,而细胞可以不均匀分布,从而在柔性细胞培养袋中接受不同的载体暴露。因此,在一些实施方案中,用于自动产生基因修饰的免疫细胞(包括本文所述的cart细胞)的方法的转导效率,比使用柔性,透气袋的方法的转换效率至少高出10%,至少高出15%,至少高出20%,至少高出25%,至少高出30%,至少高出35%,至少高出40%,至少高出45%,至少高出50%,至少高出55%,至少高出60%,至少高出65%,至少高出70%,至少高出75%,至少高出80%,至少高出85%,至少高出90%,至少高出95%或至少高出100%。
细胞培养物的生长条件也可以提高细胞产量。例如,高度透气的管道和氧气在细胞培养室中的连续再循环促进了细胞工程系统中较高的氧气水平,可能会增加细胞增殖。细胞工程系统不断监测细胞培养状态并据此进行调整的能力也可能是有利的。例如,细胞工程系统可以监测细胞培养物中的co2o2,n2和/或ph值,并调整co2o2或n2的水平。还可以及时一致地提供营养,并将其均匀分配到细胞培养物中。因此,与手动方法或利用柔性培养袋的方法相比,本文所述的用于产生基因修饰的免疫细胞(包括cart细胞)的自动化方法有利地实现更高的细胞产量。因此,在一些实施例中,用于利用本文所述的细胞工程系统自动产生基因修饰的免疫细胞(包括cart细胞)的方法产生的结果与使用柔性的透气袋进行细胞培养的方法相比至少多出10%,至少多出15%,至少多出20%,至少多出25%以上,至少多出30%,至少多出35%,至少多出40%,至少多出45%,至少多出50%,至少多出55%,至少多出60%,至少多出65%,至少多出70%,至少多出75%,至少多出80%,至少多出85%,至少多出90%,至少出多95%或至多处100%。在实施例中,通过本文描述的方法产生的细胞数目为至少约20亿(即2×109)个细胞,包括至少约21亿,至少约22亿,至少约23亿,至少约24亿,至少约25亿,至少约26亿,至少约27亿,至少约28亿,至少约29亿或至少约30亿个细胞。
附加的示例性实施例
实施例1是用于自动产生基因修饰的免疫细胞培养物的方法,该方法包括用活化剂活化免疫细胞培养物以产生活化的免疫细胞培养物,用载体转导活化的免疫细胞培养物,以产生转导的免疫细胞培养物,扩增转导的免疫细胞培养物,浓缩扩增的免疫细胞培养物,并收获浓缩的免疫细胞培养物以产生基因修饰的的免疫细胞培养物,进一步包括洗涤扩增的免疫细胞培养物和浓缩免疫细胞培养物,其中所述步骤由完全封闭的细胞工程系统进行,并且所述步骤通过产生基因修饰的免疫细胞培养物的方法进行优化。
实施例2包括实施例1的方法,其中所述过程是自调节过程,并且包括用温度传感器、ph传感器、葡萄糖传感器、氧气传感器、二氧化碳传感器和光密度传感器中的一个或多个进行监测;基于监测,调节温度、ph值水平、葡萄糖水平、氧气水平、二氧化碳水平和转导的t细胞培养物的光密度中的一种或多种。
实施例3包括实施例1-2的方法,其中该方法产生至少约1亿个存活的基因修饰免疫细胞。
实施例4包括实施例1-3的方法,其中该方法产生至少约20亿个存活的基因修饰免疫细胞。
实施例5包括实施例1-4的方法,其中免疫细胞培养物是t细胞培养物。
实施例6包括实施例5的方法,其中t细胞培养物是嵌合抗原受体t(cart)细胞培养物。
实施例7包括实施例6的方法,其中载体编码嵌合抗原受体。
实施例8包括实施例1-7的方法,其中免疫细胞培养物包含外周血单核细胞和/或纯化的t细胞。
实施例9包括实施例1-8的方法,其中免疫细胞培养物包含至少一种佐细胞。
实施例10包括实施例9的方法,其中所述佐细胞包括单核细胞或单核细胞衍生的细胞。
实施例11包括实施例9的方法,其中所述佐细胞包含针对t细胞受体的抗原,包括cd28、cd40、cd2、cd40l和/或icos。
实施例12包括实施例1-11的方法,其中活化剂包括抗体或树突细胞。
实施例13包括实施例12的方法,其中抗体被固定在表面上。
实施例14包括实施例13的方法,其中所述表面是珠(bead)的表面。
实施例15包括实施例12的方法,其中所述抗体是可溶性抗体。
实施例16包括实施例12-15的方法,其中所述抗体包含抗cd3抗体和抗cd28抗体中的至少一种。
实施例17包括实施例1-16的方法,其中转导包括病毒感染、电穿孔、膜破坏或其组合。
实施例18包括实施例1-17的方法,其中载体是慢病毒载体或逆转录病毒。
实施例19包括实施例1-18的方法,其中转导包括将载体在细胞培养基中混合并将载体在培养基中均匀地递送至活化的免疫细胞培养物。
实施例20包括实施例1-19的方法,其中所述扩增包括饲喂,洗涤和监测转导的免疫细胞培养物中的至少一种或多种。
实施例21包括实施例2-20的方法,其中针对免疫细胞培养优化转导的免疫细胞培养的氧水平。
实施例22包括实施例1-21的方法,其中,细胞工程系统在步骤(a)至(e)中的一个或多个步骤中,通过氧合组分再循环细胞培养基。
实施例23包括实施例1-22的方法,其中所述细胞工程系统在步骤(a)至(e)期间再循环营养物、废物、释放的细胞因子和/或溶解的气体。
实施例24包括实施例2-23的方法,其中细胞工程系统提供的二氧化碳水平在步骤(c)期间降低。
实施例25包括实施例1-24的方法,其中,细胞工程系统被配置为执行转导的免疫细胞培养物的饲喂、洗涤、监测和选择中的一个或多个循环。
实施例26包括实施例1-25的方法,其中浓缩包括离心、沉淀后除去上清液或过滤。
实施例27包括实施例26的方法,其中所述方法进一步包括调节离心或过滤的参数。
实施例28包括实施例1-27的方法,其中细胞工程系统包括多个室,和其中步骤(a)至(e)中的每个步骤在细胞工程系统的多个室中的不同室中进行。
实施例29包括实施例1-28的方法,其进一步包括在步骤(a)之后从活化的免疫细胞培养物中除去活化剂。
实施例30包括实施例1-29的方法,其中所述细胞工程系统在开始所述方法之前包含(a)的细胞培养物、活化剂、载体和细胞培养基。
实施例31是用于促进基因修饰的免疫细胞培养物的优选表型的方法,该方法包括用活化剂活化免疫细胞培养物以产生活化的免疫细胞培养物,其中活化剂和活化条件促进基因修饰的免疫细胞培养物的表型,用载体转导活化的免疫细胞培养物,产生转导的免疫细胞培养物,扩增转导的免疫细胞培养物,浓缩扩增的免疫细胞培养物;收获浓缩的免疫细胞培养物以产生基因修饰的的免疫细胞培养物,其中所述步骤由完全封闭的自动化细胞工程系统执行。
实施例32包括实施例31的方法,其中活化剂包括抗体或树突细胞。
实施例33包括实施例32的方法,其中抗体被固定在表面上。
实施例34包括实施例33的方法,其中所述表面是珠的表面。
实施例35包括实施例32的方法,其中所述抗体是可溶性抗体。
实施例36包括实施例32-35的方法,其中所述抗体包含抗cd3抗体、抗cd28抗体和抗cd2抗体中的至少一种。
实施例37包括实施例36的方法,其中可溶性抗体是okt3。
实施例38包括实施例31-37的方法,其中活化条件提供了基本上不受干扰的免疫细胞培养物,从而使活化剂和免疫细胞培养物之间稳定接触。
实施例39包括实施例31-38的方法,其中该方法产生至少约1亿个存活的基因修饰免疫细胞。
实施例40包括实施例39的方法,其中该方法产生至少约20亿个存活的基因修饰免疫细胞。
实施例41包括实施例31-40的方法,其中免疫细胞培养物是t细胞培养物。
实施例42包括实施例41的方法,其中t细胞培养物是嵌合抗原受体t(cart)细胞培养物。
实施例43包括实施例42的方法,其中载体编码嵌合抗原受体。
实施例44包括实施例31-43的方法,其中免疫细胞培养物包含外周血单核细胞和/或纯化的t细胞。
实施例45包括实施例31-44的方法,其中所述细胞培养物包含至少一个佐细胞。
实施例46包括实施例45的方法,其中所述佐细胞包括单核细胞或单核细胞衍生的细胞。
实施例47包括实施例45的方法,其中所述佐细胞包含针对t细胞受体的抗原,包括cd28、cd40、cd2、cd40l和/或icos。
实施例48包括实施例41-47的方法,其中t细胞培养物的表型具有的cd8+细胞与cd4+之比为约0.1∶1至约10∶1。
实施例49包括实施例31-48的方法,其中转导包括病毒感染、电穿孔、膜破坏或其组合。
实施例50包括实施例31-49的方法,其中载体是慢病毒载体或逆转录病毒。
实施例51包括实施例31-50的方法,其中转导包括将载体在细胞培养基中混合并将载体在培养基中均匀地递送至活化的免疫细胞培养物。
实施例52包括实施例31-51的方法,其中所述扩增包括饲喂,洗涤和监测转导的免疫细胞培养物中的至少一种或多种。
实施例53包括实施例31-52的方法,其中转导的免疫细胞培养物的氧水平针对促进的表型进行了优化。
实施例54包括实施例31-53的方法,其中,细胞工程系统在步骤(a)至(e)中的一个或多个步骤中,通过氧合组分再循环细胞培养基。
实施例55包括实施例31-54的方法,其中所述细胞工程系统在步骤(a)至(e)期间再循环营养物、废物、释放的细胞因子和/或溶解的气体。
实施例56包括实施例31-55的方法,其中细胞工程系统提供的二氧化碳水平在步骤(c)中降低。
实施例57包括实施例31-56的方法,其中,细胞工程系统被配置为执行几轮的饲喂、洗涤、监测和选择所述转导的免疫细胞培养物。
实施例58包括实施例31-57的方法,其中浓缩包括离心、沉淀后除去上清液或过滤。
实施例59包括实施例31-58的方法,其中细胞工程系统包括多个室,和其中步骤(a)至(e)中的每个步骤在细胞工程系统的多个室中的不同室中进行。
实施例60包括实施例31-59的方法,其进一步包括在步骤(a)之后从活化的免疫细胞培养物中除去活化剂。
实施例61包括实施例31-60的方法,其进一步包括在(b)中的转导后去除载体。
实施例62包括实施例31-61的方法,其中所述细胞工程系统在开始所述方法之前包含(a)的细胞培养物、活化剂、载体和细胞培养基。
实施例63是用于自动产生基因修饰的免疫细胞培养物的方法,该方法包括用活化剂活化免疫细胞培养物以产生活化的免疫细胞培养物,用载体转导活化的免疫细胞培养物,以产生转导的免疫细胞培养物,扩增转导的免疫细胞培养物,浓缩扩增的免疫细胞培养物,并收获浓缩的免疫细胞培养物以产生基因修饰的的免疫细胞培养物,其中,这些步骤由完全封闭的自动化细胞工程系统执行,并且其中,每个步骤都是用具有最佳细胞密度(细胞/ml)和最佳细胞融合度(细胞/cm2)的免疫细胞培养物进行的。
实施例64包括实施例63的方法,(a)的最佳细胞密度为约0.05×106个细胞/ml至约60×106个细胞/ml。
实施例65包括实施例63或权利要求64的方法,(a)的最佳细胞融合度为约0.1×106个细胞/cm2至约60×106个细胞/cm2。
实施例66包括实施例63-65的方法,其中活化剂包括抗体或树突细胞。
实施例67包括实施例66的方法,其中抗体被固定在表面上。
实施例68包括实施例67的方法,其中所述表面是珠的表面。
实施例69包括实施例66的方法,其中所述抗体是可溶性抗体。
实施例70包括实施例66-69的方法,其中所述抗体包含抗cd3抗体和抗cd28抗体中的至少一种。
实施例71包括实施例63-70的方法,其中所述方法产生至少约1亿个存活的基因修饰的免疫细胞。
实施例72包括实施例63-71的方法,其中所述方法产生至少约20亿个存活的基因修饰的免疫细胞。
实施例73包括实施例63-72的方法,其中免疫细胞培养物是t细胞培养物。
实施例74包括实施例73的方法,其中t细胞培养物是嵌合抗原受体t(cart)细胞培养物。
实施例75包括实施例74的方法,其中载体编码嵌合抗原受体。
实施例76包括实施例64-75的方法,其中免疫细胞培养物包含外周血单核细胞和/或纯化的t细胞。
实施例77包括实施例64-76的方法,其中所述细胞培养物包含至少一个佐细胞。
实施例78包括实施例77的方法,其中所述佐细胞包括单核细胞。
实施例79包括实施例77的方法,其中所述佐细胞包含针对t细胞受体的抗原,包括cd28、cd40、cd2、cd40l和/或icos。
实施例80包括实施例63-79的方法,其中转导包括病毒感染、电穿孔、膜破坏或其组合。
实施例81包括实施例63-80的方法,其中载体是慢病毒载体或逆转录病毒。
实施例82包括实施例63-81的方法,其中转导包括将载体在细胞培养基中混合并将载体在培养基中均匀地递送至活化的免疫细胞培养物。
实施例83包括实施例63-82的方法,其中所述扩增包括饲喂、洗涤、监测和选择所转导的免疫细胞培养物中的至少一种或多种。
实施例84包括实施例63-83的方法,其中针对细胞密度和细胞融合性优化转导的免疫细胞培养物的氧水平。
实施例85包括实施例63-84的方法,其中,细胞工程系统在步骤(a)至(e)中的一个或多个步骤中,通过氧合组分再循环细胞培养基。
实施例86包括实施例85的方法,其中氧气再循环是由硅胶管在步骤(a)至(c)中提供的。
实施例87包括实施例63-86的方法,其中所述细胞工程系统在步骤(a)至(e)期间再循环营养物、废物、释放的细胞因子和/或溶解的气体。
实施例88包括实施例63-87的方法,其中细胞工程系统提供的二氧化碳水平在步骤(c)中降低。
实施例89包括实施例63-88的方法,其中营养物、废物、释放的细胞因子和/或溶解的气体的再循环均匀地提供有密度为约0.05×106个细胞/ml至约60×106个细胞/ml且汇合为约0.1×106个细胞/cm2至约60×106个细胞/cm2。
实施例90包括实施例63-89的方法,其中所述细胞工程系统被配置为执行几轮的饲喂、洗涤、监测和选择所述转导的免疫细胞培养物。
实施例91包括实施例63-90的方法,其中浓缩包括离心、沉淀后除去上清液或过滤。
实施例92包括实施例63-91的方法,其中细胞工程系统包括多个室,和其中步骤(a)至(e)中的每个步骤在细胞工程系统的多个室中的不同室中进行。
实施例93包括实施例63-92的方法,其进一步包括在步骤(a)之后从活化的免疫细胞培养物中除去活化剂。
实施例94包括实施例63-93的方法,其进一步包括在(b)中的转导后去除载体。
实施例95包括实施例63-94的方法,其中所述细胞工程系统在开始所述方法之前包含(a)的细胞培养物、活化剂、载体和细胞培养基。
实施例96是用于自动产生基因修饰的免疫细胞培养物的方法,该方法包括用活化剂活化免疫细胞培养物以产生活化的免疫细胞培养物,用载体转导活化的免疫细胞培养物以产生转导的免疫细胞培养物,扩增转导的免疫细胞培养物,其中在扩增,浓缩扩增的免疫细胞培养物和收获浓缩的免疫细胞培养物的过程中不摇动转导的细胞培养物,以产生基因修饰的的免疫细胞培养物,其中所述步骤由完全封闭的自动化细胞工程系统执行。
实施例97包括实施例96的方法,其中活化剂包括抗体或树突细胞。
实施例98包括实施例97的方法,其中抗体被固定在表面上。
实施例99包括实施例98的方法,其中所述表面是珠的表面。
实施例100包括实施例97的方法,其中所述抗体是可溶性抗体。
实施例101包括实施例96-100的方法,其中所述抗体包含抗cd3抗体、抗cd28抗体和抗cd2抗体中的至少一种。
实施例102包括实施例96-101的方法,其中该方法产生至少约1亿个存活的基因修饰免疫细胞。
实施例103包括实施例102的方法,其中该方法产生至少约20亿个存活的基因修饰免疫细胞。
实施例104包括实施例96-103的方法,其中免疫细胞培养物是t细胞培养物。
实施例105包括实施例104的方法,其中t细胞培养物是嵌合抗原受体t(cart)细胞培养物。
实施例106包括实施例105的方法,其中载体编码嵌合抗原受体。
实施例107包括实施例96-106的方法,其中免疫细胞培养物包含外周血单核细胞和/或纯化的t细胞。
实施例108包括实施例96-107的方法,其中所述细胞培养物包含至少一个佐细胞。
实施例109包括实施例108的方法,其中所述佐细胞包括单核细胞或单核细胞衍生的细胞。
实施例110包括实施例109的方法,其中所述佐细胞包含针对t细胞受体的抗原,包括cd28、cd40、cd2、cd40l和/或icos。
实施例111包括实施例96-110的方法,其中转导包括病毒感染、电穿孔、膜破坏或其组合。
实施例112包括实施例96-111的方法,其中载体是慢病毒载体或逆转录病毒。
实施例113包括实施例96-112的方法,其中转导包括将载体在细胞培养基中混合并将载体在培养基中均匀地递送至活化的免疫细胞培养物。
实施例114包括实施例96-113的方法,其中所述扩增包括在不摇动免疫细胞培养物的情况下饲喂、洗涤、监测和选择转导的免疫细胞培养物中的至少一种或多种。
实施例115包括实施例96-114的方法,其中针对免疫细胞培养优化转导的免疫细胞培养的氧水平。
实施例116包括实施例96-115的方法,其中,细胞工程系统在步骤(a)至(e)中的一个或多个步骤中,通过氧合组分再循环细胞培养基。
实施例117包括实施例96-116的方法,其中细胞工程系统再循环营养物、废物、释放的细胞因子和/或溶解的气体。
实施例118包括实施例96-117的方法,其中细胞工程系统提供的二氧化碳水平在步骤(c)中降低。
实施例119包括实施例96-118的方法,其中所述细胞工程系统被配置为执行几轮的饲喂、洗涤、监测和选择所述转导的免疫细胞培养物。
实施例120包括实施例96-119的方法,其中浓缩包括离心、沉淀后除去上清液或过滤。
实施例121包括实施例96-120的方法,其中细胞工程系统包括多个室,和其中步骤(a)至(e)中的每个步骤在细胞工程系统的多个室中的不同室中进行。
实施例122包括实施例96-121的方法,其进一步包括在步骤(a)之后从活化的免疫细胞培养物中除去活化剂。
实施例123包括实施例96-122的方法,其进一步包括在(b)中的转导后去除载体。
实施例124包括实施例96-123的方法,其中所述细胞工程系统在开始所述方法之前包含(a)的细胞培养物、活化剂、载体和细胞培养基。
实施例125是用于自动产生基因修饰的免疫细胞培养物的方法,该方法由细胞工程系统执行,包括:用活化剂活化免疫细胞培养物以在第一室中产生活化的免疫细胞培养物。在细胞工程系统中,转导活化的免疫细胞培养物,该转导包括:将活化的免疫细胞培养物从第一室转移到电穿孔单元,用载体电穿孔活化的免疫细胞培养物,以产生转导的免疫细胞培养物,将转导的免疫细胞培养物转移至细胞工程系统的第二室,扩增转导的免疫细胞培养物,浓缩扩增的免疫细胞培养物;收获浓缩的免疫细胞培养物以产生基因修饰的的细胞培养物。
实施例126包括实施例125的方法,其中转导包括通过第一无菌、闭合连接将活化的免疫细胞培养物从第一室转移至电穿孔单元,用载体对活化的免疫细胞培养物进行电穿孔,以产生转导的免疫细胞培养物,通过第二无菌方法进行转移密闭连接,将免疫细胞培养物转导至细胞工程系统的第二个室。
实施例127包括实施例126的方法,其中电穿孔单元位于细胞工程系统的外部。
实施例128包括实施例125-127的方法,其中所述方法产生至少约1亿个存活的基因修饰的免疫细胞。
实施例129包括实施例128的方法,其中所述方法产生至少约20亿个存活的基因修饰的免疫细胞。
实施例130包括实施例125-129的方法,其中免疫细胞培养物是t细胞培养物。
实施例131包括实施例130的方法,其中t细胞培养物是嵌合抗原受体t(cart)细胞培养物。
实施例132包括实施例131的方法,其中载体编码嵌合抗原受体。
实施例133包括实施例125-132的方法,其中免疫细胞培养物包含外周血单核细胞和/或纯化的t细胞。
实施例134包括实施例125-132的方法,其中所述细胞培养物包含至少一个佐细胞。
实施例135包括实施例134的方法,其中所述佐细胞包括单核细胞或单核细胞衍生的细胞。
实施例136包括实施例134的方法,其中所述佐细胞包含针对t细胞受体的抗原,包括cd28、cd40、cd40l和/或icos。
实施例137包括实施例125-136的方法,其中活化剂包括抗体或树突细胞。
实施例138包括实施例137的方法,其中抗体被固定在表面上。
实施例139包括实施例138的方法,其中所述表面是珠的表面。
实施例140包括实施例137的方法,其中所述抗体是可溶性抗体。
实施例141包括实施例138-140的方法,其中所述抗体包含抗cd3抗体、抗cd28抗体和抗cd2抗体中的至少一种。
实施例142包括实施例125-141的方法,其中载体是慢病毒载体或逆转录病毒。
实施例143包括实施例125-142的方法,其中所述扩增包括饲喂、洗涤、监测和选择所转导的免疫细胞培养物中的至少一种或多种。
实施例144包括实施例125-143的方法,其中针对免疫细胞培养优化转导的免疫细胞培养的氧水平。
实施例145包括实施例125-144的方法,其中,细胞工程系统在步骤(a)至(e)中的一个或多个步骤中,通过氧合组分再循环细胞培养基。
实施例146包括实施例125-145的方法,其中所述细胞工程系统在步骤(a)至(e)期间再循环营养物、废物、释放的细胞因子和/或溶解的气体。
实施例147包括实施例125-146的方法,其中细胞工程系统提供的二氧化碳水平在步骤(c)中降低。
实施例148包括实施例125-147的方法,其中所述细胞工程系统被配置为执行几轮的饲喂、洗涤、监测和选择所述转导的免疫细胞培养物。
实施例149包括实施例125-148的方法,其中浓缩包括离心、沉淀后除去上清液或过滤。
实施例150包括实施例125-149的方法,其中细胞工程系统包括多个室,和其中步骤(a)至(e)中的每个步骤在细胞工程系统的多个室中的不同室中进行。
实施例151包括实施例125-150的方法,其进一步包括在步骤(a)之后从活化的免疫细胞培养物中除去活化剂。
实施例152包括实施例125-151的方法,其还包括在(b)中的转导之后去除载体。
实施例153包括实施例125-152的方法,其中所述细胞工程系统在开始所述方法之前包含(a)的细胞培养物、活化剂、载体和细胞培养基。
实施例154包括实施例1-153的方法,其中所述方法的步骤(c)中的转导效率比利用柔性、透气袋进行细胞培养的方法的转导效率高至少20%。
实施例155包括实施例1-154的方法,其中所述方法产生的基因修饰免疫细胞比利用带有柔性、透气袋的手动细胞培养的方法至少多出20%。
实施例156包括实施例1-155的方法,其中细胞工程系统包括多个室,和并且其中步骤(a)至(e)的每一个是在细胞工程系统的多个室中的不同室中执行的,在开始该方法之前,将(a),活化试剂,载体和细胞培养基中的每一种都包含在多个室的不同室中,并且其中多个室中的至少一个保持在用于细胞生长的温度,并且多个室中的至少一个保持在冷藏温度。
实施例157是用于自动化细胞工程系统的盒,其包括用于储存细胞培养基的低温室,用于进行免疫细胞培养物的活化、转导和扩增的高温室,其中高温室通过热障与低温室隔开,该高温室包括细胞培养室和连接到细胞培养室的一条或多条流体通路,其中流体通路提供再循环,废物的去除以及均匀的气体交换以及营养物向细胞培养室的分配,而不会干扰细胞培养室内的细胞。
实施例158包括实施例157的盒,其中细胞培养室是平坦的且非柔性的室,具有低的室高度。
实施例159包括实施例157或158的盒,其中细胞培养室被定向以便允许免疫细胞培养物在细胞培养室的底部扩散。
实施例160包括实施例157-159的盒,其中所述盒预先填充有细胞培养物、培养基、活化剂和载体。
实施例161包括实施例157-160的盒,其还包括ph传感器、葡萄糖传感器、氧气传感器、二氧化碳传感器和/或光密度传感器中的一个或多个。
实施例162包括实施例157-161的盒,其还包括一个或多个采样端口和/或注入端口。
实施例163包括实施例157-162的盒,其中所述细胞培养室还包括至少一个远端端口,所述远端端口构造成允许从所述细胞培养室去除气泡和/或作为再循环端口;中间端口,其构造成用作再循环入口端口;近端端口,其被配置为用作细胞去除的排泄端口。
实施例164包括实施例157-163的盒,进一步包括用于将盒连接到外部设备的进入端口。
实施例165包括实施例164的盒,其中,外部设备包括电穿孔单元或附加介质源。
实施例166是用于自动化细胞工程系统中的盒,包括细胞培养室,用于进行免疫细胞培养物的活化、转导和/或扩增,其具有用于容纳免疫细胞培养物的室容积,卫星容积用于通过为培养基提供额外的体积来增加室的工作体积以及没有容纳免疫细胞培养物的其他工作流体,其中卫星容积通过一个或多个流体通路与细胞培养室流体连接,从而使培养基与培养室交换而不会干扰免疫细胞培养。
实施例167包括实施例166的盒,其中卫星容积是袋。
实施例168包括实施例166的盒,其中,卫星容积是非屈服室。
实施例169包括实施例166-168的盒,其中所述卫星容积还配置为允许去除培养基而不损失免疫细胞培养物的细胞。
实施例170包括实施例166-169的盒,其还包括错流储存器。
实施例171包括实施例166-170的盒,其中细胞培养室的体积为约0.50毫升和约300毫升之间。
实施例172包括实施例171的盒,其中细胞培养室的体积为约50ml至约200ml之间。
实施例173包括实施例172的盒,其中细胞培养室的体积为约180ml。
实施例174包括实施例166-173的盒,其中卫星容积在大约0.50毫升和约300毫升之间。
实施例175包括实施例174的盒,其中卫星容积在约150ml至约200ml之间。
实施例176包括实施例166-175的盒,其中,错流储存器的体积为约0.50毫升和约300毫升之间。
实施例177包括实施例176的盒,其中错流储存器的体积在约100ml至约150ml之间。
实施例178包括实施例166-177的盒,其中工作容积为约180ml至约1l。
实施例179包括实施例178的盒,其中工作容积为约180ml至约460ml。
实施例180包括实施例157-179的盒,其中一个或多个流体通路包括硅基管部件,该硅基管部件允许通过管部件的充氧。
例子
示例1–使用cocoon系统自动生产cart细胞
在该实施例中,使用gfp和her-2慢病毒通过以下过程参数转导t细胞:在开始接种6000万个外周血单核细胞(pbmc)后,将cd3/cd28活化,il-2和il-7补充到t细胞生长培养基中以进行培养扩增。一次性盒中的一次性传感器用于实时监控温度、ph和光密度(od)。通过流体通道连接的多个盒式室实现了自动饲喂和过程组分的添加。一些室的温度控制在4℃以用于培养基和试剂的存储,而其他室包括用于加热、混合、洗涤和浓缩细胞的元件,从而可以实现全封闭过程。提取过程中的样品,以计算细胞数量和活力值。在收获过程结束时,由以下小组进行了facs分析:cd4,cd8,ngfr,ifn-γ,tnf-α等。此示例中使用的cocoon系统的概述如图6所示。图6a示出了处于闭合配置的cocoon系统以及外部用户控制显示器,该外部用户控制显示器可用于调整参数或监测细胞培养。可将无菌的一次性细胞培养“盒”装入cocoon中(图6c)。如盒的详细视图所示(图6b),每个盒都包括一个保持在37℃的上室,用于培养细胞,一个保持在4℃的下室,用于存储培养基,病毒载体和其他对温度敏感的试剂。盒被构造成使得流体可以通过内部流体通道交换,并且也可以泵入或流出盒。安装在盒中的传感器可以监控例如细胞培养物的ph值和光密度。
结果显示在图7-10中。与手动操作和使用g-rex(wilsonwolf)细胞培养板作为对照的细胞扩增相比,图7a,7b和7c分别显示了使用自动cocoon系统进行gfp转导的平均收获量、平均收获活力和平均转导效率。g-rex板的底部具有透气性,使用g-rex时,用户通常每4至5天进行一次介质交换。
图8a和8b分别示出了活细胞以及her-2car-t转导的活力和转导效率。在10天的培养中,her-2car-t细胞达到约22亿个,在cocoon系统中的生存力为97%,转导率为65%(n=4)。
还使用permalife细胞培养袋(origen)作为对照,将自动cocoon系统的性能与细胞的手动操作和生长进行了比较。permalife袋是由惰性氟化乙烯丙烯(fep)制成的可密封且透气的细胞培养袋,带有阀门,方便用户饲喂和收获细胞。图9a表明与coperone袋相比,使用cocoon系统的相对t细胞纯度水平,通过cd3+细胞的百分比评估。图9b示出了与permalifebag对照相比,在cocoon系统中培养的cd8+细胞百分比更高。图9c和9d显示转染的细胞分别产生tnf-α和inf-γ。
图10a和10b分别示出了通过在cocoon系统和permalife袋中培养的cart细胞对靶肿瘤细胞的有效和特异性杀伤。
总之,cocoon系统是一种完全封闭的细胞工程系统,是一种可行的解决方案,可以将劳动密集型的cart过程转换为全自动且高度受控的系统,从而实现可扩展性、高产量、降低制造成本,并获得更好的过程控制,以生产出高质量的car-t细胞。
示例2-cocoon系统中活化方法的比较
该实施例比较了在cocoon自动生产系统和permalife袋中在临床规模生产cart细胞中使用不同活化方法的细胞培养性能。
可以使用磁性抗cd3/抗cd28免疫磁珠活化珠来活化t细胞。这些珠提供了两个必要的刺激信号,以支持有效的t细胞活化。活化幼稚t细胞的另一种方法可以利用可溶性抗cd3抗体(okt3)。okt3是单克隆igg2a抗体,最初用作免疫抑制剂。共刺激信号可以由辅助单元提供。当使用okt3时,从混合的外周血单核细胞(pbmc)群体中启动t细胞培养可以提供必要的佐细胞来支持t细胞活化。
由于okt3和免疫磁珠利用不同的活化机制,因此一种方法的选择可能会影响最终产品的特性;具体来说,是t细胞群体,cd4+辅助性t细胞和cd8+细胞毒性t细胞的比率。细胞毒性cd8t细胞负责抗肿瘤反应。cd4细胞产生细胞因子,并有助于调节免疫反应。已经证明cd4细胞也支持细胞裂解,尽管与cd8细胞相比杀伤被延迟。cd4细胞向apc发出信号,从而活化apc并随后引发幼稚的cd8t细胞。由于有限的临床数据,人们对cd8与cd4细胞的理想靶标比率还没有很好的了解。研究表明,与单独递送cd8细胞相比,优选cd8和cd4细胞的组合(church2014;feldmann2012;reusch2015)。
两种体外活化方法都有优点和缺点。抗体结合的珠提供一致性,并确保tcr/cd3复合物以及cd28共刺激途径的稳定同时活化。珠的方法的主要缺点是与该产品相关的高成本。植入前,还必须有效地从培养物中除去珠。okt3提供了活化t细胞的低成本选择。与可溶性抗cd3方法有关的主要缺点是对佐细胞的依赖性和对培养环境的敏感性。患者样品可能具有高度可变的佐细胞和负向相互作用,可能在先前刺激后功能性失活t细胞。为了了解每种活化方法对细胞生长,表型和功能的影响,在临床规模的自动化平台中培养了由免疫磁珠和okt3活化的t细胞。
cocoon提供了气体和温度的环境控制。这包括一个37℃的区域以及一个链接的冷藏区域。cocoon和盒之间没有流体接触,从而将两次运行之间所需的清洁降至最低。播种当天,所有试剂均可装入盒,并在需要时存储在cocoon的冷藏区域中。在将液体输送到细胞之前,将其加热到37℃。由于慢病毒的稳定性,可以在转导当天将其解冻,并通过无菌连接器传递到盒中。气体交换(氧化和co2缓冲)是通过培养液通过透气管的再循环实现的。嵌入式生物传感器可提供有关溶解氧和ph的实时数据。由于t细胞需要与其他细胞或活化剂稳定接触,因此可以通过灌注进行培养基交换、洗涤和再循环以进行气体交换,而不会干扰细胞。摇摆可用于促进高效收获。
方法
细胞培养物。用dnase(sigma)解冻外周血单核细胞(pbmc)(lonza),并使其在37℃下以<2×106个细胞/ml的密度恢复过夜。使用nucleocounter200和血液分析方案(包括solution17(chemometec))进行细胞计数。以低亲和力神经生长因子受体(ngfr)作为转导标记的第三代慢病毒载体被用来转导细胞。该慢病毒是根据lonza的cgmp病毒制造工厂(德克萨斯州休斯顿)生产的,其操作流程和引物来自麦克马斯特大学(加拿大汉密尔顿)布拉姆森实验室。在所有条件下均使用1的感染复数(moi)。通过使用hek293tm细胞确定病毒滴度,并使用流式细胞仪检测ngfr。活化介质由x-vivo15(lonza)和22iu/mlil-2(cedarlane)和1%青霉素-链霉素(sigma)组成。在用可溶性抗cd3活化的条件下,将okt3(biolegend)添加到活化介质中,使其最终浓度为50ng/ml。在用免疫磁珠活化的条件下,比率为1:1。在用免疫磁珠激活的条件下,将1:1的珠子与细胞的比例添加到激活介质中。扩展培养基由x-vivo15(lonza)补充29iu/mlil-2(cedarlane),雄性ab血浆的5%人血清(sigma),1%glutamax(thermofisher)和1%青霉素-链霉素(sigma)组成。
自动的cart细胞生产。在第0天,将60×106个pbmc装入盒的输入袋中。在使用抗cd3/抗cd28珠激活的条件下,还将60×106个抗cd3/抗cd28免疫磁珠(thermofisher)添加到输入袋中,珠与细胞的比例为1:1。将输入袋连接到盒并带到cocoon(octanebiotechinc.)。在操作员登录后,盒被装入cocoon中。在第1天,将病毒(lonzahouston)解冻,然后通过盒进入口以moi为1转移到细胞培养室。在将病毒递送到细胞之前,使用活化培养基稀释培养基。将活化培养基从培养室中移出,并随病毒一起返回而不会干扰细胞。在第4天,通过添加扩展介质,总工作量增加了。在第6天和第8天与扩展介质进行了部分介质交流。在扩增步骤之后,在去除细胞之前,cocoon将最终体积降低至小于100ml。在整个培养过程中,cocoon不断收集数据。这包括泵和执行器的每个步骤、门的每次打开和关闭等。收获了完整的传感器数据,包括热值、气体浓度、液体ph值和溶解氧。操作员能够使用电话或外部计算机远程监控培养物状况。
手动cart细胞生产。在permalife细胞培养袋中,与cocoon并行进行cart细胞的人工生产。在第0天,在第0天将60×106个pbmc以0.27×106个细胞/ml的浓度接种到活化培养基中。这些培养物利用与自动培养物相同的供体细胞以及相同的培养基进行活化和扩增。在permalife袋(pl240,origen)中开始培养,并在第6天随着细胞扩增转移到更大的permalife袋(pl325,origen)中。随着体积的增加,在第8天将细胞扩增到pl240和pl325袋中。在第1天,将慢病毒以moi为1的速度添加到包装袋中。用与cocoon培养相当的体积饲喂细胞。但是,与cocoon条件不同,没有介质被浪费掉。使用的体积将培养物维持在小于2×106细胞/ml。在第10天,按质量获得培养体积,并从袋中取出总细胞样品以进行计数和分析。在用于功能测定之前,将细胞离心以减少残留物以及体积。
非转导和非活化条件。用于荧光活化细胞分选(facs)分析的未转导和未活化的阴性对照根据先前所述的协议进行了小规模培养。简而言之,将1×105个细胞接种到96孔板中,其中添加了5%人ab血清(sigma)和22ng/mlil-2(cedarlane)的x-vivo15(lonza)。使用类似的协议设置活化的但非转导的控件。细胞接种后,加入等体积的培养基。用可溶性抗cd3活化的条件补充100ng/mlokt3(biolegend),终浓度为50ng/ml。用抗cd3/抗cd28珠激活的条件以1:1的比例添加了免疫磁珠。在第4天,将活化的培养物从96孔板扩展到24孔,然后根据生长情况将其转移到t25和t75烧瓶中,并从第4天起每两天喂一次。
流式细胞计数。对于表型起始群体,用以下一抗对细胞进行染色:太平洋蓝cd3(克隆ucht1,bdbiosciences),pecd14(克隆61d3,thermofisher),apcefluor780cd4(克隆okt4,thermofisher),percp-cy5.5cd8a(克隆rpa-t8,thermofisher),bv605cd279(pd-1,克隆eh12.2h7biolegend)和live/dead可修复的紫罗兰死细胞染色剂(thermofisher)。为了评估her2转导的效率,按照上述方法对细胞进行染色,除了不对单核细胞(cd14)进行染色外,将细胞用bv421cd271(c40-1457ngfr,bdbiosciences)和live/dead可固定的绿色死细胞染色剂(thermofisher)进行染色。然后固定细胞并洗涤。在sa3800索尼光谱分析仪上,每种条件下都采集了20,000个事件。使用flowjo10.4.2进行facs分析。非转导和非激活条件用于设置门控以及荧光减一(fmo)对照。
肿瘤细胞系。如前所述,将her2阴性肿瘤细胞lox-imvi细胞(美国国立癌症研究所)从转移性黑色素瘤黑色素瘤中转移至含10%fbs(sigma)的rpmi(sigma)中。如前所述,从卵巢浆液性囊状腺癌衍生的her2阳性肿瘤细胞skov-3(atcc)细胞在含有10%fbs的mccoy5a(改良)培养基(thermofisher)中扩增。在汇合之前使用0.25%胰蛋白酶将细胞传代5至10分钟。将低传代次数冷冻保存,并将肿瘤细胞传代2至3次,然后再用于alamarblue或ics分析。
细胞因子分泌测定。如前所述(例如atkuri2005;avgoustiniatos2008),将每种培养条件一式三份地接种50,000个loximvi或skov-3肿瘤细胞到圆底96孔板中。第二天,在37℃下,将t细胞以8∶1的每孔肿瘤系的浓度与蛋白质转运抑制剂布雷菲德菌素a(golgiplug,bdbiosciences)一起接种4小时。将细胞在4℃下储存过夜。然后合并细胞用于染色和分析。如上所述,对细胞的表面表型cd3,cd4,cd8a,ngfr和live/dead可固定的绿色死细胞染色进行染色。用bdcytofix/cytoperm固定/通透溶液试剂盒(554714,bdbiosciences)固定和通透后,完成细胞内细胞因子染色(ics)。测试的活化细胞因子包括apcifnγ(克隆b27,bdbiosciences)和petnfα(克隆mab11,bdbiosciences)。索尼sa3800收集了23万多个事件(最多500,000个)用于ics分析。据报道在skov-3和lox-imvi肿瘤细胞系上产生细胞因子之间的差异是分泌tnfα或ifnγ的种群的百分比。未转导和未活化的条件与fmo控件一起用于设置门。
细胞毒性测定。如先前所述测试细胞毒性(例如,akturi2005;avgoustiniatos2008)。将贴壁的肿瘤细胞系以2×104个细胞/孔(skov-3或lox-imvi)接种在96孔平底组织培养物处理的平板中过夜。将来自cocoon和对照条件的cart细胞以各种效应子(e)t细胞与肿瘤(t)e:t的比例(从0.25:1到8:1)添加到肿瘤细胞的孔中并在37℃下共同孵育过夜。用温热的pbs或rpmi培养基将孔洗涤3次,以去除所有非粘附细胞。加入100μl的10%alamarblue细胞活力试剂(lifetechnologies)溶液,并将孔在37℃下孵育3小时。alamarblue是线粒体还原后发出荧光的活细胞的代谢指示剂,通过在tecaninfinitem200pro读板仪(tecan,maennendorf,瑞士)上的荧光(激励530nm,发射595nm)测量。与未处理的靶细胞相比,实验细胞中的荧光损失被计算为肿瘤细胞的生存力。每种条件进行三次重复测试。
结果
利用自动化平台cocoon来证明使用两种不同的活化方法实现临床规模生产cart细胞的可行性。该平台由一次性使用的一次性cocoon盒(图11a,11e)和cocoon控制系统(图11b)组成。图11f示出了如何将注射器1170或袋1172用于盒602的采样。盒设计有多个试剂袋,以使该过程所需的所有试剂能够预装并存储在盒的冷藏区中,而细胞处理则发生在培养区中。该盒支持封闭系统链接的多个单元操作,包括细胞激活,转导,扩增,实时溶解氧和ph值监控,清洗以及细胞浓度。盒的下部装有多个袋,用于盛放培养所需的各种试剂和废物。cocoon提供盒的控制系统。这包括流体和细胞转移的控制,以及控制传感器的摇摆,搅动和远程监控。执行器无需流体接触即可实现自动阀控制。在没有执行器相互作用的情况下,阀门保持关闭状态,从而使盒可以在房间之间或显微镜下移动,同时防止流体不受控制地移动。将所需试剂装入盒的储液器后,将其卡在盒的培养区中,在其中进行各种单元操作。使用icuspiros连接器无菌取样或注射病毒。在删除样本或添加病毒之前,按照预先编程的协议中定义的特定时间提醒操作员。在操作员登录并确认通知后,cocoon会自动打开以启用样本删除或添加病毒。操作员在门自动关闭并恢复环境控制之前确认该动作已完成。当将盒装入cocoon中时(图11c),并且关闭外壳(图11d),盒的下部与上部通过热障隔开。下部保持在冷藏温度,上部保持在37℃。封闭的cocoon可以进行气体和热控制。将细胞保持在37℃,同时将试剂保持在寒冷区域以延长稳定性。不透明的外壳可防止与介质成分分解有关的光诱导毒性。预热室位于37℃区域,可在将培养基转移到细胞之前对其进行加热。从pbmc加载到最终浓度和细胞收获,所有培养步骤均可实现自动化。如图11a所示,盒具有一系列访问端口,可用于在活化后加载病毒。盒中装有实时溶解氧和ph传感器,可向cocoon软件提供反馈。可以监控实时数据以及历史图表,以确保将这些因素保持在目标范围内。
在图12a中示出了cocoon处理步骤的概述。透气的permalife袋用于平行对照培养和cart细胞的扩增(例如lu2016)。图12b(cocoon)和12c(permalife袋)展示了两种形式的细胞分布,其中cocoon中的细胞在盒的顶室中培养。两个系统都使用了等量的介质。permalife细胞培养袋采用分批补料工艺,面积随总体积的增加而扩增,这是通常的做法。cocoon盒使用固定面积,采用初始补料分批补料策略,然后在培养的第6天和第8天进行部分培养基交换。
为了评估活化方法和自动化平台的性能的影响,使用了以下标准:活力、细胞数、表型、衰竭、转导效率、功能性细胞内细胞因子分泌和细胞毒性。结果总结在图16中并在此讨论。
除非另外指示为供体2,否则将相同的供体细胞用于所有条件。所有条件均接种60×106个pbmc,并加入相同体积和组成的培养基。起始细胞群包含66.6%的cd3+t细胞和12.0%的cd14+细胞。在cd3+细胞中,cd4+细胞占71.2%,cd8+细胞占28.1%。使用第二个供体来确定供体间差异的影响。第二批pbmc最初包含75.0%cd3+t细胞和4.5%cd14+细胞。在cd3+细胞中,cd4+细胞占65.0%,cd8+细胞占32.9%。
用okt3和免疫磁珠活化的cocoon培养物的第10天活细胞产率分别为2.55×109±0.1×109和2.15×109±0.1×109。用okt3和免疫磁珠活化的permalife袋培养物的活细胞产量分别为2.08×109±0.1×109和1.53×109±0.1×109(图13a)。在所有条件下的生存力均大于95%(图13a)。群体倍增水平(pdl)在cocoon中为5.2-5.4(36-43倍),在permalife袋中为4.7-5.1(25-35倍)(图13b)。
所有条件都表现出高水平的t细胞纯度,其中大于88%的活细胞表达cd3。在10天内产生的总存活t细胞大于20亿,除了在permalife袋中生长的珠活化的pbmc(图13c)。不管采用哪种活化方法,与袋相比,在cocoon条件下,总t细胞产量都更高。第10天的cocoon盒式t细胞产量为2.0-2.4×109。permalife袋产生1.5-2.0×109t细胞(图13c)。使用相同的供体细胞,在分别用免疫磁珠或okt3活化的cocoon中,cd3+细胞的pdl分别为5.7和5.9(51和60倍)(图13d)。在分别用免疫磁珠和okt3活化的permalife袋中,cd3+细胞的pdl分别为5.2和5.6(38和49倍)。
图13e示出了表达cd4和cd8糖蛋白的cd3+t细胞的百分数,分别表示辅助或细胞毒性t细胞。与t细胞群体相关的最重要结果是,与免疫磁珠活化的细胞相比,在用okt3活化的条件下cd8细胞数量增加。okt3活化导致83-86%的cd8+和6-11%的cd4+细胞,而免疫磁珠活化的条件导致48-56%的cd8+和41-48%的cd4+细胞群体。在具有相同供体的所有培养物中,衰竭相关的标志物pd-1低于10%,表明细胞枯竭水平较低(图13f)。当第二个供体在含有免疫磁珠的cocoon中培养时,在21%的细胞中表达pd-1。图13g和13h示出代表性轮廓图,其突出示出了与okt3活化的条件相比,在免疫磁珠活化的条件下cd8+细胞的显着差异。
通过替代表面标记cd271(ngfr)表达对t细胞her2的特异性来确定,其中cocoon中cd62+细胞的62-78%和perngife袋中表达ngfr的cd3+细胞的42-60%(图14a)。与袋培养相比,cocoon中的转导效率更高。通过高的转导和扩增,可存活的cart细胞的总数在cocoon中为1.26-1.66×109,在permalife袋中为0.62-1.20×109(图14b)。cd4和cd8群体中cart细胞的百分比和总数分别显示在图14c和14d中。在表达cocoon的ngfr中,转导的cd4细胞的百分比大于cd8细胞,其中cd4细胞为75.4-80.9%,cd8细胞为64-73.2%。在permalife袋中,有54.7-79.9%的cd4细胞和36.1-58.9%的cd8细胞表达ngfr。因为cd8细胞的扩增显着大于cd4细胞,所以在除免疫磁珠活化的袋培养物以外的所有条件下,cd8+转导的细胞总数明显大于cd4+转导的细胞(图14d)。在cocoon中,存在0.25-0.64×109个转导的cd4细胞和0.66-1.43×109个转导的cd8细胞。在permalife袋条件下,有0.09-0.41×109个转导的cd4细胞和0.25-1.06×109个转导的cd8细胞。图14e和14f分别示出了在cocoon条件和permalife袋条件下的转导效率的代表性等高线图。
使用细胞内细胞因子释放测定法和alamarblue杀死测定法进行细胞的功能测试(参见nociari1998)(图15)。在所有情况下,细胞均表现出tnfα和ifnγ的产生(图15a和15b),1t辅助cd4+细胞和细胞毒性cd8+细胞的特征(参见,例如romagnani1991)。较高比例的cd4+细胞分泌tnfα。与相同供体细胞的袋装培养相比,在cocoon条件下,tnfα分泌细胞的产量更高。与okt3活化的条件相比,免疫磁珠活化的条件产生的tnfα和ifnγ分泌的转导细胞百分比更高。alamarblue杀伤试验表明,cart细胞可有效杀伤卵巢癌细胞系skov-3her2+肿瘤细胞(图15c和15d)。杀伤效果的趋势跟随效应t细胞的系列稀释,而permalife和cocoon产生的细胞均产生强烈反应。her2-肿瘤细胞loximvi也暴露于t细胞以证明her2特异性。在针对cart细胞的her2阴性培养物中未发现杀伤趋势。
讨论
活化方法。cart细胞产生的评估包括使用可溶性抗cd3(okt3)以及与珠结合的抗cd3/抗cd28免疫磁珠进行的活化。与免疫磁珠活化的培养物相比,用okt3活化的培养物显示出19-36%的改善生长(图13a)。活化方法还在最终表型中产生了显着差异(图13e)。相比于okt3活化的cd3+cd8+率为84.5%,免疫磁珠活化的条件平均cd3+cd8+细胞占52.7%。对于免疫磁珠活化的条件,这表示cd8+与cd4+的比率约为1.2:1,而用okt3活化时,则为9.8:1。无论细胞是在袋中还是在cocoon条件下培养,都可以发现增加的cd8+细胞数量。
通过okt3活化的提高的产率是出乎意料的结果。免疫磁珠通过与tcr/cd3复合物以及cd28共刺激受体结合来活化t细胞。与具有用于共同刺激的抗cd28抗体的免疫磁珠不同,用可溶性抗cd3活化依靠单核细胞来呈现b7受体cd80和cd86,它们是cd28的配体(参见,例如fleischer1996)。但是,b7受体也可以与ctla-4结合并刺激该抑制途径,从而抑制t细胞生长。无论是在袋中还是在cocoon条件下培养细胞,都可以根据活化方法提高总细胞产量。结合珠的抗cd3/抗cd28抗体可以促进辅助性t细胞(cd4+细胞)的扩增,而okt3可以促进细胞毒性t细胞(cd8+细胞)的扩增(参见,例如,fleischer1996;laux2000;li2010;zhu2007)。
较高的细胞产量,特别是cd8+细胞优势可以归因于当使用okt3和单核细胞活化时刺激其他受体。以前有报道说95%的cd4+t细胞表达cd28,而只有50%的cd8细胞表达cd28(参见ledbetter1990)。因此,免疫磁珠最多只能活化50%的cd8+细胞。用okt3活化的培养物可能会受益于存在于单核细胞而非微珠上的其他共刺激性配体。
例如,单核细胞表达cd58(lfa-3)和cd40受体,它们是cd2和cd40l的配体。已知刺激这些受体可促进t细胞生长。这些佐细胞也可能表达cd137l,该cd137l与cd137相互作用并可能刺激cd8+细胞扩增。与免疫磁珠活化相比,与这些其他受体的相互作用可能代表了更多的生理抗原呈递。
由于okt3活化依赖于其他细胞,供体变异性的影响可能比用免疫磁珠的活化更重要。该研究中的起始细胞群在第0天包含12.0%cd14+细胞和66.6%cd3+细胞。可以进行剂量研究以确定单核细胞敏感性对最终产量和表型的影响。
自动化。当用okt3或免疫磁珠活化时,与手动条件相比,cocoon产生的活cart细胞产量更高。当用免疫磁珠活化时,cocoon培养物的生长比袋装培养物高40%。使用okt3培养物时,cocoon培养的细胞比袋装培养物多出23%。cocoon条件也显示出更高的转导效率,因此具有更高的cart细胞总产量(图14)。在免疫磁珠活化条件下,cocoon中cart细胞的总产量是袋的两倍以上。在okt3活化的条件下,在cocoon中,cart细胞的产量比在袋中高40%。
与permalife袋相比,cocoon的提高的产率可以增加活化。这可能是由于跨培养物区域的分布。cocoon使用坚固的非屈服室,而袋则是柔性的。细胞沉降后,观察到袋的弯曲导致细胞分布不均。这可能导致活化剂和/或细胞分布不均。另一个可能的原因可能与活化阶段的搅拌量有关。在活化的第二天转导细胞时,活化可能仍在进行中,或者活化剂可能尚未被细胞内在化。在转导步骤中,将袋培养物从培养箱移至生物安全柜,以使用无菌技术递送细胞。袋的移动有利于病毒在袋中的分布。但是,在将袋移入和移出培养箱时,细胞也会受到干扰。由于稳定的接触对于细胞活化可能很重要,因此这种运动可能会对细胞产生负面影响。在活化或转导步骤之间,cocoon培养物中的细胞不会受到干扰。在cocoon中,用于活化的培养基在转导之前从培养物中去除。少量的介质留在室中,使细胞能够保留在室的底部,在体积传输过程中不受干扰。从培养箱中取出的培养基用于稀释和混合病毒,然后转移回细胞群体。在此过程中,细胞保持不受干扰。
有效的活化可以与更有效的转导相关。也就是说,如果细胞被活化并正在活跃分裂,则慢病毒可以更有效地整合。为了评估这一点,可以在转导之前取样以测定活化效率。转导效率的提高也可能与病毒向细胞的均匀分布有关。在cocoon培养中,病毒与培养基混合并均匀分布到细胞中。使用平坦的,非柔性的容器有助于改善病毒在细胞群体中的均匀分布,从而使病毒均匀暴露。
提高性能的另一个原因可能与气体交换有关。氧水平升高可能会促进增殖。通过将培养物上清液通过硅树脂气体交换管线进行再循环,可在自动化平台中保持较高的氧气水平。在袋条件下,通过在袋材料中扩散,氟化乙烯丙烯(fep)进行气体交换即可。硅树脂的渗透系数显着大于fep的渗透系数(参见,例如,avgoustiniatos2008)。创建cocoon协议以确保足够的氧气浓度。在整个培养期间产生的生物传感器数据证实了这一点。
通过硅树脂管的气体交换也支持ph水平。即,在培养开始时,培养基通过与富含co2的环境进行气体交换来维持目标ph。随着培养物中细胞数量的增加,细胞会产生乳酸和二氧化碳,从而消除了对二氧化碳环境的需求。在整个培养过程中,cocoon环境中的co2减少,有助于维持ph值。permalife袋遵循常规规程,在整个培养过程中均存储在5%co2环境中。
在不干扰细胞的情况下,连续再循环的另一个优点是正因子和负因子的分布更均匀。这包括营养物、废物、释放的细胞因子和溶解气体。连续再循环可以通过均匀分布因素来帮助减少局部影响并提高介质效率。
自动化转化。在该实施例中,使用封闭的自动化生产系统cocoon来产生被珠结合的抗体或可溶性okt3活化的cart细胞。结果表明,使用低浓度的病毒,可以从cocoon产生具有高临床转导效率的临床相关产量。此外,可以通过活化方法来驱动细胞的表型。
结果主要来自单个供体,以比较活化方法的影响。条件之间的差异非常小。当使用不同的供体重复测试时,使用相同的活化方法时,供体之间的结果相似。这项研究证明了一种有效的方法,可以以临床相关,可扩展且易于使用的方法有效地自动化cart细胞的产生。
示例3–通过细胞工程系统通过电穿孔进行转导
背景
octanecocoontm系统是用于生产细胞疗法产品的自动化的,封闭的,端对端的生物反应器系统。octane的自动化细胞与组织工程系统(actes)由三个主要组件组成:基本仪器,软件和可定制的一次性盒。cocoontm系统能够针对上游和下游细胞培养过程进行自动分离,扩增,浓缩和缓冲液交换。
电穿孔单元能够通过电穿孔和其他非病毒方法转染传统上已知具有低转染效率的细胞,包括原代细胞,干细胞,神经元以及静止或非增殖细胞。该系统包括一个电穿孔装置,电穿孔溶液,电穿孔药筒和优化的电穿孔方案。电穿孔单元由一个核心单元和1-3个满足不同需求的附加功能性附加单元组成。例如,电穿孔装置可用于转染20μl-100μl和1ml–20ml体积的1×107至1×109的不同细胞数。
本文描述了使用电穿孔单元和octanecocoontm系统的自动化,完全封闭,无菌和稳固的转染和细胞扩增的程序。在概念验证(poc)评估中,各自的电穿孔软件和octanecocoontmactes软件将彼此独立运行。在其他实施例中,软件被完全集成在系统之间。
方法
使用电穿孔单元和cocoontm系统对外周血单核细胞(pbmc)转染和扩增的评估分为三个主要重点领域:
cocoontm盒中的细胞浓度,octanecocoontm和电穿孔单元之间的细胞转移,cocoontm和电穿孔单元之间转移的转染细胞的扩增以及cocoontm盒中的细胞浓度。
cocoontmactes盒在其培养室中再循环约450ml的培养基。细胞增殖室通常在其260cm2的区域内可容纳多达180ml的恒定体积的培养基。cocoontm盒的各种卫星储存器和室提供了超过260cm2扩散室180ml容量的其他介质体积。来自这些卫星储存器的其他培养基可在一次性cocoontm的培养部分内再循环,以提供新鲜的营养并从260cm2扩散室内的细胞中去除废物。
电穿孔单元可转染的示例性体积为20ml。20ml的体积应适当地包含至少90%的适当电穿孔溶液。因此,对于poc研究,将原始培养物的体积减小至10ml,然后在另外90ml的补充p3原代细胞电穿孔溶液中稀释,并浓缩至最终体积为10ml–18ml。
所描述的概念验证研究利用了以下内容:
来自诺信efd的20号,0.024″内径/0.036″外径的限流器,其被添加到渗透管线的末端。
用1×108cd3+:cd28+免疫磁珠(invitrogen)+刺激1×108pbmc,并在完整的t细胞培养基中扩增,该培养基由x-vivo15培养基(lonza)和5%人血清a/b(sigma)和10ng/mlil-2(peprotech)组成,并使用多个grex100wilsonwolf)培养皿培养长达10天。将测试浓度的细胞转移至250ml锥形瓶中,并在加有5%co2的37℃恒温箱中于加湿的空气中静置2-4小时。将沉降的细胞悬液的上清液减少至10ml,并丢弃过量的上清液。将90ml补充的p3原代细胞电穿孔溶液(lonza)添加到浓缩的细胞悬液中,使最终体积为100ml。然后将100ml细胞悬浮液浓缩至10ml的体积。对照细胞样品在37℃下孵育。使用nucleocounternc-200(chemometec)对预稀释的细胞培养物,稀释的培养物和最终的浓缩细胞悬液进行两次重复计数。使用血清移液管和krosflo量表测量体积。从初始培养物预稀释液,上清液和最终浓缩的细胞悬液中获得残留的测试样品。使用人血清elisa试剂盒(bethyllaboratories)来确定稀释和浓缩后剩余的血清百分比。在对照细胞和浓缩的细胞悬浮液上进行cd4+和cd8+表达的facs分析。
对cocoontm转染方案的体积减少的成功演示定义如下:≥85%的细胞恢复率,≤10%的细胞活力降低和≤10%的初始浓度的人血清残留。
在octanecocoontm和电穿孔单元之间的细胞转移。
细胞在cocoontm和电穿孔装置之间的转移需要几种一次性消耗品:cocoontm盒,电穿孔盒,两个改良的电穿孔储罐和两个连接管套件(请参见图17)。
改进的电穿孔储器包括具有鲁尔锁连接端部的入口和出口可焊接管,储器壳体内的细胞入口连接到外部入口储器管以用于无菌细胞转移到储器中,鲁尔锁底物添加端口在低压储液罐的入口管,以及盖子上的排气过滤器,用于在体积传输期间排出空气。cocoontm盒的设计带有一个端口,该端口能够以受控方式自动将液体和细胞悬浮液转移到cocoontm外部,而不会损害培养物的无菌性或细胞健康。
成功地证明了cocoontm和电穿孔装置之间细胞的无菌转移证明:转移的转染细胞的上清液通过了无菌测试,转染并递送至cocoontm盒增殖室后,在转染前后的培养样品中未检测到支原体,cocoontm盒中转染前细胞/体积的回收率≥90%,在cocoontm和电穿孔单位细胞转移运动之间,未转染细胞的生存力变化≤5%,比较在cocoontm和电穿孔装置之间自动转染和不自动转染的细胞时,在cd3+,cd4+和cd8+细胞中变化≤20%。
cocoontmactes盒式磁带具有两个带有bdq-syte母鲁尔锁紧端的采样端口,以及带有插管的入口和出口,可将细胞悬液自动转移出cocoontm盒并通过无菌连接到这些位置的连接管套件。在poc研究期间,将cocoontm盒,电穿孔储液器,电穿孔盒和连接管套件之间的连接无菌连接,以在cocoontm和电穿孔系统之间形成无菌环,如下所示。
具有icu
在实施例中,cocoontm泵将转染的细胞转移至cocoontm增殖室,利用能够电转细胞的第二电穿孔储罐或其他收获容器,在将新转染的细胞递送至大肠杆菌的增殖室之前将其收获cocoontm盒。可以使用无菌焊接技术来代替改进的电穿孔储罐和pvc管连接管套件的入口和出口pvc管之间的无菌鲁尔锁连接。
本文所述的细胞工程系统(cocoon)还允许通过从内部cocoontm环境引导通过cocoontm仪器的空心轴的导管,在cocoontm盒与电穿孔单元之间进行无菌,封闭的连接。该空心轴称为“喇叭臂”,可从外部环境访问cocoontm培养室的内部环境,而不会失去对关键工艺参数的控制。cocoontm和电穿孔装置之间的细胞移动使用了蠕动泵和两个独立控制系统的软件,但也可以利用组合系统的软件来控制独立的泵系统。
在转染之前,使用cocoontm泵,软件和连接管套件(先前已描述),将细胞/流体手动转移到无菌电穿孔储罐中以模拟预扩增(第0天)转染程序,或者从cocoontm盒增殖室转移以模拟扩增后转染程序至无菌电穿孔储存罐中。然后,cocoontm泵和软件自动将细胞/流体从cocoontm盒转移到电穿孔储罐的入口。电穿孔系统执行了从电穿孔储罐到电穿孔滤芯,再到第二个电穿孔储罐的高达20ml的预编程泵运动。然后,cocoontm泵将收获到的转染的细胞/缓冲液从第二个电穿孔储罐转移到cocoontm盒的增殖室中。
合并的第二电穿孔储罐用以收集转染的细胞,所述转染细胞准备好被cocoontm泵转移至cocoontm增殖室之前都储存在第二电穿孔储罐中。要仅使用电穿孔装置泵将转染的细胞从电穿孔装置移至cocoontm增殖室,可以使用“连接管套件清除”程序。另外,连接管套件的长度应一致。
使用先前描述的cocoontm盒,连接管套件和改良的电穿孔储罐连接(图17),使用cocoontm泵将11ml磷酸盐缓冲溶液(lonza)从cocoontm盒转移至改良的电穿孔储罐。使用电穿孔程序对pbs溶液进行模拟转染,并将11ml的体积移至第二个改良的电穿孔储罐中。然后使用cocoontm泵和软件将11ml的体积从第二个改良的电穿孔储罐转移到cocoontm盒的输出袋中。每次的运行从cocoontm储罐转移到卫星袋的体积估计为11ml。转移到第一个改良的电穿孔储罐,第二个改良的电穿孔储罐和cocoontm输出袋后,使用血清移液管测量实际体积。通过标准是从第一个改良的电穿孔储罐到cocoontm输出袋的流体回收率≥90%。
细胞悬浮测试
将在450ml完整t细胞培养基中扩增1×108和5×108总可行pbmc,该培养基由x-vivo15培养基(lonza)和5%人血清a/b(sigma)和10ng/mlil-2(peprotech),装在无菌的cocoontmactes盒中。在第3天,将除去440ml培养上清液,并进行无菌和支原体检测。细胞将在90ml补充的p3电穿孔溶液(lonza)中稀释。然后将细胞在cocoontm盒中浓缩至约10ml细胞悬浮液,然后转移到cocoontm卫星袋中。将评估使用额外的10ml补充p3电穿孔溶液洗涤增殖室并将其添加到cocoontm卫星袋中的细胞悬液中。使用nucleocounternc-200(chemometec)、支原体和无菌保持液,从卫星袋中的浓缩细胞中取出样品进行重复细胞计数。如前所述,然后将细胞通过cocoontm泵和连接管套件转移到改良的电穿孔储罐中。电穿孔单位泵和eo-210程序将用于用pmaxgfp载体(lonza)转染t细胞,并将转染的细胞转移到第二个改良的电穿孔储罐中。然后,cocoontm泵会将细胞从改良的电穿孔储罐转移到cocoontmactes盒的增殖室。从actes盒增殖室中取出细胞样品,以进行重复的细胞计数、支原体和无菌测试。将使用对照培养物重复此过程,在该培养物中,细胞不会被转染,而是使用模拟电穿孔程序ca-100通过电穿孔单元。将使用三个不同的供体对该程序进行评估;既是新鲜分离的,又是从冷冻保存的pbmc批次中分离的。
将在未转染的细胞培养物中测量细胞活力的变化。将在所有培养物中评估细胞恢复、无菌和支原体负荷。流式细胞仪将用于评估gfp,cd3+,cd4+,cd8+和其他标记物的表达。
细胞悬浮液在cocoontm和电穿孔装置之间的无菌转移提供了运动前后无菌、无支原体的上清液,转染并递送至cocoontm盒增殖室后,cocoontm盒中预转染细胞的回收率≥90%,未转染细胞的活力变化≤5%,转染后cd3+,cd4+和cd8+细胞比率的变化≤20%。
在cocoontm和电穿孔装置之间转移的转染细胞的扩增
总共1×108和5×108个可行的pbmc将在cocoontm盒中进行扩展和集中,如之前在“octanecocoontm和电穿孔lv单元之间的细胞转移,细胞悬浮测试”的方法部分所述,通过无菌连接转染电穿孔lv单元,并无菌转移到cocoontm。使用最相关和最优化的自动化cocoontm方案,将在cocoontm盒增殖室中将转染的细胞培养15天。将对照在t-225烧瓶(corning)或grex100(wilsonwolf)培养皿中扩增3天。在第3天,将对对照培养物进行无菌和手动浓缩,通过电穿孔lvuniteo-210程序进行转染,然后转移回原始容器中,以进行长达15天的持续扩增。将使用来自新鲜分离的或冷冻保存的pbmc批次的三个不同的供体评估该程序。
与在转染后24小时和收获日的对照培养物相比,在cocoontm和电穿孔单元之间转移的转染细胞的扩增提供了±10%的转染效率变化,最终细胞浓度≥对照培养物的80%,与对照培养物相比,最终细胞存活力的变化为±5%,与gfp+,cd3+,cd4+和cd8+表达的对照培养物相比,则为±10%,如通过facs测定的,转移的转染细胞的上清液通过了无菌测试,并且在转染前后的培养样品中未检测到支原体。
结果
cocoontm盒中的细胞浓度
来自两个供体的细胞通过用4.4×108和4.2×108的总活细胞沉降至10ml体积来进行浓缩。然后将这两个细胞悬液用90ml补充电穿孔溶液(nfs)稀释并浓缩。浓缩后的细胞回收率为92%和87%。转染前的细胞活力分别为92%和74%,下降幅度小于5%。在两次运行中,在最终的浓缩细胞悬液中检测到初始培养上清液的6%和8%。
表3:原始培养上清液、稀释和浓缩后的渗透液以及最终细胞悬浮液上清液中可检测到的人血清a/b的百分比。
与未浓缩的对照培养物相比,浓缩后的cd4+:cd8+谱图没有差异。
结果表明,流体从cocoontm卫星袋回收到cocoontm输出袋。在cocoontm和电穿孔装置之间转移了转染细胞的扩增。在电穿孔单元中成功进行电穿孔,产生转导的细胞。
本文提供了在电穿孔单元和cocoontm系统之间使用的闭环,实现了自动化,完全封闭的转染。该方法可用于在cocoontm系统中浓缩细胞。
实施例4–造血干细胞扩增
cd34+专注于脐带血的扩增。此方法的特定应用是从包含低cd34+数目的脐带血样本中扩增cd34+,以便将单个完全匹配的脐带用于成人治疗。因此,与其他方案相比,该方法的起始细胞数和浓度非常低。可以预测,随着起始数目和浓度的增加,细胞扩增将降低。
选择并扩增cd34+细胞
随时间推移跟踪的总有核细胞(tnc)
起始细胞浓度低于许多其他方案(0.1m细胞/ml)
发现细胞扩增基于收获方案而变化(图19)。
在培养期间跟踪细胞表型的变化
扩增12天后,tnc的25.3%为cd34+(图20)
分化的细胞表型示于图21。图22示出了单个菌落能够形成多谱系分化。
引用文献
fda,regenerativemedicineadvancedtherapydesignation.(2017).availableat:https://www.fda.gov/biologicsbloodvaccines/cellulargenetherapyproducts/ucm537670.htm.(accessed:8thaugust2017)
wang,x.&rivière,i.clinicalmanufacturingofcartcells:foundationofapromisingtherapy.mol.ther.-oncolytics3,16015(2016).
jones,s.d.,mckee,s.&levine,h.l.emergingchallengesincelltherapymanufacturing.bioprocessint10,s4--s7(2012).
trainor,n.,pietak,a.&smith,t.rethinkingclinicaldeliveryofadultstemcelltherapies.natbiotech32,729–735(2014).
nilsson,c.etal.optimalbloodmononuclearcellisolationproceduresforgammainterferonenzyme-linkedimmunospottestingofhealthyswedishandtanzaniansubjects.clin.vaccineimmunol.15,585–589(2008).
bohnenkamp,h.,hilbert,u.&noll,t.bioprocessdevelopmentforthecultivationofhumant-lymphocytesinaclinicalscale.cytotechnology38,135–145(2002).
lu,f.etal.automateddynamicfed-batchprocessandmediaoptimizationforhighproductivitycellcultureprocessdevelopment.biotechnol.bioeng.110,191–205(2013).
hollyman,d.etal.manufacturingvalidationofbiologicallyfunctionaltcellstargetedtocd19antigenforautologousadoptivecelltherapy.j.immunother.32,169–180(2009).
fda,sepaxcellseparationsystemandsingleusekits.(2011).availableat:
https://www.fda.gov/downloads/biologicsbloodvaccines/bloodbloodproducts/approvedproducts/substantiallyequivalent510kdeviceinformation/ucm278385.pdf.(accessed:8thnovember2017)
wegener,c.cellwashingwiththelovocellprocessingsystem.bioprocessintindustryy,p78(2014).
trickett,a.&kwan,y.l.tcellstimulationandexpansionusinganti-cd3/cd28beads.j.immunol.methods275,251–255(2003).
hasegawa,k.etal.invitrostimulationofcd8andcd4tcellsbydendriticcellsloadedwithacomplexofcholesterol-bearinghydrophobizedpullulanandny-eso-1protein:identificationofanewhla-dr15-bindingcd4t-cellepitope.clin.cancerres.12,1921–1927(2006).
odeleye,a.o.o.,marsh,d.t.j.,osborne,m.d.,lye,g.j.&micheletti,m.onthefluiddynamicsofalaboratoryscalesingle-usestirredbioreactor.chem.eng.sci.111,299–312(2014).
grishagin,i.v.automaticcellcountingwithimagej.anal.biochem.473,63–65(2015).
levine,b.l.,miskin,j.,wonnacott,k.&keir,c.globalmanufacturingofcartcelltherapy.mol.ther.methodsclin.dev.4,92–101(2017).
locke,f.l.etal.abstractct019:primaryresultsfromzuma-1:apivotaltrialofaxicabtageneciloleucel(axicel;kte-c19)inpatientswithrefractoryaggressivenon-hodgkinlymphoma(nhl).cancerres.77,ct019lp-ct019(2017).
luyc,parkerll,lut,zhengz,toomeyma,whitede,yaox,liyf,robbinspf,feldmansa,vanderbruggenp,klebanoffca,goffsl,sherryms,kammulaus,yangjc,rosenbergsa.treatmentofpatientswithmetastaticcancerusingamajorhistocompatibilitycomplexclassii–restrictedt-cellreceptortargetingthecancergermlineantigenmage-a3.journalofclinicaloncology(2017)35:29,3322-3329.
fda,availableonlineat:
https://www.fda.gov/downloads/advisorycommittees/committeesmeetingmaterials/drugs/oncologicdrugsadvisorycommittee/ucm566166.pdf
berdejajg,liny,rajens,siegeldsd,munshinc,liedtkem,jagannaths,mausmv,turkaa,lamlp,hegek,morganr,quigleymt,kochenderferj.first-in-humanmulticenterstudyofbb2121anti-bcmacart-celltherapyforrelapsed/refractorymultiplemyeloma:updatedresults.journalofclinicaloncology201735:15_suppl,3010-3010
kebriaeip,singhh,hulsmh,figiolamj,bassettr,olivaress,jenab,dawsonmj,kumaresanpr,sus,maitis,daij,moriarityb,forgetma,senyukovv,orozcoa,liut,mccartyj,jacksonrn,moyesjs,rondong,qazilbashm,ciureas,alousia,nietoy,rezvanik,marind,popatu,hosingc,shpallej,kantarjianh,keatingm,wierdaw,doka,largaespadada,leeda,hackettpb,champlinre,cooperljn.phaseitrialsusingsleepingbeautytogeneratecd19-specificcartcells.jclininvest.2016sep1;126(9):3363–3376.
morrisseyjb,shiy,trainorn.end-to-endcelltherapyautomation:animmunotherapycasestudy.bioprocessinternational(2017)10-18.
laffertykj,cunninghamaja.newanalysisofallogeneicinteractions.j.immunol.(1975)112:436–437.
hardingf,mcarthurj,grossj,rauletd,allisonj.cd28-mediatedsignallingco-stimulatesmurinetcellsandpreventsinductionofanergyint-cellclones(1992)nature356:607–609.
clavreula,fissons,d’hellencourtcl,couezd.interelationshipbetweencd3andcd28pathwaysinamurinetcellthymoma.molimmunol.(2000)37(10):571-7.
charronl,doctrinala,choileainsn,astieral.monocyte:tcellinteractionregulateshumantcellactivationthroughacd28/cd46crosstalk.immunolcellbiol.(2015)93(9):796-803.
fathmancg1,lineberrynb.molecularmechanismsofcd4+t-cellanergy.natrevimmunol.(2007)7(8):599-609.
greenwaldrj,freemangj,sharpeah.theb7familyrevisited.annualreviewofimmunology(2005)23(1):515-548.
kochenderferjn,dudleyme,kassimsh,etal.chemotherapy-refractorydiffuselargeb-celllymphomaandindolentb-cellmalignanciescanbeeffectivelytreatedwithautologoustcellsexpressingananti-cd19chimericantigenreceptor.journalofclinicaloncology(2015);33(6):540-549.
kalosm,levinebl,porterdl,etal.tcellswithchimericantigenreceptorshavepotentantitumoreffectsandcanestablishmemoryinpatientswithadvancedleukemia.sciencetranslationalmedicine(2011)3(95):95ra73.
riddellsr,greenbergpd.theuseofanti-cd3andanti-cd28monoclonalantibodiestocloneandexpandhumanantigen-specifictcells.jimmunolmethods(1990)apr17;128(2):189-201.
tricketta,kwanyl.tcellstimulationandexpansionusinganti-cd3/cd28beads.journalofimmunologicalmethods.275(2003)251-255.
dudleyme,wunderlichjr,sheltonte,evenj,rosenbergsa.generationoftumor-infiltratinglymphocyteculturesforuseinadoptivetransfertherapyformelanomapatients.journalofimmunotherapy(2003)26(4):332-342.
dudleyme,wunderlichjr,sheltonte,evenj,rosenbergsa.generationoftumor-infiltratinglymphocyteculturesforuseinadoptivetransfertherapyformelanomapatients.jimmunother.(2003)26(4):332–342.
mangerb,weissa,weyandc,goronzyj,stobojd.tcellactivation:differencesinthesignalsrequiredforil2productionbynonactivatedandactivatedtcells.jimmunother.(1985)135(6)3669-3673.
ceuppensj,bloemmenfj,vanwauwejp.tcellunresponsivenesstothemitogenicactivityofokt3antibodyresultsfromadeficiencyofmonocytefcgammareceptorsformurineigg2aandinabilitytocross-linkthet3-ticomplex.jimmunol(1985)135(6)3882-3886.
vanwauwejp,demeyjr,goossensjg.okt3:amonoclonalanti-humantlymphocyteantibodywithpotentmitogenicproperties.jimmunol.(1980)124(6):2708-13.
carpenterpa,pavlovics,tsojy,pressow,gooleyt,yuxz,anasettic.non-fcreceptor-bindinghumanizedanti-cd3antibodiesinduceapoptosisofactivatedhumantcells.jimmunol(2000)165(11)6205-6213.
andrisf,denanglaires,demattiaf,urbainj,leoo.naivetcellsareresistanttoanergyinductionbyanti-cd3antibodies.jofimmunology(2004)173(5)3201-3208.
wolfh,müllery,salmens,wilmannsw,jungg.inductionofanergyinrestinghumantlymphocytesbyimmobilizedanti-cd3antibodies.eurjimmunol.(1994)24(6):1410-1417.
chaijg,lechlerri.immobilizedanti-cd3mabinducesanergyinmurinenaiveandmemorycd4+tcellsinvitro.intimmunol.(1997)9(7):935-944.
verwilghenj,barojaml,vanvaeckf,vandammej,ceuppensjl.differencesinthestimulatingcapacityofimmobilizedanti-cd3monoclonalantibodies:variabledependenceoninterleukin-1asahelpersignalfort-cellactivation.immunology(1991)72(2):269-276.
schwartzrh.acell-culturemodelforlymphocyte-tclonalanergy.science(1990)248:1349-1356.
jusw,jusg,wangfm,guzj,qiuyh,yugh,mahb,zhangxg.afunctionalanti-human4-1bbligandmonoclonalantibodythatenhancesproliferationofmonocytesbyreversesignalingof4-1bbl.hybridomaandhybridomics.(2003)22:333–338.
barojaml,lorrek,vanvaeckf,ceuppensjl.theanti-tcellmonoclonalantibody9.3(anti-cd28)providesahelpersignalandbypassestheneedforaccessorycellsintcellactivationwithimmobilizedanti-cd3andmitogens.cellimmunol.(1989)120(1):205-217.
austynjm,smithkg,morrispj.tcellactivationbyanti-cd3antibodies:functionoffcreceptorsonbcellblasts,butnotrestingbcells,andcd18ontherespondingtcells.eurjimmunol.198717(9):1329-35.
taxwjm,willemshw,reekersppm,capelpja,koenerap.polymorphisminmitogeniceffectofigg1monoclonalantibodiesagainstt3antigenonhumantcells.nature(1983)304:445-447.
fleischerj,soethe,reilingn,grage-griebenowe,fladhd,ernstm.differentialexpressionandfunctionofcd80(b7-1)andcd86(b7-2)onhumanperipheralbloodmonocytes.immunology(1996)89(4):592-598.
schwartzrh.tcellanergy.annualreviewimmunology(2003)21:305-34.
feldmanna,arndtc,
reuschu,duellj,ellwangerk,herbrechtc,knackmusssh,fuceki,eserm,mcaleesef,molkenthinv,gallfl,etal.atetravalentbispecifictandab(cd19/cd3),afm11,efficientlyrecruitstcellsforthepotentlysisofcd19(+)tumorcells.mabs.(2015)7:584–604.
churchse,jensensm,antonypa,restifonp,foxba.tumor-specificcd4+tcellsmaintaineffectorandmemorytumor-specificcd8+tcells.eurjimmunol.(2014)44(1):69-79.
feldmanna,arndtc,
reuschu,duellj,ellwangerk,herbrechtc,knackmusssh,fuceki,eserm,mcaleesef,molkenthinv,gallfl,toppm,littlem,zhukovskyea.atetravalentbispecifictandab(cd19/cd3),afm11,efficientlyrecruitstcellsforthepotentlysisofcd19(+)tumorcells.(2015)7:584–604.
riddellsr,sommermeyerd,bergerc,etal.adoptivetherapywithchimericantigenreceptor-modifiedtcellsofdefinedsubsetcomposition.cancerj.(2014)20(2):141-144.
turtlecj,hanafil-a,bergerc,etal.cd19car–tcellsofdefinedcd4+:cd8+compositioninadultbcellallpatients.thejournalofclinicalinvestigation.(2016)126(6):2123-2138.
lockefl,neelapuss,bartlettnl,siddiqit,siddiqit,chavezjc,hosingcm,ghobadia,buddele,bota,rossijm,jiangy,xueax,eliasm,aycockj,wiezorekj,gowy.phase1resultsofzuma-1:amulticenterstudyofkte-c19anti-cd19cartcelltherapyinrefractoryaggressivelymphoma.moleculartherapy(2017)25(1):285-295.
trainorn,pietaka,smitht.rethinkingclinicaldeliveryofadultstemcelltherapies.naturebiotech(2014)729-735.
mahdavib,gottschalku,trainorn,smitht.thehype,hopeandrealityofpersonalization.themedicinemaker(2015)38-41.
yanm,schwaederlem,arguellod,millissz,gatalicaz,kurzrockr.her2expressionstatusindiversecancers:reviewofresultsfrom37,992patients.cancermetastasisreview(2015)34(1):157-164.
tuefferdm,couturierj,penault-llorcaf,vincent-salomona,
lutl,pugachm,somerviller,rosenbergsa,kochendeferjn,betterm,feldmansa.arapidcellexpansionprocessforproductionofengineeredautologouscar-tcelltherapies.humangenetherapy(2016)27:209-218.
nociarimm,shaleva,beniasp,russoc.anovelone-step,highlysensitivefluorometricassaytoevaluatecell-mediatedcytotoxicity.jimmunolmethods(1998)213(2):157-167.
romagnanis.type1thelperandtype2thelpercells:functions,regulationandroleinprotectionanddisease.intjclinlabres(1991)21(2):152-158.
fleischerj,soethe,reilingn,grage-griebenowe,fladhd,ernstm.differentialexpressionandfunctionofcd80(b7-1)andcd86(b7-2)onhumanperipheralbloodmonocytes.immunology(1996)89(4):592-598.
lauxi,khoshnana,tindellc,baed,zhuxm,junech,effrosrb,nela.responsedifferencesbetweenhumancd4+andcd8+t-cellsduringcd28costimulation:implicationsforimmunecell-basedtherapiesandstudiesrelatedtotheexpansionofdouble-positivet-cellsduringaging.clinimmunol.(2000)96:187-197.
liy,kurlanderrj.comparisonofanti-cd3andanti-cd28-coatedbeadswithsolubleanti-cd3forexpandinghumantcells:differingimpactoncd8tcellphenotypeandresponsivenesstorestimulation.jtranslmed.(2010)8:104.
zhuyw,zhugf,luolq,fliesas,chenlp.cd137stimulationdeliversanantigen-independentgrowthsignalfortlymphocyteswithmemoryphenotype.blood(2007)109:4882–4889.
ledbetterja,imbodenjb,schievengl,grosmairels,rabinovitchps,lindstent,thompsoncb,junech.cd28ligationint-cellactivation:evidencefortwosignaltransductionpathways.blood(1990)75(7):1531-1539.
atkurikr,herzenbergla,herzenbergla.culturingatatmosphericoxygenlevelsimpactslymphocytefunction.proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica(2005)102(10):3756-3759.
avgoustiniatoses,heringbj,rozakpr,etal.commerciallyavailablegas-permeablecellculturebagsmaynotpreventanoxiainculturedorshippedislets.transplantationproceedings.2008;40(2):395-400.
hammillja,vanseggelenh,helsencw,denisovagf,eveleghc,tantalodgm,bassettjd,bramsonjl.designedankyrinrepeatproteinsareeffectivetargetingelementsforchimericantigenreceptors.journalforimmunotherapyofcancer(2015)3:55.
vanseggelenh,tantalodgm,afsahia,hammillja,bramsonjl.chimericantigenreceptor-engineeredtcellsasoncolyticviruscarriers.moleculartherapy-oncolytics(2015)2,150014.
对于相关领域的普通技术人员而言,显而易见的是,在不脱离任何实施例的范围的情况下,可以对本文所述的方法和应用进行其他适当的修改和改编。
应当理解,尽管在此已经图示和描述了某些实施例,但是权利要求书不限于所描述和示出的部件的特定形式或布置。在说明书中,已经公开了说明性实施例,并且尽管采用了特定术语,但是它们仅在一般和描述性意义上使用,而不是出于限制的目的。根据上述教导,可以对实施例进行修改和变化。因此,应当理解,可以以不同于具体描述的方式来实践实施例。
本说明书中提到的所有出版物、专利和专利申请都以相同的程度通过引用并入本文,就像每个单独的出版物、专利或专利申请被明确地和单独地指出通过引用并入一样。
- 还没有人留言评论。精彩留言会获得点赞!