用遗传修饰的β细胞治疗糖尿病的制作方法
相关申请的交叉引用
本申请要求以下的优先权:于2017年10月3日提交的美国临时申请号62/567,604;于2017年10月4日提交的美国临时申请号62/568,117;于2018年3月2日提交的美国临时申请号62/637,913;于2018年4月25日提交的美国临时申请号62/662,651;于2018年7月6日提交的美国临时申请号62/694,634;于2018年7月11日提交的美国临时申请号62/696,603;于2018年8月10日提交的美国临时申请号62/717,587;于2018年8月20日提交的美国临时申请号62/719,975;以及于2018年9月21日提交的美国临时申请号62/734,910;所述申请各自整体引入本文作为参考。
序列表
本申请含有序列表,所述序列表已以ascii格式电子提交,并且在此整体引入作为参考。于2018年9月25日创建的所述ascii副本,命名为054610-501001wo_sl.txt,且大小为8,668字节。
发明领域
本发明涉及遗传修饰的人β细胞以及使用此类细胞的方法。遗传修饰的(转基因的)人β细胞表达了趋除(fugetactic)量的趋除剂(fugetacticagent),从而赋予针对人单核免疫细胞的保护。在一个实施方案中,趋除剂是例如cxcl12或cxcl13。在一个实施方案中,转基因β细胞包含载体,其中所述载体包含编码趋除剂,且优选人趋除剂的核酸序列。在一个实施方案中,将转基因β细胞进一步修饰为衰老的。本发明的方法包括使用这些细胞在高血糖环境中表达胰岛素,所述高血糖环境包括在糖尿病患者,特别是i型糖尿病患者中发现的那些。
发明背景
β细胞负责在胰腺中产生胰岛素。在患有1型糖尿病(t1d)的受试者中,β细胞被免疫系统攻击且破坏,并且作为结果,患有t1d的受试者无法有效地产生其自身的胰岛素。cloningtechniqueusedtocreatepancreaticcellsfortype1diabetes,diabetes.co.uk,www.diabetes.co.uk/news/2014/apr/cloning-technique-used-to-create-pancreatic-cells-for-type-1-diabetes-94233303.html(2014年4月29日)。
当受试者的持续高血糖压倒受试者的β细胞产生足够的胰岛素来预防受试者中的高血糖的能力,并且导致β细胞功能异常、去分化和死亡时,2型糖尿病(t2d)发生。feliciawpagliuca&douglasa.melton,howtomakeafunctionalβ-cell,”development2013,140(12),2472-2483。
从正常供体到糖尿病受体的同种异体β细胞移植(也称为胰岛细胞移植)已视为治疗糖尿病的方法。然而,单核免疫细胞(t细胞、b细胞和nk细胞)的浸润导致β细胞移植的失败。cloningtechniqueusedtocreatepancreaticcellsfortype1diabetes,diabetes.co.uk,http://www.diabetes.co.uk/news/2014/apr/cloning-technique-used-to-create-pancreatic-cells-for-type-1-diabetes-94233303.html(2014年4月29日);alanh.cruickshank&emyrwbenbow,“recurrenceofdiabetes,”pathologyofthepancreas(第2版,1995年);feliciawpagliuca&douglasa.melton,“howtomakeafunctionalβ-cell,”development2013,140(12),2472-2483。
目前的临床实践是经由门静脉将含有β细胞的胰岛移植到肝内,其原理是从胰腺中释放的大多数胰岛素都在肝中利用,并且该部位可通过微创程序容易地接近。然而,一半的β细胞在移植后不久就死亡,并且这被认为是由于低氧张力、主动的免疫应答、以及肝中高水平的毒素和药物。另外,即时血液介导的炎症反应(ibmir)将移植的胰岛包封在纤维蛋白凝块中,并且增强了针对移植物的免疫反应。因此,已测试了几个可替代的移植部位,包括肠、肾囊、网膜和皮下,其可能对患者安全性是最佳的,但尚未对于胰岛素的全身释放进行全面评估。
为了预防其暴露于单核免疫细胞,β细胞已包封在据报道发挥以下双重功能的装置中:将这些细胞与免疫破坏分离,并且保护宿主免于移植物。当非自体细胞(例如同种异体或异种细胞)用于移植时,或者如果将自体细胞移植到自身免疫环境(例如1型糖尿病患者)内,需要免疫保护。这可以通过经由使用半透膜或支架物理隔离细胞来阻断细胞应答来实现。这种方法减少了关于免疫抑制的需要,并且最近已在其它地方详细综述(sakata等人,worldjgastrointestpathophysiol.2012;3:19–26;qi,advmed.2014;2014:429710)。包封还预防细胞逃逸移植物的位置,并且允许在需要时的去除。这是特别相关的,因为不受控制的分化和生长例如畸胎瘤已经常在移植有干细胞衍生的胰腺前体的小鼠中观察到(kroon等人,natbiotechnol.2008;26:443–452;kelly等人,natbiotechnol.2011;29:750–756.)。畸胎瘤形成可以通过使用细胞纯化(kelly等人,2011)或通过改善分化方法,通过生成由成熟β细胞的纯群体组成的移植物来预防。如果胰岛素瘤/畸胎瘤由移植细胞形成,则包封还预防潜在的转移。
这种方法需要有效且可重现的微囊化方案,并且一些细胞可能在包封的材料内死亡,而无被清除或去除的可能性。一些报告已显示,微囊化的β细胞可以在植入后一直到6个月保持活力(orlando等人,diabetes.2014;63:1433–1444)。这意味着当装置不再起作用时,需要重复手术以更换微囊化装置。
鉴于上文,长久以来迫切需要开发有效治疗糖尿病,且特别是1型糖尿病的技术。
发明概述
本发明涉及转基因的人β细胞以及转基因的衰老人β细胞,其表达有效量的趋除剂,以便致使这些细胞对人免疫细胞有抗性。趋除剂是本领域众所周知的,包括“cxcl12”。这种细胞因子,也称为sdf-1,由胸腺和骨髓基质产生(参见例如美国专利号5,756,084,名称为:“humanstromalderivedfactor1α.and1β.”,于1998年5月26日授予honjo等人)。已报道,cxcl12排斥效应性t细胞,同时将免疫抑制性调节性t细胞募集到解剖部位。参见例如,poznansky等人,naturemedicine2000,6:543-8。cxcl12及其受体cxcr4也报道为血管生成的组成部分。
还公开了除cxcl12外的排斥免疫细胞的试剂,包括但不限于gp120、其它cxcr4配体、il-8、cxcr4结合抗体、cxcl13、cxcr5配体、cxcr5结合抗体等等。
本发明的一个实施方案是转基因的人β细胞,其表达有效量的趋除剂,优选cxcl12或cxcl13,以便致使该细胞对人免疫细胞有抗性。在一个实施方案中,通过将关于该试剂(例如cxcl12、cxcl13)的人转基因引入β细胞或β细胞的前体(例如,多能干细胞)内,来生成此类趋除有效量的趋除剂。这些人转基因β细胞进一步表征为在高血糖环境中表达胰岛素。因此,这些细胞可以用于治疗受试者中的糖尿病的方法中。本文所述的方法中使用的转基因的人β细胞可以是自体或非自体的(例如同种异体的)β细胞。在一个实施方案中,患者患有t1d。在另一个实施方案中,可以将转基因的人β细胞修饰为衰老的(不能分裂),使得消除了这些细胞的任何进一步分化成癌细胞的可能,并且取消了由于不适当的细胞分裂引起的细胞凋亡诱导。
本发明的一个实施方案使用β细胞,例如自体或同种异体β细胞,其得自或衍生自非糖尿病的人受试者或患有糖尿病的人受试者。这些β细胞包括功能性趋除剂(例如cxcl12、cxcl13)表达载体。此类载体设计为在转基因β细胞中表达该试剂,其水平足以在β细胞周围产生趋除缓冲区。不希望受理论的束缚,预期这个缓冲区允许β细胞抵抗免疫细胞的攻击,但仍表达胰岛素,如对于维持糖尿病受试者中适当的血糖水平所必要的。来自患有糖尿病的患者的自体β细胞的生成是本领域已知的。参见例如,egli等人,emboj.2015apr1;34(7):841–855,其整体引入本文作为参考。衍生自干细胞的同种异体β细胞是商购可得的。
本发明的一个方面是向有此需要的受试者施用转基因的人β细胞(其包含编码趋除剂(例如cxcl12、cxcl13)的转基因),以在受试者中调节胰岛素水平并治疗糖尿病。另外,足够量的趋除剂的表达保护免于转基因β细胞通过单核免疫细胞浸润破坏的风险。转基因的人β细胞可以是自体的或同种异体的。在本发明的一个实施方案中,转基因β细胞是衍生自患有糖尿病的患者的自体β细胞。在另一个实施方案中,转基因β细胞是同种异体人β细胞。在另一个实施方案中,患者患有1型糖尿病。
本发明的另一个方面涉及转基因的人β细胞,其能够表达趋除有效量的趋除剂(例如cxcl12、cxcl13),以便对免疫破坏有抗性。趋除剂(例如cxcl12、cxcl13)可以是内源试剂,即由待治疗的受试者表达的试剂,或外源试剂,例如来自非自体来源的试剂或修饰的趋除剂。在一个实施方案中,与未修饰的基因相比,将β细胞中编码趋除剂的基因修饰为过表达的。用于修饰基因表达的方法是本领域已知的,例如定点基因编辑以用不同的启动子(例如组成型启动子、诱导型启动子等)替换内源启动子。在一个实施方案中,将编码趋除剂的重组多核苷酸插入β细胞内,使得由重组多核苷酸表达趋除剂。用于将重组基因插入细胞内的方法(转导、转染等)是本领域众所周知的,如用于制备用于插入细胞内的具有重组多核苷酸的载体的方法一样。
在一些实施方案中,趋除剂是修饰的趋除剂。例如,可以修饰趋除剂的多肽序列,以增加循环半衰期,以掺入保守的氨基酸变化,增强与细胞外基质的结合,改善所述试剂的活性等。相应地,可以修饰编码修饰的趋除剂(例如,cxcl12或cxcl13)的基因,使得该基因与天然基因具有至少95%的序列同一性,且优选与天然基因具有99%的序列同一性。同样地,修饰的趋除剂(例如,修饰的cxcl12或cxcl13)的氨基酸序列与天然试剂具有至少95%,且优选99%的序列同一性。
在一个实施方案中,提供了包含载体的人β细胞,所述载体本身包含编码人cxcl12或修饰的cxcl12的核酸序列,其中所述β细胞制备为对人免疫细胞有抗性。
在一个实施方案中,人转基因β细胞是得自患有1型糖尿病的受试者的自体β细胞。
在一个实施方案中,人β细胞是同种异体β细胞。
在一个实施方案中,人单核免疫细胞包括nk细胞、t细胞和b细胞。在一个实施方案中,t细胞包括细胞毒性t细胞。
在一个实施方案中,转基因的人β细胞表达趋除量的人cxcl12。
在一个实施方案中,人cxcl12选自cxcl12α和cxcl12β。
在一个实施方案中,人转基因β细胞包含在内源性cxcl12编码区上游的转基因调节区,其中所述β细胞对人免疫细胞有抗性。优选地,内源性cxcl12编码区调节区包含组成型启动子。在一些实施方案中,内源性cxcl12编码区调节区包含诱导型启动子。
在一个实施方案中,包含在内源性cxcl12编码区上游的转基因调节区的人转基因β细胞(其中所述β细胞对人免疫细胞有抗性)是自体β细胞,且优选得自患有糖尿病的患者的β细胞。
在一个实施方案中,包含在内源性cxcl12编码区上游的转基因调节区的人转基因β细胞(其中所述β细胞对人免疫细胞有抗性)是同种异体β细胞。
在一个实施方案中,提供了人转基因β细胞,其包含可表达的人cxcl12或cxcl13基因,其中所述细胞表达趋除有效量的cxcl12或cxcl13,以便对人免疫细胞有抗性。
在一个实施方案中,人转基因β包含关于cxcl12的人基因。
在一个实施方案中,人转基因β细胞包含选自cxcl12α和cxcl12β的人基因。
在一个实施方案中,人转基因β细胞包含关于cxcl12β的人基因。
在一个实施方案中,提供了人转基因的衰老的β细胞,其包含可表达的人cxcl12或cxcl13基因,其中所述细胞表达趋除有效量的cxcl12或cxcl13,以便对人免疫细胞有抗性,并且进一步其中所述细胞是衰老的。
在一个实施方案中,人转基因的衰老的β细胞包含关于cxcl12的可表达人基因,并且其能够在高血糖培养基的存在下表达胰岛素。
在一个实施方案中,人转基因的衰老的β细胞包含选自cxcl12α和cxcl12β的可表达人基因。
在一个实施方案中,人转基因β细胞包含的可表达人基因为cxcl12β。
在一个实施方案中,提供了用于响应高血糖环境而产生胰岛素的方法,所述方法包括使所述环境与如上所述的人转基因β细胞群体接触。
在一个实施方案中,人转基因β细胞对选自t细胞、b细胞、nk细胞及其混合物的人免疫细胞有抗性。
在一个实施方案中,通过以下获得本文所述的β细胞:
(a)从人受试者获得人祖细胞或人多能干细胞群体;
(b)将受试者的祖细胞或多能干细胞分化成β细胞;和
(c)将编码趋除剂的核酸分子引入β细胞内。
在一个实施方案中,趋除剂是细胞因子、趋化因子、cxcr4结合抗体、cxcr4配体、cxcr5结合抗体或cxcr5配体。
在一个实施方案中,趋除剂是cxcl12、cxcl13、gp120或il-8。
在一个方面,提供了通过修饰β细胞以便以足以抑制或阻断免疫细胞杀死所述β细胞的水平表达趋除剂而促进包含免疫细胞的生物样品中的β细胞的存活的方法。
附图简述
图1是蛋白质印迹的照片,其显示了当各自在β细胞中过表达时,cxcl12α、cxcl12β、cxcl12γ、cxcl12θ和cxcl12δ和cxcl14的相对量。
图2a和2b是条形图,其显示了从表达cxcl12α或cxcl12β的β细胞中释放的乳酸脱氢酶(ldh,细胞裂解的标记物)的相对量,所述β细胞以30:1的pbmc:β细胞比与pbmc一起温育24和48小时。
图3显示了在表达每种细胞因子的两组β细胞中cxcl12α和cxcl12β的表达水平。
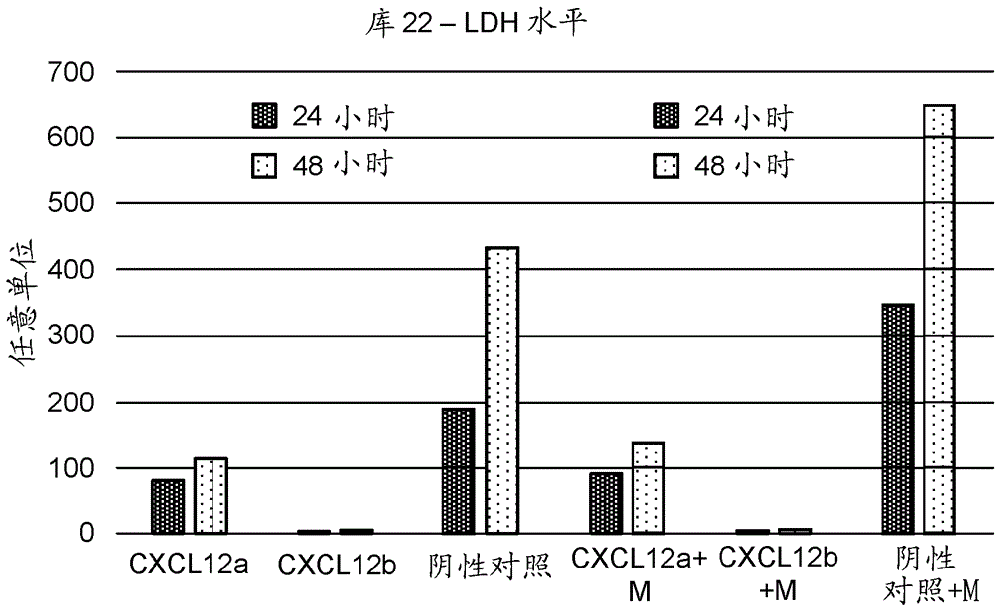
图4a和4b是条形图,其显示了从表达cxcl12α或cxcl12β的β细胞中释放的ldh的相对量,所述β细胞以30:1的pbmc:β细胞比与pbmc一起温育24和48小时,伴随或不伴随β细胞的衰老诱导(通过丝裂霉素c处理)。
图5显示了通过表达cxcl12α或cxcl12β的β细胞的高血糖攻击的胰岛素诱导,伴随或不伴随用丝裂霉素c的处理。
发明详述
本发明提供了自体/同种异体人β细胞,其是转基因的,并且包含编码人趋除剂(例如cxcl12、cxcl13)的转基因,或者已被遗传修饰为表达或过表达趋除量的内源性(人)趋除剂(例如,cxcl12、cxcl13)。在一个优选的实施方案中,本文所述的转基因β细胞被进一步修饰为衰老的。在其方法方面的另一个中,β细胞这样进行修饰或处理,以便表达有效量的趋除剂(例如cxcl12、cxcl13),以便抑制转基因的人β细胞的免疫破坏,并且响应高血糖环境而产生胰岛素。
在进一步详细公开本发明之前,将首先定义下述术语。如果术语未进行定义,则它具有如本领域理解的其一般公认的科学含义。
术语“cxcl13”指其所有已知的同种型。由于已知cxcl13介导某些癌细胞的增殖,因此它并非优选的。参见例如https://www.ncbi.nlm.nih.gov/pmc/articles/pmc3839818/。
术语“趋除性”或“趋除的”指试剂排斥(或化学排斥)具有迁移能力的真核细胞的能力。由细胞表达的cxcl12或cxcl13(或其它趋除剂)的趋除量是足以阻断或抑制免疫细胞朝向细胞迁移,或在一些方面从细胞排斥免疫细胞的量。
术语“人免疫细胞”可与术语“人单核免疫细胞”互换使用,并且包括nk细胞、t细胞和b细胞。
术语“免疫细胞抵抗的”或“对免疫系统隐身”指示β细胞表达一定量的趋除剂,其足以阻断或抑制免疫细胞朝向细胞迁移,或在一些方面从β细胞排斥免疫细胞。在一个优选的实施方案中,通过在本发明的β细胞暴露于人单核免疫细胞(例如,pbmc)后的细胞死亡程度,来测量此类阻断或抑制。可以通过来自已经历裂解的细胞的乳酸脱氢酶(ldh)释放,来评价细胞死亡。优选地,本发明的免疫细胞抵抗的β细胞可以通过这样的细胞进行评价,在两天的温育期内,在约30:1的免疫细胞与本发明的β细胞的比率下,所述细胞证明相对于对照小于50%的ldh水平。更优选地,免疫抵抗的β细胞证明相对于对照小于60%的ldh水平;且甚至更优选地,相对于对照小于75%的ldh水平;且最优选地,相对于对照小于95%的ldh水平。在本文的实施例2中阐述了用于评价ldh水平的程序。
趋除剂是具有趋除活性的试剂。趋除剂可以包括但不限于cxcl12、cxcl13、gp120、il-8、cxcr4结合抗体、cxcr4配体、cxcr5结合抗体或cxcr5配体。
术语“效应性t细胞”指能够通过释放细胞因子而产生特异性免疫应答的分化t细胞。
术语“调节性t细胞”指减少或抑制b细胞或其它t细胞对抗原的免疫应答的t细胞。
术语“cxcl12”或“sdf-1多肽”指本领域众所周知的细胞因子(参见例如,表1)。在一个实施方案中,该术语指结合cxcl12特异性抗体且具有趋化性或趋除性活性的蛋白质或其片段。通过测定t细胞迁移的方向(例如,朝向或远离目标剂),来确定趋化性或趋除性活性。参见例如,poznansky等人,naturemedicine2000,6:543-8;n.papeta等人,“long-termsurvivaloftransplantedallogeneiccellsengineeredtoexpressatcellchemorepellent,”transplantation2007,83(2),174-183。“趋除性”或“趋除迁移”是迁移细胞远离试剂来源的移动(即,朝向较低浓度的试剂)。应理解,术语“cxcl12”指其所有已知的同种型,包括α、β、γ、δ、ε、φ和θ同种型。优选的cxcl12同种型是α和β。已知cxcl12诱导血管生成。
术语“1型糖尿病”和“2型糖尿病”指与血糖升高有关的两种主要病理生理学。1型糖尿病的特征在于针对胰腺胰岛素产生β细胞的自身免疫攻击,而2型糖尿病与弱β细胞功能和外周胰岛素抵抗增加相关。与1型相似,在2型糖尿病中也观察到β细胞死亡。1型以及经常2型糖尿病需要个人注射胰岛素。1型糖尿病通常特征在于胰腺中胰岛的产生胰岛素的β细胞的丧失,导致胰岛素缺乏。这种类型的糖尿病可以进一步分类为免疫介导的或特发性的。大多数1型糖尿病具有免疫介导的性质,其中β细胞丧失是由于t细胞介导的自身免疫攻击。2型糖尿病的特征在于与胰岛素抵抗组合的β细胞功能异常。据信机体组织对胰岛素的缺陷响应性涉及胰岛素受体和下游细胞信号传导。与1型糖尿病相似,β细胞群不足也是许多2型糖尿病患者中的致病因素。在2型糖尿病的早期阶段,可以通过各种措施和药剂来逆转高血糖症,所述措施和药剂改善胰岛素分泌并且减少肝的葡萄糖产生。随着疾病进展,发生胰岛素分泌受损,并且胰岛素的治疗性替换在某些患者中有时可能变得必要。
“受试者”或“患者”指哺乳动物,优选人受试者。
“有此需要的受试者”或“有此需要的患者”是患有1型或2型糖尿病的受试者。
如本文使用的,术语“治疗(treat)”、“治疗(treating)”、“治疗(treatment)”等等指减少或改善病症和/或与其相关的症状。应了解,尽管不排除,但治疗病症或状况并不要求完全消除病症、状况或与其相关的症状。
在本公开内容中,“包含(comprises)”、“包含(comprising)”、“含有”和“具有”等等可以具有美国专利法中归于其的含义,并且可以意指“包括(includes)”、“包括(including)”等等;“基本上由……组成(consistingessentiallyof)”或“基本上由……组成(consistsessentially)”同样地具有美国专利法中归于其的含义,并且该术语是开放式的,允许多于所陈述的内容的存在,只要所陈述的内容的基本或新型特征不被多于所陈述的内容的存在改变,但排除现有技术实施方案。
当在数字名称例如温度、时间、量、浓度以及此类其它(包括范围)之前使用时,术语“约”指示近似值,其可以相差(+)或(-)10%、5%、1%或其间的任何子范围或子值。在本公开内容自始至终,其它定义在上下文中出现。
本发明的一个方面是转基因β细胞,例如人自体β细胞或非自体β细胞,例如同种异体β细胞,其包含与启动子可操作连接的编码趋除剂(例如cxcl12、cxcl13)的核酸,使得趋除剂(例如cxcl12、cxcl13)在β细胞微环境中以趋除水平表达。启动子可以是对β细胞内源的启动子,或对β细胞异源但在β细胞中有功能的启动子。优选地,编码趋除剂(例如cxcl12、cxcl13)的核酸对用转基因β细胞治疗的受试者是内源的。在一个实施方案中,同种异体β细胞衍生自非t1d供体。
本发明的一个方面是人β细胞,其包含编码趋除剂(例如cxcl12、cxcl13)的遗传修饰的内源性人基因,其中所述基因进行修饰,以包含与趋除剂编码序列可操作连接的异源启动子,使得趋除剂在β细胞微环境中以趋除水平由内源基因表达。可以使用本领域已知的基因组编辑技术,将启动子引入β细胞内,以与趋除剂编码序列可操作地连接。众所周知,cxcl12具有几种同种型,包括α、β、γ和θ。在一个优选的实施方案中,采用的同种型是cxcl12β。本文所述的转基因的人β细胞响应高血糖环境而产生胰岛素。术语“胰岛素”意欲覆盖胰岛素原和胰岛素两者。
一般而言,本发明提供了以足以阻断或抑制免疫细胞(例如人免疫细胞)迁移至β细胞或足以排斥免疫细胞的水平表达趋除剂(例如cxcl12、cxcl13)的β细胞,优选人β细胞。术语免疫细胞和单核细胞(t细胞、b细胞和nk细胞)可以互换使用。可以使用博伊登室测定,在体外评价趋除剂(例如cxcl12、cxcl13)多肽排斥免疫细胞(例如,效应性t细胞)的能力。参见例如,如先前在poznansky等人,journalofclinicalinvestigation,109,1101(2002)中描述的。可替代地,通过将此类细胞与人pbmc组合,来评价转基因的人β细胞的生存力。可以通过测量随着时间过去的一种或多种细胞死亡标记物来评估细胞死亡率。通常使用的一种此类标记物是在细胞坏死过程中释放的乳酸脱氢酶(ldh)。
不希望受任何理论的束缚,申请人预期在本发明的一个方面,由转基因β细胞产生的趋除剂(例如cxcl12、cxcl13)的量足以在β细胞微环境中提供趋除效应,但产生的量不足以提高试剂的全身水平,并且扰乱试剂在一种过程中的有益效应、而在另一种过程中产生有害后果之间的平衡。另外,已知cxcl12与其受体cxcr4结合时诱导血管生成。再次,不受任何理论的束缚,预期表达cxcl12的植入的转基因β细胞的微环境将诱导血管生成应答,其增强了植入细胞的存活性。
趋除剂(例如cxcl12、cxcl13)的趋除有效量是足以阻断免疫细胞杀死转基因β细胞的任何量。例如,转基因β细胞微环境中的趋除剂(例如cxcl12、cxcl13)的趋除有效量可以为至少约100ng/ml,并且优选为至少100nm。在一些实施方案中,转基因β细胞微环境中的趋除剂(例如cxcl12、cxcl13)的量为至少约1000ng/ml。例如,下述特定范围适合于本发明:约100nm至约200nm、约100nm至约300nm、约100nm至约400nm、约100nm至约500nm、约100nm至约600nm、约100nm至约700nm、约100nm至约800nm、约100nm至约900nm、或约100nm至约1µm。
在实施方案中,转基因β细胞微环境中的趋除剂(例如cxcl12、cxcl13)的趋除有效量范围为20ng/ml至约5μg/ml。在实施方案中,趋除有效量范围为20ng/ml至约1μg/ml。在实施方案中,β细胞微环境中的趋除剂(例如cxcl12、cxcl13)的量是趋除足够量,其范围为约100ng/ml至约500ng/ml、约500ng/ml至5µg/ml、约800ng/ml至约5µg/ml、或约1000ng/ml至约5000ng/ml。不希望受理论的束缚,预期当转基因和非转基因β细胞一起使用时,转基因β细胞可以表达足够量的趋除剂,使得产生趋除效应的微环境延伸至与非转基因β细胞相邻。转基因β细胞微环境中的趋除剂(例如cxcl12、cxcl13)的趋除有效量可以是所述范围内的任何值或子范围,包括端点。
尽管小鼠和小鼠dna由免疫学家广泛用于了解人免疫系统的工作,但人与小鼠之间存在显著差异。相应地,由载体编码的趋除剂(例如cxcl12、cxcl13)优选是人试剂。javiermestas&christopherc.w.hughes,“ofmiceandnotmen:differencesbetweenmouseandhumanimmunology,”journalofimmunology2004,172(5),2731-2738;o.cabrera等人,“theuniquecytoarchitectureofhumanpancreaticisletshasimplicationsforisletcellfunction,”pnas2006,103(7),2334-2339;m.votey,“ofmiceandmen:howthenpodprogramischangingthewayresearchersstudytype1diabetes,”diatribe,networkforpancreaticorgandonorswithdiabetes(2015年8月21日)。
cxcl12多肽是本领域已知的。参见例如,poznansky等人,naturemedicine2000,6:543-8和美国专利公开号20170246250,这两者均整体引入本文作为参考。术语cxcl12和sdf-1可以互换使用。示例性的cxcl12/sdf1同种型在美国公开20170246250的表i中提供。表1(下文)中还提供了示例性cxcl12/sdf1同种型:
在一个实施方案中,cxcl12多肽与np001029058具有至少约85%、90%、92%、95%、96%、97%、98%、99%或100%的氨基酸序列同一性,并且具有趋化因子或趋除活性。在一个实施方案中,cxcl12多肽与seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:5或seqidno:6具有至少约85%、90%、92%、95%、96%、97%、98%、99%或100%的氨基酸序列同一性,并且具有趋化因子或趋除活性。此类序列同一性基于用已知的保守第二氨基酸替换第一氨基酸。此类保守替换是本领域充分建立的,并且所得到的修饰的cxcl12多肽关于其趋除特性的测试是本领域众所周知的。参见例如,poznansky上文。
cxcl13肽是本领域已知的。cxcl13也称为b淋巴细胞趋化因子(blc)或b细胞吸引趋化因子1(bca-1),并且这些术语可以互换使用。例如,人cxcl13可以在登录号q53x90处发现。在一个实施方案中,cxcl13多肽具有包含mkfistslllmllvsslspvqgvlevyytslrcrcvqessvfiprrfidriqilprgngcprkeiivwkknksivcvdpqaewiqrmmevlrkrssstlpvpvfkrkip(seqidno:7)的氨基酸序列。在一个实施方案中,cxcl13多肽与q53x90具有至少约85%、90%、92%、95%、96%、97%、98%、99%或100%的氨基酸序列同一性,并且具有趋化因子或趋除性活性。在一个实施方案中,cxcl13多肽与seqidno:7具有至少约85%、90%、92%、95%、96%、97%、98%、99%或100%的氨基酸序列同一性,并且具有趋化因子或趋除性活性。
用于本文所述的方法中的转基因β细胞可以是自体的或非自体的(例如同种异体的)β细胞。“自体”细胞是来自同一个体的细胞。“同种异体”细胞是来自遗传上相似但不相同的相同物种供体的细胞。可用于本发明的方法中的同种异体细胞优选来自人受试者。可用于本发明的方法中的同种异体细胞可以来自亲属,例如兄弟姐妹、堂/表兄弟姐妹、父母或孩子,或来自非亲属。用于选择同种异体供体的标准是本领域众所周知的,参见例如,tatum等人,diabetesmetabsyndrobes2017:1073-78。人同种异体β细胞是商购可得的,并且自体β细胞通过由egli等人,同上所述的方法产生。
在一个实施方案中,用于本发明的方法中的转基因的人β细胞是自体转基因β细胞,其可以通过本领域已知的方法,通过从得自患者的多潜能祖细胞或多能干细胞衍生β细胞来制备。这些衍生的β细胞可以包含表达载体(例如,用其转染、感染等),所述表达载体包含编码趋除剂(例如cxcl12、cxcl13)的核酸序列。
可替代地,可以通过从有此需要的受试者中分离胰岛β细胞,来制备用于本发明的方法中的转基因β细胞。这些分离的胰岛β细胞可以包含表达载体(例如,用其转染、感染等),所述表达载体包含编码趋除剂(例如cxcl12、cxcl13)的核酸序列。可替代地,β细胞可以进行遗传修饰,以表达内源性趋除剂(例如cxcl12、cxcl13)基因,使得它组成性地产生趋除有效量的趋除剂(例如cxcl12、cxcl13)。
在本发明的一个实施方案中,β细胞包含表达载体(例如,用其转染、感染等),所述表达载体包含编码趋除剂(例如cxcl12、cxcl13)的核酸分子,所述核酸分子与适合于在β细胞中表达的启动子可操作地连接。载体可以整合到β细胞的基因组内,或者它可以以附加体形式存在而不整合到基因组内。
本发明的转基因β细胞也可以通过以下由成体干细胞制备:从受试者中分离成体干细胞,在适当条件下培养该干细胞,以扩展群体并诱导分化成β细胞。可以通过将编码趋除量的趋除剂(例如cxcl12、cxcl13)的表达载体引入细胞内、或通过编辑基因组以表达趋除量的趋除剂(例如cxcl12、cxcl13),来修饰细胞以表达趋除有效量的趋除剂(例如cxcl12、cxcl13)。载体可以在分化成β细胞之前引入干细胞内,或者可以编辑干细胞的基因组,以含有异源启动子。可替代地,载体可以引入所得到的β细胞内,或者可以编辑所得到的β细胞的基因组,以含有异源启动子。
本发明的转基因β细胞还可以通过以下进行制备:从受试者的体细胞,例如β细胞、成纤维细胞或角质形成细胞生成诱导多能干(ips)细胞;处理ips细胞以诱导分化成β细胞;并且将表达载体引入分化的β细胞内,所述表达载体包含编码趋除剂(例如cxcl12、cxcl13)的核酸序列。
本发明的转基因β细胞还可以通过以下进行制备:制备从受试者的体细胞生成的诱导多能干(ips)细胞;将表达载体引入ips细胞内,所述表达载体包含编码趋除剂(例如cxcl12、cxcl13)的核酸序列;并且在转基因引入之前或之后处理ips细胞,以诱导分化成β细胞。
本发明的转基因β细胞还可以通过以下生成:获得祖细胞或祖细胞样细胞,例如胰腺β细胞祖细胞,将包含编码趋除剂(例如cxcl12、cxcl13)的核酸序列的载体引入细胞内,并且通过本领域已知的方法,在引入载体之前或之后处理细胞,以诱导分化成β细胞或响应体内的葡萄糖水平的胰岛素释放细胞,参见例如millman等人naturecommunications(2016年5月10日)第1-8页);baek等人currstemcellrep(2016)2:52-61;russ等人,embo.j.34,1759-1772(2015);以及qadir等人,cellreports22,2408-2420(2018年2月27日)。祖细胞和祖细胞样细胞对于用转基因细胞治疗的受试者可以是自体的或非自体的,例如同种异体的。响应体内的葡萄糖水平的胰岛素产生细胞(参见例如,qadir等人,同上),可以如本文所述进行遗传修饰,以表达趋除水平的趋除剂(例如cxcl12、cxcl13),并且也是本发明的一个实施方案。此类遗传修饰的胰岛素产生细胞可以同样地用于本发明的方法中,以如本文所述治疗糖尿病。
可以通过本领域已知的方法,将来自受试者的任何合适的体细胞重新编程为ips细胞,参见例如,pagliuca和melton(2013)howtomakeafunctionalβ-cell,development(3013)140(12);2472-2483;yu等人(2007).inducedpluripotentstemcelllinesderivedfromhumansomaticcells.science318,1917-1920;takahashi和yamanaka,2006,cell126(4):663-676;wernig等人,2007,nature448:7151;okita等人,2007nature448:7151;maherali等人,2007cellstemcell1:55-70;lowry等人,2008pnas105:2883-2888;park等人,2008nature451:141-146.;takahashi等人,2007cell131,861-872;美国专利号8,546,140;美国专利号7,033,831;以及美国专利号8,268,620。可以使用本领域中已知的方法,将ips细胞分化成β细胞,参见例如美国专利公开号20170081641和美国专利公开号20130164787,以及millette和georgia,“geneeditingandhumanpluripotentstemcells:toolsforadvancingdiabetesdiseasemodelingandbetacelldevelopment”,currentdiabetesreportsnovember2017,17:116;美国专利申请号20130273651;shi,y.等人stemcells.,25:656-662(2005);或tateishi,k.等人,jbiolchem.,283:31601-31607(2008)。
优选地,趋除剂编码序列与适合于在β细胞中表达的调节区可操作地连接。合适的调节区是本领域已知的,并且包括启动子,例如哺乳动物启动子,包括例如次黄嘌呤磷酸核糖基转移酶(hptr)、腺苷脱氨酶、丙酮酸激酶、β-肌动蛋白启动子、肌肉肌酸激酶启动子和人延伸因子启动子(ef1α)、gapdh启动子、肌动蛋白启动子和遍在蛋白启动子以及病毒启动子,包括sv40早期启动子、sv40晚期启动子、金属硫蛋白启动子、鼠乳腺肿瘤病毒启动子、劳斯肉瘤病毒启动子、多角体蛋白启动子、人免疫缺陷病毒(hiv)启动子、巨细胞病毒(cmv)启动子、腺病毒启动子、腺相关病毒启动子或单纯疱疹病毒的胸苷激酶启动子。其它有关的启动子,例如病毒和真核启动子,也是本领域众所周知的(参见例如,sambrook和russell(molecularcloning:alaboratorymanual,coldspringharborlaboratorypress)。与趋除剂编码序列可操作地连接的调节区可以是适合于在受试者的细胞中表达的任何组成型启动子。
可以通过本领域已知的用于施用β细胞的任何手段,将本发明的表达趋除剂(例如cxcl12、cxcl13)的转基因细胞(无论是自体还是非自体的,例如同种异体的)施用于有此需要的受试者。本发明的转基因细胞可以以足以提供这样的胰岛素水平的量施用,所述胰岛素水平能够减轻与低水平胰岛素相关的至少一些症状。
本发明的另一个方面是治疗有此需要的受试者中的糖尿病的方法,其包括以下步骤:(a)从受试者获得或衍生β细胞或产生胰岛素的β样细胞;(b)将编码趋除剂(例如cxcl12、cxcl13)的合适表达载体引入细胞内,以形成表达所引入的趋除剂(例如cxcl12、cxcl13)的自体转基因细胞;并且(c)将自体转基因细胞移植到受试者内。
可用于将外源基因转移到哺乳动物细胞(例如β细胞)内的许多载体,包括整合到基因组内的载体、以及未整合到基因组内但作为附加体存在的载体,以及用于将此类载体引入细胞内的方法是本领域可获得且已知的。例如,可以使用逆转录病毒载体、慢病毒载体、腺病毒载体、基于腺相关病毒(aav)的载体和基于ebv的载体。参见例如,us20110280842,narayanavari和izsvák,cellgenetherapyinsights2017;3(2),131-158;hardee等人,genes2107,8,65;tipanee等人,biosciencereports(2017)37,以及chira等人oncotarget,vo.6,no.31,第30675-30703页。
本发明的另一个方面是用于在包含免疫细胞的生物样品中促进β细胞存活的方法,其包括将编码趋化剂(例如cxcl12、cxcl13)的表达载体引入β细胞内,或通过编辑β细胞的基因组,使得β细胞表达趋除量的趋除剂(例如cxcl12、cxcl13)。在本发明的一个方面,趋除剂(例如cxcl12、cxcl13)由β细胞表达,其水平足以阻断或抑制免疫细胞(例如t细胞、b细胞和/或nk细胞)向β细胞的迁移。在本发明的一个方面,趋除剂(例如cxcl12、cxcl13)由β细胞表达,其水平足以从β细胞排斥免疫细胞。在本发明的一个方面,遗传修饰的β细胞是在受试者,例如患有1型或2型糖尿病的人受试者中。在一个实施方案中,β细胞是受试者的自体β细胞。
用于将病毒载体和非病毒载体递送至哺乳动物细胞的方法是本领域众所周知的,并且包括例如脂质转染、显微注射、弹道、病毒体、脂质体、免疫脂质体、聚阳离子或脂质-核酸缀合物、裸露dna、人工病毒粒子和试剂增强的dna摄取。脂质转染试剂是商业销售的(例如transfectamtm和lipofectintm)。适合于多核苷酸的有效受体识别脂质转染的阳离子脂质和中性脂质是已知的。核酸可以递送至细胞(离体施用)或靶组织(体内施用)。脂质:核酸复合物,包括靶向脂质体,例如免疫脂质复合物的制备,是本领域技术人员众所周知的。重组介导的系统可以用于将载体引入细胞内。此类重组方法包括例如位点特异性重组酶如cre、flp或phic31的使用(参见例如oumard等人,cytotechnology(2006)50:93-108),其可以介导转基因的定向插入。
适用于本发明中的载体包括表达载体,所述表达载体包含与指导转录的启动子可操作地连接的编码趋除剂(例如cxcl12、cxcl13)的核酸。合适的启动子是本领域众所周知的,并且例如在sambrook和russell(molecularcloning:alaboratorymanual,coldspringharborlaboratorypress)中描述。用于指导趋除剂(例如cxcl12、cxcl13)的表达的启动子可以是例如sv40早期启动子、sv40晚期启动子、金属硫蛋白启动子、鼠乳腺肿瘤病毒启动子、劳斯肉瘤病毒启动子或在哺乳动物细胞中显示为对于表达有效的其它启动子。
可用于本发明的方法中的载体包括例如sv40载体、乳头状瘤病毒载体、eb病毒载体、逆转录病毒载体和慢病毒载体。
在本发明中使用的载体可以包含来自真核病毒,例如sv40、乳头状瘤病毒和eb病毒的调节元件,包括例如用于转录物的有效多聚腺苷酸化、转录终止、核糖体结合和/或翻译终止的信号。载体的另外元件可以包括例如增强子和异源剪接的内含子信号。
在本发明的一个实施方案中,β细胞的基因组可以进行遗传修饰,以增加内源性趋除剂(例如cxcl12、cxcl13)基因的表达水平。此类增加的表达可以通过以下实现:引入与内源性趋除剂(例如cxcl12、cxcl13)基因可操作连接的异源启动子,或改变内源性趋除剂(例如cxcl12、cxcl13)启动子,使得β细胞表达趋除水平的趋除剂(例如cxcl12、cxcl13)。此类增加的表达可以通过以下实现:将启动子引入β细胞的基因组内,使得它与内源性趋除剂编码序列可操作地连接,并且从而表达或过表达趋除量的趋除剂。
用于修饰基因组的基因编辑技术是本领域众所周知的,并且包括例如crispr/cas9、piggybac、sleepingbeauty基因组编辑系统(参见例如,zhang等人moleculartherapynucleicacids,第9卷,2017年12月,第230-241页;系统(参见例如,cong等人,science.2013;339(6121):819–23;mali等人,science.2013;339(6121):823–6;gonzález等人,cellstemcell.2014;15(2):215–26);he等人,nucleicacidsres.2016;44(9);hsu等人,cell.2014;157(6):1262–78.)、基于锌指核酸酶的系统(参见例如,porteus和carroll,natbiotechnol.2005;23(8):967–73;urnov等人,natrevgenet.2010;11(9):636–46)、基于talen的系统(转录激活因子样效应物核酸酶)(参见例如,cermak等人,nucleicacidsres.2011;39(12);hockemeyer等人,natbiotechnol.2011;29(8):731–4;joung和sanderjd,natrevmolcellbiol.2013;14(1):49–55;miller等人,natbiotechnol.2011;29(2):143–8,以及reyon等人,natbiotechnol.2012;30(5):460–5)。
在一个实施方案中,本文所述的转基因β细胞用试剂进行处理,所述试剂致使细胞存活并且能够控制患者中的血糖,但不能复制(即,诱导的细胞衰老)。一种此类试剂是丝裂霉素c,其是已知的dna交联剂。在处理后,这些细胞中的dna交联,从而使得不可能形成复制所必需的单链dna。此类处理防止细胞,尤其是从干细胞生成的细胞分裂,使得如果该细胞变形成癌细胞,则它不能分裂。能够诱导细胞衰老的其它已知试剂包括由petrova等人,“smallmoleculecompoundsthatinducecellularsenescence”agingcell,15(6):999-1017(2016)所述的那些,所述参考文献整体引入本文。仅作为例子,此类试剂包括这样的试剂,由于复制相关的端粒缩短、亚毒性应激(例如暴露于uv、γ辐射、过氧化氢和低氧),所述试剂引起端粒功能障碍。本发明的β细胞通过其致使非复制的具体手段并不是关键的,条件是这些细胞可以被植入而没有细胞分裂的危险。研究显示成年人胰腺具有极少的β细胞更新(turnover),其提示限制细胞分裂的能力对植入的细胞的胰岛素产生具有很少的作用至没有作用。参见例如,perl等人,thejournalofclinicalendocrinology&metabolism,第95卷,第10期,2010年10月1日,第e234-e239页。
本发明的另一个方面是调节受试者中的胰岛素水平的方法,其包括向有此需要的受试者施用本发明的β细胞,其中所述β细胞表达胰岛素并产生趋除量的趋除剂(例如cxcl12、cxcl13)。β细胞可以是自体β细胞或非自体β细胞,例如同种异体β细胞,并且可能具有表达趋除剂的载体,所述载体可以整合到β细胞基因组内或以附加体形式存在。在本发明的一个实施方案中,转基因β细胞可以进行遗传修饰,以过表达趋除水平的内源性趋除剂(例如cxcl12、cxcl13)。
将本文所述的转基因β细胞引入个体内的方法是本领域技术人员众所周知的,并且包括但不限于注射、静脉内、门静脉内或肠胃外施用。可以进行单次、多次、连续或间歇施用。参见例如,schuetz和markmann,currtransplantrep.2016sep;3(3):254–263。
药学上可接受的载体包括无菌水溶液或分散体,以及用于临时制备无菌注射溶液或分散体的无菌粉末。用于药物活性物质(包括细胞)的培养基和试剂的使用是本领域众所周知的。用于静脉内输注β细胞的典型药物组合物可以制备为含有250ml无菌林格氏溶液和100mg组合。用于制备可肠胃外施用的化合物的实际方法对于本领域技术人员是已知的或显而易见的,并且在例如remington’spharmaceuticalscience,第17版,mackpublishingcompany,easton,pa.(1985),以及其第18版和第19版中更详细地描述,所述参考文献引入本文作为参考。
本发明的转基因和遗传修饰的β细胞可以引入本领域众所周知的几个不同部位的任一个内,所述部位包括但不限于受试者的胰腺、腹腔、肾、肝、门静脉或脾。
另外,为了避免转基因β细胞向癌细胞的任何可能转化(其可能导致患者发展肿瘤的可能性),转基因β细胞可以通过以下致使衰老:与已知的试剂如丝裂霉素c接触,或者暴露于来自电离辐射、低氧、过氧化氢等的亚毒性应激。衍生自多能干细胞的细胞通常在不适当的细胞分裂过程中或由于免疫细胞清除而经历细胞凋亡。本文所述的衰老的转基因β细胞不能分裂,从而消除了在细胞分裂过程中出现的细胞凋亡触发。另外,本文所述的衰老的转基因β细胞是免疫细胞抵抗的,从而提供了针对由于免疫细胞清除的细胞凋亡诱导的保护。相应地,预期与非衰老的转基因β细胞相比,本文所述的转基因β细胞具有更长的寿命至明显更长的寿命。
可以经由移植物将转基因的且优选衰老的修饰的β细胞移植到受试者内。理想的β细胞移植部位会是这样的部位,其支持移植细胞在受试者中的植入、长期功能和存活,并且对于最大限度的患者安全性而言可容易地接近的。用于植入的部位包括肝、肠、皮下和胰腺部位。
本文使用的下述缩写具有下述含义,并且如果缩写未进行定义,则它们具有其一般公认的科学含义。氨基酸在本文中使用其建立的单字母缩写来叙述。
flag=dykddddk蛋白质标签(seqidno:10)
g/l=克/升
hrp=辣根过氧化物酶
ldh=乳酸脱氢酶
iblot=半干蛋白转移装置(invitrogen)
mes=2-(n-吗啉代)乙磺酸
ml=毫升
n/a=不适用
nm=纳摩尔浓度
pbmc=外周血单核细胞
pbs=磷酸盐缓冲盐水
tmb=3,3',5,5'-四甲基联苯胺
μl=微升
μg=微克
xg=重力倍数。
实施例
实施例1:用于评价cxcl12-a和–b同种型的表达水平的模型细胞
使用对于每种同种型商购可得的质粒(可从genscript获得的质粒),用2种不同的cxcl12同种型(α和β)转染hek293细胞。用250ug/ml的g418(从thermofisher商购可得)选择转染的细胞,并且对于每种同种型制备稳定的库。允许细胞在合适的培养基中适应条件3天。用测定稀释缓冲液1:1稀释来自表达cxcl12α和cxcl12β的转染hek293细胞的条件培养基。对于每种同种型建立两个分开的库,且然后使用标准化浓度曲线,通过吸收获得溶液中的每种同种型的浓度。将这个实验重复两次,并且结果如下:
上文结果证明,与表达cxcl12α的转基因模型细胞相比,转基因模型细胞以显著更高的水平表达cxcl12β。
实施例2-用于评价cxcl12的其它同种型的表达水平的模型细胞
使用对于每种同种型商购可得的质粒(可从genscript获得的质粒),用5种不同的cxcl12同种型(α和β)转染hek293细胞。用250ug/ml的g418(从thermofisher商购可得)选择转染的细胞,并且对于每种同种型制备稳定的库。允许细胞在合适的培养基中适应条件3天。条件培养基用mes缓冲液在4-8%nupage凝胶(从thermofisher商购可得)中分开,并且转移至硝酸纤维素(iblot)。
如图1中所示,在蛋白质印迹上,用hrp标记的抗flag标签抗体/tmb色原(可从genscript获得)检测表达水平。结果证明cxcl12的γ、δ和θ同种型具有比α或β同种型更高的浓度。
实施例3:转基因β细胞的制备
衍生自人诱导多能干细胞的胰腺β细胞购自takarabiousa,inc.(mountainview,ca),并且根据所提供的说明书进行培养。
用含有人cxcl12同种型(cxcl12a/sdf-1α或cxcl12b/sdf-1β)或对照的慢病毒载体(plenti-c-myc-ddk,origenetechnologies,rockville,md)转导细胞。慢病毒载体以每个β细胞约10:1的比率使用。下文提供了包括标签(加下划线)的序列。通过elisa(raybiotech,norcross,ga)测定cxcl12同种型的浓度(表1)。
cxcl12a(又名sdf1a)
登录号nm_199168
cxcl12b(又名sdf1b)
登录号nm_000609
实施例4:转基因β细胞排斥pbmc
使来自实施例3的转基因β细胞与人外周血单核细胞(pbmc,innovativeresearch,novi,mi)以30∶1(pbmc∶β细胞)的比率接触。简言之,将pbmc重悬浮于β完全培养基中,计数并且伴随100ulpbmc的添加进行调整,以允许30:1的pbmc:β细胞比率(以使表达的cxcl12的稀释降到最低)。最终体积为1.1ml。还制备了无pbmc的β细胞和无β细胞的pbmc的背景对照。立即从每个样品中取出150ul培养基,并且以1200xg离心10分钟。取出上清液并贮存于4℃(时间0)。将细胞送回培养箱,并且在24小时和48小时后以与时间0样品类似的方式取样。
根据制造商的说明书,使用pierceldhcytotoxicityassaykit(thermoscientific),在接触后24和48小时测试ldh的释放。增加的ldh是细胞毒性(细胞裂解)的指标。
表1和图2a中提供了来自代表性实验的数据(扣除背景)。来自第二代表性实验的数据在图2b中提供。
表1.ldh和cxcl12水平
这些数据指示β胰岛细胞的cxcl12表达保护β胰岛细胞免于免疫细胞的攻击,从而致使其有抗性。表达sdf1b/cxcl12b(其在这个实验中以高于sdf1a/cxcl12a的水平表达)的β细胞,显示在pbmc的存在下基本上没有细胞毒性。
实施例5:转基因β细胞的替代制备
从患有1型糖尿病的受试者分离的β细胞在体外用编码cxcl12的逆转录病毒表达载体、或不编码cxcl12的对照逆转录病毒载体进行转染或感染。如先前在poznansky等人,journalofclinicalinvestigation,109,1101(2002)中所述,使用博伊登室测定,就趋除量的cxcl12的表达测定具有编码cxcl12的逆转录病毒载体的转基因β细胞。预期表达至少100nmcxcl12的转基因β细胞在这个测定中将排斥免疫细胞。
实施例6:转基因β细胞的被迫衰老对转基因细胞因子表达的作用
如实施例3中所述制备β细胞。在丝裂霉素c(可得自santacruzbiotechnology)处理之前,通过elisa测定sdf1a/cxcl12a和sdf1b/cxcl12b的表达水平,以确定基线表达(“之前”)。将培养基更换为含有10ug/ml丝裂霉素c(已知诱导衰老的试剂)的新鲜培养基。将细胞送回培养箱2小时。通过轻轻吸液去除含有丝裂霉素c的培养基。将细胞用pbs洗涤两次。在第二次洗涤后,向细胞饲喂新鲜的完全培养基。通过elisa测定来确定sdf1a/cxcl12a或sdf1b/cxcl12b的表达。
来自两个代表性实验的数据显示于表2和图3a中。sdf1a/cxcl12a和sdf1b/cxcl12b的表达不受转基因β细胞的被迫衰老的影响。
表2:丝裂霉素c处理之前和之后的cxcl12a和–b水平
实施例7:转基因β细胞的被迫衰老对pbmc攻击的作用
如实施例3中所述制备β细胞。如实施例4中所述,用丝裂霉素c或对照处理细胞。如实施例2中所述,使细胞与pbmc接触。
来自两个代表性实验的数据显示于图4a和4b中。ldh水平不受转基因β细胞的被迫衰老影响。
实施例8:转基因β细胞的被迫衰老对胰岛素产生的作用
如实施例3中所述制备β细胞。如实施例4中所述,用丝裂霉素c或对照处理细胞。
将完全生长培养基更换为1ml培养基2,并且在培养基2上维持2天,伴随每24小时的培养基更换。在第3天时,用高血糖培养基(4.5g/l葡萄糖)攻击β细胞。在高血糖攻击之后24小时获取条件培养基的样品,并且通过夹心elisa测量胰岛素表达。
来自两个代表性实验的数据显示于表3和图5中。结果证明转基因β细胞和转基因的衰老的β细胞响应高血糖攻击而产生与对照β细胞基本上相等量的胰岛素。
表3:响应高血糖攻击的胰岛素表达
实施例9:转基因β细胞的体内评估
向具有人源化免疫系统的人源化小鼠(参见例如n.walsh,“humanizedmousemodelsofclinicaldisease,”annurevpathol2017,12,187-215;e.yoshihara等人)施用表达趋除量的cxcl12的转基因的人β细胞或对照转基因的人β细胞,并且在初始施用后的各个时间点测定小鼠中胰岛素的产生和转基因β细胞的存活。预期与对照转基因的人β细胞相比,表达趋除量的cxcl12的转基因的人β细胞将存活更长的时期。还预期与接受对照转基因的人β细胞的小鼠相比,接受表达趋除量的cxcl12的转基因β细胞的小鼠还将具有更高量的人胰岛素,并且与施用对照转基因的人β细胞的小鼠中的水平相比,较高水平的人胰岛素将持续更长的时期。
向具有人源化免疫系统的人源化小鼠(参见例如n.walsh,“humanizedmousemodelsofclinicaldisease,”annurevpathol2017,12,187-215;e.yoshihara等人)施用过表达来自内源性cxcl12基因的cxcl12的遗传修饰的人β细胞或对照人β细胞,并且在初始施用后的各个时间点测定小鼠中人胰岛素的产生和β细胞的存活。预期与未遗传修饰为过表达cxcl12的对照人β细胞相比,过表达cxcl12的遗传修饰的人β细胞将存活更长的时期。还预期与接受对照人β细胞的小鼠相比,接受过表达cxcl12的遗传修饰的人β细胞的小鼠也将具有更高量的人胰岛素,并且与施用对照人β细胞的小鼠中的水平相比,较高水平的人胰岛素将持续更长的时期。
任选地,用使细胞内的dna交联以预防细胞分裂的试剂(例如,丝裂霉素c)处理细胞。
前述说明书仅仅阐述以说明本发明,并不意欲为限制性的。由于本领域技术人员可以想到并入本发明的精神和实质的所述实施方案的修改,因此本发明应该被广义地解释为包括在权利要求及其等价物的范围内的所有变化。
- 还没有人留言评论。精彩留言会获得点赞!