一种双交联壳聚糖水凝胶及其制备方法和应用与流程
本发明涉及生物材料领域,具体而言,涉及一种双交联壳聚糖水凝胶及其制备方法和应用。
背景技术:
高分子水凝胶材料是一种能够迅速吸收并保持水分,同时又不会溶于水的低交联度材料,其具有高分子电解质特性以及三维网络结构,是一种集吸水、保水、缓释等功能于一体的功能高分子材料。
壳聚糖是由甲壳素脱乙酰基所得到的一种具有广泛应用价值的天然生物多糖材料,其具有无毒,生物相容性好,生物可降解,黏膜黏附性和抗菌性等优异的生物特性,是制备水凝胶的理想材料。
如何将壳聚糖分子间进行有效的交联以得到对应的壳聚糖水凝胶材料,则是目前研究的热点所在,也有很多研究人员在相同或者相关领域做出了一些探索。例如,现有技术中就公开了一种采用物理交联和化学交联结合的方法以制备类似的几丁质水凝胶的方法,该方法中,首先以环氧氯丙烷作为交联剂,进行化学交联,然后将产物置于乙醇中进行第二步交联,得到一种高强度且强度可调的几丁质水凝胶。如上现有技术采用的制备方法虽然能够实现几丁质分子间的交联,然而,该方法中所用交联剂环氧氯丙烷有较大毒性,且交联反应发生后残留的交联剂嵌入在胶体中难以清除掉。同时,该方法中第一步的化学交联反应时间较长,无法实现快速成型。而且,该方法所制得的胶体最大压缩模量仅高达260kpa,最大断裂强度达3.98mpa,难以满足作为高强度水凝胶应用的性能要求。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一目的在于提供一种双交联壳聚糖水凝胶的制备方法,本发明中,利用带有不同官能基团的壳聚糖反应交联,不仅反应交联速度较快,而且能够避免化学交联剂的使用,同时所得到的双交联壳聚糖具有良好的力学性能。
本发明的第二目的在于提供一种由本发明制备方法所得到的双交联壳聚糖水凝胶。
本发明的第三目的在于提供一种本发明双交联壳聚糖的应用。
为了实现本发明的上述目的,特采用以下技术方案:
一种高韧性、高强度以及可快速成型的双交联壳聚糖水凝胶的制备方法,所述制备方法包括:将α-β不饱和酰基化壳聚糖与巯基化壳聚糖反应所得水凝胶在乙醇溶液中浸泡处理,得到双交联壳聚糖水凝胶。
同时,本发明还提供了由本发明方法所得到的双交联壳聚糖水凝胶。
进一步的,本发明也提供了本发明双交联壳聚糖水凝胶在生物材料中的应用;以及/或者,包含本发明双交联壳聚糖水凝胶的生物材料。
与现有技术相比,本发明的有益效果为:
本发明中,利用带有不同官能基团的壳聚糖反应进行化学交联,同时通过乙醇处理以进行物理交联,从而得到了一种既包含化学交联、又包含物理交联结构的双交联壳聚糖水凝胶,不仅制备方法简便、快捷,而且制备反应速度较快,同时无需使用毒性较强的化学交联剂,制备过程绿色、环保、安全。
同时,由本发明方法所得到的双交联壳聚糖水凝胶的固化速度快,力学强度高、生物相容性好、在培养基中的稳定性好,应用范围大。与目前常见的紫外光固化壳聚糖水凝胶、ph响应壳聚糖水凝胶、温敏型壳聚糖水凝胶、以及离子响应壳聚糖水凝胶等相比,本发明双交联壳聚糖水凝胶既提高了固化速度,也改善了壳聚糖水凝胶的机械强度和弹性。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,以下将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
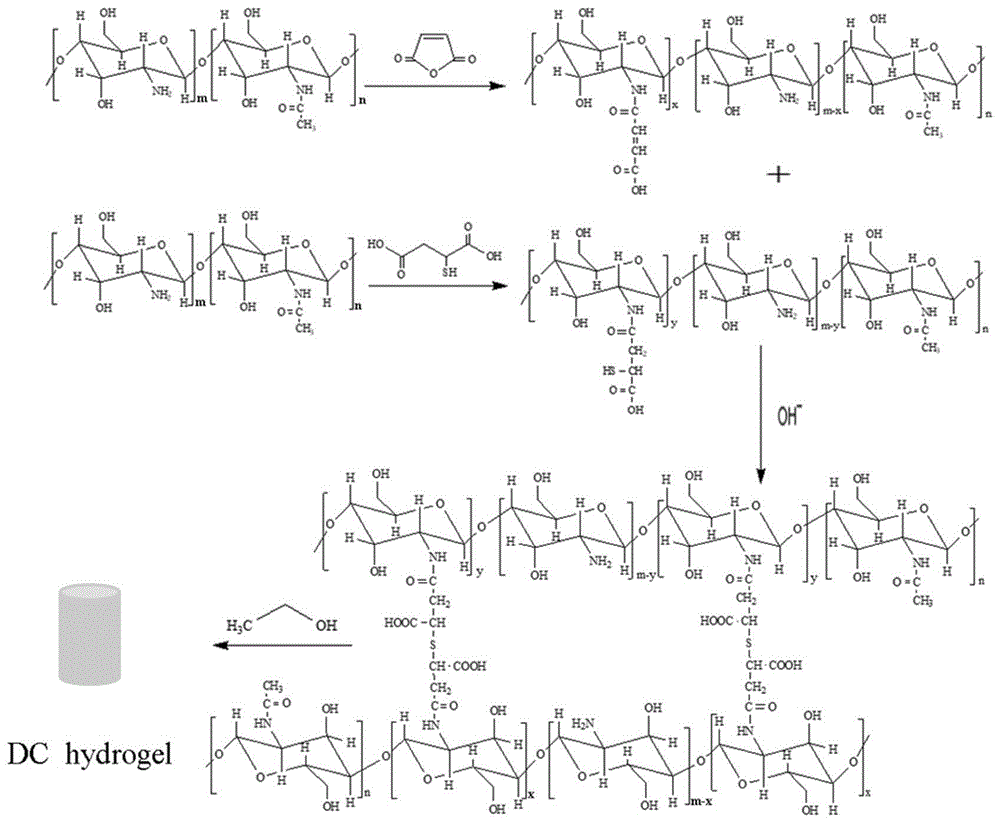
图1为本发明实施例1中双交联壳聚糖制备的反应式;
图2为本发明实施例1中双交联壳聚糖制备的反应流程图;
图3为不同水凝胶材料的力学性能测试图;
图4为不同水凝胶材料的力学性能测试图;
图5为实验例2中双交联壳聚糖生物纤维的扫描电镜图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本发明所提供的双交联壳聚糖水凝胶,是在前期壳聚糖水凝胶研究(具体可参见cn201810291744.1)的基础上,进一步采用乙醇处理的方法,所得到的具有化学交联和物理交联微观结构的双交联壳聚糖水凝胶材料,相较于现有技术中的双交联几丁质水凝胶而言,不仅制备反应更为快捷,而且无需使用具有较高毒性的交联剂,而且所得到的水凝胶材料力学性能更为优异。
本发明一方面提供了一种双交联壳聚糖水凝胶的制备方法,本发明所提供的制备方法主要包括:
将α-β不饱和酰基化壳聚糖与巯基化壳聚糖反应所得水凝胶在乙醇溶液中浸泡处理,得到双交联壳聚糖水凝胶。
如上的制备方法中,采用化学交联和物理交联方法制备双交联壳聚糖水凝胶。不同于现有技术中所采用的以环氧氯丙烷为交联剂的制备方法,本发明中第一步交联是采用巯基点击加成的方式进行,加成反应前利用马来酸酐和巯基丁二酸分别对壳聚糖进行化学改性,利用改性后的壳聚糖衍生自身互为交联剂,在催化剂的催化下发生加成反应,以实现化学交联。巯基的点击加成反应立体选择性高,反应速度快,可以实现快速成型,便于各种三维结构的制备;第二步交联采用乙醇处理,可以提高水凝胶分子侧链的分子间氢键作用力以及分子主链的疏水作用力,从而大大提高壳聚糖水凝胶的力学强度,通过改变乙醇的浓度(可以以浓度:0%<vol%≤100%的乙醇作为处理试剂)以及壳聚糖衍生物的接枝率,可以有效调节胶体力学强度。进一步的,由本发明方法所得到的壳聚糖水凝胶力学强度最大断裂强度可达10.8mpa,最大弹性模量可达1.32mpa。
在本发明优选的一些实施方式中,化学交联所得水凝胶在乙醇溶液中的浸泡处理的时间(t)为0<t≤48h(例如可以为,但不限于14,16,20,24,30,32,36或者42h等);
作为优选,所述浸泡处理的时间为24h。
在本发明优选的一些实施方式中,α-β不饱和酰基化壳聚糖与巯基化壳聚糖反应包括:
在溶液条件下,将α-β不饱和酰基化壳聚糖与巯基化壳聚糖混合反应,然后与碱溶液反应,得到水凝胶;
作为优选,此步骤中,是将α-β不饱和酰基化壳聚糖溶于酸溶液(优选为有机酸溶液,更优选为乙酸溶液,特别是0.1-30%(m/m)的乙酸溶液)中;
作为优选,此步骤中,是将巯基化壳聚糖溶于酸溶液(优选为有机酸溶液,更优选为乙酸溶液,特别是0.1-30%(m/m)的乙酸溶液)中;
作为优选,此步骤中,还包括对巯基化壳聚糖进行还原处理的步骤;
优选的,所述还原处理包括:向巯基化壳聚糖溶液中加入还原剂,进行还原处理;
更优选的,所述还原剂包括:锌(金属锌),二硫苏糖醇,以及对苯二酚中的至少一种;
更优选的,所述还原处理的时间为5-50min(例如可以为,但不限于10、15、20、25、30、35、40,或者45min等);
作为优选,此步骤中,是将α-β不饱和酰基化壳聚糖与巯基化壳聚糖混合反应后,所得产物挤出至碱溶液中反应成型,得到化学交联的水凝胶;
优选的,所述用以成型的碱溶液可以为:例如氢氧化钠、氢氧化钾,或者氢氧化钙溶液等强碱性溶液;或者为:氨水、碳酸钠、碳酸氢钠溶液等弱碱性溶液;
更优选的,所述碱溶液为氢氧化钠溶液(优选浓度为0.01-10m,例如,但不限于0.05,0.1,1,3,5,7,或者9m等)。
在本发明优选的一些实施方式,作为水凝胶制备原料的α-β不饱和酰基化壳聚糖包括如下式(i)化合物:
其中,式(i)中,r1为壳聚糖除去氨基的残基部分;
r2、r3、r4分别独立的为氢,取代或非取代烷基,取代或非取代的烷氧基,取代或非取代的芳基,以及取代或非取代的杂芳基;
作为优选,r2、r3、r4分别独立的为氢,碳原子数为1-20的取代或非取代烷基(优选为碳原子数为1-12的取代或非取代烷基,更优选为碳原子数为1-6的取代或非取代烷基,例如,但不限于:取代或非取代烷的甲基、乙基、丙基、异丙基、丁基、特丁基、戊基、异戊基、己基等),碳原子数为1-20的取代或非取代的烷氧基(优选为碳原子数为1-12的取代或非取代烷氧基,更优选为碳原子数为1-6的取代或非取代烷氧基,例如,但不限于:取代或非取代的甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、特丁氧基、戊氧基、异戊氧基、己氧基等),碳原子数为5-20的取代或非取代的芳基(优选为碳原子数5-12的取代或非取代芳基,例如,但不限于:取代或非取代的苯基、萘基、联苯基等),以及碳原子数为5-20的取代或非取代的杂芳基(优选为碳原子数5-12的取代或非取代杂芳基,例如,但不限于:取代或非取代的吡咯、吲哚、吡唑、吲唑、咪唑、苯丙吡唑、三唑、苯并三唑等);
作为优选,当r2、r3、r4中任意的r基为取代的烷基,取代的烷氧基,取代的芳基或者取代的杂芳基时,该取代的烷基,取代的烷氧基,取代的芳基或者取代的杂芳基中至少一个氢原子可以为烷基(优选碳原子数为1-20的烷基,更优选为碳原子数1-12的烷基,进一步优选为碳原子数1-6的烷基,例如,但不限于:甲基,乙基,丙基,异丙基,丁基,特丁基,戊基,异戊基,己基等),羧基,氨基,烷氧基(优选碳原子数为1-20的烷氧基,更优选为碳原子数为1-12的烷氧基,进一步优选为碳原子数为1-6的烷氧基,例如,但不限于:甲氧基,乙氧基,丙氧基,异丙氧基,丁氧基,特丁氧基,戊氧基,异戊氧基,己氧基等),芳基(优选碳原子数5-20的芳基,更优选为碳原子数5-12的芳基,例如,但不限于:苯基、萘基,联苯基等),杂芳基(优选碳原子数5-20的杂芳基,优选为碳原子数5-12的取代或非取代杂芳基,例如,但不限于:取代或非取代的吡咯,吲哚,吡唑,吲唑,咪唑,苯丙吡唑,三唑,苯并三唑等),酯基或者卤素(氟,氯,溴或碘)所取代;
其中,当取代基的数量大于1时,不同的取代基可以任选的为相同或者不同;
r5为羰基,羧基,酯基,酰胺基,取代或非取代烷基(优选为c1-c12取代或非取代烷基,更优选为c1-c6取代或非取代烷基),取代或非取代的烷氧基(优选为c1-c12取代或非取代氧烷基,更优选为c1-c6取代或非取代氧烷基),取代或非取代的芳基(优选为c5-c20取代或非取代芳基,更优选为c5-c12取代或非取代芳基),以及取代或非取代的杂芳基(优选为c1-c12取代或非取代杂芳基,更优选为c1-c6取代或非取代杂芳基);
作为优选,当r5为羰基时,所述羰基结构为:
作为优选,当r5为酯基时,所述酯基的结构为:
作为优选,当r5为酰胺基时,所述酰胺基的结构为:
在本发明更优选的一些实施方式中,所述α-β不饱和酰基化壳聚糖的合成方法包括:
将壳聚糖与酰基化试剂反应,得到α-β不饱和酰基化壳聚糖;
其中,所述酰基化试剂包括:α-β不饱和酸,α-β不饱和酸酐,α-β不饱和酰卤,以及α-β不饱和酯中的至少一种;
作为优选,所述壳聚糖的分子量0.1-1000万,例如,但不限于1,5,10,50,100,300,500,700或者900万等;
更优选的,所述壳聚糖的分子量为5万,脱乙酰度为80%,其结构可参考如下:
作为优选,所述α-β不饱和酸包括:β-甲基丙烯酸,以及β-异丙基丙烯酸中的至少一种;
所述α-β不饱和酸酐包括:马来酸酐;
所述α-β不饱和酰卤包括:丙烯酰氯,以及甲基丙烯酰氯中的至少一种;
所述α-β不饱和酯包括:甲基丙烯酸甲酯,以及甲基丙烯酸乙酯中的至少一种;
作为优选,所述合成方法还包括:将所得α-β不饱和酰基化壳聚糖进行纯化的步骤;
更优选的,所述纯化包括:透析,通过采用透析纯化,也能够将残余的修饰剂(酰化试剂)除去,从而避免修饰剂对于后续反应的影响。
在本发明特别优选的一些实施方式中,所述α-β不饱和酰基化壳聚糖的合成方法包括:
向溶于酸溶液中的壳聚糖中,加入酰化试剂(可以以溶液的形式加料),室温下搅拌混合后,在10-90℃(例如,但不限于20、30、40、50、60、70或者80℃等,优选为40-90℃)下反应2-10h(例如,但不限于3、4、5、6、7、8,或者9h等);
然后,将产物进行透析(优选透析2-4d),干燥(优选采用冷冻干燥),得到α-β不饱和酰基化壳聚糖;
作为优选,壳聚糖溶液的浓度为10~100mg/ml;
作为优选,用于溶解壳聚糖的酸溶液包括有机酸溶液,优选为乙酸溶液(特别是浓度0.01-30%的乙酸溶液);
作为优选,用于溶解酰化试剂的溶液包括:丙酮,丁酮,水,dmso和dmf等极性溶剂中的至少一种(特别是丙酮);
作为优选,壳聚糖与酰化试剂的摩尔比为1:1-1:3。
在本发明优选的一些实施方式,作为水凝胶制备原料的巯基化壳聚糖包括如下式(ii)所示化合物:
其中,式(ii)中,r1为壳聚糖除去氨基的残基部分;
r6为取代或非取代基的亚烷基,取代或非取代的亚芳基,以及取代或非取代的亚杂芳基;
作为优选,r6为碳原子数为1-20的取代或非取代烷基(优选为碳原子数为1-12的取代或非取代烷基,更优选为碳原子数为1-6的取代或非取代烷基,例如,但不限于:取代或非取代烷的甲基、乙基、丙基、异丙基、丁基、特丁基、戊基、异戊基、己基等),碳原子数为1-20的取代或非取代的烷氧基(优选为碳原子数为1-12的取代或非取代烷氧基,更优选为碳原子数为1-6的取代或非取代烷氧基,例如,但不限于:取代或非取代的甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、特丁氧基、戊氧基、异戊氧基、己氧基等),碳原子数为5-20的取代或非取代的芳基(优选为碳原子数5-12的取代或非取代芳基,例如,但不限于:取代或非取代的苯基、萘基、联苯基等),以及碳原子数为5-20的取代或非取代的杂芳基(优选为碳原子数5-12的取代或非取代杂芳基,例如,但不限于:取代或非取代的吡咯、吲哚、吡唑、吲唑、咪唑、苯丙吡唑、三唑、苯并三唑等);
作为优选,当r6为取代的烷基,取代的烷氧基,取代的芳基或者取代的杂芳基时,该取代的烷基,取代的烷氧基,取代的芳基或者取代的杂芳基中至少一个氢原子可以为烷基(优选碳原子数为1-20的烷基,更优选为碳原子数1-12的烷基,进一步优选为碳原子数1-6的烷基,例如,但不限于:甲基,乙基,丙基,异丙基,丁基,特丁基,戊基,异戊基,己基等),羧基,氨基,烷氧基(优选碳原子数为1-20的烷氧基,更优选为碳原子数为1-12的烷氧基,进一步优选为碳原子数为1-6的烷氧基,例如,但不限于:甲氧基,乙氧基,丙氧基,异丙氧基,丁氧基,特丁氧基,戊氧基,异戊氧基,己氧基等),芳基(优选碳原子数5-20的芳基,更优选为碳原子数5-12的芳基,例如,但不限于:苯基、萘基,联苯基等),杂芳基(优选碳原子数5-20的杂芳基,优选为碳原子数5-12的取代或非取代杂芳基,例如,但不限于:取代或非取代的吡咯,吲哚,吡唑,吲唑,咪唑,苯丙吡唑,三唑,苯并三唑等),酯基或者卤素(氟,氯,溴或碘)所取代;
其中,当取代基的数量大于1时,不同的取代基可以任选的为相同或者不同。
在本发明更优选的一些实施方式中,所述巯基化壳聚糖的合成方法包括:
将壳聚糖与巯基化试剂反应,得到巯基化壳聚糖;
作为优选,所述巯基化试剂包括:具有巯基和羧基的化合物;
更优选的,所述巯基化试剂包括:二巯基丁二酸、巯基丁二酸、巯基丙酸、硫代乙醇酸,以及2-巯基-3-吡啶甲酸中的至少一种;
作为优选,所述壳聚糖的分子量为0.1-1000万,例如,但不限于1,5,10,50,100,300,500,700或者900万等;
更优选的,所述壳聚糖的分子量为5万,脱乙酰度为80%;
优选的,所述合成方法还包括:将所得巯基化壳聚糖进行纯化的步骤;
更优选的,所述纯化包括:透析,同样的,通过采用透析的方式进行巯基化壳聚糖的纯化,也能够避免修饰剂(巯基化试剂)在产物巯基化壳聚糖中的残留;
作为优选,巯基化壳聚糖是在羧基活化剂存在的条件下进行反应;
更优选的,所述羧基活化剂包括:edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)以及nhc(n-羟基琥珀酰亚胺);
作为优选,所述巯基化试剂包括:同时具有羧基和巯基的化合物;
更优选的,所述巯基化试剂包括:二巯基丁二酸,巯基丁二酸,巯基丙酸,硫代乙醇酸,以及2-巯基-3-吡啶甲酸等中的至少一种;
作为优选,壳聚糖与巯基化试剂的摩尔比为1:1-10:1。
在本发明特别优选的一些实施方式中,所述巯基化壳聚糖的合成方法包括:
(a)将壳聚糖溶于酸溶液(优选为有机酸溶液,更优选为乙酸溶液,特别是浓度为0.01-30%的乙酸溶液)中;
作为优选,所得壳聚糖溶液的浓度为10~100mg/ml;
(b)将巯基化试剂(根据溶解性不同)溶于水(优选为双蒸水),碱溶液(例如氢氧化钠、氢氧化钾,或者氢氧化钙溶液等强碱性溶液,或者氨水、碳酸钠、碳酸氢钠溶液等弱碱性溶液,优选为氢氧化钠溶液)或者酸溶液(优选为有机酸溶液,更优选为乙酸溶液,特别是浓度为0.01~30%的乙酸溶液)中;
(c)将羧基活化剂加入巯基化试剂溶液中,混合均匀,并优选的在调节ph至4.5-6.5后,继续混合;
(d)将步骤(a)和步骤(c)溶液进行混合,然后优选的在50-60℃(例如,但不限于52、55、58℃等)条件下进行反应1-8h(例如,但不限于2、3、4、5、6,或者7h,优选为2-6h,更优选为4-5h)。
(e)步骤(d)反应液透析(优选透析2-4d),干燥(优选采用冷冻干燥),得到巯基化壳聚糖。
另一方面,本发明还提供了一种双交联壳聚糖水凝胶,所述双交联壳聚糖水凝胶由本发明如上制备方法得到。
本发明所制备的双交联壳聚糖水凝胶的微观化学结构,既存在化学键交联,同时也存在物理交联,因而使得本发明双交联壳聚糖水凝胶具有良好的力学性能,相较于现有技术中的几丁质水凝胶或者未经物理交联处理的水凝胶而言,在力学性能上都有显著的提高。
又一方面,本发明也提供了一种本发明双交联壳聚糖水凝胶在生物材料制备中的应用;
进一步的,本发明也能够提供一种包含本发明双交联壳聚糖水凝胶的生物材料;
如上所述的生物材料优选的包括生物纤维。
实施例1
1)将1.5g壳聚糖(分子量为50,000左右,脱酰度为80%左右)加入0.01%(m/m)的乙酸溶液中,搅拌均匀后超声30min;
将1.8g马来酸酐加入10ml丙酮中搅拌溶解,然后将所得溶液加入壳聚糖溶液中,搅拌混合均匀,在40℃条件下反应2h;
反应结束后,将反应液透析3d,期间每5h进行一次透析液替换,所得产物冷冻干燥,得到产品α-β不饱和酰基化壳聚糖(简记为mcs)。
步骤1)反应式可参考如下:
2)将1.5g巯基丁二酸加入双蒸水中搅拌溶解,然后加入1.2gedc以及300mgnhs,充分混合后,以1mnaoh调节溶液ph至6.5,继续搅拌混合;
将1.5g壳聚糖加入0.01%(m/m)的乙酸溶液搅拌溶解,然后将所得壳聚糖溶液加入含有巯基丁二酸的混合溶液中,55℃条件下反应5h;
将反应液透析3d,期间每5h进行一次透析液替换,所得产物冷冻干燥,得到产品巯基化壳聚糖(简记为cs-sh)。
步骤2)反应式可参考如下:
3)将60mgmcs加入1%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到10mg/l的mcs溶液;
将60mgcs-sh加入1%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到10mg/l的cs-sh溶液;
向所得cs-sh溶液中加入金属锌,震荡反应,然后过滤,得到还原处理后的cs-sh溶液;
将mcs溶液与还原处理后的cs-sh溶液混合反应,然后挤出至naoh溶液中反应,得到化学交联的水凝胶。
将所得化学交联的水凝胶加入无水乙醇中,浸泡24h,得到实施例1的双交联壳聚糖水凝胶。
实施例1反应式如图1所示,反应流程如图2所示。
实施例2
1)将1.5g壳聚糖(分子量为50,000左右,脱酰度为80%左右)加入0.01%(m/m)的乙酸溶液中,搅拌均匀后超声30min;
将1.8gβ-甲基丙烯酸加入5ml丙酮中搅拌溶解,然后将所得溶液加入壳聚糖溶液中,搅拌混合均匀,在40℃条件下反应2h;
反应结束后,将反应液透析3d,期间每5h进行一次透析液替换,所得产物冷冻干燥,得到产品α-β不饱和酰基化壳聚糖(简记为mcs)。
2)将1.5g巯基丁二酸加入双蒸水中搅拌溶解,然后加入1.2gedc以及300mgnhs,充分混合后,以1mnaoh调节溶液ph至6.5,继续搅拌混合;
将1.5g壳聚糖加入0.01%(m/m)的乙酸溶液搅拌溶解,然后将所得壳聚糖溶液加入含有巯基丁二酸的混合溶液中,55℃条件下反应5h;
将反应液透析3d,期间每5h进行一次透析液替换,所得产物冷冻干燥,得到产品巯基化壳聚糖(简记为cs-sh)。
3)将120mgmcs加入10%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到50mg/l的mcs溶液;
将120mgcs-sh加入10%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到50mg/l的cs-sh溶液;
向所得cs-sh溶液中加入金属锌,震荡反应,然后过滤,得到还原处理后的cs-sh溶液;
将mcs溶液与还原处理后的cs-sh溶液混合反应,然后挤出至naoh溶液中反应,得到化学交联的水凝胶。
将所得化学交联的水凝胶加入无水乙醇中,浸泡24h,得到实施例2的双交联壳聚糖水凝胶。
实施例3
1)将1.5g壳聚糖(分子量为50,000左右,脱酰度为80%左右)加入0.30%(m/m)的乙酸溶液中,搅拌均匀后超声35min;
将4.5g马来酸酐加入15ml丙酮中搅拌溶解,然后将所得溶液加入壳聚糖溶液中,搅拌混合均匀,在40℃条件下反应2h;
反应结束后,将反应液透析3d,期间每5h进行一次透析液替换,所得产物冷冻干燥,得到产品α-β不饱和酰基化壳聚糖(简记为mcs)。
2)将1.5g2-巯基烟酸加入双蒸水中搅拌溶解,然后加入1.2gedc以及300mgnhs,充分混合后,以1mnaoh调节溶液ph至5.5,继续搅拌混合;
将1.5g壳聚糖加入10%(m/m)的乙酸溶液搅拌溶解,然后将所得壳聚糖溶液加入含有2-巯基烟酸的混合溶液中,50℃条件下反应8h;
将反应液透析3d,期间每5h进行一次透析液替换,所得产物冷冻干燥,得到产品巯基化壳聚糖(简记为cs-sh)。
3)将60mgmcs加入10%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到10mg/l的mcs溶液;
将60mgcs-sh加入10%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到10mg/l的cs-sh溶液;
向所得cs-sh溶液中加入金属锌,震荡反应,然后过滤,得到还原处理后的cs-sh溶液;
将mcs溶液与还原处理后的cs-sh溶液混合反应,然后挤出至naoh溶液中反应,得到化学交联的水凝胶。
将所得化学交联的水凝胶加入无水乙醇中,浸泡24h,得到实施例3的双交联壳聚糖水凝胶。
实施例4
1)将1.5g壳聚糖(分子量为50,000左右,脱酰度为80%左右)加入30%(m/m)的乙酸溶液中,搅拌均匀后超声35min;
将4.5gβ-异丙基丙烯酸加入15ml丙酮中搅拌溶解,然后将所得溶液加入壳聚糖溶液中,搅拌混合均匀,在90℃条件下反应10h;
反应结束后,将反应液透析2d,期间每4h进行一次透析液替换,所得产物冷冻干燥,得到产品α-β不饱和酰基化壳聚糖(简记为mcs)。
2)将1.5g2-巯基烟酸加入双蒸水中搅拌溶解,然后加入1.2gedc以及300mgnhs,充分混合后,以1mnaoh调节溶液ph至5.5,继续搅拌混合;
将1.5g壳聚糖加入10%(m/m)的乙酸溶液搅拌溶解,然后将所得壳聚糖溶液加入含有2-巯基烟酸的混合溶液中,50℃条件下反应8h;
将反应液透析3d,期间每5h进行一次透析液替换,所得产物冷冻干燥,得到产品巯基化壳聚糖(简记为cs-sh)。
3)将120mgmcs加入10%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到50mg/l的mcs溶液;
将120mgcs-sh加入10%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到50mg/l的cs-sh溶液;
向所得cs-sh溶液中加入金属锌,震荡反应,然后过滤,得到还原处理后的cs-sh溶液;
将mcs溶液与还原处理后的cs-sh溶液混合反应,然后挤出至naoh溶液中反应,得到化学交联的水凝胶。
将所得化学交联的水凝胶加入无水乙醇中,浸泡24h,得到实施例4的双交联壳聚糖水凝胶。
实施例5
1)将1.5g壳聚糖(分子量为50,000左右,脱酰度为80%左右)加入30%(m/m)的乙酸溶液中,搅拌均匀后超声150min;
将5.4g马来酸酐加入20ml丙酮中搅拌溶解,然后将所得溶液加入壳聚糖溶液中,搅拌混合均匀,在90℃条件下反应10h;
反应结束后,将反应液透析3d,期间每5h进行一次透析液替换,所得产物冷冻干燥,得到产品α-β不饱和酰基化壳聚糖(简记为mcs)。
2)将1.5g3-巯基丙酸加入双蒸水中搅拌溶解,然后加入1.2gedc以及400mgnhs,充分混合后,以1mnaoh调节溶液ph至5,继续搅拌混合;
将1.5g壳聚糖加入0.1%(m/m)的乙酸溶液搅拌溶解,然后将所得壳聚糖溶液加入含有3-巯基丙酸的混合溶液中,60℃条件下反应3h;
将反应液透析3d,期间每5h进行一次透析液替换,所得产物冷冻干燥,得到产品巯基化壳聚糖(简记为cs-sh)。
3)将240mgmcs加入1%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到100mg/l的mcs溶液;
将60mgcs-sh加入10%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到10mg/l的cs-sh溶液;
向所得cs-sh溶液中加入二硫苏糖醇,震荡反应100min,然后过滤,得到还原处理后的cs-sh溶液;
将mcs溶液与还原处理后的cs-sh溶液混合反应,然后挤出至naoh溶液中反应,得到化学交联的水凝胶。
将所得化学交联的水凝胶加入无水乙醇中,浸泡24h,得到实施例5的双交联壳聚糖水凝胶。
实施例6
1)将1.5g壳聚糖(分子量为50,000左右,脱酰度为80%左右)加入30%(m/m)的乙酸溶液中,搅拌均匀后超声150min;
将5.4gβ-甲基丙烯酸加入20ml丙酮中搅拌溶解,然后将所得溶液加入壳聚糖溶液中,搅拌混合均匀,在90℃条件下反应10h;
反应结束后,将反应液透析3d,期间每5h进行一次透析液替换,所得产物冷冻干燥,得到产品α-β不饱和酰基化壳聚糖(简记为mcs)。
2)将1.5g3-巯基丙酸加入双蒸水中搅拌溶解,然后加入700mgedc以及700mgnhs,充分混合后,以1mnaoh调节溶液ph至5,继续搅拌混合;
将1.5g壳聚糖加入0.1%(m/m)的乙酸溶液搅拌溶解,然后将所得壳聚糖溶液加入含有3-巯基丙酸的混合溶液中,60℃条件下反应3h;
将反应液透析3d,期间每5h进行一次透析液替换,所得产物冷冻干燥,得到产品巯基化壳聚糖(简记为cs-sh)。
3)将60mgmcs加入1%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到10mg/l的mcs溶液;
将60mgcs-sh加入1%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到10mg/l的cs-sh溶液;
向所得cs-sh溶液中加入二硫苏糖醇,震荡反应,然后过滤,得到还原处理后的cs-sh溶液;
将mcs溶液与还原处理后的cs-sh溶液混合反应,然后挤出至naoh溶液中反应,得到化学交联的水凝胶。
将所得化学交联的水凝胶加入无水乙醇中,浸泡24h,得到实施例6的双交联壳聚糖水凝胶。
实施例7
1)将1.5g壳聚糖(分子量为50,000左右,脱酰度为80%左右)加入15%(m/m)的乙酸溶液中,搅拌均匀后超声150min;
将1.2gβ-甲基丙烯酸加入6ml丙酮中搅拌溶解,然后将所得溶液加入壳聚糖溶液中,搅拌混合均匀,在60℃条件下反应6h;
反应结束后,将反应液透析3d,期间每4h进行一次透析液替换,所得产物冷冻干燥,得到产品α-β不饱和酰基化壳聚糖(简记为mcs)。
2)将1.5g巯基乙酸加入双蒸水中搅拌溶解,然后加入1.5gedc以及700mgnhs,充分混合后,以1mnaoh调节溶液ph至6.5,继续搅拌混合;
将1.5g壳聚糖加入2%(m/m)的乙酸溶液搅拌溶解,然后将所得壳聚糖溶液加入含有巯基乙酸的混合溶液中,60℃条件下反应3h;
将反应液透析3d,期间每4h进行一次透析液替换,所得产物冷冻干燥,得到产品巯基化壳聚糖(简记为cs-sh)。
3)将240mgmcs加入1%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到100mg/l的mcs溶液;
将240mgcs-sh加入1%(m/m)的乙酸溶液中搅拌溶解,然后超声振荡和氮气除泡,得到100mg/l的cs-sh溶液;
向所得cs-sh溶液中加入对苯二酚,震荡反应,然后过滤,得到还原处理后的cs-sh溶液;
将mcs溶液与还原处理后的cs-sh溶液混合反应,然后挤出至naoh溶液中反应,得到化学交联的水凝胶。
将所得化学交联的水凝胶加入无水乙醇中,浸泡24h,得到实施例7的双交联壳聚糖水凝胶。
实验例1
将未经修饰的壳聚糖置于无水乙醇中浸泡24h,得到物理交联水凝胶,记为csh-e10;
参照实施例1中的方法,按照马来酸酐与壳聚糖摩尔比为1.2:1,巯基丁二酸与壳聚糖摩尔比为1.2:1的摩尔比例,得到化学交联水凝胶,记为m4s4-e0;
同时,参照实施例1中的方法,按照马来酸酐与壳聚糖摩尔比为1.2:1,巯基丁二酸与壳聚糖摩尔比为1.2:1的摩尔比例,得到化学交联水凝胶,然后,将所得化学交联水凝胶分别置于浓度为20%,40%,60%,80%的乙醇溶液以及无水乙醇中,浸泡24h,得到对应的双交联水凝胶,所得水凝胶分别记为m4s4-e2,m4s4-e4,m4s4-e6,m4s4-e8,m4s4-e10;
参照实施例1方法,按照马来酸酐与壳聚糖摩尔比为0.2:1,巯基丁二酸与壳聚糖摩尔比为0.2:1的摩尔比例,得到化学交联水凝胶,然后,将所得化学交联水凝胶置于无水乙醇中,浸泡24h,得到对应的双交联水凝胶,记为m1s1-e10;
参照实施例1方法,按照马来酸酐与壳聚糖摩尔比为0.5:1,巯基丁二酸与壳聚糖摩尔比为0.5:1的摩尔比例,得到化学交联水凝胶,然后,将所得化学交联水凝胶置于无水乙醇中,浸泡24h,得到对应的双交联水凝胶,记为m2s2-e10;
参照实施例1方法,按照马来酸酐与壳聚糖摩尔比为1:1,巯基丁二酸与壳聚糖摩尔比为1:1的摩尔比例,得到化学交联水凝胶,然后,将所得化学交联水凝胶置于无水乙醇中,浸泡24h,得到对应的双交联水凝胶,记为m3s3-e10;
不同水凝胶测试数据如下表所示:
由图3、图4所示检测结果,以及如上表格数据可知,相较于单一物理交联或者化学交联的水凝胶而言,本发明双交联水凝胶在力学性能上有着显著的提高,无论是压缩模量和断裂强度,都明显提高;
同时,由m4s4-e2,m4s4-e4,m4s4-e6,m4s4-e8,m4s4-e10组双交联水凝胶性能对比可知,当原料配比相同时,采用无水乙醇进行物理交联的水凝胶物理性能最优;
进一步的,由m4s4-e10,m1s1-e10,m2s2-e10,m3s3-e10组双交联水凝胶性能对比可知,原料酰基化试剂和巯基化试剂与壳聚糖配比对于最终产品双交联壳聚糖力学性能也有着明显的影响,按照1.2:1的摩尔比例所制备的酰基化壳聚糖以及巯基化壳聚糖反应后,能够得到力学性能更优的双交联壳聚糖。
实验例2
按照实施例1方法,分别得到mcs溶液与还原处理后的cs-sh溶液,将二者混合均匀后,吸入注射器中,利用注射泵进行出样,混合液在含有naoh的接收皿中快速成型,得到壳聚糖生物纤维;
然后,将所得壳聚糖生物纤维在无水乙醇中浸泡24h,得到双交联壳聚糖生物纤维,其扫描电镜图如图5所示。
尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。
- 还没有人留言评论。精彩留言会获得点赞!