一种(E)-β-芳基-β,γ-不饱和酯化合物的合成方法与流程
本发明属于有机合成化学技术领域,具体涉及一种铜催化炔烃与重氮乙酸乙酯和芳硼酸反应,一步合成(e)-β-芳基-β,γ-不饱和酯化合物的方法。
背景技术:
β,γ-不饱和酯化合物广泛存在具有重要生物活性的天然产物中,同时,在有机合成中也是重要的有机合成中间体((a)millar,j.g.;oehlschlager,a.c.;wong,j.w.j.org.chem.1983,48,4404.(b)oehlschlager,a.c.;wong,j.w.;verigin,v.g.;pierced,h.d.j.org.chem.1983,48,5009.(c)liang,j.l.;javed,u.;lee,s.h.;park,j.g.;jahng,y.arch.pharm.res.2014,37,862.(d)eissler,s.;nahrwold,m.;neumann,b.;stammler,h.g.;sewald,n.org.lett.2007,9,817.),因此,制备该类化合物的合成方法引起了有机化学家的广泛关注。
目前,文献中报道的方法主要包括:(1)含有离去基团的烯丙基底物与co的羰基化反应((a)tsuji,j.;sato,k.;okumoto,h.j.org.chem.1984,49,1341.(b)murahashi,s.;imada,y.;taniguchi,y.;higashiura,s.j.org.chem.1993,58,1538.(c)liu,q.;wu,l.;jiao,h.;fang,x.;jackstell,r.;beller,m.angew.chem.,int.ed.2013,52,8064.);(2)烯基三氟硼酸盐与2-氯乙酸乙酯的交叉偶联反应((a)molander,g.a.;barcellos,t.;traister,k.m.org.lett.2013,15,3342.(b)brown,h.c.;cho,b.t.;park,w.s.j.org.chem.1986,51,3398.);(3)α,β-不饱和酸的脱羧烷基羧化反应(gao,b.;xie,y.;shen,z.;yang,l.;huang,h.org.lett.2015,17,4968.)。尽管有较多的方法来合成此类化合物,但也存在一些缺点,例如,使用气体原料不易操作,需要昂贵的金属催化剂,原子利用率低,立体选择性难易控制等。更重要的是,对于合成(e)-β-芳基-β,γ-不饱和酯化合物尚缺少行之有效的方法。因此,发展廉价的催化体系,实现(e)-β-芳基-β,γ-不饱和酯化合物的绿色、高效的合成极其重要。
技术实现要素:
本发明目的在于克服现有技术缺陷,提供一种(e)-β-芳基-β,γ-不饱和酯化合物的合成方法,其是由碘化亚铜催化炔烃与重氮乙酸乙酯和芳硼酸一步合成反应而得,该方法具有反应步骤简单、原料廉价易得、底物适用范围广泛、立体选择性高等特点。
为实现上述目的,本发明采用如下技术方案:
一种(e)-β-芳基-β,γ-不饱和酯化合物的合成方法,其具体包括以下步骤:
将炔烃类化合物、溶剂、重氮乙酸乙酯、芳硼酸类化合物、邻菲罗啉(phen)、cui和k3po4混合,然后在惰性气体氛围下于90-110℃密闭反应1.2-3小时,反应结束经后处理即得。
具体的,所述炔烃类化合物优选为苯乙炔、4-甲基苯乙炔、4-乙基苯乙炔、4-丙基苯乙炔、4-丁基苯乙炔、4-叔丁基苯乙炔、4-氟苯乙炔、4-氯苯乙炔、4-溴苯乙炔、3-氟苯乙炔、3-氯苯乙炔、2-氟苯乙炔、2-氯苯乙炔、甲基炔丙基醚、缩水甘油基炔丙基醚或环丙基乙炔等。
具体的,所述芳硼酸类化合物优选为苯硼酸、4-甲基苯硼酸、4-乙基苯硼酸、4-异丙基苯硼酸、4-叔丁基苯硼酸、4-乙烯基苯硼酸、4-氯苯硼酸、4-溴苯硼酸、3-甲基苯硼酸、3-甲氧基苯硼酸、3-氟苯硼酸、3-氯苯硼酸或3-溴苯硼酸等。
进一步的,上述(e)-β-芳基-β,γ-不饱和酯化合物的合成方法中,所述炔烃类化合物、重氮乙酸乙酯与芳硼酸类化合物的摩尔比优选为1.2-1.5:1:2-3。
进一步的,上述(e)-β-芳基-β,γ-不饱和酯化合物的合成方法中,所述配体邻菲罗啉与重氮乙酸乙酯的摩尔比为优选5-15:100。
进一步的,上述(e)-β-芳基-β,γ-不饱和酯化合物的合成方法中,所述催化剂cui与重氮乙酸乙酯的摩尔比优选为5-15:100。
进一步的,上述(e)-β-芳基-β,γ-不饱和酯化合物的合成方法中,所述碱k3po4与重氮乙酸乙酯的摩尔比优选为1.5-2.5:1。
进一步的,上述(e)-β-芳基-β,γ-不饱和酯化合物的合成方法中,所述溶剂优选为1,4-二氧六环,每0.3mmol重氮乙酸乙酯添加1-2ml1,4-二氧六环为宜;所述惰性气体为氮气或氩气。
本发明中,以cui为催化剂、邻菲罗啉为配体,k3po4为碱在1,4-二氧六环溶剂中反应,由炔烃与重氮乙酸乙酯和芳硼酸化合物经炔烃的偕双官能团化反应立体和区域选择性一步得到(e)-β-芳基-β,γ-不饱和酯化合物。图中化合物1为芳环有各种取代基的苯乙炔类化合物、烷基炔丙基醚类化合物等。化合物2为重氮乙酸乙酯,化合物3为芳环有各种取代基的苯硼酸类化合物等。化学反应方程式如下所示:
本发明中,炔烃的双官能团化反应由于可以高效、原子经济性的一步来合成多取代烯烃,近年来得到迅速的发展。目前,炔烃的双官能团化反应研究主要集中在将两个新基团分别引入到炔烃的两个碳原子上,即炔烃的1,2-双官能团化反应,然而,炔烃的1,1-双官能团化(偕双官能团化)反应,即将两个新基团引入到炔烃的同一个碳原子上,却很少被研究。因此,本发明研究并发展廉价过渡金属催化炔烃的偕双官能团化反应来有效合成(e)-β-芳基-β,γ-不饱和酯化合物具有重要的理论研究意义和应用价值。和现有技术相比,本发明的创新性在于:
本发明合成方法反应所用的原料易从工业产品中获得,试剂廉价,催化体系简单,底物范围宽泛,且反应操作简单,产率较高,为高区域和化学选择性合成(e)-β-芳基-β,γ-不饱和酯化合物提供了简单实用的方法,适用于合成各种(e)-β-芳基-β,γ-不饱和酯化合物。
附图说明
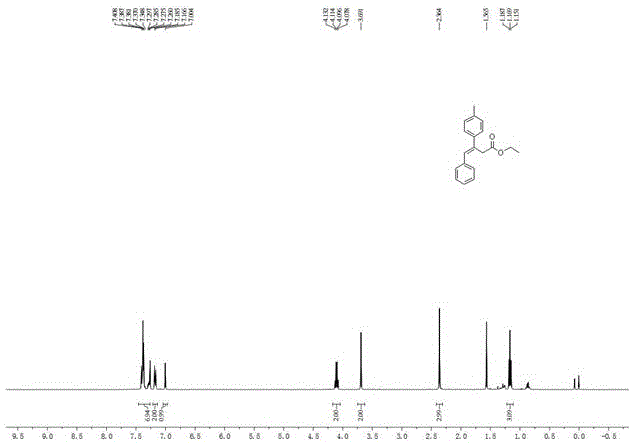
图1为实施例1产物(e)-β-芳基-β,γ-不饱和酯4a的1hnmr谱图;
图2为实施例1产物(e)-β-芳基-β,γ-不饱和酯4a的13cnmr谱图;
图3为实施例2产物(e)-β-芳基-β,γ-不饱和酯4b的1hnmr谱图;
图4为实施例2产物(e)-β-芳基-β,γ-不饱和酯4b的13cnmr谱图;
图5为实施例4产物(e)-β-芳基-β,γ-不饱和酯4d的1hnmr谱图;
图6为实施例4产物(e)-β-芳基-β,γ-不饱和酯4d的13cnmr谱图;
图7为实施例5产物(e)-β-芳基-β,γ-不饱和酯4e的1hnmr谱图;
图8为实施例5产物(e)-β-芳基-β,γ-不饱和酯4e的13cnmr谱图。
具体实施方式
以下结合实施例对本发明的技术方案作进一步地详细介绍,但本发明的保护范围并不局限于此。
实施例1
首先,在35ml的密封管中放入搅拌子,并依此加入33μl重氮乙酸乙酯(0.3mmol)、1,4-二氧六环(1ml)、41μl苯乙炔(0.36mmol)、124.9mg对甲基苯硼酸(0.9mmol),混合均匀。然后,向上述混合均匀的溶液中依次加入5.4mgphen(0.03mmol)、5.7mgcui(0.03mmol)和130.0mgk3po4(0.6mmol)。所有药品加完后,向密封管中通入氮气约3分钟,排除密封管中的空气,用旋塞密封管口,在100℃条件下搅拌反应1.5小时。反应结束后,将体系冷却至室温,向反应体系中加入3ml蒸馏水,用乙酸乙酯萃取,合并有机相,减压蒸馏除去有机相溶剂,经硅胶柱层析(v石油醚:v乙酸乙酯=50:1)得到71.0mg无色液体产物4a,产率85%。反应见下式:
谱图解析数据
1hnmr(400mhz,cdcl3):δ=1.17(t,j=7.2hz,3h),2.36(s,3h),3.69(s,2h),4.11(q,j=7.2hz,2h),7.00(s,1h),7.18(d,j=7.6hz,2h),7.28-7.41(m,7h);13cnmr(100mhz,cdcl3):δ=14.1,21.1,36.6,60.8,126.1,127.1,128.4,128.8,129.2,130.4,134.5,137.4,137.6,138.8,171.6.hrms(esi-tof).calcdforc19h21o2,[m+h]+m/z281.1542,found281.1537。
上述的4a化合物可用于合成已知物质3-芳基萘酚:
将84mg4a(0.3mmol)溶于300mg浓h2so4中,室温搅拌2小时。反应结束后,小心加入2ml冷水,用乙酸乙酯萃取(3x5ml),合并有机相,减压蒸馏除去有机相的溶剂,经硅胶柱层析(v石油醚:v乙酸乙酯=10:1)得到52.0mg白色固体产物5a,产率74%,反应方程式如下:
实施例2
首先,在35ml的密封管中放入搅拌子,并依此加入33μl重氮乙酸乙酯(0.3mmol)、1,4-二氧六环(1ml)、47μl对甲基苯乙炔(0.36mmol)、124.9mg对甲基苯硼酸(0.9mmol),混合均匀。然后,向上述混合均匀的溶液中依次加入5.4mgphen(0.03mmol)、5.7mgcui(0.03mmol)和130.0mgk3po4(0.6mmol)。所有药品加完后,向密封管中通入氮气约3分钟,排除密封管中的空气,用旋塞密封管口,在100℃条件下搅拌1.5小时。反应结束后,将体系冷却至室温,向反应体系中加入3ml蒸馏水,用乙酸乙酯萃取,合并有机相,减压蒸馏除去有机相的溶剂,经硅胶柱层析(v石油醚:v乙酸乙酯=50:1)得到72.0mg无色液体产物4b(其cas号为130240-35-6),产率82%。反应见下式:
谱图解析数据
colorlessoil.1hnmr(400mhz,cdcl3):δ=1.19(t,j=7.2hz,3h),2.37(s,3h),2.38(s,3h),3.71(s,2h),4.12(q,j=7.2hz,2h),6.99(s,1h),7.18(d,j=5.2hz,2h),7.20(d,j=5.2hz,2h),7.29(d,j=8.0hz,2h),7.41(d,j=8.0hz,2h);13cnmr(100mhz,cdcl3):δ=14.1,21.1,21.2,36.6,60.7,126.0,128.6,129.1,129.1,130.4,133.8,134.6,136.8,137.2,138.9,171.7.hrms(esi-tof).calcdforc20h23o2,[m+h]+m/z295.1698,found295.1688。
实施例3:
首先,在35ml的密封管中放入搅拌子,并依此加入33μl重氮乙酸乙酯(0.3mmol)、1,4-二氧六环(1ml)、42μl对氟苯乙炔(0.36mmol)、124.9mg对甲基苯硼酸(0.9mmol),混合均匀。然后,向上述混合均匀的溶液中依次加入5.4mgphen(0.03mmol)、5.7mgcui(0.03mmol)和130.0mgk3po4(0.6mmol)。所有药品加完后,向密封管中通入氮气约3分钟,排除密封管中的空气,用旋塞密封管口,在100℃条件下搅拌1.5小时。反应结束后,将体系冷却至室温,向反应体系中加入3ml蒸馏水,用乙酸乙酯萃取,合并有机相,减压蒸馏除去有机相的溶剂,经硅胶柱层析(v石油醚:v乙酸乙酯=50:1)得到63.0mg无色液体产物4c,产率70%。反应见下式:
谱图解析数据
colorlessoil.1hnmr(400mhz,cdcl3):δ=1.18(t,j=7.2hz,3h),2.37(s,3h),3.65(s,2h),4.11(q,j=7.2hz,2h),6.95(s,1h),7.06(t,j=7.2hz,2h),7.18(d,j=8.0hz,2h),7.34-7.40(m,4h);13cnmr(100mhz,cdcl3):δ=14.1,21.1,36.5,60.8,115.3(d,j=21.0hz),126.0,129.2,129.3,130.4(d,j=8.0hz),133.6(d,j=4.0hz),134.6,137.5,138.5,161.9(d,j=245.0hz),171.5.hrms(esi-tof).calcdforc19h20fo2,[m+h]+m/z299.1447,found299.1438。
实施例4
首先,在35ml的密封管中放入搅拌子,并依此加入33μl重氮乙酸乙酯(0.3mmol)、1,4-二氧六环(2ml)、41μl苯乙炔(0.36mmol)、145.0mg间氯苯硼酸(0.9mmol),混合均匀。然后,向上述混合均匀的溶液中依次加入5.4mgphen(0.03mmol)、5.7mgcui(0.03mmol)和130.0mgk3po4(0.6mmol)。所有药品加完后,向密封管中通入氮气约3分钟,排除密封管中的空气,用旋塞密封管口,在100℃条件下搅拌1.5小时。反应结束后,将体系冷却至室温,向反应体系中加入3ml蒸馏水,用乙酸乙酯萃取,合并有机相,减压蒸馏除去有机相的溶剂,经硅胶柱层析(v石油醚:v乙酸乙酯=50:1)得到65.0mg无色液体产物4d,产率72%。反应见下式:
谱图解析数据
colorlessoil.1hnmr(400mhz,cdcl3):δ=1.18(t,j=7.2hz,3h),3.68(s,2h),4.12(q,j=7.2hz,2h),7.02(s,1h),7.26-7.39(m,8h),7.50(s,1h);13cnmr(100mhz,cdcl3):δ=14.1,36.6,60.9,124.5,126.5,127.5,127.6,128.5,128.7,129.6,132.3,133.6,134.4,137.0,143.7,171.1.hrms(esi-tof).calcdforc18h18clo2,[m+h]+m/z301.0995,found301.0992。
实施例5
首先,在35ml的密封管中放入搅拌子,并依此加入33μl重氮乙酸乙酯(0.3mmol)、1,4-二氧六环(1ml)、31μl甲基丙炔基醚(0.36mmol)、124.9mg对甲基苯硼酸(0.9mmol),混合均匀。然后,向上述混合均匀的溶液中依次加入5.4mgphen(0.03mmol)、5.7mgcui(0.03mmol)和130.0mgk3po4(0.6mmol)。所有药品加完后,向密封管中通入氮气约3分钟,排除密封管中的空气,用旋塞密封管口,在100℃条件下搅拌1.5小时。反应结束后,将体系冷却至室温,向反应体系中加入3ml蒸馏水,用乙酸乙酯萃取,合并有机相,减压蒸馏除去有机相的溶剂,经硅胶柱层析(v石油醚:v乙酸乙酯=70:1)得到68.5mg无色液体产物4e,产率92%。反应见下式:
谱图解析数据
colorlessoil.1hnmr(400mhz,cdcl3):δ=1.19(t,j=7.2hz,3h),2.34(s,3h),3.39(s,3h),3.53(s,2h),4.10-4.17(m,4h),6.07(t,j=6.4hz,1h),7.13(d,j=7.6hz,2h),7.31(d,j=8.0hz,2h);13cnmr(100mhz,cdcl3):δ=14.1,21.0,36.4,58.2,60.8,69.4,125.9,127.5,129.0,135.4,137.2,138.5,170.9.hrms(esi-tof).calcdforc15h20nao3,[m+na]+m/z271.1310,found271.1303。
实施例6
首先,在35ml的密封管中放入搅拌子,并依此加入33μl重氮乙酸乙酯(0.3mmol)、1,4-二氧六环(1ml)、31μl环丙基乙炔(0.36mmol)、124.9mg对甲基苯硼酸(0.9mmol),混合均匀。然后,向上述混合均匀的溶液中依次加入5.4mgphen(0.03mmol)、5.7mgcui(0.03mmol)和130.0mgk3po4(0.6mmol)。所有药品加完后,向密封管中通入氮气约3分钟,排除密封管中的空气,用旋塞密封管口,在100℃条件下搅拌1.5小时。反应结束后,将体系冷却至室温,向反应体系中加入3ml蒸馏水,用乙酸乙酯萃取,合并有机相,减压蒸馏除去有机相的溶剂,经硅胶柱层析(v石油醚:v乙酸乙酯=70:1)得到66.0mg无色液体产物4f,产率90%。反应见下式:
谱图解析数据
colorlessoil.1hnmr(400mhz,cdcl3):δ=0.47-0.51(m,2h),0.85-0.88(m,2h),1.20(t,j=7.2hz,3h),1.58-1.66(m,1h),2.31(s,3h),3.61(s,2h),4.12(q,j=7.2hz,2h),5.31(d,j=9.2hz,1h),7.09(d,j=8.0hz,2h),7.24(d,j=8.4hz,2h);13cnmr(100mhz,cdcl3):δ=7.5,11.3,14.1,21.0,36.4,60.6,125.4,128.9,130.8,135.7,136.2,139.2,171.7.hrms(esi-tof).calcdforc16h21o2,[m+h]+m/z245.1542,found245.1538。
- 还没有人留言评论。精彩留言会获得点赞!