CH3结构域改造诱导形成的异源二聚体及其制备方法和应用与流程
ch3结构域改造诱导形成的异源二聚体及其制备方法和应用
技术领域
1.本发明属于抗体工程领域,具体涉及一种ch3结构域改造诱导形成的异源二聚体及其制备方法和应用。
背景技术:
2.双特异性抗体有多种构建方式,其中igg型双特异性抗体具有和普通抗体相似的结构、理化性质和fc段功能。通常igg型双特异性抗体由两条氨基酸序列不同的重链(即抗抗原a的重链hc_a和抗抗原b的重链hc_b)和两条氨基酸序列不同的轻链(即抗抗原a的轻链lc_a和抗抗原b的轻链lc_b)组成。当4条多肽链组合时,两条重链之间会形成同源二聚体和异源二聚体,轻重链之间也会形成错配,因此会产生8种不同的组合方式,其中只有一种为所需要的目标抗体分子。而从8种分子中分离纯化得到目标分子效率极低且非常困难。
3.构造igg型双特异性抗体有多种方法,通过改造fc使之形成异源二聚体是其中重要的一种方法。早在20世纪90年代,carter等人用“凸-凹”(knob-into-hole)模型改造抗体fc段,较成功的实现了双特异抗体的制备(ridgway,presta et al.1996;carter 2001)。carter等在fc第一条重链的ch3结构域上通过将一个侧链小的氨基酸突变成了一个侧链大的氨基酸从而创造出了一个“凸”,并将第二条重链上的ch3上的某些氨基酸突变成了侧链小的氨基酸创造出了“凹”。“凸-凹”模型的原理是“凸-凹”的相互作用支持异源二聚体的形成,而“凸-凸”模型及“凹-凹”模型阻碍同源二聚体的形成。然而在他们的研究结果中,“凹-凹”模型对阻碍同源二聚体的形成的能力仍然不够。
4.us2010286374a1公开了一种利用静电作用促进异源二聚体形成的方法。具体来说,将两条重链的ch3结构域中带电荷氨基酸分别突变为相反电荷的氨基酸,使得其中一条重链的ch3结构域总体上带正电荷,而另一条重链的ch3结构域总体上带负电荷,相同电荷的静电排斥会抑制同源二聚体的形成。然而,静电作用并不能完全抑制同源二聚体的形成,引入过多的突变反而引起蛋白表达水平的下降,反映出多个氨基酸突变情况下,界面氨基酸之间作用关系的复杂性。
5.将“凸-凹”模型和静电作用相结合是促进异源二聚体形成的有效方法。cn106883297a公开了一种方法,具体来说,在carter等人的“凸-凹”模型基础上进一步在“凹”的一端引入f405k突变,增强“凹-凹”界面氨基酸之间静电排斥,同时在“凸”的一端引入k409a突变,避免“凸-凹”界面氨基酸之间产生静电排斥,从而抑制“凹-凹”同源二聚体的形成并维持“凸-凹”异源二聚体的形成。尽管该专利公开的方法能提高异源二聚体的形成,但其中的一个方案仅能将异源二聚体的比例最高提高到93%。
6.us20150307628a1公开了另一种利用“凸-凹”模型和静电作用促进异源二聚体形成的方法。具体来说,其中一个方案在fc第一条重链的ch3结构域上通过k409w点突变创造出了一个“凸”,并将第二条重链上的ch3上通过f405t、d399v点突变造出了“凹”;在第一条重链的ch3结构域上通过k360e点突变使之带上负电荷,并将第二条重链上的ch3上通过q347r点突变使之带上正电荷。该方案在不引入二硫键的情况下能将异源二聚体的比例最
高提高到91.4
±
1.2%。
7.尽管cn106883297a和us20150307628a1公开的两种方法从原理上优于单纯的“凸-凹”模型并且进一步提高了异源二聚体的比例,但要把异源二聚体的比例提高到95%以上仍需要新的研究。
技术实现要素:
8.本发明的目的在于克服现有技术中的不足,提供一种ch3结构域改造诱导形成的异源二聚体及其制备方法和应用。本发明通过综合考虑分子间相互作用,如离子作用、空间作用、疏水相互作用,将“凸-凹”模型和静电作用相结合,筛选到优选的ch3突变序列,其更倾向于形成异源二聚体,而不形成同源二聚体,在不引入二硫键的情况下能将异源二聚体分子的比例最高提高到95%以上。
9.本发明所述的异源二聚体指抗体分子或片段含有两条氨基酸序列不同的重链,包括而不局限于双特异性抗体、一价抗体、fc融合蛋白等。
10.本发明的第一个方面是提供一种异源二聚体,其含有第一多肽链和第二多肽链,所述第一多肽链和第二多肽链分别含有抗体重链恒定区ch3结构域,分别命名为ch3_a结构域和ch3_b结构域,与野生型的人抗体重链恒定区ch3结构域相比,所述ch3_a和ch3_b结构域含有如下位置氨基酸的突变:ch3_a结构域的k409、f405发生突变,且ch3_a结构域和ch3_b结构域还分别在选自q347、y349、s354、e356、e357、k360、s364、l368、k370、k392、d399和k439中的一个或多个氨基酸位置具有的突变。
11.以上所述的氨基酸的位置根据kabat编号的eu索引确定。
12.优选地,所述ch3_a结构域和ch3_b结构域具有选自下列的突变中的一种或多种:
13.1a)ch3_b结构域的s364、e357发生突变,且ch3_a结构域的k370发生突变;
14.1b)ch3_b结构域的d399发生突变,且ch3_a结构域的k392发生突变;
15.1c)ch3_b结构域的e356、e357发生突变,且ch3_a结构域的k439发生突变;
16.1d)ch3_b结构域的s364发生突变,且ch3_a结构域的l368发生突变;
17.1e)ch3_b结构域的q347发生突变,且ch3_a结构域的k360发生突变。
18.进一步优选地,所述ch3_a结构域和ch3_b结构域还具有下列突变:
19.1f)ch3_b结构域的s354发生突变,且ch3_a结构域的y349发生突变;或1g)ch3_b结构域的y349发生突变,且ch3_a结构域的s354发生突变。
20.优选地,所述突变选自以下突变中的一个或数个:q347r、y349c、s354c、e356k、e357k、e357s、k360e、s364r、s364k、l368d、k370d、k392d、d399k、k439e、f405e和k409f。
21.q347r是指谷氨酰胺gln347被替换为精氨酸(r)。y349c是指酪氨酸tyr349被替换为半胱氨酸(c)。s354c是指丝氨酸ser354被替换为半胱氨酸(c)。e356k是指谷氨酸glu356被替换为赖氨酸(k)。e357k是指谷氨酸glu357被替换为赖氨酸(k)。e357s是指谷氨酸glu357被替换为丝氨酸(s)。k360e是指赖氨酸lys360被替换为赖氨酸(k)。s364r是指丝氨酸ser364被替换为精氨酸(r)。s364k是指丝氨酸ser364被替换为赖氨酸(k)。l368d是指亮氨酸leu368被替换为天冬氨酸(d)。k370d是指赖氨酸lys370被替换为天冬氨酸(d)。k392d是指赖氨酸lys392被替换为天冬氨酸(d)。d399k是指天冬氨酸asp399被替换为赖氨酸(k)。k439e是指赖氨酸lys439被替换为谷氨酸(e)。f405e是指苯丙氨酸phe405被替换为谷氨酸
(e)。k409f是指赖氨酸lys409被替换为苯丙氨酸(f)。
22.优选地,所述异源二聚体的ch3_a结构域和ch3_b结构域含有选自以下一组的突变:
23.(a1)ch3_a结构域:f405e+k409f+k370d,ch3_b结构域:s364r+e357s;
24.(a2)ch3_a结构域:f405e+k409f+k370d+s354c,ch3_b结构域:s364r+e357s+y349c;
25.(a3)ch3_a结构域:f405e+k409f+k370d+y349c,ch3_b结构域:s364r+e357s+s354c
26.(b1)ch3_a结构域:f405e+k409f+k392d,ch3_b结构域:d399k;
27.(b2)ch3_a结构域:f405e+k409f+k392d+s354c,ch3_b结构域:d399k+y349c;
28.(b3)ch3_a结构域:f405e+k409f+k392d+y349c,ch3_b结构域:d399k+s354c;
29.(c1)ch3_a结构域:f405e+k409f+k439d,ch3_b结构域:e356k+e357k;
30.(c2)ch3_a结构域:f405e+k409f+k439d+s354c,ch3_b结构域:e356k+e357k+y349c;
31.(c3)ch3_a结构域:f405e+k409f+k439d+y349c,ch3_b结构域:e356k+e357k+s354c;
32.(d1)ch3_a结构域:f405e+k409f+l368d,ch3_b结构域:s364r;
33.(d2)ch3_a结构域:f405e+k409f+l368d+s354c,ch3_b结构域:s364r+y349c;
34.(d3)ch3_a结构域:f405e+k409f+l368d+y349c,ch3_b结构域:s364r+s354c;
35.(e1)ch3_a结构域:f405e+k409f+l368d,ch3_b结构域:s364k;
36.(e2)ch3_a结构域:f405e+k409f+l368d+s354c,ch3_b结构域:s364k+y349c;
37.(e3)ch3_a结构域:f405e+k409f+l368d+y349c,ch3_b结构域:s364k+s354c;
38.(f1)ch3_a结构域:f405e+k409f+k360e,ch3_b结构域:q347r;
39.(f2)ch3_a结构域:f405e+k409f+k360e+s354c,ch3_b结构域:q347r+y349c;
40.(f3)ch3_a结构域:f405e+k409f+k360e+y349c,ch3_b结构域:q347r+s354c;
41.(g1)ch3_a结构域:f405e+k409f+k370d+k360e,ch3_b结构域:s364r+e357s+q347r;
42.(g2)ch3_a结构域:f405e+k409f+k370d+k360e+s354c,ch3_b结构域:s364r+e357s+q347r+y349c;
43.(g3)ch3_a结构域:f405e+k409f+k370d+k360e+y349c,ch3_b结构域:s364r+e357s+q347r+s354c。
44.在本发明的实施方案中,所述的抗体恒定区来源于igg(例如igg1、igg2、igg3、igg4)、iga(例如iga1、iga2)、igd、ige或igm。
45.本发明的第二个方面是提供一种组合物,其含有:(1)权利要求1-5中任意一项所述的异源二聚体,以及(2)药学上可接受的载体和/或稀释剂和/或赋形剂。
46.本发明的第三个方面是提供一种多核苷酸,所述多核苷酸包含:编码权利要求1-5中任意一项所述的异源二聚体的第一条多肽链的核苷酸分子a,以及编码权利要求1-5中任意一项所述的异源二聚体的第二条多肽链的核苷酸分子b;
47.本发明的第四个方面是提供一种载体组合,所述载体组合包括:含有所述核苷酸分子a的重组载体a,以及含有所述核苷酸分子b的重组载体b。
48.其中,所述重组载体a和重组载体b所使用的表达载体为本领域常规的表达载体,是指包含适当的调控序列,例如启动子序列、终止子序列、多腺苷酰化序列、增强子序列、标记基因和/或序列以及其他适当的序列的表达载体。所述表达载体可以是病毒或质粒,如适当的噬菌体或者噬菌粒,更多技术细节请参见例如sambrook等,molecular cloning:a laboratory manual,第二版,cold spring harbor laboratory press,1989。许多用于核酸操作的已知技术和方案请参见current protocols in molecular biology,第二版,ausubel等编著。本发明所述表达载体较佳地为pdr1,pcdna3.1(+),pcdna3.1/zeo(+),pdhfr,ptt5,pdhff,pgm-csf或pcho 1.0,更佳地为ptt5。
49.本发明的第五个方面是提供一种重组宿主细胞,所述重组宿主细胞含有所述载体组合。
50.本发明所述的重组宿主细胞的原始宿主细胞可以为本领域常规的各种宿主细胞,只要能满足使上述重组载体稳定地自行复制,且所携带所述的核苷酸可被有效表达即可。其中所述原始宿主细胞可以原核表达细胞或真核表达细胞,所述宿主细胞较佳地包括:cos、cho(中国仓鼠卵巢,chinese h amster ovary)、ns0、sf9、sf21、dh5α、bl21(de3)或tg1,更佳地为e.coli tg1、bl21(de3)细胞(表达单链抗体或fab抗体)或者cho-k1细胞(表达全长igg抗体)。将前述表达载体转化至宿主细胞中,即可得本发明优选的重组宿主细胞。其中所述转化方法为本领域常规转化方法,较佳地为化学转化法,热激法或电转法。
51.作为优选的方案,所述原始宿主细胞优选为真核细胞,进一步优选为cho细胞或293e细胞。
52.本发明的第六个方面是提供本发明第一个方面所述的异源二聚体、本发明第二个方面所述的组合物、本发明第三个方面所述的多核苷酸、本发明第四个方面所述的载体组合、或本发明第五个方面所述的重组宿主细胞在在制备双特异性抗体、双特异性融合蛋白和抗体-融合蛋白嵌合体中的用途。
53.本发明的第七个方面是提供一种制备本发明第一个方面所述的异源二聚体的方法,使用本发明第五个方面所述的重组宿主细胞表达所述异源二聚体。
54.在本发明中,所述重组宿主细胞同时含有编码异源二聚体中第一多肽链的重组载体a和编码异源二聚体中第二多肽链的重组载体b,利用该重组宿主细胞表达,回收,得到异源二聚体分子。
55.其中,所述异源二聚体可以用标准的实验手段从重组宿主细胞中纯化。例如,当异二聚体蛋白包含抗体fc片段,可以用蛋白a来纯化。纯化方法包括但不限于色谱技术如体积排阻法、离子交换法、亲和色谱法及超滤法,或者上述各种方法的适当组合。
56.在本发明中,所述重组宿主细胞中重组载体a和重组载体b的转染比例为1:3~3:1,例如1:2~2:1,例如1:1.5~1.5:1,例如约1:1。
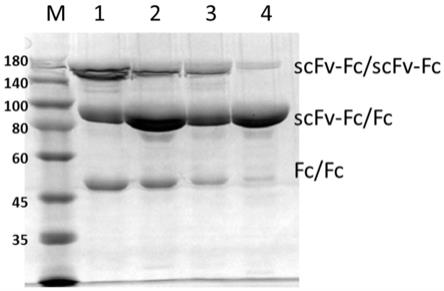
57.在本发明中,第一多肽链和第二多肽链都含有抗体fc片段的ch3结构域,两条多肽链之间通过ch3结构域或含有ch3的fc片段发生相互作用,形成二聚体,特别是异源二聚体。两条多肽链之间可以是不同的组合,例如第一多肽链为抗体,第二多肽链为融合蛋白,或者两条多肽链均为融合蛋白,或者两条多肽链均为抗体,靶向不同的抗原或抗原表位。当融合蛋白包含抗体的fc段与细胞粘附分子的胞膜外区时也称为免疫粘附素。所述细胞粘附分子主要指能识别特异性配基细胞表面受体的分子,例如包括钙粘素、选择素、免疫球蛋白超家
族、整合素及透明质酸粘素。
58.在本发明中,所述ch3来源于抗体fc片段,优选来源于人的抗体fc片段。在一般情况下,人抗体fc片段的ch3结构域来源于野生型的人抗体fc片段。野生型的人抗体fc是指存在于人群中的氨基酸序列,当然fc片段在个体中会有一些细微的差异。本发明中人抗体fc片段也包括对于野生型人抗体fc序列的个别氨基酸的改变,例如包括某些在糖基化位点突变的氨基酸,或者其它无义的突变。对于ch3以及ch2结构域,除了本发明中提到的突变外,还可能含有其它不影响抗体特别是fc段功能的突变。
59.在本发明中,当第一多肽链和/或第二多肽链中含有绞链区时,该绞链区作为柔性片段连接在两段多肽之间,以保证各段多肽链的功能;本领域技术人员可以根据需要选择绞链区的长度,例如可选择全长序列或其中的部分序列。
60.在本发明中,所述fc或其ch2、ch3结构域或绞链区中氨基酸位置的编号均根据kabat eu编号索引的位置确定。本领域技术人员知晓,即使上述区域中由于氨基酸的插入或缺失或其它突变导致氨基酸序列的改变,根据kabat eu编号索引确定的与标准序列对应的各氨基酸的位置编号仍然不变。所述eu索引描述于kabat等,sequences of proteins of immunological interest,第5版public health service,national institutes of health,bethesda,md.(1991)。
61.本发明的有益效果:
62.本发明通过综合考虑界面氨基酸之间的各种相互作用,例如离子作用、疏水相互作用和空间作用等,将“凸-凹”模型和静电作用相结合,筛选到优选的ch3突变序列,其更倾向于形成异源二聚体,而不形成同源二聚体,因而大大提高了异源二聚体分子的产量。与参考文献cn106883297a和us20150307628a1相比,本发明涉及的“凸-凹”模型构造方法更加简单、点突变更少,而且在不引入二硫键的情况下能将异源二聚体的纯度最高提高到95%以上。
附图说明
63.图1为ch3结构域晶体结构示意图。图中表明ch3_a的k409位于由ch3_b的f405、d399和k370围成的空腔内,并且和d399的侧链形成离子相互作用。
64.图2为异源抗体和同源抗体示意图。从左到右分别为ch3_a/ch3_b异源二聚体、ch3_a/ch3_a同源二聚体和ch3_b/ch3_b同源二聚体。方形模块代表静电相互作用,圆形模块代表空间作用。不同形状模块之间存在排斥作用。ch3_a/ch3_a同源二聚体之间主要存在静电-疏水排斥,ch3_b/ch3_b同源二聚体之间存在在在静电排斥和静电-疏水排斥。
65.图3为瞬时表达scfv-fc/fc异源二聚体的电泳分析。4-12%sds-page蛋白凝胶电泳。泳道从左到右依次为:蛋白分子量标准、组合1、组合2、组合3和组合4。每组产物中所包含的同源二聚体和异源二聚体因为分子量差异而在凝胶电泳中的迁移距离不同。不同的同二聚体或异二聚体蛋白所处的位置在图中被标注出。
66.图4为不同转染比例对scfv-fc/fc异源二聚体影响的电泳分析。4-12%sds-page蛋白凝胶电泳。泳道从左到右依次为:共转染比例为ch3_a重组载体:ch3_b重组载体=1:1、共转染比例为ch3_a重组载体:ch3_b重组载体=1.5:1和蛋白分子量标准。每组产物中所包含的同源二聚体和异源二聚体因为分子量差异而在凝胶电泳中的迁移距离不同。不同的同
二聚体或异二聚体蛋白所处的位置在图中被标注出。
具体实施方式
67.以下实施例是对本发明进行进一步的说明,不应理解为是对本发明的限制。实施例不包括对传统方法的详细描述,如那些用于构建载体和质粒的方法,将编码蛋白的基因插入到这样的载体和质粒的方法或将质粒引入宿主细胞的方法.这样的方法对本领域中具有普通技术的人员是众所周知的,并且在许多出版物中都有所描述,包括sambrook,j.,fritsch,e.f.and maniais,t.(1989)molecular cloning:a laboratory manual,2
nd edition,cold spring harbor laboratory press.
68.1、实验材料:
69.293e细胞,来自nrc biotechnology research institute。
70.2、实验试剂:
71.pbs:购自生工生物工程(上海)股份有限公司,货号b548117。
72.柠檬酸:购自国药集团化学试剂有限公司。
73.prime star hs dna polymerase:购自takara公司,货号r010a。
74.无内毒素质粒大提试剂盒:购自tiangen公司,货号dp117。
75.3、实验仪器:
76.hitrap mabselectsure柱:购自ge公司。
77.akta-fplc快速蛋白液相色谱系统:购自ge公司。
78.c1000 touch thermal cycler pcr仪:购自bio-rad公司。
79.chemidoc mp凝胶成像仪:购自bio-rad公司。
80.离心机:购自eppendorf公司。
81.g1600ax毛细管电泳仪:购自安捷伦公司。
82.microcal peaq-dsc微量热差式扫描量热仪:购自马尔文公司。
83.实施例1第一轮突变候选组合的设计、构建、表达和纯化
84.1、第一轮ch3结构域氨基酸修饰的设计
85.已上市的绝大多数抗体都属于igg1或igg4亚型,并且igg1和igg4的fc段氨基酸序列高度保守。本发明优选igg1作为模板设计ch3结构域的氨基酸修饰,未做特殊说明的情况下这些氨基酸修饰同样适用于igg4亚型。
86.ch3结构域会形成同源二聚体,igg1的抗体fc段的ch3结构域晶体结构(pdbcode:4bsw)如图1所示,ch3_a的k409位于由ch3_b的f405、d399和k370围成的空腔内,并且和d399的侧链形成离子相互作用。上述位点在igg4上高度保守,仅仅和igg1不同的是,igg4重链上eu编号为370位的氨基酸为arg。us20150307628a1中提到,将ch3_a的k409突变为trp(或叫做k409w)创造出一个“凸”,需同时在ch3_b引入f405t和d399v点突变,创造出一个“凹”,否则会引起空间位阻排斥和疏水-静电排斥。本发明意外惊奇的发现,将ch3_a的k409突变为phe(或叫做k409f),并不会和ch3_b上的氨基酸f405引起空间位阻排斥,也不会和ch3_b上的氨基酸k370和d399发生疏水-静电排斥。当ch3_b上的氨基酸k370突变为arg(或叫做k409r)时,也不会发生疏水-静电排斥。相反的,将ch3_b上的d399突变为非极性并且侧链较小的氨基酸如ala(或叫做d399a)从而创造出一个“凹”时反而不利于异源二聚体的形成(见
下文图3)。因此,本发明发现了一种比对照专利us20150307628a1更加简便的构造“凸-凹”模型的方法。
87.为了抑制ch3_a形成同源二聚体,进一步在ch3_a上引入f405e或f405d点突变;为了抑制ch3_b形成同源二聚体,在ch3_b上引入s364r+e357s点突变,同时在ch3_a上引入k370d或k370e点突变,如图2所示。如上所述,得到表1中的异源二聚体突变组合。
88.表1异源二聚体突变组合列表-1
[0089][0090]
2、构建带有突变的人igg1的fc片段以及scfv-fc融合蛋白的重组载体
[0091]
人工合成获得编码scfv-fc融合蛋白(scfv-fc融合蛋白序列见seq id:1)基因,其中的scfv是指抗cd3的单链抗体。然后亚克隆至哺乳动物细胞表达载体ptt5获得用于哺乳动物细胞表达scfv-fc融合蛋白的重组表达载体。将上述基因的fc片段(fc融合蛋白序列见seq id no:2)亚克隆至哺乳动物细胞表达载体ptt5获得用于哺乳动物细胞表达fc融合蛋白的重组表达载体。根据实施例1的表1,利用重叠pcr法对scfv-fc及fc编码基因进行组合突变,其中针对ch3_a链的突变位于fc融合蛋白上,针对ch3_b链的突变位于scfv-fc融合蛋白上。将突变后的基因亚克隆到ptt5,最终分别得到用于在哺乳动物细胞中表达突变的scfv-fc融合蛋白及突变的fc蛋白的重组表达载体。
[0092]
3、瞬时表达scfv-fc/fc异源二聚体,并检测不同突变组合对异源二聚体含量的影响
[0093]
将步骤1的4种突变组合相应的表达载体用pei转染至悬浮培养的293e细胞,每一组突变组合都包括了其相对应的a链(指代scfv-fc融合蛋白链)和b链(指代fc蛋白链)的重组表达载体共同转染,且a链和b链的重组表达载体共转比例为1:1。培养5~6天后,收集瞬时表达培养上清液,通过protein a亲和层析法,得到初步纯化的4组突变组合。这些瞬转产物中都包含了不同比例的同源二聚体蛋白(scfv-fc/scfv-fc,fc/fc)和异源二聚体蛋白
(scfv-fc/fc)。由于这三种蛋白(scfv-fc/scfv-fc,fc/fc,和scfv-fc/fc)的分子量大小有差异,可以通过非还原条件下sds-page电泳检测每组产物中同源二聚体蛋白(scfv-fc/scfv-fc,fc/fc)和异源二聚体蛋白(scfv-fc/fc)的组成情况,电泳检测结果如图3所示。组合1和组合2的同源二聚体明显多于组合3和组合4,表明ch3_b上的d399a突变并不利于异源二聚体的形成。组合4的同源二聚体比组合3少,表明f405e突变优于f405d。
[0094]
实施例2.第二轮突变候选组合的设计、构建、表达和纯化
[0095]
实施例1中通过在ch3_b链上引入带正电荷的氨基酸,利用静电排斥作用抑制同源二聚体(scfv-fc/scfv-fc)的形成。本实施例通过引入其他带电荷氨基酸突变的组合,旨在进一步探索减少ch3_b链之间的相互吸引,抑制同源二聚体蛋白形成的方法。在ch3_a结构域已有的k409f,f405e点突变组合基础上,进一步在ch3_a结构域和ch3_b结构域中引入下述的带电荷氨基酸突变组合:
[0096]
ch3_a结构域:k392d,ch3_b结构域:d399k;
[0097]
ch3_a结构域:k439d,ch3_b结构域:e356k+e357k;
[0098]
ch3_a结构域:l368d,ch3_b结构域:s364r;
[0099]
ch3_a结构域:l368d,ch3_b结构域:s364k;
[0100]
ch3_a结构域:k360e,ch3_b结构域:q347r;
[0101]
ch3_a结构域:k370d+k360e,ch3_b结构域:s364r+e357s+q347r。
[0102]
从而得到表2中所示的组合5-10。利用重叠pcr法对scfv-fc及fc编码基因进行组合突变,其中针对ch3_a链的突变位于fc融合蛋白上,针对ch3_b链的突变位于scfv-fc蛋白上。将突变后的基因亚克隆到ptt5,最终分别得到用于在哺乳动物细胞中表达突变的scfv-fc融合蛋白及突变的fc蛋白的重组表达载体。组合4作为对照组,组合5-10作为测试组,表达纯化方法如实施例1中步骤3所示。将纯化得到的蛋白分用非还原毛细管凝胶电泳分析,并计算各产物组分峰面积的百分比例。结果如表3所示,组合5-10均能获得较好的异源二聚体纯度,其中组合7与组合4获得的异源二聚体的纯度相当,组合10是在组合4的的基础上增加了新的带电氨基酸突变,获得了更优的异源二聚体的纯度。
[0103]
表2异源二聚体突变组合列表-2
[0104][0105]
表3不同带电荷氨基酸组合对同源二聚体和异源二聚体的比例的影响
[0106][0107]
实施例3转染比例对scfv-fc/fc异源二聚体形成的影响
[0108]
为了进一步考察a链的重组载体和b链的重组载体共转比例对于同源二聚体和异源二聚体比例的影响,将较优的突变组合4所用的共转表达载体分别用ch3_a重组载体:ch3_b重组载体=1:1及ch3_a重组载体:ch3_b重组载体=1.5:1的比例用pei转染至悬浮培养的293e细胞,培养5-6天后,收集细胞上清。通过protein a亲和层析法,得到各自的瞬转产物。通过非还原条件下sds-page电泳检测同源二聚体蛋白(scfv-fc/scfv-fc,fc/fc)和异源二聚体蛋白(scfv-fc/fc)的组成情况。具体结果见图4。从结果可以看出:重组表达载体共转比例对于产物中同源二聚体和异源二聚体比例的会带来比较明显的影响。ch3_b比ch3_a相对更容易形成同源二聚体,当共转染比例为ch3_a重组载体:ch3_b重组载体=1:1时,同源二聚体蛋白scfv-fc/scfv-fc明显较多;当提高ch3_a重组载体的转染比例,如共转染比例为ch3_a重组载体:ch3_b重组载体=1.5:1时,同源二聚体蛋白scfv-fc/scfv-fc明显减少。
[0109]
实施例4二硫键对scfv-fc/fc异源二聚体形成的影响
[0110]
在us7695936.b2和us20150307628a1中提到二硫键可以促进异源二聚体的形成,并且提高分子的热稳定性。本实施例在突变组合4基础上引入半胱氨酸突变,得到表4所示的突变组合。人工合成抗体重链hc_a(seq id no:3)、抗体重链hc_b(seq id no:4)和抗体共同轻链lc(seq id no:5)的编码基因,然后亚克隆至哺乳动物细胞表达载体ptt5上。利用重叠pcr法对hc_a及hc_b编码基因进行组合突变,其中针对ch3_a链的突变位于hc_a链上,针对ch3_b链的突变位于hc_b链上。将突变后的基因亚克隆到ptt5,最终分别得到用于在哺乳动物细胞中表达突变的重组表达载体。表达纯化方法如实施例1中步骤3所示,重组表达载体共转比例调整为hc_a链:hc_b链:共同轻链lc=1.5:1:2。将纯化得到的蛋白分用lc-ms分析,并计算各产物组分的百分比例。使用微量热差式扫描量热仪microcal peaq-dsc测量样品的tm值。结果如表5所示,组合11作为对照组,组合12和组合13在组合11的基础上引入二硫键,获得的异源二聚体比例分别为99.56%和96.89%,与组合11相似;组合12和组合13的fc的tm值分别为69.21℃和70.23℃,比组合11提高约3℃。本实施例发现,尽管对照组(组合11)已经具有大于95%的异源二聚体比例,引入二硫键依然能进一步促进异源二聚体的形成,并且提高抗体分子的热稳定性。类似的,引入二硫键也应该能提高组合5-10的异源二聚体比例和热稳定性。
[0111]
表4半胱氨酸突变组合
[0112]
[0113][0114]
表5二硫键对异源二聚体的比例和热稳定性的影响
[0115][0116]
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1